特异性地识别、结合活性结构的REIC/Dkk-3蛋白的抗体、以及使用该抗REIC/Dkk-3抗体的癌治疗的监测的制作方法
本发明涉及使用REIC/Dkk-3基因和REIC/Dkk-3蛋白的癌治疗效果的监测和伴随诊断。本发明进一步涉及能够实现以REIC/Dkk-3蛋白为肿瘤标记物的癌的预测和预后的诊断的抗REIC/Dkk-3特异性抗体、以及使用这些特异性抗体的检查方法。具体而言,涉及能够特异性识别REIC/Dkk-3的活性结构的抗REIC/Dkk-3抗体和利用这些抗体的诊断方法。
背景技术:
作为与细胞的永生化相关的基因,已知REIC/Dkk-3基因,有报道称在癌细胞中该基因的表达受到了抑制(参见专利文献1和非专利文献1至4)。
REIC/Dkk-3基因是Dkk家族的成员,已暗示其通过Wnt受体抑制Wnt信号传导(参见非专利文献5和6),有报道称Wnt基因对于细胞的生长、分化、癌化等重要的生物学状况发挥多方面的作用(参见非专利文献5和7)。
有报道称:若将全长REIC/Dkk-3蛋白以10μg/mL的浓度添加到培养有外周血单核细胞的培养液中,则该细胞分化为树突细胞样细胞(参见专利文献2)。
并且有报道称:在动物实验中,全长REIC/Dkk-3蛋白及其片段肽通过向小鼠肿瘤模型给药,显示出显著的肿瘤缩小效果(参见专利文献3)。
进而,关于对人的适应,报道了使用腺病毒的REIC/Dkk-3基因治疗在转移性去势难治性前列腺癌中显示出显著效果(完全缓解)的病例(参见非专利文献8)。
现有技术文献
专利文献
专利文献1:国际公开第WO2001/038528号
专利文献2:国际公开第WO2009/119874号
专利文献3:国际公开第WO2012/002582号
非专利文献
非专利文献1:Tsuji,T.et al.,BiochemBiophys Res Commun 268,20-4(2000)
非专利文献2:Tsuji,T.et al.,BiochemBiophys Res Commun 289,257-63(2001)
非专利文献3:Nozaki,I.et al.,Int J Oncol 19,117-21(2001)
非专利文献4:Kurose,K.et al.,J Urol 171,1314-8(2004)
非专利文献5:Bafico,A.et al.,Nat Cell Biol 3,683-6(2001)
非专利文献6:Hoang,B.H.et al.,Cancer Res 64,2734-9(2004)
非专利文献7:Moon,R.T.et al.,Science 296,1644-6(2002)
非专利文献8:Kumon,H.et al.,Clin Med Insights Oncol.23;9,31-38(2015)
技术实现要素:
发明所要解决的课题
本发明的目的在于,通过利用能够特异性地识别REIC/Dkk-3蛋白的抗REIC/Dkk-3抗体的诊断方法,提供使用REIC/Dkk-3基因和REIC/Dkk-3蛋白药物的癌治疗效果的监测方法;进而目的在于提供以REIC/Dkk-3蛋白为肿瘤标记物的癌的预测和预后的诊断方法。
用于解决课题的手段
本发明人对于使用REIC/Dkk-3基因的癌的基因治疗进行了反复研究,发现通过将REIC/Dkk-3基因引入到表达载体中并给药至生物体内,对于癌治疗显示出显著的效果。
另外,本发明人在生物体内的广泛的免疫/炎症疾病领域中明确了全长REIC/Dkk-3蛋白的作用,明确了其在治疗中的有用性、优越性(国际公开第WO2009/119874号)。
此外,本发明人对REIC/Dkk-3蛋白的片段肽进行了研究,发现了特定部分区域具有诱导由单核细胞向树突细胞样细胞分化的强生理活性,且其生理活性与全长REIC/Dkk-3蛋白同等或更高。这表明REIC/Dkk-3蛋白的特定部分区域担负着由单核细胞向树突细胞样细胞的分化诱导能力,使癌免疫活化,能够用于癌的治疗和预防(国际公开第WO2012/002582号)。
本发明人另行获取了各种抗REIC/Dkk-3单克隆抗体,尝试了血中REIC/Dkk-3蛋白测定法的开发,通过该方法对上述作为用于癌治疗的监测以及癌的预测和预后的诊断的生物标记物的利用进行了研究。
其结果,发现:通过利用新获取的抗REIC/Dkk-3单克隆抗体,能够特异性地检测出血中的特定的REIC/Dkk-3蛋白分子种,通过检测出该特定的REIC/Dkk-3蛋白分子种,能够进行癌治疗的监测以及癌的预测和预后的诊断,能够将上述特定的REIC/Dkk-3蛋白分子种作为用于癌治疗的监测以及癌的预测和预后的诊断的生物标记物来利用。
即,发现:从新获取的抗REIC/Dkk-3单克隆抗体中选择对在癌患者血中大量存在的REIC/Dkk-3蛋白分子种的反应性极低、并且对在REIC/Dkk-3治疗或外科治疗后出现的特定的REIC/Dkk-3蛋白分子种具有特异性结合性的抗体,利用该抗体的夹心ELISA法能够作为上述用于癌治疗的监测、以及癌的预测和预后诊断的检测系统来利用,从而完成了本发明。
即,本发明如下所述。
[1]一种癌的检测方法,该方法使用第1抗体或其功能性片段,测定由被测体采集的生物试样中的REIC/Dkk-3蛋白浓度,在被测体的生物试样中的REIC/Dkk-3蛋白的浓度低于正常人的生物试样中的REIC/Dkk-3蛋白浓度的情况下,判断该被测体罹患癌前病变或肿瘤性疾病,该第1抗体特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白,但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白,或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低。
[2]如[1]所述的癌的检测方法,其中,进一步使用第2抗体或其功能性片段,测定由被测体采集的生物试样中的REIC/Dkk-3蛋白浓度,计算出使用第1抗体或其功能性片段得到的测定值相对于使用第2抗体或其功能性片段得到的测定值之比,在该比低于使用正常人的生物试样得到的比的情况下,判断该被测体罹患癌前病变或肿瘤性疾病,该第2抗体特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白。
[3]如[1]或[2]所述的癌的检测方法,其中,特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的第1抗体是特异性地识别REIC/Dkk-3蛋白的N端结构域的抗体。
[4]如[2]或[3]所述的癌的检测方法,其中,特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白的第2抗体是识别REIC/Dkk-3蛋白的富含半胱氨酸的结构域的抗体。
[5]如[1]~[4]中任一项所述的癌的检测方法,其中,特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的第1抗体为N-1抗体,其是识别以保藏号NITE BP-02103进行了国际保藏的杂交瘤所产生的REIC/Dkk-3蛋白的N端结构域的单克隆抗体;特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白的第2抗体为Cys-3抗体,其是识别以保藏号NITE BP-02104进行了国际保藏的杂交瘤所产生的REIC/Dkk-3蛋白的富含半胱氨酸的结构域的单克隆抗体。
[6]一种癌治疗的监测方法,该方法使用第1抗体或其功能性片段,测定由接受癌治疗的癌患者经时地采集的生物试样中的REIC/Dkk-3蛋白浓度,在REIC/Dkk-3蛋白的浓度上升的情况下,判定具有癌治疗作用或效果,该第1抗体特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白,但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白,或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低。
[7]如[6]所述的监测方法,其中,进一步使用第2抗体或其功能性片段,测定由被测体经时地采集的生物试样中的REIC/Dkk-3蛋白浓度,计算出使用第1抗体得到的测定值相对于使用第2抗体得到的测定值之比,在该比上升的情况下,判定具有癌治疗作用或效果,该第2抗体特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白。
[8]如[6]或[7]所述的监测方法,其中,经时地采集的生物试样包含在癌治疗前、癌治疗中和癌治疗后采集的生物试样。
[9]如[6]~[8]中任一项所述的监测方法,其中,癌治疗是使用REIC/Dkk-3基因、REIC/Dkk-3片段基因、REIC/Dkk-3蛋白或REIC/Dkk-3片段肽的治疗。
[10]如[6]~[9]中任一项所述的监测方法,其中,特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的第1抗体是特异性地识别REIC/Dkk-3蛋白的N端结构域的抗体。
[11]如[7]~[10]中任一项所述的监测方法,其中,特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白的第2抗体是识别REIC/Dkk-3蛋白的富含半胱氨酸的结构域的抗体。
[12]如[6]~[11]中任一项所述的监测方法,其中,特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的第1抗体为N-1抗体,其是识别以保藏号NITE BP-02103进行了国际保藏的杂交瘤所产生的REIC/Dkk-3蛋白的N端结构域的单克隆抗体;特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白的第2抗体为Cys-3抗体,其是识别以保藏号NITE BP-02104进行了国际保藏的杂交瘤所产生的REIC/Dkk-3蛋白的富含半胱氨酸的结构域的单克隆抗体。
[13][1]~[5]中任一项所述的癌的检测方法或[6]~[12]中任一项所述的监测方法中使用的、识别REIC/Dkk-3蛋白的N端结构域的抗体、识别REIC/Dkk-3蛋白的富含半胱氨酸的结构域的抗体、或者识别REIC/Dkk-3蛋白的C端结构域的抗体、或它们的功能性片段。
[14]一种杂交瘤,其产生N-1抗体,该N-1抗体特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白,但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低,该杂交瘤以保藏号NITE BP-02103进行了国际保藏。
[15]N-1抗体或其功能性片段,该N-1抗体为[14]所述的杂交瘤所产生的单克隆抗体。
[16]一种杂交瘤,其产生Cys-3抗体,该Cys-3抗体特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白,该杂交瘤以保藏号NITE BP-02104进行了国际保藏。
[17]Cys-3抗体或其功能性片段,该Cys-3抗体为[16]所述的杂交瘤所产生的单克隆抗体。
[18]用于在[2]~[5]中任一项所述的癌的检测方法或[7]~[12]中任一项所述的监测方法中使用的检查试剂盒,其包含识别[13]所述的REIC/Dkk-3蛋白的N端结构域的抗体和识别REIC/Dkk-3蛋白的富含半胱氨酸的结构域的抗体或识别REIC/Dkk-3蛋白的C端结构域的抗体。
[19]用于在[2]~[5]中任一项所述的癌的检测方法或[7]~[12]中任一项所述的监测方法中使用的检查试剂盒,其包含[15]所述的N-1抗体和[17]所述的Cys-3抗体。
本说明书中包含作为本申请的优先权基础的日本专利申请2015-190401号的公开内容。
发明的效果
通过使用本发明的抗REIC/Dkk-3蛋白抗体的REIC/Dkk-3蛋白浓度测定法,能够进行将REIC/Dkk-3基因或REIC/Dkk-3蛋白作为药物使用的癌治疗效果的监测,通过该方法检测出的REIC/Dkk-3蛋白是对于癌的预测和预后的诊断有用的生物标记物,还能够作为伴随诊断法有效利用。
附图说明
图1-1是将全长REIC/Dkk-3蛋白[Ala22-Ile350]或包含富含半胱氨酸的结构域的REIC部分区域3[Ser135-Phe288](参见专利文献3)作为抗原,利用髂淋巴结法进行制作,根据与全长REIC/Dkk-3蛋白、REIC部分区域3和REIC部分区域1[Arg142-Ile350](参见专利文献3)的反应性进行筛选,将确定了识别区域的12种抗REIC/Dkk-3单克隆抗体的与抗原的反应模式以蛋白的种类和识别的区域示出的图。
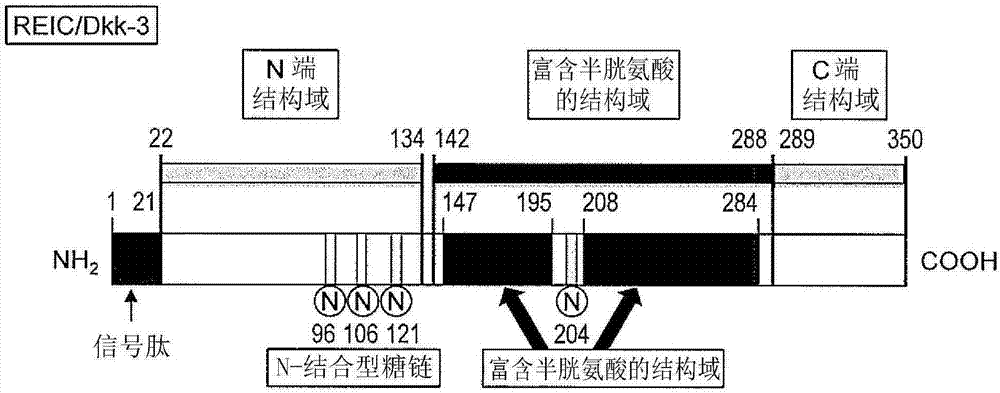
图1-2是示出REIC/Dkk-3蛋白的结构示意图的图。
图2是示出在将识别REIC/Dkk-3蛋白的N端结构域的N-1抗体作为捕获抗体、将生物素标记的抗REIC/Dkk-3多克隆抗体用作检测抗体的夹心ELISA法中,使用0、31.3、62.5、125、250、500、1000、2000pg/mL这8种浓度的REIC/Dkk-3蛋白标准品(重组型REIC/Dkk-3蛋白)制成的标准曲线的图。
图3-1是示出通过夹心ELISA法测定来自前列腺癌患者的血清中的REIC/Dkk-3蛋白的浓度,进行REIC/Dkk-3基因治疗的监测的结果的图。对于基准(治疗前)、第1次治疗后第1、2、7、14天(即将第2次治疗之前)、第15、17、21、28天、第56天(即将手术之前)、第84天的血清试样实施测定。对于患者A(图3-1A)和患者B(图3-1B),示出将识别REIC/Dkk-3蛋白的N端结构域的N-1抗体作为捕获抗体所测定的数据。
图3-2是示出通过夹心ELISA法测定来自前列腺癌患者的血清中的REIC/Dkk-3蛋白的浓度,进行REIC/Dkk-3基因治疗的监测的结果的图。对于基准(治疗前)、第1次治疗后第1、2、7、14天(即将第2次治疗之前)、第15、17、21、28天、第56天(即将手术之前)、第84天的血清试样实施测定。对于患者A(图3-2A)和患者B(图3-2B),示出将识别富含半胱氨酸的结构域的抗体Cys-3作为捕获抗体所测定的数据。
图3-3是对于患者A(图3-3A)和患者B(图3-3B)示出将N-1抗体和Cys-3抗体作为捕获抗体所测定的REIC/Dkk-3蛋白浓度的比例(%)(N-1抗体/Cys-3抗体的测定值)的图。由图中判断,也能够以利用这两种抗体所测定的浓度之比为指标进行治疗的监测。
图3-4是示出5名治疗前的患者的血清中的REIC/Dkk-3蛋白浓度的测定结果的图。
图4-1是示出通过使用识别N端结构域的N-1抗体、或识别富含半胱氨酸的结构域的Cys-3抗体作为捕获抗体、使用生物素标记的抗REIC/Dkk-3多克隆抗体作为检测抗体的夹心ELISA法,对于前列腺癌患者、正常人、外科手术后各5人的血清中的REIC/Dkk-3蛋白浓度使用夹心ELISA法所测定的结果的图。图中表明,利用两种捕获抗体所测定的REIC/Dkk-3蛋白的浓度之比能够作为癌的预测、预后的诊断有效利用。
图4-2是示出测定血清中的REIC/Dkk-3蛋白浓度而得到的5名前列腺癌患者的概况(profile)的图。
图5是示出将识别N端结构域的N-1抗体或识别富含半胱氨酸的结构域的Cys-3抗体作为检测抗体,利用夹心ELISA系统进行可组合的抗体的研究的结果的图。捕获抗体使用与检测抗体不同的抗体,以100ng/mL、10ng/mL的浓度添加纯化的REIC/Dkk-3蛋白,使用亲和素-HRP作为与检测抗体反应的作用性复合体。将作为REIC/Dkk-3蛋白与各种抗体的结合量的指标的HRP活性以吸光度450nm的测定值示出。
具体实施方式
下面,详细说明本发明。
本发明中,使用特异性地识别、结合正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的抗体。
REIC/Dkk-3基因(REIC基因)的全长碱基序列和该基因所编码的蛋白的氨基酸序列分别示于序列号1和序列号2。在序列号2所表示的氨基酸序列中,由第1位至第21位的氨基酸构成的序列为信号序列。
如图1-2所示,REIC/Dkk-3蛋白具有N端结构域(由序列号2所表示的氨基酸序列中的第22位的氨基酸至第134位的氨基酸构成的区域)、富含半胱氨酸的结构域(由序列号2所表示的氨基酸序列中的第142位的氨基酸至第288位的氨基酸构成的区域)和C端结构域(由序列号2所表示的氨基酸序列中的第289位的氨基酸至第350位的氨基酸构成的区域)。
具有活性结构的REIC/Dkk-3蛋白是指未罹患癌的正常人的正常细胞产生的REIC/Dkk-3蛋白。
认为:癌细胞本身不产生分泌REIC/Dkk-3蛋白,在癌患者血中大量存在的REIC/Dkk-3蛋白是正常细胞产生分泌的REIC/Dkk-3蛋白受到由癌细胞产生分泌的其它蛋白(蛋白酶或与REIC/Dkk-3蛋白结合的蛋白等)所致的N端结构域分解、其它物质向N端结构域的结合等、或N端结构域的糖基化模式的变化等修饰而使N端结构域的结构存在异常。即,在癌患者血中大量存在的REIC/Dkk-3蛋白是由于罹患癌而变得具有与正常细胞产生分泌的REIC/Dkk-3蛋白不同的结构的REIC/Dkk-3蛋白。另外,在癌患者血中大量存在的REIC/Dkk-3蛋白也可以说是在癌细胞存在的情况下变得具有与正常细胞产生分泌的REIC/Dkk-3蛋白不同的结构的REIC/Dkk-3蛋白。另一方面,正常人的正常细胞产生的REIC/Dkk-3蛋白的N端结构域的结构不存在异常。本发明中,将正常人的正常细胞产生的N端结构域的结构不存在异常的REIC/Dkk-3蛋白称为具有活性结构的REIC/Dkk-3蛋白。因此,特异性地识别、结合正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的抗体是识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白的N端结构域的抗体。即,识别正常细胞产生的活性结构的REIC/Dkk-3蛋白的N端结构域的抗体是对在癌患者血中大量存在的REIC/Dkk-3蛋白分子种的反应性低、并且能够识别血中的具有活性结构的特定的REIC/Dkk-3蛋白分子种的抗体,是能够识别癌患者血清特有的REIC/Dkk-3蛋白分子的结构与正常人血清的REIC/Dkk-3蛋白分子的结构的差异的抗体。如后所述,作为抗REIC/Dkk-3蛋白单克隆抗体的N-1抗体特异性地识别、结合正常细胞产生的具有活性结构的REIC/Dkk-3蛋白,但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白,或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低。因此,也将在癌患者血中大量存在的REIC/Dkk-3蛋白称为与N-1抗体的反应性降低的REIC/Dkk-3蛋白。
本发明中,为了区分并检测出具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白,可以将特异性地识别、结合正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的抗体与特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白的抗体适当组合使用。特异性地识别、结合正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的抗体是识别REIC/Dkk-3的N端结构域的抗体,有时也称为第1抗体。另外,特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白的抗体是识别富含半胱氨酸的结构域的抗体或识别C端结构域的抗体,有时也称为第2抗体。
将由序列号2所表示的氨基酸序列的第22位的Ala至第350位的Ile构成的氨基酸序列所构成的蛋白称为全长REIC/Dkk-3蛋白[Ala22-Ile350],将由第135位的Ser至第288位的Phe构成的氨基酸序列所构成的、包含富含半胱氨酸的结构域的部分区域称为REIC部分区域3[Ser135-Phe288],将由第142位的Arg至第350位的Ile构成的氨基酸序列所构成的部分区域称为REIC部分区域1[Arg142-Ile350](国际公开第WO2012/002582号)。
本发明的抗REIC/Dkk-3抗体的制作中可以使用全长REIC/Dkk-3蛋白作为免疫原,另外,也可以使用上述的REIC部分区域1[Arg142-Ile350]或REIC部分区域3[Ser135-Phe288]等REIC/Dkk-3蛋白的片段作为免疫原。作为免疫原的全长REIC/Dkk-3蛋白使用具有活性结构的REIC/Dkk-3蛋白、即重组型(recombinant)REIC/Dkk-3蛋白或正常细胞产生的REIC/Dkk-3蛋白即可。所得到的抗体可以根据与全长REIC/Dkk-3蛋白、REIC部分区域3[Ser135-Phe288]和REIC部分区域1[Arg142-Ile350]的反应性来确定识别区域。识别N端结构域的抗体是指与全长REIC/Dkk-3蛋白反应、但不与REIC部分区域3和REIC部分区域1反应的抗体,识别C端结构域的抗体是指与全长REIC/Dkk-3蛋白和REIC部分区域1反应、但不与REIC部分区域3反应的抗体,识别富含半胱氨酸的结构域的抗体是指识别N端结构域的抗体和识别C端结构域的抗体以外的抗体,是与全长REIC/Dkk-3蛋白、REIC部分区域1和REIC部分区域3反应的抗体。即,识别N端结构域的抗体是指识别[Ala22-Thr134]部分区域的抗体,识别C端结构域的抗体是指识别[Val289-Ile350]部分区域的抗体,识别富含半胱氨酸的结构域的抗体是指识别[Ser142-Phe288]部分区域的抗体。
本说明书中,“抗体”这一用语以广义使用,具体而言,包含单克隆抗体(包含全长(完整体)单克隆抗体)、多克隆抗体、多特异性抗体(例如双特异性抗体)和抗体的功能性片段。本发明中,优选使用单克隆抗体。按照本发明的方法有用的抗体可以通过现有方法和/或基因工程学进行制作。
“抗体的功能性片段”是包含全长抗体的一部分、通常是抗原结合区或抗体可变区的片段,是对于抗原具有结合活性的片段。作为其例,可以举出Fab、Fab’、F(ab’)2和Fv片段、双抗体、单链抗体分子和由抗体片段形成的多特异性抗体等。另外,这些抗体片段的多聚体也包含在本发明的抗体的功能性片段中。Fab是用蛋白分解酶木瓜蛋白酶处理抗体而得到的片段,是H链的氨基末端侧约一半与L链整体以二硫键结合而成的分子量约5万的对抗原具有结合活性的抗体片段。F(ab’)2是用蛋白分解酶胃蛋白酶处理IgG而得到的片段之中Fab藉由铰链区的二硫键结合而成的分子量约10万的抗体片段。Fab’是将上述F(ab’)2的铰链区的二硫键切断而成的分子量约5万的抗体片段。作为Fv片段之一的scFv是藉由肽接头将1个重链可变区(VH)与1个轻链可变区(VL)连结而成的抗体片段。双抗体是使scFv二聚化而成的抗体片段,是具有2价抗原结合活性的抗体片段。
上述的抗体的功能性片段也可以基于本发明的抗REIC/Dkk-3抗体的氨基酸序列信息或编码抗REIC/Dkk-3抗体的基因的碱基序列信息,通过合成或基因工程学的方法来制造。
本说明书中的“单克隆抗体”这一用语是指实质上均一的抗体,即,从除了可能微量存在的可天然产生的突变体以外由相同的各个抗体构成的群体得到的抗体。单克隆抗体是高度特异性的,以单一的抗原部位作为结合对象。此外,与包含以典型不同的抗原决定簇(表位)为对象的不同抗体的现有(多克隆)抗体制备物形成对照,各单克隆抗体以其抗原上的单一决定簇为对象。按照本发明来使用的单克隆抗体例如通过杂交瘤法或重组DNA法进行制备,此外例如也可以由噬菌体抗体库分离制备。
本说明书中的单克隆抗体还包含“嵌合抗体”(重链和/或轻链的一部分与来源于特定种的抗体或者属于特定的抗体类或亚类的抗体中的对应序列相同或同源,另一方面,该链的其余部分与来源于其它种的抗体或者属于其它抗体类或亚类的抗体中的对应序列相同或同源),进而也包含上述抗体的功能性片段,只要这些片段显示出所期望的生物活性。
作为本发明的代表性单克隆抗体,可以举出为了开发REIC/Dkk-3蛋白浓度的测定系统而利用髂淋巴结法(日本专利第4098796号公报)制作的抗REIC/Dkk-3蛋白单克隆抗体,用于例如临床试样等在各种临床试验中采集的样本中的REIC/Dkk-3蛋白的鉴定、定量。
为了鉴定、定量REIC/Dkk-3蛋白,本发明中利用的抗体可以进行酶标记、荧光标记、发光标记、放射性同位素(RI)标记,可以利用任一种现有方法进行标记。作为标记中使用的酶的例子,可以举出辣根过氧化物酶(HRP)、碱性磷酸酶、β-半乳糖苷酶等,另外可以举出生物素标记等。
作为识别REIC/Dkk-3蛋白的N端结构域的单克隆抗体(其为特异性地识别、结合正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的单克隆抗体),可以例示N-1抗体和N-2抗体。另外,作为识别REIC/Dkk-3蛋白的富含半胱氨酸的结构域的单克隆抗体(其为特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白的单克隆抗体),可以例示Cys-1抗体、Cys-2抗体、Cys-3抗体、Cys-4抗体、Cys-5抗体、Cys-6抗体、Cys-7抗体和Cys-8抗体。此外,作为识别REIC/Dkk-3蛋白的C端结构域的单克隆抗体,可以例示C-1抗体和C-2抗体。
其中,产生N-1抗体的杂交瘤于2015年8月19日在独立行政法人国家技术评估学会(NITE)专利微生物保藏中心(NITE Patent Microorganisms Depository)(日本〒292-0818千叶县木更津市上总镰足2-5-8 122号室)以保藏号NITE BP-02103(“识别的表示”为“REIC-N-1”)进行了国际保藏,产生Cys-3抗体的杂交瘤于2015年8月19日在独立行政法人国家技术评估学会(NITE)专利微生物保藏中心(NITE Patent Microorganisms Depository)(日本〒292-0818千叶县木更津市上总镰足2-5-8 122号室)以保藏号NITE BP-02104(“识别的表示”为“REIC-Cys-3”)进行了国际保藏。
上述本发明的12种抗体均对REIC/Dkk-3蛋白为高度特异性的,并且亲和性极高,所有抗体均能适用于夹心ELISA法。
对12种抗体分别所识别的REIC/Dkk-3蛋白分子上的结构域进行了鉴定,特别是识别其富含半胱氨酸的结构域的抗体能够提供不仅可应对基于REIC/Dkk-3蛋白分子全长链的REIC/Dkk-3治疗的监测、还可应对基于担负抗癌免疫活性的片段肽的REIC/Dkk-3治疗的监测的诊断方法。
识别N端结构域的抗体能够识别癌患者血清特有的REIC/Dkk-3蛋白分子的结构与正常人血清的REIC/Dkk-3蛋白分子的结构的差异,通过与识别富含半胱氨酸的结构域或C端结构域的抗体组合来测定REIC/Dkk-3蛋白,并以其测定值的比例作为指标来进行诊断,能够提供排除了以产生个体差异的浓度为指标的诊断中的误诊的诊断方法。
此外,本发明中,抗体除了包含抗体分子外,还包含抗体样分子、抗体样物质。
上述抗体样分子、抗体样物质只要是识别新获取的抗体所识别的特定活性部分结构的结合分子即可,可以为蛋白、化合物、片段等中的任一种。
使用本发明的识别REIC/Dkk-3蛋白的抗体,能够测定来自被测体的生物试样中的REIC/Dkk-3蛋白。来自被测体的生物试样没有限定,可以举出血液、血清、血浆、尿、唾液、精液、胸腔渗出液、脑脊液、腹水、胸水、羊水、膀胱冲洗液和支气管肺泡灌洗液等。其中,优选血液、血清和血浆。来自被测体的试样可以为新鲜的或冷冻的,也可以用肝素、柠檬酸或EDTA进行处理。
来自被测体的试样中的REIC/Dkk-3蛋白的检测可以利用免疫印迹法、酶免疫测定法(EIA(Enzyme Immunoassay)、ELISA(Enzyme-Linked Immunosorbent Assay,酶联免疫吸附测定))、放射线免疫测定法(RIA)、双抗体夹心法、凝集反应法、荧光免疫测定法、免疫层析法等本领域技术人员已知的定量免疫测定方法进行。优选利用夹心ELISA等使用捕获抗体和经标记的检测抗体的夹心测定法进行。
在这些免疫测定法中,除了酶标记抗体外,还可以利用荧光标记、发光标记或放射性同位素(RI)标记抗体等。
在夹心测定法中,在载体的表面固定捕获抗体,进行REIC/Dkk-3蛋白的检测或定量。
作为夹心测定法中使用的适当的载体,优选利用例如聚丙烯、聚苯乙烯、取代聚苯乙烯、聚丙烯酰胺和聚氯乙烯等高分子载体,此外还可以举出玻璃珠、琼脂糖和硝化纤维素等。
在夹心ELISA免疫测定法的一例中,作为捕获抗体使用小鼠抗人REIC/Dkk-3蛋白单克隆抗体,另外,作为检测抗体使用生物素标记兔抗人REIC/Dkk-3蛋白多克隆抗体。捕获单克隆抗体被固定于微板孔上。将稀释后的人血清/血浆试样中的REIC/Dkk-3蛋白、或REIC/Dkk-3标准抗原(重组野生型REIC/Dkk-3蛋白)在孔内进行温育,利用捕获单克隆抗体使REIC/Dkk-3抗原结合。对孔进行清洗后,在藉由捕获抗体而被固定的REIC/Dkk-3抗原中添加经生物素标记的检测抗体,之后再次对孔进行清洗。接着,加入亲和素-辣根过氧化物酶复合体。在最终清洗后,向孔中加入TMB底物(TMB substrate),检测出所结合的过氧化物酶活性。加入2N硫酸使反应停止,在450nm测定吸收。根据含有REIC/Dkk-3蛋白的试样的吸收值的相关性,能够决定血清或血浆等试样中的REIC/Dkk-3蛋白浓度。作为捕获抗体,可以使用特异性地识别REIC/Dkk-3蛋白的N端结构域的单克隆抗体、优选N-1抗体、或者识别REIC/Dkk-3蛋白的富含半胱氨酸的结构域的单克隆抗体、优选Cys-3抗体。作为检测抗体,可以使用针对REIC/Dkk-3蛋白的单克隆抗体,也可以使用以重组型REIC/Dkk-3蛋白或正常细胞产生的REIC/Dkk-3蛋白作为免疫原而制作的多克隆抗体。从不产生批次间的反应性差异的方面出发,优选单克隆抗体。
在对REIC/Dkk-3蛋白进行定量时,优选预先使用包含已知量的REIC/Dkk-3蛋白的试样制成校正曲线。或者,也可以在进行检测时,预先准备多个包含已知量的REIC/Dkk-3蛋白的对照试样,对于该对照试样也同时进行测定,制成校正曲线。可以由所测定的测定值和校正曲线对被测试样中的REIC/Dkk-3蛋白的量进行定量。
来自被测体的试样中的REIC/Dkk-3蛋白的浓度因受益于REIC/Dkk-3治疗而能够成为评价REIC/Dkk-3基因制剂或REIC/Dkk-3蛋白制剂的治疗效果的指标。将使用了REIC/Dkk-3的治疗称为REIC/Dkk-3治疗。
具体而言,通过使用本发明的抗体测定来自被测体的生物试样中的REIC/Dkk-3蛋白,能够进行被测体中的癌的检测。另外,在被测体罹患癌并接受癌治疗的情况下,能够捕捉被测体中的经时的血中REIC/Dkk-3蛋白的动态变化、即具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白的浓度的变化。血中的经时的REIC/Dkk-3蛋白的动态变化反映出癌患者的癌的状态的变化,能够进行癌的状态的监测。另外,例如在使用REIC/Dkk-3基因制剂的治疗中,REIC/Dkk-3蛋白的浓度上升表明作为治疗有效成分的REIC/Dkk-3蛋白在癌细胞中进行了表达,表明REIC/Dkk-3蛋白在癌细胞中的表达具有治疗作用。即,通过REIC/Dkk-3蛋白的动态变化的监测,能够进行癌治疗的监测。此外,在被测体罹患癌的情况下,能够进行预后的预测。此处,癌的检测包括是否罹患癌(包括癌前病变状态)的判定、是否具有罹患癌的风险的预测、癌的恶性程度(分期、强度)的判定等。癌治疗的监测是指对癌患者进行癌治疗时的癌治疗作用或癌治疗效果的监测。
这些判定、预测、判断通常由医师进行,本发明的抗体能够用于获取用于该判定、预测、判断的辅助数据。
本发明中,癌包含癌前病变和肿瘤性疾病,包含脑/神经肿瘤、皮肤癌、胃癌、肺癌、肝癌、淋巴瘤/白血病、结肠癌、胰腺癌、肛门/直肠癌、食道癌、子宫癌、乳腺癌、肾上腺癌、肾癌、肾盂输尿管癌、膀胱癌、前列腺癌、尿道癌、阴茎癌、睾丸癌、骨/骨肉瘤、平滑肌瘤、横纹肌瘤、间皮瘤和引起上述癌的癌前病变。
成为进行本发明中的癌治疗监测时的对象的癌治疗没有限定,包含使用REIC/Dkk-3基因或REIC/Dkk-3基因片段的基因治疗、使用REIC/Dkk-3蛋白或REIC/Dkk-3片段肽的治疗。
如上所述,未罹患癌的正常人的正常细胞产生具有活性结构的REIC/Dkk-3蛋白,罹患癌的癌患者的血中存在具有结构异常的REIC/Dkk-3蛋白。
本发明中,测定来自被测体的试样中的REIC/Dkk-3蛋白的浓度,或者将来自被测体的试样中存在的正常细胞产生的具有活性结构的REIC/Dkk-3蛋白与在癌患者血中大量存在的REIC/Dkk-3蛋白区别地进行测定。
例如,使用特异性地识别REIC/Dkk-3蛋白的N端结构域、特异性地识别、结合正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的抗体,测定来自被测体的试样中的REIC/Dkk-3蛋白。在被测体罹患癌的情况下,试样中具有活性结构的REIC/Dkk-3蛋白减少。特异性地识别N端结构域、特异性地识别、结合正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的抗体无法识别在癌患者血中大量存在的REIC/Dkk-3蛋白,或者反应性低,因此REIC/Dkk-3蛋白的测定值降低。另一方面,特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白中的每一者的例如识别富含半胱氨酸的结构域的抗体能够同样地识别在癌患者的血中大量存在的REIC/Dkk-3蛋白,因此REIC/Dkk-3蛋白的测定值不会显著降低。
单独测定在来自被测体的试样中的癌患者血中大量存在的REIC/Dkk-3蛋白的浓度,以浓度为指标能够进行被测体中的癌的检测,能够进行癌治疗的监测,此外在被测体罹患癌的情况下能够进行预后的预测。例如,在使用特异性地识别、结合正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的抗体进行测定时确认到被测体试样中的REIC/Dkk-3蛋白浓度低于50ng/mL、优选低于30ng/mL、进一步优选低于20ng/mL的情况下,可以判定该被测体有可能具有癌前病变/肿瘤性疾病。另外,将正常人的试样作为对照试样,与对照试样中的REIC/Dkk-3蛋白浓度进行比较,在使用特异性地识别、结合正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的抗体进行测定时被测体试样中的REIC/Dkk-3蛋白浓度低于对照试样中的REIC/Dkk-3蛋白浓度的情况下,可以判定该被测体有可能具有癌前病变/肿瘤性疾病。
另外,根据来自被测体的试样中的正常细胞产生的具有活性结构的REIC/Dkk-3蛋白的浓度与正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白的总REIC/Dkk-3蛋白的浓度之比,能够进行被测体中的癌的检测。此外,在被测体罹患癌的情况下,能够进行癌治疗的监测,能够进行预后的预测。正常细胞产生的具有活性结构的REIC/Dkk-3蛋白的浓度相对于总REIC/Dkk-3蛋白的浓度之比采取下述比例即可:使用特异性地识别、结合正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的抗体进行测定时的浓度与使用特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白的抗体进行测定时的浓度之比。例如,采取使用识别REIC/Dkk-3蛋白的N端结构域的抗体进行测定时的浓度与使用识别REIC/Dkk-3蛋白的富含半胱氨酸的结构域的抗体进行测定时的浓度之比即可。识别REIC/Dkk-3蛋白的N端结构域的抗体无法识别在癌患者血中大量存在的REIC/Dkk-3蛋白、或者反应性低;识别REIC/Dkk-3蛋白的富含半胱氨酸的结构域的抗体既能够识别在癌患者血中大量存在的REIC/Dkk-3蛋白,也能够识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白。使用了识别REIC/Dkk-3蛋白的N端结构域的抗体的测定例如可以通过使用识别REIC/Dkk-3蛋白的N端结构域的抗体作为捕获抗体、使用以全长REIC/Dkk-3为免疫原而制作的多克隆抗体作为检测抗体的夹心ELISA法来进行,也可以代替多克隆抗体而使用识别REIC/Dkk-3蛋白的富含半胱氨酸的结构域或C端结构域的单克隆抗体作为检测抗体。使用了识别REIC/Dkk-3蛋白的富含半胱氨酸的结构域的抗体的测定例如可以通过使用识别REIC/Dkk-3蛋白的富含半胱氨酸的结构域的抗体作为捕获抗体、使用以全长REIC/Dkk-3为免疫原而制作的多克隆抗体作为检测抗体的夹心ELISA法来进行,也可以代替多克隆抗体而使用识别REIC/Dkk-3蛋白的富含半胱氨酸的结构域或C端结构域的单克隆抗体作为检测抗体。作为识别REIC/Dkk-3蛋白的N端结构域的抗体,可以例示N-1抗体,作为识别REIC/Dkk-3蛋白的富含半胱氨酸的结构域的抗体,可以例示Cys-3抗体。
例如,在使用特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的抗体测定的浓度与使用特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白的抗体测定的REIC/Dkk-3蛋白的浓度之比低于使用正常人的生物试样得到的比的情况下,可以判定该被测体有可能具有癌前病变/肿瘤性疾病。
癌治疗的监测可以通过定期地、例如在癌治疗的治疗前、治疗中或治疗后由接受癌治疗的患者经时地采集试样,使用上述抗体测定试样中的REIC/Dkk-3蛋白来进行。可以将定期采集的试样中的REIC/Dkk-3蛋白浓度的变化作为指标来进行癌治疗的监测。
在癌治疗的监测中,在由接受癌治疗的癌患者定期采集的试样中正常细胞产生的具有活性结构的REIC/Dkk-3蛋白浓度上升的情况下,例如在使用N-1抗体等识别REIC/Dkk-3蛋白的N端结构域的、特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但不识别、不结合在癌患者血中大量存在的REIC/Dkk-3蛋白、或者对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的抗体测定的REIC/Dkk-3蛋白的浓度上升的情况下,意味着REIC/Dkk-3在癌细胞中进行了表达,表明在癌细胞中的表达具有基于REIC/Dkk-3的治疗作用或治疗效果。因此,可以判断:对于疾病的缓解或癌治疗具有肯定的应答,确认到癌治疗的效果。另一方面,在正常细胞产生的具有活性结构的REIC/Dkk-3蛋白浓度降低的情况下,可以判断:未确认到癌治疗的效果,或者癌发生了恶化。
另外,例如在使用特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白、但对在癌患者血中大量存在的REIC/Dkk-3蛋白的反应性低的抗体测定的浓度与使用特异性地识别正常细胞产生的具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白的抗体测定的REIC/Dkk-3蛋白的浓度之比上升的情况下,可以判断:对于疾病的缓解或癌治疗具有肯定应答,确认到癌治疗的效果。另一方面,该比降低的情况下,可以判断:未确认到癌治疗的效果,或者癌发生了恶化。
通过利用本发明的方法进行癌治疗的监测,能够作为癌患者的最佳治疗法的决定、接受REIC/Dkk-3癌治疗的患者的选择的辅助信息来利用。即,本发明的方法对于伴随诊断也有用。此处,伴随诊断是指为了在给药前预测药品的效果或副作用而进行的临床检查。
治疗的选择方法的特征在于,包括:对由对照组分别采集的试样中的具有活性结构的REIC/Dkk-3蛋白的平均浓度进行免疫学检测和定量,另一方面,对经时地由患者采集的同等的患者试样中的REIC/Dkk-3蛋白浓度的逐次变化进行免疫学检测和定量,将患者试样中的REIC/Dkk-3蛋白浓度与对照试样中的REIC/Dkk-3蛋白浓度进行比较的各步骤;基于患者试样中的REIC/Dkk-3蛋白浓度与对照试样中的REIC/Dkk-3蛋白浓度的平均浓度的差异、以及患者试样中的REIC/Dkk-3蛋白浓度的逐次变化,决定是否对患者使用现有的治疗和/或REIC/Dkk-3治疗。
本发明包括用于进行癌的检测的检查试剂盒、或者用于监测患者的治疗的有效性的检查试剂盒,上述试剂盒包含对REIC/Dkk-3蛋白具有特异性的抗体。作为该检查试剂盒所包含的识别REIC/Dkk-3蛋白的抗体,可以举出N-1抗体等识别N端结构域的抗体和Cys-3抗体等识别富含半胱氨酸的结构域的抗体或者识别C端结构域的抗体。该试剂盒可以包含使用说明书、可检测的标签或标记、促进与抗体的结合的溶液等。
实施例
通过下述实施例具体地对本发明进行说明,但本发明不受这些实施例的限定。
实施例1.抗REIC/Dkk-3蛋白单克隆抗体的制备和识别区域的确定
抗REIC/Dkk-3蛋白单克隆抗体是将全长REIC/Dkk-3蛋白[Ala22-Ile350]或包含富含半胱氨酸的结构域的REIC部分区域3[Ser135-Phe288](参见专利文献3)作为抗原,利用髂淋巴结法来制作,根据与全长REIC/Dkk-3蛋白、REIC部分区域3和REIC部分区域1[Arg142-Ile350](参见专利文献3)的反应性进行筛选而确定了识别区域的抗体。识别N端结构域的抗体是指与全长REIC/Dkk-3蛋白反应、但不与REIC部分区域3和REIC部分区域1反应的抗体,识别C端结构域的抗体是指与全长REIC/Dkk-3蛋白和REIC部分区域1反应、但不与REIC部分区域3反应的抗体,识别富含半胱氨酸的结构域的抗体是指上述识别N端结构域的抗体和识别C端结构域的抗体以外的抗体,是与全长REIC/Dkk-3蛋白、REIC部分区域1和REIC部分区域3反应的抗体。即,识别N端结构域的抗体是指识别[Ala22-Thr134]部分区域的抗体,识别C端结构域的抗体是指识别[Val289-Ile350]部分区域的抗体,识别富含半胱氨酸的结构域的抗体是指识别[Ser142-Phe288]部分区域的抗体。关于利用上述方法筛选出的12种抗体(N-1、N-2、C-1、C-2、Cys-1、Cys-2、Cys-3、Cys-4、Cys-5、Cys-6、Cys-7和Cys-8抗体)与抗原的反应模式,将蛋白的种类和所识别的区域示于图1-1。图1-2中示出REIC/Dkk-3蛋白的结构示意图。
实施例2.以人血清和血浆试样为测定对象的夹心ELISA法
作为使用抗REIC/Dkk-3蛋白抗体的ELISA法的适当的测定试样,可以举出利用肝素、柠檬酸盐或EDTA进行了处理的人血浆和人血清。为了避免血中可能包含的干扰因素引起的测定障碍,必须特别留意人的血清和血浆的制备与测定。对于在样本采集时假定混杂的凝集体,在稀释前通过微量离心分离将其从试样中除去,此外,所要检查的血清或血浆试样的最初的浓度应为约2%以下。
测定法
按照下述步骤,通过夹心ELISA法测定人血浆或血清中的人REIC/Dkk-3蛋白浓度。
1.在微孔板的孔中加入作为捕获抗体的识别REIC/Dkk-3蛋白的N端结构域的抗体N-1 50μL。使板在室温下反应1小时或在4℃反应一晩。
2.制备板清洗所使用的溶液。
3.使用板清洗液,以200μL/孔对孔进行4次清洗。
4.在微孔板的孔中加入封闭试剂(例如脱脂乳,市售封闭剂)200μL。使板在室温反应1小时。
5.使用板清洗液,以200μL/孔对孔进行4次清洗。
6.在微孔板的孔中分别加入预先稀释的试样和对照、以及8种REIC/Dkk-3蛋白标准品(0~2000pg/mL)50μL。使板在室温下反应3小时或在4℃反应一晩。
7.使用板清洗液,以200μL/孔对孔进行4次清洗。
8.在微孔板的孔中加入检测抗体(例如,经生物素标记的抗REIC/Dkk-3蛋白多克隆抗体)50μL。使板在室温下反应1小时。
9.使用板清洗液,以200μL/孔对孔进行4次清洗。
10.在微孔板的孔中加入与检测抗体反应的作用性的复合体(例如,经HRP标记的亲和素)50μL。使板在室温下反应1小时。
11.使用板清洗液,以200μL/孔对孔进行4次清洗。
12.制备作用性的底物(例如TMB底物),向微孔板的孔中加入50μL。
13.在反应充分进行的时刻,向微孔板的孔中加入100μL的停止液。
14.使用波长450nm的光谱酶标仪,测定各孔的吸光度。
标准曲线
使用0、31.3、62.5、125、250、500、1000、2000pg/mL这8种浓度的REIC/Dkk-3蛋白标准品(重组型人REIC/Dkk-3蛋白)制成标准曲线,由此进行定量分析。将标准曲线示于图2。
人血清和血浆试样
由REIC/Dkk-3基因治疗前、治疗中、治疗后的患者采集血清或血浆,冷冻保存至测定时为止。
实施例3.基于以来自前列腺癌患者的血清作为测定对象的夹心ELISA法的治疗监测
利用夹心ELISA法对来自前列腺癌患者的血清中的REIC/Dkk-3蛋白的浓度进行测定。使用识别N端结构域的N-1抗体或识别富含半胱氨酸的结构域的Cys-3抗体作为捕获抗体,对于进行了2次(第0天、第14天)REIC/Dkk-3基因治疗的患者,测定11种样本、即基准(治疗前)、第1次治疗后第1、2、7、14天(即将第2次治疗之前)、第15、17、21、28天、第56天(即将手术之前)、第84天的血清中的REIC/Dkk-3蛋白浓度。作为检测抗体,使用经生物素标记的抗REIC/Dkk-3蛋白多克隆抗体。该多克隆抗体以由HEK293细胞分泌的REIC/Dkk-3蛋白作为免疫原而制作。根据该测定数据,在使用识别N端结构域的N-1抗体作为捕获抗体的情况下,能够进行治疗的监测,将两名患者(患者A、患者B)的测定数据示于图3-1A和图3-1B中。进而,使用识别富含半胱氨酸的结构域的Cys-3抗体作为捕获抗体,测定上述血清样品中的REIC/Dkk-3蛋白浓度,将结果示于图3-2A(患者A)和图3-2B(患者B)中。如图3-1所示,在使用N-1抗体作为捕获抗体的情况下,进行REIC/Dkk-3基因治疗或外科治疗后的血清中的REIC/Dkk-3蛋白测定值显著上升。另一方面,在使用Cys-3抗体作为捕获抗体的情况下,进行REIC/Dkk-3基因治疗或外科治疗后的血清中的REIC/Dkk-3蛋白测定值不上升。通过将这些捕获抗体不同的两种测定数据进行比较,可以判断:N-1抗体对癌患者血清中的REIC/Dkk-3蛋白的反应性显著降低。作为图3-3,示出以N-1抗体和Cys-3抗体作为捕获抗体所测定的REIC/Dkk-3蛋白浓度的比例(%)(N-1抗体/Cys-3抗体的测定值)。该结果表明,作为REIC/Dkk-3蛋白浓度的比例(%)的N-1抗体/Cys-3抗体的测定值之比准确地反映了血中的REIC/Dkk-3蛋白的动态。另外,图3-4中示出患者A和B以及其他3名患者(共5人)的治疗前的血清中的REIC/Dkk-3蛋白浓度的测定结果。图3-4中示出使用识别N端结构域的N-1抗体或识别富含半胱氨酸的结构域的Cys-3抗体作为捕获抗体时的测定结果。如图3-4所示,使用N-1抗体时的血清中浓度为约10~50ng/mL,使用Cys-3抗体时的血清中浓度为约55~110ng/mL。由图3-3和图3-4可以判断,以REIC/Dkk-3蛋白的血清中浓度和利用上述2种抗体测定的浓度之比为指标,能够捕捉接受了治疗的患者血中的经时的REIC/Dkk-3蛋白的动态变化、即具有活性结构的REIC/Dkk-3蛋白和在癌患者血中大量存在的REIC/Dkk-3蛋白的浓度的变化。血中的经时的REIC/Dkk-3蛋白的动态变化反映了癌患者的癌状态的变化,还能够进行治疗的监测,以往的基于肿瘤标记物的诊断是利用癌患者的血中浓度的绝对值来进行评价,因此是包含个体差异的诊断法,与此相对,该诊断方法利用2种抗体来捕捉癌患者血清中的REIC/Dkk-3蛋白的结构变化,由此成为能够实现用于提供最适合患者个体的治疗方法的定制医疗的新型肿瘤诊断法。
实施例4.通过来自前列腺癌患者的血清、外科手术后的血清、正常人血清的比较而进行的疾病预测
通过使用识别N端的N-1抗体或识别富含半胱氨酸的结构域的Cys-3抗体作为捕获抗体、使用实施例3中所用的经生物素标记的抗REIC/Dkk-3蛋白多克隆抗体作为检测抗体的夹心ELISA法,对前列腺癌患者、外科手术后、正常人各5人的血清中的REIC/Dkk-3蛋白浓度进行测定。将以N-1抗体和Cys-3抗体作为捕获抗体所测定的REIC/Dkk-3蛋白浓度的比例(%)(N-1抗体/Cys-3抗体的测定值)示于图4-1。将5名前列腺患者的概况示于图4-2。如图4-1所示,在前列腺癌患者的血清中,N-1抗体/Cys-3抗体的测定值低,在治疗后的前列腺癌患者的血清和正常人血清中,N-1抗体/Cys-3抗体的测定值高。该结果表明,利用2种捕获抗体所测定的REIC/Dkk-3蛋白的浓度之比能够作为癌的预测、预后的诊断有效利用。
实施例5.使用抗REIC/Dkk-3蛋白单克隆抗体的夹心ELISA系统中的捕获抗体与检测抗体的组合的研究
在抗REIC/Dkk-3蛋白单克隆抗体(N-1、N-2、C-1、C-2、Cys-1、Cys-2、Cys-3、Cys-4、Cys-5、Cys-6)的夹心ELISA系统中,对于使用经生物素标记的识别N端的N-1抗体、或经生物素标记的识别富含半胱氨酸的结构域的Cys-3抗体作为检测抗体时的、可组合的捕获抗体进行了研究。捕获抗体使用与检测抗体不同的抗体,以100ng/mL、10ng/mL的浓度添加纯化的重组型REIC/Dkk-3蛋白,作为与检测抗体反应的作用性的复合体,使用了亲和素-HRP。将作为REIC/Dkk-3蛋白与各种抗体的结合量的指标的HRP活性以吸光度450nm的测定值示于图5。如图5所示,可以将所确认的所有捕获抗体与检测抗体组合而测定REIC/Dkk-3蛋白。另外可知:作为捕获抗体,N-1抗体优于N-2抗体;在识别富含半胱氨酸的结构域的抗体中,Cys-3抗体是优异的。
工业实用性
本发明的抗REIC/Dkk-3抗体是能够监测使用REIC/Dkk-3基因和REIC/Dkk-3蛋白药物的癌治疗效果的抗体,基于使用抗REIC/Dkk-3抗体的免疫测定法进行的诊断能够作为癌的预测和预后的诊断方法以及伴随诊断法有效利用,其诊断方法以检查试剂盒的形式提供。
保藏号
NITE BP-02103
NITE BP-02104
本说明书中所引用的全部出版物、专利和专利申请直接通过引用并入到本说明书中。
序列表
<110> 国立大学法人冈山大学(National University Corporation Okayama University)
桃太郎源株式会社(Momotaro-Gene Inc.)
<120> 特异性地识别、结合活性结构的REIC/Dkk-3蛋白的抗体、以及使用该抗REIC/Dkk-3抗体的癌治疗的监测(An antibody which specifically recognizes and binds toREIC/Dkk-3 protein with active structure, and a monitoring ofcancer therapy using the said antibody)
<130> PH-6679-PCT
<150> JP 2015-190401
<151> 2015-09-28
<160> 2
<170> SIPOSequenceListing 1.0
<210> 1
<211> 1053
<212> DNA
<213> 人类(Homo sapiens)
<220>
<221> CDS
<222> (1)..(1053)
<400> 1
atg cag cgg ctt ggg gcc acc ctg ctg tgc ctg cta ctg gcg gcg gcg 48
Met Gln Arg Leu Gly Ala Thr Leu Leu Cys Leu Leu Leu Ala Ala Ala
1 5 10 15
gtc ccc acg gcc ccc gcg ccc gct ccg acg gcg acc tcg gct cca gtc 96
Val Pro Thr Ala Pro Ala Pro Ala Pro Thr Ala Thr Ser Ala Pro Val
20 25 30
aag ccc ggc ccg gct ctc agc tac ccg cag gag gag gcc acc ctc aat 144
Lys Pro Gly Pro Ala Leu Ser Tyr Pro Gln Glu Glu Ala Thr Leu Asn
35 40 45
gag atg ttc cgc gag gtt gag gaa ctg gtg gag gac acg cag cac aaa 192
Glu Met Phe Arg Glu Val Glu Glu Leu Val Glu Asp Thr Gln His Lys
50 55 60
ttg cgc agc gcg gtg gaa gag atg gag gca gaa gaa gct gct gct aaa 240
Leu Arg Ser Ala Val Glu Glu Met Glu Ala Glu Glu Ala Ala Ala Lys
65 70 75 80
gca tca tca gaa gtg aac ctg gca aac tta cct ccc agc tat cac aat 288
Ala Ser Ser Glu Val Asn Leu Ala Asn Leu Pro Pro Ser Tyr His Asn
85 90 95
gag acc aac aca gac acg aag gtt gga aat aat acc atc cat gtg cac 336
Glu Thr Asn Thr Asp Thr Lys Val Gly Asn Asn Thr Ile His Val His
100 105 110
cga gaa att cac aag ata acc aac aac cag gct cga caa atg gtc ttt 384
Arg Glu Ile His Lys Ile Thr Asn Asn Gln Ala Arg Gln Met Val Phe
115 120 125
tca gag aca gtt atc aca tct gtg gga gac gaa gaa ggc aga agg agc 432
Ser Glu Thr Val Ile Thr Ser Val Gly Asp Glu Glu Gly Arg Arg Ser
130 135 140
cac gag tgc atc atc gac gag gac tgt ggg ccc agc atg tac tgc cag 480
His Glu Cys Ile Ile Asp Glu Asp Cys Gly Pro Ser Met Tyr Cys Gln
145 150 155 160
ttt gcc agc ttc cag tac acc tgc cag cca tgc cgg ggc cag agg atg 528
Phe Ala Ser Phe Gln Tyr Thr Cys Gln Pro Cys Arg Gly Gln Arg Met
165 170 175
ctc tgc acc cgg gac agt gag tgc tgt gga gac cag ctg tgt gtc tgg 576
Leu Cys Thr Arg Asp Ser Glu Cys Cys Gly Asp Gln Leu Cys Val Trp
180 185 190
ggt cac tgc acc aaa atg gcc acc agg ggc agc aat ggg acc atc tgt 624
Gly His Cys Thr Lys Met Ala Thr Arg Gly Ser Asn Gly Thr Ile Cys
195 200 205
gac aac cag agg gac tgc cag ccg ggg ctg tgc tgt gcc ttc cag aga 672
Asp Asn Gln Arg Asp Cys Gln Pro Gly Leu Cys Cys Ala Phe Gln Arg
210 215 220
ggc ctg ctg ttc cct gtg tgc ata ccc ctg ccc gtg gag ggc gag ctt 720
Gly Leu Leu Phe Pro Val Cys Ile Pro Leu Pro Val Glu Gly Glu Leu
225 230 235 240
tgc cat gac ccc gcc agc cgg ctt ctg gac ctc atc acc tgg gag cta 768
Cys His Asp Pro Ala Ser Arg Leu Leu Asp Leu Ile Thr Trp Glu Leu
245 250 255
gag cct gat gga gcc ttg gac cga tgc cct tgt gcc agt ggc ctc ctc 816
Glu Pro Asp Gly Ala Leu Asp Arg Cys Pro Cys Ala Ser Gly Leu Leu
260 265 270
tgc cag ccc cac agc cac agc ctg gtg tat gtg tgc aag ccg acc ttc 864
Cys Gln Pro His Ser His Ser Leu Val Tyr Val Cys Lys Pro Thr Phe
275 280 285
gtg ggg agc cgt gac caa gat ggg gag atc ctg ctg ccc aga gag gtc 912
Val Gly Ser Arg Asp Gln Asp Gly Glu Ile Leu Leu Pro Arg Glu Val
290 295 300
ccc gat gag tat gaa gtt ggc agc ttc atg gag gag gtg cgc cag gag 960
Pro Asp Glu Tyr Glu Val Gly Ser Phe Met Glu Glu Val Arg Gln Glu
305 310 315 320
ctg gag gac ctg gag agg agc ctg act gaa gag atg gcg ctg ggg gag 1008
Leu Glu Asp Leu Glu Arg Ser Leu Thr Glu Glu Met Ala Leu Gly Glu
325 330 335
cct gcg gct gcc gcc gct gca ctg ctg gga ggg gaa gag att tag 1053
Pro Ala Ala Ala Ala Ala Ala Leu Leu Gly Gly Glu Glu Ile
340 345 350
<210> 2
<211> 350
<212> PRT
<213> 人类(Homo sapiens)
<400> 2
Met Gln Arg Leu Gly Ala Thr Leu Leu Cys Leu Leu Leu Ala Ala Ala
1 5 10 15
Val Pro Thr Ala Pro Ala Pro Ala Pro Thr Ala Thr Ser Ala Pro Val
20 25 30
Lys Pro Gly Pro Ala Leu Ser Tyr Pro Gln Glu Glu Ala Thr Leu Asn
35 40 45
Glu Met Phe Arg Glu Val Glu Glu Leu Val Glu Asp Thr Gln His Lys
50 55 60
Leu Arg Ser Ala Val Glu Glu Met Glu Ala Glu Glu Ala Ala Ala Lys
65 70 75 80
Ala Ser Ser Glu Val Asn Leu Ala Asn Leu Pro Pro Ser Tyr His Asn
85 90 95
Glu Thr Asn Thr Asp Thr Lys Val Gly Asn Asn Thr Ile His Val His
100 105 110
Arg Glu Ile His Lys Ile Thr Asn Asn Gln Ala Arg Gln Met Val Phe
115 120 125
Ser Glu Thr Val Ile Thr Ser Val Gly Asp Glu Glu Gly Arg Arg Ser
130 135 140
His Glu Cys Ile Ile Asp Glu Asp Cys Gly Pro Ser Met Tyr Cys Gln
145 150 155 160
Phe Ala Ser Phe Gln Tyr Thr Cys Gln Pro Cys Arg Gly Gln Arg Met
165 170 175
Leu Cys Thr Arg Asp Ser Glu Cys Cys Gly Asp Gln Leu Cys Val Trp
180 185 190
Gly His Cys Thr Lys Met Ala Thr Arg Gly Ser Asn Gly Thr Ile Cys
195 200 205
Asp Asn Gln Arg Asp Cys Gln Pro Gly Leu Cys Cys Ala Phe Gln Arg
210 215 220
Gly Leu Leu Phe Pro Val Cys Ile Pro Leu Pro Val Glu Gly Glu Leu
225 230 235 240
Cys His Asp Pro Ala Ser Arg Leu Leu Asp Leu Ile Thr Trp Glu Leu
245 250 255
Glu Pro Asp Gly Ala Leu Asp Arg Cys Pro Cys Ala Ser Gly Leu Leu
260 265 270
Cys Gln Pro His Ser His Ser Leu Val Tyr Val Cys Lys Pro Thr Phe
275 280 285
Val Gly Ser Arg Asp Gln Asp Gly Glu Ile Leu Leu Pro Arg Glu Val
290 295 300
Pro Asp Glu Tyr Glu Val Gly Ser Phe Met Glu Glu Val Arg Gln Glu
305 310 315 320
Leu Glu Asp Leu Glu Arg Ser Leu Thr Glu Glu Met Ala Leu Gly Glu
325 330 335
Pro Ala Ala Ala Ala Ala Ala Leu Leu Gly Gly Glu Glu Ile
340 345 350
- 还没有人留言评论。精彩留言会获得点赞!