一种检测微管蛋白抑制剂及相关杂质的高效液相色谱法的制作方法
本发明属于化学分析领域,具体涉及用高效液相色谱检测化合物及其在制备和储存过程中产生的杂质的方法。
背景技术:
(3z,6z)-3-((e)-3-(5-叔丁基)-1h-咪唑基-4-基)亚甲基)-6-((e)-3-(3-氟苯基)-2-丙烯亚基)哌嗪-2,5-二酮是一种基于被取代的杂环骨架的微管蛋白抑制剂,分子式为c21h21fn4o2,具有式(i)所示的结构,下文将用代号hw130表示该化合物:
在合成和储藏该化合物的过程中,其分子结构中第3位和第6位的双键容易产生顺式异构体,此外还可能产生其它各种中间体、副产物和降解产物。检测该化合物及相关杂质对hw130制备过程及最终产品的质量控制十分重要,而采用一般的分析方法难于分离hw130与它的光学异构体。
技术实现要素:
本发明的目的是提供一种检测hw130的高效液相色谱检测方法,包括以下步骤:
(1)制备供试品溶液和对照品溶液
取供试品与体积比为80∶20的乙腈-水溶液混合制成浓度为0.1~0.45mg/ml的溶液,作为供试品溶液;所述的供试品为含所述微管蛋白抑制剂的制品;
(2)取所述的微管蛋白抑制剂与体积比为80∶20的乙腈-水溶液混合制成浓度为0.001~0.0045mg/ml的溶液对照品溶液;
(3)采用高效液相色谱检测供试品和对照品
检测条件为:
色谱柱zorbaxeclipsexdb-c18柱,
柱温25~45℃,
检测波长375±2nm,
流动相:以体积比为90∶10的磷酸盐缓冲液-乙腈为流动相a,以乙腈为流动相b,梯度洗脱,所述的磷酸盐缓冲液的浓度为0.01~0.05mol/l,ph值为4.5~8.5;
流速为0.8~1.3ml/min。
优选地,所述的供试品为含所述微管蛋白抑制剂的原料、粗品或者注射剂。
优选地,所述的供试品包含杂质a~f中的一种或者多种:
a为hw130的光学异构体,化学名称为(3e,6e)-3-((e)-3-(5-叔丁基)-1h-咪唑基-4-基)亚甲基)-6-((e)-3-(3-氟苯基)-2-丙烯亚基)哌嗪-2,5-二酮,具有式(ii)所示的结构:
b为合成hw130的副产物,化学名称为(3e,6e)-3-((e)-3-(5-叔丁基)-1h-咪唑基-4-基)亚甲基)-6-((e)-3-(4-氟苯基)-2-丙烯亚基)哌嗪-2,5-二酮,具有式(iii)所示的结构:
c为合成hw130的原料之一,化学名称为1,4-二乙酰基哌嗪-2,5-二酮,具有式(iv)所示的结构:
d是合成hw130的原料之一,化学名称为5-叔丁基-1h-咪唑-4-甲醛,具有式(v)所示的结构:
e也是合成hw130的原料之一,化学名称为3-(3-氟)苯基丙烯醛,具有式(vi)所示的结构:
f是合成hw130的中间体,化学名为(z)-1-乙酰基-3-((5-(叔丁基)-1h-咪唑-4-基)亚甲基)哌嗪-2,5-二酮
结构式:
优选地,所述的流动相为:
第0~5分钟,线性等度洗脱,流动相a的比例保持71%~75%不变,流动相b的比例保持25%~29%不变;
第5~10分钟,线性梯度洗脱,流动相a的比例从73%变化为61%,流动相b的比例从27%变化为39%;
第10~40分钟,线性梯度洗脱,流动相a的比例从61%变化为44%,流动相b的比例从39%变化为56%;
第40~45分钟,等度洗脱,流动相a与流动相b的比例保持44:56;
第44~50分钟,流动相a的比例为71%~75%,流动相b的比例为25%~29%。
优选地,本发明所述的磷酸盐选自磷酸二氢钾。
优选地,磷酸二氢钾的浓度为0.01mol/l,ph值为6.8。
优选地,检测柱温为28~32℃,更优选为30℃。
优选地,流动相流速为1.2ml/min,检测波长为375nm。
发明人通过对色谱条件的探索,确定了可以有效分离hw130及相关杂质的方法,实现了同时检测微管蛋白抑制剂及其分解产物等杂质,操作简便,重现性好,灵敏度高,可用于控制hw130产品的质量控制,对评价hw130化合物的合成和制剂工艺的优劣、终产品质量控制及稳定性样品检测具有重要的意义。
附图说明
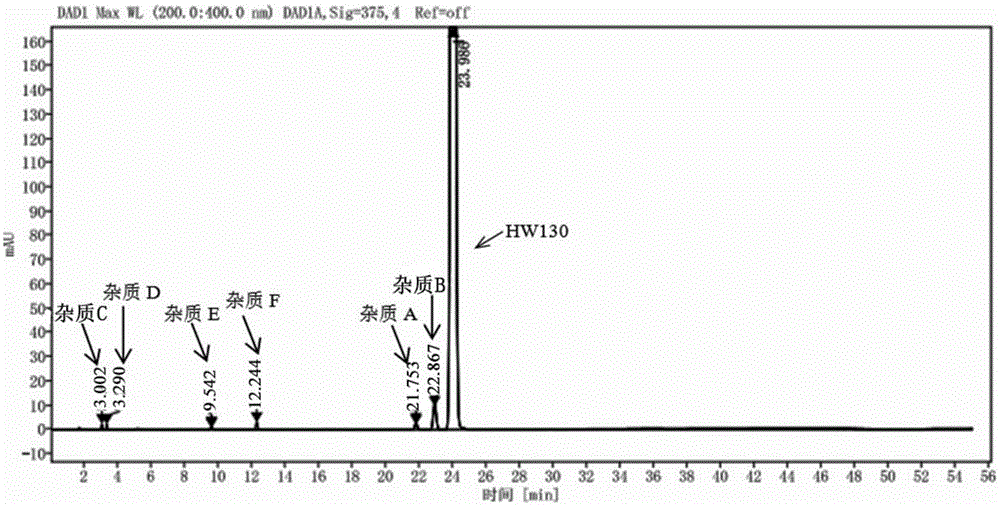
图1是系统适用性典型hplc图谱;
图2~图6是hw130原料降解试验溶液的色谱图(批号:20170701)。其中,图2是光降解样品;图3是酸降解样品;图4是碱降解样品;图5是氧化降解样品;图6是热破坏样品。
图7~图11是hw130原料稳定性试验溶液的色谱图(批号:20170701)。其中,图7是稳定性样品0h;图8是稳定性样品4h;图9是稳定性样品8h;图10是稳定性样品12h;图11是稳定性样品24h。
图12~图14是hw130原料供试品溶液的色谱图。其中,图12是hw130原料供试品溶液(批号:20170201);图13是hw130原料供试品溶液(批号:20170501);图14是hw130原料供试品溶液(批号:20170701)。
图15~图17是hw130注射用浓溶液供试品溶液的色谱图。其中,图15是hw130注射用浓溶液供试品溶液(批号:20170802);图16是hw130注射用浓溶液供试品溶液(批号:20170901);图17是hw130注射用浓溶液供试品溶液(批号:20170902)。
具体实施方式
通过如下实施例,将更好地理解本发明。这些实施例旨在阐述而不是限定本发明的范围。
仪器:agilent1260系列高效液相色谱仪;
试剂:磷酸二氢钾(分析纯),乙腈(色谱纯,merk公司),超纯水(自制);
色谱柱:aglientzorbaxeclipsexdb-c18色谱柱(4.6×250mm,5μm);
杂质a的对照品购自药明康德,纯度90.3%,批号:es8413-1-p1。杂质c~e的对照品为市售商品,纯度分别为99.1%、98.2%、98.4%,批号分别为:20170401;20170412;20161019。
实施例中制备注射用浓溶液液的原料,其中表面活性剂可以是hlb值为12~14的药学上可接受的表面活性剂,如聚氧乙烯(35)蓖麻油或者15-羟基硬脂酸聚乙二醇酯,聚乙二醇的分子量为200~1000,注射液为的组分包括活性成分0.1%~1%(w/w),表面活性剂15%~40%(w/w),聚乙二醇10%~30%(w/w),无水乙醇32%~52%(w/w),抗氧剂0.02%~0.05%(w/w)。
实施例1
制备hw130原料:
参照专利申请cn106565686a说明书的实施例3制备获得hw130原料。
实施例2
制备hw130对照品:
用丙酮重结晶由实施例1获得的hw130原料,干燥,即得hw130对照品,纯度为99.1%,批号:20170710。
实施例3
制备hw130光降解试验样品:
取实施例1中hw130原料约30mg,精密称定,置100ml容量瓶中,加50ml体积比为80∶20的乙腈-水为溶剂溶解,放置于光照(5000±500lx)下1.5小时取出,即得。
实施例4
制备hw130注射用浓溶液:
(1)将活性成分hw1300.35%(w/w)、聚乙二醇30020%(w/w)、表面活性剂聚氧乙烯(35)蓖麻油30.6%(w/w)、抗氧剂维生素e0.05%(w/w)和无水乙醇39.2%(w/w)加入配液容器中,在25℃下搅拌溶解,获得药液1;
(2)用0.45μm滤膜对由步骤1获得的药液进行粗滤除杂,获得药液2;
(3)超滤或活性炭除去药液2的热原,用9.8%(w/w)无水乙醇循环冲洗超滤或者活性炭过滤装置,合并滤液,获得药液3;
(4)除菌过滤药液3,获得药液4;
(5)将药液4灌装于注射剂管制瓶,半压塞后进入冻干机或真空干燥设备,除去乙醇,获得注射剂。
实施例5
制备杂质b的对照品:
取3-(3-氟)苯基丙烯醛与hw130中间体合成,合成条件参照公开号为cn106565686a中实施例3步骤3制得。纯度98.0%,批号:20171012。
实施例6
制备杂质f的对照品:
参照中国专利申请cn1684955中实施例2的方法制备而得,纯度为97.0%,批号:20170501。检测供试品
实施例7
(1)制备系统适应性试验溶液
取hw130对照品和杂质a~f对照品加体积比为80∶20的乙腈-水溶剂制成每1ml溶液含0.3mg的hw130,0.6μg杂质a,1.5μg杂质b,0.3μg杂质c,0.3μg杂质d,0.3μg杂质e,0.3μg杂质f的混合溶液。
制备供试品溶液
取实施例3制备的hw130光降解样品与体积比为80∶20的乙腈-水溶液混合制成浓度为0.3mg/ml的溶液,作为供试品溶液;
制备对照品溶液
取hw130对照品与体积比为80∶20的乙腈-水溶液混合制成浓度为0.003mg/ml的溶液对照品溶液;
(2)检测条件为:
色谱柱zorbaxeclipsexdb-c18柱,
柱温30℃,
检测波长375nm,
流动相:以体积比为90∶10的磷酸盐缓冲液-乙腈为流动相a,以乙腈为流动相b,梯度洗脱,如表1所示,所述的磷酸盐缓冲液ph值为6.8,所述的磷酸盐缓冲液的浓度为0.01mol/l;
流速为1.2ml/min。
精密量取10μl试验溶液,注入液相色谱仪,记录色谱图,校定检测系统至hw130主峰与相邻杂质b的峰的分离度大于1.5,hw130主峰的理论板数不低于10000,拖尾因子小于1.5;获得色谱图如图1所示。
将对照品溶液注入校定后的液相色谱仪,调节检测灵敏度,再将供试品溶液注入液相色谱仪,在上述色谱条件下进行高效液相色谱测定,记录色谱图至hw130主峰保留时间的3倍。按外标法以峰面积计算各杂质峰面积。
表1.流动相与洗脱时间
实施例8
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中流动相中磷酸盐的浓度为0.03mol/l。
实施例9
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中流动相中磷酸盐的浓度为0.05mol/l。
实施例10
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中流动相中磷酸盐的浓度为0.08mol/l。
实施例11
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中流动相中磷酸盐的浓度为0.10mol/l。
表2.磷酸盐浓度选择结果
由表2可知,实施例7的分离效果最佳,因此磷酸盐的最佳浓度为0.01/l。
实施例12
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中流动相的ph为4.5。
实施例13
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中流动相的ph为7.2。
实施例14
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中流动相的ph为7.5。
实施例15
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中流动相的ph为8.5。
表3.ph值选择结果
由表3可知,实施例7的分离效果最佳,因此流动相的最佳ph值为6.8。
实施例16
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中色谱柱为zorbaxsb氰基柱(250×4.6mm,5μm)。
实施例17
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中色谱柱为eclipsexdb-c8柱(250×4.6mm,5μm)。
实施例18
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中色谱柱为xbridge苯基柱(250×4.6mm,5μm)。
实施例19
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中色谱柱为zorbaxsb-c18柱(250×4.6mm,5μm)。
表4.色谱柱选择结果
由表4可知,实施例7的分离效果最佳,因此色谱柱为zorbaxeclipsexdb-c18时分离效果最好。
实施例20
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中柱温为25℃。
实施例21
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中柱温为28℃。
实施例22
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中柱温为32℃。
实施例23
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中柱温为45℃。
表5.柱温选择结果
由表5可知,实施例7的分离效果最佳,因此柱温为30℃时分离效果最好。
实施例24
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中流速为0.8ml/min。
实施例25
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中流速为1.0ml/min。
实施例26
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中流速为1.3ml/min。
实施例27
按照实施例7的方法检测实施例3制备的hw130光降解样品,其中流速为1.5ml/min。
表6.流速选择结果
由表6可知,实施例7的分离效果最佳,因此流速为1.2ml/min时分离效果最好。
实施例28
取按实施例7步骤(1)制备的试验溶液,按照实施例7步骤(2)的色谱条件进行检测,其中将检测波长设置为280nm。
表7.检测波长选择结果
表7的结果显示hw130对照品、杂质a、b和f在375nm的波长处有较大吸收,响应因子在0.8~1.2范围内,杂质c~e在280nm的波长处有较大吸收。
但由于检测样品的风险控制在于杂质a、b和f,在多批次样品中检测均未监控到杂质c~e。因此最后确定检测波长为375nm。
实施例29
取实施例1中的原料约30mg,精密称定,置100ml容量瓶中,加50ml体积比为80∶20的乙腈-水为溶剂溶解,配制成供试品溶液。按该步骤制备5等份的供试品溶液。
第1份放置于光照(5000±500lx)下1.5小时取出,定容,作为光破坏溶液;
第2份加1mol/l盐酸溶液3ml,在70℃水浴放置8小时后取出,冷却至室温,加氢氧化钠溶液中和后,定容,作为酸破坏溶液;
第3份加1mol/l氢氧化钠溶液3ml,在60℃水浴放置2小时后取出,冷却至室温,加盐酸溶液中和后,定容,作为碱破坏溶液;
第4份加30%过氧化氢溶液2ml,在50℃水浴放置5小时后取出,冷却至室温,定容,作为氧化破坏溶液;
第5份在90℃水浴放置8小时后取出,冷却至室温,定容,作为高温破坏溶液。
按照实施例7的色谱检测条件分别检测上述降解试验的各破坏溶液,记录色谱图分别如附图2~附图6所示。结果发现上述破坏溶液产生的杂质对主峰测定均无干扰,主峰峰纯度符合要求(峰纯度指数≥990),主峰与相邻杂质峰分离度符合要求,供试品溶液符合质量守恒(平衡指数均在90%~110%)。因此,本发明的检测方法可检控hw130制品的质量。
实施例30
取适量hw130对照品,用体积比为80∶20的乙腈-水为溶剂配制成每1ml含0.3mg的hw130溶液,作为供试品溶液。再分别用体积比为80∶20的乙腈-水为溶剂稀释成一系列不同浓度的溶液,按照实施例7的检测条件分别进样10μl,使之产生主峰为基线噪音三倍的信号。
该方法的最小检知0.6ng,(s/n≥3),若用该方法检测浓度为0.3mg/ml的hw130制品,其检出限度为0.02%。
实施例31
取实施例1中的原料约30mg,精密称定,置100ml容量瓶中,加50ml体积比为80∶20的乙腈-水为溶剂溶解,配制成供试品溶液。按照实施例7的检测条件,于0、4、8、12、24小时分别进样测定,实验结果表明,主峰面积及有关物质测定结果在24小时内基本稳定。图谱如附图7~11所示。
由此可知,本发明的方法简单灵敏,重现性好,可对样品中hw130的质量进行较好的控制。
实施例32
以实施例1制备的hw130原料为供试品。按照实施例7的方法分别对3个批次(20170201、20170501、20170701)的hw130原料进行测定。
测定结果如表8所示,图谱如附图12~附图14所示。
表8.hw130原料检测结果
根据表8结果表明:主峰与杂质b的分离度良好,杂质检出符合要求,该方法适合hw30原料供试品有关物质检验。
实施例33
hw130注射浓溶液有关物质的测定
取实施例4制备的hw130注射浓溶液作为供试品。按照实施7的检测方法分别对三个批次(20170802、20170901、20170902)的hw130注射浓溶液进行测定。
结果如表9所示,图谱如附图15~附图17所示。
表9hw130注射浓溶液有关物质测定结果
根据表9结果表明:主峰与杂质b的分离度良好,杂质检出符合要求,该方法适合hw30注射用浓溶液供试品有关物质检验。
- 还没有人留言评论。精彩留言会获得点赞!