用于血液外泌体采集的试管及外泌体分离方法与流程
本发明涉及分子生物学及临床检验技术领域,具体的说是一种无需离心去除样本中的血细胞,结构合理、操作简便的用于血液外泌体采集的试管及外泌体分离方法。
背景技术:
外泌体是直径为30-150nm的小囊泡,是由活细胞选择性包装并释放。在人体的体液中,如血液、尿液以及脑脊液等,含量丰富。外泌体内含有不同种类的脂质、核酸以及蛋白等,这些物质可以被运输到特定的靶细胞,从而发挥相应的生物学功能。因此,外泌体在细胞间通讯以及生理和病理过程中发挥着巨大的作用。
目前,血清外泌体最常用的提取方法主要有三种,其一是超高速离心法,其二是,免疫磁珠法,其三是试剂盒法,如美国的thermo公司以及sbi公司提供的相关的血清外泌体的制备试剂。但三者都有明显的不足之处,超高速离心法,所获得的外泌体纯度高,但是产率低,耗时长,操作复杂,仪器昂贵不适合医院检测实践,且重复离心操作还有可能对囊泡造成损害,从而降低其质量;免疫磁珠法,能够特异性的捕捉到相应的外泌体,但是该项技术抗体成本较高,仅为少数国际巨头公司所掌握,如美国sbi公司等,导致成本高昂;沉降试剂盒法提取外泌体的得率高,但是其纯度太低,在获取外泌体的同时,也会得到许多血清中高丰度的蛋白质。此外,现有外泌体分离技术通常在感染一段时间后采用westernblot来验证,不能实时监测。
技术实现要素:
本发明针对现有技术中存在的缺点和不足,提出了一种无需离心处理,结构合理、操作简便的用于血液外泌体采集的试管及外泌体分离方法。
本发明可以通过以下措施达到:
一种用于血液外泌体采集的试管,设有试管主体,其特征在于试管内壁具有采用肝素修饰高分子材料制成的比表面积增大10倍以上的吸附结构,吸附结构设置在试管下部。
本发明所述吸附结构为多孔结构或锯齿阵列或分形阵列吸附结构或类小肠壁结构。
本发明试管内还设有便于加速血液血球排放的沟槽结构,所述沟槽结构的设置在吸附结构的上方,沟槽结构中设有两条以上绕试管内壁设置的沟槽,沟槽沿试管中轴线由吸附结构的顶端延伸至试管口。
本发明所述沟槽结构绕试管内壁均匀设置的6-16个v型沟槽,相邻的沟槽之间的凸台表面呈外凸的弧形,便于加速血液或血球排出。
本发明所述试管主体采用肝素修饰高分子材料一体成型,或采用由肝素修饰高分子材料制成的嵌入型结构嵌入普通试管内,所述肝素修饰高分子材料为肝素修饰聚乙烯或肝素修饰聚丙烯或肝素修饰pvc或肝素修饰聚氨酯或肝素修饰pva。
本发明试管内具有光滑的底面,便于血液排出。
本发明为了持握和处理,在试管口外壁设有环形外凸台,并在试管口上设有管塞。
本发明所述吸附结构中的类小肠壁结构是指试管内壁上设有比表面积增大10倍以上的环形皱襞,皱襞为褶皱。
本发明所述吸附结构中的锯齿阵列由高度范围为0.5-2毫米间隔的锥状齿,按彼此间距范围为1-3毫米深的条形沟槽结构排列组成,其中沟槽脊设有额外凸起或凹槽以增加表面积;其中锯齿阵列由锯齿单元重复排列形成,所述锯齿单元自上至下依次设有3-6个长度不同的v型齿,3-6个v型齿的长度自上至下逐渐减小。
本发明所述吸附结构中的多孔结构中孔径范围为0.05-0.5mm、孔深度范围为0.05-0.1mm,孔径形状为圆孔或椭圆形孔或方形孔或长条形孔或三角形孔或五边形孔或六边形孔。
本发明还提出了一种利用上述试管的外泌体分离方法,其特征在于包括以下步骤:
步骤1:取上述试管,将待处理血液加入试管内,加入量为5-10毫升;步骤2:摇动试管,使试管内样本与试管内壁上的吸附结构充分接触;步骤3:倾倒步骤2处理后的试管内液体,此时样本中的外泌体囊泡物质附着在试管内壁上的吸附结构上;
步骤4:用磷酸盐缓冲液仔细多次清洗管壁
步骤5:向步骤4中试管加入适量外泌体裂解和rna提取试剂trizol,或者加入肝素水解酶或者8摩尔/升氯化钠溶液解离外泌体进行蛋白分析;
步骤5:通过核酸沉降获得核酸物质,或者通过抗体结合分析蛋白成分和含量。
本发明与现有技术和设计相比,具有采集方便及时,结构合理、操作简便等显著的优点。
附图说明:
附图1是本发明的结构示意图。
附图2是图1中沟槽结构的截面图。
附图3是本发明中吸附结构的示意图。
附图4是本发明中锯齿阵列的一种实施方式结构示意图。
附图5是实施例3中采用传统离心法分离外泌体所获得的外泌体粒径分布图。
附图6是实施例3中采用实施例1中试管结构所获得的外泌体粒径分布图。
附图7是实施例3中采用实施例2中试管结构所获得的外泌体粒径分布图。
附图8是实施例3中采用传统离心法分离外泌体所获得的外泌体浓度fitc-ss二维散点图。
附图9是实施例3中采用实施例1中试管结构分离外泌体所获得的外泌体浓度fitc-ss二维散点图。
附图10是实施例3中采用实施例2中试管结构分离外泌体所获得的外泌体浓度fitc-ss二维散点图。
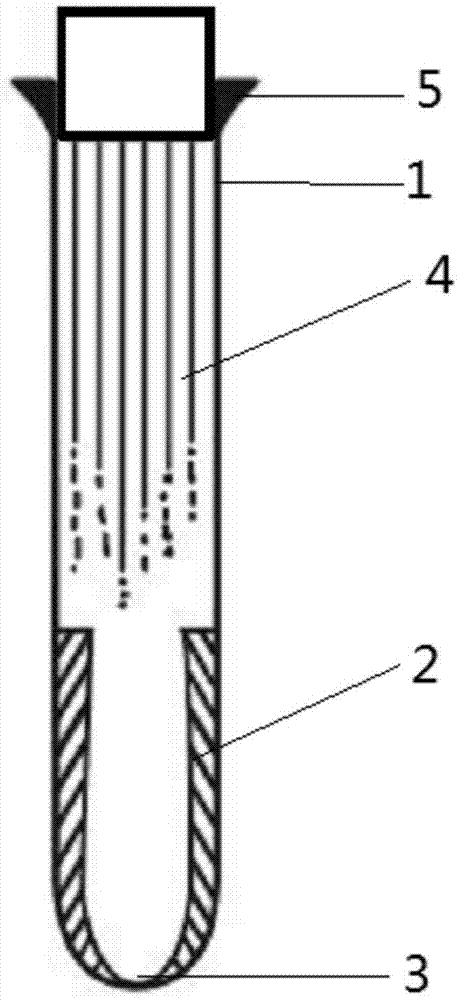
附图标记:试管主体1、吸附结构2、底面3、沟槽结构4、环形外凸台5、沟槽6。
具体实施方式:
下面结合附图和实施例对本发明作进一步的说明。
如附图所示,本发明提出了一种用于血液外泌体采集的试管,设有试管主体,其特征在于试管内壁具有采用肝素修饰高分子材料制成的比表面积增大10倍以上的吸附结构,所述吸附结构为多孔结构或锯齿阵列或分形吸附结构或类小肠壁结构,试管内具有光滑的底面3,吸附结构2设置在试管下部,如附图2所示,试管内还设有便于加速血液血球排放的沟槽结构4,所述沟槽结构4的设置在吸附结构2的上方,沟槽结构4中设有两条以上绕试管内壁设置的沟槽6,沟槽6沿试管中轴线由吸附结构的顶端延伸至试管口。
本发明所述沟槽结构4优选绕试管内壁均匀设置的6或8个v型沟槽6,相邻的沟槽6之间的凸台表面呈外凸的弧形,便于加速血液或血球排出。
本发明所述试管主体1采用肝素修饰高分子材料一体成型,或采用由肝素修饰高分子材料制成的嵌入型结构嵌入普通试管内,所述肝素修饰高分子材料为肝素修饰聚乙烯或肝素修饰聚丙烯或肝素修饰pvc或肝素修饰聚氨酯或肝素修饰pva。
本发明为了持握和处理,在试管口外壁设有环形外凸台5,并在试管口上设有管塞。
本发明所述吸附结构中的锯齿阵列由高度范围为0.5-2毫米间隔的锥状齿,按彼此间距范围为1-3毫米深的条形沟槽结构排列组成,其中沟槽脊设有额外凸起或凹槽以增加表面积;其中锯齿阵列由锯齿单元重复排列形成,所述锯齿单元自上至下依次设有3-6个长度不同的v型齿,优选三个v型齿的长度自上至下逐渐减小。
本发明所述吸附结构中的多孔结构中孔径范围为0.05-0.5mm、孔深度范围为0.05-0.5mm。
本发明还提出了一种利用上述试管的外泌体分离方法,其特征在于包括以下步骤:
步骤1:取上述试管,将待处理血液加入试管内,加入量为5-10毫升;
步骤2:摇动试管,使试管内样本与试管内壁上的吸附结构充分接触;
步骤3:倾倒步骤2处理后的试管内液体,此时样本中的外泌体囊泡物质会附着在试管内壁上的吸附结构上;
步骤4:用磷酸盐缓冲液仔细多次清洗管壁
步骤5:向步骤4中试管加入适量外泌体裂解和rna提取试剂trizol,或者加入肝素水解酶或者8摩尔/升氯化钠溶液解离外泌体进行蛋白分析;
步骤5:通过核酸沉降获得核酸物质,或者通过抗体结合分析蛋白成分和含量。
实施例1:
一种用于血液外泌体采集的试管,设有试管主体1,试管内壁具有采用肝素修饰高分子材料制成的吸附结构2,所述吸附结构为多孔结构,试管内具有光滑的底面3,吸附结构2设置在试管下部,试管内还设有便于加速血液血球排放的沟槽结构4,所述沟槽结构4的设置在吸附结构2的上方,沟槽结构4中设有两条以上绕试管内壁设置的沟槽6,沟槽6沿试管中轴线由吸附结构的顶端延伸至试管口;所述沟槽结构4绕试管内壁均匀设置的8个v型沟槽6,相邻的沟槽6之间的凸台表面呈外凸的弧形,便于加速血液或血球排出;所述试管主体1采用肝素修饰高分子材料一体成型,或采用由肝素修饰高分子材料制成的嵌入型结构嵌入普通试管内,所述肝素修饰高分子材料为肝素修饰pe或肝素修饰pvc;为了持握和处理,在试管口外壁设有环形外凸台5,并在试管口上设有管塞;
如附图3所示,吸附结构为多孔结构时,孔径范围为0.05-0.5mm、孔深度范围为0.05-0.5mm,在使用时,将待处理血液加入试管内,加入量为5-10毫升;摇动试管,使试管内样本与试管内壁上的吸附结构充分接触;倾倒处理后的试管内液体,此时样本中的外泌体囊泡物质附着在试管内壁上的吸附结构上;用磷酸盐缓冲液仔细多次清洗管壁;向步骤4中试管加入适量外泌体裂解和rna提取试剂trizol,或者加入肝素水解酶或者8摩尔/升氯化钠溶液解离外泌体进行蛋白分析;通过核酸沉降获得核酸物质,或者通过抗体结合分析蛋白成分和含量。
实施例2:
本发明提出一种用于血液外泌体采集的试管,设有试管主体1,试管内壁具有采用肝素修饰高分子材料制成的吸附结构2,所述吸附结构为锯齿阵列,试管内具有光滑的底面3,吸附结构2设置在试管下部,如附图2所示,试管内还设有便于加速血液血球排放的沟槽结构4,所述沟槽结构4的设置在吸附结构2的上方,沟槽结构4中设有两条以上绕试管内壁设置的沟槽6,沟槽6沿试管中轴线由吸附结构的顶端延伸至试管口;所述沟槽结构4优选绕试管内壁均匀设置的6或8个v型沟槽6,相邻的沟槽6之间的凸台表面呈外凸的弧形,便于加速血液或血球排出;所述试管主体1采用肝素修饰高分子材料一体成型,或采用由肝素修饰高分子材料制成的嵌入型结构嵌入普通试管内,所述肝素修饰高分子材料为肝素修饰pe或肝素修饰pvc;;为了持握和处理,在试管口外壁设有环形外凸台5,并在试管口上设有管塞。
本发明所述吸附结构中的锯齿阵列由高度范围为0.5-2毫米间隔的锥状齿,按彼此间距范围为1-3毫米深的条形沟槽结构排列组成,其中沟槽脊设有额外凸起或凹槽以增加表面积;其中锯齿阵列由锯齿单元重复排列形成,所述锯齿单元自上至下依次设有3-6个长度不同的v型齿,3-6个v型齿的长度自上至下逐渐减小。
如附图3所示,吸附结构为锯齿阵列时,锯齿阵列由两个以上锯齿单元组成,每个锯齿单元包括自上而下设置的三个v型齿;
在使用时,将待处理血液加入试管内,加入量为5-10毫升;摇动试管,使试管内样本与试管内壁上的吸附结构充分接触;倾倒处理后的试管内液体,此时样本中的外泌体囊泡物质附着在试管内壁上的吸附结构上;用磷酸盐缓冲液仔细多次清洗管壁;向步骤4中试管加入适量外泌体裂解和rna提取试剂trizol,或者加入肝素水解酶或者8摩尔/升氯化钠溶液解离外泌体进行蛋白分析;通过核酸沉降获得核酸物质,或者通过抗体结合分析蛋白成分和含量。
实施例3:
本发明与超高速离心法提取胎牛血清中外泌体粒径结果比较如下:
如附图5所示,采用现有的超高速离心法所得外泌体粒径分布如图,该方法获得的外泌体粒径为(median±s.d.,nm)71.0±8.1,采用如上述实施例1所记载试管结构所分离的外泌体粒径分布图如附图6所示,外泌体粒径为(median±s.d.,nm)73.4±9.4;采用如上述实施例2中试管结构所分离的外泌体粒径分布图如附图7所示,为(median±s.d.,nm)73.8±9.7。
由上述结果可知,采用本申请所记载试管结构分离外泌体,可以较大程度保证外泌体囊泡不被损伤,分离质量与超高速离心法相比,有所提高。
本发明与超高速离心法提取胎牛血清中外泌体纯度结果比较如下:
其中外泌体浓度计算方法如下:浓度标准品浓度记为“c1”,浓度标准品的稀释倍数记为“d1”;待测样品浓度记为“c2”,待测样品的稀释倍数记为“d2”;浓度标准品检测颗粒数记为“q1”,待测品检测颗粒数记为“q2”,待测品空白对照检测颗粒数记为“q3”,则(c1/d1)/(c2/d2)=q1/(q2-q3),(c1=2.30x10^11个/ml,d1=400,d2=100,q1=6122,q3超离=713,q3实施例1-2=816)。
附图8为采用现有的超高速离心法所得外泌体浓度fitc-ss二维散点图即绿色荧光-散射光二维散点图,所得外泌体浓度为3.78x10^10(个/ml),附图9为采用实施例1中试管结构所分离外泌体浓度fitc-ss二维散点图,所得外泌体浓度为4.91x10^10(个/ml),附图10为采用实施例2中试管结构所分离外泌体浓度fitc-ss二维散点图,所得外泌体浓度为5.15x10^10(个/ml)。
由上述结果可知,本申请中所记载的技术方案所获取的外泌体分离浓度不低于现有的超高速离心法。
本发明与现有技术和设计相比,具有采集方便及时,结构合理、操作简便等显著的优点。
- 还没有人留言评论。精彩留言会获得点赞!