SAA1检测剂在制备用于诊断过敏性紫癜肾炎的试剂盒中的应用的制作方法
本发明涉及医疗诊断领域,具体而言,涉及saa1检测剂在制备用于诊断过敏性紫癜肾炎的试剂盒中的应用。
背景技术:
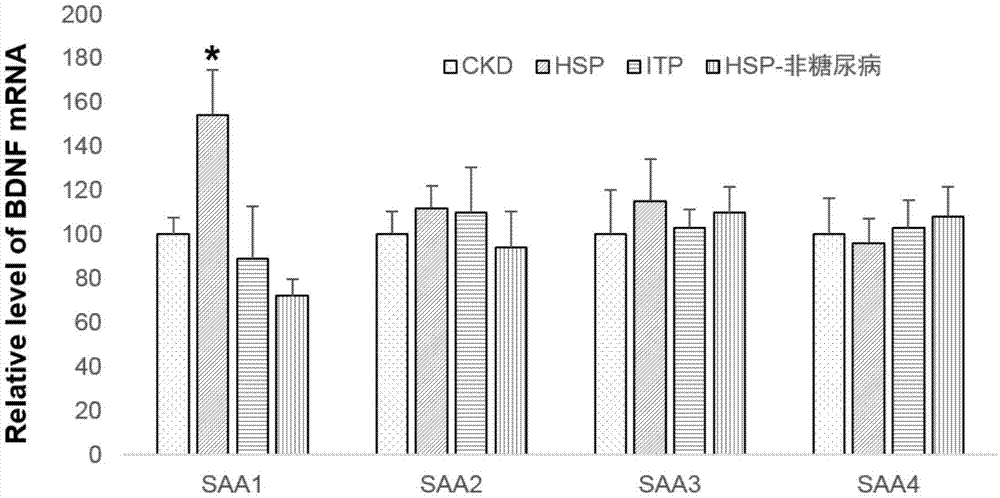
过敏性紫癜(henoch-schonleinpurpura,hsp)是一种累及全身小血管的炎症性疾病,临床上主要表现为皮肤、胃肠道、关节和肾脏受累,也可出现脑、肺和阴囊等器官受累,病理特点表现为受累脏器的小血管壁上有免疫球蛋白a(immunoglobulina,iga)为主的免疫复合物沉积(免疫巧荧光),过敏性紫癜性肾炎(henoch-schonleinpurpuranephritis,hspn)是指过敏性紫癜引起的肾实质损害,临床上在过敏性紫癜病程中(包含过敏性紫癜发病6月内)出现血尿和/或蛋白尿可诊断为过敏性紫癜性肾炎。目前认为感染、毒物和药物等可能是过敏性紫癜的重要病因,儿童过敏性紫癜发病前1-3周常有上呼吸道感染,可能与该病相关的病原体包括微小病毒b19、乙型肝炎病毒、丙型肝炎病毒、腺病毒、β溶血性链球菌、金黄色葡萄球菌和支原体;而昆虫叮咬、克拉霉素等毒物和药物可能与成人过敏性紫癜发病有关。尽管过敏性紫癜和过敏性紫癜性肾炎的具体发病机制尚不清楚,许多研究为进一步探讨其发病机制提供了大量的资料,近年来对过敏性紫癜发病机制的研究集中在基因易感性、iga1较链区糖基化异常、补体激活细胞因子和自身抗体等方面。人血清淀粉样蛋白a(humanserumamyloidaprotein,saa)是一种急性时相反应蛋白,属于载脂蛋白家族中的异质类蛋白质,分子量约12000。在急性时相反应中,经il-1、il-6和tnf刺激,saa在肝脏中由被激活的巨噬细胞和纤维母细胞合成,可升高到最初浓度的100-1000倍,但半衰期短,只有50分钟左右。既往研究证实saa家族由saa1、saa2、saa3及saa4四个家族成员构成。作为家族最主要组成成分的saa1是saa家族中表达最广泛、活性最强、反应最敏感的亚型。虽然在常态下saa1表达水平较低,但在急性期状态下其血清浓度在极短时间内升高1000倍。现有技术中还未发现saa1与过敏性紫癜性肾炎有和明显关联。技术实现要素:本发明涉及一种新颖的过敏性紫癜肾炎疾病标志物,并对其应用进行了研究。为了实现本发明的上述目的,特采用以下技术方案:本发明涉及saa1检测剂在制备用于诊断过敏性紫癜肾炎的试剂盒中的应用。根据本发明的一方面,本发明还涉及saa1检测剂在制备用于区分急性肾损伤与慢性肾损伤的试剂盒中的应用。根据本发明的一方面,本发明还涉及saa1检测剂在制备用于区分过敏性紫癜肾炎与血小板减少性紫癜肾炎的试剂盒中的应用。本发明在临床上实验证明个体血清及尿saa1的变化对于过敏性紫癜肾炎的诊断均有较高的灵敏度及特异性,并发现该标志物在过敏性紫癜与血小板减少性紫癜、慢性肾损伤中具有明显差异。本发明将为临床诊断过敏性紫癜(肾病)提供一种新的诊断手段,在辅助过敏性紫癜(肾病)的治疗以及病程监测上有一定的潜在临床价值。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为本发明一个实施例中saa1、saa2、saa3、saa4在不同人群中的mrna表达睡吧情况;图2为本发明一个实施例中saa1在不同人群中的蛋白表达水平情况。具体实施方式本发明涉及saa1检测剂在制备用于诊断过敏性紫癜肾炎(特别是合并糖尿病感染的急性肾炎)的试剂盒中的应用。优选的,如上所述的应用,所示试剂盒用于检测受试者体液。优选的,如上所述的应用,其中所述体液包括外周血、血清、血浆、痰、滑液、房水、羊水、乳汁、精液、前列腺液、汗液、尿液、泪液、囊液、胸腔积液、腹水液、心包液、乳糜、胆汁、间质液、经血、脓液、呕吐物、阴道分泌物、粘膜分泌物、胰液、支气管肺抽吸液、囊胚腔液或脐带血。优选的,如上所述的应用,其中所述体液包括外周血、血清、血浆、尿液。优选的,如上所述的应用,所述试剂盒进一步包括一种或多种过敏性紫癜肾炎生物标志物的检测剂。优选的,如上所述的应用,所述过敏性紫癜肾炎生物标志物选自尿足细胞及其相关标志蛋白(pcx)、单核细胞趋化蛋白-1(mcp-1)、巨噬细胞移动抑制因子(mif)、中性粒细胞明胶酶相关运载蛋白(ngal)、尿转化生长因子β1(tgf-β1)、肿瘤坏死因子-α(tnf-α)、mpo髓过氧化物酶、toll样受体4(tlr4)、超氧化物歧化酶(sod)、正五聚蛋白3(ptx3)、胰岛素样生长因子1(igf-1)表皮生长因子(egf)、尿蛋白。优选的,如上所述的应用,所述尿蛋白包括白蛋白(alb)、免疫球蛋白g(igg)、可溶性转铁蛋白(solubletransferrinreceptor,stfr)、tamm-horsafll蛋白、视黄醇结合蛋白。优选的,如上所述的应用,所述saa1检测剂包括抗saa1抗体;或;用于检测saa1mrna的qpcr引物和/或探针。saa1检测剂可配合任何已知的定量或半定量的蛋白/mrna检测方法,例如westernblot、qpcr、elisa、流式细胞术等等。“抗体”此用语包括多克隆抗体及单克隆抗体以及这些抗体的抗原化合物结合片段,包括fab、f(ab’)2、fd、fv、scfv、双特异抗体和抗体最小识别单位,以及这些抗体和片段的单链衍生物。抗体的类型可以选择igg1、igg2、igg3、igg4、iga、igm、ige、igd。此外,“抗体”此用语包括天然发生的抗体以及非天然发生的抗体,包括例如嵌合型(chimeric)、双功能型(bifunctional)和人源化(humanized)抗体,以及相关的合成异构形式(isoforms)。“抗体”此用语可和“免疫球蛋白”互换使用。根据本发明的一方面,本发明还涉及saa1检测剂在制备用于区分急性肾损伤(特别是合并糖尿病感染的急性过敏性紫癜性肾炎)与(特别是合并糖尿病感染的慢性过敏性紫癜性肾炎)慢性肾损伤的试剂盒中的应用。根据本发明的一方面,本发明还涉及saa1检测剂在制备用于区分(特别是合并糖尿病感染的)过敏性紫癜肾炎与血小板减少性紫癜肾炎的试剂盒中的应用。下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。实施例1itraq筛选差异蛋白parti.肾损伤尿液分子标志物的筛选1.主要实验材料:肾损伤患者(糖尿病aki患者,aki+ckd患者,糖尿病ckd患者,非糖尿病iga的ckd患者,非糖尿病非iga的ckd患者,各50例)尿液;健康人群(50例);itraq试剂盒。2.实验设置:2.1肾病患者早期检测和纳入标准2.1.1aki纳入标准(临床诊断)根据以下两条标准,作为早期aki(akii期)的纳入标准:48h内血肌酐含量上升26.2μmol/l或增高至基线值1.5-1.9倍;连续6h以上(不超过12h)尿量低于0.5ml/kg/h。2.1.2aki+ckd(ckd为基础上的aki患者,即ckd并发aki)纳入标准(临床诊断)按照临床检测指标,来判断患者是否为aki+ckd患者。2.1.3ckd纳入标准(临床诊断)检测血肌酐(酶法),根据公式计算肾小球滤过率gfr,当gfr在(45-59)ml/min/1.73m2范围内时,则该患者为早期ckd(ckd3a)患者。再根据是否患有糖尿病、iga肾病等,从而判断该患者属于哪一类ckd患者。简化mdrd公式:gfr(ml/min/1.73m2)=186×[scr(mg/dl)]-1.154×年龄-0.203×0.742(女性)。样本提供方法:病人样本:新鲜中段晨尿50ml(正常人样本增加到150ml),分装为10ml/管,每10ml尿液加入1ml蛋白酶抑制剂,4000rpm,4度,离心10分钟后,将离心后上清转移至15ml的冻存管中,-80度保存,样本浓缩由我司完成。2.2检测各类早期肾损伤中的蛋白质种类和含量2.2.1实验分组(6组)50例急性肾损伤(aki)患者混合尿液样本;50例aki+ckd患者混合尿液样本;50例糖尿病慢性肾损伤(ckd)患者混合尿液样本;50例非糖尿病iga的ckd患者混合尿液样本;50例非糖尿病非iga的ckd患者混合尿液样本;50例健康者混合尿液样本。每组,3个平行。(三次生物学重复,即需要提供每组150例病人尿液样本)2.2.2itraq联合lc-ms/ms技术进行蛋白质鉴定和含量分析(6组×2次)1.样品制备、富集和保存:取患者和健康者新鲜中端晨尿50ml,立刻冷却至4℃,2000g离心20min,取上清液,将同种疾病患者尿液或健康者尿液进行混合,保存于-80℃冰箱,也可直接进行后续操作,尿液解冻后,采用丙酮沉淀法提取蛋白质;2.蛋白浓度测定:采用bca方法,进行蛋白浓度测定;3.蛋白酶解及itraq标记;4.使用液体色谱和质谱的联用,进行一级质谱分析;5.进行二级质谱分析;6.数据库检索及生物信息学分析,鉴定蛋白质种类,并分析表达含量。2.3潜在尿液标志物的初筛2.3.1第一次筛选1.比较aki患者混合尿液样本和健康者混合尿液样本中的蛋白种类和含量高低,筛选出在aki患者中异常表达的蛋白;2.比较aki+ckd患者混合尿液样本和健康者混合尿液样本中的蛋白种类和含量高低,筛选出在aki+ckd患者中异常表达的蛋白;3.比较糖尿病ckd患者混合尿液样本和健康者混合尿液样本中的蛋白种类和含量高低,筛选出在糖尿病ckd患者中异常表达的蛋白;4.比较非糖尿病iga的ckd患者混合尿液样本和健康者混合尿液样本中的蛋白种类和含量高低,筛选出在早期非糖尿病iga的ckd患者中异常表达的蛋白;5.比较非糖尿病非iga的ckd患者混合尿液样本和健康者混合尿液样本中的蛋白种类和含量高低,筛选出在早期非糖尿病非iga的ckd患者中异常表达的蛋白。2.3.2第二次筛选1.根据2.3.1结果,比较非糖尿病ckd(包括iga和非iga的ckd)患者尿液中的蛋白质种类和含量,筛选出在非糖尿病ckd中皆异常表达的蛋白质,以及只在某类非糖尿病肾损伤中异常表达的蛋白质(即只在非糖尿病iga的ckd患者中异常表达的蛋白质,只在非糖尿病非iga的ckd患者中异常表达的蛋白质);2.根据2.3.1结果和2.3.2.1(各类非糖尿病肾损伤中皆异常表达的蛋白质),比较糖尿病ckd、非糖尿病ckd(iga和非iga的ckd)肾病患者尿液中的蛋白质种类和含量,筛选出在糖尿病ckd和非糖尿病ckd中皆异常表达的蛋白质,以及在各类ckd中特异性异常表达的蛋白质(即只在糖尿病ckd中异常表达的蛋白质,只在非糖尿病ckd中异常表达的蛋白质);3.根据2.3.1结果和2.3.2.2结果(各类ckd中皆异常表达的蛋白质),比较aki、ckd+aki、ckd(糖尿病ckd、非糖尿病iga的ckd、非糖尿病非iga的ckd)患者尿液中的蛋白质种类和含量,筛选出在各类肾损伤中皆异常表达的蛋白质,以及只在某类肾损伤中差异表达的蛋白质(即只在aki中差异表达的蛋白质,只在ckd+aki中差异表达的蛋白质,只在ckd中异常表达的蛋白质)。2.3.3第三次筛选1.根据2.3.2.3结果和2.3.1结果,筛选出只在aki患者尿液中异常表达的蛋白质,只在aki+ckd患者尿液中异常表达的蛋白质;2.根据2.3.2.2结果和2.3.1结果,筛选出只在糖尿病ckd中异常表达的蛋白质,只在非糖尿病肾损伤中异常表达的蛋白质;3.根据2.3.2.1结果和2.3.1结果,筛选出只在非糖尿病iga的ckd中异常表达的蛋白质,只在非糖尿病非iga的ckd中异常表达的蛋白质。结果:筛选出肾损伤的共有潜在尿液标志物,筛选出aki特异性潜在尿液标志物,筛选出aki+ckd特异性潜在尿液标志物,筛选出ckd共有的特异性潜在尿液标志物,筛选出糖尿病ckd特异性潜在尿液标志物,筛选出非糖尿病ckd共有的特异性潜在尿液标志物,筛选出非糖尿病iga的ckd特异性潜在尿液标志物,筛选出非糖尿病非iga的ckd特异性潜在尿液标志物。2.4潜在尿液标志物的生物学功能分析采用数据库、生物信息学软件和分析方法,分析2.2初筛后的蛋白因子与哪些蛋白质或信号分子间存在相关性和可能的作用(增殖、凋亡、生存、炎症、修复、迁移等方面),从而判断出这些潜在尿液标志物在肾损伤中的可能作用及可能的分子机制。采用peimap方法对尿液蛋白质与其它蛋白质之间的互相作用进行分析。1.使用bond(http://bond.unleashedinformatics.com/)、dip(http://dip.doe-mbi.ucla.edu/dip)、mint(http://mint.bio.uniroma2.it/mint/)、intact(http://www.ebi.ac.uk/intact/)、hprd(http://www.hprd.org/)、metacore、ingenuitypathwayanalysis、果蝇(http://www.fruitfly.org/)拟南芥(http://www.arabidopsis.org/)、水稻(http://gene64.dna.affrc.go.jp/rpd/)、黏菌(http://dictybase.org/)等数据库以及ncbiblast等软件,根据“同源性”预测蛋白相互作用原理(即一种物种中的两种蛋白质有相互作用,那么在其他物种中,这两种蛋白质的同源蛋白也应存在相互作用),从而分析出尿液标志物可能的相互作用蛋白。2.根据文献资料和上述结果,对这些可能与尿液蛋白质存在相互作用的蛋白质进行功能分类,如增殖(周期蛋白:cyclind、cyline等;周期蛋白依赖性激酶:cdk1、cdk2等;周期蛋白依赖性激酶抑制剂:p21、p53等;以及其它增殖调控因子),凋亡(bax、bcl-2、p53、caspase家族、survivin等等),间质纤维化(基质金属蛋白酶mmps及其抑制剂timps、胶原蛋白、细胞骨架相关蛋白及信号分子等),氧化应激等等。3.根据蛋白质功能分类和2.3.1结果,分析潜在尿液蛋白质可能的作用及分子机制。实施例2与saa1有关的结果依据蛋白表达丰度,蛋白差异倍数大于1.2(上调)或小于0.83(下调)且p<0.05时筛选为差异蛋白。对每一组所筛选出的差异蛋白按照差异倍数排序,选出每组前10位差异蛋白。其中saa1蛋白在合并感染糖尿病的aki患者尿液中均异常表达,上调倍数均为2.4倍以上,而在合并感染糖尿病的ckd患者中均无明显变化。据此筛选得到感兴趣的蛋白,并进行分子生物学验证。实施例3saa1为过敏性紫癜(hsp)肾炎的潜在标志物1.主要实验材料:合并感染糖尿病的hsp肾损伤患者血尿(hsp组,aki类型,50例)及肾脏穿刺样本(7例);未感染糖尿病的hsp肾损伤患者血尿(hsp-非糖尿病组,aki类型,30例);合并感染糖尿病的;慢性肾损伤(ckd)人群尿液(50例)及肾脏穿刺样本(8例);血小板减少性紫癜(itp)肾损伤患者尿液(aki类型,50例)及肾脏穿刺样本(7例);健康人群尿液(50例)。所有标本的留取均取得患者知情同意并签署知情同意书。2.尿液标本留取:过敏性紫癜性肾炎组、慢性肾损伤及小板减少性紫癜组的血尿标本在患者入院后第二天清晨留取,健康人群的血尿标本在患者就诊时留取。其中各自留尿液5ml,血液5m,留取的尿液以3000r/min离心10分钟,取上清液,将其分装到200ul的ep管中,-80℃冻存备用;留取的血液,以3000r/min离心10分钟,取上层血清,将其分装到200ul的ep管中,-80℃冻存备用;3.实验方法:3.1实时定量pcr(qpcr)1)采用trizol法提取肾脏穿刺样品中的rna。2)实时定量pcr反应体系共20ul体系,加完样品后带托离心<2000rbpm。2)引物序列:3)反应条件:saa1反应条件:95℃30s95℃0s62℃5s(退火温度)72℃10s40循环95℃0s65℃30s95℃0.1/持续降温40℃30ssaa2、saa3与saa4退火温度分别为64℃、63℃和62℃,其他反应条件与saa1相同。实验结果如图1所示。其中仅有hsp组的saa1mrna表达量发生显著变化(p<0.05,vsckd人群)。而其余几组均未发生变化。为进一步从蛋白水平验证saa1作为hspbiomarker的可行性,发明人接下来从蛋白水平进行进一步验证。3.2免疫印迹(westernblot)1)蛋白提取:从肾脏穿刺样品中提取得到的蛋白质。2)测蛋白浓度:具体步骤同elisa。3)免疫印迹(westernblot)①配胶:根据蛋白分子量的大小选择浓度为10%的胶。上层胶配方:30%丙烯酰胺6.67双蒸水8.101.5mtris8.85.020%sds0.110%aps0.1temed34μl总体积20ml下层胶配方:30%丙烯酰胺1.67双蒸水5.680.5mtris6.82.520%sds0.0510%aps0.1temed10μl总体积10ml上层下层同时配,依次加水,丙烯酰胺,1.5mtris,10%aps,20%sds,最后加temed。②加样③电泳:加样完毕后稳流电泳,一块胶电流用32ma,电压会慢慢上升至约99v时(约1h后)停止,也可根据待测蛋白分子量的大小自动调整跑胶时间。④转膜,转膜时为恒压100-120v(110v),具体步骤如下:pvdf膜在甲醇中活化后,放入水中洗涤,待沉下,再放入转移液。用转移槽,加入转移液,将夹板黑色放下面,依次放海绵,三层滤纸,胶,pvdf膜,三层滤纸和海绵。叠放整齐,用滚轴去除气泡,压紧后放入转膜槽中,膜切角标记。转膜时间根据蛋白分子量的大小决定,约为2h。⑤pvdf膜封闭:转膜结束用封闭液5%bsa封闭1h,以去除非特异性结合。⑥一抗孵育:将封闭液倒掉后加入anti-saa1antibodycloneb333a(dilutewith5%bsa,1:3000),4℃孵育过夜。⑦tbst洗3x10min。⑧二抗孵育:saa1二抗:anti-human1:5000,in5%bsa室温1h。⑨tbst洗3x10min。⑩显色液显色5min后,暗室压片。胶片用imagej软件进行统计分析,用saa1与tubulin(内参)的比值的变化来衡量saa1的变化情况。3.3elisa(1)蛋白提取:按照1:10的比例在尿液样本中加蛋白裂解液(tne:pmsf、naf、na3vo4、leupeptin1:100),在静音混悬器上翻转混匀2h,离心后取上清。(2)蛋白浓度测定(参考bca试剂盒说明书进行):①计算所需bca的量,按一定比例配好混合液(ma:mb:mc=25:24:1),每个加150ul,标准品a-i各加150ul,加样时做复孔。②因标准品是溶解在0.9%nacl中,故先将待测样品用0.9%nacl稀释后上样150ul,待测样品同样需要做复孔。③用酶标仪震荡5s,使样品混匀,然后放置于37℃培养箱中孵育2h。④从37℃培养箱中拿出,待冷却后用酶标仪测蛋白的吸光光度值,计算蛋白浓度。(3)加样:96孔板没空各加标准品或待测样品100ul,37℃孵育2h。(4)洗涤:用洗涤液洗4-6次。(5)抗原抗体反应:每孔加入抗体工作液100ul,37℃孵育1h。(6)充分洗涤后,加入酶标抗体100ul,37℃孵育30min。(7)洗掉多余抗体后,每孔中加入底物工作液100ul,37℃孵育15min。(8)终止反应,并在30min内用酶标仪测定吸光值。结果如下表所示:本发明的saa1用于hsp检测,具有非常好的灵敏度,且能很好地区分于ckd、itp及健康人群。最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1