基于钙-金属有机骨架材料作为荧光探针检测L-半胱氨酸的方法与流程
本发明属于金属有机骨架材料的制备合成和荧光传感领域,具体涉及一种基于低毒性金属有机骨架材料作为荧光探针采用荧光“关-开”模式高选择性检测l-半胱氨酸的方法。
背景技术:
l-半胱氨酸在人体中是一种不可或缺的氨基酸,作为一种重要生物活性的含巯基的化合物,在生物细胞功能中扮演着至关重要的角色。l-半胱氨酸有助于维持细胞内的氧化还原活性,蛋白质合成,解毒,新陈代谢,细胞内信号传导和基因调控等生理活动。它也是一种潜在的神经毒素或者是疾病诊断的生物标识物质,与人体机制的生理调节息息相关。而且在生物体内l-半胱氨酸的含量会直接影响生物体正常的生理活动,当人体内l-半胱氨酸含量的不足会诱发各种各样的疾病症状包括毛发色素减少,血色素减少,皮肤损伤,肝损伤,嗜睡,肌肉和脂肪的丧失。因此,对于生物体内l-半胱氨酸含量的测定变得至关重要,近些年来引发巨大关注。目前对于l-半胱氨酸的定量分析检测,常常利用一些传统的分析技术手段,如高效液相色谱法,毛细管电泳,电化学分析方法,质谱分析和比色法等等。然而,这些传统的分析技术手段存在检测过程复杂、检测时间长、抗干扰能力差、检测灵敏度低等缺点。因此,基于发展一种快捷简便、高效灵敏的分析方法应用于l-半胱氨酸的定量检测显得尤为重要。
近年来,金属有机骨架材料(mofs)因具有多样化的拓扑结构和特殊的功能性质在科学研究领域受到广泛的关注。它是以无机金属离子或金属团簇作为节点与多齿有机桥联配体为基本结构单元通过自组装形成一种新型的有机-无机杂化多孔配位聚合物材料,由于中心金属离子和有机桥联配体的功能性质的多样性造就了mofs展现出更加新颖的特意性质,例如具有巨大的比表面积、功能性孔道结构、可控的表面结构特性、良好的化学稳定性等诸多优良特性。更为重要的是可以根据需求来设计不同功能性的mofs结构,通过对金属离子和有机配体的目的性选择和mofs内外表面结构的特异性修饰,从而达到对mofs材料结构与性质的有效调控。由于mofs的多样复杂的结构和特异的功能性质,其在气体储存、吸附与分离、生物成像、多相催化、药物传输和化学传感等领域具有广泛的应用前景。基于mofs结构中有机配体上含有丰富的有机活性连接位点和金属离子中的空穴轨道,致使客体分子在mofs孔道内部或表面上可以进行特异性识别,造成对mofs材料荧光强度的影响,因而mofs材料可以作为荧光探针应用于光化学传感。与一些传统的发光材料量子点、上转换材料、金属纳米粒子和壳核复合材料相比,mofs材料的中心金属离子和有机桥联配体都能提供荧光发射位点,使得其在选择性检测无机阴阳离子、客体生物分子和硝基芳香化合物方面具有独特优势。但是,关于金属有机骨架材料作为荧光探针采用荧光“关-开”模式选择性检测生物体液中l-半胱氨酸含量的研究至今还没有相关报道。
技术实现要素:
本发明的目的在于提供了一种水溶性好、化学稳定性高、免特异性修饰、低毒性的金属有机骨架材料对生物分子l-半胱氨酸的检测方法。采用简便的“一锅法”溶剂热技术手段合成一种荧光性能好的低毒性金属有机骨架材料作为荧光探针设计一种荧光“关-开”模式实现对l-半胱氨酸快捷简便、高选择性,高灵敏度的检测。
本发明的技术目的通过以下技术方案实现:
一种基于钙-金属有机骨架材料作为荧光探针检测l-半胱氨酸的方法,其特征在于,按照如下步骤进行:
(1)标准储备溶液的配制:称取质量为0.0060g的金属有机骨架材料溶于60ml去离子水中摇匀使之完全溶解;称取质量为0.7780g三羟基氨基甲烷-盐酸(tris-hcl)溶于50ml的去离子水中摇匀使之完全溶解;称取0.0178g氯化铅分析试剂溶于8ml去离子水中摇匀使之完全溶解;称取0.0078gl-半胱氨酸溶于8ml去离子水中摇匀使之完全溶解;
(2)依次分别加入400µl金属有机骨架材料的悬浮溶液(100mgl-1),标准tris-hcl缓冲溶液(ph=7.2,0.1m)和100µl标准氯化铅溶液(1.6mm)用去离子水定容至4ml,混合均匀静置待氯化铅与金属有机骨架材料相互作用达到稳定状态,致使mofs材料产生荧光猝灭信号,检测体系处于荧光强度位于较低背景值的荧光关闭状态,利用荧光分光光度计记录荧光发射光谱;
(3)向步骤(2)的检测体系溶液中添加含有l-半胱氨酸的待测溶液,均匀混合静置使l-半胱氨酸与氯化铅相互作用稳定后,使检测体系处于较低背景值的荧光强度得到恢复,利用荧光分光光度计记录荧光发射光谱;通过两次记录的荧光发射光谱强度的变化值和拟合的线性方程指导得出待测溶液中l-半胱氨酸的浓度。
所述的拟合的线性方程为△i=14.199c+29.32,线性范围0.25-40µm,最低检出限91nm,r2值为0.98043。
本发明所述的检测l-半胱氨酸的方法,其特征在于金属有机骨架材料是一种基于(1,1':4',1"-三联苯-3,3",5,5"-四羧酸)-ca(no3)2的低毒性多孔配位聚合物材料,该材料晶体结构属于单斜晶系,c2/c空间群,其化学通式为:{[ca1.5(hl1)(dmf)2]·dmf},以ca2+作为中心金属离子,hl为(1,1':4',1"-三联苯-3,3",5,5"-四羧酸)做为有机桥联配体,其有机配体结构为:
本发明更加详细的描述如下:
本发明利用金属有机骨架材料作为荧光探针采用荧光“关-开”模式检测l-半胱氨酸的方法,其特征在于,按照如下步骤进行:
(1)标准溶液的配制
100mgl-1金属有机骨架材料溶液:称取0.0060g金属有机骨架材料溶于60ml去离子水中,利用超声波清洗器超声分散5min使之形成均匀的悬浮液。
0.1m的tris-hcl缓冲液:称取0.7880g三羟甲基氨基甲烷-盐酸溶于40ml去离子水中,随后不断滴加naoh溶液(0.5m)利用ph计调节至ph为7.4,最后用去离子水定容至50ml。
8mm氯化铅溶液:称取0.0178g氯化铅分析试剂溶于8ml去离子水中摇匀使之完全溶解。
8mml-半胱氨酸溶液:称取0.0078gl-半胱氨酸溶于8ml去离子水中,并以此为母液配制成一系列不同浓度的标准溶液。
(2)依次分别加入400µl金属有机骨架材料的悬浮溶液(100mgl-1),标准tris-hcl缓冲溶液(0.1m)和100µl标准氯化铅溶液(1.6mm)用去离子水定容至4ml,混合均匀静置待氯化铅与金属有机骨架材料相互作用达到稳定状态,致使mofs材料产生荧光猝灭信号,检测体系处于荧光强度位于较低背景值的荧光关闭状态,利用荧光分光光度计记录荧光发射光谱。
(3)向步骤1的检测溶液体系中添加一系列不同浓度的l-半胱氨酸标准溶液混合均匀静置,待l-半胱氨酸与氯化铅发生相互作用,使得被猝灭的荧光强度得到恢复并检测恢复的荧光发射光谱,通过发射光谱荧光强度的变化值和l-半胱氨酸的浓度可以拟合出线性关系方程。
(4)基于金属有机骨架材料对l-半胱氨酸的检测应用,其特征在于,反应体系中l-半胱氨酸的浓度与荧光发射强度的变化值呈现良好的线性关系,线性方程为△i=14.199c+29.32,线性范围0.25-40µm,最低检出限91nm,r2值为0.98043。
(5)在利用金属有机骨架材料应用于l-半胱氨酸的检测时,向步骤(2)的检测溶液体系中添加含有l-半胱氨酸待测溶液,均匀混合静置使l-半胱氨酸与氯化铅相互作用稳定后,使检测体系处于较低背景值的荧光强度得到恢复,利用荧光分光光度计记录荧光发射光谱。通过两次记录的荧光发射光谱强度的变化值和拟合的线性方程计算得出待测溶液中l-半胱氨酸的浓度。
本发明中金属有机骨架材料为基于(1,1':4',1"-三联苯-3,3",5,5"-四羧酸)-ca(no3)2的配合物,利用四水合硝酸钙无机盐作为无机节点,刚性对称的三联苯-四羧酸作为有机桥联配体,一锅法溶剂热技术合成了一种具有三维结构的多孔配位聚合物材料。其中有机配体的结构为:
本发明中的金属有机骨架材料的晶体结构属于单斜晶系,c2/c空间群。采用石墨单色器的mo-kα辐射(λ=0.71073å)作为衍射光源,用
表1金属有机骨架材料的晶体学数据表
本发明中配合物的晶体属于单斜晶系,c2/c空间群,配合物的基本结构单元包含了1.5caii中心离子(ca2和0.5ca1),一个去质子化的hl13-,两个配位dmf分子和一个自由晶格dmf分子。ca1与hl13-的6个o原子(o1、o1a、o5a、o5b、o8a、o8b)进行配位,ca2与hl13-的5个羧基氧原子(o2、o5a、o6a、o7a和o8a)和末端配位的两个dmf分子的氧原子(o9和o10)相配位。其中ca1、ca2和ca2a通过羧酸原子相连接形成三核的ca3o4簇作为二级构件(sbus)。每个hl13-配体以多齿桥接模式使三个羧酸基团连接三个邻近三核caii二级构件,最终构建成具有二维结构的多孔配位框架1。金属有机骨架材料1的部分键长和键角数据,如下表所示:
表2金属有机骨架材料的部分键长和键角数据表
本发明公开的基于钙-金属有机骨架材料作为荧光探针检测l-半胱氨酸的方法所具有的积极效果在于:
(1)本发明公开了基于“一锅法”溶剂热技术合成一种新型水溶性好、荧光性能好、化学稳定性高、毒性低的金属有机骨架材料,具有很好的生物相容性,并且不需要复杂的特异性修饰和功能化,可作为荧光探针应用于生物体内l-半胱氨酸含量的检测。
(2)本发明所使用的荧光探针材料mofs是一种新型的低毒性多孔配位聚合物材料具有良好的生物相容性,使其在生物检测领域得到很好的应用。金属有机骨架材料的良好水溶性,解决了目前大多数文献报道中利用mofs作为探针材料在有机溶剂体系中进行检测的难题,使得其应用范围更为广泛。
(3)本发明基于金属有机骨架材料设计一种荧光“关-开”模式体系应用于l-半胱氨酸的检测,具有选择性好、灵敏度高、抗干扰能力强等优点。使用本方法能够实现简便快捷、高效灵敏地检测,检测线性范围是0.25-40µm,检出限为91nm。
(4)利用本方法可有效的避免传统检测方法带来的检测时间长、检测过程复杂、高消耗、抗干扰能力差、灵敏度低、检出限较低等缺点困扰。将本发明与先前检测方法如比色法、色谱法、电化学法方法进行对比,优势明显如下表所示:
表3对于l-半胱氨酸检测的方法比较
附图说明
图1是本发明中使用金属有机骨架材料的化学式结构示意图;
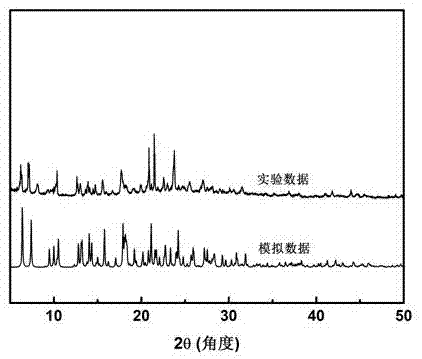
图2是本发明中使用金属有机骨架材料的粉末衍射xrd谱图;
图3是本发明中使用金属有机骨架材料的紫外吸收光谱图和荧光发射光谱图;
图4是不同浓度金属有机骨架配合物材料的荧光强度和分别添加相同浓度氯化铅的猝灭效率曲线图;
图5是氯化铅对金属有机骨架配合物材料的荧光猝灭时间效果图;
图6是l-半胱氨酸对金属有机骨架材料和氯化铅溶液组成的混合体系的荧光恢复时间效果图;
图7是不同浓度的氯化铅对金属有机骨架配合物材料的荧光恢复关系图;
图8是不同ph值对金属有机骨架配合物材料的荧光猝灭及荧光恢复曲线图;
图9是本发明中使用金属有机骨架配合物材料和氯化铅混合溶液体系检测l-半胱氨酸的荧光光谱图;
图10是本发明中使用金属有机骨架配合物材料和氯化铅混合溶液体系检测l-半胱氨酸的线性拟合图;
图11是本发明中金属有机骨架材料应用于l-半胱氨酸检测的选择性识别柱状图。
具体实施方式
下面通过具体的实施方案和附图说明来详细描述本发明。除非特别说明,本发明中所用的技术手段均为本领域技术人员所公知的方法。另外,实施方案应理解为说明性的,而非限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改变或改动也属于本发明的保护范围。
下述实施例中所使用的试剂ca(no3)2·4h2o、dmf、硝酸、乙醚、乙醇、氯化铅均为分析纯,购自百灵威试剂公司。(1,1':4',1"-三联苯-3,3",5,5"-四羧酸)有机配体购自于北京华盛锐科化工有限公司。所需的氨基酸均购于天津市光复精细化工研究所,均为br生化试剂,纯度为99%。
实施例1
金属有机骨架配合物材料的制备合成与结构表征
(1)称取141.6mgca(no3)2·4h2o和42.1mg(1,1':4',1"-三联苯-3,3",5,5"-四羧酸)有机配体试剂均匀地分散在2ml去离子水和6mldmf中搅拌0.5-1h,然后加入3-7μl(0.33m)的hno3溶液。然后将混合溶液转移至具有聚四氟乙烯内胆的不锈钢高压反应釜中,在120-140℃的温度条件下加热96-100h。最后经过48-50h冷却至室温,将得到的产物用水和乙醚洗涤数次后可以得到无色块状晶体。
(2)制备的金属有机骨架材料晶体,基于h4l1.的产率37%。c31h32ca1.5n3o11的元素分析理论值(%):c54.54,h4.73,n6.15;元素分析实验值(%):c54.79,h4.96,n6.15;表明配合物中元素组成基本与理论值一致。
(3)金属有机骨架材料的结构表征
晶体结构测定使用brukersmart1000ccd型x-射线单晶衍射仪,采用石墨单色器的mo-kα辐射λ=0.71073å)作为衍射光源,用
表1金属有机骨架材料的晶体学数据表
(4)金属有机骨架材料1的晶体结构描述
本发明中配合物的晶体属于单斜晶系,c2/c空间群,配合物的基本结构单元包含了1.5caii中心离子(ca2和0.5ca1),一个去质子化的hl13-,两个配位dmf分子和一个自由晶格dmf分子。ca1与hl13-的6个o原子(o1、o1a、o5a、o5b、o8a、o8b)进行配位,ca2与hl13-的5个羧基氧原子(o2、o5a、o6a、o7a和o8a)和末端配位的两个dmf分子的氧原子(o9和o10)相配位。其中ca1、ca2和ca2a通过羧酸原子相连接形成三核的ca3o4簇作为二级构件(sbus)。每个hl13-配体以多齿桥接模式使三个羧酸基团连接三个邻近三核caii二级构件,最终构建了二维结构的纳米多孔配位框架1,如图2所示。金属有机骨架材料1的部分键长和键角数据,如下表所示:
表2金属有机骨架材料的部分键长和键角数据表
实施例2
配制一系列标准储备溶液,以待后续实验测试
(1)100mgl-1浓度的金属有机骨架材料悬浮液配制:称取质量为0.0060g金属有机骨架材料溶于60ml去离子水中,利用超声波清洗器超声分散5min使之形成均匀的悬浮液,放置阴暗处待用。
(2)0.1m的tris-hcl缓冲液的配制:称取质量为0.7880g三羟甲基氨基甲烷-盐酸溶于40ml去离子水摇匀使之完全溶解,随后不断滴加naoh溶液(0.5m),利用ph计调节ph为7.2,最后用去离子水定容至50ml,放于冰箱中待用。
(3)8mm氯化铅溶液配制:准确称取0.0178g氯化铅分析试剂溶于8ml去离子水中摇匀使之完全溶解,以此为高标溶液配制成一系列不同浓度的标准溶液,放于冰箱中待用。
(4)8mml-半胱氨酸溶液配制:准确称取0.0078gl-半胱氨酸溶于8ml去离子水中摇匀使之完全溶解,以此为高标溶液配制成一系列不同浓度的标准溶液,放于冰箱中待用。
实施例3
本发明中使用的金属有机骨架材料的紫外吸收光谱和荧光发射光谱的测定
依次分别加入400μl金属有机骨架材料的悬浮液(100mgl-1),400μl的tris-hcl缓冲溶液(ph=7.2,0.1m)用去离子水定容至4ml,最终体系溶液中金属有机骨架材料的浓度为10mgl-1。利用紫外-可见分光光度计检测体系溶液的吸光度;利用荧光分光光度计在激发波长为282nm,激发狭缝5nm,发射狭缝5nm,光电倍增管电压560v的条件下测定体系溶液的荧光发射谱图。如图3所示,1为紫外光吸收光谱图,2为荧光发射光谱图。从图3中可看出金属有机骨架材料在282nm处有较强的紫外吸收,故使用282nm作为激发波长。当利用282nm的激发波长作用于体系溶液时,在372nm处有很强的荧光发射峰。
实施例4
基于金属有机骨架材料荧光测试以确定最优测试浓度
(1)依次分别加入200µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m)用去离子水定容至4ml,将其混合均匀静置反应40min后,利用荧光分光光度计测定反应体系的荧光发射光谱。依次分别加入200µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m),100µl的氯化铅溶液(1.6mm)用去离子水定容至4ml,混合均匀静置反应40min后,利用荧光分光光度计测定反应体系的荧光发射光谱。
(2)依次分别加入400µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m)用去离子水定容至4ml,混合均匀静置反应40min后,利用荧光分光光度计测定反应体系的荧光发射光谱。依次分别加入400µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m),100µl的氯化铅溶液(1.6mm)用去离子水定容至4ml,混合均匀静置反应40min后,利用荧光分光光度计测定反应体系的荧光发射光谱。
(3)依次分别加入800µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m)用去离子水定容至4ml,混合均匀静置反应40min后,利用荧光分光光度计测定反应体系的荧光发射光谱。依次分别加入800µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m),100µl的氯化铅溶液(1.6mm)用去离子水定容至4ml,混合均匀静置反应40min后,利用荧光分光光度计测定反应体系的荧光发射光谱。
(4)依次分别加入1200µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m)用去离子水定容至4ml,混合均匀静置反应40min后,利用荧光分光光度计测定反应体系的荧光发射光谱。依次分别加入1200µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m),100µl的氯化铅溶液(1.6mm)用去离子水定容至4ml,混合均匀静置反应40min后,利用荧光分光光度计测定反应体系的荧光发射光谱。
利用上述方法来测定不同浓度下金属有机骨架材料的荧光发射光谱(不加入氯化铅溶液)和不同浓度的金属有机骨架材料溶液中加入等量的氯化铅溶液之后的荧光发射光谱,可得到金属有机骨架材料的空白荧光强度和荧光猝灭强度的曲线图。如图4所示,可以看出随着配合物浓度的增加其荧光强度也随着增加到达一定程度荧光强度增加趋于缓慢,在不同浓度配合物溶液中存在等浓度的氯化铅条件下,荧光猝灭效率随着原材料浓度增加而逐渐降低。最终选择两条曲线交点对应的原材料浓度为最优测试浓度(根据实际情况也可选择交点对应浓度的周围浓度作为测试浓度),在本申请中选择浓度为5-15mgl-1,优选8-11mgl-1。
实施例5
确定体系氯化铅对金属有机骨架材料的最佳猝灭时间
依次分别加入400µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m),100µl的氯化铅溶液(1.6mm)用去离子水定容至4ml,混合均匀静置0-90min的不同时间内,利用荧光分光光度计测定反应体系的荧光发射光谱。如附图5所示,可看出当加入氯化铅溶液之后随着时间的推移,混合体系溶液的荧光强度在短时间内迅速降低,随后在一定时间范围内趋于缓慢降低,并且在40min左右荧光强度保持平稳状态(即体系淬灭时间为30-50min,最佳猝灭时间为40-45min)。最终在荧光测试中选择加入氯化铅溶液40min后检测体系的荧光强度,并在此时加入目标物l-半胱氨酸溶液。
实施例6
确定l-半胱氨酸加入金属有机骨架配合物材料和氯化铅混合溶液体系后的荧光恢复时间
依次分别加入400µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m),100µl的氯化铅溶液(1.6mm)用去离子水定容至4ml,混合均匀静置待溶液体系猝灭时间达到40min后,添加l-半胱氨酸溶液(1.2mm)混合均匀静置0-60min的不同时间内,利用荧光分光光度计测量反应体系的荧光发射光谱。如附图6所示,可看出当加入l-半胱氨酸溶液后随着时间的推移,体系溶液的荧光强度在短时间内增强,并且在30min左右荧光强度基本保持不变(即体系的荧光恢复时间为20-40min,优选为25-30min)。最终选择当l-半胱氨酸溶液加入金属有机骨架材料和氯化铅混合溶液体系中30min后进行荧光测试。
实施例7
确定猝灭剂氯化铅用量
依次分别加入400µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m),一系列不同浓度(15-80µm)的氯化铅溶液用去离子水定容至4ml,混合均匀静置待体系溶液反应时间到达40min后,利用荧光分光光度计测定在金属有机骨架材料溶液中存在不同浓度的氯化铅下混合溶液体系发射光谱的荧光强度,即为体系荧光猝灭的背景光谱图。
依次分别加入400µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m),一系列不同浓度(15-80µm)的氯化铅溶液,混合均匀静置待体系溶液反应时间达到40min后,添加l-半胱氨酸溶液(1.2mm)用去离子水定容至4ml。待体系溶液反应30min后,利用荧光分光光度计测定l-半胱氨酸溶液加入至混合体系溶液后的发射光谱,即为体系荧光恢复的恢复发射谱图。
根据上述两项测试结果可得出同一浓度的l-半胱氨酸对存在不同浓度氯化铅的金属有机骨架材料混合体系溶液的荧光恢复强度。当氯化铅浓度为40-50µm时,向混合溶液体系中添加30µm的l-半胱氨酸溶液的荧光恢复强度较大。当加入的氯化铅浓度高于40µm时,l-半胱氨酸对体系的荧光恢复强度较小且会由于猝灭剂浓度过高导致灵敏度降低。当加入的氯化铅浓度低于40µm时,l-半胱氨酸对体系的荧光恢复强度较小且体系有较高的荧光背景值,会检测体系产生较大的干扰。最终在荧光检测体系中,选用浓度为35µm浓度的氯化铅进行后续实验。
实施例8
确定整个反应体系的最佳ph
依次分别加入400µl金属有机骨架材料的悬浮液(100mgl-1),400µl一系列不同ph范围(5.0-8.0)的tris-hcl缓冲溶液(0.1m)用去离子水定容至4ml,混合均匀静置待体系溶液反应40min后,利用荧光分光光度计测定不同ph下体系溶液的荧光发射光谱,即为溶液体系的空白的发射光谱背景图。
依次分别加入400µl金属有机骨架材料的悬浮液(100mgl-1),400µl一系列不同ph范围(5.0-8.0)的tris-hcl缓冲溶液(0.1m),100µl的氯化铅溶液(1.6mm)用去离子水定容至4ml,混合均匀静置待体系溶液反应40min后,利用荧光分光光度计测定不同ph下体系溶液的荧光猝灭的发射光谱图,即为混合溶液体系的荧光猝灭背景图。
依次分别加入400µl金属有机骨架材料悬浮液(100mgl-1),400µl一系列不同ph范围(5.0-8.0)的tris-hcl缓冲溶液(0.1m),100µl的氯化铅溶液(1.6mm),待体系溶液反应40min后,添加l-半胱氨酸溶液(1.2mm)用去离子水定容至4ml,待溶液体系反应30min后,利用荧光分光光度计测定不同ph下体系溶液的荧光恢复发射光谱图。
根据上述三项测试结果可得到在一系列不同ph下的金属有机骨架材料的荧光猝灭效率和荧光恢复强度的曲线图,如图8所示。当tris-hcl缓冲溶液(0.1m)的ph在7.0-7.6(优选7.2-7.4之间)时,向混合体系溶液中添加l-半胱氨酸的荧光恢复强度最大。当ph高于7.2时,随着ph增加l-半胱氨酸对体系的荧光恢复强度和体系溶液的荧光猝灭效率都逐渐降低,导致体系有较高的荧光背景值,对于体系检测会产生较大干扰。当ph低于7.2时,随着ph的递减l-半胱氨酸对体系的荧光恢复强度而逐渐减小,体系的荧光猝灭效率逐渐增加最终趋于平稳状态。在荧光检测中,ph值较小时由于较高的荧光猝灭效率会降低检测体系的灵敏度,综合考虑到不同ph对体系的荧光恢复强度和荧光猝灭效率的影响,最终选择ph=7.2作为检测体系的最优测试条件。
实施例9
利用金属有机骨架材料与氯化铅的混合体系检测l-半胱氨酸
(1)依次分别加入400µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m),100µl的氯化铅溶液(1.6mm)用去离子水定容至4ml,混合均匀静置待达到最佳猝灭时间40min后,利用荧光分光光度计测定反应体系的荧光发射光谱,此发射光谱作为荧光猝灭的背景光谱图。
(2)依次分别加入400µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m),100µl的氯化铅溶液(1.6mm),混合均匀静置待达到最佳猝灭时间40min后,加入一系列不同浓度(0.25-40µm)的l-半胱氨酸溶液,将体系溶液用去离子水定容至4ml。待混合体系溶液反应30min稳定后,利用荧光分光光度计测定反应体系的荧光发射光谱,此荧光发射光谱的荧光强度与荧光猝灭的背景光谱图的荧光强度差值作为发射光谱的荧光恢复强度,将荧光发射光谱的荧光恢复强度和加入l-半胱氨酸溶液的浓度进行线性拟合。如附图9和10所示,随着l-半胱氨酸浓度的增加,反应体系的荧光强度恢复值逐渐增大,在l-半胱氨酸浓度为0.25-40µm范围内,反应体系中l-半胱氨酸的浓度与荧光恢复强度呈良好的线性关系,线性方程为△i=14.199c+29.32。上述
方法的分析特征量如下表所示,说明了本方法有较宽的线性范围和较低的检出限。
表4本方法的分析特征量
实施例10
基于金属有机骨架材料作为荧光探针对l-半胱氨酸的选择性检测
(1)依次分别加入400µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m),100µl的氯化铅溶液(1.6mm)用去离子水定容至4ml,混合均匀静置待达到最佳猝灭时间40min后,利用荧光分光光度计测定反应体系的荧光发射光谱,此发射光谱作为荧光猝灭的背景光谱图。
(2)依次分别加入400µl金属有机骨架材料的悬浮液(100mgl-1),400µl的tris-hcl缓冲溶液(ph=7.2,0.1m),100µl的氯化铅溶液(1.6mm),混合均匀静置待达到最佳猝灭时间40min后,分别加入100µl一系列浓度相等的l-半胱氨酸、谷胱甘肽、谷氨酸、甘氨酸、多巴胺、精氨酸、组氨酸、亮氨酸、赖氨酸、苏氨酸、缬氨酸、蛋氨酸的标准溶液(0.8mm),将体系溶液用去离子水定容至4ml。混合均匀静置待混合体系溶液反应30min达到稳定状态后,利用荧光分光光度计测定反应体系的荧光发射光谱,此荧光发射光谱的荧光强度与荧光猝灭的背景光谱图的荧光强度比值作为选择性参考标准。将所得数据结果绘制成柱状图,如附图11所示,考察了不同生物小分子对荧光探针荧光强度的影响。
结果显示,只有在混合体系溶液中添加l-半胱氨酸后才会导致体系的荧光强度发生明显增强,而其他生物小分子几乎没有明显的响应,表明此分析方法具有良好的选择性,该荧光探针检测体系对l-半胱氨酸能够进行特异性识别。
- 还没有人留言评论。精彩留言会获得点赞!