一种心肌肌钙蛋白I的荧光和比色双信号检测试剂盒及检测方法与流程
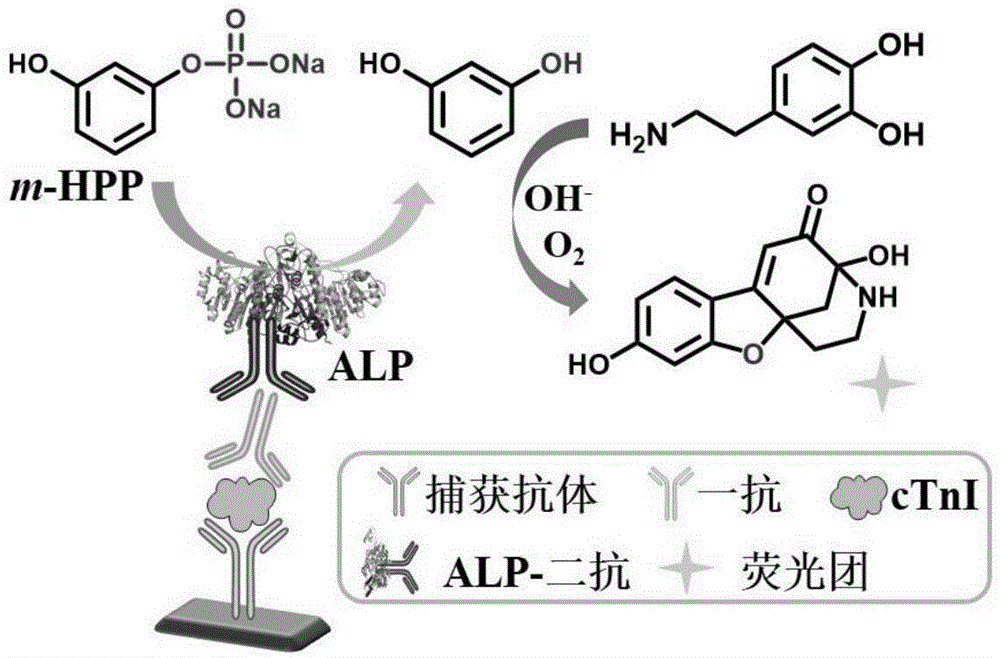
本发明属于免疫分析领域,具体涉及一种心肌肌钙蛋白i的荧光和比色双信号检测试剂盒及检测方法。
背景技术:
酶联免疫吸附分析(elisa)基于抗原抗体特异性识别作用,并以酶作为信号输出单元而实现抗原高灵敏检测的技术,是生物样品分析中的一个重要的免疫方法。酶广泛地作为免疫分析中的标记物,基于酶高效的生物催化活性,一个酶分子可以在短时间内将大量的酶底物转化成产物,从而发挥信号放大的作用,这为分析物的灵敏检测奠定基础。碱性磷酸酶(alp)是一种磷酸水解酶,该酶广泛分布于人体组织和体液。在碱性环境中,alp能水解磷酸单酯化合物,切断底物分子中的磷酸酯键,从而脱掉底物中的磷酸基团。该酶的用途广泛,它可以作为某些疾病的标志物,包括骨病,糖尿病,乳腺癌和前列腺癌和肝炎。此外,alp由于其较高的催化活性、较好的稳定性、易于和抗体偶联等特点,也经常作为elisa的信号输出酶。
生物标志物可客观测定和评价普通生理、病理或治疗过程中的某种特征性,指示不同的疾病导致的致病过程,生物标志物的监测是基础和临床研究中的重要手段。检查一种疾病特异性的生物标志物,对于疾病的鉴定、早期诊断及预防、治疗过程中的监控可能起到重要作用。心肌肌钙蛋白i(ctni)是心肌梗死患者血清中的一个重要标志物,正常成年人血清中ctni浓度通常低于0.2ng/ml,而心肌梗死爆发后,患者血清中ctni含量在3-6小时内上升至50ng/ml,最后升至550ng/ml左右。因此,ctni的准确定量对心肌梗死疾病的诊断和监控具有重大意义。
技术实现要素:
本发明的目的是为了提供一种心肌肌钙蛋白i荧光和比色双信号检测试剂盒及检测方法,该检测方法准确方便,具有普适性。
为了实现上述目的,本发明的技术方案具体如下:
本发明首先提供一种心肌肌钙蛋白i的荧光和比色双信号检测试剂盒,包括:
心肌肌钙蛋白i(ctni)、ctni捕获抗体、ctni检测一抗、碱性磷酸酶标记的二抗、包被缓冲液、洗涤液、抗体稀释液、样品稀释液、间羟基苯磷酸二钠盐(m-hpp)、多巴胺、封闭液、二乙醇胺(dea)缓冲液和mgcl2溶液。
在上述技术方案中,所述的包被缓冲液是ph=8.0~9.6的10~100mm碳酸盐溶液。
在上述技术方案中,所述的洗涤液是ph=7.4的含有0.01~0.5%tween-20和10~100mm磷酸根/磷酸氢根/磷酸二氢根的混合溶液。
在上述技术方案中,所述的抗体稀释液是ph=7.4的含有0.01~0.2%tween-20和0.1-2%牛血清蛋白的缓冲溶液;所述的样品稀释液是含有0.1-2%牛血清蛋白的缓冲溶液。
在上述技术方案中,所述的封闭液是用抗体稀释液溶解的牛血清蛋白浓度为0.1~5%的溶液。
在上述技术方案中,所述的间羟基苯磷酸二钠盐(m-hpp)的浓度为50~500μm,多巴胺的浓度为20~200μm。
在上述技术方案中,所述的dea缓冲液是浓度为10~200mm、ph9.5~12.0的溶液,所述的mgcl2溶液的浓度是0.25~5mm。
本发明还提供一种心肌肌钙蛋白i的检测方法,包括以下步骤:
步骤一:将ctni捕获抗体用包被缓冲液稀释后加入酶标板后进行孵育,然后弃去孔内液体并用洗涤液清洗,再向孔内加入封闭液,孵育后弃去孔内液体,再用洗涤液清洗,之后加入用样品稀释液稀释的不同浓度的的ctni标准溶液并进行孵育,接着弃去孔内液体后用洗涤液清洗,加入用抗体稀释液稀释后的ctni检测一抗接着进行孵育后,弃去孔内液体后并用洗涤液清洗,加入用抗体稀释液稀释后的碱性磷酸酶标记的二抗,孵育后弃去孔内液体后并用洗涤液清洗;
步骤二:在孔内加入m-hpp溶液,mgcl2溶液,dea缓冲溶液,孵育后再加入多巴胺溶液,孵育后进行荧光和紫外光谱测试。
在上述技术方案中,所述心肌肌钙蛋白i的检测方法具体包括以下步骤:
步骤一:将ctni捕获抗体用包被缓冲液稀释200倍,取100μl加入酶标板后在4℃孵育过夜或者室温孵育2.5h,弃去孔内液体并用300μl洗涤液洗3次,在孔内加入200μl封闭液,37℃孵育1h后弃去孔内液体,再用300μl洗涤液洗3次,之后加入不同浓度的用样品稀释液稀释后的ctni标准溶液并在37℃孵育1h,弃去孔内液体后用300μl洗涤液洗3次,加入100μl用抗体稀释液稀释后的ctni检测一抗,37℃孵育1h后弃去孔内液体后并用洗涤液洗涤3次,加入100μl用抗体稀释液稀释后的碱性磷酸酶标记的二抗,37℃孵育1h后弃去孔内液体后并用洗涤液洗涤3次;
步骤二:在孔内加入30μl1mmm-hpp溶液,30μlmgcl2溶液,150μldea缓冲溶液,37℃孵育60min后再加入30μl0.5mm多巴胺溶液,37℃孵育20min后进行荧光(激发波长415nm)和紫外光谱测试。
在上述技术方案中,步骤一中的ctni捕获抗体的浓度为1~50μg/ml,ctni检测一抗的浓度为0.5~20μg/ml,碱性磷酸酶标记的二抗的浓度为0.01~1μg/ml。
本发明的有益效果
本发明提供一种心肌肌钙蛋白i的荧光和比色双信号检测试剂盒,该试剂盒是基于碱性磷酸酶引发的原位荧光和显色反应检测心肌梗死标志物ctni,其原理是基于抗原抗体特异性作用和酶的信号放大效应,通过在酶标板上依次吸附捕获抗体、ctni和ctni检测一抗来形成类似三明治的结构,后续加入的碱性磷酸酶标记的二抗特异性地与ctni检测一抗结合,最后加入底物m-hpp,在碱性磷酸酶的脱磷酸作用下,m-hpp被脱磷酸化生成间苯二酚阴离子,与后续加入的多巴胺发生反应生成具有强紫外吸收和荧光发射的基团,体系的吸光度和荧光强度与碱性磷酸酶的浓度成正相关,而ctni浓度与碱性磷酸酶浓度正相关,进而实现对ctni的定量检测。碱性磷酸酶作为连接ctni浓度和光谱信号的桥梁,利用碱性磷酸酶引发的反应作为输出信号,将该试剂盒用于血清基质中ctni含量的检测,结果表明该试剂盒的检测结果正好与基于pnpp的比色elisa方法相符,该试剂盒可通过荧光激活和显色反应而检测ctni。同时,该方法具有普适性,只需根据不同的靶标抗原更换相应的捕获抗体和检测一抗,就可将其应用拓展到其他癌症标志物的检测。
本发明提供的ctni检测方法,该方法是以碱性磷酸酶作为elisa信号输出酶来提供一种荧光的信号输出模式,碱性磷酸酶具有的脱磷酸作用将m-hpp转变成间苯二酚,然后加入多巴胺溶液,间苯二酚和多巴胺能发生反应产生具有强吸收和荧光发射的基团,最终通过荧光和显色反应来检测肿瘤标志物ctni。
附图说明
图1为本发明实施例1基于碱性磷酸酶引发的原位荧光和显色反应检测心肌梗死标志物ctni的酶联免疫方法示意图。
图2为本发明实施例1-2中的elisa的荧光强度和紫外吸收强度和ctni浓度的曲线关系图。
具体实施方式
下面结合附图对本发明做以详细说明。
本发明提供一种心肌肌钙蛋白i荧光检测试剂盒,包括:
心肌肌钙蛋白i(ctni)、ctni捕获抗体、ctni检测一抗、碱性磷酸酶标记的二抗、包被缓冲液、洗涤液、抗体稀释液、样品稀释液、间羟基苯磷酸二钠盐(m-hpp)、多巴胺、封闭液、碳酸钠溶液、二乙醇胺(dea)缓冲液和mgcl2溶液。
本发明所述的ctni捕获抗体、ctni检测一抗、碱性磷酸酶标记的二抗的来源为商购,所述的ctni捕获抗体优选为ctni的鼠单抗,ctni检测一抗优选为ctni的兔多抗,碱性磷酸酶标记的二抗优选为碱性磷酸酶标记的羊抗兔igg。
按照本发明,所述的包被缓冲液优选是ph=8.0~9.6的10~100mm碳酸盐溶液;所述的洗涤液优选是ph=7.4的含有0.01~0.5%tween-20和10~100mm磷酸根/磷酸氢根/磷酸二氢根的混合溶液;所述的抗体稀释液优选是ph=7.4的含有0.05~0.2%tween-20和0.1-2%牛血清蛋白的缓冲溶液;所述的样品稀释液优选是含有0.1-2%牛血清蛋白的缓冲溶液;所述的封闭液优选是用抗体稀释液溶解的牛血清蛋白浓度为0.1~5%的溶液;所述的dea缓冲液优选是浓度为10~200mm、ph9.5~12.0的溶液,所述的mgcl2溶液的浓度优选为0.25~5mm。
本发明还提供一种心肌肌钙蛋白i的检测方法,具体包括以下步骤:
步骤一:将ctni捕获抗体用包被缓冲液稀释200倍,取100μl加入酶标板后在4℃孵育过夜或者室温孵育2.5h,弃去孔内液体并用300μl洗涤液洗3次,在孔内加入200μl封闭液,37℃孵育1h后弃去孔内液体,再用300μl洗涤液洗3次,之后加入不同浓度的用样品稀释液稀释后的ctni标准溶液并在37℃孵育1h,弃去孔内液体后用300μl洗涤液洗3次,加入100μl用抗体稀释液稀释后的ctni检测一抗,37℃孵育1h后弃去孔内液体后并用洗涤液洗涤3次,加入100μl用抗体稀释液稀释后的碱性磷酸酶标记的二抗,37℃孵育1h后弃去孔内液体后并用洗涤液洗涤3次;
步骤二:在孔内加入30μl1mmm-hpp溶液,30μlmgcl2溶液,150μldea缓冲溶液,37℃孵育60min后依次加入30μl0.5mm多巴胺溶液,37℃孵育20min后进行荧光和紫外光谱测试。
按照本发明,所述的步骤一中的ctni捕获抗体的浓度优选为1~50μg/ml,ctni检测一抗的浓度优选为0.5~20μg/ml,碱性磷酸酶标记的二抗的浓度优选为0.01~1μg/ml。
上述检测方法中:所述的包被缓冲液优选是ph=8.0~9.6的10~100mm碳酸盐溶液;所述的洗涤液优选是ph=7.4的含有0.01~0.5%tween-20和10~100mm磷酸根/磷酸氢根/磷酸二氢根的混合溶液;所述的抗体稀释液优选是ph=7.4的含有0.01~0.2%tween-20和0.1-2%牛血清蛋白的缓冲溶液;所述的样品稀释液是优选含有0.1-1%牛血清蛋白的缓冲溶液;所述的封闭液优选是用抗体稀释液溶解的牛血清蛋白浓度为0.1~5%的溶液;所述的dea缓冲液是优选浓度为10~200mm、ph10.5的溶液;所述的mgcl2溶液的浓度优选为0.25~5mm;所述的间羟基苯磷酸二钠盐(m-hpp)浓度优选为50~500μm,多巴胺浓度优选为20~200μm。
下面的实施案例中将对本发明作进一步的阐述,但本发明不限于此。需要说明的是,实施例中涉及到的原料均为商购获得。
实施例1
夹心式elisa操作步骤:
首先,选用鼠单抗作为ctni的捕获抗体,用ph=9.0的50mm碳酸盐溶液稀释至5μg/ml后,取100μl加入酶标板后在4℃静置包被过夜。弃去孔内液体并用300μl洗涤液(ph=7.4的含有0.05tween-20和20mm磷酸根/磷酸氢根/磷酸二氢根的混合溶液)清洗三次并拍干,在孔内加入200μl1%牛血清蛋白溶液,37℃封闭1h后弃去孔内液体,再用300μl洗涤液洗涤,之后加入用ph=7.4的含有0.1%牛血清蛋白的磷酸盐缓冲溶液稀释后的100μl不同浓度ctni标准溶液(0,0.125,0.25,0.5,1.0,2.0,4.0,8.0ng/ml)并在37℃孵育1h,弃去孔内液体后用300μl洗涤液清洗酶标板。加入100μl用ph=7.4的含有0.1%tween-20和0.5%牛血清蛋白的磷酸盐缓冲溶液稀释后的兔多抗(抗ctni,1μg/ml),37℃孵育1h后弃去孔内液体后并用洗涤液清洗。加入用ph=7.4的含有0.1%tween-20和0.5%牛血清蛋白的磷酸盐缓冲溶液稀释后的100μl碱性磷酸酶标记的羊抗兔二抗(200ng/ml),37℃孵育1h后弃去孔内液体后并用洗涤液清洗。此夹心式elisa方法的模型示意图如图1所示。
实施例2
碱性磷酸酶引发的原位荧光和显色反应
在实施例1中得到的酶标板孔内加入30μl1mmm-hpp溶液,30μl0.25mmmgcl2溶液,150μl20mmdea缓冲溶液(ph=10.5),37℃孵育60min后依次加入30μl0.5mm多巴胺溶液,37℃孵育20min后进行荧光和紫外光谱测试。
图2为本发明实施例1,2中的夹心式elisa体系的荧光发射和紫外吸收信号随ctni浓度变化的曲线关系图,其中图2(a)(c)分别为该elisa体系的荧光发射光谱(激发波长为415nm)和紫外吸收光谱随ctni浓度增加的变化曲线图;图2(b)(d)分别为460nm处的荧光发射强度(i460)和420nm处的吸光度(a420)随ctni浓度的线性响应关系。图2的实验结果说明,随着ctni浓度的升高(0~8.0ng/ml),体系荧光强度i460和吸光度a420与ctni浓度在0.125-8.0ng/ml之间呈现较好的线性关系,拟合的线性方程分别为i460=201.0+28.2cctni(ng/ml),r2=0.951;a420=0.01+0.0015cctni,r2=0.978。该方法能特异性检出0.03ng/ml的ctni,能够满足测试血清中ctni含量的需求。
实施例3
血清基质中ctni含量检测:
正常人的临床血清样本由吉林大学第二医院提供,血清的夹心式elisa方法与实施例1,2中的ctni测定方法基本相同,不同之处在于用添加了ctni的稀释临床血清样品代替实施例1的ctni标准溶液。同时以商品化的ctnielisa检测试剂盒(tmb-hrp)的方法作为对照。
如表1所示,血清中ctni含量的检测结果表明,本发明试剂盒的检测结果和商品化的ctnielisa试剂盒的检测结果相当,表明本发明的试剂盒检测结果可靠。
表1.血清中的ctni检测结果(mean±sd;n=3).
表1中a比色模式检测结果,b荧光模式检测结果,c商品化的tmb-hrpelisa检测结果(ng/ml)。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!