一种诱导海洋放线菌沉默基因表达产生新物质的方法与流程
本发明属于基因诱导技术领域,尤其涉及一种诱导海洋放线菌沉默基因表达产生新物质的方法。
背景技术:
目前,业内常用的现有技术是这样的:微生物产生的活性物质中超过50%来自于放线菌,由于放线菌在产生新型活性代谢产物方面的能力非常突出,在过去的50年里科学家们一直致力于从陆栖微生物源中分离新型放线菌。然而,近年来从陆栖放线菌中分离得到的新型化合物的数量在持续减少,因此人们需要从未开发的放线菌栖息地中寻找新型的放线菌,作为开发新型活性次级代谢产物的来源。由于海洋环境的特殊性,海洋放线菌在生理生化特性和遗传背景特性上与陆生放线菌存在差异,使得海洋放线菌能够产生结构新颖的活性代谢产物。海洋放线菌分布于不同的海洋环境和栖息地,已有大量研究证明可以在海洋的任何地方找到新颖的放线菌,包括从深海海底到珊瑚礁、从海底沉积物到海洋无脊椎动物和植物、从海洋的表面到海底深渊都可发现海洋放线菌的踪迹。
近年来,专性海洋放线菌salinispora属菌株被报道能产生多种结构多样的次级代谢物,该属放线菌被证明是新化学结构物质丰富的来源,包括潜在的蛋白酶抑制剂salinosporamidea,新萜类化合物,氨基酸衍生物,以及多烯大环内酯类。
海洋放线菌在水产养殖中具有重要的应用价值,已有研究海洋放线菌应用于水产养殖致病菌引起病害的预防。现有技术一报道了利用海洋放线菌治疗和预防致病性弧菌引起的虾病害,能够抑制弧菌菌膜的形成,其在养殖池塘水系中产抗菌类物质。现有技术二报道了海洋链霉菌作为益生菌应用于促进斑节对虾的生长。现有技术三研究人员从海洋放线菌中提取抗菌物质,并将其与食物一同喂养凡纳滨对虾,对具白点综合症病毒的对虾产生抗病毒效应。
近年来海水养殖业发展迅猛,许多水产养殖病害严重且难以控制,而从海洋生物及其共生微生物中寻找新型药物分子地研究发展迅速,已有研究将海洋微生物应用于水产养殖致病菌引起病害的预防,可能是其产生活性分子的作用,这为海水水产养殖病害控制提供了很好的研究方向。同时,微生物具有生长繁殖快、易于培养的优点,可通过育种、培养条件控制等技术来提高其有效成分的含量,并可利用发酵工程来实现工业化大规模生产,从而从根本上解决原材料短缺的问题。
综上所述,现有技术存在的问题是:
(1)野生放线菌菌株发酵产生的活性成分产量往往较低,有时即使可以分离得到新化合物,但因为量太少而不足以完成其活性鉴定等方面的工作。
(2)在常规培养条件下放线菌中的许多次级代谢途径是沉默的,所以较难发现其产新活性物质的能力,从而在源头上限制了原创新药先导化合物的发现。
解决上述技术问题的难度和意义:
从海洋生物及其共生微生物中寻找新型药物分子,可以对水产养殖致病菌引起的病害进行防治。
微生物具有生长繁殖快、易于培养的优点,可通过育种、培养条件控制等技术来提高其有效成分的含量,并可利用发酵工程来实现工业化大规模生产,从而从根本上解决原材料短缺的问题。
技术实现要素:
针对现有技术存在的问题,本发明提供了一种诱导海洋放线菌沉默基因表达产生新物质的方法。
本发明是这样实现的,一种诱导海洋放线菌沉默基因表达产生新物质的方法为:
步骤一:先用无菌陈海水浸洗紫海胆3次,每次10分钟,然后置于75%酒精中消毒10分钟,后用无菌生理盐水洗3遍,无菌滤纸吸干表面水分后再用无菌剪刀和解剖刀小心解剖,取出肠道于无菌生理盐水中并捣碎,用无菌生理盐水梯度稀释,吸取200μl,涂布在含有50μg/ml重铬酸钾和20μg/ml卡那霉素的高氏培养基平板上,然后置于28℃培养箱中培养15天,期间定期检查,当有疑似放线菌菌落长出时,小心挑取单菌落划线接种到新鲜isp2培养基平板上培养,经2~3次划线纯化挑取单菌落获得纯培养菌株。
步骤二:将分离纯化得到的菌株接种于200ml的液体高氏培养基和麦芽提取物(me)培养基(1l含有以下质量的组分:麦芽提取物10~15g、葡萄糖10~15g、蛋白胨1~2g,ph值为7.0~7.2)中,在26~28℃下以160~210r·min-1振荡培养10~14d,得到发酵液;过滤发酵液得到菌液和菌体,菌液用等体积的乙酸乙酯提取2~3次,菌体用氯仿甲醇(体积比为1:1)浸提2~3次,40~60℃下减压浓缩得到的提取物供抗病原菌活性筛选;
步骤三:采用平板滤纸片法筛选出2株菌株发酵液的乙酸乙酯粗提物对石斑鱼病原溶藻弧菌菌株具有生长抑制活性,抑菌圈直径为8~17mm;利用步骤二中的两种培养基,对筛选得到的上述活性菌株进行发酵条件的优化,通过18℃低温刺激、改变发酵培养基不同的碳源(葡萄糖或蔗糖)、氮源(蛋白胨或酵母膏)或者添加稀土元素等,进行200ml小规模发酵;
步骤四:利用odsc-18反相柱处理诱导后和诱导前的发酵液乙酸乙酯提取物,进行hplc-ms-uv分析,结合其氢谱分析,检测诱导后的菌株产生新次级代谢产物。发现利用改良me培养基(1l含有以下质量的组分,麦芽提取物10g、蔗糖20g、蛋白胨2g,稀土元素1mg,ph值为7.2)可以诱导菌株streptomycesspectabilishda1产生新活性成分,经检测为3,4-二甲氧基-1-萘酰胺(3,4-dimethoxy-1-naphthamide,化合物1)和p-o-3,3-二甲基烯丙基-苯甲酰胺(p-o-(3,3-dimethylallyl)-benzamide,化合物2)。
进一步,所述平板滤纸片法为用二甲基亚砜将提取物样品配成浓度为5mg/ml的溶液,加样品溶液50μl于直径6mm的灭菌滤纸圆片上,再将其贴于已涂供试菌悬液的培养基平板上,放置20min后再放入培养箱中,28℃暗培养7天,测其抑菌圈大小。
进一步,所述诱导物为稀土元素。
本发明的另一目的在于提供一种新物质的检测方法,该方法为:
步骤一:分别利用筛选培养基和添加诱导物的培养基对2株放线菌在优化好的培养条件下进行大规模发酵,发酵液与菌丝体分别以乙酸乙酯、氯仿甲醇萃取3遍,然后在抗菌活性筛选指导下,采用多种色谱分离技术将新物质的活性成分从发酵液和菌体粗提物中分离精制出来;
步骤二:综合运用现代波谱技术来确定单体化合物的化学结构;
步骤三:进一步利用平板滤纸片法对上述结构确定的活性化合物进行活性评价,排除假阳性可能和其他干扰,以期得到真正的抗菌、抗病新活性物质。
进一步,所述色谱分离技术包括:常压正相、反相硅胶柱层析、凝胶层析、半制备hplc。
进一步,所述现代波谱技术包括:一维、二维、核磁共振技术、高分辨质谱技术、x射线单晶衍射技术以及紫外、红外、旋光、圆二色谱。
综上所述,本发明的优点及积极效果为:关于诱导放线菌产新物质的方法,前人主要利用单一的化学或基因遗传操作方法进行诱导研究,而本发明首次采用低温诱导与添加不同的营养源相结合的方法来诱导海洋放线菌沉默基因表达产生新物质,利用改良me培养基诱导菌株streptomycesspectabilishda1产生新活性成分,经检测为3,4-二甲氧基-1-萘酰胺(3,4-dimethoxy-1-naphthamide,化合物1)和p-o-3,3-二甲基烯丙基-苯甲酰胺(p-o-(3,3-dimethylallyl)-benzamide,化合物2),从而利用谱学测试和活性评价相结合建立了诱导和识别海洋放线菌产新物质的方法。
附图说明
图1是本发明实施例提供的诱导海洋放线菌沉默基因表达产生新物质的方法流程图;
图2是本发明实施例提供的新物质的检测方法流程图。
图3是本发明实施例提供的诱导后的粗提物2中新出现了两个主要成分1和2示意图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下面结合附图对本发明的应用原理做详细描述。
如图1所示,本发明实施例提供的诱导海洋放线菌沉默基因表达产生新物质的方法为:
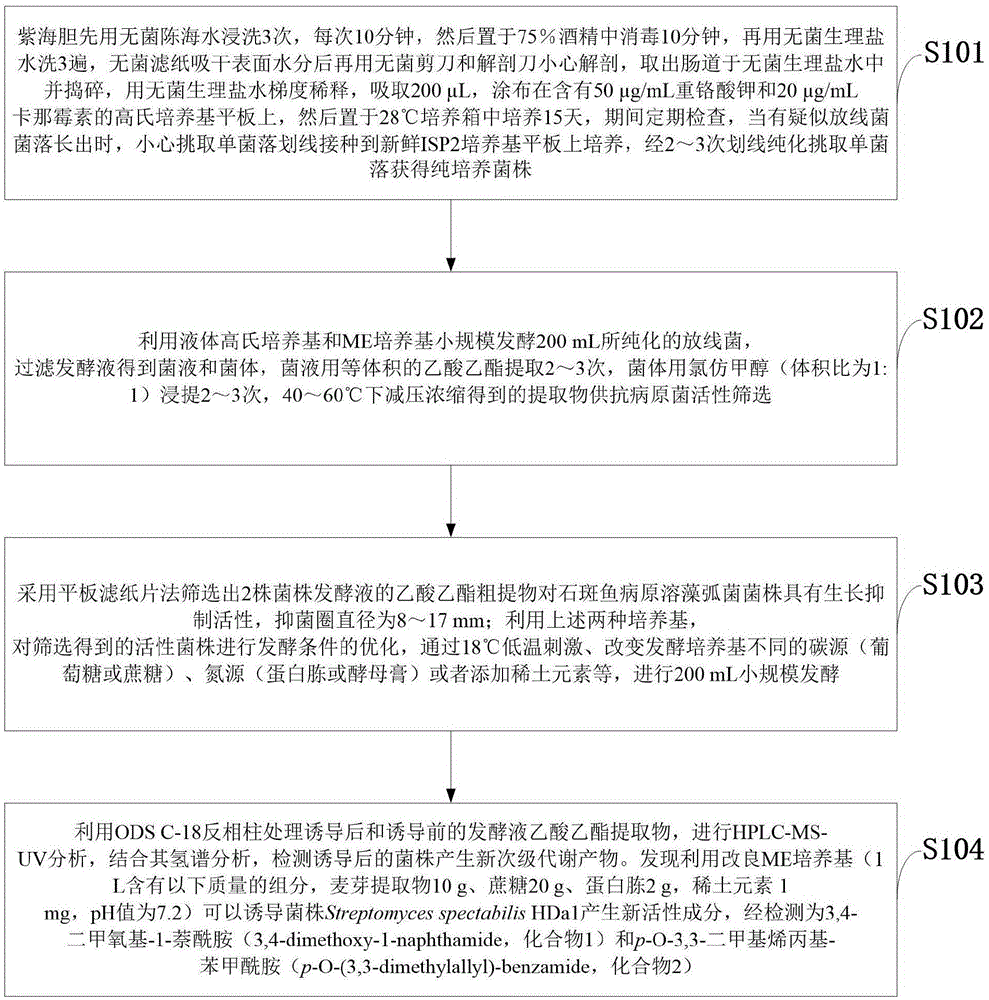
s101:紫海胆先用无菌陈海水浸洗3次,每次10分钟,然后置于75%酒精中消毒10分钟,再用无菌生理盐水洗3遍,无菌滤纸吸干表面水分后再用无菌剪刀和解剖刀小心解剖,取出肠道于无菌生理盐水中并捣碎,用无菌生理盐水梯度稀释,吸取200μl,涂布在含有50μg/ml重铬酸钾和20μg/ml卡那霉素的高氏培养基平板上,然后置于28℃培养箱中培养15天,期间定期检查,当有疑似放线菌菌落长出时,小心挑取单菌落划线接种到新鲜isp2培养基平板上培养,经2~3次划线纯化挑取单菌落获得纯培养菌株;
s102:利用液体高氏培养基和me培养基小规模发酵200ml所纯化的放线菌,过滤发酵液得到菌液和菌体,菌液用等体积的乙酸乙酯提取2~3次,菌体用氯仿甲醇(体积比为1:1)浸提2~3次,40~60℃下减压浓缩得到的提取物供抗病原菌活性筛选;
s103:采用平板滤纸片法筛选出2株菌株发酵液的乙酸乙酯粗提物对石斑鱼病原溶藻弧菌菌株具有生长抑制活性,抑菌圈直径为8~17mm;利用上述两种培养基,对筛选得到的活性菌株进行发酵条件的优化,通过18℃低温刺激、改变发酵培养基不同的碳源(葡萄糖或蔗糖)、氮源(蛋白胨或酵母膏)或者添加稀土元素等,进行200ml小规模发酵;
s104:利用odsc-18反相柱处理诱导后和诱导前的发酵液乙酸乙酯提取物,进行hplc-ms-uv分析,结合其氢谱分析,检测诱导后的菌株产生新次级代谢产物。发现利用改良me培养基(1l含有以下质量的组分,麦芽提取物10g、蔗糖20g、蛋白胨2g,稀土元素1mg,ph值为7.2)可以诱导菌株streptomycesspectabilishda1产生新活性成分,经检测为3,4-二甲氧基-1-萘酰胺(3,4-dimethoxy-1-naphthamide,化合物1)和p-o-3,3-二甲基烯丙基-苯甲酰胺(p-o-(3,3-dimethylallyl)-benzamide,化合物2)。
本发明实施例提供的平板滤纸片法为用二甲基亚砜将提取物样品配成浓度为5mg/ml的溶液,加样品溶液50μl于直径6mm的灭菌滤纸圆片上,再将其贴于已涂供试菌悬液的培养基平板上,放置20min后再放入培养箱中,28℃暗培养7天,测其抑菌圈大小。
本发明实施例提供的诱导物为稀土元素。
如图2所示,本发明实施例提供的新物质的检测方法为:
s201:分别利用筛选培养基和添加诱导物的培养基对2株放线菌在优化好的培养条件下进行大规模发酵,发酵液与菌丝体分别以乙酸乙酯、氯仿甲醇萃取3遍,然后在抗菌活性筛选指导下,采用多种色谱分离技术将新物质的活性成分从发酵液和菌体粗提物中分离精制出来;
s202:综合运用现代波谱技术来确定单体化合物的化学结构;
s203:进一步利用平板滤纸片法对上述结构确定的活性化合物进行活性评价,排除假阳性可能和其他干扰,以期得到真正的抗菌、抗病新活性物质。
本发明实施例提供的色谱分离技术包括:常压正相、反相硅胶柱层析、凝胶层析、半制备hplc。
本发明实施例提供的现代波谱技术包括:一维、二维、核磁共振技术、高分辨质谱技术、x射线单晶衍射技术以及紫外、红外、旋光、圆二色谱。
下面结合实验对本发明的应用效果作详细的描述。
下面实验中,质谱仪为agilent6210toflc-ms(高分辨)质谱仪。超导核磁共振仪为brukeraviii-500。薄层色谱用硅胶gf254和柱色谱硅胶(200-300目)均为青岛海洋化工厂产品。反相ods填料和sephadexlh-20均为美国merck公司产品。水为双重蒸馏水,其他试剂均为分析纯。生物活性测试实验中,对石斑鱼病原溶藻弧菌菌株抑制活性测试模型参照natureprotocol,2008,3,163–175(agarandbrothdilutionmethodstodeterminetheminimalinhibitoryconcentration(mic)ofantimicrobialsubstances.wiegand,i.;hilpert,k.;hancock,r.e.w.)。阳性抗菌药物氯苯尼考(florfenicol)购自海口盛京科技有限公司。
1菌株streptomycesspectabilishda1的发酵与活性筛选
分别将5块直径为1cm的海胆肠道放线菌streptomycesspectabilishda1菌块接种于液体me培养基和改良的液体me培养基中,各200ml,于28℃、210r·min-1振荡培养13d,得到发酵液。用等体积的乙酸乙酯萃取发酵液,重复提取3遍,合并乙酸乙酯提取液并在60℃下将其减压浓缩至干,分别得到粗提取物1(诱导前)和2(诱导后)。采用平板滤纸片法筛选发现粗提物2对石斑鱼病原溶藻弧菌菌株具有生长抑制活性。
2活性化合物的检测分析
(1)利用odsc-18反相柱处理诱导后和诱导前的发酵液乙酸乙酯提取物1和2,进行高效液相分析(流动相为甲醇水,以线性梯度洗脱,具体步骤为:0~35min,体积分数为0%~100%的甲醇;35~50min,体积分数为100%的甲醇;50~51min,体积分数为100%~0%的甲醇;51~56min,体积分数为0%的甲醇;紫外检测波长为254nm),检测诱导后的菌株产生新次级代谢产物,结果发现诱导后的粗提物2中新出现了两个主要成分1和2(见图3)。
(2)将5块直径为1cm的海胆肠道放线菌streptomycesspectabilishda1菌块接种于me培养基中,28℃、210r·min-1振荡培养3d,按照5%接种量接种到10l的me培养基中,28℃,210r·min-1振荡培养13d,得到发酵液。用等体积的乙酸乙酯(10l)萃取发酵液,重复提取3遍,合并乙酸乙酯提取液并在60℃下将其减压浓缩至干,得到粗提取物。对该粗提物(b)进行硅胶柱层析,用体积比为100:0、100:1、100:2、100:4、100:8、0:100的氯仿-甲醇梯度洗脱,得到b1、b2、b3、b4、b5和b6共6个子馏分。对馏分b2进行ods柱层析及半制备hplc柱层析分离,得到化合物1和化合物2。通过高分辨质谱、核磁共振(包括一维、二维nmr实验)等多种波谱学手段确定了以上化合物的结构为3,4-二甲氧基-1-萘酰胺(3,4-dimethoxy-1-naphthamide,化合物1)和p-o-3,3-二甲基烯丙基-苯甲酰胺(p-o-(3,3-dimethylallyl)-benzamide,化合物2)。采用已知的稀释梯度法测试它们的最低抑制浓度,阳性药物氯苯尼考的最低抑制浓度为5.0μg/ml,化合物1和2的最低抑制浓度分别为5.0和7.81μg/ml,与阳性药活性相当。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!