一种利用电化学发光适配体传感器检测双酚A含量的方法与流程
本发明涉及电化学发光适配体传感器领域,具体而言,涉及一种利用电化学发光适配体传感器检测双酚a含量的方法。
背景技术:
双酚a(bpa)作为聚合物极其相关产品中的关键单体被认为是最重要的内分泌干扰物,其可以在低剂量对人群健康产生危害[1]。针对bpa便利且价格低廉的灵敏检测方法的开发可以有助于促进针对与内分泌干扰毒性相关的各类健康问题的认知[2]。气相色谱质谱联用技术(gc-ms)和液相色谱质谱联用技术(lc-ms)被认为是bpa准确定量的最优方法,但是这类方法需要复杂的样品前处理过程并花费较长时间[3]。因此,为了节省时间简化操作,相关研究中报道了包括酶联免疫法、荧光、电化学和电化学发光(ecl)等检测bpa的方法[4-7]。
由于存在仪器简便和高灵敏度等优势,ecl作为一种强有力的分析技术被应用于不同领域[8,9]。最近,报道了大量利用ecl开发针对bpa的测量方法。例如,zhuang等建立了用于bpa测定的ecl传感器,这种传感器是基于加入bpa后鲁米诺溶解氧ecl系统被抑制[10]。bpa对过二硫酸盐溶液的抑制作用同样被用作对bpa的检测[11],lin等的研究中开发了一种全新的分子印迹ecl传感器用于bpa超灵敏检测[12]。另外,具有高亲和力、成本高校和超强特异性的抗-bpa适配体也被应用以增加检测的灵敏度和选择性,一种标记了mn2+混杂nayf4:yb/er上转换纳米粒子的适配体ecl传感器被用于bpa的检测[13]。在早期的研究中,我们开发了以识别bpa和适配体为基础的signal-off型ecl传感器用于bpa的灵敏检测[14],但是,signal-off模型可能会得到假阳性结果[15],因此,找到办法来解决这一问题是十分必要的。
有鉴于此,特提出本发明。
技术实现要素:
本发明涉及一种双酚a含量的检测方法,包括以下步骤:
a)提供表面固定有捕获dna单链的电极,将双酚a的适配体dna与所述电极接触形成dsdna;其中所述cdna与所述适配体dna部分互补配对;
b)将含有双酚a的待检物与所述电极共孵育,使得所述双酚a与所述适配体dna结合;
c)将所述电极与两种发卡型dnahp1和hp2接触,通过hcr反应形成长链dsdna,使用电化学发光探针标记所述长链dsdna并进行电化学发光检测;
其中,检测过程中涉及加热的步骤,温度由所述电极加热提供。
如上,本发明开发了一种简单灵敏的用于双酚a检测的电化学发光(ecl)适配体传感器。首先,在工作电极表面将捕获dna(cdna)与bpa适配体进行杂交,这一目标可以导致适配体的释放从而使得cdna可以诱导杂交链式反应(hcr)进而在电极表面形成长双联dna(dsdna),电化学发光探针嵌入双链dna(dsdna)的凹槽中作为ecl指示器,从而增强ecl的检测信号。
由于反应中可能有多个过程在加热条件下反应效率更高,因此本发明采用电极供热。例如,目标识别过程中的温度控制与hcr通过在加热电极上实现而不是加热溶液中,此外,ecl适配体传感器的效果通过提高电极温度得以增强。
在优化后的条件下,体系ecl强度与bpa浓度的对数值呈现线性相关,其中bpa浓度范围为1pm-50nm,55℃(电极表面温度)时,检出限(lod)为1.48pm,这一数值比电极表面温度为25℃时低约5.9倍。此生物传感器被应用于饮料样品中bpa的检测并获得了满意的结果。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
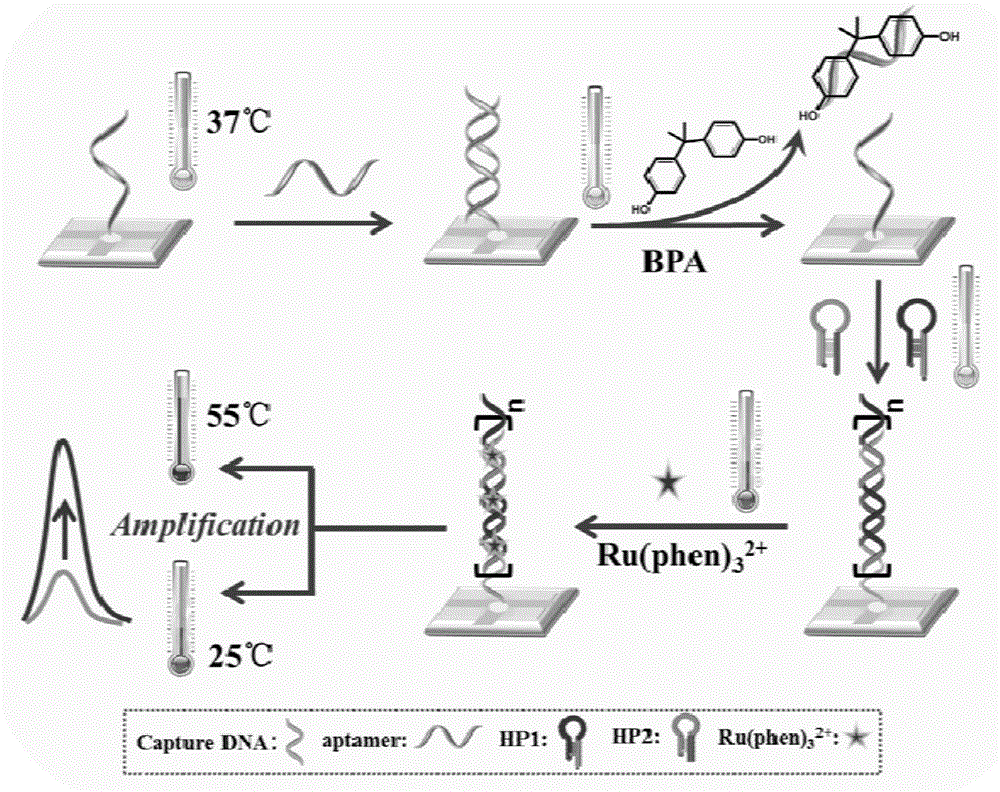
图1为针对双酚a的基于双重放大杂交链式反应与电加热电极的“signal-on”型电化学发光适配体传感器机理;
图2(a)设计体系的age结果;泳道1:1μmhp1;泳道2:1μmhp2;泳道3:1μmhp1/hp2混合物;泳道4:cdna与1μmhp1/hp2混合物;泳道5:泳道4+bpa适配体;泳道6:泳道5+bpa;
(b)nyquist图(a)电沉积ito电极,(b)电极‘a’+cdna,(c)电极‘b’+mch,(d)电极‘c’+bpa适配体,(e)电极‘d’+bpa,(f)进行hcr的电极‘e’;
(c)在没有bpa的情况下,电极温度为25℃时ecl的信号(曲线a,黑色),电极温度为55℃时ecl的信号(曲线b,红色);电极温度为25℃且体系中出现bpa(100pm)时ecl的信号(曲线c,蓝色),电极温度为25℃且体系中出现bpa(100pm)时ecl的信号(曲线d,粉色);tpa:20mmol/lpbs溶液(ph7.4);扫描频率:0.1v/s;
图3(a)反应时间对bpa与适配体反应的影响,(b)hcr的自组装时间,(c)电极表面ru(phen)32+与dsdna嵌入时间对ecl信号的影响,(d)电极表面温度对体系效果的影响;tpa:20mmol/lpbs溶液(ph7.4);扫描频率:0.1v/s;
图4(a)55℃时不同bpa浓度时ecl信号值(a-n:0,0.5pm,1pm,2pm,5pm,7.5pm,10pm,50pm,100pm,1nm,5nm,10nm,25nm,50nm);(b)不同温度时ecl强度与bpa浓度之间的关系:(a)55℃;(b)25℃;
图5(a)与其他结构类似物prg,hq,bps和bpf相比,针对bpa的特异性研究;(b)ito电极在不同温度下,传感器ecl的重现性,tpa:20mmol/lpbs溶液(ph7.4);扫描频率:0.1v/s。
具体实施方式
本发明提供了一种signal-on型ecl适配体传感器在检测,此传感器因兼具电加热电极控温和hcr扩增率高的特点而被成功应用于bpa检测。实验结果表明电极加热的效果与溶液加入效果相同,而且ecl传感器的效果会随电极温度升高而增强。后将传感器应用于饮料样品中bpa的检测并获得满意的结果,这种方法简单,低廉,无标记且具有很高的灵敏度,在针对不同目标物的现场调查方面有着极大潜力。
本发明涉及一种双酚a含量的检测方法,包括以下步骤:
a)提供表面固定有捕获dna单链的电极,将双酚a的适配体dna与所述电极接触形成dsdna;其中所述cdna与所述适配体dna部分互补配对;
b)将含有双酚a的待检物与所述电极共孵育,使得所述双酚a与所述适配体dna结合;
c)将所述电极与两种发卡型dnahp1和hp2接触,通过hcr反应形成长链dsdna,使用电化学发光探针标记所述长链dsdna并进行电化学发光检测;
其中,检测过程中涉及加热的步骤,温度由所述电极加热提供。
在一些实施方式中,表面固定有捕获dna单链的电极通过在电极表面形成金膜,再将硫醇化的捕获dna(例如1μm)在电极表面进行修饰。
在一些实施方式中,在步骤b)中,所述共孵育的温度为34℃~40℃,时间为70min~90min;
在一些实施方式中,在步骤b)中,所述共孵育的温度为35℃、37℃、38℃或39℃,时间为73min、75min、77min、78min、79min、80min、81min、82min、83min、85min或87min。
在一些实施方式中,在步骤c)中,将所述电极与两种发卡型dnahp1和hp2接触的温度为34℃~40℃,时间为90min~110min;
在一些实施方式中,在步骤c)中,将所述电极与两种发卡型dnahp1和hp2接触的温度为34℃~40℃,时间为93min、95min、97min、98min、99min、100min、101min、102min、103min、105min或107min。
在一些实施方式中,所述电化学发光探针选自ru(phen)32+。
在一些实施方式中,所述电化学发光探针标记所述长链dsdna时,标记时间为3h~4h,也可以选择3.3h、3.4h、3.5h、3.6h、3.7h。
在一些实施方式中,所述电化学发光探针标记所述长链dsdna时,标记温度为25℃~60℃,还可以选择30℃、35℃、40℃、45℃,优选50℃~60℃。
在一些实施方式中,所述双酚a的适配体dna的序列如seqidno:1所示。
在一些实施方式中,所述捕获dna单链为包含seqidno:2所示序列的单链dna。
在一些实施方式中,所述捕获dna单链的5’端还具有polyn序列,其中可以为a、t、c、g,polyn序列中n的个数可以为5~20个,优选7~13个,更优选10个。
在一些实施方式中,所述发卡型dnahp1和hp2分别如seqidno:3和4所示。
在一些实施方式中,所述温度由铟锡氧化物工作电极加热提供。
杂交链式反应(hcr)是一种通过信号放大从而增强灵敏度的高效手段,之前的研究中已经确认在hcr过程中会发生一连串的杂交反应[16],hcr的反应产物可以作为游离信号标签的信号输出载体从而达到增强信号的目的[17]。但是在传统的hcr中,为了获得更好的信号扩增效率,反应过程需要溶液加热进行准确控温,这一过程时间冗长且不适用于现场检测。
电加热电极因其是一种快捷、通用、方便的控温方法而得到越来越多的关注[18,19]。这一技术的主要特点在于不需溶液而在室温下就可以对电极进行升温,进而通过控制反应的热力学与动力学参数以达到促进传感器性能的目的[20]。本发明发现加热电极可以用于控制dna杂交和酶活性的最适温度,同时也对固定态ru(phen)32+的有促进作用。
本发明开发了一种以适配体为基础的signal-on型电化学发光bpa传感器,这种传感器结合了电加热电极和hcr信号扩增方法。其中,适配体反应和dna杂交等过程的温度可以通过电加热电极准确而便捷的控制,而不需要溶液加热的方法。ru(phen)32+嵌入双链dna(dsdna)的凹槽中作为ecl探针[21],从而克服了传统情况下dna上ecl指示器复杂的修饰过程。结合了hcr并通过提高电极表面温度,bpa检测系统ecl响应得到了双重的信号增强,这种生物传感器被应用于检测饮料样品中的bpa并获得了满意的结果。
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例
一实验部分
1试剂
二氯化三(1,10-邻二氮菲)钌(ii)水合物(ru(phen)32+),四水合氯金酸(haucl4·4h2o)和k3fe(cn)6购买于国药集团(上海,中国);bpa,双酚s(bps),双酚f(bpf),黄体酮(prg)和对苯二酚(hq)购买于sigma-aldrich(st.louis,mo,usa);二甲基亚砜(dmso),三丙胺(tpa),三(2-羧乙基)膦(tcep)和6-巯基己醇(mch)购买于阿拉丁(上海,中国)。
本研究中的的寡核苷酸有上海生工(上海,中国)合成,序列如下:(5’-3’)
capturedna(cdna):sh-ttttttttttcgtgatgcgctgggccatacgcggaacgctat
bpaaptamer:ccggtgggtggtcaggtgggatagcgttccgcgtatggcccagcgcatcacgggttcgcacca
hairpin1(hp1):gctgggccatacgcggaacgctatatagcgtgatagcgttccgcgtatggcccagcgcatcacg
hairpin2(hp2):cacgctatatagcgttccgcgtatggcccagccgtgatgcgctgggccatacgcggaacgctat
2.仪器设备
分别应用电化学工作站(chi660d,chinstruments,usa)和bpclultra-weakluminescenceanalyzer(生物物理所,中国科学院,北京,中国)完成电化学与ecl的测定;配有变压器的信号发生器(df1636a,中策电子,宁波,中国)用于加热;电极为电加热铟锡氧化物(ito)工作电极(附着有4mm宽t型ito薄膜的2cm×2cm薄片;相城科技,深圳,中国);铂丝作为反电极,ag/agcl电极作为参比电极。电加热ito电极的构建参考之前的报道[22],温度的校准采用开路电位测定法[22,23]。
2.3hcr操作和ecl检测
实验开始前,裸露的ito电极在haucl4(0.5mm)中进行循环伏安法(cv)测量(-0.4-+0.6v),从而在电极表面形成金膜。通过形成au-s共价键,硫醇化的cdna(1μm)在电极表面进行修饰(12h黑暗中),mch用于占用空闲位点,随后当电极温度达到37℃时加入溶解有1μmbpa适配体的tris-hcl缓冲液(50mm,ph=7.4)形成dsdna。
此后,缓冲液(20mmtris-hcl,ph=8)稀释后的不同浓度的bpa被加入并在相同条件下培养80min,
随后在37℃的条件下,当电极浸入包含有hp1(2μm),hp2(2μm)和tris-hcl(10mm,ph=7.4)缓冲液的溶液中hcr开始并持续100min。最终,修饰后的电极浸入ru(phen)32+(1mm)在室温下培养3.5h。需要注意的是每部操作后电极都需要重复清洗,ecl的测定在包含有20mmtpa的磷酸缓冲液(pbs,10mm,ph7.4)中进行,同时电极加热至合适的温度。
3.结果与讨论
3.1bpa的ecl适配体传感器原理
图1展示了bpa的ecl适配体传感器机理。其中电加热ito电极不仅作为工作电极,同时也是适配体-靶点成键和dna相互作用的载体与温度控制器,首先硫醇化的cdna通过au-s共价键固定在电极表面,同时通过ito电极将bpa适配体与cdna的杂交反应温度调至37℃。在体系中加入bpa后,适配体发生构象改变并从修饰后的ito电极分离[1],当电极表面温度为37℃时,两个探针(hp1和hp2)会与cdna发生hcr反应进而形成长链dsdna[17]。dsdna作为hcr反应的产物可以富集大量ru(phen)32+在其凹槽中,从而增强ecl信号[24]。相反地,在没有加入bpa的情况下,cdna会被适配体限制以至于不能进行hcr反应,电极表面只会有很短的dsdna,只会检测到较弱的ecl响应。由于升高的电极温度会是的ru(phen)32+的ecl强度大大增加[23,25],信号会有很高的灵敏度,基于这一原理,本研究开发了一种用于双酚a检测的简单灵敏的signal-on型ecl适配体传感器。
3.2可行性分析
hcr的反应产物作为ru(phen)32+的载体有助于信号聚集,因此先用琼脂糖凝胶电泳(age)验证hcr产物的可靠性[26],如图2a所示,在泳道1(只含hp1)、泳道2(只含hp2)和含有两种发卡序列(泳道3)只能看到低分子量的条带,而一旦加入cdna,就可以观察到高分子量的条带,这表明hcr中产生了大分子量物质(泳道4)。但是,bpa适配体与cdna混合首先会阻碍hcr反应,导致无法观察到组装产物(泳道5)。在体系中加入bpa后,适配体更倾向与bpa形成bpa-适配体复合物而不是适配体-cdna二聚体,所以cnda再次进入游离态从而形成dsdna(泳道6)。以上结果表示在目标物bpa出现后hcr过程开始发生。
通过交流阻抗测定利用电化学全电阻光谱学(eis)验证原理的可靠性,测定在振幅为5mv的溶解了[fe(cn)6]3-/4-(10mm)的kcl(0.5m)溶液中进行。nyquist图中高频的半圆部分与电子转移电阻相一致[27],如图2b所示,au修饰的ito电极上可以观察到一个较小的半圆区域,这表明电子在ito电极表面极易迁移(曲线a);在与cdna连接后,由于静电排斥半圆部分扩大(曲线b);而当电极被mch阻塞后,可以观察到更多明显的半圆区域(曲线c);由于适配体与cdna发生杂交可以观察到半圆部分继续扩大(曲线d);但是由于bpa(100pm)的加入,会观察到抱怨区域变窄,这可能是因为适配体远离电极表面造成的(曲线e);在hcr后,电阻形成的半圆直径大幅扩大(曲线f),这标明由于大量长链dsdna聚集在ito电极表面造成了电极导电性减弱。
在存在和不存在bpa两种情况下,我们也对ecl测定进行了研究。如图2c所示,在没有bpa的情况下,电极温度为25℃时ecl的信号较弱(曲线a),甚至当电极温度增加到55℃时,ecl强度并没有很大变化(曲线b),但是,电极温度为25℃且体系中出现bpa(100pm)时,可以观察到极强的ecl吸收(曲线c),而温度上升到55℃时,信号强度进一步增强(曲线d),也证明了温度的上升可以获得更好的ecl效果,以上结果验证了生物传感器的可行性。
3.3实验条件优化
我们优化了影响生物传感器性能的一系列实验条件。首先探究了bpa与其特异性适配体的反应时间,如图3a所示,在bpa与其适配体反应80min后ecl的信号强度升高到稳定水平,因此,80min被选作最优反应时长。hcr的自组装时间同样会影响适配体传感器的性能,ecl信号强度会随着hcr的反应时间增加而增强,在100min后不再有明显的升高(图3b),因此,后续反应时间为100min。与hcr反应时间相似,ecl信号会随着电极表面ru(phen)32+与dsdna的反应时间增长而增强,并在3.5h后达到上限,因此,3.5h被选作ru(phen)32+的最有嵌入时间(图3c)。
我们也研究了电极表面温度对固定后的ru(phen)32+的ecl的影响。如图3d所示,当温度从25℃上升至55℃,ecl信号逐渐增强(红线),而对背景噪音基本无影响(黑线)。由于高温加快了电极表面附近溶液对流与扩散的速率,55℃时ecl信号强度比25℃时信号强度高出四倍[28]。但是,当温度超过55℃时,ecl信号开始衰减,这可能是归因于高温时ru(phen)32+较低的量子效率[29]和高温对电极表面dna结构的破坏[30],而且在此温度下可以观察到较强的背景噪音干扰,因此55℃作为实验的最优温度。
3.4生物传感器的分析效果
在最优实验条件下,我们对适配体传感器的灵敏度和动态范围进行了评估。如图4a所示,在电极表面温度为55℃时,ecl信号强度随着加入的bpa浓度增加而增强,ecl强度(i)与bpa浓度的对数值在1pm-50nm范围内呈线性相关(图4b中曲线a),线性方程为i=1442.2lg(bpa)+4004.5(r2=0.9945)。但是,当电极温度变为25℃时,线性范围变为0.01nm-50nm,线性方程为i=336.1lg(bpa)+981.8(r2=0.9886),在55℃时方法的检出限(lod,s/n=3)计算得1.48pm,这一数值比25℃时的检出限低5.9倍(图4b中曲线b),这中差异来自温度对ito电极信号增强的影响。而且,通过与之前报道的以适配体为基础的传感器进行比较,我们可以看出本研究开发了一种具有灵敏度高且检测范围广的用于bpa检测的传感器(表1)。
表1本研究中ecl适配体传感器与其他基于适配体分析方法效果对比
3.5选择性与重现性
利用四种bpa的结构类似物prg,hq,bps和bpf对此bpa检测适配体传感器的选择性进行了研究。如图5a所示,相比于bpa(100pm)浓度为10nm的干扰物质产生了微不足道的影响。另外,无机离子如na+,k+,ca2+,cu2+的存在对bpa的检测也并无影响。这些结果表明开发的方法对区分bpa具有很好的选择性。
重现性的评估通过在不同电极温度下对3次平行实验进行测定,结果显示电极温度分别为25,37和55℃时,测定结果的相对标准偏差分别为5.3,4.1和2.6%(图5b),这也表明电极温度较高时,实验获得了更好的重现性。
3.6ecl生物传感器的应用
适配体传感器被用于检测饮料样品(牛奶,橙汁和椰汁)中bpa的含量,之前的文献中报道了这类样品的先处理过程[31]。此外,我们通过标准添加实验的回收率验证方法的准确性。如表2所示,样品中未检测到bpa的存在,在加入已知浓度bpa标准后,牛奶样品、橙汁样品和椰汁样品中bpa回收率范围分别为98.4%–100.5%,96.0%–101.2%和97.3%–100.8%,这一结果与lc-ms分析结果极其相近,这也表明开发的适配体传感器可以用于实际样品中bpa的检测并获得了满意的结果。
表2用本研究开发的传感器检测饮料样品中bpa的浓度与lc-ms对比
4.结论
本研究开发了一种signal-on型ecl适配体传感器,此传感器因兼具电加热电极控温和hcr扩增率高的特点而被成功应用于bpa检测。实验结果表明电极加热的效果与溶液加入效果相同,而且ecl传感器的效果会随电极温度升高而增强。后将传感器应用于饮料样品中bpa的检测并获得满意的结果,这种方法简单,低廉,无标记且具有很高的灵敏度,在针对不同目标物的现场调查方面有着极大潜力。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
参考文献
[1]h.j.lim,b.chua,a.son,detectionofbisphenolausingpalm-sizenanoaptameranalyzer,biosens.bioelectron.,94(2017)10-18.
[2]x.lin,c.cheng,p.terry,j.chen,h.cui,j.wu,rapidandsensitivedetectionofbisphenolafromserummatrix,biosens.bioelectron.,91(2017)104-109.
[3]h.badiebostan,n.m.danesh,g.karimi,m.ramezani,s.a.mousavishaegh,k.youssefi,f.charbgoo,k.abnous,s.m.taghdisi,ultrasensitivedetectionofochratoxinausingaptasensors,biosens.bioelectron.,98(2017)168-179.
[4]j.zhou,s.zhao,j.zhang,l.zhang,y.cai,l.zhou,anindirectcompetitiveenzyme-linkedimmunosorbentassayforbisphenol-abasedonthesynthesisofapoly-l-lysine-haptenconjugateasacoatingantigen,anal.methods,5(2013)1570-1576.
[5]x.cao,f.shen,m.zhang,j.bie,x.liu,y.luo,j.guo,c.sun,facilesynthesisofchitosan-cappedznsquantumdotsasaneco-friendlyfluorescencesensorforrapiddeterminationofbisphenolainwaterandplasticsamples,rscadv.,4(2014)16597-16606.[6]m.najafi,m.a.khalilzadeh,h.karimi-maleh,anewstrategyfordeterminationofbisphenolainthepresenceofsudaniusingazno/cnts/ionicliquidpasteelectrodeinfoodsamples,foodchem.,158(2014)125-131.
[7]l.chen,x.zeng,a.r.ferhan,y.chi,d.-h.kim,g.chen,signal-onelectrochemiluminescentaptasensorsbasedontargetcontrolledpermeablefilms,chem.commun.,51(2015)1035-1038.
[8]l.chen,d.huang,s.ren,y.chi,g.chen,carbondioxidegassensorbasedonionicliquid-inducedelectrochemiluminescence,anal.chem.,83(2011)6862-6867.
[9]d.-y.liu,y.-y.xin,x.-w.he,x.-b.yin,theelectrochemiluminescenceofrutheniumcomplex/tripropylaminesystemsatdna-modifiedgoldelectrodes,biosens.bioelectron.,26(2011)2703-2706.
[10]y.-f.zhuang,j.-t.zhang,g.-p.cao,simpleandsensitiveelectrochemiluminescencemethodfordeterminationofbisphenolabasedonitsinhibitoryeffectontheelectrochemiluminescenceofluminol,j.chin.chem.soc.,55(2008)994-1000.
[11]w.guo,a.zhang,x.zhang,c.huang,d.yang,n.jia,multiwalledcarbonnanotubes/goldnanocomposites-basedelectrochemiluminescentsensorforsensitivedeterminationofbisphenola,anal.bioanal.chem.,408(2016)7173-7180.
[12]y.lin,j.cao,x.li,x.zhang,j.zhang,z.lin,anovelmolecularlyimprintedelectrochemiluminescencesensorbasedonaru(bpy)32+/mwcnts/nano-tio2-nafionelectrodeforthedetectionofbisphenola,anal.methods,8(2016)7445-7452.
[13]x.guo,s.wu,n.duan,z.wang,mn2+-dopednayf4:yb/erupconversionnanoparticle-basedelectrochemiluminescentaptasensorforbisphenola,anal.bioanal.chem.,408(2016)3823-3831.
[14]s.ye,r.ye,y.shi,b.qiu,l.guo,d.huang,z.lin,g.chen,highlysensitiveaptamerbasedonelectrochemiluminescencebiosensorforlabel-freedetectionofbisphenola,anal.bioanal.chem.,409(2017)7145-7151.
[15]s.han,x.zhou,y.tang,m.he,x.zhang,h.shi,y.xiang,practical,highlysensitive,andregenerableevanescent-wavebiosensorfordetectionofhg2+andpb2+inwater,biosens.bioelectron.,80(2016)265-272.
[16]j.huang,y.wu,y.chen,z.zhu,x.yang,c.j.yang,k.wang,w.tan,pyrene-excimerprobesbasedonthehybridizationchainreactionforthedetectionofnucleicacidsincomplexbiologicalfluids,angew.chem.,int.ed.,50(2011)401-404.
[17]x.wang,a.jiang,t.hou,h.li,f.li,enzyme-freeandlabel-freefluorescenceaptasensingstrategyforhighlysensitivedetectionofproteinbasedontarget-triggeredhybridizationchainreactionamplification,biosens.bioelectron.,70(2015)324-329.
[18]p.gründler,t.zerihun,a.
[19]a.walter,f.langschwager,f.marken,g.-u.flechsig,nanostructuredheatedgoldelectrodesfordnahybridizationdetectionusingenzymelabels,sensorsactuatorsb:chem.,233(2016)502-509.
[20]s.-h.wu,b.-j.zhu,z.-x.huang,j.-j.sun,aheatedpencilleaddiskelectrodewithdirectcurrentanditspreliminaryapplicationforhighlysensitivedetectionofluteolin,electrochem.commun.,28(2013)47-50.
[21]x.-b.yin,y.-y.xin,y.zhao,label-freeelectrochemiluminescentaptasensorwithattomolarmassdetectionlimitsbasedonaru(phen)32+-double-stranddnacompositefilmelectrode,anal.chem.,81(2009)9299-9305.
[22]y.chen,y.jiang,z.lin,j.sun,l.zhang,g.chen,fabricationofanelectricallyheatedindium-tin-oxideelectrodeforelectrochemiluminescentdetectionsystem,analyst,134(2009)731-737.
[23]t.zerihun,p.gründler,electricallyheatedcylindricalmicroelectrodes.thereductionofdissolvedoxygenonpt,j.electroanal.chem.,404(1996)243-248.
[24]c.-x.tang,y.zhao,x.-w.he,x.-b.yin,a"turn-on"electrochemiluminescentbiosensorfordetectinghg2+atfemtomolelevelbasedontheintercalationofru(phen)32+intods-dna,chem.commun.,46(2010)9022-9024.
[25]y.chen,z.lin,j.chen,j.sun,l.zhang,g.chen,newcapillaryelectrophoresis–electrochemiluminescencedetectionsystemequippedwithanelectricallyheatedru(bpy)32+/multi-wall-carbon-nanotubepasteelectrode,j.chromatogr.,1172(2007)84-91.
[26]c.-c.chang,c.-y.chen,t.-l.chuang,t.-h.wu,s.-c.wei,h.liao,c.-w.lin,aptamer-basedcolorimetricdetectionofproteinsusingabrancheddnacascadeamplificationstrategyandunmodifiedgoldnanoparticles,biosens.bioelectron.,78(2016)200-205.
[27]s.zhang,j.xia,x.li,electrochemicalbiosensorfordetectionofadenosinebasedonstructure-switchingaptamerandamplificationwithreporterprobednamodifiedaunanoparticles,anal.chem.,80(2008)8382-8388.
[28]z.lin,w.wang,y.jiang,b.qiu,g.chen,detectionofn6-methyladenosineinurinesamplesbyelectrochemiluminescenceusingaheateditoelectrode,electrochim.acta,56(2010)644-648.
[29]z.lin,x.chen,h.chen,b.qiu,g.chen,electrochemiluminescentbehaviorofn6-isopentenyl-adenine/ru(bpy)32+systemonanelectricallyheatedionicliquid/carbonpasteelectrode,electrochem.commun.,11(2009)2056-2059.
[30]g.-u.flechsig,j.peter,g.hartwich,j.wang,p.gründler,dnahybridizationdetectionatheatedelectrodes,langmuir,21(2005)7848-7853.
[31]l.zhou,j.wang,d.li,y.li,anelectrochemicalaptasensorbasedongoldnanoparticlesdottedgraphenemodifiedglassycarbonelectrodeforlabel-freedetectionofbisphenolainmilksamples,foodchem.,162(2014)34-40.
[32]z.mei,h.chu,w.chen,f.xue,j.liu,h.xu,r.zhang,l.zheng,ultrasensitiveone-steprapidvisualdetectionofbisphenolainwatersamplesbylabel-freeaptasensor,biosens.bioelectron.,35(2013)26-30.
[33]n.duan,h.zhang,y.nie,s.wu,t.miao,j.chen,z.wang,fluorescenceresonanceenergytransfer-basedaptamerbiosensorsforbisphenolausinglanthanide-dopedkgdf4nanoparticles,anal.methods,7(2015)5186-5192.
[34]y.qiao,j.li,h.li,h.fang,d.fan,w.wang,alabel-freephotoelectrochemicalaptasensorforbisphenolabasedonsurfaceplasmonresonanceofgoldnanoparticle-sensitizedznonanopencils,biosens.bioelectron.,86(2016)315-320.
[35]p.yu,y.liu,x.zhang,j.zhou,e.xiong,x.li,j.chen,anovelelectrochemicalaptasensorforbisphenolaassaybasedontriple-signalingstrategy,biosens.bioelectron.,79(2016)22-28.
[36]y.liu,l.zhang,n.zhao,y.han,f.zhao,z.peng,y.li,preparationofmolecularlyimprintedpolymericmicrospheresbasedondistillation–precipitationpolymerizationforanultrasensitiveelectrochemicalsensor,analyst,142(2017)1091-1098.
- 还没有人留言评论。精彩留言会获得点赞!