一种包埋后的番茄红素的检测方法与流程
本发明涉及食品检测领域,更具体地,涉及一种包埋后的番茄红素的检测方法。
背景技术:
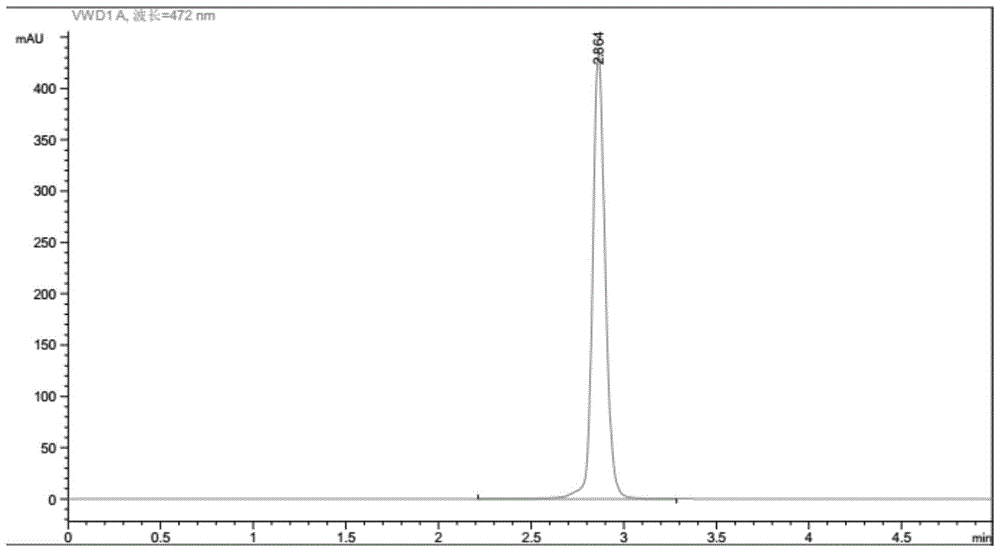
:番茄红素是类胡萝卜素的一种,主要分布在番茄、西瓜、红葡萄柚等的果实中,其中番茄中含量最高。番茄红素是一种天然色素,广泛存在于水果和蔬菜中,有“植物黄金”的美誉,被世界卫生组织和联合国粮农组织认定为a类营养素。番茄红素是目前自然界中被发现的最强抗氧化剂之一,具有高效的淬灭单线态氧及清除自由基的能力,在防治前列腺癌、肺癌、调节机体免疫、预防心血管疾病等方面具有重要生理功能。由于人体不能合成,番茄及其制品是人体通过饮食获得番茄红素的主要来源,番茄红素通常被制成液体、片剂、软胶囊及微胶囊等作为膳食补充剂。但是,番茄红素极不稳定,在加工储藏过程中受光、热和氧的作用,容易被氧化降解和异构化,导致生理活性降低,降解产物也可能对人体造成伤害。为了改善番茄红素稳定性问题,必须采取高新技术如微胶囊技术、包埋技术、微乳化技术、脂质体技术及纳米分散体技术来解决这一问题。这五种技术在开发番茄红素制剂剂型方面已有深入理论研究,其中微胶囊技术、包埋技术及脂质体技术已突破实验室规模,应用在实际生产过程中。其中,大分子包埋后的颗粒状包埋型番茄红素原料在稳定性方面有较大的优势,避免理化性质的改变,服用后也不会受到胃液中强酸的破坏,使其生物利用度有所提高。虽然包埋型番茄红素原料解决了番茄红素稳定性的问题,但是,在检测番茄红素时,这又给样品前处理及样品含量测定上带来了新的问题。包埋型番茄红素原料是通过将番茄红素分子包合嵌入以环糊精等为原料形成的筒状结构包埋剂中形成的超微粒分散物或超微型药物载体,所形成的包埋型番茄红素原料颗粒极硬,无法全部研磨为粉末,且去掉包埋后番茄红素在外界极不稳定,前处理工作较难。因此,开发快速简便、干扰小、灵敏度高、环境友好的检测分析方法是未来的研究重点,也是目前行业发展的需要。目前番茄红素的检测方法主要有光谱法、色谱法和差示扫描量热法。光谱法中用的最多的是紫外可见分光光度法,其操作简单,但不能排除样品中其他类胡萝卜素的干扰,导致测定值比真实值高,系统误差大,很难得到准确可靠的结果,除此之外,红外光谱法和拉曼光谱法测定番茄红素含量时都不需破坏样品,但在定量分析时有局限性。差示扫描量热法是一种热分析方法,虽该方法快速准确,且不需要标准品,但要求测试样品的纯度高于98%,限制了其应用范围。高效液相色谱法是番茄红素含量测定应用最广泛的检测方法,具有分析速度快、分离效率高、灵敏度高,操作自动化等优点,但关键技术在于样品前处理以及色谱条件的选择与优化。目前gb22249-2008(保健食品中番茄红素的测定)标准中前处理试样制备中包括一般试样的制备和微囊化试样的制备,但现在市场上对于多种不同材料包埋的番茄红素,比如以色列乐康瑞德的lycobeads20%vbaf(成分:海藻酸钠、阿拉伯胶、源于红番茄的番茄红素、豌豆淀粉和水)、德国巴斯夫的lycovit10%dc(成分:明胶、蔗糖、玉米淀粉、番茄红素、抗坏血酸棕榈酸酯、dl-α-生育酚、抗坏血酸钠、磷酸三钙)以及晨光生物科技的10%番茄红素微囊(成分:番茄红素、牛骨明胶、t-66、纯净水、其他),国标中这两个试样制备方法并不能全部适用。因此,需要研究一种有效的能够适用于各种材料包埋的番茄红素的检测分析方法,这不仅对进一步研究番茄红素的生理功能及其相关产品品质有重要意义,更能促进我国保健品行业的良性发展。技术实现要素:本发明的目的是针对上述不足,提出一种包埋后的番茄红素的检测方法。本发明采用高效液相色谱法检测番茄红素及其含量,在样品前处理过程中利用氨缓冲溶液进行破包埋,适用于各种包埋型番茄红素的含量测定,除此之外,溶解番茄红素的溶液中加入抗氧化剂,延缓了番茄红素的分解。本发明与gb22249-2008(保健食品中番茄红素的测定)相比,本发明的方法快速、准确,精密度、重复性良好,是对现有国标的有效改进,适用范围广,适用于大批量样品的检测。本发明的技术方案是通过以下方式实现的:一种包埋后番茄红素的检测方法,先将待测样品进行前处理得到待测液,再通过高效液相色谱法分离检测待测液中的番茄红素;其中,前处理过程中,用体积浓度为4%的氨缓冲溶液对待测样品进行破包埋;高效液相色谱法检测时采用的流动相为体积比为90:10的二氯甲烷和甲醇。本发明通过大量的实验比较,这个比例条件下,色谱峰峰型最优。上述4%氨缓冲溶液的配制方法为:先将143ml氨水用纯净水稀释定容至1l,再用磷酸调节ph至9.8,即得到4%氨缓冲溶液。磷酸优选为质量浓度为85%的磷酸。本发明通过大量的实验比较,维持溶液的ph使其呈碱性,更利于番茄红素的破包埋,ph高于9.8对色谱柱的伤害更大,ph低于9.8样品不易破包埋。所述前处理的步骤为:先将样品研磨均匀后,称取80~120mg置于100ml棕色容量瓶中,加入10~30ml4%氨缓冲溶液于水浴中超声;待溶液冷却至室温后用含抗氧化剂的四氢呋喃溶液定容,搅拌后静置,待溶液澄清后吸取1.0ml上清液置于10ml棕色容量瓶中;最后再用体积比为90:10的二氯甲烷和甲醇溶液流动相溶液定容至刻度线,得到待测液。优选的,称取100mg置于100ml棕色容量瓶中,加入20ml4%氨缓冲溶液于水浴中超声。所述含抗氧化剂的四氢呋喃溶液是由抗氧化剂溶于四氢呋喃中配制而成。所述的抗氧化剂可以为二丁基羟基甲苯(bht)、没食子酸(ga)、没食子叔丁酯(tbg)或特丁基对苯二酚(tbhq)中的一种或多种,优选为二丁基羟基甲苯(bht)。上述抗氧化剂在四氢呋喃中的浓度为0.2~1.0g/l。优选抗氧化剂在四氢呋喃中的浓度为0.25g/l。最优选的,稳定的四氢呋喃溶液由0.25gbht溶于1l四氢呋喃中配制而成。所述水浴温度为50~60℃,水浴中超声时间为15~25min。优选水浴温度为55℃,水浴中超声时间为20min。所述含抗氧化剂的四氢呋喃溶液定容后,搅拌的时间为15~25min。在用高效液相色谱法分离检测前先配制标准曲线溶液,标准曲线溶液的配制方法为:(1)配制标准贮备液:精密称取6.0mg番茄红素标准品置于25ml棕色容量瓶中,先用22.5ml二氯甲烷溶解,再用甲醇稀释至刻度线,配制得到0.2mg/ml番茄红素标准贮备液,瓶中充满氮气后密封,置于0℃保存,备用;(2)配制标准曲线溶液:取上述0.2mg/ml的番茄红素标准贮备液,用流动相分别配制成浓度为4μg/ml、8μg/ml、12μg/ml、16μg/ml、20μg/ml的标准曲线溶液。所述高效液相色谱法分离检测待测液中的番茄红素的方法为:将所述标准曲线溶液分别在色谱条件下进样,以浓度为横坐标,峰面积为纵坐标,得到标准曲线方程;将前处理得到的待测液用针式滤膜过滤后,在相同的色谱条件下进样,经反相高效分离色谱柱分离后,由紫外检测器检测,通过保留时间对待测样品进行定性;根据上述标准曲线方程,利用保留时间和峰面积计算得到待测样品中番茄红素的含量。所述高效液相色谱法采用的色谱条件为:色谱柱:c18柱柱温:30℃流速:0.6~0.8ml/min流动相:二氯甲烷:甲醇的体积比为90:10紫外检测器检测波长:472nm进样量:5μl。与现有技术比较本发明的有益效果:(1)本发明在样品前处理过程中用4%氨缓冲溶液对待测样品进行破包埋处理,可以破坏微囊的壁材使番茄红素释放,与gb22249-2008中微囊化试样的制备相比,氨缓冲溶液比n,n-二甲基甲酰胺安全性高,且对于不同壁材的微囊破包埋的效果更强,能够适用于各种材料包埋的番茄红素的检测,检测范围较广。(2)本发明在样品前处理过程中提取液为稳定的四氢呋喃溶液,因番茄红素对光及氧极不稳定,因此,用含有抗氧化剂的提取液延缓了番茄红素的分解,使用稳定的四氢呋喃溶液进行番茄红素的提取,有利于降低番茄红素被氧化降解的速度,且不影响其他性能。(3)本发明检测方法中所用流动相为体积比为90:10的二氯甲烷和甲醇,番茄红素在甲醇等极性溶剂中溶解度较小,而易溶于二氯甲烷等溶剂,gb22249-2008是以甲醇-乙腈(50:50,v:v)为流动相,此流动相会出现色谱峰过宽、与相邻峰的分离度差的现象(见图6,出峰时间21.678min),尤其在进样量大时容易分叉影响峰形,本发明将体积比为90:10的二氯甲烷和甲醇作为流动相,不仅有利于番茄红素在色谱柱上的保留,且出峰时间短(出峰时间2.8min左右)、分析速度快。(4)本发明在配制番茄红素标准贮备液时,先用22.5ml二氯甲烷溶解,再用甲醇稀释至25ml棕色容量瓶刻度线,保证了番茄红素标准品的全部溶解。由于番茄红素易溶于二氯甲烷,在甲醇中溶解度较小,因此,相比于直接用流动相配制标准贮备液,本发明配制的番茄红素标准贮备液浓度较为精确。(5)本发明检测方法进行检测时,0.6~0.8ml/min的流速、5μl的进样量都保证了色谱峰峰形良好,不易分叉。附图说明图1示出了本发明中番茄红素标准品在12μg/ml浓度点时的高效液相色谱图。图2示出了本发明应用实施例1中lycobeads20%vbaf中番茄红素的高效液相色谱图。图3示出了本发明应用实施例2中lycovit10%dc中番茄红素的高效液相色谱图。图4示出了本发明应用实施例3中10%番茄红素微囊中番茄红素的高效液相色谱图。图5示出了本发明测试例2中第一份茄红素胶囊供试品中番茄红素的高效液相色谱图。图6示出了按照gb22249-2008标准以甲醇-乙腈(50:50,v:v)为流动相,检测10%番茄红素微囊中番茄红素的高效液相色谱图。图7示出了本发明测试例3待测液1中番茄红素的高效液相色谱图。图8示出了本发明测试例3待测液2中番茄红素的高效液相色谱图。图9示出了本发明测试例3待测液3中番茄红素的高效液相色谱图。图10示出了本发明测试例3待测液4中番茄红素的高效液相色谱图。具体实施方式以下通过具体实施例对本发明进行进一步解释说明。下述实施例所用试剂:甲醇:色谱纯;二氯甲烷:色谱纯;四氢呋喃:分析纯;氨水:分析纯;磷酸:85%磷酸番茄红素标准品:纯度≥90%,购自于上海源叶生物科技有限公司,在冰箱中-20℃避光保存。所用针式滤膜为0.45μm滤膜。实施例1一种包埋后的番茄红素的检测方法,步骤如下:1、对待测样品进行前处理:称取2g待测样品充分研磨,混合均匀后,精密称取100mg置于100ml棕色容量瓶中,加入20ml4%氨缓冲溶液于55℃水浴中超声20min,每5min手摇一次;待溶液冷却至室温后用含抗氧化剂的四氢呋喃溶液定容,在磁力搅拌器上搅拌20min后静置5min,待溶液澄清后吸取1.0ml上清液置于10ml棕色容量瓶中;最后再用体积比为90:10的二氯甲烷和甲醇溶液流动相溶液定容至刻度线,得到待测液。其中,4%氨缓冲溶液的配制方法为:先将143ml氨水加入1l纯净水中混合均匀,再用85%磷酸调节ph至9.8,即得到4%氨缓冲溶液。含抗氧化剂的四氢呋喃溶液是由0.25gbht溶于1l四氢呋喃中配制而成。流动相溶液为体积比为90:10的二氯甲烷和甲醇溶液。2、配制标准曲线溶液:(1)配制标准贮备液:精密称取6.0mg番茄红素标准品置于25ml棕色容量瓶中,先用22.5ml二氯甲烷溶解,再用甲醇稀释至刻度线,配制得到0.2mg/ml番茄红素标准贮备液,瓶中充满氮气后密封,置于0℃保存,备用;(2)配制标准曲线溶液:当用于检测时,取上述0.2mg/ml的番茄红素标准贮备液,分别取40μl、80μl、120μl、160μl、200μl分别放入5个1.0ml定量瓶中,用体积比为90:10的二氯甲烷和甲醇的流动相溶液分别配制成浓度为4μg/ml、8μg/ml、12μg/ml、16μg/ml、20μg/ml的标准曲线溶液。3、高效液相色谱法分离检测待测液中的番茄红素:将所述标准曲线溶液分别在色谱条件下进样,以浓度为横坐标,峰面积为纵坐标,得到标准曲线方程;将前处理得到的待测液用0.45μm针式滤膜过滤后,在相同的色谱条件下进样,经反相高效分离色谱柱分离后,由紫外检测器检测,通过保留时间对待测样品进行定性;根据上述标准曲线方程,利用保留时间和峰面积计算得到待测样品中番茄红素的含量。其中,所述色谱条件为:色谱柱:c18柱柱温:30℃流速:0.6~0.8ml/min流动相:二氯甲烷:甲醇的体积比为90:10紫外检测器检测波长:472nm进样量:5μl。4、待测样品中番茄红素的含量的计算:式中:x——样品中番茄红素的含量,%;ρ——根据标准曲线计算得到样品中番茄红素的浓度,μg/ml;v——样品的稀释倍数;m——样品的称样量,g。应用实施例11、对待测样品进行前处理:称取2g包埋后的番茄红素待测样品(产品名称:lycobeads20%vbaf,批号:3lydb1811254,生产单位:以色列乐康瑞德有限公司)充分研磨,混合均匀后,精密称取100mg置于100ml棕色容量瓶中,加入20ml4%氨缓冲溶液于55℃水浴中超声20min,每5min手摇一次;待溶液冷却至室温后用含抗氧化剂的四氢呋喃溶液定容,在磁力搅拌器上搅拌20min后静置5min,待溶液澄清后吸取1.0ml上清液置于10ml棕色容量瓶中;最后再用流动相溶液定容至刻度线,得到待测液。其中,4%氨缓冲溶液的配制方法为:先将143ml氨水用纯净水稀释定容至1l,再用磷酸调节ph至9.8,即得到4%氨缓冲溶液。含抗氧化剂的四氢呋喃溶液是由0.25gbht溶于1l四氢呋喃中配制而成。流动相溶液为体积比为90:10的二氯甲烷和甲醇溶液。2、配制标准曲线溶液:(1)配制标准贮备液:精密称取6.0mg番茄红素标准品置于25ml棕色容量瓶中,先用22.5ml二氯甲烷溶解,再用甲醇稀释至刻度线,配制得到0.2mg/ml番茄红素标准贮备液,瓶中充满氮气后密封,置于0℃保存,备用;(2)配制标准曲线溶液:当用于检测时,取上述0.2mg/ml的番茄红素标准贮备液,分别取40μl、80μl、120μl、160μl、200μl分别放入5个1.0ml定量瓶中,用体积比为90:10的二氯甲烷和甲醇的流动相溶液分别配制成浓度为4μg/ml、8μg/ml、12μg/ml、16μg/ml、20μg/ml的标准曲线溶液。3、高效液相色谱法分离检测待测液中的番茄红素:将所述标准曲线溶液分别在色谱条件下进样,以浓度为横坐标,峰面积为纵坐标,得到标准曲线方程;将前处理得到的待测液用0.45μm针式滤膜过滤后,在相同的色谱条件下进样,经反相高效分离色谱柱分离后,由紫外检测器检测,通过保留时间对待测样品进行定性;根据上述标准曲线方程,利用保留时间和峰面积计算得到待测样品中番茄红素的含量。如图2所示,lycobeads20%vbaf中番茄红素的高效液相色谱图中,出峰时间为2.847min,图1中番茄红素标准品的出峰时间为2.864min。其中,所述色谱条件为:色谱柱:c18柱柱温:30℃流速:0.6ml/min流动相:二氯甲烷:甲醇的体积比为90:10紫外检测器检测波长:472nm进样量:5μl。4、待测样品中番茄红素的含量的计算:式中:x——样品中番茄红素的含量,%;ρ——根据标准曲线计算得到样品中番茄红素的浓度,μg/ml;v——样品的稀释倍数;m——样品的称样量,g。根据标准曲线方程计算样品中番茄红素含量,并结合样品的质量,经计算得到待测样品中番茄红素的含量22.5%。应用实施例21、对待测样品进行前处理:称取2g包埋后的番茄红素待测样品(产品名称:lycovit10%dc,批号:0014933909,生产单位:德国巴斯夫股份公司)充分研磨,混合均匀后,精密称取100mg置于100ml棕色容量瓶中,加入20ml4%氨缓冲溶液于55℃水浴中超声20min,每5min手摇一次;待溶液冷却至室温后用含抗氧化剂的四氢呋喃溶液定容,在磁力搅拌器上搅拌20min后静置5min,待溶液澄清后吸取1.0ml上清液置于10ml棕色容量瓶中;最后再用流动相溶液定容至刻度线,得到待测液。其中,4%氨缓冲溶液的配制方法为:先将143ml氨水用纯净水稀释定容至1l,再用磷酸调节ph至9.8,即得到4%氨缓冲溶液。含抗氧化剂的四氢呋喃溶液是由0.25gga溶于1l四氢呋喃中配制而成。流动相溶液为体积比为90:10的二氯甲烷和甲醇溶液。2、配制标准曲线溶液:(1)配制标准贮备液:精密称取6.0mg番茄红素标准品置于25ml棕色容量瓶中,先用22.5ml二氯甲烷溶解,再用甲醇稀释至刻度线,配制得到0.2mg/ml番茄红素标准贮备液,瓶中充满氮气后密封,置于0℃保存,备用;(2)配制标准曲线溶液:当用于检测时,取上述0.2mg/ml的番茄红素标准贮备液,分别取40μl、80μl、120μl、160μl、200μl分别放入5个1.0ml定量瓶中,用体积比为90:10的二氯甲烷和甲醇的流动相溶液分别配制成浓度为4μg/ml、8μg/ml、12μg/ml、16μg/ml、20μg/ml的标准曲线溶液。3、高效液相色谱法分离检测待测液中的番茄红素:将所述标准曲线溶液分别在色谱条件下进样,以浓度为横坐标,峰面积为纵坐标,得到标准曲线方程;将前处理得到的待测液用0.45μm针式滤膜过滤后,在相同的色谱条件下进样,经反相高效分离色谱柱分离后,由紫外检测器检测,通过保留时间对待测样品进行定性;根据上述标准曲线方程,利用保留时间和峰面积计算得到待测样品中番茄红素的含量。如图3所示,lycovit10%dc中番茄红素的高效液相色谱图中,出峰时间为2.864min,图1中番茄红素标准品的出峰时间为2.864min。其中,所述色谱条件为:色谱柱:c18柱柱温:30℃流速:0.7ml/min流动相:二氯甲烷:甲醇的体积比为90:10紫外检测器检测波长:472nm进样量:5μl。4、待测样品中番茄红素的含量的计算:式中:x——样品中番茄红素的含量,%;ρ——根据标准曲线计算得到样品中番茄红素的浓度,μg/ml;v——样品的稀释倍数;m——样品的称样量,g。根据标准曲线方程计算样品中番茄红素含量,并结合样品的质量,经计算得到待测样品中番茄红素的含量11.1%。应用实施例31、对待测样品进行前处理:称取2g的10%番茄红素微囊待测样品(产品名称:10%番茄红素微囊,批号:3-0141-180108,生产单位:晨光生物科技集团股份有限公司)充分研磨,混合均匀后,精密称取100mg置于100ml棕色容量瓶中,加入20ml4%氨缓冲溶液于55℃水浴中超声20min,每5min手摇一次;待溶液冷却至室温后用含抗氧化剂的四氢呋喃溶液定容,在磁力搅拌器上搅拌20min后静置5min,待溶液澄清后吸取1.0ml上清液置于10ml棕色容量瓶中;最后再用流动相溶液定容至刻度线,得到待测液。其中,4%氨缓冲溶液的配制方法为:先将143ml氨水用纯净水稀释定容至1l,再用磷酸调节ph至9.8,即得到4%氨缓冲溶液。含抗氧化剂的四氢呋喃溶液是由0.25gtbhq溶于1l四氢呋喃中配制而成。流动相溶液为体积比为90:10的二氯甲烷和甲醇溶液。2、配制标准曲线溶液:(1)配制标准贮备液:精密称取6.0mg番茄红素标准品置于25ml棕色容量瓶中,先用22.5ml二氯甲烷溶解,再用甲醇稀释至刻度线,配制得到0.2mg/ml番茄红素标准贮备液,瓶中充满氮气后密封,置于0℃保存,备用;(2)配制标准曲线溶液:当用于检测时,取上述0.2mg/ml的番茄红素标准贮备液,分别取40μl、80μl、120μl、160μl、200μl分别放入5个1.0ml定量瓶中,用体积比为90:10的二氯甲烷和甲醇的流动相溶液分别配制成浓度为4μg/ml、8μg/ml、12μg/ml、16μg/ml、20μg/ml的标准曲线溶液。3、高效液相色谱法分离检测待测液中的番茄红素:将所述标准曲线溶液分别在色谱条件下进样,以浓度为横坐标,峰面积为纵坐标,得到标准曲线方程;将前处理得到的待测液用0.45μm针式滤膜过滤后,在相同的色谱条件下进样,经反相高效分离色谱柱分离后,由紫外检测器检测,通过保留时间对待测样品进行定性;根据上述标准曲线方程,利用保留时间和峰面积计算得到待测样品中番茄红素的含量。如图4所示,10%番茄红素微囊中番茄红素的高效液相色谱图中,出峰时间为2.853min,图1中番茄红素标准品的出峰时间为2.864min。其中,所述色谱条件为:色谱柱:c18柱柱温:30℃流速:0.8ml/min流动相:二氯甲烷:甲醇的体积比为90:10紫外检测器检测波长:472nm进样量:5μl。4、待测样品中番茄红素的含量的计算:式中:x——样品中番茄红素的含量,%;ρ——根据标准曲线计算得到样品中番茄红素的浓度,μg/ml;v——样品的稀释倍数;m——样品的称样量,g。根据标准曲线方程计算样品中番茄红素含量,并结合样品的质量,经计算得到待测样品中番茄红素的含量10.5%。对比例1本检测方法与gb22249-2008检测结果对比情况如下所述。1、分别选取以色列乐康瑞德的lycobeads20%vbaf、德国巴斯夫的lycovit10%dc和晨光生物科技的10%番茄红素微囊样品各3批,分别使用gb22249-2008方法以及本发明检测方法进行对比检测,评价两种方法的准确性情况。结果如表1所示,结果表明:本发明检测方法比gb22249-2008方法检测的番茄红素含量更高,这是由于本发明方法对于不同壁材的微囊破包埋的效果更强,使样品中的番茄红素完全释放,对于样品中番茄红素的检测准确度更高,本发明方法更可靠,更适合各类样品含量检测。表1不同方法检测番茄红素含量对比数据测试例1精密度测试精密度实验:分别选取以色列乐康瑞德的lycobeads20%vbaf、德国巴斯夫的lycovit10%dc和晨光生物科技的10%番茄红素微囊样品各1批,按照本发明检测方法进行多次检测,评价本发明检测方法对于各类样品检测的精密度情况,三种样品的检测数据分别见表2、表3和表4所示。结果表明:本检测方法检测各类样品的精密度在2%以内,说明本检测方法的精密度较好。表2lycobeads20%vbaf检测精密度数据检测次数番茄红素含量%122.5222.4322.1422.6521.9622.5723.1822.2921.8平均值22.3rsd1.78%表3lycovit10%dc检测精密度数据表410%番茄红素微囊检测精密度数据检测次数番茄红素含量%110.5210.6310.3410.2510.4610.7710.3810.1910.5平均值10.4rsd1.86%测试例2本发明番茄红素方法学验证1、仪器与试药高效液相色谱仪(aiglent1100型,配紫外检测器,安捷伦);分析天平(bt-25s;北京赛多利斯仪器系统有限公司);分析天平(al204型,梅特勒-托利多仪器有限公司);超声清洗器(昆山市超声仪器有限公司;kq5200b;250w;50hz);磁力搅拌器(hj-2a,常州国华电器有限公司)。番茄红素对照品(上海源叶生物科技有限公司,批号:y29a10y17831);lycobeads20%vbaf番茄红素(以色列乐康瑞德公司);二氯甲烷,甲醇均为色谱纯(美国默克公司);水为超纯水;其他试剂均为国产分析纯。2、色谱条件色谱柱:agilentzorbaxsb-c18(4.6mm×150mm,5μm);流动相为二氯甲烷:甲醇=90:10;流速:0.6~0.8ml/min;检测波长:472nm;进样量:5μl;柱温30℃。3、标准储备液的制备方法精密称取6.08mg番茄红素,置于25ml棕色容量瓶中,先用22.5ml二氯甲烷溶液溶解,然后用甲醇稀释至刻度,瓶中空间充满氮气,密封,置于0℃保存,作为标准储备液(浓度为0.2369mg/ml)备用。番茄红素标准品厂家鉴定纯度为97.4%。4、供试品溶液的制备方法称取样品约2g,充分研磨,混合均匀后精密称取100mg样品置于100ml棕色容量瓶中,加20ml4%氨缓冲溶液,于55℃水浴中超声20min,每5min手摇一次。待溶液冷却至室温后,用稳定的四氢呋喃溶液定容,置于磁力搅拌器上搅拌20min。静置5min待溶液澄清,吸取上清液1.0ml置10ml棕色容量瓶中,随后再用二氯甲烷+甲醇(90+10)(v/v)溶液定容至刻度,备用。5、线性关系考察精密吸取番茄红素标准储备液0.40ml、0.80ml、1.20ml、1.60ml、2.00ml,置10ml棕色量瓶中,加二氯甲烷+甲醇(90+10)(v/v)溶液稀释至刻度,该标准系列番茄红素浓度为9.475μg/ml、18.95μg/ml、28.43μg/ml、37.90μg/ml、47.38μg/ml。分别精密吸取以上浓度的标准系列番茄红素溶液各5μl,注入液相色谱仪,测定,记录峰面积。以峰面积值为纵坐标(y),对照品溶液浓度(μg/ml)为横坐标(x),进行线性回归。得番茄红素的线性回归方程为y=73.0063x-13.4200(r=1.000)。番茄红素线性关系考察结果如表5所示,结果表明番茄红素在浓度为9.475~47.38μg/ml范围内,线性关系良好。表5番茄红素线性关系考察6、精密度试验以28.43μg/ml的番茄红素标准溶液为测定对象,依本发明方法连续进样6次,记录峰面积,番茄红素精密度试验结果如表6所示,结果表明rsd为0.8%,说明本发明方法番茄红素精密度良好。表6番茄红素精密度试验7、重复性试验分别取番茄红素胶囊供试品样品6份,按“4.供试品溶液的制备”项下方法依本发明方法制备供试品溶液。分别精密吸取以上供试品溶液各5μl,注入液相色谱仪,测定,记录峰面积。其中,第一份茄红素胶囊供试品的出峰情况如图5所示,出峰时间在2.847min,图1中番茄红素标准品的出峰时间为2.864min。按标准曲线法计算含量,番茄红素胶囊重复性试验结果如表7所示,结果表明rsd值为0.18%。表7番茄红素胶囊重复性试验8、稳定性试验以“7.重复性试验”中番茄红素胶囊第一份供试品溶液为研究对象,在0、2、4、6、8、10、12小时分别进样,每次精密吸取5μl,注入液相色谱仪,测定,记录峰面积,番茄红素胶囊稳定性试验结果如表8所示,结果表明rsd值为1.1%。表8番茄红素胶囊稳定性试验9、加样回收率试验取番茄红素胶囊样品9份,每份约50mg,均为精密称定,置于100ml棕色容量瓶中,分别精密加入15.86mg/ml番茄红素对照品溶液0.8ml、1.0ml、1.2ml,按“4.供试品溶液”的制备方法制备3个不同浓度的供试品溶液,依本发明方法测定。番茄红素胶囊加样回收率试验如表9所示,计算得到番茄红素平均回收率为99.7%,rsd值为0.9%。计算方法为:理论量(g)=称样量(g)×重复性实验平均含量(g/100g)表9番茄红素胶囊加样回收率试验测试例3不同色谱条件对高效液相色谱峰值的影响探究分别采用应用实施例3的方法处理四份包埋后的番茄红素待测样品(产品名称:10%番茄红素微囊,批号:3-0141-180108,生产单位:晨光生物科技集团股份有限公司),得到待测液1、待测液2、待测液3和待测液4,再分别通过高效液相色谱法分离检测待测液1、待测液2、待测液3和待测液4中的番茄红素,其中:待测液1:流动相为体积比为90:10的二氯甲烷和甲醇;流速为1.0ml/min,进样量为10μl;待测液2:流动相为体积比为90:10的二氯甲烷和甲醇;流速为0.5ml/min,进样量为5μl;待测液3:流动相为体积比为60:40的二氯甲烷和甲醇;流速为0.8ml/min,进样量为5μl;待测液4:流动相为体积比为10:90的二氯甲烷和甲醇;流速为0.8ml/min,进样量为5μl;其他实验步骤、实验条件以及色谱条件都同应用实施例3。待测液1中番茄红素的高效液相色谱图如图7所示,待测液2中番茄红素的高效液相色谱图如图8所示,待测液3中番茄红素的高效液相色谱图如图9所示,待测液4中番茄红素的高效液相色谱图如图10所示,由高效液相色谱图结果显示,与本发明应用实施例3相比,待测液1检测的流速过高,进样量过大,结果导致虽出峰时间快,但柱载量过高、色谱峰峰形分叉,待测液2检测的流速低于0.6ml/min,结果导致色谱峰峰形严重分叉,待测液3流动相为体积比为60:40的二氯甲烷和甲醇,结果出现两个色谱峰,无法判定番茄红素是哪个峰,待测液3流动相为体积比为10:90的二氯甲烷和甲醇,结果导致出峰时间延长,出现肩峰,不利于检测。以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本
技术领域:
的普通技术人员来说许多修改和变更都是显而易见的。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1