胰蛋白酶及其酶原的纯度检测方法与流程
本发明涉及药物分析检测领域,具体涉及一种胰蛋白酶及其酶原的纯度检测方法。
背景技术:
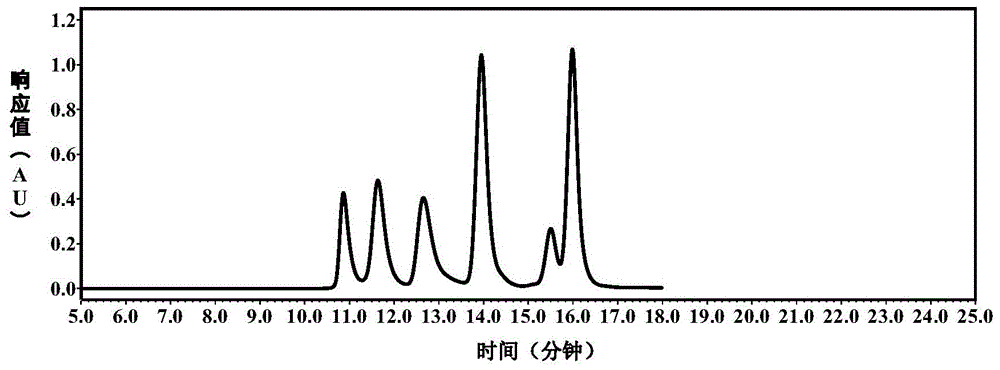
:胰蛋白酶及其酶原是胰脏中较为重要的生物活性物质,在胰脏中它们均以酶原的形式存在,其相对分子量在23.8kda。目前检测胰蛋白酶纯度的方法参照美国药典usp38中收录的反相色谱方法,参照该法进行胰蛋白酶纯度测试时,发现以动物胰脏为原料制备得到的胰蛋白酶中常含有多种不同分子量的杂质,其中部分杂质在反相色谱中的保留时间与主成份相似,无法与主成份进行有效分离。目前,采用体积排阻色谱法对胰蛋白酶及其酶原进行纯度检测的方法尚未见报道。因此,开发一种分离度好,快速,准确,对胰蛋白酶及其酶原进行纯度检测的有效方法,对药物质量控制和终产品质量的评价具有重要的意义。技术实现要素:本发明所要解决的技术问题在于克服现有技术中采用反相色谱法对胰蛋白酶进行纯度检测的方法无法有效分离胰蛋白酶及其酶原的主成分峰与周围杂质峰,导致检测结果偏高的缺陷,而提供一种胰蛋白酶及其酶原的纯度检测方法,该纯度检测方法具有分离度好、简单快速、专属性强、准确度高、重复性好、在相对分子质量为3.5kd~48kd范围内线性良好等特点;在含胰蛋白酶及其酶原的原料药合成工艺和制剂工艺中,可用于过程质量控制和终产品质量评价。目前,采用体积排阻色谱法对胰蛋白酶及其酶原进行纯度检测的方法尚未见报道。在2003年国家食品药品监督管理局颁布的《胸腺肽质量标准》、中国药典2015版垂体后叶注射液以及王吉等人撰写的《体积排阻色谱法测定胸腺肽分子量标准曲线变化的优化》中均报道了选用分子量低于14kda的核糖核酸酶标准品、人胰岛素标准品、胸腺肽α-1标准品和生长激素释放抑制因子标准品制作标准曲线的方法。制作标准曲线时,均使用不同比例的三氟乙酸-乙腈-水作为流动相。本发明人发现采用上述方法,选用鸡血清白蛋白标准品(44.287kda)、胰蛋白酶标准品、核糖核酸酶a标准品、人胰岛素标准品、胸腺肽α-1标准品和生长激素释放抑制因子标准品制作标准曲线时,都无法将鸡血清白蛋白标准品、核糖核酸酶a标准品和胰蛋白酶标准品有效分离。本发明人通过创造性的实验来改善洗脱液的成分和配比,提供了一种分离度好、专属性强且标准曲线线性良好的检测方法。同时,发现卤素离子的浓度影响分离效果,当卤素离子的浓度大于8mm时,会导致胸腺肽α-1标准品与生长激素释放抑制因子标准品的峰完全重合,当卤素离子的浓度小于3mm时,会导致胰蛋白酶标准品、核糖核酸酶a标准品和生长激素释放抑制因子标准品的分离度小于1.5。当流动相a的ph值小于1.7时,易破坏色谱柱内部填料的结构,当流动相a的ph值大于2.1时,会导致各标准峰之间分离度变小,甚至出现峰重合的现象。本发明是通过以下技术方案解决上述技术问题的。本发明提供了一种胰蛋白酶及其酶原的纯度检测方法,其包括以下步骤:将供试品溶液经体积排阻色谱法联合紫外检测法进行检测,即可;所述的体积排阻色谱法中的洗脱液包括流动相a和流动相b;所述的流动相a为含有卤素离子的三氟乙酸水溶液,所述流动相a的ph值为1.7~2.1;所述的流动相a中,所述的卤素离子的浓度为3~8mm,不包括8mm;所述的流动相b为腈类溶剂;所述的流动相a与所述的流动相b的体积比为35:65~65:35。本发明中,采用所述体积排阻色谱法联合紫外检测法得到“胰蛋白酶和/或胰蛋白酶原”的峰面积和供试品的总峰面积。本发明中,所述胰蛋白酶及其酶原的纯度为所述胰蛋白酶和/或所述胰蛋白酶原的峰面积除以所述供试品的总峰面积。本发明中,所述的胰蛋白酶及其酶原是指的所述的胰蛋白酶和胰蛋白酶原。所述的流动相a与所述的流动相b的体积比较佳地为51:49~50:50。所述的流动相a的ph较佳地为1.8~2.0,更佳地为1.9。所述的流动相a较佳地为含有氯离子的三氟乙酸水溶液。所述的三氟乙酸水溶液中的水可为本领域高效液相色谱中常用的水。所述的卤素离子可为本领域常规的卤素离子,较佳地为氯离子和/或溴离子。所述的卤素离子的浓度较佳地为3~4mm,例如4mm。所述的卤素离子一般来源于含卤素的盐或酸。当卤素离子为氯离子时,所述的氯离子来源于盐酸、氯化钾和氯化钠中的一种或多种。当卤素离子为溴离子时,所述的溴离子来源于溴化钾和/或溴化钠。所述的腈类溶剂可采用本领域高效液相色谱中常用的腈类溶剂,一般为乙腈。所述的供试品溶液在进样前较佳地进行过滤处理。所述过滤处理可采用本领域常规使用的微孔滤膜。所述微孔滤膜的膜孔径较佳地为0.22μm。所述的供试品溶液中的溶剂一般能使所述的供试品溶液中的供试品溶解即可,例如,“ph为1.7~1.9的硫酸水溶液”和/或乙腈;当所述的供试品溶液中的溶剂为“ph为1.7~1.9的硫酸水溶液”和乙腈的混合液时,硫酸水溶液与乙腈的体积比可为100:0~35:65。所述的供试品溶液中的供试品可为含有“胰蛋白酶和/或胰蛋白酶原”的原料药或制剂;在一较佳实施方案中,所述的供试品溶液中的供试品为内蒙古通牧牛羊生物科技有限公司生产的型号为jn201807001y的胰蛋白酶原或上海上药第一生化药业有限公司生产的型号为1810901的注射用胰蛋白酶。所述的供试品溶液中供试品的浓度可为本领域该类方法常规浓度,例如,0.1~1.0mg/ml。所述的供试品溶液中胰蛋白酶及其酶原的浓度可为39.70μg/ml~794.0μg/ml。所述的体积排阻色谱法可在本领域常规使用的高效液相色谱仪中进行,例如厂家为waters的型号为alliancee2695的高效液相色谱仪。所述的体积排阻色谱法中的色谱柱可为硅胶色谱柱,较佳地为tskgelg2000swxl色谱柱。所述的色谱柱的规格可为本领域常规分析柱规格,可选择以下规格的色谱柱:所述的色谱柱的填料颗粒度可为3~5μm,较佳地为5μm。所述的色谱柱的长度可为300~600mm,较佳地为300mm或250mm。所述的色谱柱的内径可为1.0~7.8mm,较佳地为7.8mm或4.6mm。所述的体积排阻色谱法的进样体积可为0.1~100μl,较佳地为20μl。所述的体积排阻色谱法中的柱温可为本领域该类操作的常规温度,较佳地为20~30℃。所述的体积排阻色谱法中的样品室温度可为10~15℃。所述的体积排阻色谱法中的洗脱方式较佳地为等度洗脱。所述的洗脱液的流速可为本领域常规的流速,较佳地为0.35~0.8ml/min,更佳地为0.5ml/min。所述的紫外检测法可在本领域常规使用的与高效液相色谱联用的紫外检测器中进行,例如厂家为waters的型号为2489的紫外检测器。所述的紫外检测法的检测波长较佳地为214nm。在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。本发明所用试剂和原料均市售可得。本发明的积极进步效果在于:本发明的胰蛋白酶及其酶原的纯度检测方法具有快速、分离度好、专属性强、准确度高、重复性好、在分子量为3.5kd~48kd范围内线性良好等特点,在胰蛋白酶及其酶原的原料药合成工艺和制剂工艺中,可用于过程质量控制和终产品的质量评价,实用性强。附图说明图1为实施例1中标准品混合液的hplc图;图2为实施例2中标准品混合液的hplc图;图3为实施例3中标准品混合液的hplc图;图4为实施例3中胰蛋白酶原产品的hplc图;图5为实施例3中注射用胰蛋白酶产品的hplc图;图6为实施例4中标准品混合液的hplc图;图7为对比实施例1中标准品混合液的hplc图;图8为对比实施例1中胰蛋白酶原产品的hplc图;图9为对比实施例1中注射用胰蛋白酶产品的hplc图;图10为对比实施例2中标准品混合液的hplc图;图11为对比实施例3中标准品混合液的hplc图;图12为对比实施例4中标准品混合液的hplc图;图13为对比实施例5中标准品混合液的hplc图;图14为对比实施例6中标准品混合液的hplc图;图15为对比实施例7中标准品混合液的hplc图;图16为对比实施例8中标准品混合液的hplc图;图17为对比实施例9中标准品混合液的hplc图;图18为对比实施例10中标准品混合液的hplc图;图19为对比实施例11中标准品混合液的hplc图;图20为效果实施例1中注射用胰蛋白酶产品的hplc图;图21为效果实施例3中以线性溶液的浓度为横坐标,主峰峰面积为纵坐标的线性回归线。具体实施方式下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。一、试剂和设备乙腈购自fisher公司的hplc级乙腈;三氟乙酸购自tedia公司的hplc级三氟乙酸;盐酸、氯化钠、氯化钾、溴化钠、溴化钾均购自国药集团化学试剂有限公司;鸡血清白蛋白标准品(slbl9222v)、胰蛋白酶标准品(slbl9512v)购自sigma公司;核糖核酸酶a标准品(140653)、人胰岛素标准品(140654)、胸腺肽α-1标准品(140655)、生长激素释放抑制因子标准品(140656)购自中国食品药品检定研究院;牛血清白蛋白标准品(wxbc7359v)购自sigma公司;牛胰岛素标准品(h2143)购自西亚试剂;胰蛋白酶原(jn201807001y)购自内蒙古通牧牛羊生物科技有限公司;注射用胰蛋白酶(1810901,规格12500u)购自上海上药第一生化药业有限公司;高效液相色谱仪购自waters公司的型号为alliancee2695的高效液相色谱仪;紫外检测器购自waters公司的型号为2489的紫外检测器;色谱柱为tskgelg2000swxl色谱柱;数据处理系统为empower3数据处理系统。二、标准曲线的测定方法:体积排阻色谱分离原理为以多孔性凝胶为固定相,被广泛应用于高分子量物质的分离及分子量测定。在洗脱过程中,样品中的大分子由于无法进入凝胶孔洞而只能沿多孔凝胶粒子之间的空隙通过色谱柱,最先从柱中被洗脱出来;中等大小的分子可以进入一些适当的孔洞中,受到轻微滞留后较慢地被洗脱出来;小分子则可进入绝大部分孔洞,由于受到更强的滞留,最后被洗脱出来。本领域技术人员均知,可利用绘制标准曲线的方法证明该体积排阻色谱法联合紫外检测法的可行性。即选取相对分子质量可覆盖待测品的相对分子质量的标准品,并配置成标准品混合液,采用体积排阻色谱法联合紫外检测法测试标准品混合液中各标准品的保留时间,以各标准品的保留时间为横坐标,以各标准品对应的相对分子质量取10为底的对数值为纵坐标,制得标准曲线,计算标准曲线的r值;当标准曲线的r值大于等于0.99时,可保证采用上述方法测试相对分子质量在该范围内的物质的保留时间时,相对分子质量相对较大的物质先出峰,相对分子质量相对较小的物质后出峰,进一步证明测试方法的可行性。下述实施例中,标准品的选择可根据本领域常规,标准品的相对分子质量可覆盖待测品的相对分子质量,本发明中标准品的相对分子质量独立地较佳地在3.5kd~48kd范围内,独立地更佳地在3.8kd~44kd范围内。其中,标准品可为核糖核酸酶a标准品、人胰岛素标准品、胸腺肽α-1标准品、生长激素释放抑制因子标准品、胰蛋白酶标准品或鸡血清白蛋白标准品中的至少五种。标准品混合液的制备方法包括:称取各标准品,分别配制一定浓度的标准品溶液,将配制的各标准品溶液混合,得标准品混合液,较佳地,将配制的各标准品溶液等体积混合,得标准品混合液。各标准品溶液的配制可采用能将标准品溶解的常规溶剂或溶液,较佳地为ph为1.7-2.1的硫酸水溶液,更佳地为ph为1.9的硫酸水溶液。标准品混合液中各标准品的浓度可为本领域制作该类标准曲线时的常规浓度,例如1.3~2.4mg/ml。当标准品为核糖核酸酶a标准品、人胰岛素标准品、胸腺肽α-1标准品或生长激素释放抑制因子标准品时,标准品混合液中各标准品的浓度较佳地为1.3mg/ml。当标准品为鸡血清白蛋白标准品或胰蛋白酶标准品时,标准品混合液中标准品的浓度较佳地为2.4mg/ml。三、实施例1~4、对比实施例1~11和效果实施例1~3实施例1标准曲线的测定体积排阻色谱法联合紫外检测法的实验条件:色谱柱为tskgelg2000swxl色谱柱,色谱柱的填料颗粒度5μm,色谱柱内径为4.6mm,色谱柱的柱长为250mm。流动相a为含有盐酸的三氟乙酸水溶液,流动相a的ph值为1.9,氯离子的浓度为4mm;流动相b为乙腈。流动相a与流动相b的体积比为50:50。洗脱方式为等度洗脱,洗脱液的流速为0.5ml/min,柱温为25℃,样品室温度为15℃,紫外检测法中的检测波长为214nm。实验步骤:分别称取核糖核酸酶a标准品、人胰岛素标准品、胸腺肽α-1标准品、生长激素释放抑制因子标准品2.0mg,分别置于四个离心管中,每个离心管中加入1.5ml的ph为1.9的硫酸水溶液,混匀,制得各标准品溶液;分别称取鸡血清白蛋白标准品、胰蛋白酶标准品3.6mg,分别置于两个离心管中,每个离心管中加入1.5ml的ph为1.9的硫酸水溶液,混匀,制得各标准品溶液;将制得的各标准品溶液等体积混合制得标准品混合液;将制得的标准品混合液经0.22μm微孔滤膜过滤,精密吸取20μl注入高效液相色谱仪中,采用体积排阻色谱法联合紫外检测法检测,记录色谱图,如图1所示。分别计算各标准品的相对分子质量取10为底的对数值(y),作为标准曲线的纵坐标;记录各标准品的保留时间(x),作为标准曲线的横坐标,得到的标准曲线为y=-3.7816x+28.3275,r=0.9945。记录各标准品的峰宽,计算分离度,分离度等于相邻色谱峰保留时间之差与两色谱峰峰宽均值之比,结果见表1所示。表1注:表1中“--”表示代表无分离度,分离度为当前峰和前一个峰之间的关系,鸡血清白蛋白为第一个出峰,无分离度;表1中“lgm”表示相对分子质量取10为底的对数值,m代表相对分子质量。结果表明,标准曲线的r≥0.99,线性良好,且核糖核酸酶a标准品、人胰岛素标准品、胸腺肽α-1标准品和胰蛋白酶标准品的分离度均大于1.5,分离度良好,专属性强。实施例2标准曲线的测定体积排阻色谱法联合紫外检测法的实验条件:采用与实施例1类似的实验条件进行实验。不同之处仅在于:流动相a为含有溴化钾的三氟乙酸水溶液,流动相a的ph为1.9,溴化钾的浓度为4mm。实验步骤:实验步骤同实施例1,记录色谱图,如图2所示。分别计算各标准品相对分子质量取10为底的对数值(y),作为标准曲线的纵坐标;记录各标准品的保留时间(x),作为标准曲线的横坐标,得到的标准曲线为y=-4.0090x+29.4009,r=0.9945。记录各标准品的峰宽,计算分离度,分离度等于相邻色谱峰保留时间之差与两色谱峰峰宽均值之比,结果见表2所示。表2结果表明,标准曲线的r≥0.99,线性良好,核糖核酸酶a标准品、人胰岛素标准品、胸腺肽α-1标准品和胰蛋白酶标准品的分离度均大于1.5,分离度良好,专属性强。实施例3标准曲线的测定和纯度测定1、标准曲线的测定体积排阻色谱法联合紫外检测法的实验条件:采用与实施例1类似的实验条件进行实验。不同之处仅在于:流动相a为含有氯化钠的三氟乙酸水溶液,流动相a的ph为1.9,氯化钠的浓度为4mm。实验步骤:绘制标准曲线的实验步骤同实施例1,记录色谱图,如图3所示。分别计算各标准品相对分子质量取10为底的对数值(y),作为标准曲线的纵坐标;记录各标准品的保留时间(x),作为标准曲线的横坐标,得到的标准曲线为y=-4.1335x+30.0622,r=0.9945。记录各标准品的峰宽,计算分离度,分离度等于相邻色谱峰保留时间之差与两色谱峰峰宽均值之比,结果见表3所示。表3结果表明,标准曲线的r≥0.99,线性良好,核糖核酸酶a标准品、人胰岛素标准品和胰蛋白酶标准品的分离度均大于1.5,分离度良好,专属性强。胸腺肽α-1标准品峰与生长激素释放抑制因子标准品峰未分离,软件系统无法计算胸腺肽α-1标准品与人胰岛素标准品的分离度。2、纯度检测利用本实施例中测定标准曲线的体积排阻色谱法联合紫外检测法的实验条件分别测试内蒙古通牧牛羊生物科技有限公司生产的批号为jn201807001y的胰蛋白酶原产品中胰蛋白酶原的纯度和上海上药第一生化药业有限公司生产的注射用胰蛋白酶产品中胰蛋白酶的纯度,具体步骤如下:称取适量胰蛋白酶原产品、注射用胰蛋白酶产品分别置于离心管中,每个离心管中加入ph为1.9的硫酸水溶液溶解,使得目标响应值与标准曲线中胰蛋白酶标准品响应值接近,混匀,制得供试品溶液。采用体积排阻色谱法联合紫外检测法检测各供试品溶液中待测品的峰面积和供试品的总峰面积,检测得到的胰蛋白酶原产品的色谱图见图4,检测得到的注射用胰蛋白酶产品的色谱图见图5;按照面积归一化法计算待测品的纯度。具体数值请见表4。表4供试品名称待测品的峰面积供试品的总峰面积纯度胰蛋白酶原产品128065811367598493.64%注射用胰蛋白酶产品116274211596757672.82%实施例4标准曲线的测定体积排阻色谱法联合紫外检测法的实验条件:采用与实施例1类似的实验条件进行实验。不同之处仅在于:流动相a为含有氯化钠的三氟乙酸水溶液,流动相a的ph为2.0,氯化钠的浓度为3mm。实验步骤:绘制标准曲线的实验步骤同实施例1,记录色谱图,如图6所示。分别计算各标准品相对分子质量取10为底的对数值(y),作为标准曲线的纵坐标;记录各标准品的保留时间(x),作为标准曲线的横坐标,得到的标准曲线为y=-3.8968x+29.0533,r=0.9938,记录各标准品的峰宽,计算分离度,分离度等于相邻色谱峰保留时间之差与两色谱峰峰宽均值之比,结果见表5所示。表5标准品名称保留时间/min峰宽分离度鸡血清白蛋白标准品11.14879--胰蛋白酶标准品11.888551.52核糖核酸酶a标准品12.713871.62人胰岛素标准品14.272783.28胸腺肽α-1标准品15.830563.83生长激素释放抑制因子标准品16.386901.38结果表明,标准曲线的r≥0.99,线性良好,胰蛋白酶标准品、核糖核酸酶a标准品、人胰岛素标准品和胸腺肽α-1标准品的分离度均大于1.5,分离度良好,专属性强。对比实施例1以2015版中国药典“垂体后叶注射液”高分子量物质测定方法测定标准曲线1、标准曲线的测定实验条件:采用2015版中国药典“垂体后叶注射液”高分子量物质测定方法,采用核糖核酸酶a标准品、人胰岛素标准品、胸腺肽α-1标准品、生长激素释放抑制因子标准品、胰蛋白酶标准品和鸡血清白蛋白标准品制作标准曲线。实验步骤:实验步骤同实施例1,记录色谱图,如图7所示,鸡血请白蛋白标准品、胰蛋白酶标准品、核糖核酸酶a标准品的峰重叠严重。结果表明,本方法无法将各标准品有效的分离开,无法绘制标准曲线并计算r值。2、纯度检测利用本实施例中测定标准曲线的方法的实验条件分别测试内蒙古通牧牛羊生物科技有限公司生产的型号为jn201807001y的胰蛋白酶原产品中胰蛋白酶原的纯度和上海上药第一生化药业有限公司生产的注射用胰蛋白酶产品中胰蛋白酶的纯度,具体步骤如下:称取适量胰蛋白酶原产品、注射用胰蛋白酶产品分别置于离心管中,每个离心管中加入ph为1.9的硫酸水溶液溶解,使得目标响应值标曲中胰蛋白酶标准品响应值接近,混匀,制得供试品溶液。采用体积排阻色谱法联合紫外检测法检测各供试品溶液中待测品的峰面积和供试品的总峰面积,检测得到的胰蛋白酶原产品的色谱图见图8,检测得到的注射用胰蛋白酶产品的色谱图见图9;按照面积归一化法计算待测品的纯度。具体数值请见表6。表6供试品名称待测品的峰面积供试品的总峰面积纯度胰蛋白酶原8996068934928996.22%注射用胰蛋白酶123068951426115886.30%结果可看出,测得胰蛋白酶原产品中胰蛋白酶原的纯度和注射用胰蛋白酶中胰蛋白酶的纯度均比实施例3测得纯度高,进一步证明了鸡血请白蛋白标准品、胰蛋白酶标准品和核糖核酸酶a标准品的峰分离效果不理想,重叠严重。对比实施例2流动性a中不含有卤素离子实验条件:采用与实施例1类似的实验条件进行实验。不同之处仅在于:流动相a为三氟乙酸水溶液,流动相a的ph为1.9,流动相b为乙腈,流动相a与流动相b的体积比为50:50。实验步骤:实验步骤同实施例1,记录色谱图,如图10所示。分别计算各标准品相对分子质量取10为底的对数值(y),作为标准曲线的纵坐标;记录各标准品的保留时间(x),作为标准曲线的横坐标,得到的标准曲线为y=-3.2967x+25.8649,r=0.9903。记录各标准品的峰宽,计算分离度,分离度等于相邻色谱峰保留时间之差与两色谱峰峰宽均值之比,结果见表7所示。表7标准品名称保留时间/min峰宽分离度鸡血清白蛋白标准品10.83148--胰蛋白酶标准品11.335351.11核糖核酸酶a标准品11.924721.04人胰岛素标准品13.278712.50胸腺肽α-1标准品14.671542.84生长激素释放抑制因子标准品15.247921.22结果表明,虽然该方法制得标准曲线的线性良好,但仅有人胰岛素标准品和胸腺肽α-1标准品的分离度大于1.5,胰蛋白酶标准品、生长激素释放抑制因子标准品和核糖核酸酶标准品的分离度均小于1.5,分离效果较差。对比实施例3以盐酸代替三氟乙酸调节流动相a的ph实验条件:采用与实施例1类似的实验条件进行实验。不同之处仅在于:流动相a为盐酸水溶液,用盐酸调节流动相a的ph至1.9,不添加三氟乙酸,氯离子浓度为12.6mm。流动相b为乙腈,流动相a与流动相b的体积比为50:50。实验步骤:实验步骤同实施例1,记录色谱图,如图11所示,六种标准品只出四个峰,可见该方法分离效果较差。对比实施例4以磷酸代替三氟乙酸调节流动相a的ph实验条件:采用与实施例1类似的实验条件进行实验。不同之处仅在于:流动相a为磷酸水溶液,用磷酸调节流动相a的ph至1.9,不添加三氟乙酸。流动相b为乙腈,流动相a与流动相b的体积比为50:50。实验步骤:实验步骤同实施例1,记录色谱图,如图12所示,六种标准品只出两个峰,可见该方法分离效果较差。对比实施例5以硫酸代替三氟乙酸调节流动相a的ph实验条件:采用与实施例1类似的实验条件进行实验。不同之处仅在于:流动相a为硫酸水溶液,用硫酸调节流动相a的ph至1.8,不添加三氟乙酸。流动相b为乙腈,流动相a与流动相b的体积比为50:50。实验步骤:实验步骤同实施例1,记录色谱图,如图13所示,六种标准品只出三个峰,可见该方法分离效果较差。对比实施例6以甲酸代替三氟乙酸调节流动相a的ph实验条件:采用与实施例1类似的实验条件进行实验。不同之处仅在于:流动相a为甲酸水溶液,用甲酸调节流动相a的ph至2.0,不添加三氟乙酸。流动相b为乙腈,流动相a与流动相b的体积比为50:50。实验步骤:实验步骤同实施例1,记录色谱图,如图14所示,六种标准品峰几乎无响应。对比实施例7以乙醇代替乙腈作为流动相b实验条件:采用与实施例1类似的实验条件进行实验。不同之处仅在于:流动相a为三氟乙酸水溶液,流动相a的ph为2.1。流动相b为乙醇,流动相a与流动相b的体积比为65:35,色谱柱的柱长为500mm。实验步骤:实验步骤同实施例1,记录色谱图,如图15所示。结果表明,分离效果较差,无法绘制标准曲线并计算r值。对比实施例8流动相a的ph为3.0实验条件:采用与实施例1类似的实验条件进行实验。不同之处仅在于:流动相a为含有氯化钠的三氟乙酸水溶液,流动相a的ph为3.0,氯化钠的浓度为3mm。实验步骤:实验步骤同实施例1,记录色谱图,如图16所示。结果表明,各个色谱峰之间无法分离,无法绘制标准曲线并计算r值。对比实施例9卤素离子的浓度为0.8mm实验条件:采用与实施例1类似的实验条件进行实验。不同之处仅在于:流动相a为含有溴化钾的三氟乙酸水溶液,流动相a的ph为1.9,溴化钾的浓度为0.8mm。实验步骤:实验步骤同实施例1,记录色谱图,如图17所示。分别计算各标准品相对分子质量取10为底的对数值(y),作为标准曲线的纵坐标;记录各标准品的保留时间(x),作为标准曲线的横坐标,得到的标准曲线为y=-3.4557x+26.6507,r=0.0.9917。记录各标准品的峰宽,计算分离度,分离度等于相邻色谱峰保留时间之差与两色谱峰峰宽均值之比,结果见表8所示。表8标准品名称保留时间/min峰宽分离度鸡血清白蛋白标准品10.85685--胰蛋白酶标准品11.424391.27核糖核酸酶a标准品12.072741.20人胰岛素标准品13.484752.73胸腺肽α-1标准品14.917543.04生长激素释放抑制因子标准品15.491901.25结果表明,虽然该方法制得标准曲线的线性良好,但仅有人胰岛素标准品和胸腺肽α-1标准品的分离度大于1.5,胰蛋白酶标准品、生长激素释放抑制因子标准品和核糖核酸酶标准品的分离度均小于1.5,分离效果较差。对比实施例10实验条件:采用与实施例1类似的实验条件进行实验。不同之处仅在于:流动相a为含有氯化钠的三氟乙酸水溶液,流动相a的ph为2.0,氯化钠的浓度为8mm。实验步骤:实验步骤同实施例1,记录色谱图,如图18所示。分别计算各标准品相对分子质量取10为底的对数值(y),作为标准曲线的纵坐标;记录各标准品的保留时间(x),作为标准曲线的横坐标,得到的标准曲线为y=-4.3431x+31.5943,r=0.9875。记录各标准品的峰宽,计算分离度,分离度等于相邻色谱峰保留时间之差与两色谱峰峰宽均值之比,结果见表9所示。表9结果表明,虽然采用该方法胰蛋白酶标准品和核糖核酸酶a标准品的分离度大于1.5,但制得标准曲线的线性相对较差,r<0.99,人胰岛素标准品的分离度小于1.5,胸腺肽α-1标准品和生长激素释放抑制因子标准品的两个色谱峰大面积重叠,分离效果较差。对比实施例11卤素离子的浓度为10mm实验条件:采用与实施例1类似的实验条件进行实验。不同之处仅在于:流动相a为含有氯化钠的三氟乙酸水溶液,流动相a的ph为2.0,氯化钠的浓度为10mm。实验步骤:实验步骤同实施例1,记录色谱图,如图19所示。记录各标准品的峰宽,计算分离度,分离度等于相邻色谱峰保留时间之差与两色谱峰峰宽均值之比,结果见表10所示。表10结果表明,该方法无法绘制标准曲线,仅有胰蛋白酶标准品和核糖核酸酶a标准品的分离度大于1.5,人胰岛素标准品的分离度均小于1.5,胸腺肽α-1标准品和生长激素释放抑制因子标准品的两个色谱峰完全重叠,分离效果较差,无法绘制标准曲线并计算r值。效果实施例1实验条件:采用与实施例3相同的实验条件进行实验。利用上述体积排阻色谱法联合紫外检测法的实验条件检测上海上药第一生化药业有限公司生产的注射用胰蛋白酶产品中胰蛋白酶的纯度,具体步骤如下:称取适量注射用胰蛋白酶产品分别置于离心管中,每个离心管中加入ph为1.9的硫酸水溶液溶解,使得目标响应值标曲中胰蛋白酶标准品响应值接近,混匀,制得供试品溶液。采用体积排阻色谱法联合紫外检测法检测各供试品溶液中待测品的峰面积和供试品的总峰面积,调整进样量为5μl、10μl或20μl,每种进样量下重复进样两次实验,检测得到的注射用胰蛋白酶产品的色谱图见图20,图20中自上而下分别对应编号1-6的色谱曲线,结果见表11。表11结果表明,调整进样量,共重复进行6次测定,待测品对应的保留时间的相对标准偏差rsd%=0.13%(rsd%<1%),测得的待测品的纯度的rsd%=0.78%(rsd%<2%),说明该检测方法具有良好的重复性。效果实施例2验证本发明检测方法的准确度体积排阻色谱法联合紫外检测法的实验条件:采用与实施例3相同的实验条件进行实验。溶液配制:(1)杂质储备液的配置:称取3.18mg牛血清白蛋白标准品和3.39mg牛胰岛素标准品置50ml容量瓶中,加入ph为1.9的硫酸水溶液溶解并稀释至刻度,即得。(2)线性储备液配制:精密称取39.70mg胰蛋白酶标准品,置10ml容量瓶中,加入ph为1.9的硫酸水溶液溶解并稀释至刻度,即得。(3)标准品混合液的配置:分别精确量取0.5ml线性储备液和1ml杂质储备液于5ml容量瓶中,加入ph为1.9的硫酸水溶液溶解并稀释至刻度,即得。(4)胰蛋白酶对照溶液配制:称取胰蛋白酶标准品3.53mg,置50ml容量瓶中,加入ph为1.9的硫酸水溶液溶解并稀释至刻度,摇匀后精密量取1ml至5ml的容量瓶中,加入ph为1.9的硫酸水溶液溶解并稀释至刻度,即得。采用本发明实施例3的测试方法测试标准品混合液中胰蛋白酶峰面积和杂质峰面积。利用公式c1=a1×f×c2/a2计算标准品混合液中牛血清白蛋白标准品和牛胰岛素标准品的浓度,结果见表12。其中,c1为标准品混合液中杂质标准品的浓度;a1为标准品混合液中杂质标准品的峰面积;c2为标准品混合液中胰蛋白酶标准品的浓度;a2为标准品混合液中胰蛋白酶标准品的峰面积;f为杂质校正因子与胰蛋白酶对照溶液校正因子的比值。校正因子f为相应成分的配制浓度与峰面积的比值。表12根据上述相关数据及公式进行计算:标准品混合液中牛血清白蛋白标准品的实际配置浓度为0.0127mg/ml,采用上述计算公式得浓度为670828×0.64×0.397/12908758=0.0132mg/ml,接近实际配制浓度。标准品混合液中牛胰岛素标准品的实际配置浓度为0.0136mg/ml,采用上述计算公式得到的浓度为945962×0.49×0.397/12908758=0.0143mg/ml,接近实际配制浓度。实验结果表明,采用本发明的方法可以准确检验出标准品混合液中引入的各杂质含量,即杂质与胰蛋白酶有效地分离开,间接证明本发明测试方法的可性能和准确性。效果实施例3供试品溶液中胰蛋白酶检测限的测定溶液配制:线性储备液配制:精密称取39.70mg胰蛋白酶标准品,置10ml容量瓶中,加入ph为1.9的硫酸水溶液溶解并稀释至刻度,即得。由线性储备液稀释成不同浓度线性溶液,并采用本发明实施例3的测试方法,测得不同浓度线性溶液中胰蛋白酶的峰面积平均值,结果见表13所示:表13以线性溶液的浓度为横坐标,线性溶液中胰蛋白酶的峰面积平均值为纵坐标绘制线性回归线,见图21;结果表明,胰蛋白酶在39.70μg/ml~794.0μg/ml的浓度范围内线性关系良好,线性回归方程为y=32630.8x-229680.5,在此范围内线性回归系数为0.9999。可见,供试品溶液中胰蛋白酶检测浓度范围为39.70μg/ml~794.0μg/ml。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1