一种血清淀粉样蛋白A和C反应蛋白的二合一质控物及其制备方法与流程
本发明涉及临床检测领域,尤其是涉及一种临床检测saa和crp时使用的血清淀粉样蛋白a和c反应蛋白的二合一质控物及其制备方法。
背景技术:
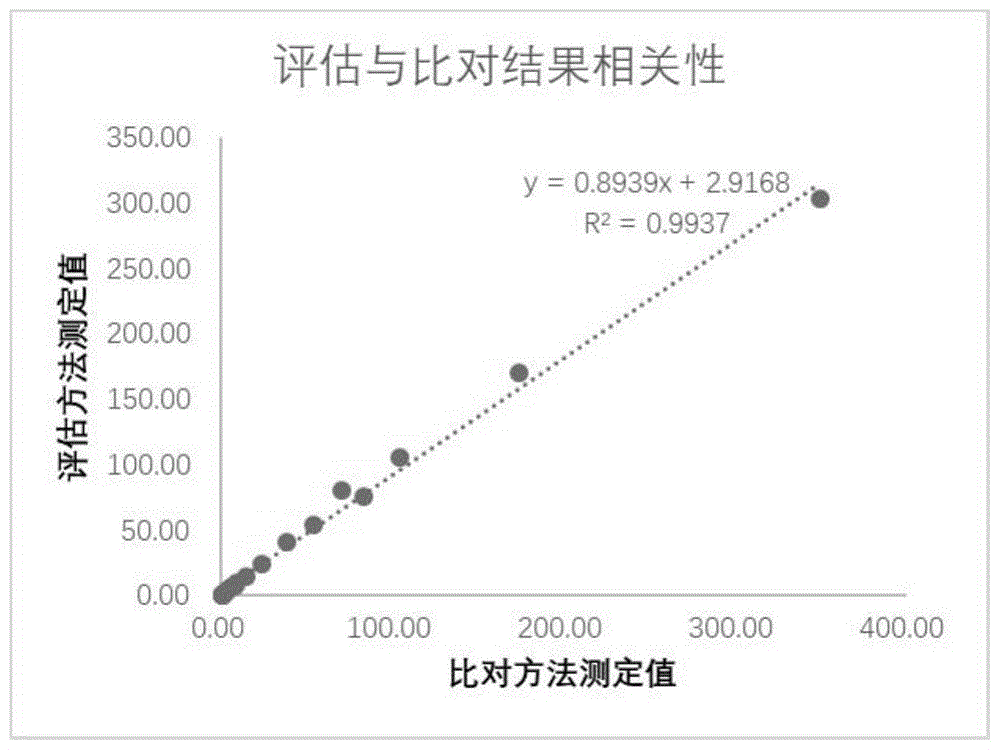
:c-反应蛋白:crp(c-reactiveprotein)是一种由肝脏生成出来的特殊蛋白,主要用作细菌感染和疾病活动性的指针。当体内有:急性炎症、细菌感染、大面积组织破坏、恶性肿瘤时,很快就会出现crp升高,而治愈时,又很快就降低到正常范围,这是一种急性期反应蛋白(acutephasereactantprotein)。在临床上,c-反应蛋白的检查主要用于诊断细菌感染以及受检者是否存在活动性疾病。常规crp对于感染的诊断和鉴别已经在临床上得到广泛的应用,目前对于crp与其他指标的联合应用也日益受到重视。血清淀粉样蛋白a:saa(serumamyloida)是组织淀粉样蛋白a的前体物质,属于急性时相反应蛋白。saa是血液中以低水平存在的正常组份。当人体有病毒或细菌感染性炎症、活动性病变、组织大面积损伤时很快升高。特别是在病毒急性感染时(48~72h)可迅速升高,并在疾病的恢复期迅速下降。因此saa是感染机体病毒时极有效的辅助诊断指标。saa、crp的组合检测更能体现优势互补。联合检测的特点和临床意义简述如下:saa在细菌和病毒感染的早期均可升高,而crp对病毒感染时一般不增高的特点,因此两者联合检测可对早期细菌和病毒感染的鉴别诊断提供有力的数据。例如两者均增高细菌感染的趋向性较大;而crp正常saa明显增高者,结合临床对病毒性感染的趋向性诊断又多了一份依据。特别是在婴幼儿感染性疾病的早期,细菌和病毒感染确是很难鉴别,所以saa和crp的联合检测比单独测crp或saa更有独特的意义。在目前的门急诊中有广泛的应用,特别对于即时检测(pointofcarepoct)的试剂盒,为了节约检测时间,常常需要用到联检试剂盒。但目前常用的控制saa和crp质控物多为单项质控物,很少有将这两项二合一的质控物。对于联合检测saa和crp的试剂盒缺少有效控制质量的手段。血清淀粉样蛋白a和c反应蛋白的二合一质控物,指的是在开展saa和crp的项目的系统上应用的一种验证性能特征的物质,在poct试剂盒的临床检测中有广泛的应用需求。目前市面上没有saa和crp二合一质控品,saa和crp联检的试剂盒缺少有效的质控手段。为了要长期保存,质控物都会做成冻干模式,但缺点在于1.不方便使用,需要复溶后才能使用,复溶的时间和环境都可能对结果产生影响;2.不能保证瓶间的均匀性,会对测试结果产生影响;3.复溶后不能长期保存,不能用于长期的室内质控。尤其是,多项复合质控品的冻品工艺复杂,用户使用不方便,仅适合生化免疫分析仪,缺少适合于poct系统的即开即用的质控品。申请号cn201910371360.5的专利文献公开一种炎症类标志物复合质控品及其制备方法与应用,上述复合质控品是以血清为基质,包含保护物质和炎症类标志物分析成分(crp、saa、pct、il-6、aso中的至少两种)。虽然这个试剂盒也包含saa和crp,但其直接用病人血清,有潜在的生物危害性,处理以及使用上均存在风险;而且需冻干保存,不能做到即开即用,使用不方便;仅适合生化免疫分析仪,不能应用于poct系统的各个技术平台例如荧光、乳胶、胶体金等平台。因此,提供一种稳定的液体血清淀粉样蛋白a和c反应蛋白的二合一质控物,已经成为本领域亟待解决的技术问题。技术实现要素:本发明所要解决的技术问题在于,提供一种血清淀粉样蛋白a以及c反应蛋白的二合一质控品,该质控品不仅能用于crp/saa在检测过程中的控制联检试剂盒质量,同时还具有生物安全性高、均匀性好、稳定性好等优势,适合于在poct/临床领域的推广和发展。为解决上述技术问题,本发明一方面提供采用一种血清淀粉样蛋白a和c反应蛋白的二合一质控品,以缓冲溶液为基质,其中含有以下组分:1)抗原:包括0.5-300mg/l的血清淀粉样蛋白a和0.5-300mg/l的c-反应蛋白;2)表面活性剂:包括质量体积百分浓度0.5%-5%的非离子型表面活性剂和质量体积百分浓度1%-10%的离子型表面活性剂;3)基质改善剂,质量体积百分浓度为1%-10%;4)生物灭活剂,质量体积百分浓度为0.01%-0.2%;所述缓冲溶液选自pb缓冲液、硼酸缓冲液、mopos缓冲液、tris-hcl缓冲液中的一种,所述缓冲液的浓度为10-150mmol/l。优选的,所述缓冲溶液的浓度为50mmol/l,所述基质改善剂的浓度为1%,所述非离子型表面活性剂浓度为1%,所述离子型表面活性剂浓度为1%。优选的,所述缓冲溶液的ph值为7.2±0.2。优选的,所述缓冲溶液为磷酸缓冲液,其浓度为50mmol/l,ph值为7.2。优选的,所述基质改善剂选自牛乳白蛋白、牛乳球蛋白、牛血清白蛋白、纤维蛋白原中的至少一种。优选的,所述非离子型表面活性剂选自聚乙二醇辛基苯基醚、烷基醇酰胺、脂肪醇聚氧乙烯醚、聚氧乙烯脱水山梨醇单月桂酸酯中的至少一种。优选的,所述离子型表面活性剂选自十二烷基苯磺酸钠、聚丙烯酰胺、溴化十六烷基三甲铵中的至少一种。优选的,所述生物灭活剂选自叠氮钠、庆大霉素、proclin300中的至少一种。为解决上述技术问题,本发明第二方面提供采用一种血清淀粉样蛋白a和c反应蛋白的二合一质控品的制备方法,包括步骤:(1)配制浓度为10-150mmol/l的缓冲溶液,所述缓冲溶液选自pb缓冲液、硼酸缓冲液、mopos缓冲液、tris-hcl缓冲液中的一种;向所述缓冲溶液中按质量体积百分浓度添加基质改善剂1%-10%,非离子型表面活性剂0.5%-5%,离子型表面活性剂1%-10%,生物灭活剂0.01%-0.2%,得到混合溶液;(2)取血清淀粉样蛋白a抗原和c反应蛋白抗原,添加至所述混合溶液,使血清淀粉样蛋白a抗原的终浓度为0.5-300mg/l,c-反应蛋白抗原的终浓度为0.5-300mg/l;(3)将步骤(2)所得溶液取样,采用血清淀粉样蛋白a检测试剂盒和c反应蛋白检测试剂盒重复测试多次,并分别计算血清淀粉样蛋白a及c反应蛋白的浓度测试结果均值。优选的,所述步骤(1)中,配制浓度为20mmol/l的pb缓冲液,ph值为7.2;按质量体积百分浓度添加bsa2.5%,聚乙二醇辛基苯基醚1%,十二烷基苯磺酸钠5%,叠氮钠0.1%。优选的,所述步骤(2)中,所述血清淀粉样蛋白a抗原和c反应蛋白抗原经复溶和/或稀释后,再添加至所述混合溶液中。优选的,所述步骤(2)的配制完成后,需在2天内完成分装,保存于2℃~8℃。优选的,所述步骤(3)中,测试结果与理论值偏差应在±15%以内,若不在范围内,可取适量配制所用的高浓度或稀释液进行调整至所需范围内。本发明中的生物灭活剂,是指添加于质控品中用于杀死质控品中的病原微生物,使病原微生物丧失感染能力,保留免疫原性的化学试剂或药物,也称灭活剂。所述生物灭活剂包括叠氮钠、庆大霉素、proclin300等试剂。本发明中的基质改善剂,是指添加于质控品中能改善质控品的基质效应以达到通用性要求的试剂。基质效应是指试剂中除分析物以外的组分常常对分析物的分析过程有显著的干扰,并影响分析结果的准确性,这些影响和干扰被称为基质效应。所述基质改善剂包括牛乳白蛋白、牛乳球蛋白、牛血清白蛋白、纤维蛋白原等。与现有技术相比较,本发明具有以下技术效果:本发明制备的saa和crp二合一质控物,不仅能对saa或者crp单项试剂盒进行有效的质量控制,更能对saa与crp联检的试剂盒在检测过程中提供质量保证。常规的质控品冻品工艺复杂,用户使用不方便,且大部分仅适合生化免疫分析仪,不适用于poct系统,而本发明提供适合poct系统的即开即用的液体质控品,通用性很好,能适合不同的检测平台,包括但不局限于胶体金平台,荧光平台,乳胶平台等。本发明经过大量筛选得到表面活性剂,能延长质控品的保存期限,保证液体质控品的稳定性。本发明中基质改善剂的加入,能有效改善二合一质控品的基质效应,达到通用性的要求,可广泛适用于胶体金平台,荧光平台,乳胶平台等poct系统及临床领域。附图说明图1为通过胶乳免疫比浊法测定crp时比对方法与评估方法的线性关系图(一)。图2为通过胶乳免疫比浊法测定crp时比对方法与评估方法基质效应评估图(二)。图3为通过胶乳免疫比浊法测定saa时比对方法与评估方法的线性关系图(一)。图4为通过胶乳免疫比浊法测定saa时比对方法与评估方法基质效应评估图(二)。图5为通过荧光免疫层析法测定crp时比对方法与评估方法的线性关系图(一)。图6为通过荧光免疫层析法测定crp时比对方法与评估方法基质效应评估图(二)。图7为通过荧光免疫层析法测定saa时比对方法与评估方法的线性关系图(一)。图8为通过荧光免疫层析法测定saa时比对方法与评估方法基质效应评估图(二)。图9为通过胶体金法测定crp时比对方法与评估方法的线性关系图(一)。图10为通过胶体金法测定crp时比对方法与评估方法基质效应评估图(二)。图11为通过胶体金法测定saa时比对方法与评估方法的线性关系图(一)。图12为通过胶体金法测定saa时比对方法与评估方法基质效应评估图(二)。图13为crp比对方法与评估方法的线性关系图(一)。图14为crp比对方法与评估方法基质效应评估图(二)。图15为saa比对方法与评估方法的线性关系图(一)。图16为saa比对方法与评估方法基质效应评估图(二)。图17为crp比对方法与评估方法的线性关系图(一)。图18为crp比对方法与评估方法基质效应评估图(二)。图19为saa比对方法与评估方法的线性关系图(一)。图20为saa比对方法与评估方法基质效应评估图(二)。图21为crp比对方法与评估方法的线性关系图(一)。图22为crp比对方法与评估方法基质效应评估图(二)。图23为saa比对方法与评估方法的线性关系图(一)。图24为saa比对方法与评估方法基质效应评估图(二)。图25为crp比对方法与评估方法的线性关系图(一)。图26为crp比对方法与评估方法基质效应评估图(二)。图27为saa比对方法与评估方法的线性关系图(一)。图28为saa比对方法与评估方法基质效应评估图(二)。图29为crp比对方法与评估方法的线性关系图(一)。图30为crp比对方法与评估方法基质效应评估图(二)。图31为saa比对方法与评估方法的线性关系图(一)。图32为saa比对方法与评估方法基质效应评估图(二)。具体实施方式下面将对本发明的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例一一种血清淀粉样蛋白a和c反应蛋白的二合一质控物及其制备方法,具体制备步骤为:(1)配制浓度为20mmol/l的pb缓冲液,ph值为7.2;按质量体积百分浓度添加bsa2.5%,聚乙二醇辛基苯基醚1%,十二烷基苯磺酸钠5%,叠氮钠0.1%。(2)根据标识规格将重组人血清淀粉样蛋白a1用纯化水复溶。将人c反应蛋白按标识复溶或直接稀释使用。根据小样试制时重组人血清淀粉样蛋白a1初赋值浓度xmg/l,人c反应蛋白初赋值浓度ymg/l配制6个浓度的质控品,浓度和配制量如下表:(3)质控品水平1~6配制完成后需在2天内完成分装,保存于2℃~8℃。(4)将配制好的质控品水平1~6,采用血清淀粉样蛋白a检测试剂盒和c反应蛋白检测试剂盒,重复测试3次,计算测试结果均值。测试结果与理论值偏差应在±15%以内,若不在范围可取适量配制所用的高浓度或稀释液进行调整至所需范围内。(5)质控品贴签与分装,储存条件及有效期:2℃~8℃条件下保存36个月。实施例二基质效应测试结果(1)准备实验样品按实施例一的方法配制6份制备样品,6份质控品的浓度分别为(crp浓度:0.5/10/50/100/200/300mg/l,saa浓度:0.5/10/50/100/200/300mg/l),和20份临床样品(来源于龙华医院)。(2)实验方法将制备样品与20份临床样品随机穿插排列,分别使用评估方法与比对方法测定所有样品,重复测定3批,每批每个样品测定1次,每批测定都需校准,评估方法与比对方法同步进行。其中,评估方法包括:血清淀粉样蛋白a测定试剂盒乳胶(胶乳免疫比浊法),血清淀粉样蛋白a(saa)测定试剂盒(胶体金法),血清淀粉样蛋白a测定试剂盒(荧光免疫层析法),全程c反应蛋白(hscrp+常规crp二合一)定量检测试剂盒(胶体金法),全程c反应蛋白(hscrp+常规crp二合一)定量检测试剂盒(胶乳免疫比浊法)。比对方法为:血清淀粉样蛋白a测定试剂盒(散射比浊法),西门子医学诊断产品(上海)有限公司。(3)数据分析利用临床样品及制备样品重复测定结果的均值作散点图,y轴为评估方法测定结果均值,x轴为比对方法测定结果均值,进行线性回归分析。用下列公式计算给定x值下(重复测量均值),临床样品评估方法测定均值y的双侧95%置信区间。式中:——根据回归曲线,计算出来的在x值的y值;n——新鲜患者样本数量;g——常数项,线性回归时为2,二次回归时为3;sy,x——回归标准误,计算公式为——x轴上第i个值(某样本比对方法测定均值);——y轴上第i个值(某样本评估方法测定均值);——所有样本比对方法测定均值的整体均值。利用以上方程,将比对方法测定均值作为x轴,计算每个制备样本的y值的95%置信区间,如果评估方法的测定均值落在该区间内,说明该制备样本对评估方法无基质效应,表明该物质在比对方法和评估方法间具有互通性。在散点图上,可将一系列临床样本的比对方法测定均值(x)与对应的y值的95%预测区间在回归线两边标记出来,若制备样品的点落在预测区间线条之外则说明存在基质效应。若制备样品的点在置信区间内,则表明不存在基质效应。(4)比对方法与评估方法测定结果以及直线回归结果20份临床样品和制备样品使用评估方法和比对方法进行测试,每批每个样品测试1次,记录测试结果。比对方法与评估方法测定结果以及直线回归结果如下所示:a1.乳胶平台:通过胶乳免疫比浊法测定crp,评估结果如表1所示,质控品1~6的判断结果均为无基质效应,有互换性。表1以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=0.8939x+2.9168,线性系数r2=0.9937,线性关系良好,如图1所示。在图1的基础上增加95%置信区间和质控品测定值,如图2所示,质控品1~6测定值均落入95%置信区间内。a2.乳胶平台:通过胶乳免疫比浊法测定saa,评估结果如表2所示,质控品1~6的判断结果均为无基质效应,有互换性。表2以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=1.0717x-4.3279,线性系数r2=0.9785,线性关系良好,如图3所示。在图3的基础上增加95%置信区间和质控品测定值,如图4所示,质控品1~6测定值均落入95%置信区间内。b1.荧光平台:通过荧光免疫层析法测定crp,评估结果如表3所示,质控品1~6的判断结果均为无基质效应,有互换性。表3以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=0.8724x+1.3419,线性系数r2=0.9966,线性关系良好,如图5所示。在图5的基础上增加95%置信区间和质控品测定值,如图6所示,质控品1~6测定值均落入95%置信区间内。b2.荧光平台:通过荧光免疫层析法测定saa,评估结果如表4所示,质控品1~6的判断结果均为无基质效应,有互换性。表4以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=0.9958x+3.0299,线性系数r2=0.9763,线性关系良好,如图7所示。在图7的基础上增加95%置信区间和质控品测定值,如图8所示,质控品1~6测定值均落入95%置信区间内。c1.胶体金平台:通过胶体金法测定crp,评估结果如表5所示,质控品1~6的判断结果均为无基质效应,有互换性。表5以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=0.8995x+2.9924,线性系数r2=0.9875,线性关系良好,如图9所示。在图9的基础上增加95%置信区间和质控品测定值,如图10所示,质控品1~6测定值均落入95%置信区间内。c2.胶体金平台:通过胶体金法测定saa,评估结果如表6所示,质控品1~6的判断结果均为无基质效应,有互换性。表6以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=1.0145x+0.7838,线性系数r2=0.9919,线性关系良好,如图11所示。在图11的基础上增加95%置信区间和质控品测定值,如图12所示,质控品1~6测定值均落入95%置信区间内。实施例三稳定性试验(1)准备实验样品6份制备样品(6个浓度的质控品(crp浓度:0.5/10/50/100/200/300mg/l,saa浓度:0.5/10/50/100/200/300mg/l)。(2)实验方法将制备样品置于2-8℃保存取时间点1个月,3个月、6个月、12个月、36个月分别测试其稳定性。每个样品测定2次。(3)实验数据如表7所示。表7实施例四均匀性测试结果测试同一批号的10瓶待检质控品,10瓶各测试1次,按公式(1)和公式(2)分别计算测试结果的平均值和标准差s1。另用上述质控品中的1瓶连续测试10次,按公式(1)和公式(2)计算测试结果的平均值和标准差s2。按公式(3)和公式(4)分别计算s瓶间和cv瓶间,cv瓶间应不大于15%。当s1<s2时,令cv瓶间=0式中:——平均值;s——标准差;n——测试次数;xi——指定参数第i次测试结果。测试结果如下:表8:crp(10mg/l)各平台均匀性结果。表9:saa(10mg/l)各平台均匀性结果:实施例五加入表面活性剂对该复合质控品稳定性的分析本实施例配制了不加入及加入不同表面活性剂的缓冲液,分别为未加表面活性剂缓冲液(缓冲液1),加离子型表面活性剂十二烷基苯磺酸钠缓冲液(缓冲液2),加非离子型表面活性剂聚乙二醇辛基苯基醚缓冲液(缓冲液3),同时加入离子型和非离子型表面活性剂缓冲液(缓冲液4),组成成分见表10。表10各缓冲液的组成成分复合质控品组成成分缓冲液1缓冲液2缓冲液3缓冲液4十二烷基苯磺酸钠--5%--5%聚乙二醇辛基苯基醚----1%1%pb缓冲液(ph7.2)20mmol/l20mmol/l20mmol/l20mmol/lbsa2.5%2.5%2.5%2.5%nan30.1%0.1%0.1%0.1%血清淀粉样蛋白a0.5-300mg/l0.5-300mg/l0.5-300mg/l0.5-300mg/lc-反应蛋白0.5-300mg/l0.5-300mg/l0.5-300mg/l0.5-300mg/l本实施例利用这四种缓冲液配制saa/crp复合质控品,将复合质控品放置在37度烘箱中加速10天,取出后平衡至室温,同时将在2-8度条件下保存的复合质控品作为对照组(不同配方的复合质控品均对应有放置在2-8度条件下保存的对照样),用已上市的试剂盒检测,最终计算测试结果的相对偏差。结果见表11。表11稳定性如下:结果表明,未加入表面活性剂的缓冲液配制的复合质控品在saa和crp上稳定性不好,加入加离子型表面活性剂十二烷基苯磺酸钠缓冲液和加非离子型表面活性剂聚乙二醇辛基苯基醚缓冲液均能提高saa/crp的稳定性,且同时加入两种表面活性剂的效果尤其显著。实施例六加入不同浓度bsa对该复合质控品稳定性的分析本实施例配制了不加入及加入不同bsa的缓冲液,分别为未加bsa缓冲液(缓冲液1),加1%bsa缓冲液(缓冲液2),加2.5%bsa缓冲液(缓冲液3),加5%bsa缓冲液(缓冲液4),组成成分见表12。表12各缓冲液的组成成分复合质控品组成成分缓冲液1缓冲液2缓冲液3缓冲液4pb缓冲液(ph7.2)20mmol/l20mmol/l20mmol/l20mmol/lbsa--1.0%2.5%5.0%nan30.1%0.1%0.1%0.1%血清淀粉样蛋白a0.5-300mg/l0.5-300mg/l0.5-300mg/l0.5-300mg/lc-反应蛋白0.5-300mg/l0.5-300mg/l0.5-300mg/l0.5-300mg/l本实施例利用这四种缓冲液配制saa/crp复合质控品,将复合质控品放置在37度烘箱中加速10天,取出后平衡至室温,同时将在2-8度条件下保存的复合质控品作为对照组(不同配方的复合质控品均对应有放置在2-8度条件下保存的对照样),用已上市的试剂盒检测,最终计算测试结果的相对偏差。结果见表13。表13稳定性如下:结果表明,未加入bsa和加入bsa的缓冲液配制的复合质控品在saa和crp上稳定性均没有太大差别,bsa不作为稳定性改善剂。在saa上随着bsa浓度的提高稳定性反而下降,当bsa加入5%时相比于2.5%浓度的bsa,saa的稳定性下降。实施例七加入不同基质改善剂对该复合质控品基质效应的影响本实施例配制了不加入及加入不同基质改善剂的缓冲液,分别为未加基质改善剂缓冲液(缓冲液1),加牛乳白蛋白缓冲液(缓冲液2),加牛乳球蛋白缓冲液(缓冲液3),加牛血清白蛋白缓冲液(缓冲液4)、加纤维蛋白原缓冲液(缓冲液5)。本实施例利用这五种缓冲液配制saa/crp复合质控品,将制备样品与20份临床样品随机穿插排列,分别使用评估方法与比对方法测定所有样品,重复测定3批,每批每个样品测定1次,每批测定都需校准,评估方法与比对方法同步进行。在散点图上,可将一系列临床样本的比对方法测定均值(x)与对应的y值的95%预测区间在回归线两边标记出来,若制备样品的点落在预测区间线条之外则说明存在基质效应。若制备样品的点在置信区间内,则表明不存在基质效应。20份临床样品和制备样品使用评估方法和比对方法进行测试,每批每个样品测试1次,记录测试结果。比对方法与评估方法测定结果以及直线回归结果如下所示:1.缓冲液1配制复合质控品:1.1使用评估方法和比对方法进行crp测定,评估结果如表14所示,质控品1~6的判断结果存在基质效应,无互换性。表14评估结果以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=0.8939x+2.9168,线性系数r2=0.9937,线性关系良好,如图13所示。在图13的基础上增加95%置信区间和质控品测定值,如图14所示,质控品1、2测定值落入95%置信区间内。但质控品3、4、5、6均不在置信区间内。存在基质效应,无互换性。1.2使用评估方法和比对方法进行saa测定,评估结果如表15所示,质控品1~6的判断结果存在基质效应,无互换性。表15评估结果以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=1.0024x+2.2178,线性系数r2=0.9918,线性关系良好,如图15所示。在图15的基础上增加95%置信区间和质控品测定值,如图16所示,质控品1、2测定值落入95%置信区间内。但质控品3、4、5、6均不在置信区间内。存在基质效应,无互换性。2.缓冲液2配制复合质控品:2.1使用评估方法和比对方法进行crp测定,评估结果如表16所示,质控品1~6的判断结果均为无基质效应,有互换性。表16评估结果以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=0.979x-0.4579,线性系数r2=0.9916,线性关系良好,如图17所示。在图17的基础上增加95%置信区间和质控品测定值,如图18所示,质控品1~6测定值均落入95%置信区间内。2.2使用评估方法和比对方法进行saa测定,评估结果如表17所示,质控品1~6的判断结果均为无基质效应,有互换性。表17评估结果以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=0.9354x+1.2644,线性系数r2=0.982,线性关系良好,如图19所示。在图19的基础上增加95%置信区间和质控品测定值,如图20所示,质控品1~6测定值均落入95%置信区间内。3.缓冲液3配制复合质控品:3.1使用评估方法和比对方法进行crp测定,评估结果如表18所示,质控品1~6的判断结果均为无基质效应,有互换性。表18评估结果以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=0.9766x+1.9527,线性系数r2=0.991,线性关系良好,如图21所示。在图21的基础上增加95%置信区间和质控品测定值,如图22所示,质控品1~6测定值均落入95%置信区间内。3.2使用评估方法和比对方法进行saa测定,评估结果如表19所示,质控品1~6的判断结果均为无基质效应,有互换性。表19评估结果以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=0.9121x+4.1673,线性系数r2=0.9892,线性关系良好,如图23所示。在图23的基础上增加95%置信区间和质控品测定值,如图24所示,质控品1~6测定值均落入95%置信区间内。4.缓冲液4配制复合质控品:4.1使用评估方法和比对方法进行crp测定,评估结果如表20所示,质控品1~6的判断结果均为无基质效应,有互换性。表18评估结果以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=1.0015x+1.1303,线性系数r2=0.9917,线性关系良好,如图25所示。在图25的基础上增加95%置信区间和质控品测定值,如图26所示,质控品1~6测定值均落入95%置信区间内。4.2使用评估方法和比对方法进行saa测定,评估结果如表21所示,质控品1~6的判断结果均为无基质效应,有互换性。表21评估结果以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=0.967x+4.401,线性系数r2=0.9915,线性关系良好,如图27所示。在图27的基础上增加95%置信区间和质控品测定值,如图28所示,质控品1~6测定值均落入95%置信区间内。5.缓冲液5配制复合质控品:5.1使用评估方法和比对方法进行crp测定,评估结果如表22所示,质控品1~6的判断结果均为无基质效应,有互换性。表22评估结果以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=0.9946x+1.0731,线性系数r2=0.9971,线性关系良好,如图29所示。在图29的基础上增加95%置信区间和质控品测定值,如图30所示,质控品1~6测定值均落入95%置信区间内。5.2使用评估方法和比对方法进行saa测定,评估结果如表23所示,质控品1~6的判断结果均为无基质效应,有互换性。表23评估结果以对比方法测定值为横坐标,以评估方法测定值为纵坐标,绘制评估方法与对比方法的结果的相关性曲线为y=0.9794x+2.9401,线性系数r2=0.9906,线性关系良好,如图31所示。在图31的基础上增加95%置信区间和质控品测定值,如图32所示,质控品1~6测定值均落入95%置信区间内。结果表明,未加基质改善剂缓冲液(缓冲液1)存在基质效应。加牛乳白蛋白缓冲液(缓冲液2),加牛乳球蛋白缓冲液(缓冲液3),加牛血清白蛋白缓冲液(缓冲液4)、加纤维蛋白原缓冲液(缓冲液5)均未出现基质效应,加入基质改善剂明显改善基质效应。综上所述,上述各实施例仅为本发明的较佳实施例而已,并不用以限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,皆应包含在本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1