一种去除蛋白质提取液中离子型表面活性剂的新方法与流程
所属技术领域
本发明涉及蛋白质和蛋白质组研究领域里一种新的样品前处理方法,能够有效去除蛋白质提取样品中的十二烷基硫酸钠(sds)等离子型表面活性剂,该方法命名为电滤法。
背景技术:
在蛋白质组学中对膜蛋白的研究非常重要,为了提取膜蛋白,需要使用sds等离子型表面活性剂,但是表面活性剂的存在又会影响后续的酶切、色谱分离和质谱鉴定。sds等表面活性剂在常用的反相色谱柱上有很强的吸附能力,并且会和蛋白质、肽段结合而影响对它们的分离,另外还会大大抑制肽段的离子化效率,减小肽段在质谱仪中的响应。所以,在色谱和质谱分析之前需要去除表面活性剂,这成为蛋白质组学研究样品前处理的重要一步。离子型表面活性剂包括sds等阴离子表面活性剂和十六烷基三甲基溴化胺(ctab)等阳离子表面活性剂。
目前去除蛋白质提取液中阳离子或阴离子表面活性剂的方法有透析、超滤、有机沉淀和固相萃取。但是这些方法都有诸多缺点。透析消耗时间长,期间要换2~3次透析液,蛋白质也有损失;超滤,以超滤管为例,需要在6000r/min的转速以上离心三次以上,每次要离一个小时左右,虽然时间相对透析短了些,但同时蛋白质损失也比较大,而且超滤管作为一次性耗材,单支30元左右,价格也比较昂贵;固相萃取柱中的反相脱盐柱虽然被广泛用来脱盐,但是不能脱去表面活性剂;有机沉淀法中常用的是丙酮沉淀法,它的缺点是蛋白沉淀不完全,而且沉淀不容易复溶。
蛋白质组学是继基因组学之后的又一重大生命科学研究项目,近年来已经成为各国竞相研究和投资的热点。蛋白质组学方法学研究中,样品前处理是关键步骤。在蛋白质提取液或肽段混合液中去除sds等离子型表面活性剂非常关键,但是目前已有的去除这些表面活性剂的办法有很多不足,急待开发一种新的离子型表面活性剂去除方法或装置,实现便捷、低廉、蛋白质损失小等要求。
技术实现要素:
本发明的目的在于去除蛋白质提取样品或肽段样品中的离子型表面活性剂,开发一种新型的去除sds等离子型表面活性剂的方法——电滤法,以消除表面活性剂对反相色谱质谱分析的影响。
本发明的基本技术原理是把电泳和超滤两种技术手段创造性地结合起来,利用分子大小不同来实现蛋白质分子和离子型表面活性剂分子的分离,这个原理可以简称电滤。在电场作用下蛋白质分子和sds等离子型表面活性剂会发生迁移,但是由于超滤膜的阻挡,蛋白无法通过,表面活性剂由于分子较小可以通过,从而实现蛋白和表面活性剂的分离好。
本发明实现其目的的技术方案是:
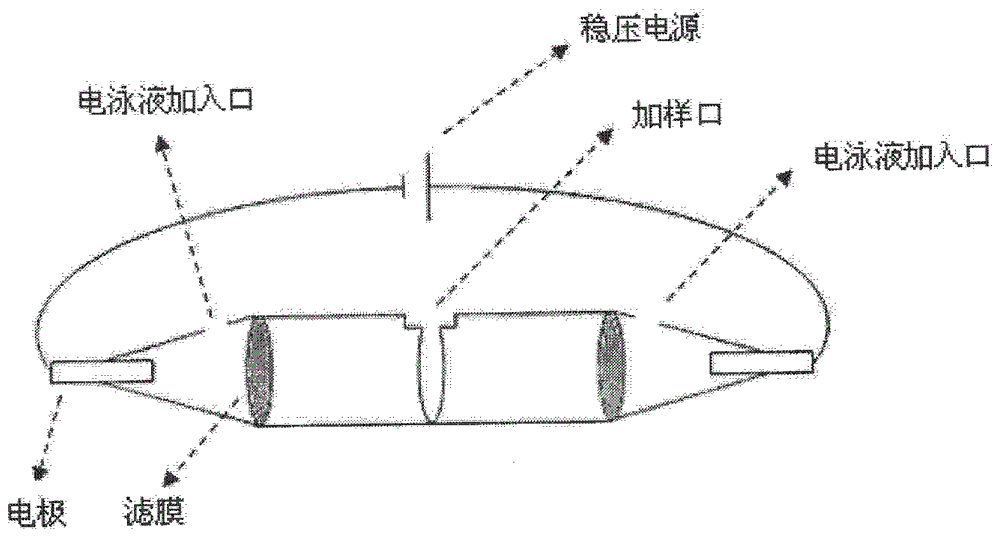
(1)电滤装置制作:电滤装置主要由超滤膜、电极和稳压电源构成,如下图1所示。电滤载体为梭状,使用两块超滤膜把腔体分成三部分,两个电极从梭状载体的两端进入,并且密封良好,电极的另一端与稳压电源相连。两块超滤膜的中间腔体使用时加入样品,两侧腔体加入电泳液。为了加入样品或电泳液体,每个腔体正上方有一个注射孔。超滤膜孔径的大小可以依样品的要求不同,用于蛋白组的研究的样品,可以采用3000da或10kda的超滤膜。肽段样品中除去表面活性剂可以采用3000da的超滤膜。
(2)电滤方法实施过程:蛋白质样品用50mmnacl溶液稀释后注入位于中间得进样口,从两端的电泳液体注入口注入50mmnacl溶液,电泳设置为恒压电泳,整个电滤装置放于冰上,电泳可在30~60min内结束。
本发明的有益效果是,可以去除蛋白提取液中的离子型表面活性剂,以使样品适合后续的液相色谱质谱分离,同时除了可以去除离子型表面活性剂外,还可以去除其他的带电的小分子,这些带电的小分子也会影响肽段的离子化。
附图说明
图1:由超滤膜、电极和稳压电源构建而成的电滤装置示意图。
图2:0.5%sds裂解液提取的蛋白样品直接酶解成肽段后进行rplc-ms/ms分析。(a)lc-ms的bpc图;(b)lc-ms的tic图;
图3:经超滤法、丙酮沉淀法和电滤法处理的样品lc-ms分析的总离子流色谱图分别和对照(未经sds去除处理)分析得到的总离子流色谱图(黄色)的叠加图。(a)超滤法处理;(b)丙酮沉淀法处理;(c)电滤法处理。
具体实施方式
本发明结合电泳和超滤两种技术手段,利用蛋白和表面活性剂在分子大小上的不同来实现蛋白和离子型表面活性剂的分离,以下结合实施例来做进一步说明。
实施例1:电滤装置的制作
(1)设计如图1所示,用胶水把两个10kda超滤离心管口对口粘在一起,然后在口对口的地方切出一个小口,在接近两个尖端的地方也各加工两个小口,以便把电极尖端插进去,电极插进去之后也用胶水封死。在尖端到滤膜之间的靠近滤膜的地方也各刨个小口,以便电滤完成之后把透过液吸出来。
(2)稳压电源和电极采用实验室常规的凝胶电泳仪电源和电极。
实施例2:电滤法去除细胞膜蛋白提取液中的sds及其与超滤法、丙酮沉淀法的比较
含0.5%sds的裂解液提取的蛋白样品,分别经未处理、超滤法、丙酮沉淀法和电滤法四种方式处理后酶解成肽段,然后进行液相色谱质谱分析比较不同方法处理后对色谱质谱分析的影响效果。
(1)细胞培养和蛋白样品制备:人神经母细胞瘤细胞(sh-sy5y)在含有10%胎牛血清的dmem培养基中,置于37℃,5%co2、饱和湿度的co2培养箱中培养。待细胞长至80%密度时分别用含有sds的提取液(7m尿素、2m硫脲、0.5%sds、1%dtt、1mmedta、40mmtris、40μl/ml蛋白酶抑制剂)和不含sds的提取液(7m尿素、2m硫脲、1%dtt、1mmedta、40mmtris、40μl/ml蛋白酶抑制剂)提取蛋白。超声破碎1min,破碎1秒,间隔2秒,共3min。超声后涡旋1min,然后4℃17000g离心30min,小心收集上清,用brandford法测定蛋白浓度。
(2)超滤法:蛋白样品溶液用加5倍体积的含8m尿素、10mmddt的50mm碳酸氢铵的溶液稀释,加入10kda超滤离心管,4℃10000g/min离心60min,如此重复离心3次。反转超滤管,收集上层截留液,brandford法测蛋白浓度
(3)丙酮沉淀法:在蛋白样品溶液中加入10倍体积的预冷的丙酮,4度静置2h,然后17000g/min4度离心30分钟,小心吸掉上清,沉淀挥发干之后用含8m尿素、10mmddt的50mm碳酸氢铵的溶液溶解,brandford法测蛋白浓度。
(4)电滤法:60μl的蛋白样品用500μl50mm的nacl溶液稀释,然后加到中间的样品孔中,两端电泳液注射口加入500μl50mm的nacl溶液。装置放到冰块上,电压设为200v电泳,电流开始时为4ma,一段时间后逐渐减小。30min后电泳结束。用注射器把中间截留的样品吸出来,即为去除sds的蛋白溶液。
(5)蛋白酶解:不同方法处理的蛋白样品,在含8m尿素、10mmddt和50mm碳酸氢铵溶液中37℃变性4小时,加入碘乙酰胺避光反应30分钟,用50mm碳酸氢铵溶液稀释尿素至1m,然后加入胰酶37℃酶解20h(蛋白质和胰酶的比例为50∶1)
(6)评估不同方法去除sds后对色谱质谱分析的影响:采用hplc/esi-trap质谱进行分析,反相高效液相色谱(rplc):c18色谱柱(2.1mm*150mm),流速0.2ml/min,流动相a:含1%甲酸的水溶液,b:含1%甲酸的乙腈溶液。梯度设置:0-5min持续3%的b相,5-45minb相由3%升至40%,45-50minb相由40%升至50%,50-55minb相由50%升至95%,然后95再持续5min。posttime:10min。esi-trapms/ms:干燥气流速7l/min,雾化压力30psig,质荷比扫描范围:300-2100。ms/ms分析,自动做二级,采用数据依赖模式。
hplc/esi-trap分析结果如图2、图3所示。以未处理得到的lc-ms离子流色谱图为对照,通过比较离子流色谱图来考察三种前处理方法对lc-ms分析的影响。四种方式处理后lc-ms分析的进样量所对应的处理之前的初始蛋白量是相同的。未做sds去除处理直接酶解成肽段后lc-ms/ms分析,其lc-ms的基峰色谱图(bpc)和总离子流色谱图(tic)如图2所示,可以看出在保留时间60-70min之间有一很大很宽的峰包,这个峰包里大多是未充分酶解的质量较大的肽段。这个较大的峰包说明sds的存在影响了酶解效率,使得酶解不能充分进行。从图3(a)超滤处理和未处理得到的总离子流色谱图的对比中可以看出,在40-60min之间,超滤处理的比未处理的峰较高,这可能是未去除的sds在这个时间段影响了肽段的离子响应。超滤处理的总离子色谱图,在60-70min内的峰包比未处理的要小,反映了超滤处理后的样品,由于sds的去除,使得酶解比较充分。从图3(b)总离子流色谱图的对比中可以看出,丙酮沉淀法处理后lc-ms分析得到的总离子流色谱图,在保留时间8-60min内的峰高明显高于对照,而在保留时间60-70min的峰包比对照的要小很多,这说明丙酮沉淀法处理后酶解进行的比较充分,反映了该方法对sds的去除效果较好。由图3(c)总离子流色谱图的对比中可以看出,电滤处理后的总离子流色谱图和对照相比,在40-60min之间峰高,而在60-70min之间峰包比较小,这说明了电滤处理后酶解效率比较高,这也反映了电滤对sds的去除增加了蛋白的酶解效率。从三种处理方法和对照的总离子色谱图的对比上可以看出,丙酮沉淀法处理后酶解得到的肽段量最多,这既是因为其较高的蛋白回收率,也因为其对sds较好的去除效果。三种处理方法和对照相比都显示出了较充分的酶解效果,反映了这三种方法都能不同程度上消除sds对酶解和色谱质谱分析的不利影响,也证明了本发明的新方法电滤法的有效性。
- 还没有人留言评论。精彩留言会获得点赞!