检验水的pH测定方法与流程
本发明涉及检验水的ph测定方法,特别是涉及用于在规定范围内测定检验水的ph的方法。本申请基于2018年7月3日在日本申请的日本特愿2018-126856号主张优先权,将其内容引用在本文中。
背景技术:
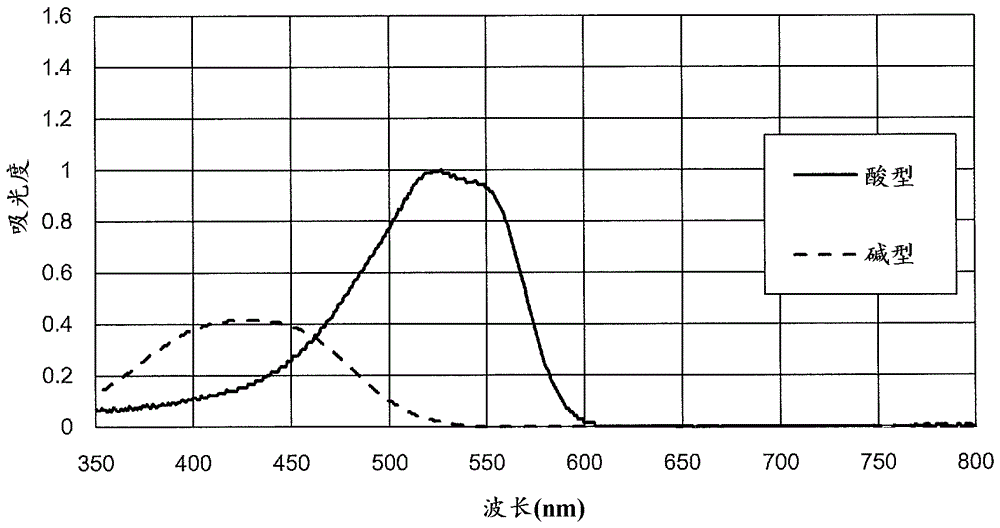
:锅炉给水或冷却塔的循环冷却水等各种用水有时会通过添加药剂来调整ph(氢离子指数)。在这种情况下,需要测定添加了药剂后的用水的ph,确认将用水的ph调整至目标范围。作为用于测定用水或溶液的ph的一般方法,专利文献1提出了滴定法和使用玻璃电极的测定法。但是,滴定法如专利文献1所述,在试样、即检验水含有大量的金属成分的情况下,随着滴定的进行,有时会生成沉淀物,为了避免该沉淀物的影响而进行处理时,存在滴定终点的检测困难而且操作复杂,并且需要大量的试样的问题。另外,使用玻璃电极的方法虽然ph的测定范围宽,但对测定值不具有自我诊断功能,因此为了确保测定值的可靠性,需要频繁的检查和校正。因此,专利文献1中,作为可消除滴定法和使用玻璃电极的测定法的缺点的替代方法,公开了在检验水中添加ph指示剂,根据检验水的变色所伴有的吸光度变化来测定试样的氢离子浓度的方法。但是,由于ph指示剂的变色区域限于一定范围,所以可通过上述替代方法测定的ph的幅度最多为1~2左右,较狭窄。现有技术文献专利文献专利文献1:日本特开昭58-204343号公报。技术实现要素:发明所要解决的课题本发明使用吸光度可因ph的变动而变动的显色试剂,可在较宽范围内测定检验水的ph。解决课题的手段本发明涉及用于在规定范围内测定检验水的ph的方法。该测定方法包括:工序1,对检验水添加试剂组合物,所述试剂组合物含有:因所述规定范围内的ph的变动而一步酸解离,从而紫外可见区的吸光度可变动的第1显色试剂;因所述规定范围内的ph的变动而一步酸解离,从而紫外可见区的吸光度可变动,且酸离解常数(pka)比第1显色试剂大的第2显色试剂;和因所述规定范围内的ph的变动而一步酸解离,从而紫外可见区的吸光度可变动,且酸离解常数(pka)在第1显色试剂和第2显色试剂之间的至少一种第3显色试剂;并且,第1显色试剂、第2显色试剂和第3显色试剂在所述规定范围内的紫外可见区的吸光度均超过0;工序2,对于添加了试剂组合物的检验水,测定紫外可见区的任意波长的吸光度;工序3,基于在工序2中测定的吸光度来判定检验水的ph。在本发明的测定方法的一个实施方式中,在工序2中测定互不相同的多种波长下的各自的吸光度,在工序3中依据以多种所述波长的各自的吸光度和检验水的ph作为变量预先求得的相关分析结果来判定检验水的ph。在本发明的测定方法的其它实施方式中,在工序2中测定互不相同的至少三种的多个波长下的各自的吸光度,依据以吸光度比和检验水的ph作为变量预先求得的相关分析结果在工序3中判定检验水的ph,所述吸光度比是以多种所述波长中吸光度最难因检验水的ph变动而变化的波长的吸光度作为分母、并且以其它的所述波长各自的吸光度分别作为分子的吸光度比。在上述其它实施方式的测定方法的一个变形例中,依据以所述吸光度比中的每一个和检验水的ph作为变量预先求得的相关分析结果,在工序3中对每个所述吸光度比分别暂时判定检验水的ph,在基于所述吸光度比中的一个暂时判定的检验水的ph与基于所述吸光度比中的另一个暂时判定的检验水的ph之差超过规定值的情况下中止工序3。本发明的测定方法的一个变形例还包括工序4,通过至少重复1次工序1~工序3,设定以在各工序3中判定的检验水的ph(y)及其判定时试剂组合物对检验水的累积添加量(x)作为变量的函数(y=fx),将在该函数(y=fx)中添加量(x)为0时的ph(y)作为检验水的ph进行最终判定。在该变形例中,基于函数(y=fx)同时判定检验水的缓冲能力。而且,在对检验水判定的缓冲能力比规定值高时,优选在工序1中使用含有氨基酸的试剂组合物作为添加到检验水中的试剂组合物。本发明的测定方法的一个实例中的检验水的ph的规定范围为4~9。在该实例中,在工序1中,使用含有选自酸解离常数(pka)为4.1~6.0范围的显色试剂的第1显色试剂、选自酸解离常数(pka)为6.5~8.5范围的显色试剂的第2显色试剂、选自酸解离常数(pka)为5.5~7.5范围的显色试剂的一种第3显色试剂的所述试剂组合物,且在工序2中,测定选自410~430nm范围的波长、选自515~535nm范围的波长和选自580~600nm范围的波长这三种波长的吸光度。本发明的测定方法的其它实例中的检验水的ph的规定范围为4~12。在该实例中,在工序1中,使用含有选自酸解离常数(pka)为4.1~6.0范围的显色试剂的第1显色试剂、选自酸解离常数(pka)为8.5~11.5范围的显色试剂的第2显色试剂、有选自酸解离常数(pka)为5.5~7.5范围的显色试剂的第1种显色试剂与选自酸解离常数(pka)为7.0~9.5范围的显色试剂且酸解离常数(pka)比第1种显色试剂大的第2种显色试剂共两种的第3显色试剂的所述试剂组合物,且在工序2中,测定选自410~430nm范围的波长、选自450~470nm范围的波长、选自515~535nm范围的波长和选自580~600nm范围的波长这四种波长的吸光度。发明的效果本发明所涉及的检验水的ph测定方法中,在检验水中添加含有可因ph的变动而一步酸解离从而吸光度变动的、酸解离常数(pka)互不相同的至少三种显色试剂的试剂组合物,并测定其紫外可见区的任意波长的吸光度,基于该吸光度来判定检验水的ph,由此可在较宽范围内测定检验水的ph。附图说明[图1]甲基红的吸收光谱。[图2]酚红的吸收光谱。[图3]溴甲酚紫的吸收光谱。[图4]表示第1实施方式例的具体例所涉及的试剂组合物中含有的各显色试剂的变色ph范围的图。[图5]溴酚蓝的吸收光谱。[图6]茜素黄的吸收光谱。[图7]表示第2实施方式例的具体例所涉及的试剂组合物中含有的各显色试剂的变色ph范围的图。[图8]表示在重复本发明所涉及的测定方法的工序1~工序3的情况下,试剂组合物在检验水中的添加量的变化与检验水的ph的关系的示意图。[图9]在实施例中制作的ph判定用图。具体实施方式本发明的ph测定方法是用于对从锅炉给水或冷却塔的循环冷却水等各种用水或各种水溶液采集的检验水,在某种程度的限定范围(有时称为“规定范围”)内测定其ph的方法,包括以下工序1~3。工序1:在本工序中,对检验水添加规定的试剂组合物。添加了试剂组合物的检验水优选适当搅拌以使添加的试剂组合物均匀地分散。这里所使用的试剂组合物含有第1显色试剂、第2显色试剂和第3显色试剂。这里所使用的各显色试剂根据其存在环境的ph,酸解离的程度、即未酸解离的碱型(hin)的显色试剂与已酸解离的酸型(in-)的显色试剂的存在比例变化,由此使得存在环境下的紫外可见区的吸光度变化。若在检验水中添加这种显色试剂,则在该检验水的ph处于显色试剂可酸解离的ph范围内的情况下,可通过对检验水测定紫外可见区的任意波长的吸光度来求得检验水中的显色试剂的酸型(in-)相对于碱型(hin)的存在比例,并可根据该存在比例和显色试剂的酸解离常数(pka)基于以下亨德森-哈塞尔巴尔赫公式计算检验水的ph。在这里,pka为25℃下的值。[数学式1]试剂组合物中使用的各显色试剂均可规定范围内的ph的变动而一步酸解离,从而紫外可见区的吸光度可变动,并且,规定范围内的紫外可见区的吸光度超过0,即在规定范围内紫外可见区的吸收不会消失。若按照上述亨德森-哈塞尔巴尔赫公式,则可清楚,显色试剂可酸解离的ph范围根据其pka而不同。因此,为了确保可测定的ph的规定范围具有某种程度的幅度,作为试剂组合物中使用的第1显色试剂、第2显色试剂和第3显色试剂,使用pka互不相同的显色试剂。即,作为第2显色试剂,选择pka比第1显色试剂大的显色试剂。另外,作为第3显色试剂,选择pka在第1显色试剂与第2显色试剂之间的显色试剂。第3显色试剂可以是只由一种显色试剂构成的显色试剂,也可以是由两种以上的显色试剂构成的显色试剂。在使用一种显色试剂作为第3显色试剂的情况下,该显色试剂优选pka在第1显色试剂的pka与第2显色试剂的pka的大致中央值的显色试剂。在使用两种以上的显色试剂作为第3显色试剂的情况下,该各显色试剂选择pka互不相同的显色试剂。在这种情况下,第3显色试剂中的各显色试剂优选各自的pka在第1显色试剂的pka与第2显色试剂的pka之间为大致均等间隔的值的显色试剂。作为试剂组合物的实施方式例,可列举出下述第1实施方式例和第2实施方式例。在各实施方式例的具体例中选择的显色试剂的各自的吸收光谱,是对用稀释用水(例如蒸馏水)将调整成显色试剂的浓度为1.00g/kg的试剂稀释至150倍而得到的溶液(以下有时将这样制备的溶液中的显色试剂的浓度称为“单位显色试剂浓度”)进行测定而得到的。在吸收光谱的测定中,使用hitachihigh-techsciencecorporation的分光光度计(型号:u-2910型),使用光路长度为10mm的比色池并将测定波长范围设定为350nm~800nm。对于各显色试剂,碱型指酸解离前的状态的显色试剂,酸型指酸解离后的状态的显色试剂。酚红的强酸型指后述第二步酸解离后的状态的显色试剂。下述第1实施方式例和第2实施方式例以及各自的具体例并不限定在本发明的测定方法中使用的试剂组合物。<第1实施方式例>本实施方式例是可在大致4~9的范围(该范围包含碳酸的整个缓冲ph范围)内测定检验水的ph的实例,含有以下显色试剂。◎第1显色试剂选自pka在4.1~6.0范围内的显色试剂。例如,可选自甲基红(pka:5.1)、溴酚蓝(pka:4.2)和溴甲酚绿(pka:4.7)。◎第2显色试剂选自pka在6.5~8.5范围内的显色试剂。例如,可选自酚红(pka:1.2和7.7)、中性红(pka:6.7和7.4)和甲酚红(pka:1.0和8.0)。◎第3显色试剂选自pka在5.5~7.5范围内的显色试剂。例如,可选自溴甲酚紫(pka:6.3)和溴麝香草酚蓝(pka:7.1)。作为本实施方式的具体例,可列举出含有以下各显色试剂的试剂组合物。◎第1显色试剂甲基红pka:5.1吸收光谱:图1◎第2显色试剂酚红pka:1.2和7.7吸收光谱:图2◎第3显色试剂溴甲酚紫pka:6.3吸收光谱:图3。对于上述具体例的试剂组合物中含有的各显色试剂,将基于上述亨德森-哈塞尔巴尔赫公式根据pka求得的变色ph范围示出于图4中。根据图4,作为第1显色试剂的甲基红可在ph为大致4~6的范围变色,作为第2显色试剂的酚红可在ph为大致7~9的范围内变色,作为第3显色试剂的溴甲酚紫可在ph为大致5.5~7的范围内变色,因此上述具体例的试剂组合物可在大致4~9的规定范围内测定检验水的ph。需说明的是,由于酚红根据其存在环境的ph而以两步酸解离,所以具有两个pka,一个pka(7.7)比用作第1显色试剂的甲基红的pka(5.1)和用作第3显色试剂的溴甲酚紫的pka(6.3)大,由于在ph为4~9的规定范围内的酸解离为一步,所以可用作第2显色试剂。<第2实施方式例>本实施方式例是可在大致4~12的范围(该范围也包含碳酸的整个缓冲ph范围)内测定检验水的ph的实例,含有以下显色试剂。◎第1显色试剂选自pka在4.1~6.0范围内的显色试剂。例如,可选自甲基红(pka:5.1)、溴酚蓝(pka:4.2)和溴甲酚绿(pka:4.7)。◎第2显色试剂选自pka在8.5~11.5范围内的显色试剂。例如,可选自茜素黄(pka:11.06)和麝香草酚蓝(pka:1.7和8.9)。◎第3显色试剂选自pka在5.5~7.5范围内的显色试剂的显色试剂a和选自pka在7.0~9.5范围内的显色试剂的显色试剂b这两种。其中,显色试剂b选择pka比显色试剂a大的显色试剂。显色试剂a例如可选自溴甲酚紫(pka:6.3)和溴麝香草酚蓝(pka:7.1)。另外,显色试剂b例如可选自酚红(pka:1.2和7.7)、中性红(pka:6.7和7.4)和甲酚红(pka:1.0和8.0)。作为本实施方式的具体例,可列举出含有以下各显色试剂的试剂组合物。◎第1显色试剂溴酚蓝pka:4.2吸收光谱:图5◎第2显色试剂茜素黄pka:11.06吸收光谱:图6◎第3显色试剂:以下显色试剂a和显色试剂b这两种显色试剂a溴甲酚紫pka:6.3吸收光谱:图3显色试剂b酚红pka:1.2和7.7吸收光谱:图2。对于上述具体例的试剂组合物中含有的各显色试剂,将基于上述亨德森-哈塞尔巴尔赫公式根据pka求得的变色ph范围示出于图7中。根据图7,作为第1显色试剂的溴酚蓝可在ph为大致3~5的范围内变色,作为第2显色试剂的茜素黄可在ph为大致9~12的范围内变色,另外,在第3显色试剂中作为显色试剂a的溴甲酚紫可在ph为大致5~7的范围内变色,作为显色试剂b的酚红可在ph为大致7~9的范围内变色,由此上述具体例的试剂组合物可在大致4~12的规定范围内测定检验水的ph。需说明的是,如上所述,酚红具有两个pka,一个pka(7.7)比用作第1显色试剂的溴酚蓝的pka(3.85)大且比用作第2显色试剂的茜素黄的pka(11.06)小,由于在ph为4~12的规定范围内的酸解离为一步,所以可用作第3显色试剂之一。对于具有两个pka的其它显色试剂(例如麝香草酚蓝、中性红和甲酚红),只要一个pka满足作为第1显色试剂、第2显色试剂或第3显色试剂的条件,就可用作所需的显色试剂。在试剂组合物中,各显色试剂的配合比例优选设定成基本上等摩尔,也可将接近希望提高分辨率(判定精度)的ph的pka的显色试剂设定为较多。试剂组合物通常是在溶剂中溶解所需的显色试剂而得到的。作为溶剂,只要是在添加于检验水中时其本身难以影响显色试剂的吸光度的溶剂,则可使用各种溶剂。例如,可使用蒸馏水或纯水等纯化水,乙二醇、丙二醇(propyleneglycol)和丙二醇(propanediol)等二醇类。为了抑制在接下来的工序2中使用的吸光度测定用比色池上附着的污垢,试剂组合物可含有表面活性剂。作为表面活性剂,可使用阳离子性、阴离子性或非离子性的各种表面活性剂,优选非离子性的表面活性剂。在本工序中,试剂组合物相对于检验水的添加量设定为预先确定的规定量。该规定量是以各显色试剂的合计量为基准的量,以下有时称为“基准添加量”。工序2:在本工序中,对于在工序1中添加了试剂组合物的检验水,测定从紫外可见区任意选择的特定的波长(以下有时称为“特定波长”)的吸光度。在这里,通过对检验水照射特定波长的光,并接收透过检验水的该光,来测定所需的吸光度。在这种情况下,作为用于测定吸光度的光源,可使用容易获取的光源。例如可从发光颜色不同的各种发光二极管(led)的组中选择使用发出特定波长的光的led。另外,在吸光度的测定中,也可通过使用分光光度计对检验水照射紫外可见光区的波长、通常为100nm~800nm的波长的光来测定吸收光谱,并根据该吸收光谱求得特定波长的吸光度。特定波长无特殊限制,但考虑到由测定对象的吸收强,另一方面即使波长稍微偏离,吸收也稳定,且若测定对象的吸光度的变化过大,则ph的测定范围容易变窄,另一方面若该变化过小,则ph的测定精度容易降低,优选设为容易观测到吸光度的变化的波长。在本工序中,可测定一个特定波长的吸光度,也可测定多个互不相同的特定波长的吸光度。工序3:在本工序中,基于在工序2中测定的特定波长的吸光度,判定检验水的ph。在工序1中添加了试剂组合物的检验水的特定波长的吸光度理论上表现为在工序1中添加到检验水中的试剂组合物中含有的各显色试剂的特定波长的吸光度的合计值。即,添加了试剂组合物的检验水的特定波长的吸光度为,将试剂组合物中含有的各显色试剂的碱型和酸型的各自的特定波长的吸光度按每一浓度累计而得到的值。因此,若使用含有第1显色试剂、第2显色试剂和由一种显色试剂构成的第3显色试剂这三种显色试剂,且明确各显色试剂的配合比例的试剂组合物,则理论上添加了该试剂组合物的检验水在特定波长下的吸光度可通过以下关系式计算。关系式中的各符号的含义如表1、2所述。[数学式2][表1]表1符号含义βr1aλ特定波长λ下的第1显色试剂的酸型的吸光度βr1bλ特定波长λ下的第1显色试剂的碱型的吸光度βr2aλ特定波长λ下的第2显色试剂的酸型的吸光度βr2bλ特定波长λ下的第2显色试剂的碱型的吸光度βr3aλ特定波长λ下的第3显色试剂的酸型的吸光度βr3bλ特定波长λ下的第3显色试剂的碱型的吸光度表1的各吸光度是通过调整成单位显色试剂浓度的相应显色试剂溶液的特定波长的吸光度与试剂组合物中的相应显色试剂的配合比例的关系(吸光度×配合比例)确定的值。[表2]表2符号单位范围含义aλabs0~2特定波长λ的吸光度测定结果r1[-]0~1第1显色试剂的碱型的存在比例r2[-]0~1第2显色试剂的碱型的存在比例r3[-]0~1第3显色试剂的碱型的存在比例d0~2试剂组合物相对于检验水的添加量偏差(其中,将基准添加量设为1)根据亨德森-哈塞尔巴尔赫公式,各显色试剂的碱型的存在比例因检验水的ph而变动,由此,对检验水注入基准注入量的明确各显色试剂的配合比例的试剂组合物时的该检验水的特定波长的吸光度可基于上述关系式对检验水按每个ph进行预测。因此,若预先根据在工序1中使用的试剂组合物来预测检验水的每个ph下的特定波长的吸光度,则通过将该预测结果与在工序2中实际测定的特定波长的吸光度进行对照,可判定检验水的ph。在工序2中测定多个互不相同的特定波长、例如两种~五种的吸光度的情况下,若预先按照上述关系式和亨德森-哈塞尔巴尔赫公式分析添加了试剂组合物的检验水的ph与各特定波长的吸光度的相关关系,则在本工序中可更高精度地判定检验水的ph。例如,在使用第1实施方式例所涉及的试剂组合物,即含有第1显色试剂、第2显色试剂和由一种显色试剂构成的第3显色试剂这三种显色试剂,且明确各显色试剂的配合比例的试剂组合物的情况下,添加了该试剂组合物的检验水的三种特定波长的吸光度,即λ1、λ2和λ3这三种特定波长(其中,λ1<λ2<λ3)的吸光度,按照上述关系式,在检验水中的各显色试剂的碱型和酸型的存在比例之间有以下式(1)、式(2)和式(3)这三种关系式成立。式(1)~(3)中各符号的含义如表3、4所述。[数学式3][表3]表3符号含义βr1aλ1、βr1aλ2和βr1aλ3分别在特定波长λ1、λ2和λ3下的第1显色试剂的酸型的吸光度βr1bλ1、βr1bλ2和βr1bλ3分别在特定波长λ1、λ2和λ3下的第1显色试剂的碱型的吸光度βr2aλ1、βr2aλ2和βr2aλ3分别在特定波长λ1、λ2和λ3下的第2显色试剂的酸型的吸光度βr2bλ1、βr2bλ2和βr2bλ3分别在特定波长λ1、λ2和λ3下的第2显色试剂的碱型的吸光度βr3aλ1、βr3aλ2和βr3aλ3分别在特定波长λ1、λ2和λ3下的第3显色试剂的酸型的吸光度βr3bλ1、βr3bλ2和βr3bλ3分别在特定波长λ1、λ2和λ3下的第3显色试剂的碱型的吸光度表3的各吸光度是通过调整成单位显色试剂浓度的相应显色试剂溶液的相应特定波长的吸光度与试剂组合物中的相应显色试剂的配合比例的关系(吸光度×配合比例)而确定的。[表4]表4符号单位范围含义aλ1abs0~2特定波长λ1的吸光度测定结果aλ2abs0~2特定波长λ2的吸光度测定结果aλ3abs0~2特定波长λ3的吸光度测定结果r1[-]0~1第1显色试剂的碱型的存在比例r2[-]0~1第2显色试剂的碱型的存在比例r3[-]0~1第3显色试剂的碱型的存在比例d0~2试剂组合物相对于检验水的添加量偏差(其中,将基准添加量设为1)在该实例中,若预先按照式(1)、(2)和(3)以及亨德森-哈塞尔巴尔赫公式分析λ1、λ2和λ3这三种特定波长与添加了试剂组合物的检验水的ph的相关关系,则可依据该分析结果,基于工序2中的λ1、λ2和λ3这三种波长的吸光度的测定结果来判定检验水的ph。特别是在如该实例那样测定三种以上的多种特定波长的吸光度的情况下,可求得以一个特定波长的吸光度作为分母、并且以其它特定波长各自的吸光度分别作为分子的吸光度比,依据以这些吸光度比和检验水的ph作为变量预先求得的相关分析结果来判定检验水的ph。在这种情况下,即使工序1中的试剂组合物相对于检验水的添加量从基准添加量发生变动,在本工序中对于检验水的ph也可得到可靠性高的判定结果。例如,在如上述实例那样测定三种特定波长λ1、λ2和λ3的吸光度的情况下,依据以吸光度比和检验水的ph作为变量预先求得的相关分析结果来判定检验水的ph,其中所述吸光度比是以特定波长λ1、λ2和λ3中吸光度最难因检验水的ph变动而变化的特定波长(假设为λ1)的吸光度作为分母、并且以其它特定波长(假设为λ2和λ3)的各自的吸光度分别作为分子的吸光度比,即aλ2/aλ1(称为吸光度比a)和aλ3/aλ1(称为吸光度比b)。在依据采用了如上所述的吸光度比的相关分析结果来判定检验水的ph的情况下,也可进一步提高判定结果的可靠性。在这里,依据以各个吸光度比和检验水的ph作为变量预先求得的相关分析结果,由工序2中的吸光度的测定结果暂时判定检验水的ph。然后,比较基于各吸光度比暂时判定的检验水的ph,在基于吸光度比中的一个暂时判定的检验水的ph与基于其它吸光度比暂时判定的检验水的ph之差超过规定值的情况下,在工序1中添加到检验水中的试剂组合物有可能产生配制上的缺陷或试剂组合物有可能产生劣化变质,或者利用试剂组合物的检验水显色有可能产生某种异常,因此中止工序3。例如,在上述实例中,在依据以吸光度比a和检验水的ph作为变量预先求得的相关分析结果,由工序2中的吸光度的测定结果暂时判定检验水的ph的同时,依据以吸光度比b和检验水的ph作为变量预先求得的相关分析结果,由工序2中的吸光度的测定结果暂时判定检验水的ph,在基于吸光度比a暂时判定的检验水的ph与基于吸光度比b暂时判定的检验水的ph之差超过规定值(例如0.5)的情况下,中止工序3。需说明的是,ph之差的上述规定值可根据所期待的测定精度来任意地设定。在工序1中添加到检验水中的试剂组合物含有四种以上的显色试剂,且在工序2中测定多个特定波长的吸光度的情况下,若仿照上述实例,按照与各特定波长的吸光度有关的多种关系式和亨德森-哈塞尔巴尔赫公式来预先分析多种特定波长的吸光度与添加了试剂组合物的检验水的ph的相关关系,则可依据该分析结果,基于工序2中的各波长的吸光度的测定结果来判定检验水的ph。在这种情况下,也可仿照上述实例,使用吸光度比来判定检验水的ph。另外,在通过利用吸光度比来判断是否需要中止工序3的情况下,可得到三种以上的吸光度比,因此例如从这些吸光度比中任意地选择两种吸光度比,在分别基于该两种吸光度比暂时判定的检验水的ph之差超过规定值的情况下中止工序3。本发明的测定方法可进一步包括以下工序4。工序4:由于本发明的测定方法是对检验水添加试剂组合物的方法,所以并不是可测定检验水本身的ph的方法,而是测定含有所添加的试剂组合物的检验水的ph。由于试剂组合物中含有的各显色试剂是因酸解离而显色的显色试剂,所以由于释放到检验水中的质子,有可能起作用使检验水的ph向降低方向变动,从而使检验水本来的ph值变动。试剂组合物对检验水的ph的影响程度根据检验水的缓冲能力而变动。即,检验水在缓冲能力高的情况(典型地含有如碳酸盐那样的缓冲成分的情况)下难以因试剂组合物的影响而产生ph的变动,但在缓冲能力低的情况下ph容易因试剂组合物的影响而变动。因此,在本发明的测定方法中,优选对测定结果进行修正,以消除因试剂组合物的影响导致的ph的变动。在测定结果的修正中,至少重复1次工序1~工序3的一系列操作(即,重复2次以上的工序1~工序3的一系列操作),在各重复操作的工序3中判定检验水的ph。如上所述,由于在各工序1中添加的试剂组合物在使检验水的ph降低的方向上起作用,所以在各重复操作的工序3中判定的检验水的ph通过分步添加试剂组合物而分步降低。例如,如图8示意性地所示,对于检验水的ph,在工序1中将试剂组合物的添加量设定为a时,与在首次的工序3中判定的值v1相比,在第2次的工序3中判定的值v2降低,在第3次的工序3中判定的值v3与值v2相比进一步降低。因此,设定以在各重复操作的工序3中判定的检验水的ph(y)及其判定时试剂组合物相对于检验水的累积添加量(x)作为变量的函数(y=fx),将在该函数(y=fx)中添加量(x)为0时的ph(y)作为所述检验水的ph进行最终判定。例如,在函数(y=fx)为如图8中用虚线表示的线性的情况下,将添加量(x)为0时的ph值即vc判定为检验水本身的ph值。检验水的缓冲能力可在上述修正操作中按照在各重复操作时的工序3中判定的检验水的ph的变化情况进行评价。该变化情况可按照上述函数(y=fx)进行定量地判定。在这里,在判断检验水的缓冲能力小的情况下,由于检验水的ph在每个工序3中的变动较为显著,所以容易通过上述函数(y=fx)进行修正,但在判断检验水的缓冲能力大的情况下,由于检验水的ph在每个工序3中的变动不明显,所以有可能难以通过上述函数(y=fx)进行适当的修正。因此,在判断检验水的缓冲能力大的情况下,特别是在按照上述函数(y=fx)判断的缓冲能力比任意设定的规定值大的情况下,优选在工序1中使用含有氨基酸的试剂组合物作为添加到检验水中的试剂组合物。氨基酸可提高试剂组合物中的显色试剂的缓冲能力,由此可促进添加了试剂组合物的检验水的ph变化。具体而言,在检验水的ph在酸性侧(ph低)的情况下,由于氨基酸中其氨基(-nh2)与质子(氢离子)配位而变化为-nh3+,所以容易使添加了试剂组合物的检验水的ph向中性方向升高。另一方面,在检验水的ph在碱性侧(ph高)的情况下,由于氨基酸从羧基(-cooh)释放的质子(氢离子),容易使添加了试剂组合物的检验水的ph向中性方向降低。例如,在检验水因含有碳酸(h2co3)而为低ph的情况下,由于从碳酸解离产生的氢离子的一部分与氨基酸的氨基配位,所以随着添加试剂组合物,检验水的ph上升而容易向中性方向变化。另外,在检验水因含有氨(nh3)而为高ph的情况下,由于从氨基酸的羧基释放的质子(氢离子)将因氨在检验水中电离而产生的氢氧根离子(oh-)的一部分中和,所以随着添加试剂组合物,检验水的ph降低而容易向中性方向变化。可利用的氨基酸无特殊限制,通常优选使用廉价且容易获取的甘氨酸、脯氨酸或丙氨酸。由于在工序1中添加到检验水中的试剂组合物含有在检验水中酸解离的显色试剂,所以ph低,但显色试剂通常在酸性下不稳定,因此在保存、保管中有可能发生分解。因此,试剂组合物优选通过添加氢氧化钠或氢氧化钾等无机强碱而将其ph调整至中性附近。若试剂组合物通过添加无机强碱而将ph调整至中性附近,则抑制显色试剂的分解,可提高检验水的ph的测定结果的可靠性。实施例制备500g的表5所示组成的试剂组合物。该试剂组合物相当于作为第1实施方式例的试剂组合物的具体例所列举的试剂组合物。[表5]表5设想对添加了0.75g试剂组合物的100ml检验水照射波长为420nm、525nm和590nm的可见光的情况,按照上述式(1)、式(2)和式(3)以及亨德森-哈塞尔巴尔赫公式计算在这种情况下预测的各波长的可见光的吸光度。在这里,对于ph以0.1的间隔在1~10范围内不同的检验水,计算上述各波长的可见光的吸光度。根据计算的各波长的吸光度,求得检验水的ph值与吸光度比(525nm/420nm)的关系和检验水的ph值与吸光度比(590nm/420nm)的关系。将结果示出于表6-1~表6-4中。另外,通过绘制两种吸光度比与检验水的ph值的关系来制作检验水的ph判定用图。将结果示出于图9中。[表6-1]表6-1[表6-2]表6-2[表6-3]表6-3[表6-4]表6-4制备调整至表7所示的ph值的验证用水。各验证用水的ph使用株式会社堀场制作所制的玻璃电极(型号:9625-10d)进行了确认。对于100ml的各验证用水,分别添加0.75g的试剂组合物并搅拌后,测定波长为420nm、525nm和590nm的可见光的吸光度。然后,对于各验证用水,求得吸光度比(525nm/420nm)和吸光度比(590nm/420nm),通过将各吸光度比应用于图9的图中来判定ph。将结果示出于表7中。[表7]表7。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1