一种凝集素探针组合在基于尿蛋白糖型鉴定大鼠妊娠方面的应用的制作方法
本发明涉及一种鉴别大鼠是否处于妊娠期的方法。
背景技术:
对于家畜而言,动物妊娠诊断是生产经营中生殖管理的重要组成部分,比如奶牛,高繁殖率是实现高产的前提条件,越早的妊娠诊断越有利于缩短产子间隔。而在有些情况下,管理者也可能希望尽早地终止计划之外的妊娠。因此了解动物正常繁殖生理状态,在农场建立一个怀孕诊断程序,检测个体是否妊娠,允许生产者做出管理决定,可以避免不符合生产需求的个体在农场中占用过多的资源。
褐家鼠(rattusnorvegicus),是经人工选育得到多种品系白化型大鼠,是仅次于小鼠的常用试验动物,通常被用作测试新的程序和药物的安全性。他们在确定遗传关系、低成本和相对较短的寿命、很小的生活空间等方面具有很大的优势。常用作研究的品系包括sd、wistar、fisher、shr、aci大鼠等。人们会根据自己实验的需求和每种品系的特性进行选择。其中sd大鼠多用作内分泌系统的实验,抗病性强,广泛应用于良好实验室操作规范(goodlaboratorypractice,glp)实验。妊娠大鼠作为很多试验的理想模型,不同妊娠期的生理生化变化,对实验设计可能都有不同的影响。目前检测妊娠的主要方法包括阴栓观察法和显微镜涂片观察的方法。对条件要求不高的实验,普遍应用阴栓法,较为便捷,对大鼠无伤害。样本量小,对动物或样本要求严格的采用显微镜涂片的方法,操作较为复杂,诊断较为准确。
多年来的研究进展表明,由于基因的数量有限,蛋白质的修饰是调节其功能的重要因素。糖基化是翻译后修饰最丰富和复杂的形式,对蛋白质的折叠、分配、稳定性和活性有显著的影响,是在细胞表面存在的蛋白质和脂质性质的一个重要调节剂。随着糖组学的迅速发展,寻找个体妊娠与否甚至是异常妊娠与否的生物标志物,以及分析两性之间糖链的差异,是随着新技术诞生,应运而生的新的探索方向。
糖组学可以被定义为对所有糖类(单糖、低聚糖、多聚糖及其修饰)的全面阐释。单糖是糖链的基本构件,哺乳动物糖链仅由十种核心单糖构成。在糖苷酶和糖基转移酶参与的几种酶促反应条件下,基本构件组成多样的糖链结构。真核蛋白质糖基化通常是以糖苷键与丝氨酸/苏氨酸残基连接形成的o-糖链,与天冬胺酸残基相连形成的n-糖链。哺乳动物大于50%的蛋白质有糖链修饰,糖蛋白出现在所有哺乳动物的体液当中在不同的物种和系统发育之间进化的糖链存在差异,这是免疫系统在区分自我和非自我之间的重要标志。
凝集素芯片技术具有覆盖率高、操作简便、实验性能快速的特点,可根据凝集素鉴定具体多糖结构的特点进行设计,在不释放蛋白质的情况下,对生物样本中的n-糖链和o-糖链同时定量分析。如利用凝集素芯片对患有绒毛膜癌的妊娠个体进行糖链分析寻找新的癌症指标,检测包括人、公猪、公牛、山羊和兔子物种哺乳动物精子表面糖链的差异,这些努力都为基础和临床的诊断提供了更多支持。
技术实现要素:
本发明的目的在于于获得一种简便、准确鉴别sd大鼠妊娠的方法。申请人通过对sd大鼠的尿液糖蛋白糖链进行大量的分析、实验,提出了一种特定凝集素探针组合,可用于快速鉴别尿液中糖蛋白糖链的变化,以此有效鉴别sd大鼠的妊娠状况。
该特定凝集素探针组合是jacalin、pwm和hhl,鉴别依据为:当样本检测结果为jacalin表达上调,且pwm和hhl表达下调,则表明相应雌性大鼠在取样时处于妊娠期(这里的“妊娠期”不包括妊娠早期,即符合上述情况时,表明样本主体在取样时处于妊娠中期或妊娠后期,反之表明样本主体在取样时处于妊娠早期或未妊娠)。
这里,相关测试产品给出“鉴别依据”的具体形式不限,例如:随附的产品说明书中记载上述条件;涉及到软件的,则还可由相应的算法体现该依据。
该凝集素探针组合可用于制备基于尿蛋白糖链鉴别sd大鼠妊娠的试剂盒,试剂盒中的凝集素芯片上点制所述凝集素探针组合。
进一步的,凝集素芯片上可以增加凝集素rca120作为内参。
利用该凝集素探针组合,基于尿蛋白糖型鉴别sd大鼠妊娠的方法,包括以下步骤:
1)取待检sd大鼠尿液样本,进行蛋白质富集、荧光标记;
2)取凝集素芯片,并利用封闭缓冲液对其完成封闭;所述凝集素芯片至少点制有以下三种凝集素:jacalin、pwm和hhl;
3)将荧光标记的尿液蛋白与孵育缓冲液混匀,然后与凝集素芯片完成孵育;
4)扫描凝集素芯片,分析得出对应于所述三种凝集素的糖链表达是否发生显著变化:若样本检测结果为jacalin表达上调,且pwm和hhl表达下调,则表明相应主体在取样时处于妊娠期。
本发明的优点:
对于大鼠妊娠状况以及妊娠阶段的鉴别,快速、简便、准确,实现成本较低。
附图说明
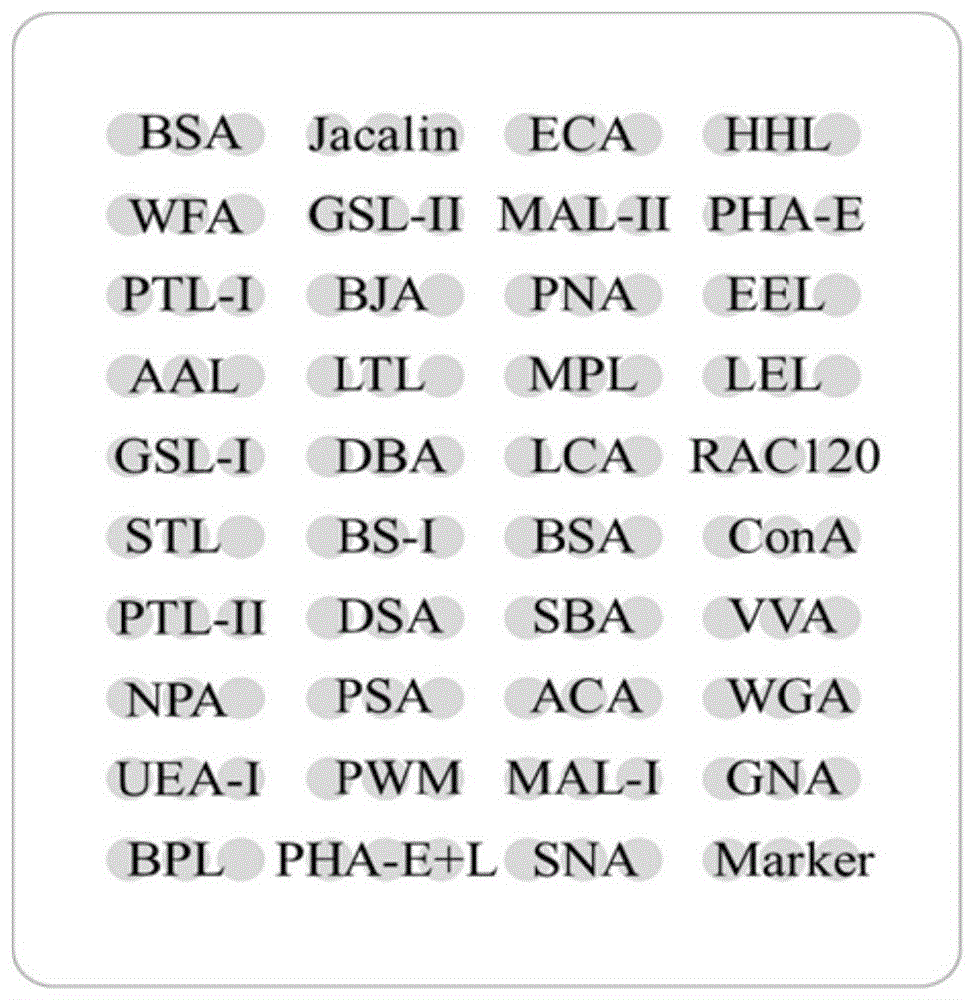
图1为最初设计的凝集素芯片上凝集素探针布局图;
图2为妊娠雌性(p)、非妊娠雌性(np)尿液蛋白凝集素芯片荧光检测结果;其中,(a)是处于妊娠中期sd大鼠,(b)对应于妊娠后期的sd大鼠,(c)对应于未妊娠的sd大鼠。
具体实施方式
以下详细介绍本申请的相关实验及分析,发明人具体的研发过程不限于此。
1.实验部分
1.1试剂与材料
甘氨酸,磷酸氢二钠,磷酸二氢钠,吐温-20和蛋白酶抑制剂均购自美国sigma-aldrich公司。牛血清白蛋白(bsa)购自德国merck公司。cy3荧光均购自美amerhsma公司。其他化学试剂均为分析纯级别,在使用前没有经过进步纯化。所有实验用水都为经milli-q50纯水系统(美国millipore公司)处理的超纯水。sephadexg-25柱脱盐购自美国gehealthcare公司。芯片杂交盒购自美国bio-rad伯乐公司。其它常见玻璃器皿均为国产。37种凝集
1.2实验仪器
电热鼓风干燥箱:天津泰斯特公司:高压灭菌锅:日本tomy公司:超速冷冻离心机5804r:德国eppendorf公司;微量核酸蛋白测定仪:德国implen公司;生物芯片扫描仪4000b:美国axon公司;芯片点样仪:博奥晶芯smartarrayer48点样仪;芯片杂交箱hl-2000:美国uvp公司。
1.3研究对象和尿液采集
大鼠尿液样本取自第四军医大学动物实验中心。雌性大鼠共5只,包括其在未妊娠(f),妊娠早期(f-1),妊娠中期(f-2),妊娠后期(f-3)四个阶段样本,3月龄,体重在300±20g的性成熟的sprague-dawley(sd)大鼠。
表2:大鼠尿液样本信息
注:以上样品编号f-1、f-1-1、f-1-2以及f-1-3均属于同一雌性大鼠(尿液样本分别取自未妊娠时、妊娠早期、妊娠中期以及妊娠后期),其他编号同理。
1.4尿液混合及荧光标记
为了消除采集时间上的差异,取相同个体同一妊娠阶段不同时间收集的样品进行混样,进行混合,用3kd超滤膜滤过样本进行蛋白质富集,然后用brandford法蛋白定量。混合样本经cy3荧光染料标记后用sephadexg-25除盐柱去掉游离荧光。标记好的蛋白准备用于凝集素芯片孵育。
1.5凝集素芯片和数据分析
1.51凝集素芯片的制备
将玻片用无水乙醇清洗三次,每次10min。离心机中甩干玻片。浸泡入250ml10%naoh溶液中,避光,摇床上反应12h后超声15min。然后用超纯水清洗四次,每次2min,无水乙醇清洗两次,每次2min。甩干。再将玻片浸泡到200ml10%gpts溶液中,避光,摇床上孵育反应3h,对玻片进行环氧化修饰。超声清洗15min,无水乙醇清洗三次,每次10min。甩干后将玻片置于37c真空干燥箱中,干燥3h。最后将环氧化玻片放置于室温干燥器中保存备用。
设计凝集素芯片矩阵(图1),选用1mg/mlbsa作阴性质控,cy3荧光染料标记的bsa作位置标记,与37种凝集素共同构成12×10矩阵,每种凝集素重复点样3次,每张芯片上重复4个矩阵。在384孔板中按矩阵设计顺序依次加入配制好的点样液,使用博奥晶芯48点样仪的针点系统,在环氧修饰片基上点制芯片。在室温且湿度为55%-65%的环境中孵育6h后,37℃真空干燥芯片,使凝集素固定于芯片上。将制备好的凝集素芯片放置于4℃干燥器,避光保存,备用。
1.52凝集素芯片的孵育及数据分析
(1)凝集素芯片的封闭
将点制好的凝集素芯片从4℃冰箱中取出,回温,首先用pbst、pbs各清洗玻片一次,每次5min,离心甩干。将凝集素芯片与700μl封闭缓冲液在芯片杂交盒中孵育,25℃旋转反应1h。封闭结束后用pbst、pbs各清洗玻片两次,每次5min,甩干。用genepix4000b芯片扫描仪扫描封闭后芯片,检查封闭效果。
(2)尿液样本的凝集素芯片检测
将荧光标记的尿液蛋白4μg与孵育缓冲液混匀(比例约1:9),每个样品混匀后在盖玻片均匀加入120pul,盖上封闭后的凝集素芯片,于芯片杂交仪中25c避光旋转孵育3h。孵育结束后用pbst、pbs各清洗玻片两次,每次5min,离心甩干。
(3)数据的扫描与分析
使用genepix4000b芯片扫描仪扫描芯片,结果如图2所示。genepix7.0软件从芯片扫描结果图圈点分析后,导出gpr文件,根据其中的数据信息进行分析。原始数据中小于一倍背景标准偏差的值去掉,每张芯片上每个样本三个重复点的有效值再取平均值(as),每组平均值表示为组内每个样本平均值(as)的均值(ag)标准偏差(sdg)。
2.结果部分
(1)37种不同的凝集素对各组血清糖蛋白糖链均有不同程度的识别,说明在成年雌性和雄性尿液中,糖蛋白糖链有差异。
(2)对于f-1组与f,f-2,f-3组分别进行wilcoxon配对检验,结果显示它们之间尿液中糖链并没有显著性差异。f组与f-2组进行wilcoxon配对检验发现,有8种凝集素具有显著性差异,且差异倍数均大于2。f组和f-3组进行wilcoxon配对检验发现,有四种凝集素具有显著性差异,且差异倍数大于2。
(3)相对于未妊娠大鼠,3种凝集素jacalin、pwm和hhl识别的糖链在
注:ratio是根据每个样品的荧光信号强度值计算出每组的均值进行比较;f为所有未妊娠雌性,f-2为所有妊娠中期,f-3为所有妊娠后期;-,无显著性差异。表3中没有列出f-1是因为妊娠早期与未妊娠差异不显著。
从表中数据可以看出,凝集素芯片结果中凝集素jacalin、hhl和pwm对应雌性妊娠中期相对于未妊娠nfi、妊娠后期相对于未妊娠nfi的fold-change值均大于2或小于0.5;
凝集素ptl-i虽在妊娠期间下调,但并非持续下调,f-3较f-2上调;
另有几种凝集素如eca、gsl-ii等对应于雌性妊娠中期相对于未妊娠nfi、妊娠后期相对于未妊娠nfi的上调/下调情况并不一致。
基于以上分析结果,申请人后期还进行了多次个体采集、检测,通过一定时间的观察验证,均与表3结果相符。
经过对表中数据的筛选,选定nfi的foldchange大于2,小于0.5,且在正在妊娠期间一直处于上调或下调的凝集素作为探针,rca120为内参(在两组的样本比较中,ratio值介于1.00-1.11之间,认为该凝集素所识别的糖链在两组样本中无差异)设计了一套用于鉴定大鼠妊娠的凝集素探针组合。
表4:鉴定妊娠的凝集素探针组合
p:妊娠大鼠;np:未妊娠大鼠;↑:表达上调;↓:表达下调;-:无显著差异。
利用本发明给出的凝集素探针组合,在实际对个体进行检测时,可预先给出以上三种凝集素表达水平的参考阈值,或者选取已知妊娠的大鼠样本作为对照样本,来判定表达上调、下调情况。
每次测定建议收集相同环境下的非妊娠大鼠的样本作为对照样本,尽可能排除环境因素,将测定的样本重复三次,取均值,来判定表达上调、下调情况。
上样量每个样本相同的情况下,未妊娠大鼠的样本参考荧光信号值如下:
妊娠上调组:jacalin:妊娠中期(8-14天):0.043727
妊娠后期(15-21天):0.058765
妊娠下调组:pwm:妊娠中期(8-14天):0.003153
妊娠后期(15-21天):0.001657
hhl:妊娠中期(8-14天):0.004853
妊娠后期(15-21天):0.001772。
注:因妊娠早期与未妊娠差异不显著,故未例出早期荧光参考值。
- 还没有人留言评论。精彩留言会获得点赞!
- Cyp2c19*2 检测用探针及 cyp2c19*3 检测用探针的制作方法
- 一种基于两核苷酸合成测序的pcr产物snp分型/突变检测方法
- 接触式台阶仪探针检测图形样块的制作方法
- 丙型肝炎病毒基因分型及il28b的snp位点检测的试剂盒及其使用方法和应用
- 用于肉制品中鸡源性成分掺假快速鉴别的Taqman-LNA荧光定量PCR方法及其引物和探针序列的制作方法
- 基于AllGlo探针的Glu504lys检测分型试剂盒及其分型方法
- 同时检测肉及肉制品中牛猪源性成分的Taqman-LNA多重荧光定量PCR方法及引物探针以 ...的制作方法
- 一种利用TaqMan探针检测桔小实蝇的方法及检测用引物和探针的制作方法
- 一种检测仔猪脐带血中圆环病毒Ⅱ型的Taqman实时荧光PCR试剂盒及其应用
- 检测单头烟粉虱携带番茄褪绿病毒的TaqMan探针和引物及其应用