一种检测PCV2抗体的方法
一种检测pcv2抗体的方法
技术领域
1.本发明属于免疫学和血清学技术领域,尤其涉及一种检测pcv2抗体的方法。
背景技术:
2.随着养殖规模的扩大,猪体内感染的疾病日益增多,给养猪业生产带来了巨大的经济损失。猪圆环病毒2型(pcv2)具有较强的致病性,可以感染不同日龄的猪。怀孕母猪感染后,经胎盘垂直感染给仔猪,初产母猪和新猪群产生繁殖障碍。除导致繁殖障碍性疾病外,还可导致猪群产生严重的免疫抑制,从而容易继发或并发其他传染病。临床上单独圆环病毒感染发病的病死率很低,80%以上的情况属于继发感染。因此,开发准确、灵敏、快速、成本低廉的分析方法就显得格外有意义。其中酶联免疫分析技术(elisa)以其特异性强、设备简单、操作方便等特点而被广泛的应用于病原微生物的检测。对比市售的elisa试剂盒与化学发光的试剂盒发现,大部分商品化的免疫试剂盒都存在灵敏度不高的问题,究其原因主要是信号放大方式有限。而在病毒感染的早期,抗体含量极低,所以用普通的elisa试剂盒难以实现疾病的早期诊断。为了适应临床免疫分析的需要,亟待发展高灵敏、定量的分析检测技术。
技术实现要素:
3.本发明的目的是:提供一种检测pcv2抗体的方法,可以较灵敏地检测出pcv2抗体。
4.本发明的技术方案为:一种检测pcv2抗体的方法,包括以下步骤:步骤一,合成纳米金:将250ml的0.01%氯金酸溶液置于双颈瓶中,加热至沸腾,搅拌下加入10ml 1%的柠檬酸三钠溶液,溶液颜色由无色逐渐变成蓝色最后变为酒红色后,继续加热至沸腾10min,移去热源,继续搅拌直至溶液冷却至室温,用0.22μm滤膜过滤,收集滤液,4℃避光保存备用;步骤二,合成检测探针取上述制备的纳米金滤液200
µ
l,调节其ph为9.0后与浓度为0.02 mg/ml的 hrp
‑
羊抗猪igg12
µ
l混匀,室温孵育30 min;加入同体积的0.2g/ml bsa溶液封闭30min,离心15min去除多余的抗体和bsa,沉淀物用220
ꢀµ
l的抗体稀释液重悬洗涤一次,再用抗体稀释液将其稀释10倍待用;步骤三,pcv2抗体检测
①
包被:用ph 9.6的抗体稀释液将pcv2抗原稀释至2.5
ꢀµ
g/ml,加入96孔酶标板每孔100
µ
l 4℃过夜,用洗涤液洗涤3次,每次3min;
②
封闭:在酶标板的每孔加入250
µ
l新配好的1% bsa封闭,置于37℃孵育2h,用洗涤液洗涤3次,每次3min;
③
加样:将待测血清100
µ
l加入上述已包被的孔中,并置于37℃孵育1h,用洗涤液
洗涤3次,每次3min;
④
加检测探针:取步骤二合成的检测探针100
µ
l加入反应孔中,并置于37℃孵育1h,用洗涤液洗涤3次,每次3min;
⑤
显色:在上述各反应孔中加入100
µ
ltmb底物显色试剂,室温闭光孵育20min;
⑥
终止反应:于上述各反应孔中加入100μl2m h2so4终止反应;
⑦
检测:于酶标仪检测450 nm处吸光度值。
5.优选地,步骤三中所述的抗体稀释液为0.1 m na2co3/nahco3缓冲液。
6.优选地,所述洗涤液为0.5% pbst。
7.本发明的有益效果为:本发明将pcv2抗原包被酶标板后,运用hrp标记的羊抗猪igg修饰包裹aunps制备成信号放大探针,负载率高,特异性强。运用制备好的探针能够高灵敏,高特异地检测猪血清中的pcv2抗体水平。
附图说明
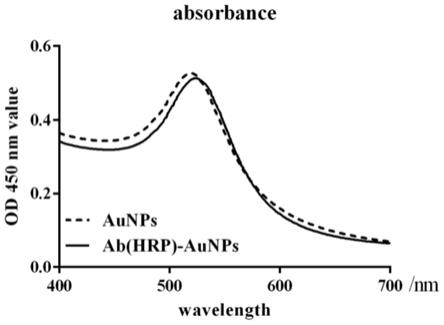
8.图1是aunps的紫外可见吸收光谱图.图2是aunps透射电镜图。
9.图3是aunps光粒径散射图。
10.图4是抗体偶联探针与血清稀释度的关系。
具体实施方式
11.下面结合实施例对本发明做详细说明。
12.实施例11、检测pcv2抗体,步骤如下:步骤一,合成纳米金:将250ml的0.01%氯金酸溶液置于双颈瓶中,加热至沸腾,搅拌下加入10ml 1%的柠檬酸三钠溶液,溶液颜色由无色逐渐变成蓝色最后变为酒红色后,继续加热至沸腾10min,移去热源,继续搅拌直至溶液冷却至室温,用0.22μm滤膜过滤,收集滤液,4℃避光保存备用;步骤二,合成检测探针取上述制备的纳米金滤液200
µ
l,调节其ph为9.0后与浓度为0.02 mg/ml的 hrp
‑
羊抗猪igg12
µ
l混匀,室温孵育30 min;加入同体积的0.2g/ml bsa溶液封闭30min,离心15min去除多余的抗体和bsa,沉淀物用220
ꢀµ
l的抗体稀释液重悬洗涤一次,再用抗体稀释液将其稀释10倍待用。
13.步骤三,pcv2抗体检测
①
包被:用ph 9.6的抗体稀释液将pcv2抗原稀释至2.5
ꢀµ
g/ml,加入96孔酶标板每孔100
µ
l 4℃过夜,用洗涤液洗涤3次,每次3min;
②
封闭:在酶标板的每孔加入250
µ
l新配好的1% bsa封闭,置于37℃孵育2h,用洗涤液洗涤3次,每次3min;
③
加样:将待测血清100
µ
l加入上述已包被的孔中,并置于37℃孵育1h,用洗涤液
洗涤3次,每次3min;
④
加检测探针:取步骤二合成的检测探针100
µ
l加入反应孔中,并置于37℃孵育1h,用洗涤液洗涤3次,每次3min;
⑤
显色:在上述各反应孔中加入100
µ
ltmb底物显色试剂,室温闭光孵育20min;
⑥
终止反应:于上述各反应孔中加入100μl2m h2so4终止反应;
⑦
检测:于酶标仪检测450 nm处吸光度值。
14.2、抗体偶联纳米金探针复合物的表征用uv
‑
vis光谱扫描仪对aunps和ab(hrp)
‑
aunps溶液进行光谱扫描。如图1所示,未修饰的aunps最大吸收峰在519 nm,当纳米金表面被蛋白质抗体包裹时,其最大吸收峰值在524nm。因为aunps粒径改变时会引起吸收峰的红移,由此初步判定蛋白质包裹在纳米金表面。
15.通过透射电镜(tem)观察纳米金粒子(aunps和ab(hrp)
‑
aunps)的颗粒分散情况。如图可示,单独的aunps颗粒大小均匀,直径大约在16 nm,略微有些聚集(图2);而包被抗体后,aunps粒径未发生明显变化,但分散性更好(图2),说明蛋白吸附有利于aunps的稳定,说明蛋白质已标记到aunps表面。
16.运用动态散射光粒径仪(dls)检测了aunps和ab(hrp)
‑
aunps两种样品的水合粒径,从图3中看见,未修饰的aunps水合粒径为24.7
±
1.04nm,当包被有蛋白质后,水合粒径增加至28.31
±
1.15nm,再次说明蛋白质抗体已成功地结合至aunps表面。
17.3、探针稀释度的优化为确定酶标探针的最佳稀释度,需要对其稀释度进行优化。将正常猪血清作为阴性对照,标准的阳性血清作为实验组,并设计空白对照,每组设3个平行孔。设置酶标探针稀释倍数为100、200、400、800、1600。如图4中所示,在阴性对照血清组,高浓度的酶标探针也会造成较高的背景信号,随着稀释倍数的增加,背景信号逐渐降低;然而当稀释1600倍时,检测信号又非常低,为了平衡灵敏度与背景吸附,选择200倍稀释浓度作为酶标探针的最佳浓度。
18.4、传统elisa与抗体偶联纳米金探针灵敏度的比较及线性关系选择在最佳实验条件下,建立aunps增强的酶免疫分析方法。传统的elisa由于一个病毒抗原仅能结合一个酶分子,而当用aunps作为载体后,能同时携带多个酶分子,增强免疫分析的敏感性。通过对比传统elisa与抗体偶联纳米金探针增强免疫分析结果发现,以aunps作为酶标记抗体的载体后,检测信号明显提高。这两种方法在阳性血清的稀释度为3200
‑
25600均表现线性关系。经计算,酶标探针方法的检测限为64100,这比传统的elisa方法高,即探针检测限检测的阳性血清浓度更低、方法的灵敏度更高。
19.在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,上面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互结合。另外以上仅为本发明的部分实施例,而不是全部实施例,基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1