用于筛选和药物发现目的的新型嵌合多肽
本申请是申请日为2014年1月30日的题为“用于筛选和药物发现目的的新型嵌合多肽”的中国专利申请no.201480019535.1的分案申请。
本发明涉及新型多肽以及它们应用于筛选和药物发现。更具体地,本发明提供了嵌合多肽,其包含融合于结合域(bindingdomain)的膜蛋白,尤其是gpcr,其中结合域是针对和/或特异性地结合于所述膜蛋白。尤其是,本发明的嵌合多肽是单一蛋白质,其中,在分子内反应中,结合域使膜蛋白稳定于感兴趣的构象。还提供了编码上述嵌合多肽的核酸序列,能够表达上述嵌合多肽的细胞,以及从其衍生的细胞成分(cellularcompositions)。还设想利用本发明的嵌合多肽用于化合物的筛选方法。
背景技术:
药物发现(药物开发)的努力一般集中于鉴定化合物,其调节-抑制或增强-感兴趣的靶的活性。经由基于生化或细胞的筛选或计算机(insilico)化合物设计来进行常规领先鉴定努力。这些方法已经确定和验证了众多的当今使用的可行的疗法。然而,如由新药物化合物的高失败率(估计仅8%的i期临床治疗最终获得食品和药物管理局批准,保守成本为每种药物8亿美元)所反映的,许多努力是不成功的并且在它们被认为是不可施药的(undruggable)以后靶经常被放弃(leeetal.2009)。相当部分的这些失败是由于这样的事实:大多数基于生化或细胞的测定是对处于它们的突出构象(优势构象,prominentconformation)(还被称为基础构象)的靶进行。然而,我们现在知道,构象柔性(构象灵活性,conformationalflexibility)是大多数当前和未来的药物靶(包括gpcr、离子通道、(核)受体、激酶和磷酸酶)的功能和药理学的关键。并且对于许多这些靶,最稳定的构象-对应于在不存在配体或辅助蛋白的情况下的突出的结构种类(基础构象)-并不对应于药物必须与其结合以对于治疗适应症最有效的可施药构象。
当今,用于药物干预的最常见的靶向蛋白类是g蛋白偶联受体(gpcr),还被称为七跨膜受体(7tmr)。它们在对一组不同的配体的生理反应中发挥基本作用,如生物胺、氨基酸、肽、蛋白质、前列腺素类、磷脂、脂肪酸、核苷、核苷酸、ca2+离子、添味剂、苦和甜促味剂、信息素和质子(heilkeretal.2009)。作用于gpcr的正位配体(orthostericligand)可以诱导对下游信号通路的连续效应(效应谱,aspectrumofeffects)。通常,gpcr需要用于激活的激动剂结合。完全激动剂最大限度地激活受体。甚至在饱和浓度下,部分激动剂诱发次最大刺激(submaximalstimulation)。在一些情况下,甚至在不存在激动剂的情况下,gpcr也可以表现出对于特定信号通路的基本活性(组成性活性)。反向激动剂可以抑制这种基本活性。显著地,虽然中性拮抗剂可以抑制在gpcr的正位结合位点处激动剂、部分激动剂、和反向激动剂的结合,但它们并不改变基本受体(basalreceptor)活性。近年来,在发现用于gpcr(其在变构位点处起作用以调节受体功能)的新配体方面已经取得进展,包括正和负变构调节物(分别为pam和nam)以及中性配体,其提供相对于正位配体的作用的新模式(christopoulos2002)。
现在公认的是,gpcr可以通过几种不同的机制来发信号,包括那些由g蛋白或多功能接头(适配体,adaptor)蛋白β-抑制蛋白介导的机制(rajagopaletal.2010)。借助于解析(solve)在具有各种配体的复合物(复合体,complex)中的若干gpcr的结构,其中上述各种配体包括反向激动剂、拮抗剂和激动剂(cherezovetal.2007,rasmussenetal.2011b,rosenbaumetal.2011,shimamuraetal.2011,xu2011,granieretal.2012,hagaetal.2012,hansonetal.2012,kruseetal.2012,mangliketal.2012,wuetal.2012,zhangetal.2012)和g蛋白(rasmussenetal.2011a),我们现在知道,gpcr是具有引起g蛋白激活的特定构象的构象复杂分子。在本发明的上下文中,具有特殊意义的是观测到,相比于基础构象,激动剂结合口袋的结构的仅相对较小变化导致在三个跨膜节段中的显著移动(多达
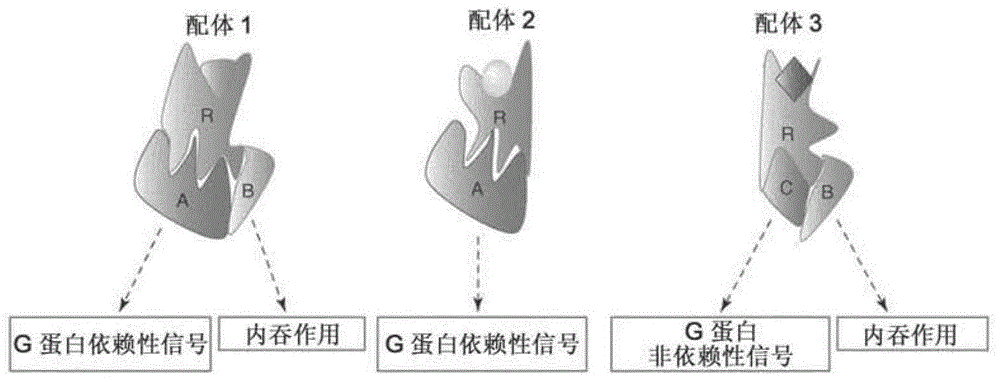
基于质谱法的策略(kahsaietal.2011)、生物物理分析(yaoetal.2006,maryetal.2012)和nmr波谱法(liuetal.2012;bokochetal.2010),提供了其它不同的配体特异性构象(其导致抑制蛋白介导的信号)的存在的直接证据。由此可见,不同的配体可以对单受体的构象和不同的信号和调节库具有不同的影响。这些多构象状态的重要性在于它们的药理相关性。如图1所示,这些受体构象的每一种可以被认为是单独的治疗药物靶,这是因为这些构象的每一种促进对于不同的效应子系统(包括g蛋白和抑制蛋白)的不同的相对效力。
药物发现方式可以在相当程度上获利于将靶捕获在治疗相关的-‘可施药的’-构象中。将受体稳定于特定功能构象将固有地将受体冻结于单一的、疾病相关的可施药构象,从而揭示了新的结构特点,其适用于用小分子或生物制剂(生物材料,biologicals)来靶向并且可以使得能够鉴定对上述可施药构象具有选择性的化合物。独特的可施药构象的稳定,包括非活性状态,其对应于低于基本活性的效应子系统,或特定功能状态,其激活单个效应子系统,不仅可以导致具有更好治疗疗效的化合物,而且还有益于鉴定具有较少不希望的副作用(其起因于触发不期望的途径)的化合物(galandrinetal.2007)。
进一步说,在高通量筛选(hts)和基于片段的药物发现(fbdd)中,构象柔性是一个问题(lawson2012)。在hts,在一些情况下,通过使用具有功能读取(functionalreadout)的全系统测定而不是还原重组系统测定,可以克服靶的不同构象的问题(kenakin,2009;rajagopaletal,2010)。然而在fbdd中,不能使用全系统测定,这是因为,初始命中的低效力/效能经常需要mm浓度的片段以获得生物活性并且引起毒性。由此可见,高通量初步筛选将显著受益于靶受体,在不存在配体或辅助蛋白的情况下,其被稳定于所期望的功能构象。进入这样的构象稳定受体将允许鉴定对于具有其特定结构特点的构象具有特异性的配体的子集(图1)。以这种方式,在各种各样的(全系统)信号测定中建立它们的效力曲线以前,利用结合的简单评估,可以进行潜在生物活性化合物的第一选择。
构象柔性还阻碍起始自片段的基于结构的药物发现。首先,基于片段的筛选(fbs)的许多潜在命中不是足够有效的以将构象平衡定量置换成蛋白-配体复合物(其可以以衍射晶体被结晶)的单构象。如果复合物不能被结晶,则用(小)配体浸泡无配体蛋白的现有结晶经常是选择的方法以获得复合物的晶体。然而,如果这些配体替换构象复杂的蛋白质的构象平衡,则这些诱导的构象变化将在许多情况下破坏晶体(danley2006)。
借助于首先于2007年解析(solve)的gpcr的结构(rasmussenetal.2007,rosenbaumetal.2007),我们进入gpcr结构生物学的新时代,其提高了将基于结构的方式应用于gpcr药物发现努力的可能性(shoichetandkobilka2012)。对于大量的相关于若干治疗适应症的gpcr药物靶,激动剂结合的活性状态经常是可施药构象。在高分辨率下解析处于这种治疗相关‘可施药的’构象的gpcr的结构仍然是一个挑战。获取激动剂结合的活性状态gpcr结构的努力已经证明是困难的,这是由于在不存在g蛋白的情况下这种状态的内在的不稳定性。已解析了复合于完全激动剂的gpcr的结构,但并不是没有困难。首先,天然激动剂通常并不充分稳定用于衍射质量晶体的形成的受体。在解决这个问题的尝试中,为结晶目的,已将激动剂共价结合于gpcr。然而,例如,共价激动剂结合的β2ar的晶体结构揭示了非常类似于非活性状态而不是活性状态的构象,并在跨膜节段中仅具有很少重排(rosenbaumetal.2011)(lebonetal.2012)。
用于确定gpcr的激动剂结合的构象的另一种方式是经由系统诱变来热稳定受体,接着在结合的激动剂的存在下测量增加的热稳定性(例如,wo2008114020、wo2009071914、wo2010149964、wo2012098413)。例如,已发现热稳定突变用于激动剂结合的a2aar(lebonetal.2011)、激动剂结合的β1-肾上腺素能受体(warneetal.2011)和激动剂结合的神经降压肽受体(whiteetal.2012)。然而,这些激动剂结合的稳定受体的结构可能不处于完全活性构象,其是基于跨膜螺旋6的小位移所判断。更重要的且与通过g蛋白或g蛋白模拟物加以稳定的活性状态相反的,这些热稳定受体没有显示对于它们的相应的激动剂的亲和力的显著增加(serrano-vegaetal.2008,shibataetal.2009,lebonetal.2011)。
仅在最近,利用构象选择性纳米抗体(xaperonetm),其模拟g蛋白功能并增加在正位位点处对于激动剂的亲和力(rasmussenetal.2011b),变得可能获得gpcr的激动剂结合的活性状态的结构。xaperone是有用的工具,用来将gpcr的结构锁定于治疗相关构象(steyaert&kobilka,2011)并促进药物候选物的发现,其中通过增加现有筛选方法的敏感性和选择性(wo2012007593)。然而,这种技术方法也有其局限性。因为在正位位点处激动剂的结合会增加对于在受体的变构细胞内侧模拟xaperonetm的g蛋白的亲和力并且反之亦然(rasmussenetal.2011b),在激动剂的存在下,gpcr-xaperonetm复合物要稳定得多。由此可见,gpcr、稳定xaperonetm和激动剂必须被共结晶以获得处于其活性构象的gpcr的晶体以及在wo2012007593中描述的发明并不很好适合于基于结构的药物发现方式,其涉及例如配体在现有结晶中的浸泡,这是因为已用来生长晶体的激动剂将与随后浸泡在其中的配体竞争。
因此,甚至在不存在激动剂的情况下将gpcr组成性稳定于特定可施药构象的新方法的开发将是一个重要的优势,以经由化合物筛选和/或基于结构的药物设计来改善药物发现。
技术实现要素:
本发明本质上提供了被稳定于治疗相关构象的药物靶。我们的新方法将靶捕获于感兴趣的构象,以揭示新结构特点,其适用于使用小分子或生物制剂进行靶向,用于治疗干预。药物靶的独特构象的组成型稳定是通过融合感兴趣的药物靶与构象选择性结合域(可选地通过接头分开)来获得,并且是在单一蛋白质内两个部分的分子内反应的结果。产生的融合多肽,在本文中还被称为嵌合多肽,是特别有趣的,因为它们可以具有显著不同于非嵌合形式的药物靶的结构性能,因此可以作为新创新工具来开发新的、更有效的或更有选择性的药物。应当理解的是,虽然已用gpcr来举例说明本发明,但它同样适用于任何膜蛋白。
本发明的嵌合多肽的一个主要优点在于,在单一蛋白质中确保gpcr与结合域的限定的1:1化学计量比,从而迫使融合配偶体(partner)的物理上的接近,同时保持结合域稳定受体于特定可施药构象的性能。为了说明这一点,并且没有限制性的目的,已构建编码gpcr和构象选择性纳米抗体的基因片段的若干基因融合(见实施例1、9、13、17、20)并且已经分析了表达的gpcr-纳米抗体融合多肽的药理特性(见实施例6、8、12、16、19、22、24-25)。我们表明,特定组的纳米抗体的性能,如稳定gpcr的活性构象的那些纳米抗体或稳定gpcr的非活性构象(无活性构象,inactiveconformation)的那些纳米抗体,被保持在这样的1:1基因融合(geneticfusion,遗传融合)中。相比于受体(其融合于模拟纳米抗体,其并没有被针对并且并不特异性地结合于β2ar(见实施例6)),例如,β2肾上腺素能受体(β2ar)(其融合于nb80,一种纳米抗体,其模拟g蛋白功能并稳定偶联于g蛋白信号的活性构象(wo2012007593)),显示对于天然激动剂肾上腺素的2072倍增加的亲和力并呈现对于反向激动剂ici118,551的43倍降低的亲和力。发现了相比于融合至模拟纳米抗体的β2ar,β2ar-nb80融合体以2000倍更紧密地结合天然激动剂肾上腺素,这表明,这些构象受限融合蛋白显示涉及特定效应子系统如g蛋白介导的信号的配体亲和力的增加。观测结果(β2ar-nb80融合体还显示对于合成激动剂如异丙基肾上腺素(isoproterenol)或沙丁胺醇的增加的亲和力)表明,这样的构象受限融合蛋白可以提供更好的起点来筛选触发/抑制特定信号通路的合成化合物或生物制剂。因此,相比于其活性状态不受限的受体,选择性地识别正位或变构位点(其是β2ar的活性构象特有的)(导致g蛋白偶联信号)的结构特点的小分子或片段可以相对于β2ar-nb801:1融合体更紧密多达3个数量级而进行结合。对于hts目的,这意味着,相比于对其活性状态不受限的β2ar的hts努力,如果用gpcr-nb融合体如β2ar-nb80融合体进行这样的筛选,则拾取诱导g蛋白偶联信号的测试化合物的敏感性可以增加3个数量级。
借助于gpcr(通过外源性添加构象选择性结合域其被稳定于特定构象(wo2012007593)),或在细胞体系(借此和构象选择性结合域一起共表达gpcr)中,在gpcr和本发明的嵌合多肽的结合域之间的分子内相互作用的明确限定的1:1化学计量比不能如在分子间相互作用中有效地被保持/确保。涉及限定的1:1化学计量比的特定优点在于,甚至在不存在任何构象选择性配体的情况下结合域部分也可以限制特定受体构象在高、有效的分子内浓度(见实施例8)。
相比于gpcr与稳定可施药构象的纳米抗体的非共价复合物(wo2012007593)(rasmussenetal.2011b),基于经典的受体结合技术如放射性配体竞争(抑制或置换)测定来选择性地筛选配体(其对于给定gpcr的特定可施药构象具有特异性)的子集的hts可以显著受益自本发明的嵌合多肽。这是由于这样的事实,即放射性配体竞争测定(或通过另一种方式标记的配体的竞争测定)严格依赖于游离配体和受体结合的配体的物理分离。这通常是通过用过滤器的过滤、通过离心、通过尺寸排阻层析或通过其它生物物理方法来进行。利用同样的常规方法,可以容易地自结合于gpcr-结合域融合体的标记配体分离游离配体(通过任何方式标记的),这是因为以gpcr与结合域的限定的1:1化学计量比来共价连接嵌合体。在结合域并不共价连接于gpcr(wo2012007593)的情况下,放射性配体竞争测定和数据的随后分析的进行要困难得多,这是因为并不持有gpcr与结合域的1:1化学计量比,这意味着更多分子物质有待分离和分析:游离配体、自由结合域、配体-受体复合物、受体-结合域复合物、配体-受体-结合域复合物与游离配体、自由嵌合体和配体-嵌合体复合物(在gpcr-结合域融合体的情况下)(见实施例8)。
此外,利用新出现的生物物理方法,包括表面等离子体共振(richetal.2011)和靶固定nmr筛选(fruhetal.2010),本发明的gpcr-结合域融合蛋白的创新特点还允许筛选gpcr的特定功能构象,用于结合先导化合物或片段,这是因为gpcr可以以gpcr与结合域的限定的1:1化学计量比在固相上被固定为处于所期望的功能构象的单一蛋白融合体。
此外,尤其令人惊奇的是,本发明的gpcr-结合域融合蛋白允许在单个比较放射性配体竞争测定中筛选和区别激动剂、拮抗剂和反向激动剂。在无需细胞受体信号测定的情况下,区别和预测nm-μm浓度的测试化合物的作用方式的能力是用于化合物筛选的另外的优点(见实施例24-26)。
具有限定的1:1化学计量比的这些gpcr-结合域融合蛋白的另一个优点涉及gpcr的x射线晶体学以及其在基于结构的药物设计中的应用。更具体地,gpcr-结合域融合体的一个优点是,在存在或不存在任何配体的情况下,可以以限定的1:1化学计量比来纯化和结晶融合蛋白。因此仅仅通过将化合物浸入无配体gpcr-结合域融合体就可以确定多配体-受体共复合物结构,并具有以预先限定的受体构象来捕获这种晶体系统的另外的优点,如,例如,导致g蛋白和/或β-抑制蛋白偶联信号的活性构象,或不能促进g蛋白和/或抑制蛋白偶联信号的非活性构象。这种用(低亲和力)先导化合物来浸泡/共结晶无配体受体的可能性是先导生成的前提条件,其涉及虚拟筛选(virtualscreening)以及在药物发现的先导优化部分中,例如以解决选择性和溶解性问题。
因此,按照第一方面,本发明涉及包含gpcr部分和结合域部分的嵌合多肽。更具体地,本发明的嵌合多肽包含融合于结合域的gpcr,其中所述结合域在分子内相互作用中是针对和/或能够特异性地结合于gpcr。按照一种具体实施方式,直接或通过接头,将结合域融合于gpcr。在一种具体实施方式中,结合域不是天然存在的结合配偶体(bindingpartner),如g蛋白或抑制蛋白(arrestin)。
优选地,如包含在嵌合多肽中的结合域是构象选择性结合域。按照一种具体实施方式,本发明涉及包含融合于结合域的gpcr的嵌合多肽,其中上述结合域对于活性构象是选择性的,所以,在结合于结合域以后,gpcr被稳定于活性构象。按照具体实施方式,活性构象是激动剂结合的活性构象,如完全激动剂结合的活性构象或部分激动剂结合的活性构象。可替换地,本发明还涉及包含融合于结合域的gpcr的嵌合多肽,其中上述结合域对于非活性构象是选择性的,所以,在结合于结合域以后,gpcr被稳定于非活性构象。按照一种实施方式,非活性构象是反向激动剂结合的非活性构象。优选地,相比于单独的相应的gpcr,本发明的包含融合于构象选择性结合域的gpcr的嵌合多肽具有对于构象选择性配体的增加的亲和力。
按照更具体的实施方式,本发明提供了如上所述的嵌合多肽,其中结合域特异性地结合于gpcr的细胞内构象表位(抗原决定基,epitope),更具体地其中所述细胞内表位被包含在用于下游信号蛋白的结合位点(例如g蛋白结合位点)。可替换地,本发明提供了如上所述的嵌合多肽,其中结合域结合于gpcr的胞外构象表位。
按照其它具体实施方式,形成如上所述的嵌合多肽的一部分的结合域包含氨基酸序列,其包含4个框架区(fr1至fr4)和3个互补决定区(cdr1至cdr3)、或其任何适宜的片段。更具体地,结合域可以是免疫球蛋白单可变域(immunoglobulinsinglevariabledomain),优选免疫球蛋白单可变域,其衍生自仅重链抗体。最优选地,免疫球蛋白单可变域包含vhh序列或纳米抗体序列(nanobodysequence)。
在另一个方面,本发明设想包含如上所述的嵌合多肽和受体配体的复合物。这样的复合物可以处于溶液或晶体中。
此外,还涵盖包含编码如上所述的嵌合多肽的核酸序列的核酸分子,以及包含上述核酸的宿主细胞。宿主细胞可以具有原核或真核来源,如细菌细胞、酵母细胞、哺乳动物细胞、昆虫细胞。还设想膜成分(膜组分,membranecompositions),其包含如本文描述的嵌合多肽或复合物。
本发明的一个其它方面涉及用来产生包含融合于结合域的gpcr的嵌合多肽的方法,上述方法包括以下步骤:在合适的条件下培养包含如上文中描述的嵌合多肽的宿主细胞,以及可选地分离嵌合多肽。
此外,本发明还提供了用来在宿主细胞的细胞表面或在特定细胞膜部分(fraction)中展示处于活性或非活性构象的gpcr的方法,上述方法包括以下步骤:提供包含如上所述的嵌合多肽的宿主细胞,以及在合适的条件下培养上述细胞以表达嵌合多肽。
本发明的再一个方面是确定(识别)构象选择性化合物的方法,上述方法包括以下步骤:
(i)提供如上所述的嵌合多肽,以及
(ii)提供测试化合物,以及
(iii)评估测试化合物与包含在嵌合多肽中的gpcr的选择性结合。
通过上述方法确定的构象选择性化合物(小分子、抗体、抗体衍生物、肽或任何其它蛋白支架,其可以与gpcr相互作用)可以是非偏爱激动剂(unbiasedagonist)、非偏爱反向激动剂、或偏爱配体(biasedligand),其分别触发或抑制g蛋白偶联信号或抑制蛋白偶联信号。按照一种具体实施方式,如上所述的方法进一步包括以下步骤:按照生物活性(激动剂活性、反向激动剂、拮抗剂活性)来分类测试化合物。或者换句话说,上述方法允许区分激动剂、反向激动剂和拮抗剂活性。
还涵盖如上所述的嵌合多肽或如上所述的复合物用来结晶和/或用来解析gpcr的结构;用来将gpcr捕获于功能构象状态中的应用(用途)。
在以下描述和所附权利要求中限定本发明的进一步的方面和优选的实施方式。
附图说明
图1:gpcr信号的构象复杂性。配体偏爱效力的示意图,其中三种不同的配体可以诱导和/或稳定不同的受体构象,其将各自促进相对于不同的效应子系统的不同的相对效力。缩写:r,受体;a、b和c,在特定信号通路中涉及的蛋白质或蛋白质组(修改自galandrinetal.2007)。
图2a-2e:在实施例1中描述的β2ar-纳米抗体融合体包含借助于肽接头连接的两种不同的蛋白质:gpcrβ2ar365n,接头ggggsgggs(下划线并以粗体突出显示)、纳米抗体。下划线处为ha信号肽和his6肽标记物。以粗体表示flag标记物,以灰色阴影指示tev切割位点。2a.β2ar-纳米抗体融合构建体的草图(cartoonrepresentation)。2b.由pfastbacβ2ar365n-nb80编码的开放阅读框的氨基酸序列。2c.由pfastbacβ2ar365n-nb71编码的开放阅读框的氨基酸序列。2d.由pfastbacβ2ar365n-nb69编码的开放阅读框的氨基酸序列。2e.由pfastbacβ2ar365n-nb60编码的开放阅读框的氨基酸序列。
图3:通过western印迹分析的在sf9细胞中重组β2ar-纳米抗体融合蛋白的表达。通过抗flag检测来检测融合蛋白的存在(如在实施例4中解释的)。非感染sf9细胞的膜(泳道1)。表达未融合于任何nb的重组β2ar365n的sf9细胞的膜(泳道2:用1:250稀释的p2感染细胞并培养48小时;泳道3:用1:250稀释的p2感染细胞并培养55小时;泳道5:用1:100稀释的p2感染细胞并培养48小时;泳道6:用1:100稀释的p2感染细胞并培养55小时)。蛋白标志物(pagerulertmprestainedproteinladder,fermentascat.nrsm0671)(泳道4)。表达重组β2ar365n-nb80的sf9细胞的膜(泳道7:用1:100稀释的p2感染细胞并培养55小时)。表达重组β2ar365n-nb71的sf9细胞的膜(泳道8:用1:100稀释的p2感染细胞并培养55小时)。表达重组β2ar365n-nb69的sf9细胞的膜(泳道9:用1:100稀释的p2感染细胞并培养55小时)。
图4a-4f:相比于β2ar365n-nb69模拟融合体,β2ar365n-nb80融合体的配体结合性能。与[3h]-双氢烯丙洛尔([3h]-dihydroalprenolol,[3h]-dha)竞争的不同的配体的放射性配体置换测定(displacementassay),用于结合于β2ar365n-nb80(空心圆),以及利用β2ar365n-nb69嵌合体(实心圆)作为内部参比物,用于非限制β2肾上腺素能受体(如在实施例6中描述的)。对两种受体进行竞争测定,其中分别使用天然激动剂肾上腺素(a)、激动剂(-)-异丙基肾上腺素(b)、中性拮抗剂烯丙洛尔(c)、部分激动剂沙丁胺醇(d)、反向激动剂ici-118,551(e)、和拮抗剂卡维地洛(f)作为竞争性配体。利用graphpadprism6.0的标准设置,已通过非线性回归来将曲线拟合于用于竞争性结合的模型。ic50标记值已经拟合于一结合位点竞争模型。ic50高标记值已经拟合于二结合位点竞争性结合模型并对应于最高亲和力位点的ic50。
图5a-5b:相比于非融合β2ar365n,β2ar365n-nb80融合体的配体结合性能。与[3h]-双氢烯丙洛尔([3h]-dha)竞争的不同的配体的放射性配体置换测定,用于结合于β2ar365n-nb80(空心正方形),以及使用非融合β2ar365n受体(实心正方形)作为内部参比物,用于非限制β2肾上腺素能受体(如在实施例6中描述的)。对两种受体进行竞争测定,其中分别使用天然激动剂肾上腺素(a)、和拮抗剂卡维地洛(b)作为竞争性配体。已通过非线性回归来将曲线拟合于用于竞争性结合的模型,其中利用graphpadprism6.0的标准设置。ic50标记值已经拟合于一结合位点竞争模型。ic50高标记值已经拟合于二结合位点竞争性结合模型以及对应于最高亲和力位点的ic50。
图6a-6f:相比于β2ar365n-nb69融合体,β2ar365n-nb71融合体的配体结合性能。与[3h]-双氢烯丙洛尔([3h]-dha)竞争的不同的配体的放射性配体置换测定,用于结合于β2ar365n-nb71(空心三角形),以及利用β2ar365n-nb69嵌合体(实心三角形)作为内部参比物,用于非限制β2肾上腺素能受体(如在实施例6中描述的)。对两种受体进行竞争测定,其中分别使用天然激动剂肾上腺素(a)、完全激动剂异丙基肾上腺素(b)、中性拮抗剂烯丙洛尔(c)、部分激动剂沙丁胺醇(d)、反向激动剂ici-118,551(e)和拮抗剂卡维地洛(f)作为竞争性配体。已通过非线性回归来将曲线拟合于用于竞争性结合的模型,其中使用graphpadprism6.0的标准设置。ic50标记值已经拟合于一结合位点竞争模型。ic50高标记值已经拟合于二结合位点竞争性结合模型以及对应于最高亲和力位点的ic50。
图7:相比于β2ar365n-nb69融合体,β2ar365n-nb80融合体的热稳定性。无配体ddm溶解的融合蛋白β2ar365-nb80(空心菱形)和β2ar365n-nb69(实心菱形)的热稳定性。在不存在任何配体的情况下,对在0,08%ddm中的溶解的受体进行热稳定性测定(在实施例7中描述的)。已通过非线性回归来将曲线拟合,利用对数(激动剂)vs反应-可变斜率(四参数)方程,其中利用prism并利用graphpadprism6.0(graphpadsoftware,sandiego,ca)。
图8:相比于复合于外源添加的nb80的非融合β2ar365n,β2ar365n-nb80融合体的配体结合性能。在不同浓度的nb80的存在下(500nmnb80:实心三角形,50nmnb80:实心菱形,5nmnb80:实心倒三角形以及50pmnb80:实心正方形;虚线)或在不同浓度的nb69的存在下(500nmnb69:空心三角形,50pmnb69空心正方形;点线),与[3h]-双氢烯丙洛尔([3h]-dha)竞争的肾上腺素的放射性配体置换测定,用于结合于非融合β2ar365n受体。在测定中,β2ar365n-nb80融合体(实心圆,实线)和β2ar365n-nb69融合体(空心圆,实线)用作内部参比物(如在实施例8中描述的)。已通过非线性回归来将曲线拟合于用于竞争性结合的模型,其中利用graphpadprism6.0的标准设置。ic50标记值已经拟合于一结合位点竞争模型。ic50高标记值已经拟合于二结合位点竞争性结合模型以及对应于最高亲和力位点的ic50。
图9a-9c:在实施例9中描述的m2r-纳米抗体融合体含有借助于肽接头连接的两种不同的蛋白质:gpcrm2δi3r、接头gggsggggsggggsggggsgggs(下划线并以粗体突出显示)(seqidno:49)和纳米抗体。下划线处为ha信号肽以及his6肽标记物。以粗体表示flag标记物,以灰色阴影指示tev切割位点。a.m2r-纳米抗体融合构建体的草图。b.由pfastbac1m2δi3r编码的开放阅读框的氨基酸序列。c.由pfastbac1m2δi3r-nb9-1编码的开放阅读框的氨基酸序列。
图10a-10b:相比于自由非融合m2δi3r,m2δi3r-nb9-1的配体结合性能。与[3h]-n甲基东莨菪碱([3h]-nmethylscopolamine,[3h]-nms)竞争的不同的配体的放射性配体置换测定,用于结合于m2δi3r-nb9-1(实心圆),以及使用m2δi3r(交叉圆)作为内部参比物,用于非限制毒蕈碱性受体m2(如在实施例12中描述的)。对两种受体进行竞争测定,其中分别使用激动剂氯化氨甲酰胆碱(卡巴可,carbachol)(a)或激动剂氧化震颤素m(oxotremorinem)(b)作为竞争性配体。已通过非线性回归来将曲线拟合于用于竞争性结合的模型,其中使用graphpadprism6.0的标准设置。ic50标记值已经拟合于一结合位点竞争模型。ic50高标记值已经拟合于二结合位点竞争性结合模型以及对应于最高亲和力位点的ic50。
图11a-11c:在实施例13中描述的β1ar-纳米抗体融合体含有借助于肽接头连接的两种不同的蛋白质:gpcr人β1ar、接头ggggsggggsggggsggggsgggs(seqidno:60)(下划线并以粗体突出显示)和纳米抗体。下划线处为ha信号肽和his6肽标记物。以粗体表示flag标记物,以灰色阴影指示tev切割位点。a.β1ar-纳米抗体融合构建体的草图。b.由pfastbachβ1ar-nb80编码的开放阅读框的氨基酸序列。c.由pfastbachβ1ar-nb69编码的开放阅读框的氨基酸序列。
图12a-12c:相比于hβ1ar-nb69融合体,hβ1ar-nb80融合体的配体结合性能。与[3h]-双氢烯丙洛尔([3h]-dha)竞争的不同的配体的放射性配体置换测定,用于结合于hβ1ar-nb80(空心圆),以及利用hβ1ar-nb69嵌合体(实心圆)作为内部参比物,用于非限制β1肾上腺素能受体(如在实施例16中描述的)。对两种β1受体融合体进行竞争测定,其中分别使用天然激动剂肾上腺素(a)、反向激动剂ici-118,551(b)和中性拮抗剂烯丙洛尔(c)作为竞争性配体。通过非线性回归来将曲线拟合于用于竞争性结合的模型,其中使用graphpadprism6.0的标准设置。ic50标记值已经拟合于一结合位点竞争模型。ic50高标记值已经拟合于二结合位点竞争性结合模型以及对应于最高亲和力位点的ic50。
图13a-13c:相比于β2ar365n-nb69模拟融合体,β2ar365n-nb60融合体的配体结合性能。与[3h]-双氢烯丙洛尔([3h]-dha)竞争的不同的配体的放射性配体置换测定,用于结合于β2ar365n-nb80(空心圆)、β2ar365n-nb60(交叉空心圆),其中使用β2ar365n-nb69嵌合体(实心圆)作为内部参比物,用于非限制β2肾上腺素能受体(如在实施例19中描述的)。对β2受体融合体进行竞争测定,其中分别使用天然激动剂肾上腺素(a)、激动剂(-)-异丙基肾上腺素(b)和反向激动剂ici-118,551(c)作为竞争性配体。通过非线性回归来将曲线拟合于用于竞争性结合的模型,其中使用graphpadprism6.0的标准设置。ic50标记值已经拟合于一结合位点竞争模型。ic50高标记值已经拟合于二结合位点竞争性结合模型以及对应于最高亲和力位点的ic50。
图14.全长野生型人mor1(uniprot代码p35372;seqidno:46)和小鼠mor1(uniprot代码p42866;sedidno:45)的aa序列对比。为了纯化表达在sf9细胞中的小鼠mor1,已在两个下划线甘氨酸之间引入n末端tev(n端;小鼠mor1的昆虫细胞表达)蛋白酶切割位点。在表达在sf9中的小鼠和人mor1中,在下划线异亮氨酸和下划线谷氨酸之间也已引入c末端3c蛋白酶切割位点。以灰色阴影示出按照uniprot数据库的理论细胞内环(icl)和细胞内c端。在mor-纳米抗体融合构建体中已被删除的aa残基是带删除线的(striked-through)。
图15:在实施例20中描述的mor1-纳米抗体融合体含有借助于肽接头连接的两种不同的蛋白质:gpcrmor1、34gs接头(下划线并以粗体突出显示)和纳米抗体。下划线处为ha信号肽和his6肽标记物。以粗体表示flag标记物。以灰色阴影指示3c切割位点。a.mor1-纳米抗体融合构建体的草图。b-e.四种mor-nb开放阅读框的氨基酸序列。
图16:相比于hmor1-nb10模拟融合体,hmor1-nb33融合体的配体结合性能。与放射性配体竞争的不同的配体的放射性配体置换测定,用于结合于hmor1-nb33(圆),其中使用hmor1-nb10嵌合体(正方形)作为内部参比物,用于非限制受体。对两种受体进行竞争测定,其中使用激动剂dmt1-dalda(a)、kgop01(b)、和拮抗剂纳洛酮(c)作为竞争性配体。
图17.具有不同的活性谱,与β2ar融合体的比较片段结合。
6种片段与活性状态稳定β2ar365n-nb80融合体(空心条)相对于突出的、非限制构象β2ar365n-nb69融合体(黑条)的结合的代表性的实例,利用[3h]-双氢烯丙洛尔([3h]-dha)作为放射性配体并通过放射性配体置换测定所测得。2种片段(ac23506、cc56213)示出激动剂曲线,2种片段(cc46746、cc44914)具有拮抗剂曲线以及2种片段km08985)示出反向激动剂曲线。
图18a-18c.相比于β2ar-nb69融合体,6种片段与β2ar-nb80融合体的剂量反应曲线(剂量响应曲线)。
与[3h]-双氢烯丙洛尔([3h]-dha)竞争的6种不同的片段的放射性配体置换测定,用于结合于β2ar365n-nb80(空心圆),以及使用β2ar365n-nb69嵌合体(实心圆)作为内部参比物,用于非限制β2肾上腺素能受体(如在实施例24中描述的)。对β2受体融合体进行竞争测定,其中分别使用具有激动剂曲线的2种片段(a)、具有拮抗剂曲线的2种片段(b)和具有反向激动剂曲线的2种片段(c)作为竞争性配体。借助于对数(激动剂)vs反应-可变斜率(四参数)方程,已通过非线性回归来拟合曲线,其中使用prism并使用graphpadprism6.0.(graphpadsoftware,sandiego,ca)。
图19:相比于β2ar-nb69模拟融合体,制作的(阐述的,elaborate)片段与β2ar-nb80融合体的结合性能。与[3h]-双氢烯丙洛尔([3h]-dha)竞争的不同的制作的和原始亲代片段的放射性配体置换测定,用于结合于β2ar365n-nb80(实心符号),其中使用β2ar365n-nb69嵌合体(空心符号)作为内部参比物,用于非限制β2肾上腺素能受体。对β2受体融合体进行竞争测定,其中分别使用(a)cc40246(实线)、制作的片段:化合物2(虚线)和化合物3(点线)作为竞争性配体,以及分别使用(b)cc56213(实线)、制作的片段:化合物9(虚线)和化合物10(点线)作为竞争性配体。已通过非线性回归来将曲线拟合于用于竞争性结合的模型,其中使用graphpadprism6.0的标准设置。ic50标记值已经拟合于一结合位点竞争模型。
具体实施方式
定义
现将参照特定实施方式和参照某些附图来描述本发明,但本发明并不限于此而是仅受限于权利要求。在权利要求中的任何参考符号不应当被解释为限制范围。描述的附图仅是示意性的并且是非限制性的。在附图中,为了说明的目的,一些要素的尺寸可以被放大并且没有按尺度绘制。在本描述和权利要求中使用术语"包含"的情况下,它并不排除其它要素或步骤。在当提及单数名词时使用不定或定冠词例如"一"或"一种"、"该"的情况下,除非另外特别声明,这包括上述名词的复数。此外,在描述和权利要求中的术语第一、第二、第三等是用于区分类似的要素并且不一定用于描述顺序或时间顺序。应该理解的是,如此使用的术语在适当情况下是可互换的,以及本文描述的本发明的实施方式能够以不同于本文描述或说明的顺序的其它顺序进行操作。
除非本文中另外定义,连同本发明一起使用的科学和技术术语和短语应具有由本领域的技术人员通常理解的含义。通常,连同本文描述的分子和细胞生物学、结构生物学、生物物理学、药理学、遗传学以及蛋白质和核酸化学一起使用的术语,以及本文描述的分子和细胞生物学、结构生物学、生物物理学、药理学、遗传学以及蛋白质和核酸化学的技术,是本领域中众所周知和常用的。除非另有说明,通常按照在本领域中众所周知的以及如在整个本说明书中引用和讨论的各种一般和更具体的参考文献中描述的常规方法来进行本发明的方法和技术。见,例如,sambrooketal.molecularcloning:alaboratorymanual,3thed.,coldspringharborlaboratorypress,coldspringharbor,n.y.(2001);ausubeletal.,currentprotocolsinmolecularbiology,greenepublishingassociates(1992,和2002增刊);rup,biomolecularcrystallography:principles,practiceandapplicationstostructuralbiology,1stedition,garlandscience,taylor&francisgroup,llc,aninformabusiness,n.y.(2009);limbird,cellsurfacereceptors,3ded.,springer(2004)。
术语"嵌合多肽”、“嵌合蛋白"、"融合多肽"、“融合蛋白”在本文中可互换使用并且是指蛋白,该蛋白包含至少两个单独的和不同的多肽成分,其可以不源自或可以不源自相同的蛋白。多肽成分,虽然通常在天然状态下是未连接的,是通过它们的相应的氨基和羧基末端并经由肽键加以连接以形成单一连续多肽。例如,融合于抗体的感兴趣的蛋白是嵌合蛋白的实例。用于连接或融合两种多肽的方便的方式是通过表达它们(作为融合蛋白)自重组核酸分子,其包含第一多核苷酸,该第一多核苷酸编码第一多肽,其可操作地连接于编码第二多肽的第二多核苷酸。否则,可以通过肽键,其起因于内含肽(intein)介导的蛋白质剪接(muralidharanandmuir2006)或sortagging(poppetal.2007),来连接包含在融合蛋白中的多肽,或可以通过任何其它方式来化学连接。通常,嵌合多肽将不存在为在由在非重组基因组中的基因编码的蛋白中的连续多肽。术语“嵌合多肽”和语法等效术语是指非天然存在的分子,其意味着它是人造的。术语“融合于”、和其它语法等效术语,当提及嵌合多肽(如本文定义的)时,是指用于连接两个或更多多肽成分的任何化学或重组机制。两个或更多多肽成分的融合可以是序列的直接融合或它可以是间接融合,例如借助于间插(intervening)氨基酸序列或接头序列。本文将进一步提供实例。
如在本文中所使用的,术语“膜蛋白”是指蛋白质,其附连于或关联于细胞或细胞器的膜。它们经常被细分为几种类型,包括整合膜蛋白(integralmembraneprotein)、外在膜蛋白(外围膜蛋白,peripheralmembraneprotein)和脂质锚定蛋白。优选地,膜蛋白是整合膜蛋白,其永久结合于脂双层并且其需要洗涤剂或另一种非极性溶剂来除去。整合膜蛋白包括跨膜蛋白,其永久附连于脂膜并跨过膜一次或若干次。适宜的膜蛋白的实例包括受体如gpcr(除了别的以外)。
如在本文中所使用的,术语"多肽"、"蛋白质"、“肽”在本文中可互换使用,并且是指任何长度的氨基酸的聚合物形式,其可以包括编码和非编码的氨基酸、化学或生物化学修饰或衍生的氨基酸、和具有修饰肽主链的多肽。在整个申请中,将使用氨基酸的标准单字母表示法。通常,术语“氨基酸”将指“蛋白原氨基酸(proteinogenicaminoacid)”,即那些氨基酸,其天然存在于蛋白质中。最特别地,氨基酸是处于l异构体形式,但还设想d氨基酸。
如在本文中所使用的,术语"核酸分子"、"多核苷酸"、“多核酸”、“核酸”可互换使用并且是指任何长度的核苷酸的聚合物形式:脱氧核糖核苷酸或核糖核苷酸、或其类似物。多核苷酸可以具有任何三维结构,并且可以执行任何功能(已知或未知的)。多核苷酸的非限制性实例包括基因、基因片段、外显子、内含子、信使rna(mrna)、转运rna、核糖体rna、核酶、cdna、重组多核苷酸、分支多核苷酸(branchedpolynucleotides)、质粒、载体、任何序列的分离的dna、调控区、任何序列的分离的rna、核酸探针、和引物。核酸分子可以是线性或环状的。
本文披露的任何肽、多肽、核酸等可以被"分离"或"纯化"。"分离的"在本文中用来表示提到的材料:(i)分离自与其存在于自然界的一种或多种物质(例如,分离自至少一些细胞材料、分离自其它多肽、分离自它的天然序列环境);和/或(ii)通过一种方法所产生,上述方法涉及人工处理如重组dna技术、化学合成等;和/或(iii)具有在自然界中不存在的序列、结构、或化学成分。如在本文中所使用的,"纯化的"是指,存在指示的核酸或多肽,其基本上不存在其它生物大分子,例如,多核苷酸、蛋白质等。在一种实施方式中,多核苷酸或多肽被纯化以致它包含(constitue)按重量计至少90%,例如,按重量计至少95%,例如,按重量计至少99%,的多核苷酸或多肽(但可以存在水、缓冲剂(缓冲液)、离子、和其它小分子,尤其是分子量小于1000道尔顿的分子)。
如在本文中所使用的,术语"序列同一性"是指,针对比较窗口,基于核苷酸-核苷酸或氨基酸-氨基酸,序列相同的程度。因此,"序列同一性百分比"的计算是通过相对于比较窗口比较两个最佳比对序列,确定在两个序列中存在相同核酸碱基(例如,a、t、c、g、i)或相同的氨基酸残基(例如,ala、pro、ser、thr、gly、val、leu、ile、phe、tyr、trp、lys、arg、his、asp、glu、asn、gln、cys和met)的位置的数目以产生匹配位置的数目,匹配位置的数目除以在比较窗口中的总位置数目(即,窗口大小),然后结果乘以100,以产生序列同一性百分比。可以通过人工或通过利用在本领域中可获得的计算机程序来确定序列同一性百分比。有用的算法的实例是pileup(higgins&sharp,cabios5:151(1989)、blast和blast2.0(altschuletal.j.mol.biol.215:403(1990)。用于进行blast分析的软件是通过nationalcenterforbiotechnologyinformation(http://www.ncbi.nlm.nih.gov/)公开可获得的。
"相似性"是指相同的或构成保守置换的氨基酸的百分比数目。可以利用序列比较程序如gap(deverauxetal.1984)确定相似性。以这种方式,可以通过将间隙插入序列对比来比较类似或基本不同长度的序列与本文中引用的那些序列,例如,通过由gap使用的比较算法来确定上述间隙。如在本文中所使用的,“保守替换”是用其侧链具有类似的生化特性(例如是脂族的,是芳族的,是带正电荷的,…)的其它氨基酸所进行的氨基酸替换,并且是技术人员众所周知的。非保守替换则是用其侧链并不具有类似的生化特性的其它氨基酸所进行的氨基酸的替换(例如用极性残基替换疏水性残基)。保守替换将通常产生不再是相同的但仍然高度相似的序列。保守替换是预期组合,如gly,ala;val,ile,leu,met;asp,glu;asn,gln;ser,thr;lys,arg;cys,met;以及phe,tyr,trp。
"缺失"在这里被定义为在氨基酸或核苷酸序列中的变化,其中,相比于亲本多肽或核酸的氨基酸序列或核苷酸序列,一个或多个氨基酸或核苷酸残基分别是不存在的。在蛋白质的范围内,缺失可以涉及约2、约5、约10、多达约20、多达约30或多达约50或更多个氨基酸的缺失。蛋白质或其片段可以含有多于一个的缺失。在gpcr的范围内,缺失还可以是环缺失、或n和/或c端缺失、或它们的组合。如对于技术人员将是清楚的,gpcr的n和/或c端缺失还被称为gpcr的氨基酸序列的截短体或截短型gpcr。
"插入"或"添加"是在氨基酸或核苷酸序列中的变化,相比于亲本蛋白质的氨基酸序列或核苷酸序列,其已分别导致一个或多个氨基酸或核苷酸残基的添加。"插入"一般是指在多肽的氨基酸序列内添加一个或多个氨基酸残基,而"添加"可以是插入或指在n或c端、或两个末端处添加的氨基酸残基。在蛋白质或其片段的范围内,插入或添加通常是约1、约3、约5、约10、多达约20、多达约30或多达约50或更多个氨基酸。蛋白质或其片段可以含有多于一个的插入。
如在本文中所使用的,相比于亲本蛋白质或其片段的氨基酸序列或核苷酸序列,"替换"产生于分别由不同的氨基酸或核苷酸来替换一个或多个氨基酸或核苷酸。应理解的是,蛋白质或其片段可以具有保守氨基酸替换,其对蛋白质活性基本上没有影响。保守替换是预期组合,如gly,ala;val,ile,leu,met;asp,glu;asn,gln;ser,thr;lys,arg;cys,met;以及phe,tyr,trp。
当参照细胞、核酸、蛋白质或载体使用时,术语"重组体"是指,通过外源核酸或蛋白质的引入或天然核酸或蛋白质的改变,细胞、核酸、蛋白质或载体已被修饰,或细胞衍生自如此修饰的细胞。因此,例如,重组细胞表达在细胞的天然(非重组)形式内没有发现的核酸或多肽,或表达天然基因,该天然基因在其他情况下会异常表达、低表达、过度表达或根本不表达。
如在本文中所使用的,术语"表达"是指借其并基于基因的核酸序列来产生多肽的过程。上述过程包括转录和翻译。
如在本文中所使用的,术语"可操作地连接的"是指连锁,其中调节序列邻接于感兴趣的基因以调控感兴趣的基因,以及以反式或在一定距离处作用的调节序列以调控感兴趣的基因。例如,dna序列可操作地连接于启动子,其时它连接于启动子下游(相对于启动子的转录起始位点)并允许转录延伸通过dna序列进行。如果它被表达为参与多肽的转运的前体蛋白,则用于信号序列的dna可操作地连接于编码多肽的dna。通常通过在适宜限制位点或代替其插入的衔接头或接头处的连接(利用本领域技术人员已知的限制性内切核酸酶)来完成dna序列与调节序列的连锁。
如在本文中所使用的,术语"调节序列",以及还被称为“调控序列”是指这样的多核苷酸序列,其是必要的以影响它们所可操作地连接的编码序列的表达。调节序列是这样的序列,其调控核酸序列的转录、转录后事件和翻译。调节序列包括适当的转录起始、终止、启动子和增强子序列;有效的rna加工信号如剪接和多腺苷酸化信号;稳定细胞质mrma的序列;增强翻译效率的序列(例如,核糖体结合位点);增强蛋白质稳定性的序列;以及当需要时,增强蛋白质分泌的序列。上述调控序列的特性是不同的,其取决于宿主生物体。术语"调节序列"旨在包括(在最低限度)其存在是表达必不可少的所有成分,并且还可以包括其存在是有利的另外的成分,例如,前导序列和融合配偶体序列。
如在本文中所使用的,术语"载体"旨在指这样的核酸分子,其能够转运它已连接的另一种核酸分子。载体可以是任何适当类型,包括但不限于噬菌体、病毒、质粒、噬菌粒、粘粒、杆粒(bacmid)或甚至人工染色体。某些载体能够在它们被引入的宿主细胞中自主复制(例如,载体,其具有在宿主细胞中起作用的复制起点)。在引入宿主细胞以后。其它载体可以被整合进入宿主细胞的基因组,从而连同宿主基因组一起被复制。此外,某些优选的载体能够指导感兴趣的某些基因的表达。这样的载体在本文中称为"重组表达载体"(或者简单地,"表达载体")。按照需要并按照特定的宿主生物体(例如细菌细胞、酵母细胞),适宜的载体具有调节序列,如启动子、增强子、终止序列等。通常,按照本发明的重组载体包含至少一种“嵌合基因”或“表达盒(表达框)”。表达盒通常是dna构建体,其优选包括(在转录的方向上,5’至3’):启动区,与转录起始区可操作地连接的本发明的多核苷酸序列、其同源物、变体或片段,以及终止序列,其包括用于rna聚合酶的终止信号和多腺苷酸化信号。可以理解的是,所有这些区应能够在待转化的生物细胞(如原核或真核细胞)中操作。包含转录起始区的启动子区,其优选包括rna聚合酶结合位点,以及多腺苷酸化信号对于待转化的生物细胞可以是天然的,或可以源自替代来源,其中在生物细胞中上述区是功能性的。
如在本文中所使用的,术语“宿主细胞”旨在指已将重组载体引入其中的细胞。应当理解的是,这样的术语旨在不仅指特定主体细胞而且指上述细胞的子代。由于起因于突变或环境影响在后代中某些修饰可以发生,所述这样的子代可以事实上不相同于亲代细胞,但仍然被包括在术语"宿主细胞"的范围内(如在本文中所使用的)。宿主细胞可以是在培养物中生长的分离的细胞或细胞系或可以是保留(reside)在活组织或生物体中的细胞。尤其是,宿主细胞是细菌或真菌来源,但还可以是植物或哺乳动物来源。措辞“宿主细胞”、“重组宿主细胞"、"表达宿主细胞"、"表达宿主系统"、"表达系统"旨在具有相同含义并且在本文中可互换使用。
如在本文中所使用的,“表位”是指多肽的抗原决定簇(antigenicdeterminant)。表位可以包含处于空间构象的3个氨基酸,其是表位独有的。通常,表位由至少4、5、6、7个这样的氨基酸组成,以及更通常地,由至少8、9、10个这样的氨基酸组成。用于确定氨基酸的空间构象的方法在本领域中是已知的,并且包括,例如,x射线晶体学和多维核磁共振。
如在本文中所使用的,“构象表位”是指包含氨基酸的表位,其中上述氨基酸处于多肽的折叠的三维构象独有的空间构象。通常,构象表位由氨基酸组成,其中上述氨基酸在线性序列中是不连续的但其以蛋白质的折叠结构聚集在一起。然而,构象表位还可以由线性序列的氨基酸组成,其中上述线性序列的氨基酸采用多肽的折叠的三维构象独有的构象(并且在变性状态中不存在)。在蛋白质复合物中,构象表位由氨基酸组成,其中上述氨基酸在一个或多个多肽的线性序列中是不连续的,在不同的折叠多肽的折叠和它们在独特的四级结构中缔合以后,其聚集在一起。类似地,在这里构象表位还可以由一个或多个多肽的线性序列的氨基酸组成,其聚集在一起并采用四级结构独有的构象。
术语蛋白质的"构象"或"构象状态"通常是指在任何瞬间蛋白质可以采取的结构的范围。本领域技术人员将认识到,构象或构象状态的决定因素包括蛋白质的一级结构,如反映在蛋白质的氨基酸序列(包括修饰氨基酸)中和围绕蛋白质的环境。蛋白质的构象或构象状态还涉及结构特点如蛋白质二级结构(例如,α螺旋、β片层,除了别的以外)、三级结构(例如,多肽链的三维折叠)、和四级结构(例如,多肽链与其它蛋白质亚单位的相互作用)。除了别的以外,对多肽链的翻译后和其它修饰如配体结合、磷酸化、硫酸化、糖基化、或疏水性基团的附连(连接),可以影响蛋白质的构象。此外,环境因素,如周围溶液的ph、盐浓度、离子强度、和重量克分子渗透浓度(osmolality),以及与其它蛋白质和辅因子的相互作用(除了别的以外)可以影响蛋白质构象。除其它方法之外,还可以通过对于活性或结合于另一种分子的功能测定或借助于物理方法如x射线晶体学、nmr、或自旋标记(spinlabeling),来确定蛋白质的构象状态。对于蛋白质构象和构象状态的一般性讨论,参考cantorandschimmel,biophysicalchemistry,parti:theconformationofbiological.macromolecules,w.h.freemanandcompany,1980,以及creighton,proteins:structuresandmolecularproperties,w.h.freemanandcompany,1993。
“功能构象”或“功能构象状态”是指以下事实:蛋白质,尤其是gpcr,具有不同的构象状态,其具有活性的动态范围,尤其是从没有活性到最大活性。应该清楚的是,如在本文中所使用的,“功能构象状态”意在覆盖蛋白质,尤其是gpcr,的任何构象状态,其具有任何活性,包括没有活性,并且并不意味着涵盖蛋白质的变性状态。gpcr的功能构象的非限制性实例包括活性构象、非活性构象或基础构象。特定类别的功能构象被定义为“可施药构象”并且一般是指靶蛋白的独特的治疗相关构象状态。作为说明,β2肾上腺素能受体的激动剂结合的活性构象对应于涉及平滑肌松弛、支气管通道扩张(哮喘)、在肌肉和肝脏中的血管舒张、子宫肌松弛、和胰岛素释放的受体的可施药构象。因此,将理解的是,可施药性(druggability)局限于特定构象,其取决于治疗适应症。在本文中进一步提供更多细节。
如在本文中所使用的,相对于gpcr的功能构象状态,术语“稳定”或“稳定的”是指将gpcr保留或保持于它用其它方式可能呈现的可能的构象的子集,这是由于gpcr部分与本发明的嵌合多肽的结合域部分的分子内相互作用的效果。在此范围内,特异性地或选择性地结合于gpcr的特定构象的结合域是指这样的结合域,相比于gpcr可以呈现的其它构象,其以更高的亲和力结合于处于构象的子集的gpcr。本领域技术人员将认识到,特异性地或选择性地结合于gpcr的特定构象的结合域将稳定此特定构象、和其相关活性。在本文中进一步提供更多细节。
如在本文中所使用的,术语"亲和力"一般是指配体(如本文中进一步定义的)结合于靶蛋白以向着通过它们的结合所形成的复合物的存在移动靶蛋白和配体的平衡的程度。因此,例如,在以相对相等浓度结合嵌合多肽和配体的情况下,高亲和力的配体将结合于嵌合多肽以向着高浓度的得到的复合物移动平衡。解离常数kd通常用来描述在配体和靶蛋白之间的亲和力。通常,解离常数具有低于10-5m的值。优选地,解离常数是低于10-6m,更优选地,低于10-7m。最优选地,解离常数是低于10-8m。用于描述在配体和它的靶蛋白之间的亲和力的其它方式是缔合常数(ka)、抑制常数(ki)、或间接地通过评估配体的效力,其中通过测量半最大抑制浓度(ic50)或半最大有效浓度(ec50)。应当理解的是,在本发明的范围内,术语“亲和力”用于结合靶gpcr的构象表位的结合域的情况以及结合于本发明的嵌合多肽的测试化合物(如本文中进一步定义的)的情况,更具体地结合于包含在嵌合多肽中的靶gpcr的正位或变构位点。
应当指出的是,在分子内相互作用中,如结合域部分与本发明的嵌合多肽的gpcr部分的特异性相互作用,两个相互作用基团被包含在单个分子内。在结合域和靶之间的解离常数,当它们是单独分子时,可以是已知的,但对于分子内相互作用,它们在溶液中的浓度是不相关的。相反,对于分子内相互作用,在大分子内两种基团的“有效浓度”才是重要的。如在本文中所使用的,术语“有效分子内浓度”或“有效摩尔浓度”(m有效)是指有效浓度并且可以计算为kd间/kd内,其中解离常数kd内,其是无量纲,是用来描述分子内反应的解离常数,其中上述分子内反应是靶gpcr和结合域的融合,以及其中kd间,其具有浓度的单位(例如摩尔浓度),是用于类似的分子间相互作用的解离常数,其中上述类似的分子间相互作用是结合域和靶gpcr的非共价复合。有效摩尔浓度将取决于大分子的结构,尤其是它使两种反应物在一起或保持它们分开的程度,加上两种基团被保持在其中的环境。如果大分子结构保持两种基团分开,则用于分子内反应的有效摩尔浓度将基本上是零,当结合域并不针对和/或不能特异性地结合(如本文中进一步定义的)于靶gpcr时,就是这种情况。在另一种极端情况下,当大分子结构保持两种基团处于用于反应的正确的接近和取向时,它们的有效摩尔浓度可以是非常高,高达1010m,的浓度,借助于两种独立分子,其是不可行的。按照本发明,当结合域能够特异性地结合(如本文中进一步定义的)于靶gpcr时,情况就是这样。这样的值是通过理论考虑加以预测并且还实验上观测到,其中依据当基团是在相同分子上以及在单独的分子上时,对于相同反应,速率或平衡常数的比率。
如在本文中所使用的,术语"特异性"是指结合域,尤其是免疫球蛋白或免疫球蛋白片段,如vhh或纳米抗体,相对于不同的抗原,优先结合于一种抗原的能力,并且并不一定意味着高亲和力。
如在本文中所使用的,术语"特异性地结合"和"特异性结合"一般是指结合域,尤其是免疫球蛋白,如抗体,或免疫球蛋白片段,如vhh或纳米抗体,优先结合于存在于不同的抗原的均匀混合物中的特定抗原的能力。在某些实施方式中,特异性结合相互作用将区别在样品中期望和不期望的抗原,在一些实施方式中大于约10至100倍或更大(例如,大于1000或10,000倍)。在gpcr的构象状态的范围内,上述术语特别是指,相比于另一种构象状态,结合域(如本文定义的)优先识别和/或结合于gpcr的特定构象状态的能力。因此,如在本文中所使用的,在本发明的上下文中,术语“构象选择性结合域”是指以构象选择性方式结合于靶gpcr的结合域。选择性地结合于gpcr的特定构象的结合域是指这样的结合域,相比于gpcr可以呈现的其它构象,其以更高亲和力结合于处于构象的子集的gpcr。本领域技术人员将认识到,选择性地结合于gpcr的特定构象的结合域将稳定或保留gpcr于此特定构象。例如,活性状态构象选择性结合域将优先结合于处于活性构象状态的gpcr并且将不会或在较小程度上结合于处于非活性构象状态的gpcr,因而将对所述活性构象状态具有更高亲和力;或反之亦然。术语“特异性地结合”、“选择性地结合”、“优先结合”、和其语法等效术语在本文中可互换使用。术语“构象特异性的”或“构象选择性的”在本文中也可互换使用。
如在本文中所使用的,术语“化合物”或“测试化合物”或“候选化合物”或“药物候选化合物”旨在具有相同含义并描述在测定中测试的任何分子,旨在具有天然存在的或合成的,如用于药物发现目的的筛选测定。因此,这些化合物包括有机或无机化合物。上述化合物包括小分子、多核苷酸、脂质或激素类似物,其特点是低分子量。其它生物聚合有机测试化合物包括小肽或肽样分子(肽模拟物),其包含约2至约40个氨基酸,以及较大多肽,其包含约40至约500个氨基酸,如抗体、抗体片段或抗体缀合物(抗体结合物,antibodyconjugate)。测试化合物还可以是蛋白支架或合成支架。为了高通量的目的,可以使用测试化合物库,如组合或随机库,其提供足够范围的多样性。实例包括但不限于天然化合物库、变构化合物库、肽库、抗体片段库、合成化合物库、基于片段的库、噬菌体展示文库等。在本说明书中可以进一步发现更详细的描述。
如在本文中所使用的,术语"配体"是指分子,其结合于多肽,尤其是gpcr。配体可以是但不限于蛋白质、(多)肽、脂质、小分子、蛋白支架、核酸、离子、碳水化合物、抗体或抗体片段。配体可以是合成的或天然存在的。配体还包括"天然配体",其是用于天然蛋白质的内源性的、天然配体。在本发明的范围内,配体是指在细胞内位点或细胞外位点和/或在跨膜结构域结合于gpcr的分子。通常但不一定,在配体的结合以后,gpcr将采用特定构象。因此,配体还可以是“构象选择性配体”或“构象特异性配体”。上述术语包括激动剂、完全激动剂、部分激动剂、和反向激动剂,其结合在正位位点或变构位点处。为清楚起见,术语“构象选择性配体”或“构象特异性配体”并不包括中性拮抗剂,因为中性拮抗剂并不选择性地结合gpcr的特定构象。
如在本文中所使用的,“正位配体”是指这样的配体(天然和合成的),其结合于受体(如gpcr)的活性位点,并根据它们的效力或者换句话说根据它们对通过特定途径的信号的影响来进一步分类。如在本文中所使用的,“激动剂”是指这样的配体,通过结合受体蛋白,其增加受体的信号活性。完全激动剂能够实现最大蛋白刺激;部分激动剂不能诱发完全活性(甚至在饱和浓度下)。通过防止更强大的激动剂的结合,部分激动剂还可以作为“阻断剂”。“拮抗剂”,还被称为“中性拮抗剂”,是指这样的配体,其结合受体而没有刺激任何活性。“拮抗剂”还被称为“阻断剂”,这是由于其防止其它配体的结合的能力,因而,阻断激动剂诱导的活性。此外,“反向激动剂”是指这样的拮抗剂,除阻断激动剂效应之外,其还将受体的基本或组成性活性降低至低于未配位的蛋白质(unligandedprotein)的基本或组成性活性。
如在本文中所使用的,配体还可以是能够选择性地刺激受体信号活性的子集的“偏爱配体”,例如在gpcr的情况下,g蛋白或β-抑制蛋白功能的选择性激活。这样的配体被称为“偏爱配体”、“偏爱激动剂”或“功能选择性激动剂”。更具体地,配体偏爱可以是不完美偏爱,其特征在于对于不同的信号具有不同的相对效能的多种受体活性的配体刺激,或可以是完美偏爱,其特征在于一种受体蛋白活性的配体刺激而没有另一种已知的受体蛋白活性的任何刺激。
另一种配体被称为别构调节剂。如在本文中所使用的,“别构调节剂(allostericregulator)”或以其它方式“别构调制剂(allostericmodulator)”、“别构配体”或“效应分子”是指这样的配体,其在受体蛋白如gpcr的变构位点(即,物理上不同于蛋白质的活性位点的调节位点)处结合。与正位配体相反,别构调节剂是非竞争性的,这是因为它们在不同位点处结合受体蛋白并修饰它们的功能,即使内源性配体也正在结合。增强蛋白质活性的别构调节剂在本文中称为“别构激活剂”或“正别构调节剂”(pam),而那些降低蛋白质活性的别构调节剂则在本文中称为“别构抑制剂”或以其它方式“负别构调节剂”(nam)。
如在本文中所使用的,术语“确定”、”测量”、”评估”、“监测”和“测定”可互换使用并且包括定量和定性确定。
如在本文中所使用的,在抗体的范围内,术语"互补决定区"或"cdr"是指h(重)或l(轻)链的可变区(还分别简称为vh和vl)并且包含能够特异性地结合于抗原靶的氨基酸序列。这些cdr区负责抗体对于特定抗原决定簇结构的基本特异性。这样的区还被称为"高变区"。cdr表示在可变区内氨基酸的非连续延伸,但不论物种,已发现,在可变重链和轻链区内这些关键的氨基酸序列的定位位置具有在可变链的氨基酸序列内的类似位置。所有规范抗体的可变重链和轻链各自具有3个cdr区,对于相应的轻(l)和重(h)链,其每一个非邻接于其它cdr区(被称为l1、l2、l3、h1、h2、h3)。免疫球蛋白单可变域,尤其是vhh或纳米抗体,通常包含单氨基酸链,其可以被认为包含4个“框架序列或区”或fr和3个“互补决定区”或cdr。纳米抗体具有3个cdr区,每一个非邻接于其它cdr区(被称为cdr1、cdr2、cdr3)。fr和cdr序列的描述可以,例如,基于用于v域和v样域的imgt独特的编号系统(lefrancetal.2003,)。
详细描述
嵌合多肽
本发明的第一方面涉及嵌合多肽,其包含融合于结合域的g蛋白偶联受体(gpcr),其中结合域是针对和/或特异性地结合于gpcr。因此本发明提供了嵌合多肽,其是至少两个部分的融合蛋白,尤其是至少gpcr部分和结合域部分,其中结合域是针对和/或特异性地结合于gpcr。
通常,形成嵌合多肽的一部分的gpcr部分的选择不是本发明的关键,并且将通常根据预定用途和应用加以选择。结合域部分的前提条件是它的特异性地结合(如本文定义的)于所选择的gpcr的能力。因此,结合域部分可以通常是针对任何期望的gpcr,以及可以尤其是针对任何gpcr的任何构象表位(如本文定义的)。特异性地结合于"构象表位”的结合域特异性地结合于折叠蛋白质的三级(即,三维)结构,并以大大降低的(即,至少2、5、10、50或100的系数)亲和力结合于蛋白质的线性(即,未折叠、变性)形式。尤其是,所述构象表位可以是胞内或胞外区、或膜内区的一部分,或任何期望的gpcr的域或环结构。因此,按照特定实施方式,结合域部分可以是针对胞外区、域、环或其它胞外构象表位(任何期望的gpcr的),但优选是针对跨膜结构域的胞外部分或更优选地针对连接跨膜结构域的胞外环。可替换地,结合域部分可以是针对任何期望的gpcr的胞内区、域、环或其它细胞内构象表位,但优选是针对跨膜结构域的胞内部分之一或更优选针对连接跨膜结构域的胞内环。在其它具体实施方式中,结合域部分可以是针对构象表位,其形成天然配体的结合位点的一部分,包括但不限于内源性正位激动剂。在其它实施方式中,结合域部分可以是针对构象表位,尤其是细胞内表位,其被包含在用于下游信号蛋白的结合位点中,包括但不限于g蛋白结合位点、β-抑制蛋白结合位点。
按照一种优选的实施方式,本发明的嵌合多肽包含融合于结合域的gpcr,其中,在分子内反应中,在结合域与gpcr的结合以后,gpcr被稳定于特定构象而不需要另外的配体。优选地,本发明的嵌合多肽包含通过处于功能构象的结合域(如本文定义的)加以稳定的gpcr。如前文中定义的,术语“稳定的”是指,关于结构(例如构象状态)和/或特定生物活性(例如胞内信号活性、配体结合亲和力,…),gpcr的增加的稳定性。关于结构和/或生物活性的增加的稳定性,这可以借助于物理方法如x射线晶体学、nmr、或自旋标记(除其它方法之外),或通过对于活性(例如ca2+释放、camp生成或转录活性、β-抑制蛋白募集,…)或配体结合的功能测定(除其它方法之外)来容易地确定。术语“稳定”还包括在非生理条件下通过变性剂或变性条件诱导的gpcr的增加的热稳定性。如在本文中所使用的,术语“热稳定”、“热稳定的”、“增加的热稳定性”是指gpcr的功能特性而不是热力学性能以及是指蛋白对由热和/或化学方式(包括但不限于加热、冷却、冷冻、化学变性剂、ph、洗涤剂、盐、添加剂、蛋白酶或温度)诱导的不可逆变性的抗性。不可逆变性导致蛋白质的功能构象的不可逆解折叠、生物活性的丧失和变性蛋白的聚集。关于对加热的增加的稳定性,这可以通过测量配体结合或通过利用光谱法如荧光、cd或光散射(其对于在升高的温度下的解折叠是敏感的)来容易地确定。优选的是,结合域部分能够增加稳定性,如通过处于功能构象状态的gpcr的热稳定性的增加所测得,其中增加为至少2℃、至少5℃、至少8℃,以及更优选至少10℃或15℃或20℃。关于对洗涤剂或对离液剂(chaotrope)的增加的稳定性,通常在测试洗涤剂或测试离液剂的存在下温育gpcr规定的时间并利用,例如,配体结合或光谱法,可选地在升高的温度下(如上文所讨论的)来确定稳定性。以其它方式,结合域部分能够增加对极端ph的gpcr的功能构象状态的稳定性。关于ph的极端值,将选择典型的测试ph,例如为6至8、5.5至8.5、5至9、4.5至9.5,更具体地为4.5至5.5(低ph)或8.5至9.5(高ph)。如在本文中所使用的,术语“(热)稳定”、“(热)稳定的”、“增加的(热)稳定性”适用于包埋在脂质颗粒或脂质层(例如,脂单层、脂双层等)中的gpcr以及适用于已溶解在洗涤剂中的gpcr。
因此,特别设想,本发明的嵌合多肽包含在结合域部分的结合以后被稳定于功能构象的gpcr部分。按照本发明的一种优选的实施方式,在对于活性构象具有选择性的结合域的结合以后,gpcr部分被稳定于活性构象。如在本文中所使用的,术语“活性构象”是指受体构象谱,在配体的结合以后,其允许向着细胞内效应子系统的信号转导,包括g蛋白依赖性信号和g蛋白非依赖性信号(例如β-抑制蛋白信号)。因此,“活性构象”涵盖一系列的配体特异性构象,包括激动剂结合的活性构象、部分激动剂结合的活性构象或偏爱激动剂构象(biasedagonistconformation),其诱导细胞内效应蛋白的协同结合。在另一种优选实施方式中,在对于非活性构象具有构象选择性的结合域的结合以后,gpcr部分被稳定于非活性构象。如在本文中所使用的,术语“非活性构象”是指受体构象谱,其不允许或阻断向着细胞内效应子系统的信号转导。因此,“非活性构象”涵盖一系列的配体特异性构象,包括反向激动剂结合的非活性构象,其防止细胞内效应蛋白的协同结合。应当理解的是,为了获得活性或非活性构象,配体的结合位点不是关键的。因此,正位配体以及别构调节剂可以同样能够将gpcr稳定于活性或非活性构象。因此,按照本发明的一种具体实施方式,能够稳定gpcr部分的结合域部分可以结合在正位位点处或在变构位点处。在其它具体实施方式中,能够稳定gpcr部分的结合域部分可以是这样的结合域,其对于激动剂结合的活性构象具有选择性,或其对于部分激动剂结合的活性构象具有选择性,或其对于偏爱激动剂结合的功能构象结合域具有选择性,或其对于反向激动剂结合的非活性构象具有选择性。
因此,将理解的是,本发明的嵌合多肽是构象限制蛋白质,因为融合体的gpcr部分被稳定于特定功能构象,其是由于束缚结合域的高局部浓度。为了进一步说明这一点(但没有限制性的目的),相比于相应的非融合gpcr或相比于融合于模拟结合部分(还被称为对照结合部分或不相干的结合部分,并且其并不针对和/或并不特异性地结合于gpcr)的相应gpcr的嵌合多肽,本发明的包含被稳定于活性构象的gpcr的嵌合多肽将对于激动剂,更具体地对于完全激动剂、部分激动剂或偏爱激动剂,具有提高或增强的亲和力。此外,相比于相应的非融合gpcr或相比于融合于模拟结合部分的相应gpcr的嵌合多肽,本发明的包含被稳定于活性构象的gpcr的嵌合多肽将对于反向激动剂具有降低的亲和力。相比而言,相比于相应的非融合gpcr或相比于融合于模拟结合部分的相应gpcr的嵌合多肽,本发明的包含被稳定于非活性构象的gpcr的嵌合多肽将对于反向激动剂具有增强的亲和力和/或将对于激动剂具有降低的亲和力。对于配体的亲和力的提高或降低可以通过以下项直接测量和/或计算自以下项的降低或提高:ec50、ic50、kd、ki或本领域技术人员已知的亲和力或效力的任何其它度量。优选地,在结合于限制gpcr以后,本发明的嵌合多肽对于配体的亲和力被增加或减小至少2倍、至少5倍、至少10倍、至少50倍,以及更优选至少100倍、至少200倍、至少300倍、至少400倍、至少500倍,甚至更优选至少1000倍或2000倍或更大。应当理解的是,可以借助于任何类型的配体,包括天然配体、小分子、以及生物制剂;借助于正位配体以及别构调节剂;借助于单一化合物以及化合物库;借助于先导化合物或片段等,来测量对于触发/抑制特定信号通路的构象选择性配体的亲和力。
此外,形成如所描述的嵌合多肽的部分的不同部分彼此融合的方式将通常取决于gpcr的类型和结合域(例如,它与其结合的构象表位)的特性。如由本领域技术人员已知的,gpcr的特征在于,胞外n端,接着通过三个胞内和三个胞外环连接的7个跨膜α-螺旋,以及最后细胞内c端(同样进一步参见本文)。取决于结合位点(胞外或胞内或跨膜),结合域部分将优选被融合于gpcr的n末端或融合于c末端。优选地,在细胞内位点处结合gpcr的结合域将被融合于gpcr的c端。同样,在细胞外位点处结合gpcr的结合域将被融合于gpcr的n端。结合域部分将连同它的c末端一起融合于gpcr的n末端或结合域可以连同它的n末端一起融合于gpcr的c末端。此外,融合可以是序列的直接融合或可以是间接融合,例如借助于间插氨基酸序列或接头序列(如本文中进一步描述的)。本领域的技术人员将知道如何设计融合构建体。如果可供使用的话,将单独地利用gpcr的原子结构和/或单独地利用结合域的原子结构和/或利用复合于结合域的gpcr的原子结构。可替换地,可以将gpcr连接于结合域,其中利用内含肽介导的蛋白质剪接(muralidharanandmuir2006)或sortagging(poppetal.2007)或用于利用小分子或其它蛋白质的蛋白质位点特异性标记或工程化的其它化学酶促方法,例如如在chenandting(2005)和rabuka(2010)中描述的并以引用方式结合于本文。
下文将进一步详细描述形成本发明的嵌合多肽的部分的不同部分的特定实施方式。
gpcr部分
本发明的嵌合多肽包含至少两种多肽成分,其中之一是gpcr。作为gpcr,可以使用任何感兴趣的gpcr。技术人员可以选择适宜的gpcr,其取决于预期应用(如本文中进一步描述的)。以相同的思路,并取决于预期用途,可以选择来自任何生物体的gpcr,如真菌(包括酵母)、线虫、病毒、昆虫、植物、鸟(例如鸡、火鸡)、爬行动物(reptile)、或哺乳动物(例如,小鼠、大鼠、兔、仓鼠、沙鼠、狗、猫、山羊、猪、牛、马、鲸、猴、骆驼(camelid)、或人)。
如在本文中所使用的,"g蛋白偶联受体"或"gpcr"是技术人员众所周知的并且是指这样的多肽,其共享共同的结构基序,具有22至24个疏水性氨基酸的7个区,其形成7个α螺旋,其中每一个跨越膜。通过数字来确定每个跨距,即,跨膜-1(tm1)、跨膜-2(tm2)等。通过在细胞膜的外部、或"胞外"侧上的在跨膜-2和跨膜-3、跨膜-4和跨膜-5、以及跨膜-6和跨膜-7之间的氨基酸的区,分别称作"胞外"区1、2和3(ec1、ec2和ec3),来连接跨膜螺旋。还通过在细胞膜的内部、或"胞内"侧上的在跨膜-1和跨膜-2、跨膜-3和跨膜-4、以及跨膜-5和跨膜-6之间的氨基酸的区,分别称作"胞内"区1、2和3(ic1、ic2和ic3),来连接跨膜螺旋。受体的"羧基"("c")末端位于细胞内的胞内空间中,以及受体的"氨基"("n")末端位于细胞外侧的细胞外空间中。通过gpcr的初级氨基酸序列的分析,可以容易地确定任何这些区。
gpcr结构和分类在本领域中通常是众所周知的以及gpcr的进一步讨论可见于probstetal.1992;marcheseetal.1994;
因此,按照本发明的特定实施方式,本发明的嵌合多肽包含gpcr,其选自包括gpcr的谷氨酸家族的gpcr、gpcr的视紫红质家族的gpcr、gpcr的粘附素家族的gpcr、gpcr的frizzled/taste2家族的gpcr、以及gpcr的促胰液素家族的gpcr的组。优选地,包含在嵌合多肽中的gpcr是哺乳动物蛋白、或植物蛋白、或微生物蛋白、或病毒蛋白、或昆虫蛋白。甚至更优选地,gpcr是人蛋白。
更具体地,gpcr包括但不限于5-羟色胺受体、乙酰胆碱受体(毒蕈碱型,muscarinic)、腺苷受体、肾上腺素受体、过敏毒素受体、血管紧张素受体、apelin受体、胆汁酸受体、铃蟾肽(bombesin)受体、缓激肽受体、大麻素受体、趋化因子受体、胆囊收缩素受体、多巴胺受体、内皮素受体、雌激素(g蛋白偶联)受体、甲酰肽受体、游离脂肪酸受体、甘丙肽受体(galaninreceptors)、生长素受体(生长激素受体,ghrelinreceptors)、糖蛋白激素受体、促性腺激素释放激素受体(gonadotrophin-releasinghormonereceptors)、组胺受体、kiss1衍生肽受体、白三烯受体(leukotrienereceptors)、溶血磷脂受体、黑色素浓集激素受体(melanin-concentratinghormonereceptors)、黑皮质素受体、褪黑激素受体、促胃动素受体(胃动素受体,motilinreceptors),神经介素u受体、神经肽ff/神经肽af受体、神经肽s受体、神经肽w/神经肽b受体、神经肽y受体、神经降压肽受体(neurotensinreceptors)、烟酸受体家族、阿片样受体、增食欲素受体(食欲素受体,orexinreceptors)、p2y受体、肽p518受体、血小板活化因子受体、前动力蛋白受体(prokineticinreceptors)、促乳素释放肽受体、前列腺素类受体、蛋白酶活化受体、松弛素家族肽受体、生长抑素受体(生长激素抑制素受体,somatostatinreceptors)、速激肽受体(tachykininreceptors)、促甲状腺素释放激素受体、微量胺受体、硬骨鱼紧张肽受体(urotensinreceptor)、后叶加压素(vasopressin)和催产素受体、a类孤儿(classaorphans)、非信号7tm趋化因子结合蛋白、降钙素受体、促肾上腺皮质素释放因子受体、胰高血糖素受体家族、甲状旁腺素受体、vip和pacap受体、b类孤儿、钙传感受体(钙感应受体,calcium-sensingreceptors)、gabab受体、gprc5受体、代谢型谷氨酸受体(metabotropicglutamatereceptors)、c类孤儿、frizzled受体、视紫红质和其它g蛋白偶联7跨膜段受体(g-proteincoupledseventransmembranesegmentreceptors)。gpcr还包括这些gpcr受体,其彼此关联,作为同聚或异聚二聚体或作为高阶低聚体(higher-orderoligomers)。gpcr的氨基酸序列(和编码它们的cdna的核苷酸序列)是容易得到的,例如通过参考genbank(http://www.ncbi.nlm.nih.gov/entrez)。相对于人基因的hgnc标准化术语;来自不同生物体的不同同种型的登录号可获自uniprot(www.uniprot.org)。此外,关于gpcr的受体命名法、药理、功能和病理生理信息的综合概述可以检索自iuphar数据库(http://www.iuphar-db.org/)。
按照一种优选的实施方式,形成本发明的嵌合多肽的一部分的gpcr选自包括肾上腺素能受体的组,优选α肾上腺素能受体,如α1肾上腺素能受体和α2肾上腺素能受体,以及β肾上腺素能受体,如β1肾上腺素能受体、β2肾上腺素能受体和β3肾上腺素能受体;或选自包括毒蕈碱性受体(muscarinicreceptors)的组,优选m1毒蕈碱性受体、m2毒蕈碱性受体、m3毒蕈碱性受体、m4毒蕈碱性受体和m5毒蕈碱性受体;或选自包括阿片样受体家族的组,优选μ阿片样受体(μ或mop或mor1),δ阿片样受体(δ或dop),κ阿片样受体(κ或kop),nop阿片样受体,所有这些在本领域中都是众所周知的。
应当理解的是,取决于目的和应用,包含在融合蛋白中的gpcr可以是天然存在的或非天然存在的(即,人工改变的)受体。相关于gpcr,术语"天然存在的"是指自然产生的gpcr。尤其是,gpcr的野生型多态变体和同种型,以及跨越不同物种的直向同源物(ortholog)是天然存在的蛋白质的实例,并且发现于例如但不限于哺乳动物,更具体地人、或病毒、或植物、或昆虫(除了别的以外)。在自然界发现这样的gpcr。此外,上述术语旨在涵盖来自特定物种的β2肾上腺素能受体的野生型多态变体和某些其它变体,包括突变体。例如,"人β2肾上腺素能受体"具有氨基酸序列,其是至少95%相同于(例如,至少95%或至少98%相同于)genbank登录号np_000015的天然存在的"人β2肾上腺素受体"。或者同样地,"人毒蕈碱性乙酰胆碱受体m2"具有氨基酸序列,其是至少95%相同于(例如,至少95%或至少98%相同于)genbank登录号aaa51570.1的天然存在的"人毒蕈碱性乙酰胆碱受体m2"。或者同样地,“人μ阿片样受体”具有氨基酸序列,其是至少95%相同于(例如,至少95%或至少98%相同于)genbank登录号np_000905的天然存在的"人μ阿片样受体"。相对于gpcr,术语"非天然存在的"是指gpcr,其不是天然存在的。已突变的野生型gpcr和天然存在的gpcr的变体是非天然存在的gpcr的实例。非天然存在的gpcr可以具有氨基酸序列,其是至少80%相同于,至少90%相同于,至少95%相同于或至少99%相同于天然存在的gpcr。在某些情况下,可能是有利的是,包含在嵌合多肽中的gpcr是非天然存在的蛋白质。例如,以及仅用于说明目的,为了增加获得包含稳定于特定构象的gpcr的嵌合多肽的晶体的可能性,可能期望进行一些蛋白质工程而没有或只是最低限度影响构象(例如对于激动剂具有增加的亲和力的活性构象)。或,替代地或另外地,为了增加gpcr的细胞表达水平,或为了增加稳定性,还可以考虑将某些突变引入感兴趣的gpcr。相对于天然存在的gpcr的氨基酸或核苷酸序列、或其它变体,非天然存在的gpcr的非限制性实例包括但不限于通过突变已变成组成型活性的gpcr、具有环缺失的gpcr、具有n和/或c端缺失的gpcr、具有替换、插入或添加、或它们的任何组合的gpcr。在本发明的范围内还包括靶gpcr,其包括嵌合或杂合gpcr,例如具有来自一种gpcr和第二gpcr的环的n和/或c端的嵌合gpcr,或包括融合于一部分的gpcr,如t4溶菌酶、黄素氧还蛋白(flavodoxin)、木聚糖酶、红素氧还蛋白或细胞色素b,如用于gpcr结晶(chunetal.2012以及还描述于专利申请wo2012/158555、wo2012/030735、wo2012/148586)。
按照具体实施方式,在本发明的范围内,非天然存在的gpcr,如包含在嵌合多肽中,可以具有氨基酸序列,其是至少80%相同于,至少90%相同于,至少95%相同于,至少97%相同于,或至少99%相同于天然存在的gpcr。此外,应当理解的是,本发明还设想这样的gpcr,其具有环缺失、或n和/或c端缺失、或替换、或插入或添加(相对于它的氨基酸或核苷酸序列)、或它们的任何组合(如前文中定义的,以及参看实施例部分)。
结合域部分
本发明的嵌合多肽包含至少两个多肽部分,其之一是gpcr(如上文中描述的),以及另一部分是针对和/或特异性地结合于gpcr的结合域。
如在本文中所使用的,术语“结合域”是指全部或部分的蛋白质类(proteinaceous)(蛋白质、蛋白质样或含蛋白质)分子,其能够利用特异性分子间相互作用来结合于gpcr。按照一种具体实施方式,术语“结合域”并不包括gpcr的天然存在的结合配偶体,例如g蛋白、抑制蛋白、内源性配体;或它们的变体或衍生物(包括片段)。更具体地,术语“结合域”是指多肽,更具体地蛋白域。蛋白质结合域是整体蛋白质结构的元件,其自稳定并且经常独立于蛋白链的其它部分进行折叠。结合域的长度会变化:约25个氨基酸多达至500个氨基酸和更多。许多结合域可以分类为折叠并且是可识别的、可确定的三维结构。一些折叠在许多不同蛋白质中是如此普遍以致它们被给予专用名称。非限制性实例是这样的结合域,其选自3-或4-螺旋束、犰狳重复域(armadillorepeatdomain)、富含亮氨酸重复域、pdz域、sumo或sumo样域、钙粘着蛋白域、免疫球蛋白样域、磷酸酪氨酸结合域、普列克底物蛋白同源域(pleckstrinhomologydomain)、src同源2域(除了别的以外)。因此结合域可以源自天然存在的分子,例如源自先天性或适应性免疫系统的成分,或它可以是完全人工设计的。
通常,结合域可以是基于免疫球蛋白或它可以基于在蛋白质中存在的域,包括但不限于微生物蛋白、蛋白酶抑制剂、毒素、纤连蛋白、脂钙蛋白(lipocalins)、单链反向平行卷曲螺旋蛋白或重复基序蛋白。在本领域中是已知的结合域的特定实例包括但不限于:抗体、重链抗体(hcab)、单域抗体(sdab)、小体(minibodies)、源自骆驼(camelid)重链抗体的可变域(vhh或纳米抗体)、源自鲨鱼抗体的新抗原受体的可变域(vnar)、α体(alphabodies)、a蛋白、g蛋白、设计的锚蛋白重复域(designedankyrin-repeatdomains,darpin)、纤连蛋白iii型重复、抗运载蛋白(anticalin)、扭结菌素(knottin)、工程ch2域(纳米抗体)、工程sh3域、亲和体(affibodies)、肽和蛋白质、脂肽(例如pepducins)(见例如,gebauer&skerra,2009;skerra,2000;starovasniketal.,1997;binzetal.,2004;koideetal.,1998;dimitrov,2009;nygrenetal.2008;wo2010066740)。经常地,当利用选择方法来生成特定类型的结合域时,包含共有或框架序列(其含有随机潜在相互作用残基)的组合文库用来筛选与感兴趣的分子,如蛋白质的结合。
按照一种优选的实施方式,特别设想,形成本发明的嵌合多肽的一部分的结合域衍生自先天性或适应性免疫系统。优选地,所述结合域衍生自免疫球蛋白。优选地,按照本发明的结合域衍生自抗体或抗体片段。术语"抗体"(ab)通常是指由免疫球蛋白基因编码的多肽、或其功能片段,其特异性地结合和识别抗原,并且是本领域技术人员已知的。抗体意在包括常规四链免疫球蛋白,其包含多肽链的两个相同对,每对具有一个"轻"(约25kda)和一个"重"链(约50kda)。通常,在常规免疫球蛋白中,重链可变域(vh)和轻链可变域(vl)相互作用以形成抗原结合位点。术语“抗体”意在包括全抗体,包括单链全抗体,和抗原结合片段。在一些实施方式中,抗原结合片段可以是抗原结合抗体片段,其包括但不限于fab、fab'和f(ab')2、fd、单链fv(scfv)、单链抗体、二硫键连接的fv(dsfv)以及包含vl或vh域或由vl或vh域构成的片段,和那些的任何组合或能够结合于靶抗原的免疫球蛋白肽的任何其它功能部分。术语“抗体”还意在包括仅重链抗体、或它们的片段,包括免疫球蛋白单可变域(如本文中进一步定义的)。
术语“免疫球蛋白单可变域”定义分子,其中抗原结合位点是存在于单免疫球蛋白域上,并由单免疫球蛋白域(其不同于常规免疫球蛋白或它们的片段,其中通常两个免疫球蛋白可变域相互作用以形成抗原结合位点)所形成。然而应当清楚的是,术语“免疫球蛋白单可变域”确实包含常规免疫球蛋白的片段,其中抗原结合位点是由单可变域所形成。优选地,在本发明的范围内,结合域部分是免疫球蛋白单可变域。
通常,免疫球蛋白单可变域将是氨基酸序列,其包含4个框架区(fr1至fr4)和3个互补决定区(cdr1至cdr3),优选按照下述式(1):fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4(1),或其任何适当的片段(其通常将含有至少一些氨基酸残基,其形成互补决定区的至少之一)。包含4个fr和3个cdr的免疫球蛋白单可变域是本领域技术人员已知的并且已描述(作为非限制性实例)于wesolowskietal.2009。免疫球蛋白单可变域的典型的但非限制性的实例包括轻链可变域序列(例如vl域序列)或其适当的片段、或重链可变域序列(例如vh域序列或vhh域序列)或其适当的片段,只要它能够形成单抗原结合单位。因此,按照一种优选的实施方式,结合域部分是免疫球蛋白单可变域,其是轻链可变域序列(例如vl域序列)或重链可变域序列(例如vh域序列);更具体地,免疫球蛋白单可变域是重链可变域序列,其衍生自常规四链抗体,或重链可变域序列,其衍生自重链抗体。免疫球蛋白单可变域可以是域抗体、或单域抗体、或“dab”或dab、或纳米抗体(如本文定义的)、或另一免疫球蛋白单可变域、或它们的任何一种的任何适宜的片段。对于单域抗体的一般描述,参考以下书籍:“singledomainantibodies”,methodsinmolecularbiology,eds.saerensandmuyldermans,2012,vol911。免疫球蛋白单可变域通常包含单氨基酸链,其可以被认为包含4个“框架序列”或fr和3个“互补决定区”或cdr(如前文中定义的)。应该清楚的是,免疫球蛋白单可变域的框架区还可有助于它们的抗原的结合(desmyteretal2002;korotkovetal.2009)。cdr序列(因而fr序列)的描述可以基于用于v域或v样域的imgt独特的编号系统(lefrancetal.2003)。可替换地,可以通过利用kabat编号系统来描述fr和cdr序列,如在riechmann和muyldermans(2000)的文章中应用于来自骆驼的vhh域。
应当指出的是,在它们的最广泛意义上,作为结合域部分的免疫球蛋白单可变域并不限于具体的生物来源或限于具体的制备方法。术语“免疫球蛋白单可变域”包括不同来源的可变域,包括小鼠、大鼠、兔、驴、人、鲨鱼、骆驼可变域。按照具体实施方式,免疫球蛋白单可变域源自鲨鱼抗体(所谓的免疫球蛋白新抗原受体或ignar),更具体地来自天然存在的重链鲨鱼抗体,不含轻链,并且被称为vnar域序列。优选地,免疫球蛋白单可变域源自骆驼抗体。更优选地,免疫球蛋白单可变域源自天然存在的骆驼仅重链抗体,不含轻链,并且被称为vhh域序列或纳米抗体。
按照一种特别优选的实施方式,如包含在本发明的嵌合多肽中的结合域部分是免疫球蛋白单可变域,其是纳米抗体(如本文中进一步定义的,并且包括但不限于vhh)。如在本文中所使用的,术语“纳米抗体”(nb)是单域抗原结合片段。它特别是指源自天然存在的仅重链抗体的单可变域并且是本领域技术人员已知的。纳米抗体通常源自出现在骆驼中的仅重链抗体(不含轻链)(hamers-castermanetal.1993;desmyteretal.1996)并且因此往往称作vhh抗体或vhh序列。骆驼包括旧世界骆驼(oldworldcamelids)(双峰骆驼(野骆驼,camelusbactrianus)和单峰骆驼(camelusdromedarius))和新世界骆驼(newworldcamelids)(例如羊驼(lamapaccos)、大羊驼(lamaglama)、原驼(lamaguanicoe)和骆马(lamavicugna))。纳米抗体(nanobody)
在本发明的范围内,术语“免疫球蛋白单可变域”还包括“人源化”或“骆驼源化”可变域,尤其是“人源化”或“骆驼源化”纳米抗体。例如,可以通过提供分别编码天然存在的vhh域或vh域的核苷酸序列,然后以本身已知的方式改变在所述核苷酸序列中的一种或多种密码子,以这样的方式以致新核苷酸序列分别编码本发明的"人源化"或"骆驼源化"免疫球蛋白单可变域,来进行"人源化"和"骆驼源化"。然后可以以本身已知的方式来表达这种核酸,以提供本发明的所期望的免疫球蛋白单可变域。可替换地,分别基于天然存在的vhh域或vh域的氨基酸序列,利用本身已知的用于肽合成的技术,可以分别设计和从头合成本发明的所期望的人源化或骆驼源化免疫球蛋白单可变域的氨基酸序列。另外,分别基于天然存在的vhh域或vh域的氨基酸序列或核苷酸序列,利用本身已知的用于核酸合成的技术,可以设计和从头合成分别编码本发明的所期望的人源化或骆驼源化免疫球蛋白单可变域的核苷酸序列,其后,可以以本身已知的方式来表达如此获得的核酸,以提供本发明的所期望的免疫球蛋白单可变域。用于获得本发明的免疫球蛋白单可变域和/或编码其的核酸的其它适宜的方法和技术,其开始于天然存在的vh序列或优选vhh序列,将是本领域技术人员清楚的,并且可以例如包括结合一个或多个天然存在的vh序列(如一个或多个fr序列和/或cdr序列)的一个或多个部分,一个或多个天然存在的vhh序列(如一个或多个fr序列或cdr序列)的一个或多个部分,和/或一个或多个合成或半合成序列,以适宜的方式,以提供本发明的纳米抗体或编码其的核苷酸序列或核酸。
同样在本发明范围之内的是免疫球蛋白单可变域的天然或合成类似物、突变体、变体、等位基因、部分或片段(本文中统称为"变体"),尤其是纳米抗体(如本文定义的),以及尤其是seqidno:13-20(见表1-2)的免疫球蛋白单可变域的变体。因此,按照本发明的一种实施方式,术语"本发明的免疫球蛋白单可变域"或"本发明的纳米抗体"在其最广泛意义上还涵盖这样的变体。通常,相比于本发明的免疫球蛋白单可变域(如本文定义的),在这样的变体中,一个或多个氨基酸残基可以已被置换、删除和/或添加。在一个或多个fr中和/或在一个或多个cdr中,以及尤其是seqidno:13-20(见表1-2)的免疫球蛋白单可变域的fr和cdr的变体,可以进行这样的替换、插入或缺失。变体,如在本文中所使用的,是序列,其中每个或任何框架区和每个或任何互补决定区显示与在参比序列中的相应区至少80%同一性,优选至少85%同一性,更优选90%同一性,甚至更优选95%同一性,或甚至仍然更优选99%同一性(即fr1_变体与fr1_参比、cdr1_变体与cdr1_参比、fr2_变体与fr2_参比、cdr2_变体与cdr2_参比、fr3_变体与fr3_参比、cdr3_变体与cdr3_参比、fr4_变体与fr4_参比),如通过利用算法如pileup和blast并用电子方法测得。用于进行blast分析的软件是通过nationalcenterforbiotechnologyinformation(http://www/ncbi.nlm.nih.gov/)公开可获得的。应当理解的是,为确定免疫球蛋白单可变域的一个或多个序列的cdr的氨基酸序列的氨基酸同一性程度,形成框架区的氨基酸残基被忽略。类似地,为了确定本发明的免疫球蛋白单可变域的一个或多个序列的fr的氨基酸序列的氨基酸同一性程度,形成互补区的氨基酸残基被忽略。免疫球蛋白单可变域的这样的变体可以具有特定优点,因为它们可以具有改善的效力/亲和力。
借助于非限制性实例,替换可以例如是保守替换(如本文描述的)和/或一个氨基酸残基可以被在另一vhh域中在相同位置处天然存在的另一氨基酸残基置换。因此,任何一个或多个替换、缺失或插入、或它们的任何组合,其改善免疫球蛋白单可变域的性能或其并不减损所期望性能或减损免疫球蛋白单可变域的所期望性能的平衡或组合(即,达到这样的程度,其中免疫球蛋白单可变域不再适用于它的预期用途),包括在本发明的范围内。基于本文披露的内容和可选地在有限程度的常规实验以后,其可以例如涉及引入有限数目的可能的替换和确定它们对如此获得的免疫球蛋白单可变域的性能的影响,技术人员将通常能够确定和选择适宜的替换、缺失或插入、或它们的适宜组合。
在本发明的范围内还涵盖这样的免疫球蛋白单可变域,其具有“多价”形式并且连同两个或更多单价免疫球蛋白单可变域一起通过键合、化学方式或通过重组dna技术所形成。多价构建体的非限制性实例包括“二价”构建体、“三价”构建体、“四价”构建体等。包含在多价构建体内的免疫球蛋白单可变域可以是相同或不同的。在另一种特定实施方式中,本发明的免疫球蛋白单可变域具有“多特异性”形式并且通过将两个或更多免疫球蛋白单可变域键合在一起所形成,其中至少一个具有不同的特异性。多特异性构建体的非限制性实例包括“双特异性”构建体、“三特异性”构建体、“四特异性”构建体等。为了进一步说明这一点,本发明的任何多价或多特异性(如本文定义的)免疫球蛋白单可变域可以适当地针对在相同抗原上的两种或更多种不同的表位,例如针对gpcr的两种或更多种不同的表位;或可以针对两种或更多种不同的抗原,例如针对gpcr的表位和gpcr的天然结合配偶体(例如g蛋白、β-抑制蛋白)的表位。尤其是,本发明的单价免疫球蛋白单可变域是如此以致以小于500nm的亲和力,它将结合于靶gpcr,优选小于200nm,更优选小于10nm,如小于500pm。本发明的多价或多特异性免疫球蛋白单可变域还可以具有(或被设计和/或选择用于)增加的亲和力(avidity)和/或改善的选择性,用于期望的gpcr,和/或用于任何其它所期望的性能或所期望性能的组合,其可以通过使用上述多价或多特异性免疫球蛋白单可变域来获得。在一种具体实施方式中,本发明的上述多价或多特异性结合域还可以具有(或被设计和/或选择用于)在调节gpcr的信号活性中改善的效力(同样进一步参见本文)。
进一步,并且取决于用来表达本发明的嵌合多肽的宿主生物体,可以以这样的方式来设计在结合域部分内的缺失和/或替换以致例如除去用于翻译后修饰的一个或多个位点(如一个或多个糖基化位点),如将是在本领域的技术人员的能力内。可替换地,可以设计替换或插入,以引入用于官能团的附连的一个或多个位点(如本文中进一步描述的)。
适用于本发明的结合域部分的筛选和选择
优选种类的结合域,尤其是形成本发明的嵌合多肽的一部分的免疫球蛋白单可变域,是针对和/或特异性地结合于gpcr的功能构象状态(如上文中描述的)。构象选择性结合域,尤其是免疫球蛋白单可变域,可以以几种方式来确定,并且将在下文以用于vhh的非限制性的方式加以说明。优选地,在用处于功能构象状态的gpcr(可选地结合于受体配体)免疫骆驼科的步骤以后,可以选择构象选择性结合域,以将动物的免疫系统暴露于gpcr特有的构象表位(例如,激动剂结合的gpcr以提高针对处于其活性构象状态的gpcr的抗体)。可选地,通过化学交联,可以将特定配体偶联于感兴趣的gpcr。因此,如本文进一步描述的,通过用gpcr,优选处于功能构象状态的gpcr,适当地免疫骆驼物种(即以提高针对所述gpcr的免疫反应和/或仅重链抗体),通过从所述骆驼获得适宜的生物样品(如血液样品、或b细胞的任何样品),以及通过生成针对所述gpcr的vhh序列(开始自所述样品),可以优选生成或获得上述vhh序列。对于技术人员这样的技术将是清楚的。用于获得所期望的vhh序列的又一种技术涉及适当地免疫能够表达仅重链抗体的转基因哺乳动物(即以提高(激发,raise)针对处于功能构象状态的gpcr的免疫反应和或仅重链抗体),从所述转基因哺乳动物获得适宜的生物样品(如血液样品、或b细胞的任何样品),然后生成针对所述gpcr(开始自所述样品,利用任何本身已知的适宜的技术)的vhh序列。例如,为此目的,可以使用重链抗体表达小鼠以及在wo02085945和wo04049794中描述的进一步的方法和技术。
为了用gpcr免疫动物,可以利用常规方法,其可以采用在宿主细胞中表达gpcr的重组形式,并利用亲和力层析和/或基于抗体的方法来纯化gpcr,来产生和纯化gpcr。在特定实施方式中,杆状病毒(baculovirus)/sf-9系统可以用于表达,虽然还可以使用其它表达系统(例如,细菌、酵母或哺乳动物细胞系统)。用于表达和纯化gcpr的示例性方法描述于,例如,kobilka(1995)、eroglu等(2002)、chelikani等(2006)和书籍"identificationandexpressionofgprotein-coupledreceptors"(kevinr.lynch(ed.),1998)(除许多其它参考文献之外)。还可以在磷脂囊泡(phospholipidvesicles)中重构gpcr。同样,用于在磷脂囊泡中重构活性gpcr的方法是已知的,描述于:luca等(2003)、mansoor等(2006)、niu等(2005)、shimada等(2002)、和eroglu等(2003)(除了别的以外)。在某些情况下,可以在高磷脂密度(例如,1mg受体/mg磷脂)下重构gpcr和磷脂。在特定实施方式中,可以测试磷脂囊泡以证实gpcr是活性的。在许多情况下,gpcr可以以两种取向(正常取向,和"内面向外"取向,其中胞内环是在囊泡的外侧上)存在于磷脂囊泡中。借助于gpcr的其它免疫方法包括但不限于使用表达gpcr或其部分的完整细胞,用编码gpcr的核酸序列接种(例如dna接种),用表达gpcr的病毒或病毒样颗粒免疫(除了别的以外)(例如如在wo2010070145、wo2011083141中描述的)。
可以利用在本领域中众所周知的适用于产生免疫反应的任何技术来免疫任何适宜的动物,尤其是哺乳动物如兔、小鼠、大鼠、骆驼、羊、牛、鲨鱼、猪(除了别的以外),或鸟如鸡或火鸡。
可以选择特异性地结合于所述gpcr的功能构象状态的构象表位的纳米抗体(作为非限制性实例),例如,通过筛选在它们的表面上表达仅重链抗体的细胞(例如获自适当免疫骆驼的b细胞)或在它们的表面上展示geniii和纳米抗体的融合的噬菌体、或展示交配因子蛋白(matingfactorprotein)aga2p的融合的酵母细胞的组、集合或文库,通过筛选vhh序列或纳米抗体序列的(原初或免疫)文库,或通过筛选编码vhh序列或纳米抗体序列的核酸序列的(原初或免疫)文库,其均可以以本身已知的方式进行,并且上述方法可以可选地进一步包括一个或多个其它适宜的步骤,如,例如但不限于,亲和力成熟的步骤,表达所期望的氨基酸序列的步骤,筛选相对于所期望的抗原(在这种情况下,gpcr)的结合和/或活性的步骤,确定所期望的氨基酸序列或核苷酸序列的步骤,引入一个或多个人源化替换的步骤,形成适宜的多价和/或多特异性形式的步骤,筛选所期望的生物和/或生理特性(即利用本领域中已知的适宜测定)的步骤,和/或一个或多个上述步骤的以任何合适的顺序的任何组合。
各种方法可以用来确定在结合域和靶gpcr之间的特异性结合(如前文中定义的),包括例如,酶联免疫吸附测定(elisa)、流式细胞术、放射性配体结合测定、表面等离子体共振测定、噬菌体展示等,其是本领域中常见的做法,例如,讨论于sambrooketal.(2001),molecularcloning,alaboratorymanual.thirdedition.coldspringharborlaboratorypress,coldspringharbor,ny,以及进一步说明于实施例部分。应当理解的是,为此目的,将经常使用独特的标记或标签,如肽标记、核酸标记、化学标记、荧光标记、或放射性同位素标记(如本文中进一步描述的)。
选择构象选择性结合剂的特别优选的方式是如在例如wo2012/007593中描述的。在另一种优选实施方式中,还可以通过利用细胞分选来选择构象选择性结合剂,以从包含细胞表面束缚胞外结合剂的文库的细胞的群体来选择这样的细胞,其特异性地结合于处于其活性构象的gpcr或处于其非活性构象的gpcr,但不能同时,例如如在kruse等(2013)中描述的。没有限制性的目的,构象选择性结合剂的选择还进一步说明于实施例部分。
还预期,结合域一般将能够结合于如包含在本发明的嵌合多肽中的特定gpcr的所有天然存在的或合成的类似物、变体、突变体、等位基因、部分、片段、和同种型;或至少结合于特定gpcr的那些类似物、变体、突变体、等位基因、部分、片段、和同种型,它们包含一个或多个抗原决定簇或表位,其和本发明的结合域所结合的特定gpcr的抗原决定簇或表位是基本上相同的。
接头部分
在本发明的范围内,可以直接或间接地彼此融合结合域部分和gpcr部分(或最终还有其它部分,如本文中进一步描述的),由此,通常通过使用间插氨基酸序列或接头部分来发生间接偶联。优选的“接头分子”或“接头”是长度为1至200个氨基酸的肽,并且通常,但不一定,加以选择或设计以是非结构化的和柔性的。例如,可以选择并不形成特定二级结构的氨基酸。或,可以选择氨基酸以致它们并不形成稳定的三级结构。或,氨基酸接头可以形成随机螺旋。这样的接头包括但不限于富含gly、ser、thr、gln、glu或进一步的氨基酸(其经常关联于天然蛋白质中的非结构化的区)的合成肽(dosztányi,z.,csizmok,v.,tompa,p.,&simon,i.(2005).iupred:webserverforthepredictionofintrinsicallyunstructuredregionsofproteinsbasedonestimatedenergycontent.bioinformatics(oxford,england),21(16),3433-4.)。非限制性实例包括(gs)5或(gs)10。适宜的接头序列的其它非限制性实例还描述于实施例部分。
在许多情况下,虽然不一定,有效分子内浓度(如本文定义的)将取决于gpcr-结合域融合体中的接头长度。因此,将选择最佳的接头长度以致有效分子内浓度达到最大值。优选地,氨基酸接头序列具有对蛋白水解剪切的低敏感性并且并不干扰嵌合多肽的生物活性。
因此,按照具体实施方式,氨基酸(aa)接头序列是0至200个aa、0至150个aa、0至100个aa、0至90个aa、0至80个aa、0至70个aa、0至60个aa、0至50个aa、0至40个aa、0至30个氨基酸、0至20个aa、0至10个氨基酸、0至5个氨基酸的肽。短接头的序列的实例包括但不限于ppp、pp或gs。
对于某些应用,可能是有利的是,接头分子包含或由一个或多个特定序列基序组成。例如,可以将蛋白酶切割位点引入接头分子,以致可以释放gpcr部分和结合域部分。有用的切割位点在本领域中是已知的,并且包括蛋白酶切割位点如具有序列iegr(seqidno:47)的因子xa切割位点、具有序列lvpr(seqidno:48)的凝血酶切割位点、具有序列ddddk(seqidno:49)的肠激酶切割位点、或prescission(或3c)切割位点levlfqgp(seqidno:50)。
如果利用化学酶促方法(用于蛋白修饰)来连接结合域部分和gpcr部分,则接头部分可以存在不同的化学实体,这取决于酶或合成化学,其用来体内或体外产生共价嵌合体(rabuka2010)。
其它部分和修饰
本发明的嵌合多肽可以被进一步修饰和/或可以包含(或可以被进一步融合于)其它部分(如本文中进一步描述的)。修饰的实例、以及可以被修饰的(即,要么在蛋白质骨架上,但优选在侧链上)在本发明的嵌合多肽内的氨基酸残基的实例、可以用来引入这样的修饰的方法和技术以及这样的修饰的潜在用途和优点,对于技术人员而言将是清楚的。例如,这样的修饰可以涉及将一个或多个官能团、残基或部分引入(例如通过共价连接或以另一种合适的方式)嵌合多肽之中或之上,尤其是结合域部分之中或之上或gpcr部分之中或之上,和/或可选地接头部分之中或之上。上述官能团和用于引入它们的技术的实例对于技术人员而言将是清楚的,并且一般可以包括在本领域中提及的所有官能团和技术以及本身已知的用于药物蛋白的修饰的官能团和技术,以及尤其是用于抗体或抗体片段(包括scfv'和单域抗体)的修饰,对其例如参见remington'spharmaceuticalsciences,16thed.,mackpublishingco.,easton,pa(1980)。可以例如将上述官能团直接连接(例如共价地)于嵌合多肽,或可选地经由适宜的接头或隔离物,如对于技术人员而言将再次是清楚的。通常较少优选的修饰包括n-连接的或o-连接的糖基化,通常作为共翻译和/或翻译后修饰的一部分,其取决于用于表达本发明的嵌合多肽的宿主细胞。又一种修饰可以包括引入一种或多种可检测标记或其它信号生成基团或部分,其取决于标记的嵌合多肽的预期用途。用于连接、使用和检测它们的适宜的标记和技术对于技术人员而言将是清楚的,并且例如包括但不限于荧光标记(如荧光素、异硫氰酸盐、罗丹明、藻红蛋白、藻蓝蛋白、别藻蓝蛋白、邻苯二醛(邻苯二甲醛,o-phthaldehyde)、和荧光胺,以及荧光金属如eu或其它金属,其来自镧系)、磷光标记、化学发光标记或生物发光标记(如荧光醇(luminal)、异荧光醇、theromatic吖啶酯、咪唑、吖啶盐、草酸酯、二氧杂环丁烷(dioxetane)或gfp以及其类似物)、放射性同位素、金属、金属螯合物或金属阳离子或其它金属或金属阳离子,其特别适用于体内、体外或原位检测和成像、以及生色团和酶(如苹果酸脱氢酶、葡萄球菌核酸酶、δ-v-类固醇异构酶、酵母醇脱氢酶、α-甘油磷酸脱氢酶、丙糖磷酸异构酶、生物素抗生物素蛋白过氧化物酶、辣根过氧化物酶、碱性磷酸酶、天冬酰胺酶、葡糖氧化酶、β-半乳糖苷酶、核糖核酸酶、脲酶、过氧化氢酶(触酶,catalase)、葡萄糖-vi-磷酸脱氢酶、糖淀粉酶和乙酰胆碱酯酶)。其它适宜的标记对于技术人员而言将是清楚的,并且例如包括可以利用nmr或esr光谱法加以检测的部分。本发明的这样的标记的嵌合多肽可以例如用于体外、体内或原位测定(包括本身已知的免疫测定如elisa、ria、eia和其它"夹心测定"等)以及体内靶向和成像用途,其取决于特定标记的选择。如对于技术人员而言将是清楚的,另一种修饰可以涉及引入螯合基团,例如以螯合上面提到的金属或金属阳离子之一。适宜的螯合基团例如包括但不限于二乙基-烯三胺五乙酸(dtpa)或乙二胺四乙酸(edta)。又一种修饰可以包括引入官能团,其是特异性结合对的一部分,如生物素-(链)抗生物素蛋白结合对。这样的官能团可以用来连接本发明的嵌合多肽和另一种蛋白质、多肽或化合物,其结合于结合对的另一半,即通过结合对的形成。例如,可以将本发明的嵌合多肽共轭于生物素,和连接于另一种蛋白质、多肽、化合物或载体,其共轭于抗生物素蛋白或链霉抗生物素蛋白(streptavidin)。例如,这样的共轭嵌合多肽可以用作报道子(报告子),例如在其中可检测的信号产生剂共轭于抗生物素蛋白或链霉抗生物素蛋白的检测系统中。这样的结合对可以例如还用来将本发明的嵌合多肽结合于载体,包括适用于药用目的的载体。一个非限制性实例是由caoandsuresh,journalofdrugtargeting,8,4,257(2000)描述的脂质体制剂。这样的结合对还可以用来连接治疗活性剂至本发明的嵌合多肽。
包含嵌合多肽的组合物
本发明的嵌合多肽还可以包含(或可以进一步融合于)其它分子,尤其是配体,包括受体配体(如完全激动剂、部分激动剂、拮抗剂、反向激动剂、偏爱激动剂、天然结合配偶体等)。因此,按照一个方面,本发明还设想复合物,其包含嵌合多肽(如上文中描述的)和受体配体。作为非限制性实例,可以通过尺寸排阻层析来纯化稳定的复合物。在一种优选实施方式中,按照本发明的复合物处于溶解形式,如在洗涤剂中。在可替换的优选实施方式中,按照本发明的复合物被固定于固体载体。固体载体的非限制性实例以及用于固定的方法和技术进一步描述于详细描述部分。在又一种实施方式中,按照本发明的复合物是在细胞组成(cellularcomposition)中,包括生物体、组织、细胞、细胞系、或在源自所述生物体、组织、细胞或细胞系的膜成分或脂质体成分中。膜或脂质体成分的实例包括但不限于细胞器、膜制剂、病毒、病毒样脂颗粒(viruslikelipoparticles,vlp)等。应当理解的是,细胞成分、或膜或脂质体成分可以包含天然或合成的脂质。在又一种优选的实施方式中,复合物是晶体。所以,还提供了复合物的晶体,以及制备所述晶体的方法,其在下文中更详细地描述。优选地,设想复合物的晶体形式,其包含按照本发明的嵌合多肽和受体配体。
因此,本发明还涉及包含嵌合多肽或复合物(如上所述的)的膜或脂质体成分。膜成分可以源自组织、细胞或细胞系并且包括细胞器、膜提取物或其馏分、vlp、病毒等,只要保留嵌合多肽的足够的功能性。
表达系统
在另一个方面,本发明涉及核酸分子,其包含编码本发明的和如上文中描述的嵌合多肽的核酸序列。按照一种具体实施方式,本发明涉及核酸分子,其包含编码本发明的嵌合多肽的核酸序列,其中核酸从5’至3’编码:
·信号肽,
·表位标签(epitopetag),
·蛋白酶切割位点,
·感兴趣的gpcr,
·靶向感兴趣的gpcr的构象选择性结合域
可替换地,按照另一种具体实施方式,本发明涉及核酸分子,其包含编码本发明的嵌合多肽的核酸序列,其中核酸从5’至3’编码:
·信号肽,
·表位标签,
·蛋白酶切割位点,
·靶向感兴趣的gpcr的构象选择性结合域,
·感兴趣的gpcr
在实施例部分中进一步举例说明上述核酸分子。
进一步,本发明还设想表达载体,其包含编码本发明的任何嵌合多肽的核酸序列,以及表达上述表达载体的宿主细胞。适宜的表达系统包括在细菌或酵母、病毒表达系统中的组成型和诱导性表达系统,如杆状病毒、塞姆利基森林病毒和慢病毒,或在昆虫或哺乳动物细胞中的瞬时转染。可以按照由本领域技术人员已知的技术来完成本发明的嵌合多肽的克隆和/或表达。
按照本发明的“宿主细胞”可以是任何原核或真核生物。按照一种优选的实施方式,宿主细胞是真核细胞并且可以是任何真核生物,但在特定实施方式中,设想酵母、植物、哺乳动物和昆虫细胞。使用的细胞的特性将通常取决于产生嵌合多肽的方便性和成本、所期望的糖基化性能、嵌合多肽的起源、预期应用、或它们的任何组合。哺乳动物细胞可以例如用于实现复杂的糖基化,但为在哺乳动物细胞系统中产生蛋白质,它可能不符合成本效益。植物和昆虫细胞、以及酵母通常实现高生产水平并且是更具成本效益的,但可能需要另外的修饰以模拟哺乳动物蛋白的复杂的糖基化模式。酵母细胞经常用于蛋白质的表达,这是因为它们可以经济培养,产生高产率的(中等分泌的)蛋白质,以及当适当修饰时能够产生具有适宜的糖基化模式的蛋白质。进一步,酵母提供确立的遗传学,从而允许迅速转化、测试的蛋白质局部化策略、和简便的基因敲除技术。昆虫细胞也是用来表达gpcr的有吸引力的系统,这是因为昆虫细胞提供表达系统而没有干扰哺乳动物gpcr信号。用于蛋白质生产的真核细胞或细胞系是在本领域中众所周知的,包括具有修饰糖基化途径的细胞系,以及下文将提供非限制性实例。
适用于具有(harboring)、表达、和产生用于随后分离和/或纯化的蛋白质的动物或哺乳动物宿主细胞包括中国仓鼠卵巢细胞(cho),如cho-k1(atccccl-61)、dg44(chasinetal.,1986;kolkekaretal.,1997)、cho-k1tet-on细胞系(clontech)、cho指定的ecacc85050302(camr,salisbury,wiltshire,uk)、cho克隆13(geimg,genova,it)、cho克隆b(geimg,genova,it)、cho-k1/sf指定的ecacc93061607(camr,salisbury,wiltshire,uk)、rr-chok1指定的ecacc92052129(camr,salisbury,wiltshire,uk)、二氢叶酸还原酶阴性cho细胞(cho/-dhfr,urlaubandchasin,1980)、和dp12.cho细胞(美国专利号5,721,121);通过sv40转化的猴肾cv1细胞(cos细胞、cos-7、atcccrl-1651);人胚肾细胞(例如,293细胞、或293t细胞、或被亚克隆于在悬浮培养物中生长的293细胞,grahametal.,1977,j.gen.virol.,36:59,或gntikohek293s细胞,reevesetal.2002);幼仓鼠肾细胞(bhk、atccccl-10);猴肾细胞(cv1、atccccl-70);非洲绿猴肾细胞(vero-76、atcccrl-1587;vero、atccccl-81);小鼠塞尔托利细胞(睾丸支持细胞,sertolicell)(tm4,mather,1980,biol.reprod.,23:243-251);人宫颈癌细胞(hela、atccccl-2);犬肾细胞(mdck、atccccl-34);人肺细胞(w138、atccccl-75);人肝癌细胞(hep-g2、hb8065);小鼠乳腺肿瘤细胞(mmt060562、atccccl-51);水牛(buffalo)大鼠肝细胞(brl3a、atcccrl-1442);tri细胞(mather,1982);mcr5细胞;fs4细胞。按照一种具体实施方式,细胞是选自hek293细胞或cos细胞的哺乳动物细胞。
示例性非哺乳动物细胞系包括但不限于昆虫细胞,如sf9细胞/杆状病毒表达系统(例如,回顾jarvis,virologyvolume310,issue1,25may2003,第1-7页),植物细胞如烟草细胞、蕃茄细胞、玉米细胞、藻类细胞,或酵母如酵母种(saccharomycesspecies)、裂殖酵母种(schizosaccharomycesspecies)、汉逊酵母种(hansenulaspecies)、亚罗酵母种(yarrowiaspecies)或毕赤酵母种(pichiaspecies)。按照特定实施方式,真核细胞是酵母细胞,其来自酵母种(例如酿酒酵母(saccharomycescerevisiae))、裂殖酵母种(例如裂殖酵母(schizosaccharomycespombe))、汉逊酵母种(例如多形汉森酵母(hansenulapolymorpha))、亚罗酵母种(例如解脂耶氏酵母(yarrowialipolytica))、克鲁维酵母种(例如乳酸克鲁维酵母(kluyveromyceslactis))、毕赤酵母种(例如巴斯德毕赤酵母(pichiapastoris))、或komagataella种(例如komagataellapastoris)。按照一种具体实施方式,真核细胞是毕赤酵母细胞,以及在一种最特定实施方式中是巴斯德毕赤酵母细胞。
可以遵循由sambrookandrussel(molecularcloning,alaboratorymanual,3rdedition,volume3,chapter16,section16.1-16.54)概述的原则来进行靶细胞(例如哺乳动物细胞)的转染。此外,还可以利用试剂如腺病毒载体来进行病毒转导。适当病毒载体系统、调控区和宿主细胞的选择是本领域中普通技术人员的水平之内的公知常识。按照标准规范,产生的转染的细胞被保持在培养物中或冷冻以备后用。
因此,本发明的另一方面涉及用于产生根据本发明的嵌合多肽的方法,上述方法包括至少以下步骤:
a)在适宜的细胞表达系统(如上本定义的)中表达编码按照本发明的嵌合多肽的核酸,以及可选地
b)分离和/或纯化所述嵌合多肽。
因此,上述构象限制嵌合多肽可以视为新型的单蛋白工具,其特别可用于筛选和药物发现(在其最广泛意义上),本文现进一步详细说明所有这些。
应用
本文描述的嵌合多肽和对其加以编码的核酸、复合物、细胞、和从其衍生的细胞成分,可以用于各种各样的环境和应用,例如但不限于:(1)用于直接分离和/或纯化作为单一蛋白质的嵌合多肽,其中感兴趣的gpcr以组成方式被稳定于感兴趣的构象;(2)用于gpcr的结晶研究和高分辨率结构分析,其中通过利用本发明的嵌合多肽;(3)用于配体筛选和(基于结构的)药物发现;(4)用于在细胞表面处或在另一细胞膜部分中稳定地和组成型表达作为单一融合蛋白的并处于感兴趣的构象的gpcr,所有这些将在下文中进一步详细地加以描述。
分离和纯化方法
本发明的一个主要优点在于,可以以感兴趣的构象并以gpcr与结合域的限定的1:1化学计量比来分离和纯化gpcr。本发明的特定优点在于,甚至在不存在任何配体的情况下,在嵌合多肽中的结合域可以将特定受体构象稳定于非常高的有效分子内浓度。此外,本领域的技术人员将认识到,选择性地结合gpcr的折叠状态的结合域将保护此gpcr免受化学或热变性,从而增加构象稳定性和/或热稳定性。因此,嵌合多肽可以被分离自混合物,并可选地纯化为单一蛋白质,其中受体采用由结合域稳定的构象。这种分离的或纯化的嵌合多肽是用于随后的结晶、配体表征和化合物筛选、免疫(除了别的以外)的非常有用的和直接的工具。
因此,本发明设想用于分离和/或纯化嵌合多肽的方法,其中上述嵌合多肽包含融合于结合域的gpcr,其中上述结合域特异性地结合于gpcr,上述方法包括通过任何合适的方式来分离和/或纯化嵌合多肽的步骤。
可替换地,可以期望,首先生成如上文中描述的嵌合多肽和受体配体(例如正位配体,别构配体,天然结合蛋白如g蛋白等)的复合物,其可以接着随后被分离和最终纯化。
因此,本发明还设想用于分离和/或纯化嵌合多肽和受体配体的复合物的方法,该方法包括通过任何合适的方式来分离和/或纯化复合物的方法。
在本质上,通常用来产生和纯化gpcr(见上文)的同样的方法可同样用于本发明的嵌合多肽的生产和纯化。用于分离/纯化嵌合多肽(如上所述的)的方法包括但不限于基于亲和力的方法如亲和力层析、亲和力纯化、免疫沉淀、蛋白质检测、免疫化学、表面展示技术、尺寸排阻层析、离子交换层析(除了别的以外),并且均是本领域中众所周知的技术。例如,可以在宿主细胞中以重组形式来表达嵌合多肽,并随后利用亲和力层析和/或基于抗体的方法加以纯化。在特定实施方式中,杆状病毒/sf-9系统可以用于表达,虽然还可以使用其它表达系统(例如,细菌、酵母或哺乳动物细胞系统)(如本文中进一步描述的)。
在基于结构的药物设计中的晶体学(crystallography)和应用
本发明的一个方面涉及本发明的嵌合多肽在gpcr的x射线晶体学中的有用性以及其在基于结构的药物设计中的应用。
膜蛋白(包括gpcr)的结晶仍然是一个挑战。虽然表达和纯化方法不断出现,其允许生成毫克量,但借助于这些分子来实现稳定性也许是要克服的最困难的障碍,尤其是鉴于这些蛋白质可以采用的多种构象。洗涤剂溶解的gpcr的增加的受体稳定性保护它们免受蛋白水解降解和/或聚集并且促进正确折叠蛋白质的均质样品的纯化和浓缩。本领域的技术人员将认识到,这样的样品是用于生成衍射晶体的优选的起点。
在通过x射线晶体学来确定大分子结构的过程中,结晶过程本身是另一个主要瓶颈。成功的结晶需要形成晶核以及它们随后生长至适当尺寸的晶体。由于均匀核化的结果,在过饱和溶液中,晶体生长一般自发地发生。在典型的稀疏矩阵筛选实验(sparsematrixscreeningexperiment)中可以结晶蛋白质,其中广泛采样沉淀物、添加剂和蛋白质浓度,并针对特定蛋白质可以确定适合于成核作用和晶体生长的过饱和条件。与稀疏矩阵筛选方式有关的是在蛋白质本身中产生结构变化,例如通过添加结合蛋白质的配体,或通过形成不同的突变,优先地在靶蛋白的表面残基中或通过试图结晶靶蛋白的不同物种直向同源物。
由于结晶涉及待组合在晶格中的分子的构象熵(conformationalentrypy)的不利的损失,所以降低同时仍然在溶液中的靶的构象熵的方法应加强结晶的可能性,其中通过降低晶格形成的净熵惩罚(netentropicpenalty)。‘表面熵减少’方式已证明是高度有效的(derewenda2004)。同样,通过结合于和稳定蛋白质的构象状态的子集,结合配偶体如离子、小分子配体、和肽可以降低构象异质性。虽然这样的结合配偶体是有效的,但并不是所有蛋白质具有已知的结合配偶体,并且甚至当结合配偶体是已知时,它的亲和力、溶解性、和化学稳定性可能与结晶试验不相容。
由于这些膜蛋白的两亲性表面,用于高分辨率结构研究的gpcr的结晶是特别困难的。包埋在膜双层中,蛋白质与磷脂的酰基链的接触位点是疏水性的,而极性表面则暴露于脂质的极性首基以及暴露于水相。为了获得良序(well-ordered)三维晶体,—在高分辨率下进行x射线结构分析的前提条件—借助于洗涤剂来增溶gpcr并纯化为蛋白质–洗涤剂复合物。洗涤剂胶团以带状方式覆盖膜蛋白的疏水性表面(hunteandmichel2002;ostermeieretal.1995)。gpcr–洗涤剂复合物形成三维晶体,其中通过突出自洗涤剂胶团的蛋白质的极性表面来进行在相邻蛋白质分子之间的接触(dayetal.2007)。明显地,洗涤剂胶团需要在晶格中的空间。虽然在胶团之间的吸引相互作用可以稳定晶体堆积(crystalpacking)(rasmussenetal.2007),但这些相互作用并不导致刚性晶体接触。由于许多膜蛋白(包括gpcr)包含相对较小或高度柔性的亲水性域,所以增加得到良序晶体的可能性的策略是扩大蛋白质的极性表面和/或降低它们的柔性。大多数生理方法是使用天然信号配偶体如g蛋白或抑制蛋白。不幸的是,gpcr与g蛋白或抑制蛋白的相互作用是高度脂质依赖性的,并且一直难以形成对于晶体学具有足够的稳定性的复合物。
因此,本发明的嵌合多肽的特定优点在于,结合域在非常高的有效分子内浓度下结合在gpcr上的构象表位,因而稳定受体,降低它的构象柔性并增加它的极性表面,从而促进严格的1比1受体-结合域融合体的结晶。特定的优点是,在不存在任何配体的情况下,可以结晶本发明的嵌合多肽。
令人惊讶地发现,通过以限定的1:1化学计量比,融合于构象选择性结合域,来最大限度地降低所选gpcr的构象异质性,本发明的嵌合多肽可以用作工具来增加获得良序晶体的可能性。因此,按照一种实施方式,设想为结晶目的使用本发明的嵌合多肽。有利地,晶体可以形成自融合蛋白,其中,gpcr被捕获于特定受体构象,更具体地治疗相关受体构象(例如活性构象),如通过选择形成融合蛋白的一部分的构象选择性结合域所确保。在结合gpcr以后,结合域还将降低胞外区的柔性以生长良序晶体。免疫球蛋白单可变域(包括纳米抗体)特别适用于此目的,这是因为它们结合构象表位并由一个单一的刚性球状域组成,没有柔性接头区,不同于常规的抗体或衍生的片段如fab’。
因此,按照一种优选的实施方式,本发明提供了包含融合于结合域的gpcr的嵌合多肽,其可用作用于结晶gpcr的直接工具,并最终用来解析(solve)结构。按照一种具体实施方式,本发明还设想结晶嵌合多肽和受体配体(如前文中定义的)的复合物。在上述方法的一种特别优选的实施方式中,包含在嵌合多肽或复合物中的gpcr是处于活性状态构象,其揭示了新的结构特点,它们适用于用小分子或生物制剂靶向并且可以使得能够鉴定对于活性构象具有选择性的化合物。尤其是,这些新的结构特点可以发生在正位位点处或在变构位点处,从而分别允许发展新构象特异性正位或变构化合物或它们的片段。在另一种实施方式中,包含在嵌合多肽或复合物中的gpcr是处于非活性状态构象(其特征在于,相比于非限制gpcr,对于反向激动剂的增加的亲和力和/或对于激动剂的降低的亲和力)或处于导致β-抑制蛋白依赖性信号的功能构象(其特征在于,相比于非限制gpcr,对于β-抑制蛋白偏爱激动剂的增加的亲和力)。
因此,可以利用用于膜蛋白的任何的各种各样的专用结晶方法,其中许多综述于caffrey(2003&2009),来结晶本发明的嵌合多肽(其可选地复合于受体配体)。一般而言,上述方法是基于脂质的方法,其包括在结晶以前将脂质加入复合物。这样的方法先前已经用来结晶其它膜蛋白。许多这些方法,包括脂质立方相结晶方法和bicelle结晶方法,利用脂质的自发自组装性能以及洗涤剂作为囊泡(囊泡融合方法(vesicle-fusionmethod))、盘状胶团(discoidalmicelles)(bicelle方法)、和液晶或中间相(mesophase)(中间或立方相方法)。脂质立方相结晶方法描述于,例如:landauetal.1996;gouaux1998;rummeletal.1998;nollertetal.2004,rasmussenetal.2011a,b,其出版物的披露那些方法的内容以引用方式结合于本文。bicelle结晶方法描述于,例如:fahametal.2005;fahametal.2002,其出版物的披露那些方法的内容以引用方式结合于本文。
按照另一种实施方式,本发明涉及嵌合多肽(如本文描述的)用来解析gpcr-结合域融合体(以及可选地进一步包含受体配体)的结构的应用。如在本文中所使用的,“解析结构”是指确定蛋白质的原子排列或原子坐标,并且经常是通过生物物理方法,如x射线晶体学,来完成。
在许多情况下,获得衍射质量晶体是解析它的原子分辨率结构的关键障碍。因此,按照具体实施方式,本文描述的嵌合多肽可以用来改善晶体的衍射质量以致可以解析gpcr-结合域融合体的晶体结构。
进一步,获得gpcr靶的结构信息,例如以帮助指导gpcr药物发现,是非常需要的。除更多gpcr的结晶之外,尤其是用于获得结合于先导化合物(其具有药物或生物活性)的受体的结构以及其化学结构的方法用作用于化学修饰的起点以改善效力、选择性、或药代动力学参数。本领域的技术人员将认识到,本发明的嵌合多肽特别适用于与先导化合物共结晶,其对于由结合域诱导的非突出的功能构象(不同于基础构象)具有选择性,这是因为上述结合域能够大幅增加对于构象选择性化合物的亲和力。
按照另一种实施方式,本发明允许在不存在任何配体的情况下起始自在受体和结合域之间的限定的1:1化学计量比来结晶嵌合多肽,由此构象选择性结合域的高有效分子内浓度可以稳定受体于在晶格内的所期望的构象。本领域的技术人员将认识到,这种无受体的被稳定于特定功能构象的预形成晶体是浸泡实验(soakingexperiment)的理想起点,其旨在解析复合于片段的受体或结合于处于由结合域诱导的构象的受体的化合物的结构。
按照另一种实施方式,本发明包括用于确定包含gpcr-结合域融合体的嵌合多肽的晶体结构的方法,该方法包括以下步骤:
a)提供按照本发明的嵌合多肽,以及
b)允许嵌合多肽结晶。
在用于确定晶体结构的上述方法的特定实施方式中,包含gpcr-结合域融合体的嵌合多肽进一步包含结合于gpcr的受体配体,更具体地激动剂、反向激动剂等。
可以通过生物物理方法如x射线晶体学来完成晶体结构的所述确定。上述方法可以进一步包括以下步骤:获得晶体(如前文中定义的)的原子坐标。
配体筛选和药物发现
通过利用本发明的嵌合多肽,或有利地,通过直接使用宿主细胞或细胞培养物(其包含按照本发明的嵌合多肽),或通过利用从其衍生的膜制剂,包括化合物筛选和免疫,特别设想其它应用,其将在本文中进一步描述。
在化合物筛选、先导物优化(先导化合物优化,leadoptimization)和药物发现(包括抗体发现)的过程中,需要更快、更有效、更便宜以及特别是信息丰富的筛选测定,其提供关于各种化合物特性和它们对各种细胞途径的影响(即效力、特异性、毒性和药物代谢)的同时信息。因而,需要快速和低成本筛选大量的化合物以确定感兴趣的蛋白质的新的特异性配体,优选构象选择性配体,其可以是潜在的新药物候选物。通过提供gpcr药物靶,其被稳定于非突出的可施药构象,这是由于以1与1化学计量比共价结合的构象选择性结合域的高有效分子内浓度,本发明解决了这个问题。这允许在单个测定中快速和可靠地识别和区分不同功能模式的配体,包括具有激动剂曲线、反向激动剂曲线、拮抗剂曲线、偏爱激动剂曲线等的配体,以增加确定具有所期望的药理特性的配体的速度和可能性。尤其是,提供了嵌合多肽和包含其的宿主细胞、以及宿主细胞培养物或从其衍生的膜制剂(对于其,上文已描述了特定偏好)特别适用于此目的。因此,这些嵌合多肽、宿主细胞、以及宿主细胞培养物或从其衍生的膜制剂可以用作在各种各样的环境中用于筛选的免疫原或选择试剂。
因此,按照一种优选的实施方式,本发明包括嵌合多肽、宿主细胞、宿主细胞培养物、或从其衍生的膜制剂(按照本发明和如上文中描述的)用于gpcr的构象选择性化合物的筛选和/或鉴定程序(其最终可能导致潜在的新药物候选物)的应用。
按照一种实施方式,本发明设想用于确定构象选择性化合物的方法,该方法包括以下步骤:
(i)提供按照本发明的嵌合多肽,以及
(ii)提供测试化合物,以及
(iii)评估测试化合物与包含在嵌合多肽中的gpcr的选择性结合,以及
(iv)选择构象选择性化合物。
对于嵌合多肽、宿主细胞、宿主细胞培养物和其膜制剂的特定偏好是如上文相对于本发明的前述方面所定义的。
在上述方法的一种具体实施方式中,构象选择性化合物是对包含在嵌合多肽中的gpcr的活性构象具有选择性的化合物。在上述方法的另一种特定实施方式中,构象选择性化合物是对包含在嵌合多肽中的gpcr的非活性构象具有选择性的化合物。在上述方法的又一实施方式中,构象选择性化合物是对于导致β-抑制蛋白依赖性信号的功能构象或任何其它感兴趣的功能构象具有选择性的化合物。
在一种优选实施方式中,如在本文进一步描述的任何筛选方法中使用的嵌合多肽被提供为全细胞、或细胞(细胞器)提取物如膜提取物或其馏分,或可以被加入脂质层或囊泡(包含天然和/或合成脂质)、高密度脂颗粒、或任何纳米颗粒,如纳米盘,或被提供为病毒或病毒样颗粒(vlp),以致保留相应蛋白质的足够的功能性。用于从膜片段或膜-洗涤剂提取物制备包含gpcr的嵌合多肽的方法详细综述于cooper(2004),其以引用方式结合于本文。可替换地,还可以将嵌合多肽溶解于洗涤剂。
用于药物发现的筛选测定可以是固相(例如珠、柱、载玻片、芯片或板)或溶液相测定,例如结合测定,如放射性配体结合测定。在高通量测定中,在一天内以96、384或1536孔格式,可以筛选多达数千种不同的化合物。例如,微量滴定板的每个孔可以用来运行相对于选择的潜在调节剂的独立测定,或,如果观测到浓度或温育时间效应,则每5-10个孔可以测试单一调节剂。因此,单个标准微量滴定板可以测定约96种调节剂。可以每天测定许多板;当今,测定筛选多达约6.000、20.000、50.000或更多不同的化合物是可能的。
各种方法可以用来确定在稳定gpcr和测试化合物之间的结合,包括例如,流式细胞术、放射性配体结合测定、酶联免疫吸附测定(elisa)、表面等离子体共振测定、基于芯片的测定、免疫细胞荧光、酵母双杂交技术和噬菌体展示,其是本领域中常见的做法,例如,在sambrooketal.(2001),molecularcloning,alaboratorymanual.thirdedition.coldspringharborlaboratorypress,coldspringharbor,ny中。还可以使用检测在测试化合物和膜蛋白之间的结合的其它方法,包括超滤法,其借助于离子喷雾质谱法/hplc方法或其它(生物)物理和分析方法、荧光能量共振转移(fret)方法(例如,本领域中技术人员众所周知的)。应当理解的是,利用关联于化合物的独特的标记或标签,如肽标记、核酸标记、化学标记、荧光标记、或放射性同位素标记(如本文中进一步描述的),可以检测结合的测试化合物。
在一种实施方式中,确定化合物是否改变如包含在嵌合多肽中的gpcr与受体配体(如本文定义的)的结合。可以利用本领域中已知的标准配体结合方法(如本文描述的)来测定gpcr与其配体的结合。例如,可以放射性标记或荧光标记配体。可以对全细胞或对获自细胞的膜或水溶受体(借助于洗涤剂)进行测定。将通过其改变标记配体的结合来表征化合物(参看实施例部分)。化合物可以降低在gpcr和其配体之间的结合,或可以增加在gpcr和其配体之间的结合,例如至少2倍、3倍、4倍、5倍、10倍、20倍、30倍、50倍、100倍的系数。
按照一种特别优选的实施方式,通过配体结合测定或竞争测定,甚至更优选放射性配体结合或竞争测定,来进行确定构象选择性化合物的上述方法。最优选地,以比较测定,更具体地,比较配体竞争测定,甚至更具体地比较放射性配体竞争测定,其进一步说明于实施例部分,来进行确定构象选择性化合物的上述方法。
如果以比较测定来进行上述方法,则应当理解的是,上述方法将包括以下步骤:比较测试化合物与包含在嵌合多肽中的gpcr的结合,其中通过构象选择性结合域部分将gpcr稳定于感兴趣的功能构象(例如活性构象或非活性构象),与测试化合物与对照的结合。在本发明的范围内,对照可以是相应的非融合gpcr或融合于模拟结合域部分(还被称为对照结合部分或不相干的结合部分)(其是并不针对和/或并不特异性地结合于相应gpcr的结合域部分)的相应gpcr的嵌合多肽。
在一种特定的优选的实施方式中,在任何上述方法中评估测试化合物与包含在嵌合多肽中的gpcr的选择性结合的步骤是通过测量和/或计算测试化合物对于嵌合多肽的亲和力(如本文定义的)来完成,如还进一步说明于实施例部分。
经常,针对构象选择性化合物的gpcr靶的高通量筛选将是优选的。这将通过将按照本发明的嵌合多肽固定在适宜的固体表面或载体(其可以被排列或以其它方式多路复用(multiplex))上得到促进。适宜的固体载体的非限制性实例包括珠、柱、载玻片、芯片或板。
更具体地,固体载体可以是颗粒(例如珠或颗粒,通常用于提取柱)或具有片材形式(例如膜或过滤器、玻璃或塑料载玻片、微量滴定测定板、量杆(dipstick)、毛细管填充装置或诸如此类),其可以是扁平、打褶(pleated)、或中空纤维或管。以下基质是实例而不是穷举的,这样的实例可以包括二氧化硅(多孔无定形二氧化硅),即flash系列的筒(cartridges),其包含60a不规则的二氧化硅(32-63um或35-70um),由biotage(dyaxcorp.的部门供应、琼脂糖或聚丙烯酰胺载体,例如由amershampharmaciabiotech供应的琼脂糖凝胶系列产品,或由bio-rad供应的affi-gel载体。此外存在大孔聚合物,如由bio-rad供应的压力稳定的affi-prep载体。可以使用的其它载体包括:右旋糖酐、胶原、聚苯乙烯、甲基丙烯酸酯、藻酸钙、可控多孔玻璃(controlledporeglass)、铝、钛和多孔陶瓷。可替换地,固体表面可以包括质量相关传感器的部分,例如,表面等离子体共振检测器。市售载体的进一步实例讨论于,例如,proteinimmobilisation,r.f.taylored..,marceldekker,inc.,newyork,(1991)。
固定可以是非共价或共价的。尤其是,按照技术人员已知的标准技术,在固体表面上按照本发明的嵌合多肽的非共价固定或吸附可以经由表面包被抗体、或链霉抗生物素蛋白或抗生物素蛋白、或金属离子的任何一种而进行,其识别附连于嵌合多肽的分子标签(例如strep标签、组氨酸标记等)。
尤其是,通过共价交联(利用常规偶联化学)可以将嵌合多肽附连于固体表面。固体表面可以自然地包含适用于共价附连的可交联残基或它可以被涂布或衍生以引入适宜的可交联基团(按照在本领域中众所周知的方法)。在一种具体实施方式中,在经由反应性部分(其并不包含化学间隔臂),直接共价偶联于所期望的基质以后,会保留固定的蛋白质的足够的功能性。关于在固体载体上抗体(片段)的固定方法的进一步实例和更详细的信息讨论于jungetal.(2008);类似地,膜受体固定方法综述于cooper(2004);两者均以引用方式结合于本文。
分子生物学的进展,特别是通过定位诱变,使得能够在蛋白质序列中进行特定氨基酸残基的突变。例如,特定氨基酸(在具有已知或推断结构的蛋白质中)的突变到赖氨酸或半胱氨酸(或其它所期望的氨基酸)可以提供用于共价偶联的特异位点。还可以再设计特定蛋白质以改变涉及化学偶联的表面可用氨基酸的分布(kallwassetal,1993),从而有效控制偶联蛋白的取向。类似的方法可以应用于按照本发明的嵌合多肽,以提供定向固定的方式而没有添加包含天然或非天然氨基酸的其它肽尾或域。应当理解的是,可以在嵌合多肽的gpcr部分和/或结合域部分中引入突变并且需要精心选择以并不干扰结构构象和/或生物活性。例如,如果将在是抗体或抗体片段的结合域部分如纳米抗体中引入突变,则在框架区中引入突变是优选的,从而最大限度地减少对抗体(片段)的抗原结合活性的干扰。
方便地,固定的蛋白质可以用于免疫吸附过程如免疫测定,例如elisa,或免疫亲和力纯化过程,其中通过使按照本发明的固定的蛋白质接触测试样品(按照本领域中常规的标准方法)。可替换地和特别地,为了高通量的目的,可以排列或以其它方式多路复用固定的蛋白质。优选地,按照本发明的固定的蛋白质用于筛选和选择选择性地结合于gpcr的特定构象的化合物。
应当理解的是,可以固定结合域部分或gpcr部分(其形成融合体的一部分),其取决于应用的类型或需要完成的筛选的类型。此外,gpcr-稳定结合域(靶向gpcr的特定构象表位)的选择将确定gpcr的取向,因而,化合物鉴定的所期望的结果,例如特异性地结合所述构象稳定gpcr的胞外部分、膜内部分或胞内部分的化合物。
在一种可替换的实施方式中,可以将测试化合物(或测试化合物的文库)固定在固体表面中,如芯片表面,而提供例如在洗涤剂溶液中或在膜样制剂中的嵌合多肽。
因此,在一种具体实施方式中,提供固定按照本发明的嵌合多肽的固体载体,用于任何上述筛选方法。
最优选地,例如在噬菌体展示选择协议(在溶液中)中,或在放射性配体结合测定中,既不固定嵌合多肽也不固定测试化合物。
待测试的化合物可以是任何小化合物(chemicalcompound)、或大分子,如蛋白质、糖、核酸或脂质。通常,测试化合物将是小化合物、肽、抗体或它们的片段。应当理解的是,在一些情况下,测试化合物可以是测试化合物的文库。尤其是,用于治疗性化合物如激动剂、拮抗剂或反向激动剂和/或调节剂的高通量筛选测定形成本发明的一部分。为了高通量的目的,可以使用化合物库或组合文库如变构化合物库、肽库、抗体库、基于片段的库、合成化合物库、天然化合物库、噬菌体展示文库等。用于制备和筛选此类文库的方法是本领域技术人员已知的。
可以可选地将测试化合物共价或非共价连接于可检测标记。用于连接、使用和检测它们的适宜的可检测标记和技术对于技术人员而言将是清楚的,并且包括但不限于可通过光谱学、光化学、生物化学、免疫化学、电学、光学或化学方式加以检测的任何成分。有用的标记包括磁珠(例如dyna珠)、荧光染料(例如所有alexafluor染料、荧光素、异硫氰酸盐、得克萨斯红、罗丹明、绿色荧光蛋白等)、放射性标记(例如3h、125i、35s、14c、或32p)、酶(例如辣根过氧化物酶、碱性磷酸酶)、和比色标记如胶体金或有色玻璃或塑料(例如聚苯乙烯、聚丙烯、胶乳等)珠。用于检测上述标记的方式是本领域技术人员众所周知的。因此,例如,可以利用摄影胶片或闪烁计数器来检测放射性标记,可以利用用来检测发出的照明的光检测器来检测荧光标记物。通常通过提供具有底物的酶并检测通过酶对底物的作用所产生的反应产物来检测酶标记,以及通过简单可视化有色标记来检测比色标记。在本发明的涉及本发明的嵌合多肽的第一方面的范围内较早描述了其它适宜的可检测标记。
因此,按照具体实施方式,如在任何上述筛选方法中使用的测试化合物选自包括以下项的组:多肽,肽,小分子,天然产物,肽模拟物,核酸,脂质,脂肽,碳水化合物,抗体或从其衍生的任何片段,如fab、fab'和f(ab')2、fd,单链fv(scfv),单链抗体,二硫键连接的fv(dsfv)和包含vl或vh域的片段,重链抗体(hcab),单域抗体(sdab),小体(minibody),源自骆驼重链抗体(vhh或纳米抗体)的可变域,源自鲨鱼抗体(vnar)的新抗原受体的可变域,蛋白支架,包括α体、a蛋白,g蛋白,设计的锚蛋白重复域(designedankyrin-repeatdomains)(darpin),纤连蛋白iii型重复,抗运载蛋白(anticalin),扭结菌素(knottin),工程ch2域(纳米抗体)(如前文中定义的)。
在一种优选的实施方式中,高通量筛选方法涉及提供包含大量的潜在的治疗性配体的组合化学或肽文库。然后在一种或多种测定中,如本文描述的,筛选这样的“组合文库”或“化合物库”,以确定那些文库成员(特定化学物质或子类),其显示所期望的特性活性。“化合物文库”是通常最终用于高通量筛选的储存化学品的集合。“组合文库”是通过化学合成或生物合成,通过结合许多化学“结构单元”所产生的不同的化合物的集合。组合文库的制备和筛选是本领域技术人员众所周知的。如此确定的化合物可以作为常规的“先导化合物”或可以本身用作潜在或实际的治疗剂。因此,在一种进一步的实施方式中,如上文描述的筛选方法进一步包含修饰这样的测试化合物,其已显示选择性地结合于嵌合多肽,包括包含处于特定构象的gpcr的嵌合多肽,并确定修饰的测试化合物是否结合于gpcr(当停留在特定构象时)。
因此,按照更具体的实施方式,包含本发明的嵌合多肽和受体配体的复合物可以用于任何上述筛选方法。优选地,受体配体选自包括小分子、多肽、抗体或从其衍生的任何片段、天然产物等的组。更优选地,受体配体是完全激动剂、或部分激动剂、偏爱激动剂、拮抗剂、或反向激动剂(如上文中描述的)。
可能需要鉴定和表征靶gpcr的天然或内源性配体。尤其是,有必要"去孤儿(de-orphanise)"gpcr,对其还没有确定天然活化配体。这样的配体可以回收自生物样品如血液或组织提取物或回收自配体库。因此,按照一种具体实施方式,如在任何上述筛选方法中使用的测试化合物被提供为生物样品。尤其是,样品可以是取自个体的任何适宜的样品。例如,样品可以是体液样品如血液、血清、血浆、脊髓液。
虽然如上所述的筛选方法足以确定化合物的功能分布,但可在二级测定中另外评估化合物对靶gpcr的下游信号的功能效应。因此,可以利用任何适宜的体外测定、基于细胞的测定、体内测定和/或动物模型(本身已知的)、或它们的任何组合,其取决于涉及的特定疾病或病症,来测试化合物和/或包含上述化合物的组合物的效力。
应当理解的是,按照本发明,嵌合多肽、宿主细胞和其衍生物可以被进一步设计,因而是用于基于细胞的测定的开发或改进的特别有用的工具。基于细胞的测定对于评估新生物靶的作用机制和化合物的生物活性是关键的。例如但不限于,用于gpcr的目前的基于细胞的测定包括途径激活(ca2+释放、camp生成或转录活性)的测量、通过用gfp标记gpcr和下游元件,蛋白质运输的测量;以及在蛋白质之间相互作用的直接度量,其中利用荧光共振能量转移(fret)、生物发光共振能量转移(bret)或酵母双杂交方式。
进一步,可能是特别有利的是,用本发明的嵌合多肽、或宿主细胞或其包含上述项的衍生物来免疫动物,以相对于靶gpcr,激发抗体,优选构象选择性抗体。因此,本文还设想这样的免疫方法。用于体内激发抗体的方法在本领域中是已知的,并且还描述于上文。可以利用在本领域中众所周知的适用于生成免疫反应的任何技术来免疫任何适宜的动物,例如,哺乳动物如兔、小鼠、大鼠、骆驼、羊、牛、猪,或鸟如鸡或火鸡,或鱼,如鲨鱼。在免疫以后,按照本领域中众所周知的技术,可以形成编码免疫球蛋白基因、或其部分,并表达在细菌、酵母、丝状噬菌体、核糖体或核糖体亚基或其它展示系统中的表达文库。进一步说,产生的抗体库包含用于任何如上文中描述的筛选方法的适宜测试化合物的集合。如上文描述的已被激发的抗体还可以是用来特异性地检测处于特定构象状态的gpcr的有用的诊断工具,并因而也形成本发明的一部分。
在一种实施方式中,固定嵌合多肽(如上文中描述的)可以用于选择结合域,其包括结合构象稳定受体的抗体或抗体片段或肽。本领域的技术人员将认识到,可以选择这样的结合域(作为非限制性实例):通过筛选在它们的表面上表达结合域的细胞、或在它们的表面上展示geniii和纳米抗体的融合体的噬菌体、或展示交配因子蛋白(matingfactorprotein)aga2p的融合体的酵母细胞的组、集合或文库,或通过核糖体展示(除了别的以外)。
一种具体实施方式涉及上述固定嵌合多肽用于分离结合域,其对于受体的由高有效分子内浓度的构象选择性结合域(其以1比1化学计量比共价结合于受体)所诱导的构象具有选择性。
本发明的再一方面涉及试剂盒,其包含本发明的嵌合多肽或宿主细胞或宿主细胞培养物或膜制剂(按照本发明)。试剂盒可以进一步包含试剂的组合如缓冲剂、分子标记、载体构建体、参比样品材料、以及适宜的固体载体等。这样的试剂盒可以用于本发明的任何应用(如本文描述的)。例如,试剂盒可以包含可用于化合物筛选应用的测试化合物(的文库)。
以下实施例旨在促进本发明的进一步理解。虽然本文参照说明性实施方式描述了本发明,但应当理解的是,本发明并不限于此。那些本领域中以及获得本文教导的技术人员将认识到在其范围内的另外的改进和实施方式。因此,本发明仅受限于本文所附权利要求。
实施例
实施例1:β2ar-纳米抗体融合蛋白构建体的生成
在此实施例中描述的gpcr-纳米抗体融合体是嵌合多肽,其包含用肽接头连接的两种不同的蛋白质:gpcrβ2ar、接头ggggsgggs(seqidno:51)和纳米抗体,其所有是按此顺序从氨基到羧基末端加以融合。融合编码这些蛋白质的基因(如下所述)(图2a-2e)并克隆在pfastbac1载体(invitrogen,目录号10359-016)中。
gpcr部分扩增自dna,其编码源自流感病毒的可切割血凝素(ha)蛋白信号肽(sp)(mktiialsyifclvfa;seqidno:52),接着flag表位(dykdddda;seqidno:53),接着tev切割位点(enlyfqgf;seqidno:54),接着人β2肾上腺素能受体的编码序列,其涵盖gly2至gly365(seqidno:55)。还将n187e的点突变引入构建体以破坏这种不希望的糖基化位点(β2ar365n;rasmussenetal.,2011b)。进行到β2ar365n的β2肾上腺素能受体工程以增加在sf9细胞中受体的细胞表达水平。
纳米抗体基因片段扩增自编码相应的纳米抗体的噬菌粒。nb80(seqidno:13)是β2ar特异性纳米抗体,其稳定结合于完全激动剂如bi-167107的β2ar的活性状态(rasmussenetal.2011b)。nb71(seqidno:14)是另一种β2ar特异性xaperone,其稳定活性状态(wo2012007593)。nb69(seqidno:15)对于毒蕈碱性3受体具有特异性并且对于β2ar没有可检测的亲和力。
通过重叠延伸pcr(overlapextensionpcr)来框内基因融合gpcr和纳米抗体。因此,20ng的包含gpcrcdna的质粒用作在50μlpcr反应中的模板(pfu聚合酶,fermentas,目录号ep0501),其包含4%的dmso,以扩增β2ar编码dna,其中利用引物ep211(5’-gcggaattcgagctcgcc-3’;seqidno:56)和引物ep207(5‘-cctccgccggatccgccacctcctccactctgctcccctgtg-3’;seqidno:57)。引物ep211具有ecori限制位点,其是在编码序列的5’端处。引物ep207合并在受体的c端处的部分的ggggsgggs(seqidno:51)接头。用于此反应的扩增条件是2分钟95℃,35个循环的30秒94℃,30秒50℃,1分钟30秒72℃,接着在72℃下10分钟以扩增融合体的开放阅读框的gpcr编码部分。
nb69、nb71和nb80均具有相同的n端和c端序列。在50μl中的pcr中,借助于pfu聚合酶,扩增纳米抗体dna,其中利用5ng的每种构建体,并借助于引物ep206(ggcggatccggcggaggttcgcaggtgcagctgcaggagtctgggggagg;seqidno:58)以合并在纳米抗体的n端处的ggggsgggs接头的重叠部分和ep202(tggaattctagattagtgatggtgatggtggtgtgaggagacggtgacctgggt;seqidno:59),从而在合并在基因的3’端处的xbai克隆位点的融合蛋白的c末端处加入his6标记的序列。使用以下扩增条件:2分钟95℃,30个循环的30秒94℃,30秒50℃,1分钟72℃,接着在72℃下10分钟以扩增杂交体的纳米抗体编码部分。
编码gpcr或纳米抗体的pcr片段是利用pcr纯化试剂盒(promega)加以纯化并用作在新50μlpcr反应中的模板:20ng的ep211-β2ar-ep207(ep211和ep207是指已用于pcr扩增的引物)扩增的pcr片段与大约20ng的扩增的ep206-纳米抗体-ep202片段混合并利用kapataq聚合酶(sopaghem,目录号bk1002)融合,其中通过如下的重叠延伸。在95℃下熔解2分钟以及5个循环的30秒95℃,30秒55℃,1分钟45秒以后,利用引物ep202和ep211并在28个循环(30秒95℃,30秒55℃,1分钟45秒72℃)中,接着在72℃下10分钟,来扩增融合β2ar-纳米抗体开放阅读框。分开纯化包含不同的β2ar-纳米抗体开放阅读框的pcr片段,克隆为在pfastbac1中的ecori-xbai片段并在大肠杆菌(e.coli)top10中加以转化。质粒dna制备自单集落(克隆,clonies)并且通过测序来证实开放阅读框的序列。构建体是指定的pfastbacβ2ar365n-nb80(实验室参考ca6836)、pfastbacβ2ar365n-nb69(实验室参考ca6833)、和pfastbacβ2ar365n-nb71(实验室参考ca6835)。由不同的β2ar365n-nb融合构建体编码的氨基酸序列示于图2a-2e(seqidno:1-4)。
实施例2:β2ar-纳米抗体融合体在杆状病毒感染sf9细胞中的表达
为了产生编码β2ar-纳米抗体融合体的杆粒,利用
对于每种杆粒,通过混合1ml的grace的未补充昆虫细胞培养基(sigma,目录号g8142)、15μl的cellfectinii(invitrogen,cat.nr10362-100)和5μl的杆粒dna(大约3μg)来制备转染混合物。在室温下预温育这种转染混合物20分钟。接着,将1x107颗粒化的sf9细胞再悬浮在转染混合物中并在27℃下摇动。在4小时以后,添加4ml的无蛋白esf921sf9培养基(表达系统llc,目录号96-001)并在27℃和130rpm下生长细胞48小时。添加额外的5ml的esf921sf9培养基并通过离心来收获p1重组杆状病毒原液(p1)以前温育细胞另外24小时至40小时。通过在新鲜sf9培养物(以3x106细胞/ml的密度)中稀释p1100倍并在27℃和130rpm下培养,来形成p2重组杆状病毒原液。在感染以后,通过离心72小时来收获p2病毒原液。通过用p2杆状病毒原液来感染新鲜生长的sf9细胞(以4百万/ml的密度)(1:100至1:250)以完成不同的β2ar365n-nb融合体的重组表达。在收获以前,在27℃(130rpm)下培养受感染细胞48小时至55小时。通过对活细胞的荧光显微术来证实gpcr-纳米抗体杂交体的表达(实施例3)。用补充有1.5mmedta的冰冷的pbs(lifetechnologies,目录号10010-023)来洗涤表达重组蛋白的细胞两次,颗粒化(pellet)并在-80℃下储存。
实施例3:通过荧光显微术来确认β2ar-纳米抗体融合蛋白的表达
为了监测不同的β2ar365n-nb融合体的表达,利用荧光显微术,分析了非感染sf9细胞和用p1重组杆状病毒原液感染的sf9细胞(在感染72小时以后收获)的受体表达。为此目的,在8孔μ-载玻片(ibidi,目录号80821)中,将15μl的每种细胞培养物稀释到200μl的包含1μg小鼠抗flag(m2)单克隆抗体(sigma,目录号f3165)和1μg共轭于fitc的大鼠抗小鼠-igg(ebioscience,目录号11-4011)的pbs,然后在黑暗中温育15分钟。在细胞被表面附连以后,小心地除去过量的染色液(stainingsolution)。借助于eclipsete2000(nikon)倒置显微镜来获取受感染细胞和非感染细胞的图像。利用透射显微术,以及利用落射荧光透射显微术,并利用fitc过滤器,来获取图像。利用相同的曝光设定来进行所有荧光测量。
非感染sf9细胞与表达β2ar365n-nb80、β2ar365n-nb71、β2ar365n-nb69或非融合β2ar365n的细胞的荧光图像的比较表明,类似于非融合受体(数据未示出),嵌合多肽主要表达在昆虫细胞的细胞表面上。
实施例4:从表达β2ar-纳米抗体融合体的昆虫细胞来制备膜
将通过离心新鲜的50ml的表达重组β2ar-nb融合体的sf9细胞的培养物所获得的细胞沉淀物再悬浮于8ml的包含蛋白酶抑制剂的裂解缓冲液(10mmtris/hclph7.4、1mmedta、10μg/ml亮抑酶肽(leupeptine)、0,2mmpmsf)。通过利用小玻璃研磨机和聚四氟乙烯杵(特氟龙研磨棒,teflonpestle)来充分压碎再悬浮沉淀物来裂解细胞。通过在26000g下的离心来回收膜。将膜沉淀物再悬浮于1.5ml的储存缓冲液(10mmtris/hclph7.4、1mmedta、10%蔗糖)并在80℃下以等分试样存储。借助于bca蛋白测定试剂盒(thermoscientificpierce,目录号23225)并按照制造商的说明来测量总蛋白浓度。通过分析这些sf9膜的蛋白质含量(通过western印迹分析),进一步证实了在杆状病毒感染sf9细胞中gpcr-纳米抗体杂交体的表达(实施例5)。通过放射性配体竞争测定,已经分析了这些gpcr-纳米抗体杂交体的药理特性(实施例6)。
实施例5:通过western印迹证实了β2ar-纳米抗体融合蛋白的表达
将不同杆状病毒感染sf9细胞的膜制剂(25μg总蛋白)加载在12,5%sds-page凝胶上。在电泳以后,将蛋白质转移到硝酸纤维素片并用4%脱脂乳来阻断膜。利用抗flagm2(sigma,目录号f3165)作为一抗以及抗小鼠碱性磷酸酶共轭物(sigma,cat.nra3562)并连同nbt和bcip一起来显影印迹以检测重组蛋白的表达(图3)。具有适当分子量(对于纳米抗体-融合体和非融合β2ar,分别为大约57和43kda)的带的检测,对于产生的所有构建体,证实了融合蛋白的表达。
实施例6:通过比较放射性配体竞争测定,β2ar-纳米抗体融合体的药理特性的分析
为了分析不同β2ar365n-纳米抗体融合体的药理特性,我们进行了比较放射性配体竞争实验,其中使用天然激动剂肾上腺素(epinephrine)(sigma目录号e4250)、(-)-异丙基肾上腺素盐酸盐((-)-isoproterenolhydrochloride)(完全激动剂,sigma目录号i6504)、沙丁胺醇(部分激动剂,sigmacat.nrs8260)、ici-118,551盐酸盐(反向激动剂,sigmacat.nri127)或烯丙洛尔盐酸盐(中性拮抗剂,sigmacat.nra8676)和卡维地洛(拮抗剂,sigmacat.nrc3993)作为竞争剂以及中性拮抗剂[3h]-双氢烯丙洛尔作为放射性配体。不同的配体的药理效应是按照kahsaietal.(2011)。
对表达β2ar365n(没有纳米抗体融合)、β2ar365n-nb80、β2ar365n-nb71或β2ar365n-nb69的sf9昆虫细胞膜进行放射性配体竞争结合实验。使表达不同的重组蛋白(实施例2和4,5μg总蛋白)的sf9细胞的膜与(-)-异丙基肾上腺素((-)-isoproterenol)、肾上腺素、沙丁胺醇、ici118,551或烯丙洛尔混合,浓度为在结合缓冲液(75mmtrisph7.5、12.5mmmgcl2、1mmedta、0.05%bsa)中的10-11m至10-4m。接着,将放射性配体[3h]-双氢烯丙洛尔(2nm最终浓度)加入每个稀释品并在室温下并在摇动的平台上(总反应体积/测定点是250μl)温育样品2小时。通过经whatmangf/c单过滤器(unifilter)(perkinelmer,cat.nr6005174)的过滤,并利用96孔filtermate收获器(perkinelmer)来分离受体结合的放射性配体与游离(free)放射性配体。在过滤以后,用冰冷的洗涤缓冲液(20mmtris-hclph7.4)洗涤保留在滤板上的膜,并50℃下干燥过滤器1小时。在添加40μl闪烁液(microscinttm-o,perkinelmer,目录号6013611)以后,用wallacmicrobetatrilux闪烁计数器来测量保留在过滤器上的放射性(cpm)。数据表示重复进行三次的每个试验的平均值±sem(平均值的标准误差)。通过非线性回归分析并利用prism(graphpadsoftware,sandiego,ca)来确定ic50值。
在第一系列的实验中,我们比较了β2ar365n-nb80融合体的药理特性与β2ar365n-nb69嵌合体的性能(图4a-4f)。nb80是一种xaperone,其选择性地结合于激动剂结合的β2ar并表现出g蛋白样行为,因而稳定在激动剂·β2ar·nb80复合物中的受体的活性状态构象(rasmussenetal.2011b)。nb69是模拟纳米抗体,其特异性地结合于大鼠毒蕈碱性受体m3,并且对于β2ar没有可检测亲和力。我们发现,β2ar365n-nb80嵌合体的药理特性完全不同于对照nb69-融合受体的性能。相比于nb69嵌合体,融合于具有g蛋白样行为的纳米抗体(nb80)的β2ar表现出对于激动剂(肾上腺素、异丙基肾上腺素、沙丁胺醇)增加的亲和力以及对于反向激动剂(ici-118,551)降低的亲和力,其是通过测试配体对nb80和模拟融合体的调节的ic50来举例说明(表3)。这证明了,β2ar365n-nb80嵌合体,而不是对照模拟β2ar365n-nb69嵌合体,采用活性状态构象,其特征在于对于激动剂增加的亲和力以及对于反向激动剂降低的亲和力。
相比于对照β2ar365n-nb69,β2ar365n-nb80嵌合体对于天然激动剂肾上腺素的增加的亲和力可以计算自来自竞争性结合实验(示于图4a)的ic50值的比率,其中通过β2ar365n-nb69的ic50除以β2ar365n-nb80的ic50高,其导致
类似地,相比于对照β2ar365n-nb69,β2ar365n-nb80嵌合体对于反向激动剂ici-118,551的降低的亲和力可以计算自来自示于图4e的竞争性结合实验的ic50值的比率,其中通过β2ar365n-nb69的ic50除以β2ar365n-nb80的ic50,其导致
显著地,相比于对照β2ar365n-nb69嵌合体,β2ar-nb80融合体对于中性拮抗剂烯丙洛尔的亲和力几乎没有影响。β2ar365n-nb80和β2ar365n-nb69对于烯丙洛尔的ic50(图4c)确实是非常类似的,其与以下事实一致:中性拮抗剂是结合不同的功能构象的非选择性配体。
明显地,相比于对照β2ar365n-nb69嵌合体,β2ar-nb80融合体对于拮抗剂卡维地洛的亲和力几乎没有影响。用β2ar365n-nb80和β2ar365n-nb69检测的卡维地洛的ic50(图4f)确实是非常类似的(差别小于系数2)。
在第二系列的实验中,我们比较了β2ar365n-nb80融合体的药理特性与非融合β2ar365n受体的性能(图5a-5b)。融合于具有g蛋白样行为的纳米抗体(nb80)的β2ar表现出对于天然激动剂肾上腺素3数量级更高的亲和力,这表明,β2ar365n-nb80嵌合体,而不是非融合对照受体,采用活性状态构象,其特征在于对于激动剂的增加的亲和力。相比于对照非融合β2ar365n,β2ar365n-nb80嵌合体对于天然激动剂肾上腺素的增加的亲和力可以计算自来自示于图5a的竞争性结合实验的ic50值的比率,其中通过非融合β2ar365n的ic50除以β2ar365n-nb80的ic50高,其导致
明显地,相比于对照非融合β2ar365n,β2ar-nb80融合体对于拮抗剂卡维地洛的亲和力几乎没有影响。β2ar365n-nb80和非融合β2ar365n-nb69对于卡维地洛的ic50(图5b和表3)确实是非常类似的。
在第三个实验中,我们比较了β2ar365n-nb71融合体的药理特性与β2ar365n-nb69嵌合体的性能(图6a-6f和表3)。nb71是另一种纳米抗体,其选择性地结合β2ar的活性构象(wo2012007594)。我们发现,β2ar365n-nb71嵌合体的药理性能还表现出对于激动剂(异丙基肾上腺素、沙丁胺醇)的增加的亲和力以及对于反向激动剂ici-118,551的降低的亲和力,这表明,β2ar365n-nb71嵌合体,但不是对照β2ar365n-nb69嵌合体,采用活性状态构象,其特征在于对于激动剂增加的亲和力和对于反向激动剂降低的亲和力。相比于对照β2ar365n-nb69,β2ar365n-nb71嵌合体对于天然激动剂肾上腺素的增加的亲和力可以计算自来自示于图6a的竞争性结合实验的ic50值的比率,其中通过β2ar365n-nb69的ic50除以β2ar365n-nb71的ic50高,其导致
类似地,相比于对照β2ar365n-nb69,β2ar365n-nb71嵌合体对于反向激动剂ici-118,551的降低的亲和力可以计算自来自示于图6e的竞争性结合实验的ic50值的比率,其中通过β2ar365n-nb69的ic50除以β2ar365n-nb71的ic50,其导致
显著地,相比于对照β2ar365n-nb69嵌合体,β2ar-nb71融合体对于中性拮抗剂烯丙洛尔的亲和力几乎没有影响。对于烯丙洛尔,β2ar365n-nb71和β2ar365n-nb69的ic50(图6c)确实是非常类似的,其与以下事实一致:中性拮抗剂是结合不同的功能构象的非选择性配体。
明显地,相比于对照β2ar365n-nb69嵌合体,β2ar-nb71融合体对于拮抗剂卡维地洛的亲和力几乎没有影响。对于卡维地洛,β2ar365n-nb71和β2ar365n-nb69的ic50(图6f)确实是非常类似的。
实施例7:β2ar-纳米抗体融合体的构象热稳定性
用于gpcr的稳定,即gpcr的热稳定的策略的一种是基于在(放射性)配体的存在下偶联于热稳定性测定的系统诱变以筛选具有改善的热稳定性的突变体(tate2012)。不幸的是,在激动剂的存在下是热稳定的受体显示没有对于它们的相应的激动剂的亲和力的显著增加(serrano-vegaetal.2008,shibataetal.2009,lebonetal.2011),这表明,这些热稳定受体并不采用受体的完全活性构象。
为了测试β2ar365n-nb80融合体,具有活性状态β2ar受体的所有性能的融合蛋白,是否具有增加的热稳定性,我们对β2ar365n-nb80和β2ar365n-nb69进行热稳定性测定以测量稳定受体的活性构象的具有g蛋白样行为的纳米抗体(nb80)是否也增加它的热稳定性,从而导致真正的构象热稳定受体。
为了增溶受体,我们在冰上在1%ddm(20mmtrishcl、ph7,4、500mmnacl、1%n-十二烷基β-d-麦芽糖苷、10μg/ml亮抑酶肽、0,2mmpmsf)中温育来自表达β2ar365n-nb80或β2ar365n-nb69的sf9细胞的膜(大约1mg总膜蛋白)一小时。接着,通过在17000g下离心5分钟来除去不溶性物质。接着,用缓冲液(20mmtrishcl、ph7,4、500mmnacl)将溶解的受体稀释至0,08%ddm的ddm浓度并通过离心(在20000g和4℃下20分钟)再次除去不溶性物质。用测定缓冲液(20mmtrishcl、ph7,4、500mmnacl、1%n-十二烷基β-d-麦芽糖苷)将增溶受体的20μl等分试样稀释至90μl并留在冰上30分钟。
通过在不存在任何配体的情况下在规定温度下温育稀释的等分试样30分钟来评估热稳定性。在30分钟以后,将过量的放射性配体(5nm最终浓度)加入每个样品并将样品留在冰上45分钟。
为了量化功能性受体的剩余部分,通过在用冰冷的测定缓冲液平衡的2ml葡聚糖凝胶(sephadex)g50柱上的凝胶过滤将受体结合的放射性配体与游离放射性配体分离。将受体结合的放射性配体收集在1ml的容积中并稀释在6ml闪烁液(optiphasehisafe2,perkinelmer,目录号1200-436)中以用液体闪烁分析仪tri-carb2810tr(perkinelmer)来计数放射性(cpm)。在1μm冷烯丙洛尔的存在下,通过测量残留在蛋白质部分中的放射性来估计非特异性结合。
数据表示,在给定温度下,相对于在0℃下的受体结合的配体,特异性地结合于受体的放射性配体的平均值±sem(重复进行三次实验)。这些实验表明,在0,08%ddm中,溶解的β2ar365n-nb80嵌合体(tm=33℃)具有比β2ar365n-nb69(tm=29℃)更高的热稳定性(图7)。由于nb80稳定β2ar的活性构象,所以我们的结论是,β2ar365n-nb80嵌合体代表着构象热稳定受体。
实施例8:β2ar-纳米抗体融合体与复合于外源添加的纳米抗体的非融合β2ar的药理特性的比较
为了比较融合与非融合nb80稳定β2ar的活性状态的效率,比较了β2ar365n-nb80融合体与复合于外源添加的nb80的非融合β2ar365n的药理特性。我们进行类似的比较放射性配体竞争实验(如在实施例6中描述的)。天然激动剂肾上腺素(sigmacat.nre4250)用作竞争剂以及[3h]-双氢烯丙洛尔用作放射性配体。作为对照,并行测定β2ar365n-nb69融合体和复合于外源添加的nb69的β2ar365n。
对表达β2ar365n(没有纳米抗体融合)、β2ar365n-nb80或β2ar365n-nb69的sf9昆虫细胞膜(5μg总蛋白)进行放射性配体竞争结合实验。表达β2ar365n-nb80融合体或β2ar365n-nb69融合体的sf9细胞的膜与在结合缓冲液(75mmtrisph7.5、12.5mmmgcl2、1mmedta、0.05%bsa)中的不同浓度(10-10m至10-4m)的肾上腺素混合。并行地,在与在结合缓冲液中不同浓度(10-10m至10-4m)的肾上腺素混合以前,将不同浓度(50pm至500nm)的纯化nb80或nb69加入表达非融合β2ar365n的sf9细胞的膜。接着,将放射性配体[3h]-双氢烯丙洛尔(2nm最终浓度)加入每种条件并在室温下在摇动的平台上温育样品2小时(总反应体积/测定点是250μl)。收获配体结合的膜并测量放射性(如在实施例6中描述的)。数据表示重复进行三次的每个数据点的平均值±sem。
数据表示重复进行三次的每个实验的平均值±sem。通过非线性回归分析并利用prism(graphpadsoftware,sandiego,ca)来确定ic50值。
如在图8中可以观察到的,非融合β2ar365n对于天然激动剂肾上腺素的亲和力取决于nb80的浓度,其中增加的表观亲和力伴随着增加浓度的外源添加的nb80。在存在500nmnb80的情况下,β2ar365n的肾上腺素效力移动仅是87倍,而对于β2ar365n-nb80融合体则是534倍(在存在外源添加的nb80和β2ar365n-nb80的情况下,通过模拟融合体的ic50除以非融合β2ar365n的相应的ic50所计算得到)。仅在5μm外源性nb80的存在下,针对非融合β2ar365n所获得的ic50相同于针对β2ar365n-nb80融合体所获得的ic50。必须将5μm游离(自由,free)nb80加入非融合受体以测量非融合β2ar365n和β2ar365n-nb80融合体对于天然激动剂肾上腺素的可比亲和力。因此,在β2ar365n-nb80融合体中nb80的有效分子内浓度似乎高于500nm。
对于β2ar365n-nb80融合体,在sf9膜中b2ar的量被确定为大约20pmol/mg总膜蛋白。因此,五μg的β2ar365n-nb80sf9膜包含大约0.1pmol的β2ar。五μm的外源添加的nb80(在250μl的反应体积中)对应于大约1.25nmol的nb80。在测试条件下并假设β2ar的同等表达(不论是否融合于nb80),相比于β2ar-nb80融合体,需要相对于β2ar的12500倍摩尔过量的外源添加的nb80,以相同效率限制受体于它的肾上腺素结合的活性状态。
经由对活性状态限制与非限制β2ar(实施例6和8)的比较放射性配体竞争测定获得的结果允许区别(部分)激动剂(ic50比率>10)与拮抗剂和反向激动剂(ic50比率<1)(表3)。在nm-μm浓度下,区别和预测测试化合物(激动剂、部分激动剂、拮抗剂、反向激动剂)的作用方式而不需要细胞受体信号测定的能力是用于化合物筛选的优势。
实施例9:m2r-纳米抗体融合蛋白构建体的生成
在此实施例中描述的gpcr-纳米抗体融合体是嵌合多肽,其包含借助于肽接头连接的两种不同的蛋白质:gpcrm2毒蕈碱性乙酰胆碱受体(m2r)、接头gggsggggsggggsggggsgggs(seqidno:49)和纳米抗体,所有它们从氨基至羧基末端按此顺序加以融合。编码这些蛋白质的基因被融合(如下所述)(图9a-9c)并克隆在pfastbac1载体中。
合成式合成的(syntheticallysynthesized)gpcr部分编码源自流感病毒的可切割血凝素(ha)蛋白信号肽(sp)(mktiialsyifclvfa;seqidno:52),接着flag表位(dykdddd;seqidno:50),接着tev切割位点(enlyfqg;seqidno:51),接着人m2毒蕈碱性乙酰胆碱受体的编码序列,其涵盖met1至arg466并具有胞内环3的缺失:用thr和arg替换氨基酸pro233直到lys374。将点突变(n2d、n3d、n6d、n9d)引入构建体以破坏糖基化位点(m2δi3r;seqidno:5)。进行此毒蕈碱性受体工程以增加受体在sf9细胞中的细胞表达水平。
nb9-1(seqidno:16)是纳米抗体,其选择性地结合于激动剂结合的m2δi3r并表现出g蛋白样行为(还被称为g蛋白模拟物),从而稳定受体在激动剂·m2δi3r·nb9-1复合物中的活性状态构象。m2δi3r-nb9-1融合体被针对昆虫细胞表达加以优化并通过geneart(pmk-rqm2δi3-nb9-1;实验室参考ca7908;lifetechnologies)加以合成。将受体-纳米抗体融合体克隆为在bamhi-xbai开放的pfastbac1载体中的bglii-xbai片段,其导致pfastbac1-m2δi3r-nb9-1(实验室参考ca7911)。通过在pfastbac1载体中克隆来自pmk-rqm2δi3r(由geneart加以合成,实验室参考7909)的bglii-xbai片段来构建仅编码m2δi3r开放阅读框而没有接头和纳米抗体(pfastbac1-m2δi3r;实验室参考ca7914)的对照构建体。在大肠杆菌(e.coli)top10细胞中转化所有构建体。由m2δi3r对照构建体和m2δi3r-nb融合构建体编码的氨基酸序列示于图9b和9c(seqidno:5和6)。已经以类似的方式制备m2δi3r-nb9-8融合构建体。nb9-8(seqidno:17)是具有g蛋白样行为的m2r特异性纳米抗体的另一个实例(kruse,2013)。
实施例10:在杆状病毒感染sf9细胞中m2δi3r-纳米抗体融合体和m2δi3r的表达
为了产生编码m2δi3r-纳米抗体融合体的杆粒,利用
制备p1和p2杆状病毒原液(如在实施例2中描述的)。通过用100倍稀释p2杆状病毒原液来感染新鲜生长的密度为4x106/ml的sf9细胞以完成m2δi3r或m2δi3r-nb9-1融合体的重组表达。在收获以前,在27℃(130rpm)下,培养受感染细胞48小时至60小时。通过对活细胞的荧光显微术来证实gpcr-纳米抗体杂交体的表达。用冰冷的pbs(ph7.4、1.5mmedta)洗涤表达重组蛋白的细胞两次,颗粒化(沉淀,pellet)并储存在-80℃下。
实施例11:从表达m2δi3r或m2δi3r-nb融合体的昆虫细胞来制备膜
将通过离心表达重组m2δi3r或m2δi3r-nb融合体的sf9细胞的新鲜50ml培养物所获得的细胞沉淀物加工成膜提取物并完全如在实施例4中描述的加以存储。借助于bca蛋白测定试剂盒并按照制造商的说明来测量总蛋白浓度。通过放射性配体竞争测定来分析这些gpcr-纳米抗体杂交体的药理特性(实施例12)。
实施例12:通过比较放射性配体竞争测定来分析m2δi3r-纳米抗体融合体的药理特性
为了分析m2δi3r-纳米抗体融合体的药理特性,我们进行比较放射性配体竞争实验,其中使用氯化氨甲酰胆碱(carbachol)(完全激动剂,sigma目录号c4382)和氧化震颤素m(oxotremorinem)(激动剂,sigma目录号o100)作为竞争剂以及[3h]-n甲基东莨菪碱([3h]-nmethylscopolamine)(perkinelmer目录号net636001mc)作为放射性配体。
对表达m2δi3r(没有纳米抗体融合)或m2δi3r-nb9-1的sf9昆虫细胞膜进行放射性配体竞争结合实验。使表达不同的重组蛋白(实施例10和11,10μg总蛋白)的sf9细胞的膜与氯化氨甲酰胆碱或氧化震颤素m混合,浓度为在结合缓冲液(75mmtrisph7.5、12.5mmmgcl2、1mmedta、0.05%bsa)中的10-9m至10-2m。接着,将放射性配体[3h]-n甲基东莨菪碱(0,5nm最终浓度)加入每个稀释品并在室温下在摇动的平台上(总反应体积/测定点是250μl)温育样品2小时。利用96孔filtermate收获器(perkinelmer),并通过经whatmangf/c单过滤器(perkinelmer,目录号6005174)的过滤,来分离受体结合的放射性配体与游离的放射性配体。在过滤以后,用冰冷的洗涤缓冲液(20mmtris-hclph7.4)来洗涤保留在滤板上的膜,并在50℃下干燥过滤器1小时。在添加35μl闪烁液(microscinttm-o,perkinelmer,目录号6013611)以后,用wallacmicrobetatrilux闪烁计数器来测量保留在过滤器上的放射性(cpm)。
我们比较了m2δi3r-nb9-1融合体的药理特性与m2δi3r的性能(图10a-10b)。我们发现,m2δi3r-nb9-1嵌合体的药理特性不同于对照m2δi3r的性能,其通过测试配体对m2δi3r-nb9-1融合体和m2δi3r的ic50和ic50比率(表4)来举例说明。相比于对照非融合m2δi3r,m2δi3r-nb9-1嵌合体对于合成激动剂氯化氨甲酰胆碱的增加的亲和力被计算为比率ic50m2δi3r/ic50高m2δi3r-nb9-1(图10a),其导致
实施例13:β1ar-纳米抗体融合蛋白构建体的生成
在此实施例中描述的gpcr-纳米抗体融合体是嵌合多肽,其包含借助于肽接头连接的两种不同的蛋白质:β1肾上腺素能受体(β1ar)、接头ggggsggggsggggsggggsgggs(seqidno:60)和纳米抗体,所有它们从氨基到羧基末端按此顺序被融合。编码这些蛋白质的基因(图11a)被融合(如下所述)。
由geneart(pmk-rqhβ1ar;实验室参考caca7910)合成的合成β1ar基因。它编码源自流感病毒的可切割血凝素(ha)蛋白信号肽(sp)(mktiialsyifclvfa;seqidno:52),接着flag表位(dykdddda;seqidno:53),接着tev切割位点(enlyfqg;seqidno:51),接着人β1肾上腺素能受体的编码序列,其涵盖pro50至arg401(hβ1ar,uniprotp08588)。β1ar编码序列包含胞内环3(ser260直到gly304)的缺失和两个点突变c392s、c393s以改善在sf9细胞中受体的细胞表达水平。β1ar和β2ar的氨基酸序列的对比表明,构成在β2ar·gs复合物中的nb80表位的氨基酸侧链(rasmussenetal.2011a)在β1ar和β2ar中是相同的,除了r318(β1ar编号;uniprotp08588),其被在β2ar中的赖氨酸所置换。基于此观察结果,一个额外的点突变r318k被引入以产生在β1ar中的完全nb80表位。
编码相应的纳米抗体的纳米抗体基因片段克隆自在实施例1中描述的质粒。nb80(seqidno:13)是β2ar纳米抗体,其稳定结合于完全激动剂如bi-167107的β2ar的活性状态(rasmussenetal.2011b)。nb69(seqidno:15)对于毒蕈碱性3受体具有特异性并且对于β2ar没有可检测的亲和力。
β1ar受体,作为bglii-bamhi片段,克隆自在bamhi开放的pfastbacβ2ar365n-nb80(ca6836)载体中的pmk-rqhβ1ar(实验室参考ca7910),以替换β2ar受体,从而导致pfastbac-hβ1ar-nb80(实验室参考ca7923)。通过从在pfastbacβ2ar365n-nb69(ca6833)中的pmk-rqhβ1ar克隆相同的bglii-bamhi片段来构建编码连接于nb69的β1ar开放阅读框的对照构建体pfastbac-hβ1ar-nb69(实验室参考ca7924),以替换β2ar受体。在e.colitop10细胞中转化所有构建体。编码hbeta1ar-nb融合构建体的氨基酸序列示于图11b-11c(seqidno:7和8)。
实施例14:在杆状病毒感染sf9细胞中β1ar-纳米抗体融合体的表达
为了产生编码β1ar-纳米抗体融合体的一种的杆粒,利用
制备p1和p2杆状病毒原液(如在实施例2中描述的)。通过用100倍稀释p2杆状病毒原液来感染新鲜生长的密度为4x106/ml的sf9细胞以完成β1ar-nb80或β1ar-nb69融合体的重组表达。在收获以前,在27℃(130rpm)下,培养受感染细胞48小时至60小时。用冰冷的pbs(ph7.4、1.5mmedta)洗涤表达重组蛋白的细胞两次,颗粒化并储存在-80℃下。
实施例15:从表达hβ1ar-nb80或hβ1ar-nb69融合体的昆虫细胞制备膜
将通过离心表达重组hβ1ar-nb80或hβ1ar-nb69融合体的sf9细胞的新鲜50ml培养物所获得的细胞沉淀物加工成膜提取物并完全如在实施例4中描述的加以存储。借助于bca蛋白测定试剂盒并按照制造商的说明来测量总蛋白浓度。通过放射性配体竞争测定来分析这些gpcr-纳米抗体杂交体的药理特性(实施例16)。
实施例16:通过比较放射性配体竞争测定来分析hβ1ar-纳米抗体融合体的药理特性
为了分析不同的hβ1ar-纳米抗体融合体的药理特性,我们利用天然激动剂肾上腺素,然后反向激动剂ici-118,551盐酸盐或中性拮抗剂烯丙洛尔盐酸盐作为竞争剂以及中性拮抗剂[3h]-双氢烯丙洛尔作为放射性配体进行比较放射性配体竞争实验。不同的配体的药理效应是按照kahsaietal.(2011)。
将表达不同的重组蛋白(实施例14和15,5μg总蛋白)的sf9细胞的膜与肾上腺素、ici118,551或烯丙洛尔混合,其浓度为在结合缓冲液(75mmtrisph7.5、12.5mmmgcl2、1mmedta、0.05%bsa)中的10-11m至10-4m。接着,将放射性配体[3h]-双氢烯丙洛尔(2nm最终浓度)加入每个稀释品并在室温下在摇动的平台上(总反应体积/测定点是250μl)温育样品2小时。受体结合的放射性配体分离自游离的放射性配体(如在实施例6中描述的)。数据表示重复进行三次的每个实验的平均值±sem(平均值的标准误差)。通过非线性回归分析并利用prism(graphpadsoftware,sandiego,ca)来确定ic50值。
在此系列实验中,我们比较了hβ1ar-nb80融合体的药理特性与hβ1ar-nb69融合体的性能(图12a)。我们发现,hβ1ar-nb80嵌合体的药理特性完全不同于对照nb69-融合受体的性能。相比于nb69嵌合体,融合于具有g蛋白样行为的纳米抗体(nb80)的hβ1ar表现出对于激动剂肾上腺素的增加的亲和力以及对于反向激动剂(ici-118,551)的降低的亲和力,其是通过测试配体对hβ1ar-nb80融合体和hβ1ar-nb69融合体的调节的ic50(表5)来举例说明。这证明了,hβ1ar-nb80嵌合体,但不是对照模拟β2ar365n-nb69嵌合体,采用活性状态构象,其特征在于对于激动剂的增加的亲和力以及对于反向激动剂的降低的亲和力。
相比于对照hβ1ar-nb69,hβ1ar-nb80嵌合体对于天然激动剂肾上腺素的增加的亲和力可以计算自来自示于图12a的竞争性结合实验的ic50值的比率,其中通过hβ1ar-nb69的ic50除以hβ1ar-nb80的ic50高,其导致
显著地,相比于对照hβ1ar-nb69嵌合体,hβ1ar-nb80融合体对于中性拮抗剂烯丙洛尔的亲和力几乎没有影响。β2ar365n-nb80和β2ar365n-nb69对于烯丙洛尔的ic50(图12c)确实是非常类似的,其与以下事实一致:中性拮抗剂是结合不同的功能构象的非选择性配体。
实施例17:β2ar-nb60融合构建体的生成
在此实施例中描述的gpcr-纳米抗体融合体是嵌合多肽,其包含借助于肽接头连接的两种不同的蛋白质:gpcrβ2ar、接头ggggsgggs(seqidno:51)和nb60,所有它们从氨基到羧基末端按此顺序加以融合。融合编码这种蛋白质的基因(如在实施例1中描述的,具有轻微调整)。
gpcr部分扩增自dna,其编码源自流感病毒的可切割血凝素(ha)蛋白信号肽(sp)(mktiialsyifclvfa;seqidno:52),接着flag表位(dykdddda;seqidno:53),接着tev切割位点(enlyfqgf;seqidno:54),接着人β2肾上腺素能受体的编码序列,其涵盖gly2至gly365(seqidno:55)。还将n187e的点突变引入构建体以破坏这种不希望的糖基化位点(β2ar365n;rasmussenetal.,2011b)。进行到β2ar365n的β2肾上腺素能受体工程以增加在sf9细胞中受体的细胞表达水平。
纳米抗体基因片段扩增自编码nb60的噬菌粒。nb60(seqidno:18)是β2ar-特异性纳米抗体,其被描述为会稳定非活性β2ar构象并显著抑制g蛋白激活和β-抑制蛋白募集(stausetal.2013)。
通过重叠延伸pcr,框内基因融合gpcr和纳米抗体。因此,2ng的包含gpcrcdna的质粒用作在50μlpcr反应中的模板(phusion聚合酶,(biolabs,目录号m0530s)以扩增编码dna(ca6817)的β2ar,其中利用引物ep232(5’-gcagatctcggtccgaag-3’;seqidno:61)和引物ep207(5’-cctccgccggatccgccacctcctccactctgctcccctgtg-3’;seqidno:57)。引物ep232退火在编码序列的5’端处的ecori限制位点的5’。引物ep207合并在受体的c端处的ggggsgggs(seqidno:51)接头的一部分。用于此反应的扩增条件是30秒98℃、25个循环的10秒98℃、30秒64,5℃、30秒72℃,接着在72℃下5分钟以扩增编码融合体的开放阅读框的一部分的gpcr。
nb60具有和在实施例1中的纳米抗体相同的n末端和c端序列。在50μl反应中,利用2ng模板(ca2760)和phusion聚合酶来扩增这种纳米抗体dna(如在实施例1中描述的)。使用以下扩增条件:30分钟98℃、25个循环的10秒98℃和10秒72℃,接着在72℃下5分钟以扩增编码杂交体的部分的纳米抗体。
利用pcr纯化试剂盒(promega)来纯化编码gpcr或纳米抗体的pcr片段并用作在新50μlpcr反应中的模板:使6ng的ep232-β2ar-ep207(ep232和ep207是指已用于pcr扩增的引物)扩增pcr片段与大约2ng扩增ep206-纳米抗体-ep202片段混合并与phusion聚合酶融合,其中通过如下重叠延伸。在98℃下熔解30秒和5个循环的在98℃下10秒和在72℃下30秒以后,在25个循环(10秒98℃、30秒67℃、40秒72℃)中,接着在72℃下5分钟,利用引物ep232和ep202来扩增融合的β2ar-纳米抗体开放阅读框。纯化包含β2ar-nb60开放阅读框的pcr片段,克隆为在pfastbac1中的ecori-xbai片段并在大肠杆菌(e.coli)top10中转化。质粒dna制备自单菌落并通过测序来证实开放阅读框的序列。构建体是指定的pfastbacβ2ar365n-nb60(实验室参考ca8235)。由不同的β2ar365n-nb融合构建体编码的氨基酸序列示于图2e(seqidno:4)。
实施例18:在杆状病毒感染sf9细胞中β2ar-nb60的表达以及从表达β2ar-nb60融合体的昆虫细胞来制备膜
为了在sf9细胞中表达β2ar365n-nb60融合体,制备编码β2ar-nb60融合体的杆粒并感染sf9细胞(如在实施例2中描述的)。从表达β2ar-nb60融合体的昆虫细胞来制备膜(如在实施例4中描述的)。通过放射性配体竞争测定,已经分析了这些gpcr-纳米抗体杂交体的药理特性(实施例19)。
实施例19:通过比较放射性配体竞争测定,β2ar–nb60融合体的药理特性的分析
为了分析β2ar365n-nb60融合体的药理特性,我们进行了比较放射性配体竞争实验,其中利用天然激动剂肾上腺素、(-)-异丙基肾上腺素盐酸盐(完全激动剂)、和ici-118,551盐酸盐(反向激动剂)作为竞争剂以及中性拮抗剂[3h]-双氢烯丙洛尔作为放射性配体。不同的配体的药理效应是按照kahsaietal.(2011)。
对表达β2ar365n-nb80、β2ar365n-nb60或β2ar365n-nb69的sf9昆虫细胞膜进行放射性配体竞争结合实验。使表达不同的重组蛋白(实施例2和4,5μg总蛋白)的sf9细胞的膜与肾上腺素、(-)-异丙基肾上腺素或ici118,551混合,其浓度为在结合缓冲液(75mmtrisph7.5、12.5mmmgcl2、1mmedta、0.05%bsa)中的10-11m至10-2m。接着,将放射性配体[3h]-双氢烯丙洛尔(2nm最终浓度)加入每个稀释品并在室温下在摇动的平台上(总反应体积/测定点是250μl)温育样品2小时。分离受体结合的放射性配体和游离的放射性配体(如在实施例6中描述的)。数据表示重复进行三次的每个实验的平均值±sem(平均值的标准误差)。通过非线性回归分析并利用prism(graphpadsoftware,sandiego,ca)来确定ic50值。
在这些实验中,我们比较了β2ar365n-nb60融合体的药理特性与β2ar365n-nb80和β2ar365n-nb69嵌合体的性能(图13a)。nb60是纳米抗体,其据称会稳定非活性β2ar构象(stausetal.2013)。nb80是纳米抗体,其选择性地结合于激动剂结合的β2ar并表现出g蛋白样行为,因而稳定受体在激动剂·β2ar·nb80复合物中的活性状态构象(rasmussenetal.2011b)。nb69是模拟纳米抗体,其特异性地结合于大鼠毒蕈碱性受体m3并且对于β2ar没有可检测亲和力。我们发现,β2ar365n-nb60嵌合体的药理特性完全不同于对照nb69-融合受体的性能。相比于nb69嵌合体,融合于nb60的β2ar表现出对于激动剂(肾上腺素、异丙基肾上腺素)的降低的亲和力以及对于反向激动剂ici-118,551的亲和力几乎没有影响,其是通过测试配体对nb60和nb69融合体的调节的ic50(表6)来举例说明。这证明了,β2ar365n-nb60嵌合体,但不是对照模拟β2ar365n-nb69嵌合体,采用这样的构象,其不同于激动剂结合的活性状态构象并且不同于受体的基础构象。这种构象的特征在于,对于激动剂的降低的亲和力。我们的结果清楚地表明,不同的纳米抗体能够稳定受体的不同的构象状态。
相比于对照β2ar365n-nb69,对于天然激动剂肾上腺素的β2ar365n-nb60嵌合体的降低的亲和力(与β2ar365n-nb80嵌合体的增加的亲和力)可以计算自来自示于图13a的竞争性结合实验的ic50值的比率,其中通过β2ar365n-nb69的ic50除以β2ar365n-nb60的ic50,其导致
实施例20:μ-阿片样受体-纳米抗体融合构建体的生成
mor1aa序列是在不同的哺乳动物物种之间高度保守的。更具体地,在小鼠、牛、猪和人mor1之间的预测的胞内拓扑域(icl+c端)的交叉物种序列同源性是>90%。因为知道,nb33与小鼠mor1的细胞内表位相互作用,所以我们预计,nb33还稳定hmor1的活性构象,因为在icl2中仅存在一个保守替换(在图14中以‘:’表示)和在c端中的一个半保守替换(在图14中以‘.’表示)。
在此实施例中描述的gpcr-纳米抗体融合体编码嵌合多肽,其类似于在实施例1中描述的那些嵌合多肽。在这里,我们描述了人μ-阿片样受体(hmor1,ncbi参比序列nm_000914.1),其基因融合于纳米抗体nb33(实验室参考xa8633)并由34aagly-ser接头(ggggsggggsggggsggggsggggsggggsgggs;seqidno:62)分开。编码hmor1的开放阅读框被优化用于昆虫细胞表达并且在geneart(lifetechnologies)处被定制合成为ecori-hindiii片段。合成杂交基因的草图示于图15。相比于示于图2a的β2ar融合体,对于阿片样受体融合体,i)tev切割位点被省略以及ii)β2ar365n被人mor1nt序列所置换,其中上述序列编码aa残基1-360并具有aa残基2-5(dssa)的额外缺失以及立即接着在34gs接头以前的3c切割位点插入(levlfqgp)。nb33(实验室参考xa8633;seqidno:19)表现出gi/o蛋白样行为(还被称为gi/o蛋白模拟物),并选择性地稳定mor1在激动剂·mor1·nb33复合物中的活性状态构象。类似于gi,添加过量的nb33会增加小鼠mor1对激动剂dmt1-dalda的亲和力至少10倍。在融合构建体中,设计nb33的编码序列以在fr1中引入独特的psti限制位点。编码hmor1-34gs-nb33的合成基因被克隆为在pfastbac1中的ecori-hindiii片段并转化到大肠杆菌(e.coli)tg1,从而导致pfastbac1::hmor1-34gs-nb33(实验室参考xa8901)。融合体的编码aa序列示于图15-a。并行地,hmor1与不相关的纳米抗体的另一融合体被生成为表达mor1的突出构象的对照构建体。因此,编码纳米抗体nb10的基因片段(实验室参考ca4910)交换在pfastbac1::hmor1-34gs-nb33中的nb33编码序列。nb10(seqidno:20)是充分表征的纳米抗体,其对于趋化因子gpcr的胞外表位具有特异性并且对于mor1没有可检测的亲和力。为了制备用于融合体的nb10编码基因片段,通过pcr来再扩增nb10,其中利用引物a6e(5’-gatgtgcagctgcaggagtctggrggagg-3’;seqid63),其在纳米抗体的fr1中引入psti位点(将v变化成q)以及giii(5’-ccacagacagccctcatag-3’;seqid64),后者低聚物杂交于基因iii。作为模板,使用5ng的表达nb10基因iii融合体的噬菌粒pxap100的dna制剂。用于此反应的扩增条件是3分钟94℃和25个循环的30秒94℃、30秒55℃、45秒72℃,接着在72℃下10分钟。在纯化以后,用psti(经过寡a6e引入)和bsteii(在fr4中天然存在的独特的位点)双酶切扩增子,纯化并连接入衍生自pfastbac1::hmor1-34gs-nb33的6.2kbp凝胶纯化psti-bsteii片段,从而导致pfastbac1::hmor1-34gs-nb10。融合体hmor1-34gs-nb10(seqidno:20)的编码aa序列示于图15-c。在克隆以后,两种融合构建体的质粒dna制备自单集落并通过测序来证实杂交基因的序列。
实施例21:在杆状病毒感染sf9细胞中μ阿片样受体-纳米抗体融合体的表达
为了产生编码mor1-纳米抗体融合体的杆粒,将五ng的pfastbac1::hmor1-34gs-nb33或pfastbac1::hmor1-34gs-nb10转化进入dh10bactm细胞。通过在sf9细胞中转染mor1-纳米抗体杆粒来产生重组杆状病毒。每种杆粒用于cellfectinii介导的sf9转染(如在实施例2中描述的),除了对于nb10融合体和对于nb33融合体分别在转染以后72小时和48小时来收获p1重组杆状病毒。将p1病毒原液储存在-80℃下作为快速冷冻培养上清的等分试样,其中添加5%(最终浓度)的胎牛血清(fcs)。通过在新鲜sf9培养物中稀释p150至1000倍(密度为1x106个细胞/ml)并在27℃和130rpm下培养来制备p2重组杆状病毒原液。在感染以后48和72小时,通过离心来收获p2病毒原液并存储(如上所述)在-80℃下直到进一步使用。用冰冷的pbs(lifetechnologies,目录号10010-023),补充有1.5mmedta)洗涤细胞沉淀物两次,储存在-80℃下以制备膜。通过用50、200和1000倍稀释p2杆状病毒原液来感染新鲜生长的sf9细胞(密度为2e6个细胞/ml)以完成不同的mor1-nb融合体的重组表达。作为阴性对照表达,用flag标记的非相关的m2r的p2来并行感染sf9细胞。在收获以前在27℃(130rpm)下培养受感染细胞48小时。用冰冷的pbs(ph7.4,1.5mmedta)洗涤细胞沉淀物两次并储存在-80℃下直到制备膜。经由流式细胞术来证实gpcr-纳米抗体嵌合体的过表达(数据未示出)。
实施例22:通过比较放射性配体竞争测定来分析hmor1-nb融合体的药理特性
经由对膜(p2)的放射性配体测定来评估hmor1-34gs-nb33或hmor1-34gs-nb10在sf9细胞中的过表达,以证实天然mor1折叠和通过nb33的活性构象异构体(conformer)的稳定。为了制备膜,将1e7hmor1sf9细胞的等分试样再悬浮于1ml冰冷的包含蛋白酶抑制剂的裂解缓冲液(实施例4)。借助于小容积ultraturrax细胞混合器(ika),施加6个10秒脉冲,在冰上均化细胞悬液。在预冷却的离心机中在15000xg下离心细胞匀浆35分钟。丢弃上清液并将膜沉淀物再悬浮于75mmtrishclph7.4、1mmedta、5mmmgcl2、10%蔗糖,并储存在-80℃下直到进一步使用。利用bca蛋白测定试剂盒并按照制造商的说明来确定膜制剂的总蛋白质含量。
在放射性配体测定中通过测量[3h]-二丙诺啡([3h]-diprenorphine)拮抗剂放射性配体(perkinelmer,目录号net1121)的总(tb)和非特异性(ns)结合来证实作为纳米抗体融合体(hmor1-34gs-nb33和hmor1-34gs-nb10膜;p2,72小时温育)的重组mor1的过表达。
用对hmor1-34gs-nb33或hmor1-34gs-nb10膜(p2,72小时表达)的放射性配体竞争测定(mangliketal,2012)来评估重组mor1的药理特性。将在作为结合缓冲液的包含1%bsa的tbb(75mmtris-hclph7.4、1mmedta、5mmmgcl2、100mmnacl)中的15μg的hmor1-34gs-nb33或hmor1-34gs-nb10sf9膜转移到96孔板。随后,添加连续稀释的冷激动剂竞争剂(dmt1-dalda或kgop01)或拮抗剂(纳洛酮(naloxone))。在添加1nm[3h]-二丙诺啡(最终浓度)以后,在室温下温育反应混合物(125μl的总容积)1小时。用96孔filtermate收获器并借助于通过预浸在tbb(具有1%bsa)中的whatmangf/c过滤器,然后在冰冷的tbb中加以洗涤,来将膜结合的[3h]-二丙诺啡与未结合的放射性配体分离。在50℃下干燥过滤器1小时。在添加35μl闪烁液(microscinttm-o)以后,用wallacmicrobetatrilux闪烁计数器来测量保留在过滤器上的放射性(cpm)。计算残余的放射性配体结合的百分比并且典型实验的曲线示于图16。在曲线图中的每个值是3个数据点的平均值。通过非线性回归分析,借助于1位点–拟合对数ic50方程并利用prism(graphpadsoftware,sandiego,ca)来确定ic50值。针对所有测试的配体获得的ic50示于表x。对于hmor1-34gs-nb33和hmor1-34gs-nb10sf9膜,激动剂dmt-dalda的ic50分别是655和18。相比于对于hmor1-34gs-nb10膜获得的那些亲和力,对于测试的每种激动剂配体(dmt1-dalda或kgop01),对于hmor1-34gs-nb33膜,显示最高亲和力(最低ic50)。对于每种激动剂,ic50比率≥20(表7)表明,它们偏好活性状态限制的mor1受体。对于拮抗剂纳洛酮,ic50并不显著不同,不管是用hmor1-34gs-nb33还是用hmor1-34gs-nb10膜来确定。此数据支持,nb33融合体表达mor1作为活性构象异构体并相比于对于拮抗剂纳洛酮具有对于激动剂的更高的亲和力。
实施例23:利用对β2ar-nb融合体的比较放射性配体置换测定所进行的片段文库筛选
实施例6说明,相比于β2ar365n-nb69融合体,β2ar365n-nb80融合体的药理特性是根本上不同的:nb80融合体优先结合天然和合成激动剂,而它对于反向激动剂则显示较低亲和力。实施例12、16、19进一步说明特定gpcr-nb融合体的改进的药理特性。基于这方面知识,我们测试了,这些药理差异是否可以开发用于药物发现。作为实例,我们筛选了片段文库以确定以不同的亲和力结合于β2ar365n-nb80与β2ar365n-nb69的片段。
为了确定以不同的亲和力结合于β2ar365n-nb80与β2ar365n-nb69的片段,针对构象选择性片段,我们筛选了maybridgero3片段文库(包含分子量为80至300da的片段)的1000种片段。以200mm的浓度,将所有片段溶解于100%dmso。首先将1000种不同的maybridge片段稀释至在100%dmso中的20mm,接着在结合缓冲液(75mmtrisph7.5、12.5mmmgcl2、1mmedta、0.05%bsa)中将它们稀释40倍。在比较放射性配体竞争结合实验中,在1296孔板中,使表达β2ar365n-nb80融合体的sf9细胞(5μg总蛋白,在100μl结合缓冲液中)的膜与100μl的1000种稀释片段中的每种混合。并行地,在不同系列的96孔板中,使表达β2ar365n-nb69融合体的sf9细胞(5μg总蛋白,在100μl结合缓冲液中)的膜与100μl的相同的1000种稀释片段的每种混合。接着,将放射性配体[3h]-双氢烯丙洛尔(50μl,2nm最终浓度)加入每种样品(总共2000个样品)并在室温下在摇动的平台上(总反应体积/测定点是250μl)温育所有样品2小时。每种片段的最终筛选浓度是200μm。每个96孔板还包括用肾上腺素(1e-7m)和烯丙洛尔(1e-6m、1e-8m)(作为对照)温育的膜。收获膜并测量剩余[3h]-双氢烯丙洛尔放射性(如在实施例6中描述的)。基于大多数片段将不替换放射性配体,我们计算每个96孔板的计数/孔的平均数(排除对照)并使用这种平均值来标准化在上述板上的所有数据点(以%来表示)。这些标准化数据用来比较每种片段对于β2ar365n-nb80与β2ar365n-nb69的结合,其中通过针对β2ar365n-nb69获得的标准化值除以针对β2ar365n-nb80获得的标准化值。高于1的比率表明,片段对于β2ar365n-nb80是选择性的(具有较高亲和力)。低于1的比率表明,片段对于β2ar365n-nb69是选择性的。
为了测量这种测定的可重复性,再次重复测定对于β2ar365n-nb80最具选择性的44种片段、对于β2ar365n-nb69最具选择性的44种片段以及在类似程度上替换在β2ar365n-nb80和β2ar365n-nb69上的放射性配体的44种片段并利用三个独立测定的数据来再次排列(rank)。这种比较测定使得能够将β2ar片段命中(hit)类选(triage)为三种不同的功能模式:
·片段,相比于β2ar365n-nb69,其对于β2ar365n-nb80更具选择性,分别类似于天然和合成的β2ar激动剂肾上腺素和异丙基肾上腺素(激动剂曲线)。
·片段,在类似程度上,其替换在β2ar365n-nb80和β2ar365n-nb69上的放射性配体,类似于烯丙洛尔(拮抗剂曲线)
·片段,相比于β2ar365n-nb80,其对于β2ar365n-nb69更具选择性,类似于ici118551(反向激动剂曲线)。
作为代表性示例,6种片段的%[3h]-双氢烯丙洛尔结合示于图17,其表明,根据它们的效力,我们可以剖析不同的片段:由ac23506、cc56213表示的来自排名最靠前的12种具有激动剂曲线的片段的2种片段优先结合β2ar的活性构象,来自排名最高的具有反向激动剂曲线的片段的2种片段(km08985、aw00189)优先结合突出构象(反向激动剂曲线)以及以相同的亲和力,2种片段(cc46746、cc44914)结合两种构象(拮抗剂曲线)。明显地,排名前12位的命中的具有激动剂曲线的仅一种片段具有儿茶酚胺(catecholamine)结构,其是内源性和若干合成的β2ar激动剂特有的。
实施例24:通过比较放射性配体竞争测定来分析所选片段的活性谱
随后,通过比较对β2ar365n-nb80融合体与β2ar365n-nb69融合体的剂量反应曲线(如在实施例6中描述的)来证实所选18种片段命中的曲线,12种具有激动剂活性曲线,3种具有拮抗剂活性曲线以及3种具有反向激动剂活性曲线。简单地说,使表达不同的重组融合蛋白的sf9细胞的膜与18种片段命中的每种混合,浓度为在结合缓冲液中的4x10-7m至4x10-4m,将放射性配体[3h]-双氢烯丙洛尔加入每种混合物,然后在室温下在摇动的平台上温育样品2小时。分离受体结合的放射性配体和游离的放射性配体(如在实施例6中描述的)。数据表示重复进行三次的每个实验的平均值±sd(标准差(标准偏差,standarddeviation))。通过非线性回归分析并利用prism(graphpadsoftware,sandiego,ca)来产生曲线图。对于活性状态稳定β2ar365n-nb80融合体与β2ar365n-nb69融合体(受体的突出构象)的剂量反应曲线证实了在实施例23中选择的18种片段的活性曲线。出人意外地,属于激动剂曲线的12种确定的片段中的11种从来没有关联于具有激动剂活性的β2ar配体。(用于每种活性曲线(激动剂、拮抗剂、反向激动剂)的2种片段的剂量反应曲线的代表性实例示于图18a-18c)。片段ac23506、cc56213明显地以比β2ar365n-nb69融合体更高的亲和力结合活性状态稳定β2ar365n-nb80融合体(图18a)。对于片段km08985、aw00189,我们看到相反的情况(图18c),同时具有拮抗剂曲线的片段cc46746、cc44914以相同的亲和力结合两种构象(图18b)。
实施例25:通过比较放射性配体测定来分析制作的片段的药理特性
为了表明比较放射性配体测定可以指导具有激动曲线的片段的制作,基于它们的剂量反应曲线来选择片段cc56213以加以制作。随后,在比较放射性配体测定如(图19)中,测试多种化学变体(如在实施例6中描述的)。简单地说,使表达β2ar365n-nb80融合体或β2ar365n-nb69融合蛋白的sf9细胞的膜与每种制作的片段(被称为化合物8、9、10)混合以及与原始片段cc56213混合,浓度为在结合缓冲液中的10-9m至10-3m,将放射性配体[3h]-双氢烯丙洛尔加入每种混合物,然后在室温下在摇动的平台上温育样品2小时。分离受体结合的放射性配体和游离的放射性配体(如在实施例6中描述的)。数据表示重复进行三次的每个实验的平均值±sem(平均值的标准误差)。通过非线性回归分析并利用prism(graphpadsoftware,sandiego,ca)来产生曲线图。
相比于亲本片段(数据未示出),化合物8具有降低的亲和力,同时,相比于亲本片段cc56213,化合物9和10则具有增加的效力。通过计算对于每种β2ar构象异构体的ic50值,来说明制作的片段(化合物9、10)相对于母体化合物的改善的亲和力。相比于对照β2ar365n-nb69,β2ar365n-nb80嵌合体对于所阐述的化合物9、10和亲本片段cc56213的增加的亲和力可以计算自来自示于图19的竞争性结合实验的ic50值的比率,其中通过β2ar365n-nb69的ic50除以β2ar365n-nb80的ic50,其导致对于化合物9、10、cc56213分别为
实施例26:借助于adrb2camp生物传感器测定(hithunter-discoverx)来剖析(绘谱,profile)激动作用
为了测试具有‘激动剂曲线’的片段(在实施例23和24中描述的12种片段)是否能够诱导β2ar信号,在discoverx设施处在细胞测定中在2种浓度(2mm和100μm)下测试了来自实施例23的18种片段,其中测量g蛋白介导的β2ar激活。在hithunter测定中,dmso的%是≤1%,一种浓度,其被表明对于使用的β2ar细胞不是毒性的。作为对照,在测定中包括肾上腺素(1μm和50nm)和烯丙洛尔(0,1μm和5nm)。
表1.纳米抗体的列表
表2.所列纳米抗体的cdr
表3.对于活性状态限制β2ar的配体依赖性效力移动。数值表示指定非限制β2ar(作为与模拟nb69的融合体或作为非融合受体)的ic50与限制于活性状态的受体(nb80或nb71融合体)的ic50的比率
nd:未确定
表4.相比于m2δi3r,配体对于m2δi3r-nb9-1的ic50
表5.相比于β2ar-nb69,配体对于hβ1ar-nb80的ic50
表6.相比于β2ar-nb69,配体对于β2ar-nb60的ic50
表7.配体对于突出的(hmor1-34gs-nb10)和活性状态稳定(hmor1-34gs-nb33)mor1构象异构体的ic50和折叠偏好
参考文献
·binzetal.,naturebiotech.,22:575-582(2004)
·bokoch,m.p.,y.zou,s.g.rasmussen,c.w.liu,r.nygaard,d.m.rosenbaum,j.j.fung,h.j.choi,f.s.thian,t.s.kobilka,j.d.puglisi,w.i.weis,l.pardo,r.s.prosser,l.muellerandb.k.kobilka(2010)."ligand-specificregulationoftheextracellularsurfaceofag-protein-coupledreceptor."nature463(7277):108-112.
·caffrey(2003).membraneproteincrystallization.jstruct.biol.2003142:108-32.
·caffrey,m.&cherezov,v.crystallizingmembraneproteinsusinglipidicmesophases.natprotoc4,706-731,(2009).
·chasinetal.,1986,som.cellmolec.genet.,12:555-556.
·chelikanietalproteinsci.200615:1433-40
·chen,i.anda.y.ting(2005)."site-specificlabelingofproteinswithsmallmoleculesinlivecells."curropinbiotechnol16(1):35-40.
·cherezov,v.etal.high-resolutioncrystalstructureofanengineeredhumanbeta2-adrenergicgprotein-coupledreceptor.science318,1258-1265,doi:1150577[pii]10.1126/science.1150577(2007).
·christopoulos,a.(2002)."allostericbindingsitesoncell-surfacereceptors:noveltargetsfordrugdiscovery."natrevdrugdiscov1(3):198-210.
·chun,e.,a.a.thompson,w.liu,c.b.roth,m.t.griffith,v.katritch,j.kunken,f.xu,v.cherezov,m.a.hansonandr.c.stevens(2012)."fusionpartnertoolchestforthestabilizationandcrystallizationofgprotein-coupledreceptors."structure20(6):967-976.
·danley,d.e.(2006)."crystallizationtoobtainprotein-ligandcomplexesforstructure-aideddrugdesign."actacrystallogrdbiolcrystallogr62(pt6):569-575.
·dayp.w.,rasmussens.g.,parnotc.,fungj.j.,masooda.,kobilkat.s.,yaox.j.,choih.j.,weisw.i.androhrerd.k.etal.,amonoclonalantibodyforgprotein-coupledreceptorcrystallography,natmethods4(2007),pp.927–929.
·derewendaz.s.rationalproteincrystallizationbymutationalsurfaceengineering,structure(camb)12(2004),pp.529–535.
·desmytera,spinellis,payanf,lauwereysm,wynsl,muyldermanss,cambillauc.threecamelidvhhdomainsincomplexwithporcinepancreaticalpha-amylase.inhibitionandversatilityofbindingtopology.jbiolchem.2002jun28;277(26):23645-50.
·deverauxetal.1984,nucleicacidsresearch12,387-395
·dimitrovds.engineeredch2domains(nanoantibodies).mabs.2009jan-feb;1(1):26-8.
·erogluetalembo20023:491^96
·erogluetalproc.natl.acad.sci.2003100:10219-10224
·fahametalcrystallizationofbacteriorhodopsinfrombicelleformulationsatroomtemperature.proteinsci.200514:836-40.2005
·fahametal,bicellecrystallization:anewmethodforcrystallizingmembraneproteinsyieldsamonomericbacteriorhodopsinstructure.jmoibiol.2002feb8;316(1):1-6.
·foord,s.m.,t.i.bonner,etal.(2005)."internationalunionofpharmacology.xlvi.gprotein-coupledreceptorlist."pharmacologicalreviews57(2):279-288.
·fredriksson,r.,m.c.lagerstrom,etal.(2003)."theg-protein-coupledreceptorsinthehumangenomeformfivemainfamilies.phylogeneticanalysis,paralogongroups,andfingerprints."molecularpharmacology63(6):1256-1272.
·frühv,zhouy,chend,lochc,abe,grinkovayn,verheijh,sligarsg,bushwellerjh,siegalg.applicationoffragment-baseddrugdiscoverytomembraneproteins:identificationofligandsoftheintegralmembraneenzymedsbb.chembiol.2010aug27;17(8):881-91.
·galandrins,oligny-longprég,bouvierm.theevasivenatureofdrugefficacy:implicationsfordrugdiscovery.trendspharmacolsci.2007aug;28(8):423-30.
·gebauerm,skerraa.engineeredproteinscaffoldsasnext-generationantibodytherapeutics.curropinchembiol.2009jun;13(3):245-55.
·georgeetal.2002,natrevdrugdiscov1:808.
·gouaux,it'snotjustaphase:crystallizationandx-raystructuredeterminationofbacteriorhodopsininlipidiccubicphases.structure.19986:5-10;
·graniers,manglika,kruseac,kobilkats,thianfs,weiswi,kobilkabk.structureoftheδ-opioidreceptorboundtonaltrindole.nature.2012may16;485(7398):400-4.
·hagak,kruseac,asadah,yurugi-kobayashit,shiroishim,zhangc,weiswi,okadat,kobilkabk,hagat,kobayashit.structureofthehumanm2muscarinicacetylcholinereceptorboundtoanantagonist.nature.2012jan25;482(7386):547-51.
·hamers-casterman,c.,t.atarhouch,s.muyldermansetal.naturallyoccurringantibodiesdevoidoflightchains.nature363,446-448,doi:10.1038/363446a0(1993).
·hansonma,rothcb,joe,griffithmt,scottfl,reinhartg,desaleh,clemonsb,cahalansm,schuerersc,sannamg,hangw,kuhnp,rosenh,stevensrc.crystalstructureofalipidgprotein-coupledreceptor.science.2012feb17;335(6070):851-5.
·heilkeretal2009.drugdiscoverytoday14:231-240.
·huntec.andmichelh.,crystallisationofmembraneproteinsmediatedbyantibodyfragments,curropinstructbiol12(2002),pp.503–508.
·kahsai,a.w.,k.xiao,s.rajagopal,s.ahn,a.k.shukla,j.sun,t.g.oasandr.j.lefkowitz(2011)."multipleligand-specificconformationsofthebeta2-adrenergicreceptor."natchembiol7(10):692-700.
·kallwassetal,biotechnol.lett.,15(1),29-34,1993
·kenakin2002,trendspharmacolsci25:186.
·kenakintp(2009)cellularassaysasportalstoseven-transmembranereceptor-baseddrugdiscovery.naturereviewsdrugdiscovery8:617-626
·kobilka,b.k.aminoandcarboxylterminalmodificationstofacilitatetheproductionandpurificationofagprotein-coupledreceptor.analbiochem231,269-271(1995).
·koideetal,j.moibiol,284:1141-1151(1998)
·kolakowski,l.f.(1994)."gcrdb-ag-protein-coupledreceptordatabase."receptors&channels2(1):1-7.
·kolkekaretal.,1997,biochemistry,36:10901-10909.
·korotkovkv,pardone,steyaertj,holwg.crystalstructureofthen-terminaldomainofthesecretingspdfrometecdeterminedwiththeassistanceofananobody.structure.2009feb13;17(2):255-65.
·kruseac,huj,panac,arlowdh,rosenbaumdm,rosemonde,greenhf,liut,chaeps,drorro,shawde,weiswi,wessj,kobilkabk.structureanddynamicsofthem3muscarinicacetylcholinereceptor.nature.2012feb22;482(7386):552-6.
·kruseac,ringam,manglika,huj,huk,eitelk,hübnerh,pardone,valantc,sextonpm,christopoulosa,feldercc,gmeinerp,steyaertj,weiswi,garciakc,wessj,kobilkabk.activationandallostericmodulationofamuscarinicacetylcholinereceptor.nature.2013dec5;504(7478).
·
·landauetal,lipidiccubicphases:anovelconceptforthecrystallizationofmembraneproteins.proc.natl.acad.sci.199693:14532-5
·lawson,a.d.(2012)."antibody-enabledsmall-moleculedrugdiscovery."natrevdrugdiscov11(7):519-525.
·lebon,g.,k.bennett,a.jazayeriandc.g.tate(2011)."thermostabilisationofanagonist-boundconformationofthehumanadenosinea(2a)receptor."jmolbiol409(3):298-310.
·lebon,g.,t.warneandc.g.tate(2012)."agonist-boundstructuresofgprotein-coupledreceptors."curropinstructbiol22(4):482-490.
·leegm,craikcs(2009).trappingmovingtargetswithsmallmolecules.science.apr10;324(5924):213-5.
·lefranc,m.p.,c.pommie,etal.(2003)."imgtuniquenumberingforimmunoglobulinandtcellreceptorvariabledomainsandigsuperfamilyv-likedomains."developmentalandcomparativeimmunology27(1):55-77.
·liujj,horstr,katritchv,stevensrc,wüthrichk.biasedsignalingpathwaysinβ2-adrenergicreceptorcharacterizedby19f-nmr.science.2012mar2;335(6072):1106-10.
·lucaetalproc.natl.acad.sci.2003100:10706-l1
·manglika,kruseac,kobilkats,thianfs,mathiesenjm,sunaharark,pardol,weiswi,kobilkabk,graniers.crystalstructureoftheμ-opioidreceptorboundtoamorphinanantagonist.nature.2012mar21;485(7398):321-6.
·mansooretalproc.natl.acad.sci.2006103:3060-3065
·marcheseetal.genomics23:609-618,1994
·mary,s.,m.damian,m.louet,n.floquet,j.a.fehrentz,j.marie,j.martinezandj.l.baneres(2012)."ligandsandsignalingproteinsgoverntheconformationallandscapeexploredbyagprotein-coupledreceptor."procnatlacadsciusa109(21):8304-8309.
·mather,1982,annalsnyacad.sci.,383:44-68
·muralidharan,v.andt.w.muir(2006)."proteinligation:anenablingtechnologyforthebiophysicalanalysisofproteins."natmethods3(6):429-438.
·niuetal,biophysj.200589:1833-1840
·nollertetallipidiccubicphasesasmatricesformembraneproteincrystallizationmethods.200434:348-53
·nygren,p-a.(2008)alternativebindingproteins:affibodybindingproteinsdevelopedfromasmallthree-helixbundlescaffold.febsj.275,2668-2676.
·ostermeierc.,iwatas.,ludwigb.andmichelh.,fvfragment-mediatedcrystallizationofthemembraneproteinbacterialcytochromecoxidase,natstructbiol2(1995),pp.842–846.
·palczewski,k.etal.crystalstructureofrhodopsin:agprotein-coupledreceptor.science289,739-745(2000).
·popp,m.w.,j.m.antos,g.m.grotenbreg,e.spoonerandh.l.ploegh(2007)."sortagging:aversatilemethodforproteinlabeling."naturechemicalbiology3:707-708.
·probstetal.1992,dnacellbiol.199211:1-20
·rabuka,d.(2010)."chemoenzymaticmethodsforsite-specificproteinmodification."curropinchembiol14(6):790-796.
·rajagopal,s.,k.rajagopalandr.j.lefkowitz(2010)."teachingoldreceptorsnewtricks:biasingseven-transmembranereceptors."naturereviews.drugdiscovery9:373-386.
·rasmussensg,devreebt,zouy,kruseac,chungky,kobilkats,thianfs,chaeps,pardone,calinskid,mathiesenjm,shahst,lyonsja,caffreym,gellmansh,steyaertj,skiniotisg,weiswi,sunaharark,kobilkabk.crystalstructureoftheβ2adrenergicreceptor-gsproteincomplex.nature.2011ajul19;477(7366):549-55.
·rasmussen,s.g.,h.j.choi,j.j.fung,e.pardon,p.casarosa,p.s.chae,b.t.devree,d.m.rosenbaum,f.s.thian,t.s.kobilka,a.schnapp,i.konetzki,r.k.sunahara,s.h.gellman,a.pautsch,j.steyaert,w.i.weisandb.k.kobilka(2011b)."structureofananobody-stabilizedactivestateofthebeta(2)adrenoceptor."nature469(7329):175-180.
·rasmussen,s.g.f.,h.-j.choi,d.m.rosenbaum,t.s.kobilka,f.s.thian,p.c.edwards,m.burghammer,v.r.p.ratnala,r.sanishvili,r.f.fischetti,g.f.x.schertler,w.i.weisandb.k.kobilka(2007)."crystalstructureofthehumanbeta2adrenergicg-protein-coupledreceptor."nature450:383-387.
·reevesetal.2002,pnas,99:13419
·richrl,erreyj,marshallf,myszkadg.biacoreanalysiswithstabilizedg-protein-coupledreceptors.analbiochem.2011feb15;409(2):267-72.
·riechmannandmuyldermansj.immunol.methods2000;240:185-195.
·riosetal.2001,pharmacolther92:71
·rosenbaum,d.m.,v.cherezov,m.a.hanson,s.g.rasmussen,f.s.thian,t.s.kobilka,h.j.choi,x.j.yao,w.i.weis,r.c.stevensandb.k.kobilka(2007)."gpcrengineeringyieldshigh-resolutionstructuralinsightsintobeta2-adrenergicreceptorfunction."science318(5854):1266-1273.
·rosenbaum,d.m.etal.structureandfunctionofanirreversibleagonist-beta(2)adrenoceptorcomplex.nature469,236-240(2011).
·rosenbaumd.m.,s.g.rasmussen,andb.k.kobilka,nature459(7245),356(2009).
·rummeletal,lipidiccubicphases:newmatricesforthethree-dimensionalcrystallizationofmembraneproteins.j.struct.biol.1998121:82-91;
·serrano-vega,m.j.,f.magnani,y.shibataandc.g.tate(2008)."conformationalthermostabilizationofthebeta1-adrenergicreceptorinadetergent-resistantform."proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica105(3):877-882.
·shibata,y.,j.f.white,m.j.serrano-vega,f.magnani,a.l.aloia,r.grisshammerandc.g.tate(2009)."thermostabilizationoftheneurotensinreceptornts1."journalofmolecularbiology390(2):262-277.
·shimadaetalj.biol.chem.2002277:31774-80
·shimamurat,shiroishim,weyands,tsujimotoh,winterg,katritchv,abagyanr,cherezovv,liuw,hangw,kobayashit,stevensrc,iwatas.structureofthehumanhistamineh1receptorcomplexwithdoxepin.nature.2011jun22;475(7354):65-70.
·shoichet,b.k.andb.k.kobilka(2012)."structure-baseddrugscreeningforg-protein-coupledreceptors."trendspharmacolsci33(5):268-272.
·skerra,j.molecularrecognition,13:167-187(2000).
·starovasnikma,braistedac,wellsja.structuralmimicryofanativeproteinbyaminimizedbindingdomain.procnatlacadsciusa.1997sep16;94(19):10080-5.
·stausdp,winglerlm,strachanrt,rasmussensgf,pardone,ahns,etal.regulationofbeta-2-adrenergicreceptorfunctionbyconformationallyselectivesingle-domainintrabodies.molpharmacol.2013dec6.
·steyaertj,kobilkabk(2011).nanobodystabilizationofgprotein-coupledreceptorconformationalstates.curropinstructbiol.aug;21(4):567-72.
·tate,c.g.(2012)."acrystalclearsolutionfordeterminingg-protein-coupledreceptorstructures."trendsbiochemsci.
·urlaubandchasin,1980,proc.natl.acad.sci.usa,77:4216
·warne,t.,r.moukhametzianov,j.g.baker,r.nehmé,p.c.edwards,a.g.w.leslie,g.f.x.schertlerandc.g.tate(2011)."thestructuralbasisforagonistandpartialagonistactiononaβ1-adrenergicreceptor."nature469:241-244.
·wesolowskietal.(2009),med.microbiol.immunol.198:157
·white,j.f.,n.noinaj,y.shibata,j.love,b.kloss,f.xu,j.gvozdenovic-jeremic,p.shah,j.shiloach,c.g.tateandr.grisshammer(2012)."structureoftheagonist-boundneurotensinreceptor."nature490(7421):508-513.
·wuh,wackerd,milenim,katritchv,hangw,vardye,liuw,thompsonaa,huangxp,carrollfi,mascarellasw,westkaemperrb,mosierpd,rothbl,cherezovv,stevensrc.structureofthehumanκ-opioidreceptorincomplexwithjdtic.nature.2012mar21;485(7398):327-32.
·xu,f.,etal.(2011)."structureofanagonist-boundhumana2aadenosinereceptor."science332(6027):322-327.
·yao,x.,c.parnot,x.deupi,v.r.p.ratnala,g.swaminath,d.farrensandb.kobilka(2006)."couplingligandstructuretospecificconformationalswitchesinthebeta2-adrenoceptor."naturechemicalbiology2:417-422.
·zhangc,srinivasany,arlowdh,fungjj,palmerd,zhengy,greenhf,pandeya,drorro,shawde,weiswi,coughlinsr,kobilkabk.high-resolutioncrystalstructureofhumanprotease-activatedreceptor1.nature.2012dec20;492(7429):387-92.。
序列表
<110>弗拉芒区生物技术研究所(vibvzw)
布鲁塞尔自由大学(vrijeuniversiteitbrussel)
<120>用于筛选和药物发现目的的新型嵌合多肽
<130>js/fus/441
<150>us61/758,518
<151>2013-01-30
<150>ep13154552.7
<151>2013-02-08
<150>ep13187265.7
<151>2013-10-03
<160>64
<170>patentinversion3.5
<210>1
<211>531
<212>prt
<213>人工序列
<220>
<223>gpcr-纳米抗体融合体
<400>1
metlysthrileilealaleusertyrilephecysleuvalpheala
151015
asptyrlysaspaspaspaspalagluasnleutyrpheglnglyphe
202530
glyglnproglyasnglyseralapheleuleualaproasnargser
354045
hisalaproasphisaspvalthrglnglnargaspgluvaltrpval
505560
valglymetglyilevalmetserleuilevalleualailevalphe
65707580
glyasnvalleuvalilethralailealalysphegluargleugln
859095
thrvalthrasntyrpheilethrserleualacysalaaspleuval
100105110
metglyleualavalvalpropheglyalaalahisileleumetlys
115120125
mettrpthrpheglyasnphetrpcysgluphetrpthrserileasp
130135140
valleucysvalthralaserilegluthrleucysvalilealaval
145150155160
aspargtyrphealailethrserprophelystyrglnserleuleu
165170175
thrlysasnlysalaargvalileileleumetvaltrpilevalser
180185190
glyleuthrserpheleuproileglnmethistrptyrargalathr
195200205
hisglnglualaileasncystyralaglugluthrcyscysaspphe
210215220
phethrasnglnalatyralailealaserserilevalserphetyr
225230235240
valproleuvalilemetvalphevaltyrserargvalpheglnglu
245250255
alalysargglnleuglnlysileasplyssergluglyargphehis
260265270
valglnasnleuserglnvalgluglnaspglyargthrglyhisgly
275280285
leuargargserserlysphecysleulysgluhislysalaleulys
290295300
thrleuglyileilemetglythrphethrleucystrpleuprophe
305310315320
pheilevalasnilevalhisvalileglnaspasnleuilearglys
325330335
gluvaltyrileleuleuasntrpileglytyrvalasnserglyphe
340345350
asnproleuiletyrcysargserproasppheargilealaphegln
355360365
gluleuleucysleuargargserserleulysalatyrglyasngly
370375380
tyrserserasnglyasnthrglygluglnserglyglyglyglygly
385390395400
serglyglyglyserglnvalglnleuglngluserglyglyglyleu
405410415
valglnalaglyglyserleuargleusercysalaalaserglyser
420425430
ilepheserileasnthrmetglytrptyrargglnalaproglylys
435440445
glnarggluleuvalalaalailehisserglyglyserthrasntyr
450455460
alaasnservallysglyargphethrileserargaspasnalaala
465470475480
asnthrvaltyrleuglnmetasnserleulysprogluaspthrala
485490495
valtyrtyrcysasnvallysasptyrglyalavalleutyrglutyr
500505510
asptyrtrpglyglnglythrglnvalthrvalserserhishishis
515520525
hishishis
530
<210>2
<211>527
<212>prt
<213>人工序列
<220>
<223>gpcr-纳米抗体融合体
<400>2
metlysthrileilealaleusertyrilephecysleuvalpheala
151015
asptyrlysaspaspaspaspalagluasnleutyrpheglnglyphe
202530
glyglnproglyasnglyseralapheleuleualaproasnargser
354045
hisalaproasphisaspvalthrglnglnargaspgluvaltrpval
505560
valglymetglyilevalmetserleuilevalleualailevalphe
65707580
glyasnvalleuvalilethralailealalysphegluargleugln
859095
thrvalthrasntyrpheilethrserleualacysalaaspleuval
100105110
metglyleualavalvalpropheglyalaalahisileleumetlys
115120125
mettrpthrpheglyasnphetrpcysgluphetrpthrserileasp
130135140
valleucysvalthralaserilegluthrleucysvalilealaval
145150155160
aspargtyrphealailethrserprophelystyrglnserleuleu
165170175
thrlysasnlysalaargvalileileleumetvaltrpilevalser
180185190
glyleuthrserpheleuproileglnmethistrptyrargalathr
195200205
hisglnglualaileasncystyralaglugluthrcyscysaspphe
210215220
phethrasnglnalatyralailealaserserilevalserphetyr
225230235240
valproleuvalilemetvalphevaltyrserargvalpheglnglu
245250255
alalysargglnleuglnlysileasplyssergluglyargphehis
260265270
valglnasnleuserglnvalgluglnaspglyargthrglyhisgly
275280285
leuargargserserlysphecysleulysgluhislysalaleulys
290295300
thrleuglyileilemetglythrphethrleucystrpleuprophe
305310315320
pheilevalasnilevalhisvalileglnaspasnleuilearglys
325330335
gluvaltyrileleuleuasntrpileglytyrvalasnserglyphe
340345350
asnproleuiletyrcysargserproasppheargilealaphegln
355360365
gluleuleucysleuargargserserleulysalatyrglyasngly
370375380
tyrserserasnglyasnthrglygluglnserglyglyglyglygly
385390395400
serglyglyglyserglnvalglnleuglngluserglyglyglyleu
405410415
valglnproglyglyserleuargleusercysalaalaserglyphe
420425430
alaphesersertyrgluleuargtrptyrargglnalaproglylys
435440445
glnhisgluleuvalalaglyilethrthrglyglyasnthrtyrtyr
450455460
alaaspservallysglyargphethrileserargaspasnalalys
465470475480
asnthrvaltyrleuglnmetserasnleuargprogluaspthrala
485490495
valtyralacysasnalaasntrpaspleuleuserasptyrtrpgly
500505510
glnglythrglnvalthrvalserserhishishishishishis
515520525
<210>3
<211>535
<212>prt
<213>人工序列
<220>
<223>gpcr-纳米抗体融合体
<400>3
metlysthrileilealaleusertyrilephecysleuvalpheala
151015
asptyrlysaspaspaspaspalagluasnleutyrpheglnglyphe
202530
glyglnproglyasnglyseralapheleuleualaproasnargser
354045
hisalaproasphisaspvalthrglnglnargaspgluvaltrpval
505560
valglymetglyilevalmetserleuilevalleualailevalphe
65707580
glyasnvalleuvalilethralailealalysphegluargleugln
859095
thrvalthrasntyrpheilethrserleualacysalaaspleuval
100105110
metglyleualavalvalpropheglyalaalahisileleumetlys
115120125
mettrpthrpheglyasnphetrpcysgluphetrpthrserileasp
130135140
valleucysvalthralaserilegluthrleucysvalilealaval
145150155160
aspargtyrphealailethrserprophelystyrglnserleuleu
165170175
thrlysasnlysalaargvalileileleumetvaltrpilevalser
180185190
glyleuthrserpheleuproileglnmethistrptyrargalathr
195200205
hisglnglualaileasncystyralaglugluthrcyscysaspphe
210215220
phethrasnglnalatyralailealaserserilevalserphetyr
225230235240
valproleuvalilemetvalphevaltyrserargvalpheglnglu
245250255
alalysargglnleuglnlysileasplyssergluglyargphehis
260265270
valglnasnleuserglnvalgluglnaspglyargthrglyhisgly
275280285
leuargargserserlysphecysleulysgluhislysalaleulys
290295300
thrleuglyileilemetglythrphethrleucystrpleuprophe
305310315320
pheilevalasnilevalhisvalileglnaspasnleuilearglys
325330335
gluvaltyrileleuleuasntrpileglytyrvalasnserglyphe
340345350
asnproleuiletyrcysargserproasppheargilealaphegln
355360365
gluleuleucysleuargargserserleulysalatyrglyasngly
370375380
tyrserserasnglyasnthrglygluglnserglyglyglyglygly
385390395400
serglyglyglyserglnvalglnleuglngluserglyglyglyleu
405410415
valglnalaglyglyserleuargleusercysthralaserglyleu
420425430
thrleuserasntyralametglytrppheargglnalaproglylys
435440445
gluarggluphevalalaalaaspthrtrpasnglyasnthrtyrhis
450455460
glnaspservallysglyargphethrileserargaspasnalalys
465470475480
asnthrvaltyrleuglnmetasntyrleulysprogluaspthrala
485490495
valtyrtyrcysalaalaargglyserargargseralatyrtyrser
500505510
serserasptyrthrtyrargglyglnglythrglnvalthrvalser
515520525
serhishishishishishis
530535
<210>4
<211>530
<212>prt
<213>人工序列
<220>
<223>gpcr-纳米抗体融合体
<400>4
metlysthrileilealaleusertyrilephecysleuvalpheala
151015
asptyrlysaspaspaspaspalagluasnleutyrpheglnglyphe
202530
glyglnproglyasnglyseralapheleuleualaproasnargser
354045
hisalaproasphisaspvalthrglnglnargaspgluvaltrpval
505560
valglymetglyilevalmetserleuilevalleualailevalphe
65707580
glyasnvalleuvalilethralailealalysphegluargleugln
859095
thrvalthrasntyrpheilethrserleualacysalaaspleuval
100105110
metglyleualavalvalpropheglyalaalahisileleumetlys
115120125
mettrpthrpheglyasnphetrpcysgluphetrpthrserileasp
130135140
valleucysvalthralaserilegluthrleucysvalilealaval
145150155160
aspargtyrphealailethrserprophelystyrglnserleuleu
165170175
thrlysasnlysalaargvalileileleumetvaltrpilevalser
180185190
glyleuthrserpheleuproileglnmethistrptyrargalathr
195200205
hisglnglualaileasncystyralaglugluthrcyscysaspphe
210215220
phethrasnglnalatyralailealaserserilevalserphetyr
225230235240
valproleuvalilemetvalphevaltyrserargvalpheglnglu
245250255
alalysargglnleuglnlysileasplyssergluglyargphehis
260265270
valglnasnleuserglnvalgluglnaspglyargthrglyhisgly
275280285
leuargargserserlysphecysleulysgluhislysalaleulys
290295300
thrleuglyileilemetglythrphethrleucystrpleuprophe
305310315320
pheilevalasnilevalhisvalileglnaspasnleuilearglys
325330335
gluvaltyrileleuleuasntrpileglytyrvalasnserglyphe
340345350
asnproleuiletyrcysargserproasppheargilealaphegln
355360365
gluleuleucysleuargargserserleulysalatyrglyasngly
370375380
tyrserserasnglyasnthrglygluglnserglyglyglyglygly
385390395400
serglyglyglyserglnvalglnleuglngluserglyglyglyleu
405410415
valglnalaglyglyserleuargleusercysalaalaserglyser
420425430
ilepheserleuasnaspmetglytrptyrargglnalaproglylys
435440445
leuarggluleuvalalaalailethrserglyglyserthrlystyr
450455460
alaaspservallysglyargphethrileserargaspasnalalys
465470475480
asnthrvaltyrleuglnmetasnserleulysalagluaspthrala
485490495
valtyrtyrcysasnalalysvalalaglythrpheseriletyrasp
500505510
tyrtrpglyglnglythrglnvalthrvalserserhishishishis
515520525
hishis
530
<210>5
<211>356
<212>prt
<213>人工序列
<220>
<223>gpcr-纳米抗体融合体
<400>5
metlysthrileilealaleusertyrilephecysleuvalpheala
151015
asptyrlysaspaspaspaspgluasnleutyrpheglnglymetasp
202530
aspserthraspserseraspasnserleualaleuthrserprotyr
354045
lysthrphegluvalvalpheilevalleuvalalaglyserleuser
505560
leuvalthrileileglyasnileleuvalmetvalserilelysval
65707580
asnarghisleuglnthrvalasnasntyrpheleupheserleuala
859095
cysalaaspleuileileglyvalphesermetasnleutyrthrleu
100105110
tyrthrvalileglytyrtrpproleuglyprovalvalcysaspleu
115120125
trpleualaleuasptyrvalvalserasnalaservalmetasnleu
130135140
leuileileserpheaspargtyrphecysvalthrlysproleuthr
145150155160
tyrprovallysargthrthrlysmetalaglymetmetilealaala
165170175
alatrpvalleuserpheileleutrpalaproalaileleuphetrp
180185190
glnpheilevalglyvalargthrvalgluaspglyglucystyrile
195200205
glnphepheserasnalaalavalthrpheglythralailealaala
210215220
phetyrleuprovalileilemetthrvalleutyrtrphisileser
225230235240
argalaserlysserargilelyslysasplyslysgluprovalala
245250255
asnglnaspprovalserthrarglyslysproproproserargglu
260265270
lyslysvalthrargthrileleualaileleuleualapheileile
275280285
thrtrpalaprotyrasnvalmetvalleuileasnthrphecysala
290295300
procysileproasnthrvaltrpthrileglytyrtrpleucystyr
305310315320
ileasnserthrileasnproalacystyralaleucysasnalathr
325330335
phelyslysthrphelyshisleuleumetcyshistyrlysasnile
340345350
glyalathrarg
355
<210>6
<211>506
<212>prt
<213>人工序列
<220>
<223>gpcr-纳米抗体融合体
<400>6
metlysthrileilealaleusertyrilephecysleuvalpheala
151015
asptyrlysaspaspaspaspgluasnleutyrpheglnglymetasp
202530
aspserthraspserseraspasnserleualaleuthrserprotyr
354045
lysthrphegluvalvalpheilevalleuvalalaglyserleuser
505560
leuvalthrileileglyasnileleuvalmetvalserilelysval
65707580
asnarghisleuglnthrvalasnasntyrpheleupheserleuala
859095
cysalaaspleuileileglyvalphesermetasnleutyrthrleu
100105110
tyrthrvalileglytyrtrpproleuglyprovalvalcysaspleu
115120125
trpleualaleuasptyrvalvalserasnalaservalmetasnleu
130135140
leuileileserpheaspargtyrphecysvalthrlysproleuthr
145150155160
tyrprovallysargthrthrlysmetalaglymetmetilealaala
165170175
alatrpvalleuserpheileleutrpalaproalaileleuphetrp
180185190
glnpheilevalglyvalargthrvalgluaspglyglucystyrile
195200205
glnphepheserasnalaalavalthrpheglythralailealaala
210215220
phetyrleuprovalileilemetthrvalleutyrtrphisileser
225230235240
argalaserlysserargilelyslysasplyslysgluprovalala
245250255
asnglnaspprovalserthrarglyslysproproproserargglu
260265270
lyslysvalthrargthrileleualaileleuleualapheileile
275280285
thrtrpalaprotyrasnvalmetvalleuileasnthrphecysala
290295300
procysileproasnthrvaltrpthrileglytyrtrpleucystyr
305310315320
ileasnserthrileasnproalacystyralaleucysasnalathr
325330335
phelyslysthrphelyshisleuleumetcyshistyrlysasnile
340345350
glyalathrargglyglyglyserglyglyglyglyserglyglygly
355360365
glyserglyglyglyglyserglyglyglyserglnvalglnleugln
370375380
gluserglyglyglyleuvalglnalaglyglyserleuargleuser
385390395400
cysalaalaserglyhisthrpheserseralaargmettyrtrpval
405410415
argglnalaproglylysgluarggluphevalalaalaileserarg
420425430
serglyphethrtyrseralaaspservallysglyargphethrile
435440445
serargaspilealaasnasnthrvaltyrleuglnmetasnserleu
450455460
glnprogluaspthralailetyrthrcystyralaalatyrleuasp
465470475480
gluphetyrasnasptyrthrhistyrtrpglyleuglythrglnval
485490495
thrvalserserhishishishishishis
500505
<210>7
<211>488
<212>prt
<213>人工序列
<220>
<223>gpcr-纳米抗体融合体
<400>7
metlysthrileilealaleusertyrilephecysleuvalpheala
151015
asptyrlysaspaspaspaspalagluasnleutyrpheglnglypro
202530
gluproleuserglnglntrpthralaglymetglyleuleumetala
354045
leuilevalleuleuilevalalaglyasnvalleuvalilevalala
505560
ilealalysthrproargleuglnthrleuthrasnleupheilemet
65707580
serleualaseralaaspleuvalmetglyleuleuvalvalprophe
859095
glyalathrilevalvaltrpglyargtrpglutyrglyserphephe
100105110
cysgluleutrpthrservalaspvalleucysvalthralaserile
115120125
gluthrleucysvalilealaleuaspargtyrleualailethrser
130135140
propheargtyrglnserleuleuthrargalaargalaargglyleu
145150155160
valcysthrvaltrpalaileseralaleuvalserpheleuproile
165170175
leumethistrptrpargalagluseraspglualaargargcystyr
180185190
asnaspprolyscyscysaspphevalthrasnargalatyralaile
195200205
alaserservalvalserphetyrvalproleucysilemetalaphe
210215220
valtyrleuargvalpheargglualaglnlysglnvallyslysile
225230235240
aspargalaglylysargargproserargleuvalalaleulysglu
245250255
glnlysalaleulysthrleuglyileilemetglyvalphethrleu
260265270
cystrpleuprophepheleualaasnvalvallysalaphehisarg
275280285
gluleuvalproaspargleuphevalphepheasntrpleuglytyr
290295300
alaasnseralapheasnproileiletyrcysargserproaspphe
305310315320
arglysalapheglnargleuleuserseralaargargalaalaarg
325330335
argargglyglyglyglyserglyglyglyglyserglyglyglygly
340345350
serglyglyglyglyserglyglyglyserglnvalglnleuglnglu
355360365
serglyglyglyleuvalglnalaglyglyserleuargleusercys
370375380
alaalaserglyserilepheserileasnthrmetglytrptyrarg
385390395400
glnalaproglylysglnarggluleuvalalaalailehissergly
405410415
glyserthrasntyralaasnservallysglyargphethrileser
420425430
argaspasnalaalaasnthrvaltyrleuglnmetasnserleulys
435440445
progluaspthralavaltyrtyrcysasnvallysasptyrglyala
450455460
valleutyrglutyrasptyrtrpglyglnglythrglnvalthrval
465470475480
serserhishishishishishis
485
<210>8
<211>492
<212>prt
<213>人工序列
<220>
<223>gpcr-纳米抗体融合体
<400>8
metlysthrileilealaleusertyrilephecysleuvalpheala
151015
asptyrlysaspaspaspaspalagluasnleutyrpheglnglypro
202530
gluproleuserglnglntrpthralaglymetglyleuleumetala
354045
leuilevalleuleuilevalalaglyasnvalleuvalilevalala
505560
ilealalysthrproargleuglnthrleuthrasnleupheilemet
65707580
serleualaseralaaspleuvalmetglyleuleuvalvalprophe
859095
glyalathrilevalvaltrpglyargtrpglutyrglyserphephe
100105110
cysgluleutrpthrservalaspvalleucysvalthralaserile
115120125
gluthrleucysvalilealaleuaspargtyrleualailethrser
130135140
propheargtyrglnserleuleuthrargalaargalaargglyleu
145150155160
valcysthrvaltrpalaileseralaleuvalserpheleuproile
165170175
leumethistrptrpargalagluseraspglualaargargcystyr
180185190
asnaspprolyscyscysaspphevalthrasnargalatyralaile
195200205
alaserservalvalserphetyrvalproleucysilemetalaphe
210215220
valtyrleuargvalpheargglualaglnlysglnvallyslysile
225230235240
aspargalaglylysargargproserargleuvalalaleulysglu
245250255
glnlysalaleulysthrleuglyileilemetglyvalphethrleu
260265270
cystrpleuprophepheleualaasnvalvallysalaphehisarg
275280285
gluleuvalproaspargleuphevalphepheasntrpleuglytyr
290295300
alaasnseralapheasnproileiletyrcysargserproaspphe
305310315320
arglysalapheglnargleuleuserseralaargargalaalaarg
325330335
argargglyglyglyglyserglyglyglyglyserglyglyglygly
340345350
serglyglyglyglyserglyglyglyserglnvalglnleuglnglu
355360365
serglyglyglyleuvalglnalaglyglyserleuargleusercys
370375380
thralaserglyleuthrleuserasntyralametglytrpphearg
385390395400
glnalaproglylysgluarggluphevalalaalaaspthrtrpasn
405410415
glyasnthrtyrhisglnaspservallysglyargphethrileser
420425430
argaspasnalalysasnthrvaltyrleuglnmetasntyrleulys
435440445
progluaspthralavaltyrtyrcysalaalaargglyserargarg
450455460
seralatyrtyrserserserasptyrthrtyrargglyglnglythr
465470475480
glnvalthrvalserserhishishishishishis
485490
<210>9
<211>550
<212>prt
<213>人工序列
<220>
<223>gpcr-纳米抗体融合体
<400>9
metlysthrileilealaleusertyrilephecysleuvalpheala
151015
asptyrlysaspaspaspaspalametalaprothrasnalaserasn
202530
cysthraspalaleualatyrsersercysserproalaproserpro
354045
glysertrpvalasnleuserhisleuaspglyasnleuserasppro
505560
cysglyproasnargthraspleuglyglyargaspserleucyspro
65707580
prothrglyserprosermetilethralailethrilemetalaleu
859095
tyrserilevalcysvalvalglyleupheglyasnpheleuvalmet
100105110
tyrvalilevalargtyrthrlysmetlysthralathrasniletyr
115120125
ilepheasnleualaleualaaspalaleualathrserthrleupro
130135140
pheglnservalasntyrleumetglythrtrppropheglythrile
145150155160
leucyslysilevalileserileasptyrtyrasnmetphethrser
165170175
ilephethrleucysthrmetservalaspargtyrilealavalcys
180185190
hisprovallysalaleuasppheargthrproargasnalalysile
195200205
ileasnvalcysasntrpileleuserseralaileglyleuproval
210215220
metphemetalathrthrlystyrargglnglyserileaspcysthr
225230235240
leuthrpheserhisprothrtrptyrtrpgluasnleuleulysile
245250255
cysvalpheilephealapheilemetprovalleuileilethrval
260265270
cystyrglyleumetileleuargleulysservalargmetleuser
275280285
glyserlysglulysaspargasnleuargargilethrargmetval
290295300
leuvalvalvalalavalpheilevalcystrpthrproilehisile
305310315320
tyrvalileilelysalaleuvalthrileprogluthrthrphegln
325330335
thrvalsertrphisphecysilealaleuglytyrthrasnsercys
340345350
leuasnprovalleutyralapheleuaspgluasnphelysargcys
355360365
phearggluphecysileprothrserserasnileleugluvalleu
370375380
pheglnglyproglyglyglyglyserglyglyglyglyserglygly
385390395400
glyglyserglyglyglyglyserglyglyglyglyserglyglygly
405410415
glyserglyglyglyserglnvalglnleuglngluserglyglygly
420425430
leuvalargproglyglyserargargleusercysvalaspserglu
435440445
argthrsertyrprometglytrppheargargalaproglylysglu
450455460
arggluphevalalaserilethrtrpserglyileaspprothrtyr
465470475480
alaaspservalalaaspargphethrileserargaspvalalaasn
485490495
asnthrleutyrleuglnmetasnserleulyshisgluaspthrala
500505510
valtyrtyrcysalaalaargalaprovalglyglnserserserpro
515520525
tyrasptyrasptyrtrpglyglnglythrglnvalthrvalserser
530535540
hishishishishishis
545550
<210>10
<211>555
<212>prt
<213>人工序列
<220>
<223>gpcr-纳米抗体融合体
<400>10
metlysthrileilealaleusertyrilephecysleuvalpheala
151015
asptyrlysaspaspaspaspalametalaprothrasnalaserasn
202530
cysthraspalaleualatyrsersercysserproalaproserpro
354045
glysertrpvalasnleuserhisleuaspglyasnleuserasppro
505560
cysglyproasnargthraspleuglyglyargaspserleucyspro
65707580
prothrglyserprosermetilethralailethrilemetalaleu
859095
tyrserilevalcysvalvalglyleupheglyasnpheleuvalmet
100105110
tyrvalilevalargtyrthrlysmetlysthralathrasniletyr
115120125
ilepheasnleualaleualaaspalaleualathrserthrleupro
130135140
pheglnservalasntyrleumetglythrtrppropheglythrile
145150155160
leucyslysilevalileserileasptyrtyrasnmetphethrser
165170175
ilephethrleucysthrmetservalaspargtyrilealavalcys
180185190
hisprovallysalaleuasppheargthrproargasnalalysile
195200205
ileasnvalcysasntrpileleuserseralaileglyleuproval
210215220
metphemetalathrthrlystyrargglnglyserileaspcysthr
225230235240
leuthrpheserhisprothrtrptyrtrpgluasnleuleulysile
245250255
cysvalpheilephealapheilemetprovalleuileilethrval
260265270
cystyrglyleumetileleuargleulysservalargmetleuser
275280285
glyserlysglulysaspargasnleuargargilethrargmetval
290295300
leuvalvalvalalavalpheilevalcystrpthrproilehisile
305310315320
tyrvalileilelysalaleuvalthrileprogluthrthrphegln
325330335
thrvalsertrphisphecysilealaleuglytyrthrasnsercys
340345350
leuasnprovalleutyralapheleuaspgluasnphelysargcys
355360365
phearggluphecysileprothrserserasnileleugluvalleu
370375380
pheglnglyproglyglyglyglyserglyglyglyglyserglygly
385390395400
glyglyserglyglyglyglyserglyglyglyglyserglyglygly
405410415
glyserglyglyglyserglnvalglnleuglngluserglyglygly
420425430
leuvalglnproglyglyserleuargleusercysalaalasergly
435440445
serpheargserilevalsermetalatrptyrargglnalaprogly
450455460
lysglnarggluleuvalalaserserasnserglyglyserthrasn
465470475480
tyralaaspservallysglyargphethrileserargaspasnala
485490495
lysasnthrvaltyrleuglnmetasnserleulysprogluaspthr
500505510
alavaltyrtrpcysasnvalglnasnargleuproglypheaspala
515520525
pheserglyargserilealagluthrtyrtrpglyglnglythrgln
530535540
valthrvalserserhishishishishishis
545550555
<210>11
<211>548
<212>prt
<213>人工序列
<220>
<223>gpcr-纳米抗体融合体
<400>11
metlysthrileilealaleusertyrilephecysleuvalpheala
151015
asptyrlysaspaspaspaspalametglyproglyasnileserasp
202530
cysseraspproleualaproalasercysserproalaproglyser
354045
trpleuasnleuserhisvalaspglyasnglnseraspprocysgly
505560
proasnargthrglyleuglyglyserhisserleucysproglnthr
65707580
glyserprosermetvalthralailethrilemetalaleutyrser
859095
ilevalcysvalvalglyleupheglyasnpheleuvalmettyrval
100105110
ilevalargtyrthrlysmetlysthralathrasniletyrilephe
115120125
asnleualaleualaaspalaleualathrserthrleuprophegln
130135140
servalasntyrleumetglythrtrppropheglyasnileleucys
145150155160
lysilevalileserileasptyrtyrasnmetphethrserilephe
165170175
thrleucysthrmetservalaspargtyrilealavalcyshispro
180185190
vallysalaleuasppheargthrproargasnalalysilevalasn
195200205
valcysasntrpileleuserseralaileglyleuprovalmetphe
210215220
metalathrthrlystyrargglnglyserileaspcysthrleuthr
225230235240
pheserhisprothrtrptyrtrpgluasnleuleulysilecysval
245250255
pheilephealapheilemetprovalleuileilethrvalcystyr
260265270
glyleumetileleuargleulysservalargmetleuserglyser
275280285
lysglulysaspargasnleuargargilethrargmetvalleuval
290295300
valvalalavalpheilevalcystrpthrproilehisiletyrval
305310315320
ileilelysalaleuilethrileprogluthrthrpheglnthrval
325330335
sertrphisphecysilealaleuglytyrthrasnsercysleuasn
340345350
provalleutyralapheleuaspgluasnphelysargcysphearg
355360365
gluphecysileprothrserserthrileleugluvalleuphegln
370375380
glyproglyglyglyglyserglyglyglyglyserglyglyglygly
385390395400
serglyglyglyglyserglyglyglyglyserglyglyglyglyser
405410415
glyglyglyserglnvalglnleuglngluserglyglyglyleuval
420425430
argproglyglyserargargleusercysvalaspsergluargthr
435440445
sertyrprometglytrppheargargalaproglylysgluargglu
450455460
phevalalaserilethrtrpserglyileaspprothrtyralaasp
465470475480
servalalaaspargphethrileserargaspvalalaasnasnthr
485490495
leutyrleuglnmetasnserleulyshisgluaspthralavaltyr
500505510
tyrcysalaalaargalaprovalglyglnserserserprotyrasp
515520525
tyrasptyrtrpglyglnglythrglnvalthrvalserserhishis
530535540
hishishishis
545
<210>12
<211>553
<212>prt
<213>人工序列
<220>
<223>gpcr-纳米抗体融合体
<400>12
metlysthrileilealaleusertyrilephecysleuvalpheala
151015
asptyrlysaspaspaspaspalametglyproglyasnileserasp
202530
cysseraspproleualaproalasercysserproalaproglyser
354045
trpleuasnleuserhisvalaspglyasnglnseraspprocysgly
505560
proasnargthrglyleuglyglyserhisserleucysproglnthr
65707580
glyserprosermetvalthralailethrilemetalaleutyrser
859095
ilevalcysvalvalglyleupheglyasnpheleuvalmettyrval
100105110
ilevalargtyrthrlysmetlysthralathrasniletyrilephe
115120125
asnleualaleualaaspalaleualathrserthrleuprophegln
130135140
servalasntyrleumetglythrtrppropheglyasnileleucys
145150155160
lysilevalileserileasptyrtyrasnmetphethrserilephe
165170175
thrleucysthrmetservalaspargtyrilealavalcyshispro
180185190
vallysalaleuasppheargthrproargasnalalysilevalasn
195200205
valcysasntrpileleuserseralaileglyleuprovalmetphe
210215220
metalathrthrlystyrargglnglyserileaspcysthrleuthr
225230235240
pheserhisprothrtrptyrtrpgluasnleuleulysilecysval
245250255
pheilephealapheilemetprovalleuileilethrvalcystyr
260265270
glyleumetileleuargleulysservalargmetleuserglyser
275280285
lysglulysaspargasnleuargargilethrargmetvalleuval
290295300
valvalalavalpheilevalcystrpthrproilehisiletyrval
305310315320
ileilelysalaleuilethrileprogluthrthrpheglnthrval
325330335
sertrphisphecysilealaleuglytyrthrasnsercysleuasn
340345350
provalleutyralapheleuaspgluasnphelysargcysphearg
355360365
gluphecysileprothrserserthrileleugluvalleuphegln
370375380
glyproglyglyglyglyserglyglyglyglyserglyglyglygly
385390395400
serglyglyglyglyserglyglyglyglyserglyglyglyglyser
405410415
glyglyglyserglnvalglnleuglngluserglyglyglyleuval
420425430
glnproglyglyserleuargleusercysalaalaserglyserphe
435440445
argserilevalsermetalatrptyrargglnalaproglylysgln
450455460
arggluleuvalalaserserasnserglyglyserthrasntyrala
465470475480
aspservallysglyargphethrileserargaspasnalalysasn
485490495
thrvaltyrleuglnmetasnserleulysprogluaspthralaval
500505510
tyrtrpcysasnvalglnasnargleuproglypheaspalapheser
515520525
glyargserilealagluthrtyrtrpglyglnglythrglnvalthr
530535540
valserserhishishishishishis
545550
<210>13
<211>120
<212>prt
<213>人工序列
<220>
<223>nb80
<400>13
glnvalglnleuglngluserglyglyglyleuvalglnalaglygly
151015
serleuargleusercysalaalaserglyserilepheserileasn
202530
thrmetglytrptyrargglnalaproglylysglnarggluleuval
354045
alaalailehisserglyglyserthrasntyralaasnservallys
505560
glyargphethrileserargaspasnalaalaasnthrvaltyrleu
65707580
glnmetasnserleulysprogluaspthralavaltyrtyrcysasn
859095
vallysasptyrglyalavalleutyrglutyrasptyrtrpglygln
100105110
glythrglnvalthrvalserser
115120
<210>14
<211>116
<212>prt
<213>人工序列
<220>
<223>nb71
<400>14
glnvalglnleuglngluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphealaphesersertyr
202530
gluleuargtrptyrargglnalaproglylysglnhisgluleuval
354045
alaglyilethrthrglyglyasnthrtyrtyralaaspservallys
505560
glyargphethrileserargaspasnalalysasnthrvaltyrleu
65707580
glnmetserasnleuargprogluaspthralavaltyralacysasn
859095
alaasntrpaspleuleuserasptyrtrpglyglnglythrglnval
100105110
thrvalserser
115
<210>15
<211>124
<212>prt
<213>人工序列
<220>
<223>nb69
<400>15
glnvalglnleuglngluserglyglyglyleuvalglnalaglygly
151015
serleuargleusercysthralaserglyleuthrleuserasntyr
202530
alametglytrppheargglnalaproglylysgluargglupheval
354045
alaalaaspthrtrpasnglyasnthrtyrhisglnaspservallys
505560
glyargphethrileserargaspasnalalysasnthrvaltyrleu
65707580
glnmetasntyrleulysprogluaspthralavaltyrtyrcysala
859095
alaargglyserargargseralatyrtyrserserserasptyrthr
100105110
tyrargglyglnglythrglnvalthrvalserser
115120
<210>16
<211>121
<212>prt
<213>人工序列
<220>
<223>nb9-1
<400>16
glnvalglnleuglngluserglyglyglyleuvalglnalaglygly
151015
serleuargleusercysalaalaserglyhisthrpheserserala
202530
argmettyrtrpvalargglnalaproglylysgluargglupheval
354045
alaalaileserargserglyphethrtyrseralaaspservallys
505560
glyargphethrileserargaspilealaasnasnthrvaltyrleu
65707580
glnmetasnserleuglnprogluaspthralailetyrthrcystyr
859095
alaalatyrleuaspgluphetyrasnasptyrthrhistyrtrpgly
100105110
leuglythrglnvalthrvalserser
115120
<210>17
<211>121
<212>prt
<213>人工序列
<220>
<223>nb9-8
<400>17
glnvalglnleuglngluserglyglyglyleuvalglnalaglyasp
151015
serleuargleusercysalaalaserglypheasppheaspasnphe
202530
aspasptyralaileglytrppheargglnalaproglyglngluarg
354045
gluglyvalsercysileaspproseraspglyserthriletyrala
505560
aspseralalysglyargphethrileserseraspasnalagluasn
65707580
thrvaltyrleuglnmetasnserleulysprogluaspthralaval
859095
tyrvalcysseralatrpthrleuphehisseraspglutyrtrpgly
100105110
glnglythrglnvalthrvalserser
115120
<210>18
<211>119
<212>prt
<213>人工序列
<220>
<223>nb60
<400>18
glnvalglnleuglngluserglyglyglyleuvalglnalaglygly
151015
serleuargleusercysalaalaserglyserilepheserleuasn
202530
aspmetglytrptyrargglnalaproglylysleuarggluleuval
354045
alaalailethrserglyglyserthrlystyralaaspservallys
505560
glyargphethrileserargaspasnalalysasnthrvaltyrleu
65707580
glnmetasnserleulysalagluaspthralavaltyrtyrcysasn
859095
alalysvalalaglythrpheseriletyrasptyrtrpglyglngly
100105110
thrglnvalthrvalserser
115
<210>19
<211>122
<212>prt
<213>人工序列
<220>
<223>nb33
<400>19
glnvalglnleuglngluserglyglyglyleuvalargproglygly
151015
serargargleusercysvalaspsergluargthrsertyrpromet
202530
glytrppheargargalaproglylysgluarggluphevalalaser
354045
ilethrtrpserglyileaspprothrtyralaaspservalalaasp
505560
argphethrileserargaspvalalaasnasnthrleutyrleugln
65707580
metasnserleulyshisgluaspthralavaltyrtyrcysalaala
859095
argalaprovalglyglnserserserprotyrasptyrasptyrtrp
100105110
glyglnglythrglnvalthrvalserser
115120
<210>20
<211>127
<212>prt
<213>人工序列
<220>
<223>nb10
<400>20
glnvalglnleuglngluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyserpheargserileval
202530
sermetalatrptyrargglnalaproglylysglnarggluleuval
354045
alaserserasnserglyglyserthrasntyralaaspservallys
505560
glyargphethrileserargaspasnalalysasnthrvaltyrleu
65707580
glnmetasnserleulysprogluaspthralavaltyrtrpcysasn
859095
valglnasnargleuproglypheaspalapheserglyargserile
100105110
alagluthrtyrtrpglyglnglythrglnvalthrvalserser
115120125
<210>21
<211>8
<212>prt
<213>人工序列
<220>
<223>cdr1nb80
<400>21
glyserilepheserileasnthr
15
<210>22
<211>8
<212>prt
<213>人工序列
<220>
<223>cdr1nb71
<400>22
glyphealaphesersertyrglu
15
<210>23
<211>8
<212>prt
<213>人工序列
<220>
<223>cdr1nb69
<400>23
glyleuthrleuserasntyrala
15
<210>24
<211>8
<212>prt
<213>人工序列
<220>
<223>cdr1nb9-1
<400>24
glyhisthrpheserseralaarg
15
<210>25
<211>11
<212>prt
<213>人工序列
<220>
<223>cdr1nb9-8
<400>25
glypheasppheaspasnpheaspasptyrala
1510
<210>26
<211>8
<212>prt
<213>人工序列
<220>
<223>cdr1nb60
<400>26
glyserilepheserleuasnasp
15
<210>27
<211>6
<212>prt
<213>人工序列
<220>
<223>cdr1nb33
<400>27
gluargthrsertyrpro
15
<210>28
<211>8
<212>prt
<213>人工序列
<220>
<223>cdr1nb10
<400>28
glyserpheargserilevalser
15
<210>29
<211>7
<212>prt
<213>人工序列
<220>
<223>cdr2nb80
<400>29
ilehisserglyglyserthr
15
<210>30
<211>7
<212>prt
<213>人工序列
<220>
<223>cdr2nb71
<400>30
ilethrthrglyglyasnthr
15
<210>31
<211>7
<212>prt
<213>人工序列
<220>
<223>cdr2nb69
<400>31
aspthrtrpasnglyasnthr
15
<210>32
<211>7
<212>prt
<213>人工序列
<220>
<223>cdr2nb9-1
<400>32
ileserargserglyphethr
15
<210>33
<211>8
<212>prt
<213>人工序列
<220>
<223>cdr2nb9-8
<400>33
ileaspproseraspglyserthr
15
<210>34
<211>7
<212>prt
<213>人工序列
<220>
<223>cdr2nb60
<400>34
ilethrserglyglyserthr
15
<210>35
<211>8
<212>prt
<213>人工序列
<220>
<223>cdr2nb33
<400>35
ilethrtrpserglyileasppro
15
<210>36
<211>7
<212>prt
<213>人工序列
<220>
<223>cdr2nb10
<400>36
serasnserglyglyserthr
15
<210>37
<211>14
<212>prt
<213>人工序列
<220>
<223>cdr3nb80
<400>37
asnvallysasptyrglyalavalleutyrglutyrasptyr
1510
<210>38
<211>10
<212>prt
<213>人工序列
<220>
<223>cdr3nb71
<400>38
asnalaasntrpaspleuleuserasptyr
1510
<210>39
<211>18
<212>prt
<213>人工序列
<220>
<223>cdr3nb69
<400>39
alaalaargglyserargargseralatyrtyrserserserasptyr
151015
thrtyr
<210>40
<211>15
<212>prt
<213>人工序列
<220>
<223>cdr3nb9-1
<400>40
tyralaalatyrleuaspgluphetyrasnasptyrthrhistyr
151015
<210>41
<211>11
<212>prt
<213>人工序列
<220>
<223>cdr3nb9-8
<400>41
seralatrpthrleuphehisseraspglutyr
1510
<210>42
<211>13
<212>prt
<213>人工序列
<220>
<223>cdr3nb60
<400>42
asnalalysvalalaglythrpheseriletyrasptyr
1510
<210>43
<211>17
<212>prt
<213>人工序列
<220>
<223>cdr3nb33
<400>43
alaalaargalaprovalglyglnserserserprotyrasptyrasp
151015
tyr
<210>44
<211>21
<212>prt
<213>人工序列
<220>
<223>cdr3nb10
<400>44
asnvalglnasnargleuproglypheaspalapheserglyargser
151015
ilealagluthrtyr
20
<210>45
<211>398
<212>prt
<213>小家鼠(musmusculus)
<400>45
metaspserseralaglyproglyasnileseraspcysserasppro
151015
leualaproalasercysserproalaproglysertrpleuasnleu
202530
serhisvalaspglyasnglnseraspprocysglyproasnargthr
354045
glyleuglyglyserhisserleucysproglnthrglyserproser
505560
metvalthralailethrilemetalaleutyrserilevalcysval
65707580
valglyleupheglyasnpheleuvalmettyrvalilevalargtyr
859095
thrlysmetlysthralathrasniletyrilepheasnleualaleu
100105110
alaaspalaleualathrserthrleupropheglnservalasntyr
115120125
leumetglythrtrppropheglyasnileleucyslysilevalile
130135140
serileasptyrtyrasnmetphethrserilephethrleucysthr
145150155160
metservalaspargtyrilealavalcyshisprovallysalaleu
165170175
asppheargthrproargasnalalysilevalasnvalcysasntrp
180185190
ileleuserseralaileglyleuprovalmetphemetalathrthr
195200205
lystyrargglnglyserileaspcysthrleuthrpheserhispro
210215220
thrtrptyrtrpgluasnleuleulysilecysvalpheilepheala
225230235240
pheilemetprovalleuileilethrvalcystyrglyleumetile
245250255
leuargleulysservalargmetleuserglyserlysglulysasp
260265270
argasnleuargargilethrargmetvalleuvalvalvalalaval
275280285
pheilevalcystrpthrproilehisiletyrvalileilelysala
290295300
leuilethrileprogluthrthrpheglnthrvalsertrphisphe
305310315320
cysilealaleuglytyrthrasnsercysleuasnprovalleutyr
325330335
alapheleuaspgluasnphelysargcysphearggluphecysile
340345350
prothrserserthrilegluglnglnasnseralaargilearggln
355360365
asnthrarggluhisproserthralaasnthrvalaspargthrasn
370375380
hisglnleugluasnleuglualagluthralaproleupro
385390395
<210>46
<211>400
<212>prt
<213>智人
<400>46
metaspserseralaalaprothrasnalaserasncysthraspala
151015
leualatyrsersercysserproalaproserproglysertrpval
202530
asnleuserhisleuaspglyasnleuseraspprocysglyproasn
354045
argthraspleuglyglyargaspserleucysproprothrglyser
505560
prosermetilethralailethrilemetalaleutyrserileval
65707580
cysvalvalglyleupheglyasnpheleuvalmettyrvalileval
859095
argtyrthrlysmetlysthralathrasniletyrilepheasnleu
100105110
alaleualaaspalaleualathrserthrleupropheglnserval
115120125
asntyrleumetglythrtrppropheglythrileleucyslysile
130135140
valileserileasptyrtyrasnmetphethrserilephethrleu
145150155160
cysthrmetservalaspargtyrilealavalcyshisprovallys
165170175
alaleuasppheargthrproargasnalalysileileasnvalcys
180185190
asntrpileleuserseralaileglyleuprovalmetphemetala
195200205
thrthrlystyrargglnglyserileaspcysthrleuthrpheser
210215220
hisprothrtrptyrtrpgluasnleuleulysilecysvalpheile
225230235240
phealapheilemetprovalleuileilethrvalcystyrglyleu
245250255
metileleuargleulysservalargmetleuserglyserlysglu
260265270
lysaspargasnleuargargilethrargmetvalleuvalvalval
275280285
alavalpheilevalcystrpthrproilehisiletyrvalileile
290295300
lysalaleuvalthrileprogluthrthrpheglnthrvalsertrp
305310315320
hisphecysilealaleuglytyrthrasnsercysleuasnproval
325330335
leutyralapheleuaspgluasnphelysargcysphearggluphe
340345350
cysileprothrserserasnilegluglnglnasnserthrargile
355360365
argglnasnthrargasphisproserthralaasnthrvalasparg
370375380
thrasnhisglnleugluasnleuglualagluthralaproleupro
385390395400
<210>47
<211>4
<212>prt
<213>人工序列
<220>
<223>因子xa切割位点
<400>47
ilegluglyarg
1
<210>48
<211>4
<212>prt
<213>人工序列
<220>
<223>凝血酶切割位点
<400>48
leuvalproarg
1
<210>49
<211>5
<212>prt
<213>人工序列
<220>
<223>肠激酶切割位点
<400>49
aspaspaspasplys
15
<210>50
<211>8
<212>prt
<213>人工序列
<220>
<223>prescission(或3c)切割位点
<400>50
leugluvalleupheglnglypro
15
<210>51
<211>9
<212>prt
<213>人工序列
<220>
<223>接头
<400>51
glyglyglyglyserglyglyglyser
15
<210>52
<211>16
<212>prt
<213>甲型流感病毒
<400>52
metlysthrileilealaleusertyrilephecysleuvalpheala
151015
<210>53
<211>8
<212>prt
<213>人工序列
<220>
<223>flag表位
<400>53
asptyrlysaspaspaspaspala
15
<210>54
<211>8
<212>prt
<213>人工序列
<220>
<223>tev切割位点
<400>54
gluasnleutyrpheglnglyphe
15
<210>55
<211>413
<212>prt
<213>智人
<400>55
metglyglnproglyasnglyseralapheleuleualaproasnarg
151015
serhisalaproasphisaspvalthrglnglnargaspgluvaltrp
202530
valmetglymetglyilevalmetserleuilevalleualaileval
354045
pheglyasnvalleuvalilethralailealalysphegluargleu
505560
glnthrvalthrasntyrpheilethrserleualacysalaaspleu
65707580
valmetglyleualavalvalpropheglyalaalahisileleumet
859095
lysmettrpthrpheglyasnphetrpcysgluphetrpthrserile
100105110
aspvalleucysvalthralaserilegluthrleucysvalileala
115120125
valaspargtyrphealailethrserprophelystyrglnserleu
130135140
leuthrlysasnlysalaargvalileileleumetvaltrpileval
145150155160
serglyleuthrserpheleuproileglnmethistrptyrargala
165170175
thrhisglnglualaileasncystyralaasngluthrcyscysasp
180185190
phephethrasnglnalatyralailealaserserilevalserphe
195200205
tyrvalproleuvalilemetvalphevaltyrserargvalphegln
210215220
glualalysargglnleuglnlysileasplyssergluglyargphe
225230235240
hisvalglnasnleuserglnvalgluglnaspglyargthrglyhis
245250255
glyleuargargserserlysphecysleulysgluhislysalaleu
260265270
lysthrleuglyileilemetglythrphethrleucystrpleupro
275280285
phepheilevalasnilevalhisvalileglnaspasnleuilearg
290295300
lysgluvaltyrileleuleuasntrpileglytyrvalasnsergly
305310315320
pheasnproleuiletyrcysargserproasppheargilealaphe
325330335
glngluleuleucysleuargargserserleulysalatyrglyasn
340345350
glytyrserserasnglyasnthrglygluglnserglytyrhisval
355360365
gluglnglulysgluasnlysleuleucysgluaspleuproglythr
370375380
gluaspphevalglyhisglnglythrvalproseraspasnileasp
385390395400
serglnglyargasncysserthrasnaspserleuleu
405410
<210>56
<211>18
<212>dna
<213>人工序列
<220>
<223>引物
<400>56
gcggaattcgagctcgcc18
<210>57
<211>42
<212>dna
<213>人工序列
<220>
<223>引物
<400>57
cctccgccggatccgccacctcctccactctgctcccctgtg42
<210>58
<211>50
<212>dna
<213>人工序列
<220>
<223>引物
<400>58
ggcggatccggcggaggttcgcaggtgcagctgcaggagtctgggggagg50
<210>59
<211>54
<212>dna
<213>人工序列
<220>
<223>引物
<400>59
tggaattctagattagtgatggtgatggtggtgtgaggagacggtgacctgggt54
<210>60
<211>24
<212>prt
<213>人工序列
<220>
<223>接头
<400>60
glyglyglyglyserglyglyglyglyserglyglyglyglysergly
151015
glyglyglyserglyglyglyser
20
<210>61
<211>18
<212>dna
<213>人工序列
<220>
<223>引物
<400>61
gcagatctcggtccgaag18
<210>62
<211>34
<212>dna
<213>人工序列
<220>
<223>接头
<400>62
ggggsggggsggggsggggsggggsggggsgggs34
<210>63
<211>29
<212>dna
<213>人工序列
<220>
<223>引物
<400>63
gatgtgcagctgcaggagtctggrggagg29
<210>64
<211>19
<212>dna
<213>人工序列
<220>
<223>引物
<400>64
ccacagacagccctcatag19
- 还没有人留言评论。精彩留言会获得点赞!