蜂王浆新鲜度的生物标记物及其筛选方法与流程
本发明涉及蜂王浆新鲜度的生物标记物及其筛选方法。
背景技术:
蜂王浆和蜂蜜是两种深受欢迎的蜂产品。蜂王浆,又称王浆和蜂乳,是由5~15日龄工蜂头部营养腺(包括脑后腺、咽下腺和上颚腺等)分泌的特殊白色乳状物质。蜂王浆是蜂王和3日龄内工蜂幼虫的专用食料,是决定蜜蜂雌性幼虫发育成为蜂王还是工蜂的关键食物因素。作为一种营养保健品,蜂王浆的活性和功能很多,显然其功能与其所含的生物活性成分有关,已知其主要成分包括蛋白质、碳水化合物、脂类和王浆酸等。近年来相关研究表明,蜂王浆中的主要生物活性在常温下会随储存时间下降,极易变质而失去营养功能。迄今为止十羟基葵烯酸(王浆酸,10-hda)含量是目前我国和国际蜂王浆标准中衡量品质优劣的主要指标(gb9697-2008蜂王浆)。然而研究显示,在长期储存过程中,蜂王浆中的10-hda含量非常稳定,并不适合作为代表蜂王浆新鲜度的指标[antinellijf,zegganes,renéedavico,etal.evaluationof(e)-10-hydroxydec-2-enoicacidasafreshnessparameterforroyaljelly[j].foodchemistry,2003,80(1):85-89],因此亟需完善的蜂王浆质量评价体系。
蛋白质是蜂王浆中的主要活性物质,占王浆干重的30~50%,其中由9个成员(mrjp1~9)组成的糖基化蛋白家族—王浆主蛋白(majorroyaljellyproteins,缩写mrjps)占王浆中可溶性蛋白含量的90%左右。在常温下储存过程中,由于蜂王浆中内源性酶等的作用,蛋白质随会随着储存时间的推移而降解,引起蛋白质结构的改变和含量的下降。现有蜂王浆新鲜检测技术主要是由沈立荣团队研发的,基于对单一蜂王浆主蛋白成员——王浆主蛋白1(mrjp1)特异性蛋白标志物mrjp1含量进行检测的聚丙烯酰胺电泳法(sds-page)和间接酶联免疫测定法(elisa)[shenli-rongetal.determinationofroyaljellyfreshnessbyelisawithahighlyspecificanti-apalbumin1,majorroyaljellyprotein1antibody[j].journalofzhejianguniversity-scienceb,2015,16(2):155-166],并申请发明专利-电泳胶蛋白条带检测蜂王浆新鲜度的建立方法和应用(申请号:201410554252.9)。这些方法能通过蜂王浆中mrjp1随时间的降解程度分析,对蜂王浆的新鲜度做出快速判断。然而,由于elisa法的开发需要利用动物制备特异性抗体,周期长,成本高且重现性不高;而sds-page法的只能根据电泳图像的蛋白条带灰度作初步的含量差别判断,特异性较低,定量能力差,均不适合作为标准化的精准定性定量分析方法。近年来,胡菡等制备了利用王浆主蛋白3-mrjp3为抗原的单克隆抗体,申报了可检测mrjp3含量的酶标仪(elisa)快速检测方法及试剂盒(胡菡,李建科,冯毛,房宇,韩宾.抗蜂王浆主蛋白3的单克隆抗体及检测蜂王浆主蛋白3的酶联免疫试剂盒.2018年,cn107892713a)。
与上述传统分析方法相比,基于高选择性和特异性的选择离子监测模式和精确的定量能力,lc-ms是当今蛋白质组学研究的最重要的技术手段之一,在食品特定蛋白质定量检测上受到广泛的应用[陈启,赖世云,张京顺,任一平.利用超高效液相色谱串联三重四级杆质谱定量检测人乳中的α-乳白蛋白.食品安全质量检测学报,2014,(5):2095-2100;胡蓓,张京顺,柯星,蒋易蓉,周健,果基施锑,任一平.高效液相色谱-串联质谱法测定婴幼儿配方奶粉中酪蛋白磷酸肽含量.食品科学,2018,(39):286-291]。
2018年,浙江工商大学傅玲莉等在报道了采用液相色谱串联质谱方法,筛选了采用单一王浆主蛋白:mrjp1的特异性多肽“ffdydfgsder”为标记物检测mrjp1含量,作为判断蜂王浆掺假或者质量优劣的方法[nalin,sichen,hongzhang,junminli,linglinfu.quantificationofmajorroyaljellyprotein1infreshroyaljellybyultraperformanceliquidchromatography-tandemmassspectrometry.journalofagriculturalandfoodchemistry.66(5):1270-1278]。
但蜂王浆主蛋白是一组需要通过整体协同作用,发挥生物活性的功能蛋白,特别是主蛋白mrjp1~5均属于糖基化蛋白,占王浆主蛋白总量的80%以上(schmitzova´,j,klaudiny,j,albert,s.,schroder,w,schreckengost,w,hanes,j,judova,j.&simuth,j.1998.afamilyofmajorroyaljellyproteinsofthehoneybeeapismelliferal.cellularandmolecularlifesciences54,1020–1030),王浆的促进生育和抗衰老功能是主蛋白的整体协同作用(ajithanathkoomankode,ganapathiramanathana.,ananthakrishnan,jayakumarannaira,vethasundaramsugunanb.areviewonroyaljellyproteinsandpeptides.journaloffunctionalfoods44(2018)255-264),而以往的论文和发明专利检测蜂王浆的新鲜度基本是以某种单一主蛋白含量为主要目标,缺乏多种蛋白组合的综合性评价方法检测方法。
技术实现要素:
为了克服现有技术的不足,本发明的目的在于提供蜂王浆新鲜度的生物标记物及其筛选方法。
本发明解决其技术问题所采用的技术方案是:
一种基于蛋白质组学的体现蜂王浆新鲜度的生物标记物的筛选方法,
1)预处理:将蜂王浆样品经dtt、iaa溶液预处理后,用重组牛胰蛋白酶酶解,得到王浆主蛋白(majorroyaljellyproteins,mrjps)的多肽溶液;
2)数据分析:使用proteinlynxglobalserver(plgs)蛋白质组学分析平台,将经超高效液相色谱串联飞行时间质谱(uplc-q-tof/ms)检测出的mrjps多肽序列信息与从uniprot蛋白质数据库(www.uniprot.org)获取的mrjps多肽序列理论信息比对分析,得到王浆粗蛋白酶解产物中mrjps多肽的鉴别结果;将经uplc-q-tof/ms质谱分析得到mrjps多肽参数导入超高效液相色谱串联三重四极杆质谱(uplc-tqms)仪器中,建立候选多肽的定量mrm分析方法,经检测得到69条候选多肽;
3)特征多肽筛选:基于tqms仪器分析,对69条候选多肽作重复检测,初步剔除35条峰面积低于2000的低含量多肽;
建立mrjps候选多肽的酶解时间与酶解程度的热力分析图,进一步筛选出同时具备高易酶解性与高酶解后稳定性的候选mrjps多肽;高易酶解性多肽的标准是候选多肽的相对峰面积比值能在酶解2h内达到90%以上,高酶解后多肽稳定性的标准是候选多肽的相对峰面积比值在酶解24h后不小于70%;剔除候选多肽中的非特异性多肽,得到15条mrjps候选多肽;
基于2小时最佳酶解时间和高响应值,从15条候选多肽中分别筛选出1条mrjp1、mrjp2、mrjp3的最佳候选多肽:
mrjp1的特异性标志多肽:yngvpsslnvisk,seqidno:1;
mrjp2的特异性标志多肽:tlqmiagmk,seqidno:2;
mrjp3的特异性标志多肽:ltvagesftvk,seqidno:3。
基于蛋白质组学的蜂王浆新鲜度生物标记物,为以下特异性标志多肽的一条或多条的组合:mrjp1的特异性标志多肽:yngvpsslnvisk,seqidno:1;mrjp2的特异性标志多肽:tlqmiagmk,seqidno:2;mrjp3的特异性标志多肽:ltvagesftvk,seqidno:3。
所述的生物标记物,采用同位素标记的肽段yngvpssl*nvisk、tl*qmiagmk和l*tvagesftvk作为内标,其中*为定量离子,l*为同位素标记[13c6,15n]-亮氨酸。
所述的生物标记物,采用液相色谱串联质谱检测法(lc-ms)量分别检测蜂王浆样品中的mrjp~3的含量,yngvpsslnvisk在10-1600ng/ml范围内具有良好线性关系,tlqmiagmk和ltvagesftvk在10-600ng/ml的范围内具有良好线性关系,相关系数r2>0.99。
本发明的有益效果是:建立了基于蛋白组学的蜂王浆主要内源性标志蛋白mrjps中对储存温度较为敏感的一组成员mrjp1~3的定量检测的lc-ms法,并能通过蜂王浆中mrjp1~3个体及组合整体含量随储存时间的降解程度分析,对蜂王浆的新鲜度作出精确判断。本发明为蜂王浆新鲜度检测提供了一种新的方法,与以往方法相比,本检测方法的特异性与定量能力较为精准。
附图说明
图1是转移到tqms的多肽的稳定性分析。
图2是34条候选肽的总离子流图。
图3是候选多肽的易酶解性与酶解后稳定性的热力分析图。
图4是候选多肽的分类。
图5是mrjp1-3的特征多肽峰图。
图6是三条特征多肽的标准曲线。
图7是mrjp1含量下降程度与保温时间的线性关系。
图8是mrjp2含量下降程度与保温时间的线性关系。
图9是mrjp3含量下降程度与保温时间的线性关系。
图10是鲜蜂王浆保温过程中mrjp1~3含量的变化趋势。
图11是鲜蜂王浆保温过程中mrjp1~3含量降解率变化趋势。
具体实施方式
下面结合具体实施例和附图,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明范围。
本发明中,若非特指,所采用的原料和设备等均可从市场购得或是本领域常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
实施例1:蜂王浆中mrjp1~3的特异性标志肽的筛选
预处理:称取0.1g蜂王浆样品于8ml碳酸氢铵溶液中(0.1m)充分溶解,然后转入100ml容量瓶中定容。取930μl上述溶解液与10μldtt(100mm)于2ml离心管中振荡混匀,后置于50℃恒温水浴锅中孵育30min。随后,将30μliaa(100mm)加入上述混合液中振荡混匀,并将其置于黑暗环境中,在室温下反应30min。随后,取10μl重组牛胰蛋白酶溶液(500μg/ml)加入上述混合溶液中振荡混匀,后置于37℃恒温水浴锅中酶解2h。2h后加入10μl10%甲酸终止酶解反应。用0.22μm膜过滤后,即可上机分析。
超高效液相色谱串联飞行时间质谱(uplc-q-tof/ms)定性分析参考条件如下:液相色谱分离条件:使用c18蛋白分析柱(1.7μm粒径,2.1mm×100mm)。a相为0.1%甲酸水溶液,b相为0.1%甲酸乙腈溶液;流速:0.3ml/min;进样量:5μl;柱温:40℃;样品室温度:10℃;洗脱条件为:0~20min3%b~40%b,20~20.1min40%b~100%b,保持100%b2min,22.1~22.2min100%b~3%b,平衡2.8min,共25min。采用配备有电喷雾离子源(esi)的synaptg2高分辨ms系统进行数据采集。具体检测条件如下:模式esi+,毛细管电压3kv,样品锥孔电压25v,萃取锥孔电压4v,离子源温度120℃,脱溶剂温度350℃,锥孔反吹气流50l/h,脱溶剂气流650l/h,循环碰撞能量15~35v,lockspray参比物质:leucine-enkephalin。使用proteinlynxglobalserver(plgs)2.5软件(美国waters公司)对获得的数据进行分析,相关参数设如下:mode:electrospray-mse,enzyme:trypsin,lockmassforcharge1:556.2771da,allowedmissedcleavage:1,minimalfragmentionmatchesperpeptide:2,minimalfragmentionmatchesperprotein:5,fixedmodifications:carbamdomethylc,其他参数设置为默认值。mrjps的肽序列信息是从uniprot数据库(uniprotkb,www.uniprot.org)获得的,具体编号见表1。
表1mrjps及其酶解多肽的分析结果
超高效液相色谱串联三重四极杆质谱(uplc-tqms)定量分析参考条件如下:使用c18蛋白分析柱(1.7μm粒径,2.1mm×100mm)。a相为0.1%甲酸水溶液,b相为0.1%甲酸乙腈溶液;流速:0.3ml/min;进样量:10μl;柱温:40℃;样品室温度:10℃;洗脱条件为:0~1min保持3%b1min,1~1.5min3%b~20%b,1.5~3.5min20%b~60%b,3.5~3.6min60%b~100%b,保持100%b0.5min,4.1~4.2min100%b~3%b,平衡1min,共5.2min。采用配备有电喷雾离子源的xevo-tq-ms系统进行数据采集。xevo-tq-ms的具体检测条件如下:模式esi+,毛细管电压3.5kv,离子源温度150℃,脱溶剂温度350℃,锥孔反吹气流50l/h,脱溶剂气流650l/h,氩气碰撞压0.35pa。
实验结果:使用plgs蛋白质组学分析平台,将经tof高分辨质谱检测出的mrjps的肽序列信息与从蛋白质数据库uniprot获取的mrjps的理论信息作对比分析,得到王浆粗蛋白中mrjps的鉴别结果。如表1所示,mrjp1~7,mrjp9以及它们的共108条酶解多肽能被tof质谱检测出。mrjp8未被鉴别出,最主要的原因可能是mrjp8在蜂王浆中的含量太低。检测出的mrjps肽段覆盖率从低到高依次是mrjp9的1.7%至mrjp1的76.6%。mrjp1~3的肽段覆盖率显著高于其余王浆主蛋白,反应出它们在蜂王浆中的mrjps中含量最高,可能是作为高含量、高稳定的mrjps标志物的潜在选择。
鉴于三重四级杆质谱对痕量样品的定量分析具有的高灵敏度和良好的定量重现性的特点,我们将经tof质谱分析得到多肽参数(包括电荷,分子量和保留时间等)导入tqms仪器中建立对候选多肽的定量分析的mrm方法。利用该方法对蜂王浆样品中mrjps多肽的检测结果如表1所示,只有108条候选多肽中的69条多肽能在tqms被检测出,其余39条多肽未能被检测出的原因除了仪器误差,最主要的是蜂蜜中mrjps的含量较低导致这些酶解多肽的响应值不足而无法被检出,所以它们不符合作为蜂蜜中含量稳定的标志多肽的要求。
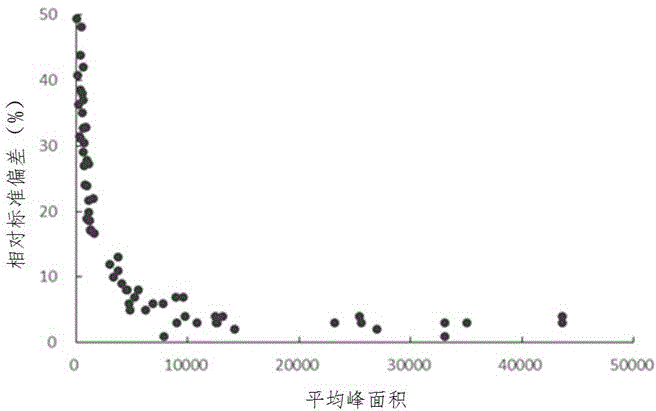
为了对69条候选多肽进行初步筛选,通过tqms对它们进行10次连续重复进样分析。结果如图1所示,从整体上看,每条多肽的峰面积与10次重复检测结果的相对标准偏差(rsd)之间有着紧密的关联相关。峰面积低于2000的多肽的重复检测结果的rsd较高(>15%)。导致这些多肽峰面积较低的原因主要有两个:(1)多肽的电离效率较低,不能被充分离子化导致被三重四极杆检测系统检测出的响应值较低;(2)多肽难以被酶解出来或者酶解后容易降解,导致其在待测溶液中的浓度较低。这些多肽的相对标准偏差较高,反映出它们在质谱定量分析中的高不稳定性,因而无法满足准确定量的要求。因而剔除掉35条峰面积低于2000的多肽,选择剩下的34条多肽作为标志多肽的候选者进行进一步的筛选。在34条多肽中,有10条属于mrjp1,8条属于mrjp2,7条属于mrjp3,2条属于mrjp4,4条属于mrjp5,1条属于mrjp6,2条属于mrjp7。这34条候选肽的总离子流图如图2所示。
基于特异性标志肽的液质联用蛋白质定量分析方法的原理是在理想酶解条件下,酶解后肽段的摩尔浓度与该蛋白质的摩尔浓度近似相等。因此,只需要为目标蛋白筛选出一条合适的标志多肽即可完成对目标蛋白的定量分析。合适的标志多肽一般需要满足两个条件:(1)该肽段是目标蛋白的特异性多肽;(2)该肽段在定量分析中的稳定性好,重复性高。因此为了检测候选多肽的酶解效率以及经胰蛋白酶酶解后该肽的稳定性,对分别经1、2、3、4、5、6、7、8和24h,9个不同酶解时间的所有候选多肽进行tqms检测,分析它们的易酶解性和酶解后稳定性定性。
如图3所示,不同候选多肽的酶解效率差异很大。例如,有些多肽能在2~3h内完全酶解,而某些多肽如ealphvpifdr,iaidk和gvpsslnvisek在24h内可能仍未完全酶解。经过24h酶解后,各肽段的相对峰面积比值从低到高为16~94%,这表明不同候选多肽酶解后的稳定性也存在很大差异。因而可以根据候选多肽的易酶解性与酶解后稳定性差异对它们进行筛选。基于候选多肽的易酶解性与酶解后稳定性的差异,将34条候选肽分为4类(见图4)。高易酶解性的标准是候选多肽的相对峰面积比值能在酶解2h内达到90%以上。高酶解后稳定性的标准是,候选多肽的相对峰面积比值在酶解24h后不小于70%。由于同时具备高易酶解性与高酶解后稳定性,a类中的5条候选肽是标志肽的最佳选择。b类中的5条候选肽是次优选择,虽然它们具有较高的易酶解性,但酶解后稳定性较差,因而在较短的酶解时间内可用作标志肽。c类中的8条候选肽虽然酶解后稳定性高但易酶解性差,因此也不是最佳选择,需要在较长的酶解时间下可用作标志肽。因此,由于所需最佳酶解时间的不同,b类和c类中的候选多肽不适合同时选为标记肽。d类中的7条候选肽由于它们的易酶解性与高酶解后稳定性均较差,因此不适合选作标志肽。按照此标准,候选多肽ealphvpifdr,iaidk和gvpsslnvisek无法被选作标志肽,因为即使在酶解24h后它们仍未达到最大酶解程度。如图4所示,由于mrjp4和mrjp6的酶解多肽均不属于a,b或c类,因而缺乏用于定量分析的标志肽,不考虑用作内源性标志蛋白。因为ltsntfdydpr、ltsntfdydpk和nypfdvdqwr均同时存在于两个以上的蛋白中,为非特异性肽,因而不能选作特异性标志肽。mrjp5和mrjp7也缺乏用于定量分析的标志肽,不考虑用作内源性标志蛋白。因此,仅从类别a~c的mrjp1~3中选择出了15条候选肽。
表2mrjp1~3的候选标志多肽
考虑到由于所需最佳酶解时间的不同,b类和c类中的候选多肽不适合同时选为标记肽。所需酶解时间较低的a类和b类中的多肽组合才是首选。最后,如表2所示,由于b类中的yngvpsslnvisk和a类中的ltvagesftvk的质谱检测的响应值较高,因此更适合被分别选作mrjp1和mrjp3的特异性标志肽。mrjp2唯一属于的a类的tlqmiagmk被选为它的特异性标志肽。最佳的酶解时间为2小时。为了减少lc-ms定量分析中的基质效应,提高检测的准确度,为3条特异性标志肽分别合成了yngvpssl*nvisk、tl*qmiagmk和l*tvagesftvk3条同位素内标,建立了对mrjp1~3进行定量分析的超高效液相色谱串联三重四级杆质谱法(uplc-tqms)。
实施例2:蜂王浆中mrjp1-3含量的检测方法
预处理:同实例1中预处理方法。
质谱检测:参考条件如下:采用配备有电喷雾离子源的xevo-tq-ms系统进行数据采集。xevo-tq-ms的具体检测条件如下:模式esi+,毛细管电压3.5kv,离子源温度150℃,脱溶剂温度350℃,锥孔反吹气流50l/h,脱溶剂气流650l/h,氩气碰撞压0.35pa。质谱多反应监测方法的参数参考条件表3所示。
表3标志多肽及其内标肽的mrm方法
注:*定量离子,l*为同位素标记[13c6,15n]-亮氨酸。
液相色谱分离:参考条件如下:使用c18蛋白分析柱(1.7μm粒径,2.1mm×100mm)。a相为0.1%甲酸水溶液,b相为0.1%甲酸乙腈溶液;流速:0.3ml/min;进样量:10μl;柱温:40℃;样品室温度:10℃;洗脱条件为:0~1min保持3%b1min,1~1.5min3%b~20%b,1.5~3.5min20%b~60%b,3.5~3.6min60%b~100%b,保持100%b0.5min,4.1~4.2min100%b~3%b,平衡1min,共5.2min。
标准曲线配制:yngvpsslnvisk,10-1600ng/ml;tlqmiagmk和ltvagesftvk,10-600ng/ml。其中包含同位素yngvpssl*nvisk、tl*qmiagmk和l*tvagesftvk浓度为100ng/ml。
计算mrjp1~3含量:通过上述检测步骤和标准曲线,可获得样品酶解液中特异肽的摩尔浓度。在完全酶解的情况下,特征多肽和王浆蛋白的摩尔浓度相同。所以可以通过特异肽的摩尔浓度乘以王浆蛋白分子量计算得王浆蛋白的质量浓度。
实验结果:如图5所示,蜂王浆中能检测出三条完好且区分开的mrjp1-3特征峰图。特征多肽标准溶液的测定结果如图6所示,结果表yngvpsslnvisk在10-1600ng/ml的范围内具有良好的线性关系,tlqmiagmk和ltvagesftvk在10-600ng/ml的范围内具有良好的线性关系,相关系数r2>0.99,满足定量检测要求。
以上结果表明,本实验方法能准确的定量检测出所测蜂王浆样品中所含的mrjp1-3的含量。
实施例3:以mrjp1为检测目标的蜂王浆新鲜度检测方法
实验样品:为模拟蜂王浆在一般储存过程中发生的受温度影响而降解的过程,现将蜂王浆样品按以下方法进行老化处理:将蜂王浆样品置于40°c恒温储存,每隔7天取出部分并储存于-80°c冰箱冷藏,分别编号a-f,即编号a-f的样品是在40°c下恒温储存第0、7、14、21、28、35天的蜂王浆。样品取出后均置于-80°c储存待进一步鉴定。
蜂王浆中mrjp1检测方法:如实例2中所述。
实验结果:实验结果(表4)显示,与冷冻保存的鲜王浆相比,保温7d、14d、21d、28d、35d的鲜王浆中的mrjp1含量分别下降11.5%、14.7%、31.3%、33.7%、52.4%(表4)。经相关性分析结果(图7)显示,mrjp1含量的下降程度与保温时间成正相关(r2>0.9)。该结果证实,我们建立的检测方法对mrjp1具有高度的专一性,是一种非常实用的蜂王浆新鲜度检测新技术。
表4老化蜂王浆样品中mrjp1含量检测结果
实施例4:以mrjp2为检测目标的蜂王浆新鲜度检测方法
实验样品:如实例3中所述对蜂王浆样品进行老化处理。
蜂王浆中mrjp2检测方法:如实例2中所述。
实验结果:实验结果(表5)显示,与冷冻保存的鲜王浆相比,保温7d、14d、21d、28d、35d的鲜王浆中的mrjp2含量分别下降32.0%、54.0%、70.1%、78.6%、87.7%(表5)。相关性分析结果显示(图8)发现,mrjp2含量的下降程度与保温时间成正相关(r2>0.9)。该结果证实,我们建立的检测方法对mrjp2具有高度的专一性,是一种非常实用的蜂王浆新鲜度检测新技术。
表5老化蜂王浆样品中mrjp2含量检测结果
实施例5:以mrjp3为检测目标的蜂王浆新鲜度检测方法
实验样品:如实例3中所述对蜂王浆样品进行老化处理。
蜂王浆中mrjp3检测方法:如实例2中所述。
表6老化蜂王浆样品中mrjp3含量检测结果
实验结果:结果(表6)显示,与冷冻保存的鲜王浆相比,保温7d、14d、21d、28d、35d的鲜王浆中的mrjp2含量分别下降17.8%、23.8%、50.1%、60.1%、81.1%(表6)。相关性分析结果(图9)显示,mrjp3含量的下降程度与保温时间成正相关(r2>0.9)。该结果证实,我们建立的检测方法对mrjp3具有高度的专一性,是一种非常实用的蜂王浆新鲜度检测新技术。
实施例6:以mrjp1-3组合含量和比例为指标判断蜂王浆新鲜度检测方法
实验样品:如实例3中所述对蜂王浆样品进行老化处理。
蜂王浆中mrjp1-3检测方法:如实例2中所述。
表7鲜蜂王浆保温(40℃)过程中mrjp1~3含量的变化
实验结果(表7):结果显示,鲜王浆中三种蛋白含量依次为mrjp1>mrjp3>mrjp2含量,三者分别为56.9±6.1mg/g、26.8±0.5mg/g、16±0.6mg/g。模拟老化实验,即将鲜王浆保温7d、14d、21d、28d、35d,mrjp1、mrjp2、mrjp3含量均随着呈下降趋势(图10、图11,降解率与保温时间均呈正相关(图7、8、9,r2>0.9)。虽然mrjp1、mrjp2、mrjp3的绝对含量一直是mrjp1>mrjp3>mrjp2,保温35天后,三者的含量分别为27.1±0.7mg/g、5.1±0.1mg/g、2.0±0.1mg/g。但三种蛋白的降解率(%)顺序为mrjp2>mrjp3>mrjp1,三者分别为87.7%、81.1%、52.4%。由于主蜂王浆蛋白由不同蛋白组成家族,各种蛋白的功能不同,其中mrjp1具有抗衰老、抗氧化、抗肿瘤、免疫调节作用,mrjp2具有促进细胞增殖、抗肿瘤功能,mrjp3具有抗过敏、加速免疫反应、抗炎作用。发挥主蛋白的营养健康功能需要各蛋白成员的协同作用(ajithanathkoomankode,ganapathiramanathana.,ananthakrishnan,jayakumarannaira,vethasundaramsugunanb.areviewonroyaljellyproteinsandpeptides.journaloffunctionalfoods44(2018)255-264)。而mrjp1~3是mrjps家族中含量较高,营养功能最有代表性的三个成员,因此,将三种蛋白标记组合检测,是一种比检测单一蛋白更为全面的、反映蜂王浆新鲜度的质量鉴定方法。
上述描述中的实施方案可以进一步组合或者替换,且实施方案仅仅是对本发明的优选实施例进行描述,并非对本发明的构思和范围进行限定,在不脱离本发明设计思想的前提下,本领域普通技术人员对本发明的技术方案做出的各种变化和改进,均属于本发明的保护范围。本发明的保护范围由所附权利要求及其任何等同物给出。
序列表
<110>杭州艾蜂健康科技有限公司
<120>蜂王浆新鲜度的生物标记物及其筛选方法
<141>2021-03-07
<160>3
<170>siposequencelisting1.0
<210>1
<211>13
<212>prt
<213>中华蜜蜂(apisceranaceranafabricius)
<400>1
tyrasnglyvalproserserleuasnvalileserlys
1510
<210>2
<211>9
<212>prt
<213>中华蜜蜂(apisceranaceranafabricius)
<400>2
thrleuglnmetilealaglymetlys
15
<210>3
<211>11
<212>prt
<213>中华蜜蜂(apisceranaceranafabricius)
<400>3
leuthrvalalaglygluserphethrvallys
1510
- 还没有人留言评论。精彩留言会获得点赞!