高通量压电谐振芯片制备方法及测量系统与流程
本发明涉及一种石英晶体微天平,特别是一种高通量(8通道及以上)压电抗声波耦合及抗应力干扰谐振芯片的制备方法及其测量系统。
背景技术:
石英晶体微天平(QCM)是一种对表面质量高度敏感的传感器,具有操作简单、高敏感度、无需标记、实时监测、免侵入等优点,已被广泛用于物理、化学、生物等各个领域。QCM作为一种基于压电效应的声波分析传感器,它可以通过质量分析和粘弹性分析定量测定固-固/固-液相界面吸附和反应,其在化学与生物传感等领域已有广泛应用,目前在这方面已经有大量的文献报道。近年QCM的质量与粘弹性敏感原理也被应用于动物细胞黏附、铺展和生长等动态过程的监测及细胞在药物等激励下的响应研究。可目前的QCM装置与测量系统是低通量的,即一般仅允许一个到几个QCM同时测定,十个到几十个QCM同时测定的系统、主要应用于气相低阻尼情形、且仅有频率一个测试变量,不利于液相为基础的生物分析、特别是不适于活细胞分析。
活细胞测定有别于生化成分分析的一个重要差别在于活细胞是动态的,其行为与功能与其传代数、所处的细胞微环境等密切相关。因此为了测定细胞对药物的响应,研究细胞在不同病理与生理状态的变化,只有采用大量的平行测试,如高通量测试才能得到可比较、有意义、重复性好、效率高的结果。同样,高通量QCM分析系统对蛋白质相互作用、基因分析等生化分析也是特别有效的。目前,已有其它传感分析技术,包括电化学阻抗与光传感技术已实现了高通量测试而应用于细胞与生物分子相互作用分析。QCM相对于其它传感分析的优势在于它既不要求象电化学阻抗技术那样一定是导电传感表面,也不需象光传感技术那样必须为透明基质。此外,QCM的灵敏度与探测深度可通过调节其厚度或频率而改变,特别地、它还可直接提供待测体系的粘弹性信息,有助于研究细胞与生物分子的结构与功能。可目前尚没有八通量以上的高通量QCM技术问世,其主要原因在于高通量石英晶体芯片研制的困难。
石英晶体很薄、易碎,为了使石英晶体振荡,必须在晶体两面被上金属电极以施加交变电场。用作液相生化或细胞QCM分析的石英晶体通常通过O形圈或环,经机械方法固定于检测池中,仅将一面QCM电极与测试体系接触,显然这种方法需要装拆池子、操作不便而不可能制成高通量的QCM检测系统,且机械安装时会在与O形圈或环接融的石英部分施加应力而影响石英晶体的谐振性能,甚至导致晶片破损。另一种典型结构为通过金属棒及弹簧与被在石英晶体外沿的金属电极接触、同样不可避免地会产生应力。因此,由于不同石英晶体制作工艺及其安装时所受应力的差异使获得性能一致的QCM芯片及检测池-实现高通量QCM技术的必要条件的满足造成了额外困难。
过去一、二十年来,人们致力于在单片石英晶体上制造多个石英晶体谐振片,通常被称作单片QCM阵列,显然这种方法所制备的每个QCM芯片都是完全一致的,所制备的QCM阵列结构紧凑。可这种技术有两个缺陷,首先不管从材料来源还是晶体加工技术,石英晶体片的尺寸非常有限,在晶片频率确定即晶片厚度确定的情况下,晶片尺寸越大加工晶片时越容易破损,因此利用单片石英晶体所制备的QCM阵列从源头上就不可能实现高通量。此外,同一石英晶体基片上不同QCM同时振荡时将通过共同基底声波的传播不可避免地存在相互干扰,除非相邻两个QCM的距离足够远,这样将进一步限制同一基片上的QCM阵列数。这种单片QCM阵列结构中的声波相互干扰非常复杂,取决于相邻电极及电极引线间的距离,每一电极的大小、几何形状、厚度与力学性能。显然,这种声波相互干扰随着各电极与实际待测体系的相互作用而进一步加剧和变得更不可预测。为解决声波干扰,人们试验了对基底结构修饰的各种方法,如采用凸面结构和X轴反转结构等,这些方法虽有效,但并不能完全消除声波干扰。新近,Kata Jaruwongrungsee等在《基于无干扰的多通道单片石英晶体微天平的实时多组分分析生物传感器》(Real-time multianalyte biosensors based on interference-free multichannel monolithic quartz crystal microbalance,Biosensors and Bioelectronics,67(2015)576–581)中提到,通过在单片石英衬底相邻QCM电极之间插入聚二甲基硅氧烷隔离材料而有效抑制了相邻QCM之间厚度剪切振荡模式之间的耦合。可如上所说,由于单片石英晶体尺寸的限制而不可能实现高通量(上述工作仅在单片石英晶体上构造了三个压电谐振芯片)。此外,由于各QCM芯片之间仍为同一石英材料相连,包括剪切模式在内的各种声耦合不可能完全消除。
在中国专利“微型压电谐振式传感器阵列芯片”(专利申请号99117440.2)中,莫志宏采用将多个独立、微型、两面敷有电极的压电谐振片,通过固定在非压电材料的绝缘基片上而提出了微型压电谐振式传感器阵列芯片的制备方案,由于避免了使用压电石英晶体本身作为共同基质、压电谐振片之间的声耦合与干扰将大为降低。但该方案中的压电晶体背面电极与绝缘基片上的共电极是通过刚性接触的,不可避免将产生一定的接触应力,此外绝缘基片本身为硬质材料、固定其上的压电谐振片之间仍有可能会有一定的声耦合。在另一实用新型专利“压电传感检测多孔板”(专利号:99241239.0)中,莫志宏提出了将压电谐振片固定在通孔绝缘基板底部的方案,具体地,将直径稍大于通孔的压电谐振片外周用环氧树脂胶粘剂固定在通孔绝缘基板底部而形成检测池。这种结构避免了石英晶体电极与基板的硬接触,但石英外周用环氧树脂粘合,环氧树脂等粘合剂凝固过程仍将产生应力、且凝固后胶粘处十分坚硬,声波仍可能部分传播而不能完全消除同一基片上相近不同压电谐振片之间的声耦合,同时不同压电谐振片的引线间存在干扰,因此可能造成振荡减弱及寄生振荡,使压电谐振芯片主峰阻尼增加。此外,由于压电片和环氧树脂膨胀系数的不同,在极端环境或化学处理(如Piranha溶液)下,可能出现易碎压电片破裂的情形。
目前在药物筛选方面,为减少被筛选样品的用量,扩大筛选规模,实现药物筛选的一样多筛,高通量药物筛选所使用的主要是分子和细胞水平的筛选模型。但是,在生物学评估中(如活体实验前)或存在药用靶点未知的情况下,往往需要较长的周期,而且需要大量的活体实验才能得出初步的结论。细胞是生物体结构和功能的基本单位,一个生物体对于疾病、伤害和治疗的响应其实是源于其细胞的响应。因此迫切需要开发出能在细胞层次,快速筛选药物与评估药物生物学毒性的方法。
技术实现要素:
本发明为了解决以上问题,提出了一种免声波干扰、无应力、低阻尼、高稳定性、方便操作的高通量压电谐振芯片制备方法及相应的测量系统,并通过测试八通道压电谐振芯片的谐振性能、抗干扰能力及几种药物对大鼠心肌细胞的影响而进行了验证。本发明提出的方案可为细胞层次高通量药物筛选与毒性评估等提供一种新的、强有力分析手段,并可用于分子相互作甪和化学、环境科学等分析检测领域。
为了实现上述目的,本发明提出的一种高通量压电谐振芯片制备方法,包括在一基片上开设多个穿孔或使用透明材料制成的半穿孔,每一穿孔或半穿孔内置入一压电谐振片,各压电谐振片用相同批次材料和工艺制作而成,各压电谐振片的上、下两面分别经铬或钛粘附层连接工作电极及背面电极,工作电极及背面电极的一端经低温导电银胶与接口端子连接,且各压电谐振片周围使用柔性粘合层连接基片,各压电谐振片的背面电极底部设有后盖。
为实现上述目的,本发明提出的一种上述高通量压电谐振芯片测量系统,包括高通量压电谐振芯片、检测池、光学/荧光显微镜、电化学工作站及样品池,所述高通量压电谐振芯片包括基片,基片上开设多个穿孔或使用透明材料制成的半穿孔,每一穿孔或半穿孔内置入一压电谐振片,各压电谐振片用相同批次材料和工艺制作而成,且各压电谐振片周围使用柔性粘合层连接基片,各压电谐振片的上、下两面分别经铬或钛粘附层连接工作电极及背面电极,且工作电极及背面电极的一端经低温导电银胶与接口端子连接,各压电谐振片的背面电极底部设有后盖。
所述高通量压电谐振芯片放置在实验环境控制箱中,且高通量压电谐振芯片的各压电谐振片上面分别设置检测池,各检测池的上方分别设置对电极,且高通量压电谐振芯片上方设置排枪移液器,高通量压电谐振芯片的下方设置一光学/荧光显微镜;电化学工作站的一端选择性连接一个或多个检测池的对电极,另一端连接相应检测池底部的压电谐振片工作电极,并经第二控制器、振荡电路或测试系统连接计算机的数据输入端;样品池经聚合物输送管顺序连接流式细胞仪、蠕动泵及排枪移液器的样品输入端,第一控制器连接蠕动泵及用于驱动排枪移液器移动的动力驱动系统,计算机的输出控制端连接流式细胞仪和光学显微镜或荧光显微镜。
所述压电谐振片、基片的片形为圆形或多边形。
所述柔性粘合层采用704硅胶、聚二甲基硅氧烷或柔性玻璃等一些固化过程中可消除应力的材料制成。704硅胶(单组份室温硫化硅橡胶)耐老化、耐酸碱、耐高低温(-60℃-250℃),无腐蚀、绝缘、防水、抗震性能良好,此外704硅胶与生物相容、可用于细胞分析。软性固化无毒材料(比如柔性玻璃),能保持固定强度,又能在其固化过程中消除与压电谐振片之间的接触应力,比如采用热压法和适当的去应力工艺将柔性或软性玻璃等材料分别与压电谐振片及基片连接。
本发明仅在压电谐振片外周边缘与704硅胶等软性材料构成的柔性粘合层接触的结构能大大减少压电谐振片振荡时的阻尼。如图5显示本发明八通道压电谐振芯片检测池与常规QCM井型池动态电阻比较,动态电阻减少显著,且各个通道动态电阻大小变化范围较常规QCM井型池小得多,说明本发明能显著减小压电谐振片固定过程应力的产生和减少阻尼。此外,所有通道压电谐振片的谐振主峰附近均无寄生峰出现,这进一步说明各压电谐振片之间无干扰。
所述高通量压电谐振芯片的压电谐振片可以是压电晶体(如:石英晶体、铌酸锂和钽酸锂等,优选为石英晶体)、压电陶瓷(BaTiO3、PbTiO3、PbZrO3等)、压电高聚物(聚偏氟乙烯)和压电复合材料(PMN-PT、PZT-PVDF、PLN-PMN-PZT等)。
所述工作电极及背面电极可以是金属膜(金膜、银膜或铝膜等)、导电复合材料膜(导电玻璃等)。所述工作电极的面积至少覆盖压电谐振片的振荡能陷区域,更好地是覆盖整个压电谐振片,背面电极依据晶体频率仅覆盖压电谐振片的振荡能陷区域。
所述基片可以是晶体材料(如石英晶体片)或是复合材料(树脂、聚氯乙烯、聚氟乙烯、有机玻璃等)。
所述高通量压电谐振芯片测量系统可以是每个压电谐振片设置独立的测量电路,包括用于频率测量的振荡电路、用于频率与动态电阻或耗散测量的复合电路、用于基频与多个泛音频率测量的系统、用于晶体谐振频率与等效参数测量的阻抗或网络测量系统。
所述高通量压电谐振芯片测量系统,也可以是所有或部分压电谐振片连接一个共同的测量电路,通过开关控制器或通过移动每一压电谐振片到固定的测试连接处依序轮流测试。
所述光学/荧光显微镜可透视被有ITO等透明膜导电材料的压电谐振片从而实现细胞可视化,并与压电同时、实时观察和监测。
所述电化学工作站通过在检测池上方添加对电极,工作电极连接压电谐振片的工作电极,实现压电技术和电化学阻抗技术的联用。
所述流式细胞仪不仅可以计算进入检测池的细胞数量,也可以测定细胞的生理生化指标。
所述高通量压电谐振芯片根据培养对象和实验需求放置于相应的温度(如:动物细胞37℃)、相应二氧化碳浓度(如:动物细胞5%)和相应湿度条件下的环境控制箱或CO2培养箱中。
所述检测池根据需求可添加不同的反应物或培养基。如动物细胞的培养采用其中包含5%胎牛血清的DMEM培养基。
基于以上系统在药物评估/筛选方面的检测方法,包括以下步骤:
(1)根据实验目的选择相应的石英晶体切型、基频和/或倍频特性良好的QCM谐振芯片。
(2)用80℃30%H2O2:98%H2SO4=1:3的混合液清洗压电谐振片的工作电极表面30s,并用去离子水将检测池内部冲洗干净,然后用氮气吹干。
(3)以上步骤重复3次。
(4)将清洗后的压电谐振片置入37℃,5%CO2培养箱中,在每一压电谐振片上的检测池中加入200μl培养基,待数据平稳(约2h)后,分别手动/自动加入相同数量的动物细胞。
(5)24h后,加入待测试的药物或天然产物,根据QCM中频率和电阻的变化,用细胞粘弹性指数等来标定细胞在药物或天然产物的作用下其细胞力学等性能等的变化情况,从而推测出药物对细胞的影响。
(6)通过光学显微镜或荧光显微镜对细胞的形态学变化进行观察。电化学工作站可获得细胞黏附、铺展、生长以及药物响应下阻抗变化的动态信息;流式细胞仪可进行细胞计数和细胞添加初始状态数据与实验酶解后细胞状态信息。
(7)清洗QCM检测池和培养箱。
所述步骤(4)中,将长满80%左右细胞培养瓶中的培养基去除;用pH=7.5的磷酸缓冲溶液冲洗培养瓶,去除悬浮的坏死细胞;将0.25%浓度的胰酶加入培养瓶中消化2min后,用含血清培养基中和胰酶,用流式细胞仪计数,预热后分别加入每个检测池相应的细胞数。
所述步骤(5)中,QCM主要通过频率(f)和电阻(R)对细胞生理或病理变化进行反映,通过细胞粘弹性指数CVI=ΔR/ΔF来反应细胞的软硬程度,从而推测药物对细胞的影响。
所述步骤(7)中,清洗使用75%酒精和无菌水,并使用紫外灯灭菌30min。
与现有技术相比,本发明所具有的有益效果为:
1、本发明提供的高通量压电谐振芯片可用于物理、化学、环境科学和药物评估/筛选,可缩短和解决药物筛选中存在的靶向不确定和周期长等问题;
2、本发明压电谐振片为相同批次、相同加工工艺生产的压电谐振片,从而解决了现有技术中存在的不同压电谐振片中存在的差异问题;
3、本发明通过在基片上穿孔,将压电谐振片设置于穿孔中,并在压电谐振片与基片之间设置柔性粘合层,这样,柔性粘合层与基片的硬基质层组成声波干扰阻断层,除压电谐振片的工作电极及背面电极最外端通过低温导电银胶与基片上的接口端子连接,且低温导电银胶上覆盖有柔性粘合层,压电谐振片唯一接触的材料为软性材料,且仅在影响压电谐振片性能最小的最外周与柔性粘合层接触,因此柔性粘合层在与压电谐振片粘合过程中不会产生应力或仅产生微小的应力。柔性粘合层(软性材料)不仅能消除或大大减少压电谐振片固定过程应力的产生,减少阻尼,隔离其他非生物相容材料和细胞等生物材料的接触,同时和基片组成双层声波干扰阻断层,更好的阻断相邻压电谐振片产生的声波相互干扰,解决了现有技术中存在的多个压电谐振片之间存在声波互相干扰的问题,且由于压电谐振片的工作电极及背面电极引线所在区域为穿孔基板,引线间干扰小,不会产生寄生振荡,同时也解决了现有技术中压电谐振片固定过程的刚性连接所产生的接触应力和因为单片压电晶片尺寸的限制而不能实现高通量的问题;
4、本发明同时也可以根据要求进行不同性能(如不同频率)压电谐振片阵列的组合,及添加额外的测定模块(如光学和电化学工作站)以应对不同需求。比如,可选择不同厚度或频率的石英晶体,利用声波频率越高,所探测的耦合界面层越薄;声波频率越低,所探测的耦合界面层越厚的特性,可用于细胞不同结构的探测与研究(如图4所示)。石英晶体的频率范围可为0.5-400MHz。将这些不同基频等特性的晶体固定于同一基片上即可实现细胞不同结构力学性能等的同时测定与研究,这是现有其它技术与方法无法实现的。
附图说明
图1为本发明高通量压电谐振芯片结构示意图。
图2为本发明高通量压电谐振芯片测量系统结构示意图。
图3为本发明高通量压电谐振芯片抗干扰状态与传统压电谐振芯片抗干扰状态对比图,图中A表示传统压电谐振阵列;B表示刚性连接的抗声波耦合压电谐振阵列;C表示本发明柔性连接抗声波耦合压电谐振阵列,图中曲线表示声波干扰,箭头表示应力。
图4表示不同基频高通量压电谐振芯片测定细胞不同深度结构状态示意图。
图5为本发明八通道压电谐振芯片检测池与常规QCM井型池动态电阻比较图。
图6为本发明压电谐振片对不同浓度蔗糖水溶液的频移响应图。
图7为本发明压电谐振片对不同浓度蔗糖水溶液的动态电阻响应图。
图8为本发明压电谐振片对H9C2细胞黏附及诺考达唑的响应图。
图9为本发明压电谐振芯片对H9C2细胞黏附Y27632、紫杉醇、维拉帕米的响应图。
图10为本发明压电谐振芯片抗干扰实验结果图,图中:每隔120s分别向四个通道加入120μL去离子水,结果表明当通道进行质量加载时对相邻通道无明显影响。
具体实施方式
下面结合附图与实例对本发明作进一步说明。
如图1所示,本发明高通量压电谐振芯片1一实施例包括至少两个压电谐振片101和基片108,基片108上开设多个穿孔,穿孔直径大小略大于压电谐振片101直径。压电谐振片101置于基片108的穿孔内,且压电谐振片101周围使用柔性粘合层106连接基片108,压电谐振片101的上、下两面经铬粘附层102分别连接工作电极103及背面电极104,且工作电极103及背面电极104的一端经低温导电银胶105与印刷电路107连接。压电谐振片101的背面电极104的底部设有后盖109,以有效防止环境干扰。
上述实施例中,基片108上开设的是穿孔,但并不局限于此,基片108上开设的也可是使用透明材料制成的半穿孔结构。上述实施例中的铬粘附层102也可用钛粘附层代替。
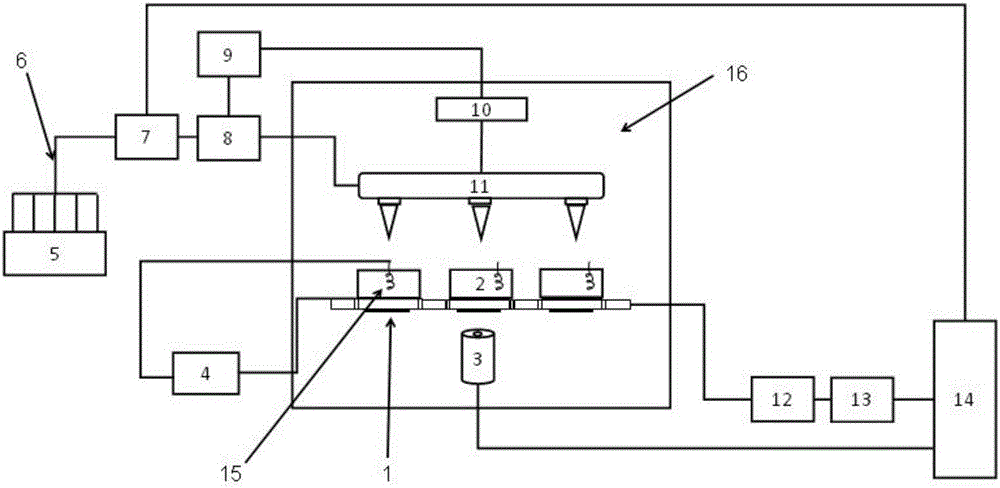
如图2所示,本发明高通量压电谐振芯片测量系统一实施例包括:1:高通量压电谐振芯片;2:检测池;3:光学/荧光显微镜;4:电化学工作站;5:样品池;6:聚合物输送管;7:流式细胞仪;8:蠕动泵;9:第一控制器;10:动力驱动系统;11:排枪移液器;12:第二控制器;13:振荡电路或其它测试系统;14:计算机;15:对电极;16:实验环境控制箱。
所述高通量压电谐振芯片1放置在实验环境控制箱16中,且高通量压电谐振芯片1的各压电谐振片101上面分别设置检测池2,各检测池2的上方分别设置对电极15及排枪移液器11,高通量压电谐振芯片1的下方设置光学/荧光显微镜3。电化学工作站4的一端选择性连接一个或多个检测池2的对电极15,另一端连接相应检测池2的压电谐振片101的工作电极,并经第二控制器12、振荡电路或其它测试系统13连接计算机14的输入端;样品池5经聚合物输送管顺序连接流式细胞仪7、蠕动泵8及排枪移液器11,第一控制器连接蠕动泵8及用于驱动排枪移液器11移动的动力驱动系统10,从而可以将样品池5中的样品按照要求量经排枪移液器11导入各检测池2中;计算机14的输出控制端连接流式细胞仪7和光学/荧光显微镜3。
下面以八通道压电谐振芯片为例说明本发明的高通量压电谐振芯片1的各项性能:
首先用网络/阻抗分析仪测定八通道石英晶体压电谐振芯片的等效参数,结果如表一所示。
表1八通道压电谐振芯片各通道在空气中的谐振频率与等效参数
由上表可见,安装好后八通道压电谐振芯片的各压电谐振片的谐振频率变化小于2KHz,其它等效电路参数变化也很小,特别是动态电阻只有31Ω左右,变动范围不超过±10Ω。因此,相同工艺、同一批次所制备的石英晶体本身相互差异很小,经过704硅胶粘合剂固定后引起的石英晶体参数变化也较小,特别是晶体动态电阻或阻尼值及变动范围较之常规通过O形圈接触、螺丝拧紧固定的QCM池子的动态电阻与变动范围要小得多(如图5所示)。
在进行八通道压电谐振芯片蔗糖浓度实验时,通过培养控制箱将温度控制在20℃,分别往4个不同通道检测池(由于现有QCA922石英晶体分析仪仪器软件功能的限制,只能同时测量4个通道)加入200μL不同浓度的蔗糖溶液,等待数据稳定后,记录QCM信号采集处理分析仪在计算机上显示的频率和电阻的变化。通过该温度下不同蔗糖浓度对应的粘度(η)密度(ρ)得出频移、动态电阻变化与(ρη)1/2的回归曲线。如图6和图7所示,各通道压电谐振芯片对(ρη)1/2都有很好的线性响应,且通道之间差异性不大。
在进行八通道压电谐振芯片对H9C2大鼠心肌细胞黏附及随后对药物诺考达唑响应实验时,用80℃30%H2O2:98%H2SO4=1:3的混合液清洗压电谐振片工作电极表面30s,并用去离子水将检测池内部冲洗干净,然后用氮气吹干,步骤重复3次。将400μL培养基加入2h、待数据平稳后,分别向每个通道加入20000H9C2细胞。待24h后加入诺考达唑溶液至最终浓度均为2μmol/L。图8A给出了其中一个通道的典型响应,可见加入细胞后,开始QCM频率下降、动态电阻增加,之后两者变化均有所回落而慢慢趋于稳定。加入诺考达唑后,晶体频率上升、电阻下降,对应CVI增加,表明细胞在诺考达唑作用下变硬,该结论与文献中其它技术所得出的结论一致。图8B给出了不同通道之间细胞黏附及随后药物作用引起的最终频移与动态电阻变化,可见各通道间的变化趋势一致、且变化范围波动不大。通道1-4细胞在诺考达唑作用下引起的CVI增加幅度分别为:0.06,0.08,0.1.0.1(Ω/Hz),变硬的趋势与大小也比较一致。
上述结果表明所研制的八通道压电谐振芯片从本身各压电谐振片之间的微小差异、不同通道压电谐振片对溶液粘密度响应的一致性、对细胞黏附的程度与药物作用引起的响应程度都证明本发明所提出的压电谐振芯片制造方法是可行的,并可拓宽至更高通量压电谐振芯片的制造。
在进行八通道压电谐振芯片检测H9C2细胞对不同药物的响应实验时,用80℃30%H2O2:98%H2SO4=1:3的混合液清洗芯片电极表面30s,并用去离子水将检测池冲洗干净,然后用氮气吹干,步骤重复3次。将400μL培养基加入2h待数据平稳后,分别向每个通道加入20000H9C2细胞。待24h后加入Y27632、紫杉醇、维拉帕米分别至最终浓度3μmol/L、10μmol/L、10μmol/L,不同药物作用下的QCM响应曲线如图9中的A-C所示,根据采集的数据,计算细胞的粘弹性指数CVI,得出以下结论:高通量压电谐振芯片可研究细胞对不同药物的响应,不同药物的响应能通过CVI的变化情况来反应。如本实例结果所示,Y27632与维拉帕米使细胞变软、而紫杉醇使细胞有所变硬,这些结果亦与文献中已报道的结果一致。
在进行八通道压电谐振芯片抗声波干扰实验时,将运行稳定的气相压电谐振芯片,每隔120s分别向四个通道加入100μL去离子水。以检验通道进行质量加载时是否对相邻通道造成影响。图10结果表明当通道进行质量加载时对相邻通道无明显影响。
- 还没有人留言评论。精彩留言会获得点赞!