一种包载紫杉醇胶束纳米簇及其制备方法与流程
本发明属生物医药技术领域,涉及一种包载紫杉醇胶束纳米簇及其制备方法;所述包载紫杉醇胶束纳米簇为一种延长聚合物胶束体内循环时间并有效发挥肿瘤EPR效应的胶束纳米簇,可提高肿瘤治疗作用。
技术背景
现有技术公开了紫杉醇(PTX)是一线广谱抗肿瘤药物,通过促进纺锤体微管蛋白的聚合,抑制解聚,保持微管蛋白稳定,从而抑制肿瘤细胞有丝分裂过程,进而起到抗肿瘤作用,疗效显著;但其在水中的溶解度小于1ug/m。所述紫杉醇上市制剂主要是利用PEG-PLA胶束系统增加紫杉醇的给药剂量,两亲性材料在水溶液中能够形成具有球形的内核-外壳结构的共聚物胶束,其内核作为疏水性药物的容器,将紫杉醇增溶在内部,降低其毒副作用,外壳对药物起保护作用,使其不易被网状内皮系统吞噬,提高药物的稳定性,避免了传统制剂中增溶剂聚氧乙烯蓖麻油的使用,从而可明显降低紫杉醇注射液的过敏性、血液毒性,提高药物使用的安全性。但实践显示,所述较并没有增加肿瘤部位的相对药物蓄积,反而略少于且的体内循环时间较缩短,不能给紫杉醇到达肿瘤部位发挥疗效提供足够的时间。
研究显示,实体肿瘤具有增强渗透与滞留效应(EPR),由于相对较强的毛细血管渗透性,纳米粒子在肿瘤组织的相对蓄积增加;然而,EPR效应的发挥对于纳米粒子的粒径有一定的限制。据报道,平均粒径10nm的紫杉醇胶束与游离的紫杉醇相比几乎没有显示出任何EPR效应;与平均粒径大于300nm或小于50nm 的纳米粒子相比,粒径为100nm和200nm的粒子显示出更高的蓄积;平均粒径为100nm的粒子显示出更长的体内循环以及相对低的单核巨噬细胞摄取量。虽然,所述紫杉醇PEG-PLA胶束具有该体系特有的优势,但由于大部分聚合物胶束的粒径较小(10~50nm),不能有效发挥肿瘤EPR效应,因此,构建一种新型的聚合物胶束结构,即聚合物胶束纳米簇,在维持原有胶束结构不变的前提下,通过交联反应形成较大的亲水性聚合物骨架来承载胶束从而形成胶束聚集体,既可以保证胶束原有结构不变维持原有胶束的载药能力,又可以将体系粒径增大至100nm左右来发挥肿瘤EPR效应,从而提高紫杉醇给药体系的有效性和安全性。
所述TPGS是一种非离子表面活性剂,可用作增溶剂、吸收促进剂、乳化剂、沉淀抑制剂以及作为药物的载体等被广泛应用于制剂研究中。当前有报道,TPGS能够提高紫杉醇生物利用度,提高紫杉醇的治疗效果,以及作为p-gp抑制剂逆转肿瘤多药耐药。
所述聚乙稀亚胺(PEI),是一种具有功能性的水溶性大分子,主要分为两种结构形式:树枝状和直线状;相对分子质量从数百至几十万不等,其大分子链上拥有大量的氨基,不仅为胶束提供了稳定存在的屏障,且使体系表面带上了正电荷和功能性基团,为纳米颗粒的表面多功能修饰提供了可行性。
技术实现要素:
本发明的目的是提供一种包载紫杉醇胶束纳米簇;所述包载紫杉醇胶束纳米簇为一种新型的聚合物胶束结构,即聚合物胶束纳米簇;该纳米簇在保证原有聚合物胶束结构不变的基础之上,能有效地增大体系粒径,延长体内循环时间,增加肿瘤EPR效应,从而提高该药临床应用的有效性和安全性。
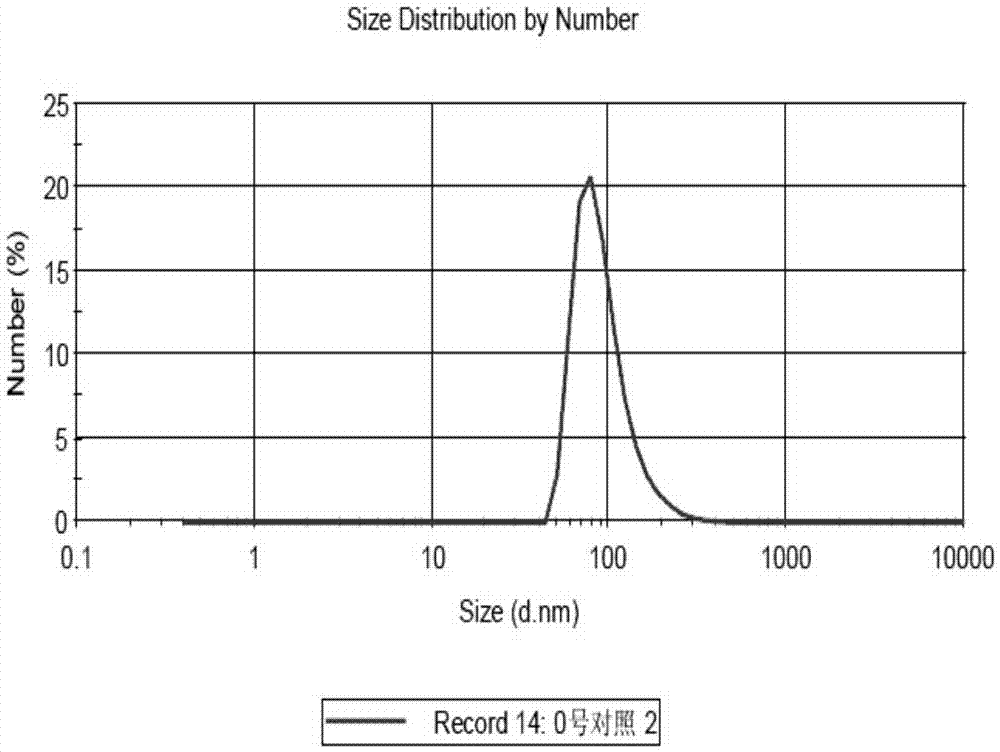
本发明所述包载紫杉醇胶束纳米簇,采用TPGS与PEI构建亲水性交联网状 骨架,使聚合物胶束穿插其中从而增大体系粒径,并通过IgG中和表面正电荷并增加体系亲水性,制得包载紫杉醇胶束纳米簇;该包载紫杉醇胶束纳米簇的粒径为100nm左右;本发明中,取稀释后的胶束和包载紫杉醇胶束纳米簇溶液适量,滴加在覆盖碳膜的铜网上,2.0%磷钨酸负染,室温干燥后置于透射电镜下观察,粒径分别为15nm,100nm左右(分别如图1、图2所示)。
本发明的另一目的是提供所述包载紫杉醇胶束纳米簇的制备方法;
本发明所述包载紫杉醇胶束纳米簇的制备方法,采用乳化超声法制备胶束纳米簇,包括以下的步骤:
(1)紫杉醇和载体材料充分溶解于有机溶剂中a,材料和紫杉醇形成均匀的溶液Ⅰ;
(2)所述溶液Ⅰ旋转蒸发除去有机溶剂a,制得载体和药物薄膜;
(3)将上述薄膜水化,制得聚合物胶束溶液Ⅱ;
(4)在所述聚合物胶束溶液Ⅱ中加入PEI溶液,在搅拌下加入含TPGS-CDI的有机溶剂b,形成白色乳液Ⅲ;
(5)将上述白色乳液Ⅲ水浴超声,旋转蒸发除去有机溶剂b,得到溶液Ⅳ;
(6)所述溶液Ⅳ在搅拌下加入IgG溶液,室温搅拌1h得到胶束纳米簇溶液Ⅴ,置于4℃冰箱备用,制得包载紫杉醇胶束纳米簇。
本发明中,制备所述聚合物胶束的聚合物材料为PEG2000-PLA,且经试验显示,其他材料形成的胶束均难以达到理想的载药量;其中,所述的PEG2000-PLA,PEG的分子量为2000,与PLA的嵌段比为(40:60)~(60:40),即PLA的分子量为1333~3000,总分子量在3333~5000;
本发明所述制备方法中,所述PEI的分子量在600~25000Da;
本发明所述制备方法中,所述的TPGS为D-a-Vitamin E和PEG的酯化产物,其中PEG的分子量为500~5000;本发明中也可采用分子量在500~5000的PEG或含有分子量在500~5000的PEG的大分子;
本发明所述制备方法中,所述胶束载体材料紫杉醇与PEG-PLA的质量比为(1:5)~(1:1000);
本发明所述制备方法中,优选通过乳化超声法形成乳液;
本发明中,制备所述胶束纳米簇的方法为薄膜分散法,但并不局限于该方法,也可以采用透析法、乳化法或冻干法;
本发明所述制备方法中,所述胶束载体材料PEG-PLA与胶束纳米簇骨架材料的质量比为(5:1)~(1:1000);
本发明所述制备方法中,所述有机溶剂a选自二氯甲烷、三氯甲烷、四氢呋喃、乙腈、乙醚、丙酮、甲醇或乙醇的任意一种;
本发明所述制备方法中,所述有机溶剂b选自二氯甲烷或三氯甲烷中的任一种;
本发明所述制备方法中,所述白色乳液Ⅲ中水相和有机相的体积比为(2:1)~(20:1);
本发明所述制备方法中,所得胶束以动态光散射法测定的粒径范围为10nm-30nm;
本发明所述制备方法中,所得胶束纳米簇以动态光散射法测定的粒径范围为50nm-200nm;
本发明所述制备方法中,所述步骤⑵中旋转蒸发温度为25℃~60℃;
本发明所述制备方法中,所述步骤⑶中水化介质选自去离子水、生理盐水或PBS的任意一种;
本发明所述制备方法中,所述步骤⑸中水浴超声时间为5~60min;
本发明所述制备方法中,所述步骤⑸中旋转蒸发温度为25~60℃;
本发明所述制备方法中,所述IgG是免疫球蛋白G,是血清主要的抗体成分,是一种亲水性小分子,也可采用其他带负电的亲水性小分子。
本发明还进行了评估包载紫杉醇胶束纳米簇对A549和RAW细胞摄取药物影响的实验:结果显示,A549细胞摄取1h后胶束纳米簇的PTX浓度显著强于普通胶束,而RAW细胞的PTX浓度显著低于普通胶束;所述紫杉醇PEG-PLA胶束纳米簇对A549细胞株的IC50值为2.39±0.63ng/ml;结果表明,所述A549细胞对胶束纳米簇的摄取量显著多于普通胶束,而RAW细胞的摄取量显著低于普通胶束;证实,制得的该胶束纳米簇可以减少巨噬细胞吞噬,增加其在肿瘤细胞的相对蓄积(如图3所示)。
本发明采用MTT法考察空白载体材料对A549肿瘤细胞的毒性,结果显示,胶束纳米簇对A549的IC50值大于500ng/ml,表明所述胶束纳米簇的载体材料生物相容性较好(如图4所示)。
本发明采用MTT法分别考察载紫杉醇胶束纳米簇对A549肿瘤细胞的细胞毒作用,结果显示,3种紫杉醇制剂的IC50值排序为胶束纳米簇﹤普通胶束﹤游离紫杉醇,两两之间均具有显著性差异(P<0.05);结果表明,制得的胶束纳米簇能提高紫杉醇的细胞毒性(如图5所示)。
本发明以DiR荧光标记胶束和胶束纳米簇示踪其在体内的分布行为,结果 如图7所示,给药后随着时间的延长胶束纳米簇在肿瘤部位有明显的蓄积,且较胶束的蓄积更加明显;结果表明,由于粒径增大胶束纳米簇的EP R效应显著增加。
本发明以健康SD大鼠为模型,通过静脉注射对其进行药动学评价,结果如图7所示,通过该方法所制得的紫杉醇PEG-PLA胶束纳米簇对大鼠静脉注射的药动学过程符合二室模型,其中t1/2为412.93±120.21min,CL的范围在0.012±0.003L/min/kg之间;结果表明,其符合二室模型,与普通胶束相比,用带负电的小分子中和之后的胶束纳米簇能明显延长体内循环时间;
本发明以荷有A549皮下瘤的裸鼠为动物模型,通过静脉给予普通胶束和胶束纳米簇,进行体内药效学评价,给药12天后处死裸鼠并分离皮下瘤,结果显示所述胶束纳米簇对A549肿瘤的药效明显优于普通胶束(如图6所示)。
本发明的包载紫杉醇胶束纳米簇,与市售的普通紫杉醇胶束相比,具有入戏优点;
能在保证紫杉醇PEG-PLA胶束系统高载药量基础之上,延长体系体内循环时间,增强EPR效应,从而增加其在肿瘤部位的相对蓄积,减少药物的不良反应,提高抗肿瘤的治疗效果。
附图说明
图1为紫杉醇PEG-PLA胶束的粒径分布图。
图2为紫杉醇胶束纳米簇的粒径分布图。
图3为紫杉醇PEG-PLA胶束的透射电镜照片,制备的胶束分布均匀,形态圆整。
图4为紫杉醇胶束纳米簇的透射电镜照片,制备的胶束纳米簇分散均匀,且 无团聚现象。
图5为紫杉醇胶束纳米簇的稀释稳定性。考察指标为胶束纳米簇粒径,在一定的稀释范围内,紫杉醇胶束纳米簇的稳定性良好。
图6为RAW细胞对紫杉醇PEG-PLA胶束和紫杉醇胶束纳米簇的摄取量。
图7为A549肿瘤细胞对紫杉醇PEG-PLA胶束和紫杉醇胶束纳米簇的摄取量。
图8为空白胶束纳米簇材料对A549肿瘤细胞的细胞毒评价。
图9为游离紫杉醇(Free PTX)、紫杉醇普通胶束和紫杉醇胶束纳米簇分别对A549细胞的细胞毒作用。
图10为健康SD大鼠静脉滴注胶束纳米簇(PNMC)的药动学曲线(n=6)。
图11为DiR示踪的普通胶束(DiRPEG-PLA micelles;DM)和胶束纳米簇(DiR micelles nanocluster;DMNC)分别在不同时间在荷A549皮下瘤小鼠的体内分布。
图12为荷皮下瘤裸鼠静脉注射普通胶束和胶束纳米簇12天后的离体瘤比较。
具体实施方式
下面结合实施例对本发明做详细说明,但本发明的保护范围不局限于下述实施例。
实施例1:
称取50mg PEG-PLA、10mg紫杉醇,加入4ml乙腈,超声使载体材料和药物充分溶解。将该溶液置于旋转蒸发仪40℃下旋蒸30min将有机溶剂彻底蒸干,室温下置于真空干燥箱中过夜,除去残留少量溶剂得干燥透明的药膜骨架,然后加入10ml去离子水在500rpm转速下恒速搅拌30min,将水化液过0.22μm醋酸 纤维素酯滤膜,得到紫杉醇PEG-PLA胶束溶液,500rpm转速搅拌下在紫杉醇PEG-PLA胶束溶液中加入0.5%PEI 200μl,并滴加1ml含有20mgTPGS-CDI的二氯甲烷溶液,将所得乳浊液乳化超声30min,并于40℃下旋蒸除去有机溶剂,加入1mg IgG,室温孵育1h,制得包载紫杉醇胶束纳米簇。
实施例2:
称取70mg PEG-PLA、10mg紫杉醇,加入4ml二氯甲烷,超声使载体材料和药物充分溶解,将该溶液置于旋转蒸发仪40℃下旋蒸30min将有机溶剂彻底蒸干,室温下置于真空干燥箱中过夜,除去残留少量溶剂得干燥透明的药膜骨架,然后加入10ml去生理盐水在500rpm转速下恒速搅拌30min。将水化液过0.22μm醋酸纤维素酯滤膜,得到紫杉醇PEG-PLA胶束溶液,500rpm转速搅拌下在紫杉醇PEG-PLA胶束溶液中加入0.5%PEI 200μl,并滴加1ml含有20mgTPGS-CDI的二氯甲烷溶液,将所得乳浊液乳化超声30min,并于30℃下旋蒸除去有机溶剂,加入1mg IgG,室温孵育1h,制得包载紫杉醇胶束纳米簇。
实施例3:
称取100mg PEG-PLA、30mg紫杉醇,加入4ml二氯甲烷,超声使载体材料和药物充分溶解,将该溶液置于旋转蒸发仪50℃下旋蒸30min将有机溶剂彻底蒸干,室温下置于真空干燥箱中过夜,除去残留少量溶剂得干燥透明的药膜骨架,然后加入15ml生理盐水在500rpm转速下恒速搅拌30min。将水化液过0.22μm醋酸纤维素酯滤膜,得到紫杉醇PEG-PLA胶束溶液,500rpm转速搅拌下在紫杉醇PEG-PLA胶束溶液中加入0.5%PEI 300μl,并滴加1ml含有20mgPEG-CDI的三氯甲烷溶液,将所得乳浊液乳化超声30min,并于40℃下旋蒸除去有机溶剂,加入1.5mg IgG,室温孵育1h,制得包载紫杉醇胶束纳米簇。
实施例4:
称取10mg PEG-PLA、2mg紫杉醇,加入4ml乙腈,超声使载体材料和药物充分溶解。将该溶液置于旋转蒸发仪30℃下旋蒸30min将有机溶剂彻底蒸干,室温下置于真空干燥箱中过夜,除去残留少量溶剂得干燥透明的药膜骨架。然后加入15ml去离子水在500rpm转速下恒速搅拌30min。将水化液过0.22μm醋酸纤维素酯滤膜,得到紫杉醇PEG-PLA胶束溶液。500rpm转速搅拌下在紫杉醇PEG-PLA胶束溶液中加入0.5%PEI 300μl,并滴加1.5ml含有40mgPEG-CDI的二氯甲烷溶液,将所得乳浊液乳化超声30min,并于40℃下旋蒸除去有机溶剂,加入1.5mg IgG,室温孵育1h,制得包载紫杉醇胶束纳米簇。
实施例5:
称取50mg PEG-PLA、2mg紫杉醇,加入4ml乙腈,超声使载体材料和药物充分溶解。将该溶液置于旋转蒸发仪40℃下旋蒸30min将有机溶剂彻底蒸干,室温下置于真空干燥箱中过夜,除去残留少量溶剂得干燥透明的药膜骨架,然后加入10ml生理盐水在500rpm转速下恒速搅拌30min。将水化液过0.22μm醋酸纤维素酯滤膜,得到紫杉醇PEG-PLA胶束溶液,500rpm转速搅拌下在紫杉醇PEG-PLA胶束溶液中加入0.5%PEI 200μl,并滴加1ml含有40mgTPGS-CDI的三氯甲烷溶液,将所得乳浊液乳化超声30min,并于50℃下旋蒸除去有机溶剂,加入1mg IgG,室温孵育1h,制得包载紫杉醇胶束纳米簇。
实施例6:
称取20mg PEG-PLA、2mg紫杉醇,加入4ml乙腈,超声使载体材料和药物充分溶解,将该溶液置于旋转蒸发仪30℃下旋蒸30min将有机溶剂彻底蒸干,室温下置于真空干燥箱中过夜,除去残留少量溶剂得干燥透明的药膜骨架,然后加入 20ml PBS(Ph7.4)在500rpm转速下恒速搅拌30min,将水化液过0.22μm醋酸纤维素酯滤膜,得到紫杉醇PEG-PLA胶束溶液,500rpm转速搅拌下在紫杉醇PEG-PLA胶束溶液中加入0.5%PEI 200μl,并滴加1ml含有40mgTPGS-CDI的三氯甲烷溶液,将所得乳浊液乳化超声30min,并于40℃下旋蒸除去有机溶剂,加入1mg IgG,室温孵育1h,制得包载紫杉醇胶束纳米簇。
实施例7:
称取20mg PEG-PLA、2mg紫杉醇,加入4ml乙腈,超声使载体材料和药物充分溶解,将该溶液置于旋转蒸发仪30℃下旋蒸30min将有机溶剂彻底蒸干,室温下置于真空干燥箱中过夜,除去残留少量溶剂得干燥透明的药膜骨架,然后加入10ml生理盐水在500rpm转速下恒速搅拌30min。将水化液过0.22μm醋酸纤维素酯滤膜,得到紫杉醇PEG-PLA胶束溶液,500rpm转速搅拌下在紫杉醇PEG-PLA胶束溶液中加入0.5%PEI 200μl,并滴加1ml含有40mgTPGS-CDI的三氯甲烷溶液,将所得乳浊液乳化超声30min,并于40℃下旋蒸除去有机溶剂,加入1mg IgG,室温孵育1h,制得包载紫杉醇胶束纳米簇。
实施例8:
称取20mg PEG-PLA、2mg紫杉醇,加入4ml乙腈,超声使载体材料和药物充分溶解,将该溶液置于旋转蒸发仪30℃下旋蒸30min将有机溶剂彻底蒸干,室温下置于真空干燥箱中过夜,除去残留少量溶剂得干燥透明的药膜骨架,然后加入20ml PBS(pH7.4)在500rpm转速下恒速搅拌30min。将水化液过0.22μm醋酸纤维素酯滤膜,得到紫杉醇PEG-PLA胶束溶液,500rpm转速搅拌下在紫杉醇PEG-PLA胶束溶液中加入0.5%PEI 200μl,并滴加1ml含有40mgTPGS-CDI的三氯甲烷溶液,将所得乳浊液乳化超声30min,并于40℃下旋蒸除去有机溶剂,加入1mg IgG, 室温孵育1h,制得包载紫杉醇胶束纳米簇。
实施例9:
称取50mg PEG-PLA、10mg紫杉醇,加入4ml乙腈,超声使载体材料和药物充分溶解,将该溶液置于旋转蒸发仪40℃下旋蒸30min将有机溶剂彻底蒸干,室温下置于真空干燥箱中过夜,除去残留少量溶剂得干燥透明的药膜骨架,然后加入10ml PBS(pH7.4)在500rpm转速下恒速搅拌30min。将水化液过0.22μm醋酸纤维素酯滤膜,得到紫杉醇PEG-PLA胶束溶液。500rpm转速搅拌下在紫杉醇PEG-PLA胶束溶液中加入0.5%PEI 200μl,并滴加2ml含有20mgTPGS-CDI的三氯甲烷溶液,将所得乳浊液乳化超声30min,并于40℃下旋蒸除去有机溶剂,加入1mg IgG,室温孵育1h,制得包载紫杉醇胶束纳米簇。
实施例10:
称取50mg PEG-PLA、10mg紫杉醇,加入4ml乙腈,超声使载体材料和药物充分溶解,将该溶液置于旋转蒸发仪40℃下旋蒸30min将有机溶剂彻底蒸干,室温下置于真空干燥箱中过夜,除去残留少量溶剂得干燥透明的药膜骨架,然后加入20ml去离子水在500rpm转速下恒速搅拌30min。将水化液过0.22μm醋酸纤维素酯滤膜,得到紫杉醇PEG-PLA胶束溶液。500rpm转速搅拌下在紫杉醇PEG-PLA胶束溶液中加入0.5%PEI 400μl,并滴加5ml含有20mgTPGS-CDI的三氯甲烷溶液,将所得乳浊液乳化超声30min,并于40℃下旋蒸除去有机溶剂,加入4mg IgG,室温孵育1h,制得包载紫杉醇胶束纳米簇。
实施例11:
称取50mg PEG-PLA、12.5mg紫杉醇,加入4ml乙腈,超声使载体材料和药物充分溶解,将该溶液置于旋转蒸发仪40℃下旋蒸30min将有机溶剂彻底蒸干, 室温下置于真空干燥箱中过夜,除去残留少量溶剂得干燥透明的药膜骨架,然后加入10ml去离子水在500rpm转速下恒速搅拌30min,将水化液过0.22μm醋酸纤维素酯滤膜,得到紫杉醇PEG-PLA胶束溶液。500rpm转速搅拌下在紫杉醇PEG-PLA胶束溶液中加入0.5%PEI 400μl,并滴加0.5ml含有40mgTPGS-CDI的二氯甲烷溶液,将所得乳浊液乳化超声30min,并于50℃下旋蒸除去有机溶剂,加入1mg透明质酸,室温孵育1h,制得包载紫杉醇胶束纳米簇。
实施例12:
细胞摄取定量检测:按照载体与药物的比例分别制备5μg/ml的紫杉醇PEG-PLA胶束和5μg/ml的紫杉醇胶束纳米簇,并在37℃下孵育1h;
将对数生长期的A549细胞以1×105cells/pore的密度接种于6孔板,待细胞贴壁后用PBS洗涤细胞单层2遍,加入不含FBS的DMEM培养液,在37℃孵育30min;孵育结束后吸出培液,用预冷的PBS浸洗3遍,每孔加入紫杉醇PEG-PLA胶束和5μg/ml的紫杉醇胶束纳米簇各1ml,平行操作3份,在37℃孵育3h,孵育结束后,快速除去药物,用预冷的PBS洗涤细胞单层3遍,加入400μl的蒸馏水,用细胞刮取器轻轻的将细胞刮下转移到EP管中,取100μl细胞样品,加入200μl甲醇探头超声提取细胞内PTX,于10000rpm离心5min,取上清液采用HPLC法测定细胞内PTX含量,去剩余部分的细胞样品用BCA法测定细胞内的蛋白含量;将每孔PTX的含量除以相应孔的蛋白含量,用以消除每孔细胞数量带来的误差。
实施例13:
用含FBS培液稀释紫杉醇胶束纳米簇至含紫杉醇0.001μg/ml~10μg/ml的系列浓度,制剂对照组为:(a)同浓度范围的紫杉醇溶液(溶解于含1.0%DMSO的PBS中);(b)同样浓度范围的紫杉醇PEG-PLA胶束;将人非小细胞肺癌细胞A549 以5×103cells/pore的密度接种到96孔培养板中,培养24h后,按以上实验方案给予含药溶液,平行操作六份,在常规培养条件下直接培养96h,培养结束后用MTT法计算细胞生长抑制率并求半数抑制浓度IC50值;结果表明,所述包载紫杉醇胶束纳米簇组的IC50显著小于PEG-PLA胶束组,所述胶束纳米簇确实可以增大粒径提高紫杉醇的细胞毒性。
实施例14:
将荷A549皮下瘤裸鼠随机分成4组,每组6只,分别设为生理盐水(saline)对照组、Taxol组(PTX:10mg/kg)、PEG-PLA胶束组(PTX:10mg/kg)和胶束纳米簇组(PTX:10mg/kg),于0、4、8天进行给药,实验第12天,处死裸鼠,剥离肿瘤,拍照并称瘤重,根据以下公式计算肿瘤生长抑制百分率(IRT%):
其中Wtreated为治疗组的平均瘤重,Wcontrol为对照组的平均瘤重。
结果表明,所述包载紫杉醇胶束纳米簇组的肿瘤抑瘤率明显高于普通胶束,在体内产生良好的治疗肿瘤的药效。
- 还没有人留言评论。精彩留言会获得点赞!