HGF的冻干配制品的制作方法
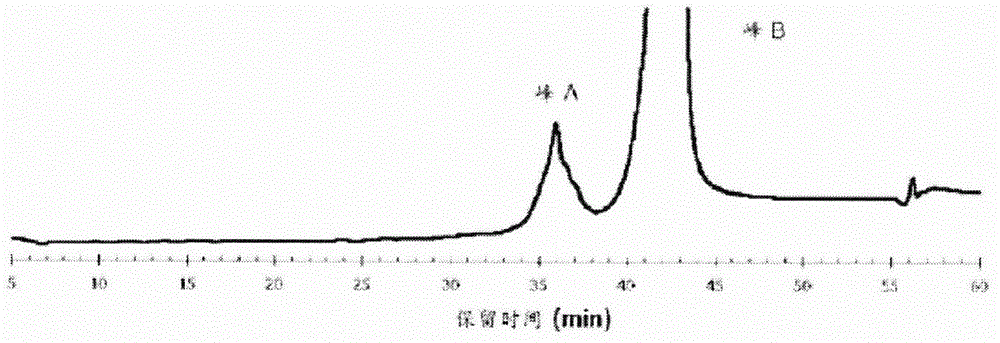
本发明涉及一种包含肝细胞生长因子的冻干配制品。背景肝细胞生长因子(HGF)是一种生物活性肽,具有肝实质细胞增殖活性并且已经在多种动物物种中发现。在人类中,已经在来自患有暴发性肝炎患者的血浆中发现人肝细胞生长因子(hHGF)(专利文献1),并且近年来,重组人肝细胞生长因子(rhHGF)已经可以通过生物技术大规模生产(非专利文献1)。预期这些肝细胞生长因子可以用作通过增加正常肝实质细胞而针对肝炎和肝硬化有效的治疗和预防剂,并且由于其多种生物活性,可以用作肾衰竭及胃、十二指肠、皮肤等由抗癌剂的副作用引起的病损的治疗剂。包含肝细胞生长因子的冻干配制品已经披露于专利文献2中,该专利公开包括一种肝细胞生长因子以及一种稳定剂例如甘氨酸、丙氨酸、山梨醇、甘露醇或葡聚糖硫酸盐。专利文献3披露了一种冻干配制品,包括一种浓度低至小于5mg/mL的、适合于药物的肝细胞生长因子,该配制品包括稳定剂例如精氨酸、赖氨酸、组氨酸、谷氨酸或天冬氨酸。专利文献4披露了一种冻干配制品,包括一种肝细胞生长因子以及一种稳定剂例如纯蔗糖。引文列表专利文献[专利文献1]专利公开JP-A-S63-22526[专利文献2]专利公开JP-A-H9-25241[专利文献3]WO2000/072873[专利文献4]WO2008/102849非专利文献[非专利文献1]《自然》(Nature),342卷,440-443页,1989发明概述本发明将解决的问题然而,目的在于增加肝细胞生长因子稳定性的、包括披露于专利公开JP-A-H9-25241、WO2000/072873以及WO2008/102849中的肝细胞生长因子的冻干配制品仍未提供足够的储存稳定性。此外,尚未知如何抑制与肝细咆生长因子关联的杂质的生成或如何保持包含肝细胞生长因子的冻干配制品中的储存前同种型比率。因此本发明目标在于提供一种冻干配制品,该冻干配制品相较于传统冻干配制品具有改进的肝细胞生长因子储存稳定性。用于解决该问题的手段本发明的诸位发明人已经进行了大量的研究以实现上述目标并且结果发现可能使用一种冻干配制品实现该目标,该冻干配制品包括(1)一种肝细胞生长因子,(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐。由此诸位发明人完成了本发明。本发明提供了以下内容:[1]一种冻干配制品,该冻干配制品包括(1)一种肝细胞生长因子,(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐;[2]一种用于生产冻干配制品的方法,该方法包括以下步骤:(I)在添加(1)一种肝细胞生长因子之前,调节一种水性溶液的pH为pH4.5至6.5,该水性溶液至少包括(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐;并且制备一种水性溶液,该水性溶液包括(1)该肝细胞生长因子,(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐;并且(II)将步骤(I)中获得的、包含肝细胞生长因子的水性溶液冻干;[3]一种方法,该方法通过将(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐包含于含有(1)肝细胞生长因子的冻干配制品中来稳定肝细胞生长因子;[4]一种方法,该方法通过将(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐包含于含有(1)肝细胞生长因子的冻干配制品中来稳定肝细胞生长因子,以抑制肝细胞生长因子聚集体的生成、抑制与肝细胞生长因子关联的杂质的生成和/或保持储存前同种型比率;[5]一种方法,该方法通过将(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐包含于含有(1)肝细胞生长因子的冻干配制品中来稳定肝细胞生长因子,以抑制肝细胞生长因子聚集体的生成;[6]一种方法,该方法通过将(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐包含于含有(1)肝细胞生长因子的冻干配制品中来稳定肝细胞生长因子,以抑制与肝细胞生长因子关联的杂质的生成;[7]一种方法,该方法通过将(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐包含于含有(1)肝细胞生长因子的冻干配制品中来稳定肝细胞生长因子,以保持肝细胞生长因子的储存前同种型比率;以及[8]如以上描述的项目[1]至[7],其中该肝细胞生长因子具有由SEQIDNO:1表示的氨基酸序列。有利作用本发明可以提供一种冻干配制品,该冻干配制品相较于传统冻干配制品具有改进的肝细胞生长因子储存稳定性。附图简要说明图1是与肝细胞生长因子关联的杂质的代表性色谱图;图2是肝细胞生长因子同种型的代表性色谱图;图3显示在测试实例2中初始以及在60℃储存1个月后测试的冻干配制品中可溶性聚集体的量;图4显示在测试实例3中初始以及在60℃储存1个月后测试的冻干配制品中杂质的总量;图5显示相对于在测试实例4中初始以及在60℃储存1个月后测试的冻干配制品中的同种型,峰B的比率;图6显示相对于在测试实例4中测试的冻干配制品中的同种型,海藻糖含量与峰B的比率之间的相关性;并且图7显示相对于在测试实例4中测试的冻干配制品中的同种型,精氨酸含量与峰B的比率之间的相关性。实施方式的说明在下文中详细描述了本发明的实施例。本发明不限于下文描述的实施例并且在发明范围内可以进行不同的修改。本发明的冻干配制品包括(1)一种肝细胞生长因子,(2)海藻糖以及(3)一种或多种选自下组的化合物(下文也称作“化合物(3)”),该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐。用于在本发明中使用的肝细胞生长因子是一种具有促进肝实质细胞生长的活性的蛋白质,并且不具体受限,只要其被纯化一定程度可以用作一种药物。例如,可以参见专利公开JP-A-H11-56382。该肝细胞生长因子可以是组织器官(例如哺乳动物的肝脏、脾脏、和肾脏)或流体组织(例如血浆和血清)中天然存在的那些中的任一种,或是被改性为具有变体氨基酸序列和/或变体碳水化合物链的那些中的任一种。哺乳动物的实例包括人、大鼠、兔、乳牛、马、绵羊等,其中人是优选的。人肝细胞生长因子的氨基酸序列的实例包括SEQIDNO:1。该肝细胞生长因子可以提取并纯化自组织器官(例如哺乳动物的肝脏、脾脏、和肾脏)以及流体组织(例如血浆和血清),或分离自产该肝细胞生长因子的细胞。该肝细胞生长因子可以通过向一种适当的宿主细胞引入一种适当的载体(其中已经通过基因工程技术整合了编码该肝细胞生长因子的多核苷酸)来获得。该载体不具体受限,只要其允许表达编码肝细胞生长因子的多核苷酸。该载体的实例包括具有选择标记(是针对抗生素例如新霉素具有抗性的基因)的载体、具有编码二氢叶酸还原酶(DHFR)或谷氨酰胺合成酶(GS)的基因的载体等,其可以在动物细胞中扩增,其中优选pCI载体(可获得自普洛麦格公司(Promega))以及pcDNA载体(可获得自英杰公司(Invitrogen))。该宿主细胞不具体受限,只要其允许使用载体进行转化并且允许重组肝细胞生长因子进行表达。宿主细胞的实例包括大肠杆菌、枯草芽孢杆菌、酵母菌、丝状真菌、植物细胞、昆虫细胞、动物细胞等,其中优选动物细胞并且特别优选中国仓鼠卵巢(CHO)细胞。通过基因工程技术获得的肝细胞生长因子可以是,例如,无具体限制的重组肝细胞生长因子。例如,可以参见专利公开JP-A-H3-285693。所用的肝细胞生长因子可以是,例如,获得自为CHO细胞的宿主细胞的重组人肝细胞生长因子(rhHGF)。肝细胞生长因子可以是,在改性的氨基酸序列保留该肝细胞生长因子的活性的范围内,通过天然存在的肝细胞生长因子的氨基酸序列中的一个或多个,优选1个至10个氨基酸残基的取代、缺失、添加或插入或其组合改性的改性肝细胞生长因子、改性的肝细胞生长因子可以是与天然存在的肝细咆生长因子的氨基酸序列具有,例如,80%,优选85%,更优选90%并且仍更优选95%同源性的肝细胞生长因子。例如,可以参见WO90/010651、专利公开JP-A-H4-030000以及专利公开JP-A-H5-111383。冻干之前肝细胞生长因子的浓度不具体受限并且可以是例如,5mg/mL或更低,优选3mg/mL或更低并且更优选1mg/mL或更低。向患者胃肠外给予本发明的冻干配制品。当冻干配制品用于肺部给予时,本发明的冻干配制品在使用之前进行溶解并且通过喷雾器向患者进行给予。当冻干配制品用于注射时,本发明的冻干配制品在使用之前进行溶解并且向患者静脉内、皮下、或肌内给予。通过溶解冻干配制品获得的水性溶液中肝细胞生长因子的浓素不具体受限并且可以是例如,5mg/mL或更低。用于溶解本发明的冻干配制品的水不具体受限,只要它是医疗实践中使用的水即可,并且其实例包括注射用水、已灭菌的纯化水、盐水等。用于在本发明中使用的海藻糖不具体受限,只要它被纯化为药学上可接受的程度并且其实例包括海藻糖酐、海藻糖水合物等。海藻糖水合物的实例包括但不具体受限于列于《日本药典》(JapanesePharmacopoeia)第16版等中的海藻糖水合物(海藻糖二水合物)。添加至该冻干配制品中的海藻糖的量是这样的以使得肝细胞生长因子与海藻糖(在该段落的下文中,表述为相当于海藻糖酐的量)之间的质量比是,例如,1∶4至1∶460,优选1∶4至1∶370并且更优选1∶8至1∶280。可替代地,基于就固体物质而言该冻干配制品的总质量是按质量计100.0份,海藻糖是,例如,按质量计20.0至95.0份并且优选是按质量计30.0至94.0份。此外,在通过溶解冻干配制品获得的、包含1.0mg/mL的肝细胞生长因子的水性溶液中,海藻糖的浓度是,例如,4.0mg/mL至460.0mg/mL并且优选是8.0mg/mL至280.0mg/mL。用于在本发明中使用的化合物(3)选自下组,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐。该化合物(3)不具体受限,只要它被纯化为药学上可接受的程度。可以使用一种或两种或更多种化合物(3)。鉴于聚集体或杂质生成的抑制,化合物(3)优选地是一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐。化合物(3)包括作为一种碱性物质的精氨酸、组氨酸、赖氨酸和葡甲胺并且优选地是一种或多种选自精氨酸、组氨酸和赖氨酸的化合物。添加至冻干配制品中的化合物(3)的量可以在如下浓度范围内,该范围允许肝细胞生长因子在用于生产该冻干配制品的、包含肝细胞生长因子的水性溶液中、或在通过溶解该冻干配制品获得的、包含肝细胞生长因子的水性溶液中溶解而不聚集。添加至冻干配制品中的化合物(3)的量是这样的以使得肝细胞生长因子与化合物(3)(在该段落的下文中,表述为相当于游离态的量)之间的质量比是,例如,1∶1至1∶50,优选1∶1至1∶40并且更优选1∶2至1∶35。可替代地,基于就固体物质而言该冻干配制品的总质量是按质量计100.0份,化合物(3)的量是,例如,按质量计1.5至60.0份并且优选是按质量计3.0至59.0份。此外,在通过溶解冻干配制品获得的、包含1.0mg/mL的肝细胞生长因子的水性溶液中,化合物(3)的量是,例如,1.0mg/mL至50.0mg/mL,优选是1.0mg/mL至40.0mg/mL并且更优选是2.0mg/mL至35.0mg/mL。在本发明中化合物(3)可以是其药学上可接受的盐。药学上可接受的盐的实例包括盐酸盐、乙酸盐、钠盐、钾盐、镁盐等。在本发明中,在一种包括(1)肝细胞生长因子的冻干配制品中,通过进一步包括(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐,可以相较于传统冻干配制品改进肝细胞生长因子的储存稳定性。如在此使用的,储存稳定性是指抑制肝细胞生长因子聚集体的生成、抑制与肝细胞生长因子关联的杂质的生成和/或保持储存前同种型比率。本发明提供了一种方法,该方法通过将(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐包含于含有(1)肝细胞生长因子的冻干配制品中来稳定肝细胞生长因子。即本发明提供了一种方法,该方法通过将(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐包含于含有(1)肝细胞生长因子的冻干配制品中来稳定肝细胞生长因子,以抑制肝细胞生长因子聚集体的生成。本发明还提供了一种方法,该方法通过包含(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐来稳定肝细胞生长因子,以抑制含有(1)肝细胞生长因子的冻干配制品中与肝细胞生长因子关联的杂质的生成。本发明进一步提供了一种方法,该方法通过将(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐包含于含有(1)肝细胞生长因子的冻干配制品中来稳定肝细胞生长因子,以保持肝细胞生长因子的储存前同种型比率。如在此使用的,术语“聚集体”是指肝细胞生长因子的聚集体并且其实例包括可溶性聚集体(例如二聚体和三聚体)以及通过相互作用生成的不可溶性聚集体。在本发明中,聚集体的量可以通过,例如,经尺寸排阻色谱法测量可溶性聚集体的量来评估。在本发明中,可溶性聚集体的量,例如,当针对储存在60℃1个月后的冻干配制品经由尺寸排阻色谱法评估聚集体的量时,是例如,小于1.4%并且优选是1.0%或更低。可替代地,针对储存在60℃1个月后的冻干配制品经由尺寸排阻色谱法测量的聚集体的量是储存之前聚集体的量的例如,4.6倍或更低,优选4倍或更低,更优选3.5倍或更低并且仍更优选3倍或更低。不可溶性聚集体的量可以通过以下方法进行评估,针对相对较大(具有1μm或更大尺寸)的不可溶性聚集体,通过《日本药典》第16版中描述的在不可溶性颗粒物质测试中的不透光度法或微流成像法,并且针对具有小于1μm或更低尺寸的不可溶性聚集体,通过光散射法或超速离心法。如在此使用的,术语“杂质”(“impurity”或“impurities”)是指对应于反相色谱法中观察到的除肝细胞生长因子峰之外的一个或多个峰的一种或多种物质。通过反相色谱法评估杂质的量。例如,针对在本说明书实例中使用的冻干配制品,如图1中所示的,观察到了在保留时间为10分钟左右的两个峰(下文分别称为“ImpA”和“ImpB”)以及除ImpA和ImpB之外的、在保留时间为6至7分钟左右的其他杂质的峰(下文成为“其他imp”)。在本发明中,其他杂质的量,例如,当针对储存在60℃1个月后的冻干配制品经由反相色谱法评估杂质的量时,是例如,1.7%或更低,优选1.5%或更低,更优选1.3%或更低并且仍更优选1.0%或更低。可替代地,针对储存在60℃1个月后的冻干配制品经由反相色谱法测量的杂质的量是储存之前杂质的量的例如,小于9倍,更优选7倍或更低,更优选5倍或更低并且仍更优选3倍或更低。如在此使用的,术语“同种型”是指肝细胞生长因子的电荷变体(chargevariant)并且是指具有不同电荷状态的多种蛋白质。同种型比率可以,例如,通过离子交换色谱法进行评估。例如,针对在本说明书实例中使用的冻干配制品,如图2中所示的,观察到了在保留时间为35至45分钟处的两个峰(下文分别称为“峰A”和“峰B”)。如在此使用的,术语“同种型比率”是指每种同种型相对于同种型总量的比例。本发明中肝细胞生长因子的生物活性可以根据在转化生长因子β-1(TGFβ-1)存在下评估貂肺上皮细胞(Mv.1.Lu细胞)或4BMr5细胞的增殖的、基于细胞的测定进行评估(参见《免疫方法杂志》(JournalofImmnologicalMethods).258卷,1-11页,2001等)并且可以被表示为50%有效浓度(EC50)。储存期间冻干配制品的生物活性的变化可以表示为通过用储存之后的EC50除以储存之前的EC50获得的相对滴度(%)。为了保持用于生产冻干配制品的、包含肝细胞生长因子的水性溶液或通过溶解冻干配制品获得的、包含肝细胞生长因子的水性溶液的恒定pH,该冻干配制品可包含一种缓冲剂。在本发明中使用的缓冲剂不具体受限,只要它是药学上可接受的,并且其实例包括磷酸、磷酸二氢钠、磷酸二氢钠一水合物、柠檬酸水合物、柠檬酸钠水合物、柠檬酸二钠、乙酸、冰乙酸、乙酸钠水合物、碳酸钠水合物、碳酸氢钠、甘氨酸、甘氨酰甘氨酸等。缓冲剂通常以缓冲溶液的形式使用,常用的缓冲溶液是例如磷酸盐缓冲溶液、柠檬酸缓冲溶液以及乙酸缓冲溶液。依据冻干前包含肝细胞生长因子的水性溶液的浓度,冻干配制品中的缓冲剂的量是例如1至100mM。通过调节浓度至这个范围,可以实现通过溶解该冻干配制品获得的、包含肝细胞生长因子的水性溶液的恒定pH。取决于pH,肝细胞生长因子具有变化的溶解度,其中最低限度的溶解度在等电点左右。因此当考虑到等电点时,可以选择pH,以使得肝细胞生长因子可以在用于生产该冻干配制品的、包含肝细胞生长因子的水性溶液中、或在通过溶解该冻干配制品获得的、包含肝细胞生长因子的水性溶液中溶解而不聚集。在本发明中,在本说明书中的实例中使用的肝细胞生长因子例如,在做为等电点的中性pH左右具有0.1至0.2mg/mL的最低溶解度并且在pH5左右具有1.6mg/mL或更高的溶解度。因此,冻干前的水性溶液以及通过溶解冻干配制品获得的水性溶液具有的pH是例如,4.5至6.5并且优选是5.0至6.0。在本发明的用于生产肝细胞生长因子的冻干配制品的方法中,除缓冲剂之外可以使用一种pH调节剂以调节冻干前的水性溶液的pH。在本发明中使用的pH调节剂不具体受限,只要它是药学上可接受的,并且其实例包括盐酸、无水柠檬酸、柠檬酸水合物、柠檬酸钠水合物、甘氨酸、丁二酸、乙酸、冰乙酸、乙酸钠水合物、酒石酸、氢氧化钠、碳酸氢钠、碳酸钠水合物、干碳酸钠、单乙醇胺、三乙醇胺、乳酸、乳酸钠、磷酸、磷酸氢钠水合物、无水磷酸一氢钠、磷酸二氢钠、无水磷酸二氢钠、磷酸二氢钠晶体、磷酸三钠、磷酸氢二钾、磷酸二氢钾等。为了防止待给予的药物溶液中肝细胞生长因子含量的下降(归因于冻干配制品重构后肝细胞生长因子吸附于组成容器的玻璃或树脂上),冻干配制品可以包含一种表面活性剂。在本发明中使用的表面活性剂不具体受限,只要它是药学上可接受的,并且其实例包括非离子型表面活性剂,具体包括聚山梨酯80、聚山梨酯20、泊洛沙姆、聚乙二醇、HCO-40、HCO-60等。在通过溶解冻干配制品获得的、包含1.0mg/mL的肝细胞生长因子的水性溶液中,表面活性剂在冻干配制品中的量是,例如,0.020至1.0mg/mL,优选0.050至1.0mg/mL,更优选0.075至0.5mg/mL并且仍更优选0.075至0.2mg/mL。基于就固体物质而言冻干配制品的总质量是按质量计100.0份,本发明的冻干配制品包括按质量计0.1至4.5份的肝细胞生长因子,按质量计20.0至95.0份的海藻糖(在该段落的下文中,表述为相当于海藻糖酐的量)以及按质量计1.5至60.0份的化合物(3)(在该段落的下文中,表述为相当于游离态的量)。在一个实施例中,基于就固体物质而言冻干配制品的总质量是按质量计100.0份,肝细胞生长因子按质量计占0.3至4.4份,海藻糖按质量计占30.0至94.0份并且化合物(3)按质量计占3.0至59.0份。在另一个实施例中,肝细胞生长因子按质量计占0.3至4.4份,海藻糖按质量计占30.0至94.0份,化合物(3)按质量计占3.0至59.0份并且聚山梨酯80按质量计占0.026至0.7份。在本发明中,如果需要的话,冻干配制品可以进一步包括一种添加剂,例如运载体、张度剂以及抗氧化剂。一种用于生产本发明的冻干配制品的方法,该方法包括以下步骤:(I)在添加(1)一种肝细胞生长因子之前,调节一种水性溶液的pH为pH4.5至6.5,该水性溶液至少包括(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐;并且制备一种水性溶液,该水性溶液包括(1)该肝细胞生长因子,(2)海藻糖以及(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐;并且(II)将步骤(I)中获得的、包含肝细胞生长因子的该水性溶液冻干。本发明的冻干配制品可以通过该生产方法生产。在步骤(I)中,将包括至少(3)一种或多种选自下组的化合物,该组由以下各项组成:精氨酸、组氨酸、赖氨酸、葡甲胺、谷氨酸、天冬氨酸、脯氨酸、肌酸、肌酸酐、三(羟甲基)氨基甲烷、及其药学上可接受的盐的水性溶液的pH调节至pH4.5至6.5并且优选调节至pH5.0至6.0。在调节pH之前,该水性溶液可以包含(2)海藻糖但不包含(1)肝细胞生长因子。即,在将包括至少化合物(3)的水性溶液的pH调节至pH4.5至6.5之后,向其中添加(1)肝细胞生长因子或向其中同时或顺序地添加(1)肝细胞生长因子以及(2)海藻糖。为了调节pH,可以使用缓冲剂和/或pH调节剂。在pH调节过程中,反应温度不具体受限。可以通过溶解化合物(3)于一种溶剂中来制备包括至少化合物(3)的水性溶液。用于制备包括至少化合物(3)的水性溶液的溶剂不具体受限,只要其是例如,药学上可接受的水。其实例包括注射用水、已灭菌的纯化水等。(1)肝细胞生长因子和(2)海藻糖能以原样或以水性溶液的形式添加。用于制备水性溶液的溶剂可以与用于制备包括至少化合物(3)的水性溶液的溶剂相同或不同。在(1)肝细胞生长因子和(2)海藻糖的添加过程中,温度不具体受限。在步骤(I)中,如果需要的话,可以添加表面活性剂、其他添加剂(运载体、张度剂、抗氧化剂等)等。在步骤(II)中,将步骤(I)中获得的、包含肝细胞生长因子的水性溶液冻干。在将包含肝细胞生长因子的水性溶液倾倒入小瓶或安瓿中之后,该包含肝细胞生长因子的水性溶液可以根据常用方法冻干。优选地是包含肝细胞生长因子的水性溶液通过经由过滤器等的过滤进行灭菌并冻干。冻干方法的实例包括包含如下三单元操作的一种方法:一个冰冻步骤,用于在常压下冷却并冷冻;一个初级干燥步骤,用于在减压下升华并干燥未与溶质结合的自由水;以及一个次级干燥步骤,用于去除溶质中固有的吸附水和结晶水(可以提及《日本药学技术》(Pharm.Tech.Japan),8卷,1期,75-87页,1992等以供参考)。冷冻步骤过程中的温度是,例如,-40℃或更低。初级干燥步骤过程中的温度是,例如,-20℃至10℃。次级干燥步骤过程中的温度是,例如,20℃至30℃。减压是例如,10Pa或更低。如在此使用的,术语“块状物(cake)”是指冻干配制品中的多孔固体物质。可以通过多孔结构或块状物的颜色或冻干配制品在水中的溶解度的目视观察或由此获得的水性溶液的目视观察来评估该冻干配制品的特征。本发明的冻干配制品总体上是可接受的白色块状物并且在水中快速溶解以给出一种澄澈且无色的水性溶液。另一方面,潜在地归因于可能衍生自肝细胞生长因子等的不可溶性聚集体的生成,通过溶解传统冻干配制品获得的水性溶液可能是浑浊的。由此通过溶解冻干配制品获得的水性溶液的特征可以指示不可溶性聚集体的生成。冻干配制品储存后水性溶液澄澈的事实意味着不可溶性聚集体的生成受到抑制。实例通过不限制本发明的实例,在下文中更加详细地描述本发明。基于专利公开JP-A-H11-056382中披露的氨基酸序列信息,通过完全合成一种基因、将该基因并入到一种载体中、在CHO细胞中表达蛋白质并且分离和纯化该蛋白质来制备在本发明实例中使用的肝细胞生长因子。(实例1至25和对比实例1至7)通过下文描述的方法制备实例和对比实例中的冻干配制品。表1至4指出包含肝细胞生长因子的每mL各水性溶液中多种组分的量(mg)。表中的值四舍五入至小数点后一位。以范围从100mL至250mL的体积制备包含肝细胞生长因子的水性溶液。<混合缓冲液的制备>根据包含肝细胞生长因子的每种水性溶液的体积以及表1至4中指出的浓度,混合除肝细胞生长因子或聚山梨酯80之外的组分并用适当量的注射用水(包含肝细胞生长因子的水性溶液体积的约80%)搅拌。目视确认溶解之后,用盐酸和/或氢氧化钠将pH调节至5.5并且用注射用水调节体积以给出一种混合缓冲液。<包含肝细胞生长因子的水性溶液的制备>通过以下程序制备包含肝细胞生长因子的水性溶液。(a)通过使用上述混合缓冲液超滤,调节包含肝细胞生长因子的水性溶液以获得如表1中指出的肝细胞生长因子的浓度。在紫外-可见光分光光度计(使用具有1cm的光程的池)上测量在280nm处的吸光度之后,根据以下公式(A)计算肝细胞生长因子的浓度:蛋白质浓度(mg/mL)=(A280/1.73)×D(A)其中:A280:在280nm处的吸光度;1.73∶0.1%浓度的样品溶液在1cm的光程以及在280nm处的理论吸光度;并且D:测量时的稀释因子。(b)其后添加聚山梨酯80从而获得表1中指出的所希望的浓度,随后通过经由无菌过滤器进行过滤(产品名称:MILLEXGV0.22μm过滤器,可获得自密理博公司(Millipore))以给出包含肝细胞生长因子的水性溶液。<冻干步骤>将该包含肝细胞生长因子的水性溶液以1mL分到5-mL玻璃小瓶中,然后将这些玻璃小瓶用橡皮帽部分闭合。根据表5中指出的程序冻干之后,将每个小瓶用橡皮帽完全闭合。然后将铝帽附接至该玻璃小瓶以给出冻干配制品。对比实例5是根据WO2000/072873中披露的配方生产的冻干配制品。对比实例6是根据WO2008/102849中披露的配方生产的冻干配制品。(测试实例1)根据以下程序,针对冻干配制品的特征、冻干配制品在注射用水中的溶解度以及溶解后获得的水性溶液的特征检查实例1至11和对比实例1至6的所获得的冻干配制品。<方法>在1000至3000勒克斯的环境中,在白色和黑色背景下目视观察每种获得的冻干配制品(块状物的形成以及色调)。然后向每种冻干配制品中添加注射用水(1mL),接着将其静置,之后目视观察冻干配制品的溶解度和所获得溶液的颜色。表6中指出的术语“速溶”是指配制品在1分钟之内完全溶解并且术语“微溶”是指配制品在甚至1分钟之后未完全溶解。<结果>实例1至4和对比实例1至6的样品的结果示于表6中。实例1至4形成白色块状物并且显示更好的溶解度。包含木糖醇的对比实例1以及包含山梨醇的对比实例3不形成块状物并且是白色或无色的熔融固体。不包含糖类的对比实例5是白色固体,无针对冻干配制品通常观察到的块状物形成。实例5至11也形成了类似于实例1至4的白色块状物并且显示更好的溶解度。表6将所获得的冻干配制品在25℃、40℃或60℃下储存在恒温室中持续2周或1个月,随后进行以下测试。(测试实例2)如下评估实例1至25和对比实例1至7中可溶性聚集体的量。<方法>在冰冷却下向实例和对比实例的每种冻干配制品中添加注射用水(1mL)以用于溶解。将该溶液适度震荡以获得匀质溶液,随后静置5分钟。将所获得的溶液分散到250-μL小瓶插入物,将这些插入物放置于HPLC小瓶以获得样品。在以下分析条件下针对储存之前以及之后可溶性聚集体的量通过尺寸排阻色谱法对每种样品进行测量并且通过面积百分比法计算可溶性聚集体的量。检测器:UV280nm;柱:保护柱(商标名:TSKgelG3000SWXL,可获得自东曹公司(TosohCorporation));柱温:30℃;流动相:通过溶解39g的磷酸二氢钠、87.5g的氯化钠以及5.0g的月桂基硫酸钠于5000mL的水中并用2mol/L氢氧化钠溶液调节该溶液的pH至7.5获得;进样50L;并且流速:1mL/min。<结果>初始(储存之前)以及在25℃、40℃或60℃下储存2周或1个月之后的样品中可溶性聚集体的量的测量结果示于表7至9中。初始以及在60℃下储存1个月之后的、实例1至4和对比实例1至6的样品中可溶性聚集体的量的测量结果示于图3中。此外,冻干配制品中海藻糖含量与可溶性聚集体的量之间的相关性示于表10中。根据表7,对比实例1至6的可溶性聚集体的量随着储存期和储存温度的增加而增加。在60℃下储存1个月之后,可溶性聚集体的量显著增加。同时根据表7和8,如在对比实例中的、可溶性聚集体的量的这样一种显著变化在所测试的储存条件下针对实例1至11未观察到。由此可溶性聚集体的生成在实例1至11中受到抑制,甚至是在60℃的储存条件下。根据表9和10,在不包含海藻糖的对比实例7中,可溶性聚集体的量显著增加。而针对包含不同量的肝细胞生长因子的实例12至15以及包含不同量的精氨酸的实例23至25,未观察到可溶性聚集体的量的显著变化。表7表8表9表10(测试实例3)如下评估实例1至25和对比实例1至7中杂质的量。<方法>使用的样品是在HPLC小瓶中的、制备以用于可溶性聚集体的量的评估的那些。在以下分析条件下针对储存之前以及之后杂质的量通过反相色谱法对每种样品进行测量并且通过面积百分比法计算杂质的量。检测器:UV215nm;柱:反相柱(商标名:InertsilWP300-C8,可获得自GL科学公司(GLSciencesInc.)),附接有GLCart保护柱;柱温:40℃;流动相A:水/三氟乙酸(1000∶1);流动相B:乙腈/三氟乙酸(1000∶0.85);进样:25μL;流速:1mL/min;并且梯度:流动相B相对于流动相A和流动相B的总量的体积比:15%(初始)-70%(27.5min)-70%(30min)-15%(30.01min)-15%(35min)。<结果>初始(储存之前)以及在25℃、40℃或60℃下储存2周或1个月之后的实例1至11和对比实例1至6的样品中杂质的量的测量结果示于表11和12中。初始以及在60℃下储存1个月之后的、实例1至4和对比实例1至6的样品中杂质的总量的测量结果示于图4中。根据表11,在25℃和40℃的储存条件下实例1至4中杂质的总量未显著变化。根据表11和12,甚至是在60℃的储存条件下,实例1至11中杂质的总量相对于初始值增加至多两倍,而所有对比实例的配制品中量的增加都是几乎10倍或更高。在60℃的储存条件下,发现所有对比实例的配制品中ImpA、ImpB以及其他imp中任一者都增加。由此杂质的生成在实例1至11中受到抑制,甚至是在60℃的储存条件下。在实例12至25中,在任何储存条件下都未观察到杂质总量的显著变化。表11表12(测试实例4)如下评估实例1至25和对比实例1至7中的同种型比率。<方法>使用的样品是在HPLC小瓶中的、制备以用于聚集体的量的评估的那些。在以下分析条件下针对储存之前以及之后的同种型的量通过离子交换色谱法对每种样品进行测量并且通过面积百分比法计算同种型比率。检测器:UV215nm;柱:商标名:AgilentBioSCXNP5PK,可获得自安捷伦科技公司(AgilentTechnologies);柱温:30℃;流动相A:50mmol/LTris-HCl缓冲液(pH9.0);流动相B:50mmol/LTris-HCl缓冲液(pH9.0),1mol/LNaCl进样:50μL;流速:0.5mL/min;并且梯度:相对于流动相A和流动相B的总量的流动相B的体积比:20%(初始)-60%(50min)-80%(51min)-80%(60min)-20%(60.01min)-20%(80min)。<结果>同种型的量的变化的测量结果表示为相对于初始(储存之前)以及在25℃、40℃或60℃下储存2周或1个月之后的样品中峰A和峰B的总和而言的峰B的比率,示于表13至15中。同种型比率的变化的测量结果表示为初始以及在60℃下储存1个月之后的、实例1至4和对比实例1至6的样品中峰B的比率,示于图5中。此外,冻干配制品中海藻糖含量与峰B的比率之间的相关性示于图6中并且精氨酸含量与峰B的比率之间的相关性示于图7中。根据表13和14,在所测试的储存条件下,在实例1至11和对比实例5中几乎未观察到峰B的同种型比率的变化,而在60℃的储存条件下,在其他对比实例中峰B的同种型比率显著变化。由此同种型比率变化在实例1至11中受到抑制,甚至是在60℃的储存条件下。在对比实例1中,储存后观察到显著变化,即,峰A的同种型被消除,使得所检测的同种型仅是峰B并且观察到不是同种型的一个峰。根据图6,发现峰B的同种型比率随着配制品中海藻糖含量的增加而下降。类似地,针对不包含海藻糖的对比实例7的配制品,也观察到了峰B的同种型比率的下降。根据图7,发现在60℃的储存条件下持续1个月后峰B的同种型比率随着配制品中精氨酸含量的下降而下降。同时根据配制品中肝细胞生长因子的含量变化,未观察到同种型比率变化。表13表14表15(测试实例5)如下评估实例1至25和对比实例1至7中不可溶性聚集体的量。<方法>向每种冻干配制品中添加注射用水(1mL),将该冻干配制品静置并且然后稀释于注射用水或每种安慰剂水性溶液中以给出样品。在流动颗粒成像分析仪上针对储存前和储存后不可溶性微粒的数量对每种样品进行测量,并且根据以下公式计算不可溶性微粒的数量:微粒的数量(数量/小瓶)=P×1000×V/(n×v)其中:P:检测的颗粒的数量;V:样品溶液的体积(mL);n:测量数;并且v:每一测量的样品的体积。<结果>初始(储存之前)以及在60℃下储存2周或1个月之后的实例1至11和对比实例1至6的样品中不可溶性聚集体的量的测量结果示于表16和17中。根据表16,在60℃下储存1个月之后,在对比实例1至6中的不可溶性聚集体的量增加。同时根据表16和17,如在对比实例中的、不可溶性聚集体的量的这样一种显著变化针对实例1至11未观察到。由此不可溶性聚集体的生成在实例1至11中受到抑制,甚至是在60℃的储存条件下持续1个月。针对实例12至25未观察到不可溶性聚集体的量的显著变化。表16表17(测试实例6)如下评估实例1、对比实例5和对比实例6的生物活性。<方法>培养貂肺上皮细胞(Mv.1.Lu细胞),确认细胞活力,并且然后以1×105/mL制备细胞溶液。向96-孔测定板的每个孔中添加转化生长因子β-1(TGFβ-1)的溶液并且向每个孔中添加肝细胞生长因子浓度为0.125、0.25、0.5、1、2、4、8、16、32、64或128ng/mL的样品溶液。然后添加1×105/mL的细胞溶液并且将该板在5%二氧化碳孵育箱中在37℃下孵育69小时。向该板添加可获得自东仁分子技术公司(DojindoMolecularTechnologies,Inc.)的细胞计数试剂盒(CellCountingKit)(10μL),然后将该板孵育3小时并且针对在450nm处的吸光度进行测量。相对于样品中的HGF浓度(横轴),将所获得的吸光度绘制在纵轴上,并且使用分析软件(SoftMaxPro,可获得自分子设备公司(MolecularDevices))、采用平行线分析以及4参数回归分析计算这些样品的EC50。通过用储存之后的EC50除以储存之前的EC50计算相对滴度(%)。<结果>在60℃下储存1个月之后的、实例1和对比实例5和6的样品中EC50的相对滴度示于表18中。根据表18,在60℃下储存1个月之后,针对对比实例5和6观察到相对滴度的下降。同时针对实例1未观察到相对滴度的下降,表明甚至是在60℃的储存条件下持续1个月之后仍保持生物活性。表18实例1对比实例5对比实例6相对滴度(%)1018045工业实用性本发明的冻干配制品之所以具有工业实用性是因为它可以提供具有高质量的医疗实用肝细胞生长因子配制品。序列表自由文本SEQIDNO:1表示人肝细胞生长因子的氨基酸序列。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1