用于生物医学应用的可控的自退火微凝胶颗粒的制作方法
本申请要求于2014年7月17日提交的美国临时专利申请第62/025,844号、于2014年10月3日提交的第62/059,463号以及于2015年1月13日提交的第62/103,002号的优先权。依据35 U.S.C.§119要求优先权。通过引证将上述专利申请并入本文,如同在本文中完全阐述一样。
技术领域
本技术领域总体上涉及伤口治疗的领域,并且特别地涉及微凝胶颗粒(microgel particle)和包含该颗粒的支架(scaffold)用于治疗和密封伤口以及用于组织填料应用的用途。
背景技术:
与组织的产生和再生有关的中心原理是集体细胞迁移(一种整个细胞网络一起移动至发育区域以促进功能组织形成的过程)。研究人员寻求研发伤口愈合剂;然而,这些材料表现出批次与批次间的变化性并且表现出降解速率,这限制了对于生长组织的延长的结构支持。合成材料相比天然材料是更加可调节的,并且它们的机械性能已设计为允许与广泛的组织类型一起使用。然而,尽管具有这种可调节性,但是合成的可注射生物材料被限制为无孔或纳米孔支架(需要物理降解用于细胞通过材料迁移)。含有预形成的微尺度(microscale)的相互连接孔的多孔合成水凝胶允许更大的细胞迁移率而不需要降解,避免了在细胞迁移率和无孔支架固有的材料稳定性之间的权衡。孔形成的典型模式包括致去除孔剂的毒性,或包封的微颗粒的降解,这需要这些构建体离体浇铸,防止它们像可注射生物材料一样与周围组织无缝整合或需要长期体内发展以解决多孔结构。例如,Healionics公司开发了自身描述为球形模板神经再生(STAR)的技术,其中STAR支架通过将可控尺寸的填充珠(packed bead)阵列烧结在一起,将聚合物浇铸到珠之间的间隙空间(interstitial space)中以及溶解掉珠以产生相互连接的球形空隙的孔网络而形成。然而,如上所述,这些常规方法需要对致孔剂进行毒性去除。
技术实现要素:
人类皮肤伤口是对于公众健康和经济的不断增长的威胁,并且非常难以治疗。医生在治疗皮肤伤口时,设法保持该区域湿润,因为干燥伤口愈合比湿润伤口慢得多。为实现该目的,医生经常使用软膏填充伤口,就像用新的沥青填充坑洞一样。然而,这些和其他常规的伤口愈合的方法不能提供使新组织生长的最佳支架。结果,新的组织生长(如果有的话)相对缓慢和脆弱,导致更长的愈合时间,达到及时的愈合仅是可能的程度。
在工程化组织愈合的背景下,本发明人已经确定相互连接的微孔支架发展的黄金标准对于与周围组织的本体整合(大量整合,bulk integration)是必需的,该微孔支架允许相互连接的细胞网络和集体迁移,而不需要支架降解或侵入性的程序用于植入。事实上,为了最有效,本发明人已经确定这些材料应当促进集体细胞迁移,其介导再生,同时提供促进伤口愈合和小生境识别(niche recognition)的分子线索。此外,本发明人还确定了这些材料必须能够通过迁移细胞和天然基质无缝替换,提供替换前的稳定的结构支持,并且易于被递送至损伤部位并顺应损伤部位以使纤维化和炎症反应最小化。
本文提供了实施这些原理的系统、组合物、方法和装置并且提供了促进组织的快速再生同时维持伤口周围组织的结构支持的生物材料。实际上,在组织工程领域中,本发明人已经使用可流动或可注射的基于微凝胶、定制材料化学和均匀球形构建块(building block)(包括例如,人类头发宽度的构建块)的微流体制造,实现了对长期和未满足的医疗需求的解决方案。
本文所描述的技术利用化学来产生微小微凝胶,其可以被组装成大单元,同时保留用于细胞浸润的路径。结果是微观合成聚合物体(例如,球体)的填充簇附着在它们表面,类似于粘在一起的一罐口香糖。该填充簇产生填充在伤口中的微孔退火颗粒的支架(例如,多孔凝胶支架)。新组织快速生长至微凝胶颗粒之间的空隙中,并且随着微凝胶颗粒降解进入体内,新生长的组织的基质留在伤口曾经存在的地方。新组织继续生长,直到伤口完全愈合。
本文所描述的微凝胶体系代表了对常规产品的实质性改进。例如,本文中所描述的技术不需要添加生长因子以将细胞吸引到材料中。所描述的微凝胶网络的几何形状诱导细胞迁移到微凝胶中。
本发明人已经证明,所描述的微凝胶可以以先前未见的速率促进新细胞的生长和连接的细胞网络的形成。例如,在体内研究期间,在第一个48小时观察到显著的组织再生,与如今所使用的常规材料相比,在五天内具有更多的愈合。
本文所描述的技术可用于广泛的应用。例如,所公开的微凝胶技术可用于伤口应用,包括急性损伤,如撕裂和手术伤口闭合,以及更多慢性应用,如糖尿病性溃疡和大面积烧伤伤口。本文中所描述的水凝胶支架也可用于创伤情形,如战场或急诊室。
在某些方面,本文描述了包含微孔凝胶(microporous gel)的系统、组合物、方法和装置,该微孔凝胶包含含有多个微凝胶颗粒和交联剂(crosslinker)的水性溶液,该交联剂包括,例如可生物降解交联剂。本文所描述的微孔凝胶是可流动的和/或可注射的,并且可以以多种不同的方式施加,包括,例如局部施加,或者通过注射。注射和/或可流动的微孔凝胶可以经皮插入或插入至深部组织中。可流动的微孔凝胶也可局部给予至真皮和其它组织。
在一方面,当将退火剂(annealing agent)施加至多个微凝胶颗粒时,微凝胶颗粒形成其中具有间隙空间的微凝胶颗粒的共价稳定的支架。在某些应用中,系统、组合物、方法和装置被特别设计用于生物医学应用。在一些实施方式中,微孔凝胶颗粒进一步包含交联剂,其中该交联剂包括基质金属蛋白酶(matrix metalloprotease)(MMP)-可降解交联剂。在一种或多种实施方式中,退火剂包含因子XIIIa。在进一步的或另外的实施方式中,退火剂包含曙红Y、自由基转移剂或它们的组合。
在一些实施方式中,微凝胶系统、组合物、方法和装置进一步包括被配置为照射多个微凝胶颗粒和退火剂的混合物的光源。在一种或多种实施方式中,微孔凝胶颗粒包含暴露至它们的表面上的细胞粘附肽(cell adhesive peptide)。在一些实施方式中,微孔凝胶颗粒包含K-肽。在进一步或另外的实施方式中,微孔凝胶颗粒包含K肽,其含有因子XIIIa识别的赖氨酸基团。在一些实施方式中,微孔凝胶颗粒包含Q-肽。在一些实施方式中,Q肽包含因子XIIIa识别的谷氨酰胺基团。在某些实施方式中,微孔凝胶颗粒包含可降解交联剂。在某些实施方式中,微孔凝胶颗粒包含间隙空间,其包含显示负凹度(negative concavity)的边界表面。在一种或多种实施方式中,微凝胶颗粒的共价稳定的支架具有约10%至约50%的空隙体积(孔隙体积,void volume)。
在一种实施方式中,用于生物医学应用的微孔凝胶体系包括含有由可生物降解交联剂,如基质金属蛋白酶(MMP)-可降解交联剂形成的多个微凝胶颗粒的水性溶液以及退火剂,当将该退火剂应用于多个微凝胶颗粒时,导致微凝胶颗粒形成其中具有间隙空间的微凝胶颗粒的共价稳定的支架。
在另一种实施方式中,微孔凝胶系统包括递送装置和包含在水性溶液中并存储在递送装置中的可生物降解微凝胶颗粒的集合。退火剂或退火剂前体(annealing agent precursor)也存储在递送装置中。取决于所采用的具体实施方式,递送装置可以包含单个或多个隔室(compartment)。
在另一种实施方式中,治疗组织的方法包括向组织递送包含用细胞粘附肽修饰的多个微凝胶颗粒的水基溶液(aqueous-based solution),其中微凝胶颗粒由可生物降解交联剂,如基质金属蛋白酶(MMP)-可降解交联剂形成。将多个微凝胶颗粒暴露至退火剂,该退火剂使微凝胶颗粒退火以形成其中具有间隙空间的微凝胶颗粒的共价稳定的支架。
在另一实施方式中,用于生物医学应用的微孔凝胶系统包括通过以下各项的反应所形成的微凝胶颗粒的集合:具有一个或多个细胞附着部分(cell attachement moiety)的主链聚合物、一种或多种退火组分和可生物降解网络交联剂组分。微孔凝胶系统包括内源性或外源性退火剂,其通过退火组分将微凝胶颗粒原位连接在一起,以形成其中具有间隙空间的微凝胶颗粒的共价稳定的支架。
在另一方面,本文描述了包括递送装置或机构和微孔凝胶的系统、组合物、方法和装置。在某些实施方式中,递送装置包含含有多个微凝胶颗粒的水性溶液和退火剂或退火剂前体。在一种或多种实施方式中,递送装置包括单隔室递送装置(compartment delivery device),其包含水性溶液(包含多个微凝胶颗粒)和退火剂。在一种或多种实施方式中,递送装置包括多个(例如,双)隔室的递送装置,其中一个隔室包含含有多个微凝胶颗粒的水性溶液和第一退火剂前体,并且第二隔室包含含有多个微凝胶颗粒的水性溶液和第二退火剂前体。在某些实施方式中,微孔凝胶进一步包含含有至少一个D-氨基酸的(MMP)-可降解交联剂。在进一步或另外的实施方式中,微凝胶颗粒包含含有多个D-氨基酸的(MMP)-可降解交联剂。
在又一方面,本文描述了一种微孔凝胶系统,包括:递送装置;多个可生物降解微凝胶颗粒,其包含在水性溶液中并存储在递送装置中;和存储在递送装置中的退火剂或退火剂前体。在一种或多种实施方式中,微孔凝胶颗粒进一步包含两种或更多种类型的可生物降解微凝胶颗粒的集合,其包含在水性溶液中并存储在递送装置中。在某些实施方式中,递送装置包括两个隔室,可生物降解微凝胶颗粒存储在两个隔室中的每一个中,并且第一退火剂前体存储在一个隔室中,以及第二退火剂前体存储在另一隔室中,其中退火剂是通过存在的第一和第二退火剂前体形成。在一种或多种实施方式中,递送装置包括单隔室,并且可生物降解微凝胶颗粒的集合和退火剂都存储在单隔室中。在又进一步或另外的实施方式中,退火剂包含存储在单隔室中的光引发剂和自由基转移剂。在进一步或另外的实施方式中,微孔凝胶系统进一步包含发光装置,其配置为照射可生物降解微凝胶颗粒的集合和退火剂的混合物。在某些实施方式中,微凝胶颗粒包含基本上单分散的球体。在一种或多种实施方式中,基本上单分散的球体具有约30微米至约150微米的范围内的直径。在进一步或另外的实施方式中,微凝胶颗粒在退火后与另一微凝胶颗粒共价连接。
在另一方面,提供了一种治疗组织的方法,包括:向组织递送包含多个微凝胶颗粒的水基溶液;以及将多个微凝胶颗粒暴露至退火剂,该退火剂将微凝胶颗粒退火以形成其中具有间隙空间的微凝胶颗粒的共价稳定的支架。在一些实施方式中,多个微凝胶颗粒用细胞粘附肽修饰,并且其中微凝胶颗粒由基质金属蛋白酶(MMP)-可降解交联剂形成。在一种或多种实施方式中,退火剂被递送至组织。在一些实施方式中,退火剂存在于组织内。在另外的实施方式中,该方法进一步包括通过暴露至光而引发微凝胶颗粒的退火。在一些实施方式中,光的波长是在可见范围内。在一些实施方式中,光的波长是在红外范围内。在一种或多种实施方式中,水基溶液和退火剂同时递送。在一些实施方式中,水基溶液和退火剂顺序递送。在又进一步的或另外的实施方式中,微凝胶颗粒包含治疗活性(therapeutically active)的化学化合物(chemical compound)。在某些实施方式中,微凝胶颗粒将该化学化合物暴露或洗脱至组织。在一种或多种实施方式中,该组织包括美容重建的部位、慢性伤口发展、急性组织损伤或由手术切口引起的组织间隙。在又一另外的实施方式中,(MMP)-可降解交联剂包含D-氨基酸。
在另一方面,提供了微孔凝胶系统或装置,包括微凝胶颗粒的集合,其包含具有一种或多个细胞附着部分的主链聚合物、一种或多种退火组分以及一种或多种可生物降解网络交联剂组分;以及内源性或外源性退火剂,其通过退火组分将微凝胶颗粒原位连接在一起,以形成其中具有间隙空间的微凝胶颗粒的共价稳定的支架。在某些实施方式中,主链聚合物包括聚(乙二醇)乙烯基砜。在一种或多种实施方式中,一个或多个细胞附着部分包含RGD肽或其片段、纤连蛋白(fibronectin)或其片段、胶原蛋白或其片段、或者层粘连蛋白(laminin)或其片段。在一些实施方式中,一个或多个细胞附着部分包含RGD肽或其片段。在一种实施方式中,一个或多个细胞附着部分包含SEQ ID NO:3或其片段。在进一步的或另外的实施方式中,一种或多种退火组分包含K-肽和Q-肽。在某些实施方式中,K-肽包含因子XIIIa识别的赖氨酸基团,并且Q-肽包含因子XIIIa识别的谷氨酰胺基团。在一些实施方式中,可生物降解网络交联剂组分包含基质金属蛋白酶(MMP)可降解交联剂。在一种或多种实施方式中,(MMP)-可降解交联剂包含D-氨基酸。在某些实施方式中,微凝胶颗粒的集合包括两种或更多种类型的微凝胶颗粒。在一种或多种实施方式中,第一类型的微凝胶颗粒包含含有D-氨基酸的(MMP)-可降解交联剂,并且第二类型的微凝胶颗粒包含仅含有L-氨基酸的(MMP)-可降解交联剂。在一种或多种实施方式中,系统或装置包括含有微凝胶颗粒的集合和退火剂的单隔室递送装置。在一种或更多种实施方式中,系统或装置进一步包括双隔室递送装置,其中一个隔室包含含有多个微凝胶颗粒的水性溶液和第一退火剂前体,并且第二隔室包含含有多个微凝胶颗粒的水性溶液和第二退火剂前体,其中退火剂通过存在的第一和第二退火剂前体而形成。
在另一方面,描述了一种治疗组织的方法,包括:向组织递送用细胞粘附肽修饰的微凝胶颗粒的第一层,其中微凝胶颗粒由可生物降解交联剂形成;将第一层暴露至退火剂,该退火剂使微凝胶颗粒退火以形成其中具有间隙空间的微凝胶颗粒的共价稳定的支架;将用细胞粘附肽修饰的微凝胶颗粒的第二层递送至组织,其中该微凝胶颗粒由可生物降解交联剂形成,并且其中,第二层中的微凝胶颗粒与第一层中的微凝胶颗粒相比,在物理性能或化学组成中的一种上不同;以及将第二层暴露至退火剂,该退火剂退火微凝胶颗粒以形成其中具有间隙空间的微凝胶颗粒的共价稳定的支架。在一种或多种实施方式中,第二层中的微凝胶颗粒具有不同的尺寸。在另外的实施方式中,第二层中的微凝胶颗粒具有不同的形状。在一种或多种实施方式中,第二层中的微凝胶颗粒具有不同的刚度(stiffness)。在某些实施方式中,在第二层中的微凝胶颗粒具有与第一层中的化学组分不同的化学组分。在进一步的或另外的实施方式中,第二层中的微凝胶颗粒具有与第一层中的相同化学组分的不同浓度的化学组分。
在另一方面,提供了治疗组织的方法,包括:向组织递送包含用细胞粘附肽修饰的多个微凝胶颗粒的水基溶液,其中该微凝胶颗粒由可生物降解交联剂形成;将该多个微凝胶颗粒暴露至退火剂,该退火剂退火微凝胶颗粒以形成在其中具有间隙空间的微凝胶颗粒的共价稳定的支架。
在另一实施方式中,治疗组织的方法包括,向组织递送用细胞粘附肽修饰的微凝胶颗粒的第一层,其中微凝胶颗粒由可生物降解交联剂形成。将第一层暴露至退火剂,该退火剂将微凝胶颗粒退火以形成其中具有间隙空间的微凝胶颗粒的共价稳定的支架。将用细胞粘附肽修饰的微凝胶颗粒的第二层递送至组织,其中微凝胶颗粒由可生物降解交联剂形成,并且其中第二层中的微凝胶颗粒与第一层中的微凝胶颗粒相比,在物理性质或化学组成中的一种上不同。将第二层暴露至退火剂,该退火剂将微凝胶颗粒退火以形成其中具有间隙空间的微凝胶颗粒的共价稳定的支架。
在另一实施方式中,治疗组织的方法包括,向组织递送含有用细胞粘附肽修饰的多个微凝胶颗粒的水基溶液,其中微凝胶颗粒由可生物降解交联剂形成。将多个微凝胶颗粒暴露至退火剂,该退火剂将微凝胶颗粒退火以形成其中具有间隙空间的微凝胶颗粒的共价稳定的支架。
在又另一方面,描述了制备微凝胶颗粒的方法,包括:提供油包水液滴生成微流体装置(water-in-oil droplet generating microfluidic device),其具有通向共用通道的多个输入通道以及与共用通道在下游位置相交的一对油挤压通道(捏油通道,油捏压通道,oil-pinching channel),使含有用寡肽修饰的聚合物主链的第一预聚物溶液流入至第一输入通道;使含有可生物降解交联剂的第二溶液流入至第二输入通道;使油和表面活性剂流入至一对油挤压通道以形成包含第一预聚物溶液和第二溶液的液滴;以及收集通过该液滴的交联形成的微凝胶颗粒。在另一实施方式中,该方法进一步地包括插在第一输入通道和第二输入通道之间的第三输入通道,其中含有预聚物的第三惰性溶液流入至第三输入通道。在一种或多种实施方式中,该方法进一步包括,用位于该对油挤压通道与共用通道相交的位置的下游的另外一对包覆通道(sheathing channel)包覆(sheathe)所产生的液滴,其中另外一对包覆通道携带油和浓度高于上游的一对油挤压通道中所包含的表面活性剂的表面活性剂。在一种实施方式中,该方法进一步包括离心所收集的微凝胶颗粒。在另一方面,该方法包括降低离心的微凝胶颗粒的自由水体积含量。在一种或多种实施方式中,该方法包括将所收集的微凝胶颗粒存储延长的时间段(例如,数月至数年)。
在另一种实施方式中,制备微凝胶颗粒的方法包括,提供油包水液滴生成微流体装置,其具有通向共用通道的多个输入通道和与共用通道在下游位置相交的一对油挤压通道。使包含用寡肽修饰的聚合物主链的第一预聚物溶液流入至第一输入通道。使包含可生物降解交联剂的第二溶液流入至第二输入通道。油和表面活性剂流入至该对油挤压通道中以形成包含第一预聚物溶液和第二溶液的液滴。微凝胶颗粒通过液滴的交联形成,然后收集液滴。
从以下详细描述中,本公开的其他目的、特征和优点对于本领域技术人员将变得显而易见。然而,应当理解,具体实施方式和具体实施例(在示出本公开的一些实施方式的同时)是通过举例说明而非限制性的方式给出的。在不脱离本公开的精神的情况下,可以在本公开的范围内进行多种改变和修改,并且本公开包括所有这些修改。此外,一种实施方式的方面可以被用于其他的不同的实施方式中。
附图说明
使用附加权利要求中的特性阐述了本公开的新的性质。通过参考说明示例性的实施方式的以下详细描述(其中使用了本公开的原理)以及以下附图,将获得本公开的性质和优点的更佳理解:
图1示出了由多个退火的微凝胶颗粒形成的部分支架。
图2A示出了将微凝胶颗粒注射至伤口部位用于其愈合的示例性的方法。
图2B示意性示出了不同的微凝胶颗粒(通过微凝胶颗粒表面上的连接基加强的)之间的示例性的退火反应。
图2C示出了组织浸润至组织上的递送部位内形成的支架中的示例性的方法,其中,组织和微凝胶之间的边界表示它们之间的任何界面,其中细胞可以穿过该界面,由组织向内移动或者由微凝胶向外移动向组织。
图3A示出了根据一种实施方式的微流体装置的由顶向下的视图,该装置用于产生作为微孔凝胶系统的一部分的多个微凝胶颗粒。
图3B示出了液滴产生区域和下游的油/表面活性剂挤压区域的放大视图(参见图3A中的方框区域)。
图3C示出了在图3A中示出的两个分支通道的放大的透视图。
图3D示出了根据一种实施方式的图3A的微流体装置的侧视图。
图3E示出了图3B中所示的方案的实施的简化的截图(photograph taken of a reduction),其中左侧的荧光溶液含有交联剂,右侧的荧光溶液含有聚合物和反应缓冲液,并且中间流含有惰性液体溶液以防止在液滴分割之前左溶液和右溶液的混合。中间和右侧流之间的明亮荧光示出了由于反应缓冲液的扩散导致的中间流中的pH变化。
图3F示出了图3B和图3E中所示的方案的实施简化图,同时还示出了在引入挤压的油流之后液滴分割的发光的微观图。
图4A示出了根据另一种实施方式的微流体装置的由顶向下的视图,该装置用于产生作为微孔凝胶系统的一部分的多个微凝胶颗粒。
图4B示出了在液滴分割区域中,具有0.25%80的矿物油挤压和分段的PEG预凝胶,以及下游的矿物油中的5%80溶液混合并且防止微凝胶在完全胶凝化之前在下游聚结。
图4C示出了液滴在温育期间在分流区没有重新结合,并且离开微通道进入收集孔。
图5示出了根据一种实施方式的可以用于产生微凝胶液滴的示例性的微流体T型接头。
图6A示出了根据一种实施方式的双筒注射器的形式的示例性的分配装置。
图6B示出了根据另一种实施方式的单筒注射器的形式的示例性的分配装置。
图6C示出了根据一种实施方式的以保持微凝胶颗粒的管的形式的示例性的分配装置。
图7A示出了对于注射二十四(24)小时后的用支架(微孔退火颗粒或“MAP”支架)以及无孔对照注射的组织,在SKH1-Hrhr小鼠中的组织切片的苏木精和伊红染色(H&E染色)。
图7B示出了作为注射后天数的函数的伤口闭合(%)的图。该图示出了,与无孔双侧对照(N=5)相比,在五(5)天的时间段内,使用支架的伤口闭合率有统计学显著的改善。
图7C示出了在SKH1-Hrhr小鼠中,5天期间,比较凝胶支架(左图)与无孔PEG凝胶对照(右图)的体内伤口愈合模型期间伤口闭合的代表性图像。
图7D示出了在7天的体内BALB/c实验期间伤口闭合的代表性图像。在体内7天后,与未治疗对照、缺少K和Q肽的凝胶、无孔PEG凝胶相比,支架促进明显更快的伤口愈合,并且支架比预制的多孔凝胶(precast porous gel)促进更快的伤口愈合。使用规范的、基于致孔剂的浇铸方法(casting method),体外生产的精确匹配伤口形状的多孔凝胶示出了可观的伤口愈合率,与支架相当,但缺乏可注射性(N≥5)。
图7E是示出对于对应于图7D的每种治疗类别,来自BALB/c体内伤口愈合的伤口闭合定量数据的条形图。所有数据表示为平均值+/-SEM。使用标准的双尾t检验进行统计学显著性(*:p<0.05;**p<0.01)。
图7F示出了对于对应于图7D和图7E的每种治疗类型,在体内7天期间伤口床闭合的痕迹。
图7G示出了如何可以使用类似于图6A或6B的注射器装置(例如,25Gauge注射器)将含微凝胶颗粒的溶液或浆料注射至治疗部位中,其中微凝胶符合注射部位的形状(例如,在这种情况下为星形的激光切割的丙烯酸类模具),并且随后将支架退火成星形形状。
图8A和8B示出了在小鼠模型中,在皮肤切除和凝胶应用二十一(21)天后,用微凝胶支架(图8A)和未治疗或“假手术”(图8B)治疗的受损组织(即,伤口部位)的染色显微镜图像。可以清楚地在图8A中看到由微凝胶支架实现的疤痕减少。正方形表示在凝胶应用于伤口后的重组组织中的毛囊和油腺(皮脂腺)。圆圈表示在重组组织中剩余的微凝胶颗粒。
图8C示出了显示用假手术治疗的组织以及用凝胶支架治疗的组织的表皮厚度的图。
图8D示出了显示用假手术治疗的组织以及用凝胶支架治疗的组织的皮脂腺数目的图。
图8E示出了显示用假手术治疗的组织以及用凝胶支架治疗的组织的毛囊数目的图。
图8F示出了显示用假手术治疗的组织以及用凝胶支架治疗的组织的疤痕宽度(scar width)的图。
图8G示出了显示用假手术治疗的组织以及用凝胶支架治疗的组织的乳房囊肿(milial cysts)的数量的图。
图9A示出了储能模量(作为不同凝胶化动力学(pH和温度)的混合后时间的函数)的图。在25摄氏度的pH 8.25由图中的底线表示;在25摄氏度的pH 8.8由图中的顶线表示;以及在37摄氏度下的pH 8.25由图中的中间线表示。
图9B示出了在x轴上不同的水凝胶重量百分数用于产生不同刚度的材料。该图示出了各种水凝胶重量百分数的储能模量(Pa)。
图9C示出了在x轴上的不同交联剂化学计量,用于在所得凝胶中产生不同刚度值。该图示出了作为PEG分子上的自由交联剂末端(-SH)与乙烯基(-VS)的r比值的函数的储能模量(Pa)。
图9D示出了对于无孔对照(图的底线)以及本文所描述的多孔凝胶(图的顶线),作为时间的函数的%降解的图。
图9E示出了在200μm(上图)或100μm(下图)处,用FXIIIa退火的支架的SEM图像。
图9F示出了在200μm(上图)或100μm(下图)处,未用FXIIIa的微凝胶颗粒的SEM图像。未退火的微凝胶颗粒见于图9F。
图10示出了使用所描述的技术制造的微凝胶,其中通过使用膦-叠氮化物'点击'化学,用荧光牛血清白蛋白(BSA)蛋白(外周)补充微凝胶的表面。此外,在微流体制造期间,纳米颗粒(500nm)嵌入于微凝胶内。
图11示出了使用本文所描述的微孔凝胶系统治疗损伤组织的示例性方法。施加微凝胶颗粒(上图),可选地,使用施用器(第二图),开始微凝胶颗粒的退火以形成支架(第三图),以及观察到改善的伤口愈合(下图)。
图12A示出了显示在体外多孔凝胶支架中培养六天期间以及在6天后的无孔凝胶中的3D细胞网络形成的荧光图像。(350Pa:与多孔凝胶支架相同的体积模量,600Pa:与单个微凝胶匹配的微尺度模量)。
图12B示出了在代表不同的人类组织类型的三种细胞系中,退火后二十四(24)小时的细胞存活率大于93%的图。HDF:人真皮成纤维细胞,AhMSC:脂肪来源的人间充质干细胞,BMhMSC:骨髓来源的人间充质干细胞。
图13A示出了用于在退火之前,将活细胞与预先形成的微凝胶颗粒组合的示例性方法。微凝胶颗粒彼此退火,将活细胞截留在微凝胶退火后产生的相互连接的微孔网络内。
图13B-D是示出了以下的照片图像:将与活细胞组合的微凝胶颗粒溶液可模制成大规模形状(macro-scale shape),并且可以被注射以形成在退火后保持的复杂形状。图13B示出了示例性的体外注射器注射。图13C示出了示例性的体外形状模制。图13D示出了示例性的体外退火的支架。图13E示出了微凝胶颗粒可模制成大规模形状,并且可以在活细胞(由指向荧光HEK-293T细胞的箭头指示)的存在下进行。
图14A示出了显示在示例性的实施方式中,可以在生产频率的范围内合成不同尺寸的微凝胶颗粒的图。
图14B示出了在另一示例性实施方式中,向每个溶液入口(其中油入口超过30Psi)提供高入口压力使得能够提高生产频率。
图14C示出了显示高精度制造的微凝胶构建块(允许产生限定的凝胶支架)的图。不同的构建块尺寸允许确定性控制所得的微孔网络特性,这在本文中呈现为中值孔径+/-标准偏差(SD)。
具体实施方式
在优选的实施方式的描述中,参考形成实施方式的一部分的附图,其中通过举例说明的方式示出具体实施方式,其中可以实践本文描述的主题的。应当理解,在不脱离本文所描述的本发明主题的范围和精神的情况下,可以使用其他的实施方式并且可以进行结构改变。此外,在不脱离本发明的范围的情况下,不同实施方式的各个方面可以与本文中所描述的其它实施方式一起使用。
在本文描述的主题的一个方面,公开了用于生物医学应用,如伤口愈合的固体微凝胶支架,当多个微凝胶颗粒在退火反应中彼此退火时,形成该固体微凝胶支架。在本文描述的主题的一个方面,退火反应在相邻的微凝胶颗粒之间形成共价键。例如,在退火后的状态下,支架形成符合应用部位或递送的部位的三维结构。由于微凝胶颗粒的不完全填充,由颗粒形成的退火支架包括在其中形成的间隙空间,其中细胞可以迁移、结合和生长。形成的支架结构在伤口或其他递送部位退火时是多孔的(与由基于纤维蛋白的产品提供的无孔固体支架不同)。该孔隙包括以上提及的间隙空间以及可以在颗粒自身中产生或形成的纳米级孔。支架结构的微孔隙允许营养物、细胞生长和分化因子的高扩散性,以及细胞迁移、向内生长和渗透。因为增强了通过间质空间的细胞迁移,同时保持整体支架完整性,支架的微孔性提供了优于常规的纤维蛋白胶、超支化聚合物或具有可降解交联剂选择的聚合物的加速愈合或改善的药物或药剂的治疗递送。此外,通过不限制生物材料为天然材料,例如,通过具有更大的可用范围和更宽阵列的生物信号可以改善降解曲线(degradation profile)和物理性能(例如,刚度、内部扩散率等)或者可以将治疗活性化学物质包含在材料中(例如,可以将抗生素、类固醇、生长因子等装载于支架中)。此外,在某些实施方式中,通过将期望的生物材料改性,可以调节用于引发或控制生物活性的药物、化合物或其他材料的释放或洗脱。在愈合过程期间或者在降解支架时,可以将以上讨论的信号化合物或分子暴露至组织。在初始放置支架于递送部位处之后,也可以将信号化合物或分子释放或洗脱至受影响区中。
超过STARTM技术的方法的本文所描述的主题的一个优点是支架的形成发生在体内,允许其完全地填充期望的空间并且调节以(化学地或其他)结合至周围的组织。此外,凝胶颗粒的预递送形成允许获得的所形成的支架的受控的机械可调节性以匹配周围组织的性能。这些能力导致更好的密封和与组织的全部整合。较大的整合导致材料损坏的可能性降低以及长期再生增强。这还帮助防止受环境的污染。而且,退火支架的微孔属性有益于响应于支架的免疫异物的减少。
图1示出了由多个退火的微凝胶颗粒12形成的成形的三维支架10的一部分。支架10包括其中的间隙空间14,其是在较大支架10内形成微孔的空隙。间隙空间14具有允许细胞的浸润、结合和生长的尺寸和几何轮廓(geometrical profile)。应当理解,本文公开的支架10的微孔属性涉及位于形成较大支架结构的退火的微凝胶颗粒12之间的间隙空间或空隙14的网络。在一种实施方式中,在支架10内产生的间隙空间或空隙14显示负凹度(例如,内部空隙表面是凸面的)。图1示出了具有显示负凹度的空隙壁16的示例性的空隙14。由于在一种优选的实施方式中彼此退火的微凝胶颗粒12在形状上通常或基本为球形,因此产生负凹度。根据一种实施方式,这允许微凝胶颗粒12的封装产生约10%至约50%,以及在另一种实施方式中约26%至约36%的低空隙体积分数(void volume fraction)。尽管空隙体积分数低,但是在某些实施方式中,在空隙14的网络内显示的负凹度为空隙体积提供了相对高的表面积用于细胞相互作用。对于给定体积的细胞,它们然后平均地暴露至甚至更多和更大的表面(例如,在空隙壁16上),以在支架10中的空隙网络内相互作用。
重要的是注意到,空隙网络由其中微凝胶表面非常接近的区域(例如,邻近的相邻的退火微凝胶颗粒12)组成,导致用于细胞粘附和快速迁移通过的高表面积的粘附区域,同时进一步在微凝胶颗粒12之间的间隙中的邻近区域具有更大的空隙空间,其可以使细胞和组织在该空间中生长。因此,与全部的小空隙或全部的更大的空隙相比,邻近的紧密空隙区和更宽敞的空隙间隙的组合预期对组织向内生长和再生长具有有益的效果。
注意到,在以上描述的实施方式中,由于微凝胶颗粒12的球形形状导致负凹度。在其他的实施方式中,微凝胶颗粒12可能不是球形的。在支架10中仍然可以使用其它的非球形形状。仍然参考图1,支架10由微凝胶颗粒12形成,该微凝胶颗粒12经由退火表面17彼此固定。如本文所解释的,在将微凝胶颗粒12施加至预期的递送部位期间或之后,形成退火表面17。
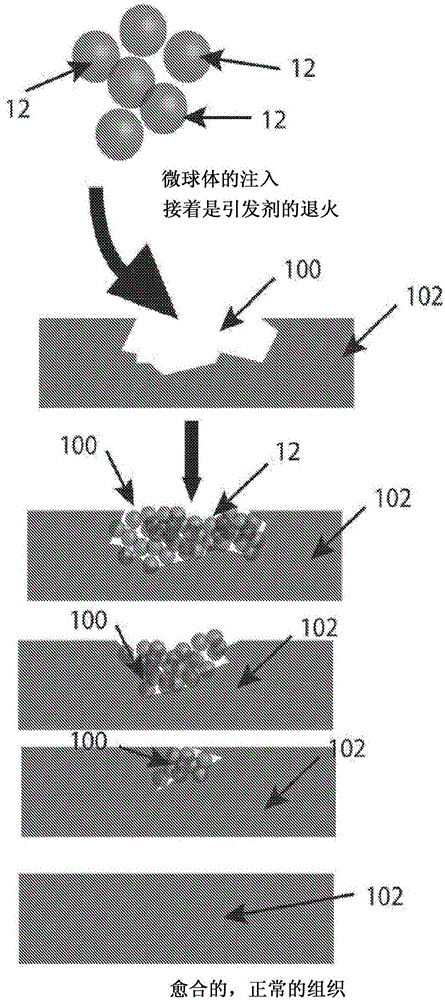
支架10可以用于各种应用,包括各种医学应用,如军事现场医疗、医学创伤治疗、手术后闭合、烧伤、炎症和遗传性和自身免疫性起泡病等。在一种或更多种实施方式中,支架10用作组织密封剂(例如,急性伤口愈合物质,手术密封剂,用于以下的局部药剂(topical agent):局部厚度、全厚度或隧道伤口,压力性溃疡,静脉性溃疡,糖尿病性溃疡,慢性血管溃疡,供体皮肤移植部位,莫氏手术后,激光手术后,足部伤口,伤口开裂,擦伤,撕裂,二度或三度烧伤,放射性损伤,皮肤撕裂和引流伤口等)。图2A-2C示出了一种实施方式,其中支架10用于治疗在哺乳动物的组织102中形成的伤口部位100。在某些实施方式中,支架10用于立即治疗急性伤口。在急性伤口中,支架10提供了多种益处,包括密封伤口100、防止经表皮的水分流失、提供细胞或药物以及增强皮肤伤口(例如,手术部位、烧伤伤口、溃疡)愈合的快速方法,以提供更多的天然组织发育(例如,避免疤痕组织的形成)。支架10的一个特别的益处是支架10减少或最小化疤痕组织形成的能力。支架10提供了对组织胶(tissue glue)和其它目前可注射的组织填料和粘合剂的更有效的替代。
如图2A所示,将微凝胶颗粒12递送至伤口部位100,随后开始退火反应,以使微凝胶颗粒12彼此退火,从而形成支架10。如图2A所示,伤口部位100由支架10密封,并且随着时间的推移,伤口部位100愈合成正常组织(还参见图11)。图2B示出了相邻的微凝胶颗粒12(颗粒A和颗粒B)如何经历退火反应的化学或酶促引发,以在微凝胶颗粒12之间形成退火表面17。图2C示出了放大的视图,其举例说明支架10如何作为结构支持还允许由于支架10的多孔属性导致的组织浸润和生物材料再吸收。示出了细胞106浸润在支架10内形成的间隙空间。
支架10还可以以再生能力使用,例如,施用至烧伤、急性和慢性伤口等的组织。在一种实施方式中,支架10用于慢性伤口。在慢性伤口中,在正常的愈合过程被抑制的情况下,支架10不仅可以用于密封伤口,而且可以用于去除多余的水分,并且应用药物,包括可以有助于促进正常伤口愈合过程的细胞疗法。在用于体积损失(与老化、脂肪萎缩、脂肪营养不良、皮肤疤痕或者表面或深部皮肤(deep rhytide)相关)的组织填料施加的情况下,可以使用微凝胶颗粒12经由针或套管直接注射至真皮中以改善组织轮廓、组织损失或组织位移。因为在再生医学中使用的细胞可以在微凝胶颗粒12内生长,所以可以包括细胞(例如,间充质干细胞,成纤维细胞等)作为疗法(通过在组织中原位退火之前,在微凝胶颗粒内初始聚合细胞(1-20个细胞),或者可以将细胞初始粘附至微凝胶颗粒上,或者可以用微凝胶颗粒溶液(非粘附的)引入细胞)。
也可以将支架10用于体外组织生长、用于生物科学研究的三维(3D)基质以及化妆品和皮肤病的应用。例如,对于更多的生理学相关的药物检验,可以将癌细胞与微凝胶前体一起接种,并且一旦退火可以允许肿瘤球体快速的3D生长,而不需要如同其他的3D培养凝胶体(例如,)所需要的基质降解。期望的是,形成退火凝胶的3D基质中的细胞之间的快速形成接触的能力将增强来自单个细胞类型或多种细胞类型的微组织的生长和形成,该微组织可以用于筛选药物或者检测化妆品。表皮层可以在支架10的表面上形成,相比于动物模型,这可以允许在更多的类似皮肤的替代物上检测药物或化妆品。先前的3D培养材料可以使凝胶内的细胞接种均匀地遍布体积,但是由于缺乏孔隙而不能维持细胞-细胞接触,或者不能产生孔隙,而是需要在制备后接种细胞并迁移到支架中。
如本文解释的,在退火的支架10大体上形成限定的结构时,在最终退火之前,前体材料是可流动的,并且可以作为糊剂、浆料递送,或者甚至注射至研究中的递送部位。其他的可注射的水凝胶可以提供支架用于原位组织再生长和再生,然而这些注射的材料要求在组织再形成之前凝胶降解,限制它们的提供物理载体的能力。本文中所描述的可注射的微孔凝胶系统通过提供相互连接的微孔网络用于同时的组织再形成和材料降解规避了这种挑战。
微流体形成使得基本上单分散的微凝胶颗粒12形成相互连接的微孔退火的颗粒支架10(在本文描述的主题的一个方面),从而使得微凝胶颗粒12(例如,构建块)的受控的化学、物理和几何性能,以提供组装的支架10的物理和化学性能的下游控制。在体外,在支架10形成期间结合的细胞在四十八(48)小时内增殖并形成广泛的三维网络。在体内,形成支架10的可注射的凝胶系统促进细胞迁移,导致在五(5)天内快速的皮肤组织再生和组织结构形成。使用支架10实现的微孔性和可注射性的组合对于体内组织再生和新的组织生成提供了新的途径。
图2A示出了在伤口部位100内形成的支架10。用于组织再生的成功材料受益于材料降解速率与组织发育的精确匹配。如果降解发生得太快,则支架保留不足以支持组织向内生长。相反,太慢的速率将阻止适当的组织发育,并且可以促进纤维化和/或免疫排斥。已经使用水解和酶促可降解材料来进行基于局部环境的降解速率的调节。然而,材料机械稳定性与细胞浸润的去耦损失(decoupling loss)已证明是非常具有挑战性的。也可以使用轻度交联的基质促进细胞向材料的浸润,然而这常常导致与周围组织的机械不匹配和差的材料稳定性。可替代地,可以通过改变聚合物主链同一性或交联密度,使降解速率和组织形成匹配来调节水凝胶降解速率。虽然可以调整这些技术以解决可注射水凝胶的具体应用,但是它们不提供坚实的途径来实现不依赖于材料稳定性损失的本体组织整合。
每个伤口部位在其对于功能性组织再生的物理的、化学的和降解要求方面是独特的,需要对各种挑战性环境稳健的材料策略。如本文所描述的产生的微孔凝胶系统和获得的支架10通过提供用于细胞迁移和与周围组织的本体整合的微孔的稳定连接的相互连接的网络,规避了在组织向内生长之前对材料降解的需要。根据一种实施方式,微孔凝胶体系通过使用自组装的微凝胶颗粒12作为“构建块”或“亚单元”(由微流体的油包水液滴分割形成)来实现这些有利的特征。根据一种实施方式,以这种方式形成的微凝胶颗粒12基本上是单分散的。微凝胶颗粒12可以被注射和模制成任何期望的形状。然后微凝胶颗粒12的晶格通过表面官能团彼此退火以形成相互连接的微孔支架10(具有或不具有存在于相互连接的多孔网络中的细胞)。在一种实施方式中,支架10优选包括共价连接的微凝胶颗粒12,其形成用于组织再生和向内生长的三维支架10。
通过将可注射性和微孔性组合,微孔凝胶系统提供了理想的生物材料支架用于体外的有效的细胞网络形成和体内的本体组织整合。模块化微孔凝胶系统还为快速细胞迁移、指导细胞粘附的分子线索和组织再生期间和之后的再吸收提供了机械支持。通过微流体制造,可以可预测地和均匀地调节微凝胶颗粒12的化学的、物理的和几何性能,允许出现的支架10的性能的下游控制。新的基于构建块(building block)的方法(其中稳健实现的不完美的自组装是合乎需要的以实现微孔性),从根本上改变了作为组织模拟构建体的水凝胶的使用和实施,提供了用于本体组织整合的可注射支架的途径的哲学变化(philosophical change)。
在本文所描述的主题的一个方面,微孔凝胶系统使用直径尺寸在约5μm至约1,000μm范围内的微凝胶颗粒12。微凝胶颗粒12可以由亲水性聚合物、两亲性聚合物、合成的或天然聚合物(例如,聚(乙二醇)(PEG)、聚(丙二醇)、聚(甲基丙烯酸羟乙酯)、透明质酸(HA)、明胶、纤维蛋白、壳聚糖、肝素、类肝素和合成形式的HA、明胶、纤维蛋白、壳聚糖、肝素或类肝素)。在一种实施方式中,微凝胶颗粒12由能够形成水凝胶的任何天然(例如,修饰的HA)或合成的聚合物(例如,PEG)制成。在一种或多种实施方式中,可以使用能够形成固体水凝胶构建体的聚合物网络和/或任何其它的支持网络。用于大多数组织工程/再生医学应用的合适的支持材料通常是生物相容的并且优选是可生物降解的。合适的生物相容性和可生物降解的载体的实例包括:天然聚合物碳水化合物及其合成改性的、交联的或取代的衍生物,如明胶、琼脂、琼脂糖、交联海藻酸、壳多糖、取代和交联的瓜尔胶、纤维素酯(特别是用亚硝酸和羧酸取代和交联)、混合的纤维素酯和纤维素醚;含氮的天然聚合物,如蛋白质和衍生物,包括交联的或改性的明胶和角蛋白;乙烯基聚合物(如,聚(乙二醇)丙烯酸酯/甲基丙烯酸酯/乙烯基砜/马来酰亚胺/降冰片烯/烯丙基)、聚丙烯酰胺、聚甲基丙烯酸酯、上述缩聚物的共聚物和三元共聚物,如聚酯,聚酰胺以及其它的聚合物,如聚氨酯;以及上述类型的混合物或共聚物,如通过在预先存在的天然聚合物上起始合成聚合物的聚合而获得的接枝共聚物。多种生物相容的和可生物降解的聚合物可用于治疗应用的用途;实例包括:聚己内酯、聚乙交酯、聚丙交酯、聚(乳酸-共-乙醇酸)(poly(lactic-co-glycolic acid))(PLGA)和聚-3-羟基丁酸酯。由这种材料制备网络的方法是熟知的。
在一种或多种实施方式中,微凝胶颗粒12进一步包括共价附着的化学物质或分子,其作用为在微凝胶颗粒12形成期间形成的信号修饰。信号修饰包括添加,例如粘附肽,细胞外基质(ECM)蛋白等。也可以通过共价方法或非共价相互作用(例如,静电电荷-电荷相互作用或扩散限制性螯合)在微凝胶颗粒12形成之后,将官能团和/或连接体添加至微凝胶颗粒12中。根据所需的降解特性选择交联剂。例如,微凝胶颗粒12的交联剂可以被水解地、酶促地、光解地等降解。在一种特别优选的实施方式中,交联剂是基质金属蛋白酶(MMP)-可降解交联剂。
这些交联剂的实例是合成制备的或天然分离的肽,其具有对应于MMP-1靶底物、MMP-2靶底物、MMP-9靶底物、随机序列、Omi靶序列、热休克蛋白靶序列的序列,以及任何这些列出的序列全部具有或具有一些D手性或L手性的氨基酸。在另一实施方式中,交联剂序列是由以上列出的相同的主链组成的水解可降解的天然的和合成的聚合物(例如,肝素、藻酸盐、聚(乙二醇)、聚丙烯酰胺、聚甲基丙烯酸酯,所列缩聚物的共聚物和三元共聚物,如聚酯、聚酰胺和其它聚合物,如聚氨酯)。
在另一种实施方式中,交联剂是具有对应于以下序列的合成制备的或天然分离的DNA寡核苷酸:限制性酶识别序列、CpG基序、锌指基序、CRISPR或Cas-9序列、Talon识别序列和转录因子结合的结构域。来自所列的实施方式的任何交联剂在每一端被反应性基团活化,该反应性基团被定义为允许交联剂参与交联反应以形成聚合物网络或凝胶的化学基团,其中这些官能团可以包括:半胱氨酸氨基酸、合成的和天然存在的含硫醇的分子、含碳烯基团、活化酯、丙烯酸酯、降冰片烯、伯胺、酰肼、膦酸、叠氮化物、含环氧基团、含SANPAH的基团和含重氮基的基团。
在一种实施方式中,用于产生微凝胶颗粒12的化学物质(chemistry)允许随后的退火以及通过自由基引发的聚合形成支架10。这包括与四甲基乙二胺结合的化学引发剂(如过硫酸铵)。可替代地,可以将光引发剂,如2959或曙红Y与自由基转移剂,如游离巯基(以10μM至1mM范围内的浓度使用)一起与光源组合使用,该光源是用于引发如本文所描述的反应。游离巯基的一个实例可包括,例如,本文所描述的氨基酸半胱氨酸。当然,也可以使用包含游离半胱氨酸的肽或者包含游离硫醇的小分子。自由基转移剂的另一个实例包括N-乙烯基吡咯烷酮(NVP)。
可替代地,亲核基团(例如,硫醇、胺、氨氧基)上的迈克尔和假迈克尔加成反应(Michael and pseudo-Michael addition reaction)(包括α,β-不饱和羰基(例如,丙烯酸酯、乙烯基砜、马来酰亚胺等)可以用于使微凝胶颗粒12退火以形成支架10。在另一可替代的实施方式中,微凝胶颗粒12形成化学(formation chemistry)允许通过包括纤维蛋白原到纤维蛋白的引发的溶胶-凝胶转变(通过加入催化性酶凝血酶)形成网络。
允许颗粒-颗粒退火的官能团包含在微凝胶颗粒12的形成期间或之后。在一种或多种实施方式中,这些官能团包括α,β-不饱和羰基,其可以通过任一自由基引发的与邻近颗粒上的α,β-不饱和羰基的反应,或者与亲核官能团的迈克尔和假迈克尔加成反应而活化用于退火,该亲核官能团作为颗粒之间的多官能连接体或作为存在于相邻颗粒上的官能团外源地呈现。该方法可以使用多种微凝胶颗粒12群体类型(population type),当混合时形成支架10。例如,呈现出,例如亲核表面基团的X型微凝胶颗粒12可以与呈现例如α,β-不饱和羰基的微凝胶颗粒12型Y一起使用。在另一实施方式中,可以包括参与点击化学(click chemistry)的官能团,允许直接附着到呈现互补点击功能的相邻微凝胶颗粒12上,或者通过参与或引发(例如,铜)点击反应的外源呈现的多功能分子附着。
退火官能团可以包括任何先前讨论的用于微凝胶交联的官能团,该功能团与初始交联反应相比在其引发条件(例如,温度、光、pH)方面是正交的或相似的(如果潜在的反应性基团保留)。例如,如果初始交联反应由温度依赖的迈克尔加成反应组成,则随后的退火官能团可以通过温度或光引发(例如,曙红Y,)来引发。作为另一实施例,初始微凝胶可以在一波长的光(例如,用的紫外线的)下光聚合,并且微凝胶颗粒12的退火发生在相同的或另一波长的光(例如,用曙红Y的可见的)下,反之亦然。除了用共价偶联反应退火之外,退火部分可以包括非共价疏水的,客体/主体相互作用(例如,环糊精),在邻接的微凝胶颗粒12上的互补核酸序列或核酸模拟物(例如,蛋白质核酸)之间的杂交,或离子相互作用。离子相互作用的实例将由与Ca2+退火的微凝胶颗粒表面上的藻酸盐官能团组成。所谓的“A+B”反应也可以用于退火微凝胶颗粒12。在该实施方式中,两种分开的微凝胶类型(A型和B型)以各种比例(在0.01:1至1:100A:B之间)混合,并且A型的表面官能团与B型反应(反之亦然)以引发退火。这些反应类型可以属于本文列出的任何机制。
在一种实施方式中,微凝胶颗粒12使用微流体方法(微流控方法,microfluidic method)或毫流体方法(毫流控方法,millifluidic method)制造,产生具有小变异性和高通量(例如,大于10个颗粒/秒的频率)的确定性的微凝胶颗粒长度尺度。微凝胶颗粒12长度尺度(例如,直径)的变化的系数(coefficient of variation)可以在平均长度尺度的35%以内、或更优选在15%以内、甚至更优选在5%以内。毫流体或微流体允许均匀的、预定的、简明的材料性质被包括在微凝胶颗粒12的形成之前、形成中和形成后。此外,微流体/毫流体生产机制允许容易按比例放大生产,以及对微凝胶颗粒12的化学组成和物理特性的良好的质量控制。用于微凝胶颗粒12产生的毫流体和/或微流体技术是容易规模化的过程,以产生用于商业需要的大量材料,同时保持微凝胶颗粒12特征的高准确度与精密度。此外,与涉及静电纺丝或大规模纤维蛋白纯化的其它技术相比,均以低成本将其实现。
在一种实施方式中,微凝胶颗粒12是使用依赖于油包水乳剂产生的自动化流体方法形成的。这包括微流体或毫流体方法,该方法使用玻璃/PDMS、PDMS/PDMS、玻璃/玻璃,或者模制的/铸造的/压印的塑料芯片以生成具有小于35%的粒度分布变化的油包水液滴。
图3A-3F示出了用于生成微凝胶颗粒12的微流体装置20的一种实施方式。微流体装置20在,如PDMS的基底材料22中形成,其可以包括粘合基底22的另一基底材料24(例如,玻璃)。在该实施方式中,微流体装置20包括第一入口26、第二入口28和第三入口30。如图3A中所示,第三入口30插入在第一入口26和第二入口28之间。在该实施方式中,第一入口26连接至包含4-臂(arm)聚(乙二醇)乙烯基砜(PEG-VS)主链(20kDa)的溶液(已经用用于细胞粘附性能的寡肽(例如,RGD)和表面/组织退火官能团(例如,K和Q肽)预先修饰)。PEG-VS主链可以被500μM K-肽(Ac-FKGGERCG-NH2[SEQ ID NO:1])(Genscript)、500μM Q肽(Ac-NQEQVSPLGGERCG-NH2[SEQ ID NO:2])和1mM RGD(Ac-RGDSPGERCG-NH2[SEQ ID NO:3])(Genscript)预官能化。输入到第一入口26的溶液可以含有约5%(基于重量)的修饰的PEG-VS,其包含在0.3M三乙醇胺(Sigma),pH 8.25的缓冲液中。第二入口28连接至含有交联剂的溶液,该交联剂在一种实施方式中是12mM的二半胱氨酸修饰的基质金属蛋白酶(MMP)(Ac-GCRDGPQGIWGQDRCG-NH2[SEQ ID NO:4])底物(Genscript)。在使用荧光成像进行的实验中,MMP底物与10μM Alexa-fluor 647-马来酰亚胺(Life Technologies)预反应。当然,在实际应用中,不需要使用荧光探针。所有溶液可以通过在Luer-Lock注射器过滤器中的0.2μm聚醚砜(PES)膜无菌过滤。
如本文中所使用的,K-肽是指其中含有因子XIIIa识别的赖氨酸基团的那些肽。如本文中所使用的,Q-肽是指其中含有因子XIIIa识别的谷氨酰胺基团的那些肽。因此,可以使用超出以上具体提及的肽序列。这种肽序列适用于以上列出的RGD肽序列。
第三入口30连接至含有按重量计5%的PEG-VS(未被K、Q或RGD肽修饰)的水性溶液。PEG-VS水性溶液优选地与通过第一入口26引入的PEG-VS溶液粘度匹配,并且可以用于控制交联剂溶液的pH以及抑制交联直到液滴形成。通过使第三入口30插入于第一入口26和第二入口28之间,PEG-VS水性溶液用作防止液滴产生区域上游的反应性溶液的任何材料扩散性混合的屏障。这显著增加了装置在污染发生之前的寿命。图3E和3F示出了惰性液体溶液如何防止在液滴分割之前左溶液和右溶液的混合。注意到,制备微凝胶颗粒12的方法也将省略第三入口30并相应地调节肽/交联剂浓度,但是装置的寿命不长。
参照图3A、3B和3C,第一入口26、第二入口28和第三入口30分别连接至通道32、34、36。通道在接头38相交并且在共用通道40中携带。第四入口42设置在装置中并且连接至至含有表面活性剂(例如,按体积计80,尽管可以使用其他表面活性剂)的油相。第四入口42连接至在共用通道40的下游区域处的接头(junction)48处相交的两个通道44、46。装置20中的接头48是形成包含PEG-VS组分和交联剂的水基液滴的位置。液滴的内容物经历混合,并且在凝胶化时形成微凝胶颗粒12,在本实施方式中,该凝胶颗粒是环境温度和流逝时间的函数。在该装置中,提供了第五入口50,其与含有表面活性剂的另一油相连接至,该油相的体积百分数高于连接至第四入口42的体积百分数。例如,第五入口50可连接至含有按体积计80的油相。同样,也可以使用除了80之外的其它表面活性剂。第五入口50连接至两个通道52、54,其在如图所示的挤压方向(pinching orientation)上在接头56处相交。
共用通道40延长到一系列逐渐分支的分支通道58。分支通道58允许微凝胶颗粒12通过单独的平行通道的连续流动,其中可以可选地控制局部环境条件。例如,可以控制各个分支通道58的温度以调节微凝胶颗粒12的交联条件。同样,可以用光照射分支通道58以控制光活化反应。微凝胶颗粒12可以使用出口59从装置20移除。然而,应当理解,由于当装置在环境温度或其附近操作时,交联反应可以仅仅通过时间的流逝而发生,因此分支通道58的温度的调节或光活化的使用是完全可选的。
如在图3D中最佳地看到的,第一入口26、第二入口28、第三入口30、第四入口42和第五入口50分别连接至流体线路26’、28’、30’、42’和50’,它们均连接至泵送装置51或将相应流体泵送至相应连接的入口28、28、30、42、50中的多个泵送装置51。泵送装置51可以包括连接到每种不同流体的单独的泵。可以被使用的泵类型的实例包括注射器泵或通常与微流体装置结合使用的其他泵。在一个方面,泵送装置51使用流体贮存器上方的调节的加压气体来以期望的流速泵送流体通过该装置。
图4A-4C示出了用于产生微凝胶颗粒12的微流体装置60的可替代的实施方式。在该可替代的实施方式中,与图3A-3C的实施方式不同,没有携带用于在液滴产生之前分离PEG和交联组分的水性溶液的第三入口30。相反,在该实施方式中,微流体装置60包括第一入口62、第二入口64、第三入口66和第四入口68。第一入口62连接至如以上描述的改性的PEG-VS源。第二入口64连接至交联剂。第三入口66连接至含有油和表面活性剂的源。第四入口68连接至含有油和表面活性剂的源,该源浓度高于连接至第三入口66的源的浓度。在该实施方式中,第一入口62和第二入口64连接至通向共用通道74的相应的通道70、72。第三入口66连接至在其中产生液滴(液滴将在反应时形成微凝胶颗粒12)的接头80(在图4B中最佳地示出)处与共用通道74相交的一对通道76、78。第四入口68连接至一对通道82、84,该对通道在相对于接头80的下游位置86(在图4B中最佳地示出)处与共用通道74相交。如在图4A中所示,装置60包括一系列逐渐分支的分支通道88,其类似于在图3A-3C的实施方式的上下文中描述的那些。通过分支通道88的微凝胶颗粒12可以收集在收集室90(其可以从装置60移除)等中。使用如前面在图3A-3C的实施方式的上下文中描述的流体管线和泵送装置将流体递送到装置60。
在一种实施方式中,导致微凝胶颗粒12形成的流体条件包括基于PEG的和基于交联剂的水性溶液的在芯片上的混合,其中一部分含有基础聚合物,并且另一部分含有交联剂或引发剂。当然,在图3A-3C的实施方式中,存在三输入混合(three-input mixing),其包括上述组分加上添加水基惰性流。这些PEG和交联剂溶液以1:1体积比或高达至1:100的另一可控比(由进入装置的相对流速控制)混合。控制油和总水流速率的比值以确定特定尺寸的微凝胶颗粒12,其中这些比值可以为4:1(含水部分(aqueous):油)至1:10(含水部分:油)的范围。
如以上解释的,在图3A-3D的实施方式中,芯片装置20被设计成具有三种水基溶液合并以形成微凝胶颗粒12,其中,通过液滴发生器上游的非反应性溶液将基础聚合物和交联剂/引发剂分离,以预防溶液反应以及在液滴产生的上游区域中随着时间的芯片结垢(fouling)。在该构造中,非反应性溶液的部分应当等于或小于基础和交联剂溶液(其它溶液的体积速率的1至0.05倍)。因此,该实施方式可以改善用于微凝胶产生的芯片的可靠性和寿命。此外,在该实施方式或先前的实施方式中,可以将细胞引入至两种或三种引入的水性溶液中的任一种,以使得能够将这些细胞(每个颗粒的单个细胞或2-20个细胞的簇)封装在微凝胶颗粒12内,使得封装的细胞可以产生促进伤口愈合或细胞向内生长的因子。
尽管图3A-3D和4A-4C示出了可用于产生微凝胶颗粒12的微流体装置20、60的不同实施方式,但是在可替代的实施方式中,微流体流动路径可包括如图5示出的“T型接头”结构。在该实施方式中,微流体装置92包括在携带含水相的第一通道94与包括油相的第二通道96之间形成的接头。液滴97形成并经由出口通道98(其可以与第一或第二通道94、96相同)运输。可替代地,可以使用不同的液滴形成构造来产生微凝胶颗粒12。例如,由于非平行的顶壁和底壁,该装置可以使用限制的梯度来产生液滴97,如在Dangla et al.,Droplet microfluidics driven by gradient of confinement,Proc Natl Acad Sci USA,110(3):853-858(2013)中公开的那些,通过引证将其并入本文。
在以上描述的微流体装置中,通道表面应当被改性,使得含水相是非润湿的,其可以包括表面的氟化,或者通过基于共价硅烷的处理或另一种基于非特异性吸附的方法将表面转化为疏水的或亲氟的。可替代地,含有亲氟基团的塑料聚合物包含芯片材料,并且可与先前提及的表面涂层组合或者不与表面涂层组合。此外,在优选的实施方式中,使用的油应该是补充有非离子表面活性剂的矿物油(石蜡油)、补充有离子表面活性剂的植物油或补充有氟化表面活性剂的氟化油(或这些两种油/表面活性剂体系的任意组合)。这些微流体或毫流体方法以等于或超过10Hz的速率产生微凝胶颗粒12的单分散(变化的系数小于35%),其中手工地(手动地)或使用自动化流体处理系统完成收集。为了防止微凝胶颗粒12在交联反应完成之前聚结,需要足够的表面活性剂来稳定预凝胶液滴,然而,高水平的表面活性剂也使液滴产生过程不稳定。因此,用于微凝胶颗粒12产生的微流体系统的优选实施方式包括在产生液滴的初始挤压油流(initial pinching oil flow)中的低浓度的表面活性剂(1%或更少),随后从单独的入口添加油+表面活性剂溶液,其与形成的液滴和油溶液合并且含有较高水平的表面活性剂(比初始表面活性剂高达至10倍或甚至50倍)。这示出在,例如图3A-3D和4A-4C的实施方式中。
在另一可替代的实施方式中,两种油挤压流具有相同浓度的表面活性剂。在又一实施方式中,不是第二挤压油流,而是只有流动聚焦油(flow-focusing oil)流动以产生液滴。此外,如以上解释的,在一些可替代的实施方式中,没有第二挤压油流,并且仅使用t型接头油流来产生液滴。当然,t型接头液滴接头可以可选地与具有相等或更大表面活性剂浓度的第二富集油(focusing oil)入口组合。
在形成之后,使用通过含水相的离心或者通过固体膜过滤装置的过滤,从油相中提取微凝胶颗粒12。例如,过滤可以用于降低固定微凝胶颗粒12的自由水性溶液的体积(自由体积)。在一种实施方式中,含水的自由体积小于总体积的约35%。在另一实施方式中,为了产生有意多分散群体,在毫流体或微流体平台中进行微凝胶颗粒产生,产生相对单分散微凝胶颗粒12的存料(stock),该存料随后以期望比值混合以获得微凝胶颗粒12尺寸的确定性分布和比值。用1:1、10:1或超过100:1的化学计量比,可以精确地控制微凝胶颗粒12尺寸的比值以控制在最终退火支架10中的孔结构或化学性能。
可替代地,也可以使用声波混合法或旋转涡流进行经由油包水系统的微凝胶颗粒12的产生。这些后者方法产生具有100纳米至500微米范围的尺寸的微凝胶颗粒12的多分散群体(polydisperse population)。随后,可以使用多孔过滤、微流体过滤或本领域已知的其他技术过滤这些颗粒以获得较窄粒径分布的微凝胶颗粒12(例如,小于50%的变化的系数)。作为另一替代,可以通过形状限定掩模,使用停止流动光刻(stop flow lithography)、连续流动光刻和其他方法来制造不同形状的组分微凝胶颗粒12,来产生依赖于成形流(与UV引发的聚合结合)的成形颗粒(参见Amini等人,国际公开号WO/2013/049404,通过引证将其并入本文)。在这种情况下,微凝胶颗粒12是具有可以在5至1000微米之间变化的长和短尺寸的非球形。也可以通过在油包水乳液中产生球形颗粒,然后通过微制造的压缩物挤出所述颗粒来制造成形颗粒,该微制造的压缩物具有小于颗粒的直径的长度尺度。先前的球形颗粒随着它们转变成凝胶而采用压缩的形状,并且当它们通过以上列出的任何交联剂反应在压缩中成为凝胶时保持该形状。凝胶在离开微制造的结构之后保持该形状。成形颗粒可以允许对在最终支架(由微凝胶颗粒12退火形成的)内的孔、总孔隙率、孔的弯曲度和改善的粘附性的另外控制。
在一种或多种实施方式中,微凝胶颗粒12被共价地或非共价地修饰(例如,通过扩散包含在空间内)以提供生物活性分子(例如,小分子药物、抗生素、肽、蛋白质、类固醇、基质聚合物、生长因子、抗原、抗体等)。在微凝胶颗粒12形成之后包含信号分子可以通过被动扩散、表面固定(永久或临时)和/或本体固定(永久或临时)来实现。
在另一实施方式中,纳米颗粒被包括在初始预聚物溶液中,并在初始聚合或凝胶化期间合并于微凝胶颗粒12中,并且纳米颗粒可包括用于持续或快速释放和递送的生物活性分子。在另一实施方式中,含有游离伯胺(作为含赖氨酸的寡肽的一部分被包含)的微凝胶颗粒12可以用NHS-叠氮化物修饰。可以向这组微凝胶颗粒12添加用NHS-膦修饰的蛋白质,导致微凝胶颗粒12的表面包被(surface-coating)具有修饰的蛋白质。图10示出了这样的实施方式,其中微凝胶颗粒12具有嵌入其中的纳米颗粒和使用点击化学,用蛋白质修饰的表面。
在生产和可选的改性后,可以将微凝胶颗粒12(其可以是均匀的或非均匀的混合物)施加到所需位置(体外,原位,体内)。哺乳动物组织102上的期望位置可以包括,例如伤口部位100或受损组织的其他部位。可以单独地将微凝胶颗粒12引入于等渗盐水性溶液或浆液(优选30-99%体积分数,且次优选1-30%体积分数的微凝胶颗粒12)。可替代地,微凝胶颗粒12可以与作为单细胞或细胞的聚集体一起以10:1的细胞与颗粒的比例引入以在最终退火的支架10内产生致密的细胞网络,或者以1:100或甚至1:1000产生稀疏接种的支架10以及产生可用于再生的可溶性因子的细胞。在另一种实施方式中,微凝胶颗粒12可以与以小体积分数颗粒(<10%)的细胞一起,在细胞容许的培养基中培养一段时间,以促进对单个微凝胶颗粒12的粘附。这些复合细胞粘附的微凝胶颗粒12可以作为活性组分(退火以形成微孔细胞接种的支架10)引入,这可有益于增强再生活性的速度。引入微凝胶颗粒12的期望的体外位置包括孔板(例如,6孔、96孔、384孔)或微流体装置,以在退火后形成用于细胞的3D微孔培养环境,并且能够进行后续的生物测定或具有更多生理学相关的3D或多细胞条件的高通量筛选测定。为了在体外引入,可以将微凝胶颗粒12溶液移液到孔中或通过注射器注射引入,随后引入退火溶液或触发光化学退火。可替代地,微凝胶颗粒12溶液的溶液可以,在递送前与缓慢作用的退火溶液(在10-30分钟内发生退火)混合。原位位置包括外部伤口部位(例如,切口、水疱、疮、压疮、静脉溃疡、糖尿病性溃疡、慢性血管溃疡、供体皮肤移植部位、莫氏手术后部位、激光手术后部位、足部伤口、伤口裂开、擦伤、撕裂、二度或三度烧伤、放射性损伤、皮肤撕裂和引流伤口等)。由于表皮是上皮结构,微凝胶颗粒溶液可以用于治疗其他上皮表面(即,泌尿道上皮的(膀胱和肾),呼吸消化的(肺,胃肠),类似于皮肤上皮(即,胃或十二指肠溃疡;以及穿透至肺、膀胱、或肠瘘等的外伤)。因此,微凝胶颗粒溶液可以通过导管或插管施用于其它组织,如神经组织和心脏组织,其中组织向内生长将有利于防止疤痕形成,以及促进损伤后,如脊髓损伤、脑梗塞/中风和心肌梗死后的再生愈合。
为了原位引入,含有微凝胶颗粒的溶液可与退火溶液分开存储,并在引入期间混合(类似于环氧粘合剂的方法),以防止在进入伤口部位100之前过早引发退火反应。
在另一实施方式中,两种溶液可以存储在具有两个相等或不相等直径的筒的注射器或挤压管施用器中,使得当注射器的柱塞被压下或挤压管被压缩时,其同时地以正确的化学计量递送微凝胶颗粒12和退火溶液。图6A示出了递送装置110的一种这样的实施方式,其包括第一筒112、第二筒114以及用于从每个筒112、114分配含微凝胶颗粒12的溶液的柱塞116。例如,第一筒112包含浓度范围为0.1至5U/ml的微凝胶颗粒12和凝血酶,并且第二筒114包含浓度为0.1至1000U/ml的微凝胶颗粒12和FXIII。在两个筒112、114中,存在1比1体积分数的含K肽和Q肽的微凝胶颗粒12,其中微凝胶颗粒12中的K肽和Q肽的浓度范围为10-1,000μM。在该实施方式中,在混合后,凝血酶激活FXIII(形成FXIIIa),并且获得的FXIIIa负责在相邻微凝胶颗粒12上的K肽和Q肽的表面退火和连接。
可替代地,两个筒112、114可含有两种单独的微凝胶颗粒12类型,其具有需要组合以引发交联的退火部分。可替代的存储和递送方法将是在如图6B所示的单筒注射器110中,或如图6C所示的多用途或一次性可压缩管(例如,类似于牙膏或抗生素软膏),其中微凝胶颗粒浆料可以被挤出到所需体积并铺展在伤口部位100上,然后通过暴露至光而退火,其中用于光化学的活性剂是浓度为100μM的曙红Y,尽管浓度在10μM-1mM的范围内也会起作用。优选地,曙红Y伴有自由基转移剂,其可以是,例如具有游离巯基的化学物质。一种这样的自由基转移剂的实例,包括半胱氨酸,或者包括本文所描述的半胱氨酸的肽(例如,以500μM的浓度使用)。光应通过宽光谱白光(白炽灯或LED)或者绿色或蓝色LED灯发出。手电筒、光棒(wand)、灯或甚至环境光可以用于供应白光。曝光应该在0.1秒至1000秒之间发生,并且光的强度应该在退火部位处在0.01mW/cm2至100mW/cm2的范围之间。在另一实施方式中,光介导的退火可以使用UV光(波长在300-450nm之间)实现,其中光化学试剂是浓度为0.01%w/v至10%w/v的2959。曝光时间应在0.1秒至100秒之间,其中在退火部位处的光强度为0.1mW/cm2至100mW/cm2。对于其中使用光引发退火的实施方式,微凝胶前体12在使用之前将被存储在不透明的(相对于引发退火的波长范围是不透明的)注射器或挤压管110容器中。期望的原位位置包括内部切口和组织间隙(例如,来自手术切口或切除),烧伤伤口、放射伤口和溃疡、或在整容手术应用中填充组织位置并促进组织向内生长和再生,而不是现有的可注射物导致的普遍的纤维化过程。
使用双筒或单筒注射器的递送也适合于该指示,并且使用光活化和可插入至手术部位的UV或白光源退火。对于原位和体内应用,可以使用无菌施用器将微凝胶颗粒浆料铺展成与伤口齐平或埋设在伤口部位100内和其附近(在伤口内和超过原始伤口范围的2mm至1cm)以产生延伸超出伤口部位100或组织缺损的退火支架,以提供另外的保护、水分和结构以支持组织再生。
通过施加刺激(例如,自由基引发剂、酶、迈克尔加成等)或通过与已经存在于微凝胶颗粒12的施加部位处的刺激物相互作用来引发退火过程,该刺激物与微凝胶颗粒12的表面上的官能团互相作用,形成由退火(连接)微凝胶颗粒12形成的固体的连续的高度多孔的支架10。如果用于组织中,退火过程可允许支架10与周围环境组织融合,提供有效的密封,局部药物和/或细胞递送装置,用于体内感测的血管化支架以及更好的组织再生路径。退火过程允许现场(on-site)/按需(on-demand)的凝胶形成(其对于体外和体内应用是理想的),例如通过小切口递送到微创外科手术部位,或通过针注射或通过导管或套管。支架12可以包括微凝胶颗粒12的均质或异质群体。如所讨论的,微凝胶颗粒12的异质群体可以在物理方面(例如,在尺寸、形状或刚度上)变化或者在以下化学组成方面变化(例如,可降解的连接剂的改变的降解速率,或者改变降解速率的L-或D-氨基酸,不同的退火部分,细胞粘附部分、或具有生物活性分子或纳米颗粒的微凝胶12的负载)。最终的退火支架10的异质组成可以是随机的,或者是均匀组成的层状结构,以在微孔结构中产生梯度(例如,通过改变层中的微凝胶颗粒12尺寸)或化学组合物的梯度(通过具有不同组合物或生物活性分子负载的微凝胶颗粒12层)。梯度可用于指导体内的细胞向内生长和组织再生,或体外的组织结构的发育。可以通过递送单一组合物的凝胶的顺序浆料,然后退火,且随后递送第二组合物的下一凝胶,接着退火来实现微凝胶颗粒12组合物中的梯度,该退火将新的微凝胶层连接到前一层,直到已经累积了期望数量的层。可以使用注射的浆料的体积和注射部位的面积来控制每个层的厚度。实现梯度的可替代的实施方式是装载多筒注射器施加器,如在图6A中所示的在每个筒中具有不同的微凝胶组合物。同时地将每个筒压缩并以分层的片供给到喷嘴120。注射器施用器的喷嘴120自身可以是非圆形或者是矩形的,以产生注入至带状结构中的部位的多种组合物的分层浆料,其然后可以在该布置中退火。可以通过自由基、酶促或化学的(例如,点击化学)方法实现结构连续的退火支架10的形成。
在一种或多种实施方式中,一旦准备将微凝胶颗粒12置于递送部位,那么通过微凝胶颗粒12之间的表面化学相互作用进行退火。在一种实施方式中,该方法通过经由表面可聚合基团的自由基引发的退火(例如,通过光敏自由基引发剂的自由基引发等)进行。在另一实施方式中,该过程通过经由表面呈递的酶促活化的底物(例如,转谷氨酰胺酶,如因子XIIIa)的酶促化学发生。在另一实施方式中,该过程通过经由迈克尔和假迈克尔加成反应的共价偶联发生。该方法可以使用当混合时形成固体支架10的多种微凝胶颗粒群体类型(例如,呈现例如亲核表面基团的微凝胶颗粒12A型,和呈现例如α,β-不饱和羰基的微凝胶颗粒12B型)。在另一实施方式中,该过程通过点击化学(click chemistry)粘着发生。类似地,该方法可以使用当混合时形成固体微孔凝胶的异质微凝胶颗粒12群体。在另一实施方式中,可以使用光(例如,白光或UV光)实现退火,以引发凝胶表面上分子之间的化学反应,该化学反应由在本文描述的微凝胶中和其周围(或直接共价地连接至其)的溶液中的光活化分子介导。
在一种优选的实施方式中,微凝胶颗粒12包括与酶促可降解交联剂结合的基于PEG的聚合物主链以允许生物再吸收性。在某些实施方式中,基于PEG的聚合物主链是用于细胞粘附性能(例如,RGD)和表面退火官能性(例如,K和Q肽)的寡肽预修饰的4-臂聚(乙二醇)乙烯基砜(PEG-VS)主链,并且交联剂是基质金属蛋白酶(MMP)-可降解交联剂。
在一种或多种实施方式中,微凝胶颗粒12由油包水乳剂(乳液,emulsion)形成。在PEG溶液与交联剂溶液组合后(紧接着在完成凝胶化之前分配到微凝胶液滴中),发生微凝胶颗粒12的凝胶化。可以进一步地添加包括肽配体的多种底物以增强生物活性。在一种实施方式中,通过向纯化的微凝胶颗粒12添加和活化自由基光引发剂以诱导化学交联来实现支架形成。在另一种实施方式中,通过对纯化的微凝胶颗粒12使用和/或活化内源性存在的或外源性施加的谷氨酰胺转移酶因子XIII以诱导酶促的交联来实现支架形成,该微凝胶颗粒12在形成之前、形成期间或形成之后已经用两种肽配体修饰。在单独的实施方式中,使用上述自由基和酶促方法的组合实现支架形成。
由于在体内形成完全相互连接的微孔支架的能力,本公开主题的获得的支架10提供了优于当前多孔支架技术的优点。通常,由于通过孔的移动自由,多孔支架提供更多的活细胞接近(即,不需要降解以允许像所有当前和先前的无孔和纳米多孔支架那样的穿透)。例如,当在体内皮肤伤口中植入并退火支架10时,如在图7B中看出的,当与相同材料的无孔凝胶相比时,在5天后观察到显著增强的细胞侵袭和生长中的组织结构。图7A示出了对于在注射24小时后,用支架10(标识为MAP支架)以及无孔对照注射的组织,SKH1-Hrhr小鼠中的组织切片的H&E染色。图7B示出了作为注射后天数的函数的伤口闭合(%)的图。该图示出了,当与无孔双侧对照(N=5)相比时,在五(5)天的时间段内,使用支架10的伤口闭合率存在统计学显著的改善。图7C示出了在SKH1-Hrhr小鼠中,在5天体内伤口愈合模型期间,伤口闭合的代表性图像。图7D示出了在7天的体内BALB/c小鼠实验期间,伤口闭合的代表性图像。图7E示出了来自BALB/c体内伤口愈合的伤口闭合定量数据。在体内7天后,与未治疗对照、无孔PEG凝胶和缺少K和Q肽的凝胶相比,支架10促进明显更快的伤口愈合。使用规范的、基于致孔剂的铸造方法,体外生产的精确匹配伤口形状的多孔凝胶表现出了可观的伤口愈合率,与支架10相当,但缺乏可注射性(N≥5)。图7F示出了对应于图7D的每种治疗类型的体内7天期间伤口床(wound bed)闭合的痕迹。
此外,施用至微凝胶颗粒12或支架10的治疗剂可以缓慢地或快速地释放,并且取决于预期的治疗(例如,如果其用于治疗慢性伤口,则使用随时间缓慢降解的更稳定的交联剂),支架10具有在预定时间段内通过水解、蛋白水解或酶解而分解的能力。此外,微凝胶支架10的退火质量允许支架10作为组织密封剂起作用(例如,急性伤口、手术闭合等),以及临床上可用于模拟组织的不同模制形状的填充。图7G示出了如何使用类似于图6A或6B的注射器装置将包含微凝胶颗粒的溶液或浆料施加至治疗部位,其中微凝胶符合注射部位的形状(例如,在这种情况下为星形部位),并且随后将支架10退火成星形。
通过调节微凝胶支架10的降解速率,可以改变伤口中的疤痕形成或再生反应。在一种实施方式中,通过在MMP-可降解交联剂中使用D-氨基酸而不是L-氨基酸来修饰微凝胶支架10的降解速率。调节微凝胶颗粒12与交联剂中D-或L-手性的比值,调节组织中的降解速率。由D和L交联的微凝胶(以1:1的比值)的混合物制成的支架10在注射21天后导致凝胶存在于组织中,然而,在仅有D的凝胶中,在体内21天后没有留下剩余的凝胶。组织愈合和疤痕形成反应还取决于D:L的化学计量,并因此取决于降解速率。图8A-8G示出了直接与未治疗的伤口相比,当使用D:L的1:1混合物时疤痕减少的效果。在1:1的D:L凝胶治疗中,皮肤厚度加倍并且疤痕尺寸减少25%。此外,与未治疗的情况相比,在凝胶治疗的情况下,存在六(6)倍的毛囊和汗腺。
实验性的
使用微流体的油包水乳液方法将连续的预凝胶含水相分割成如本文所描述的均匀的支架构建块。在微观尺度上连续生成微凝胶颗粒12作为构建块,而不是使用典型的基于涡流和超声的方法,能够严格控制出现的支架10的形成环境和最终的材料性能。通过调节预凝胶溶液和挤压油流(pinching oil flow)的流速以及微流体通道的几何形状,产生具有低多分散性(low polydispersity)的一系列微凝胶颗粒尺寸。虽然制造方法是连续的,但其实际上保持高通量属性,其中生成速率是对于较大颗粒(>100μm)的250Hz至对于小颗粒(约15μm)的约1200Hz的范围。这对于单个装置每50分钟转化为大约100μl的预溶胀的凝胶。这种方法最终导致物理和化学上高度单分散的颗粒。微流体产生微凝胶颗粒“构建块”是容易扩展的过程:对于广泛采用和使用的实际需求。
获得的微凝胶颗粒12由以下的完全合成的水凝胶网组成:用细胞粘附肽(RGD[SEQ ID NO:3])和两个转谷氨酰胺酶肽底物(K[SEQ ID NO:1]和Q[SEQ ID NO:2])修饰的聚(乙二醇)-乙烯基砜(PEG-VS)主链。微凝胶颗粒12通过迈克尔型加成与半胱氨酸封端的基质金属蛋白酶敏感性肽序列交联,这允许细胞控制的材料降解和随后的再吸收。
将微凝胶颗粒12纯化至等渗细胞培养基的水性溶液中用于存储,并且当用于形成凝胶时,微凝胶颗粒12通过活化因子XIII(FXIIIa)介导的K和Q肽之间的非标准的酰胺键彼此退火,该活化因子XIII作用为稳定血凝块的天然存在的酶。这种酶介导的退火过程允许将活细胞并入包含相互连接的微孔网络的动态形成的支架10中。在添加FXIIIa之后,且在支架退火之前,微凝胶颗粒12的浆料可以通过注射器施加递送,最终固化成其被注入的腔的形状。图9A示出了如何通过调节pH和温度来改变退火动力学。为该实验选择的退火环境为pH 8.25和37℃的温度。
在向微凝胶颗粒12添加FXIIIa时观察到导致退火凝胶中储能模量超过三倍增加的结构变化。通过高真空SEM观察证实退火被认为是支架形成所必需的,其中在脱水后,支架采用高度拉伸但相互连接的网,而没有FXIIIa的构建块则分离成单独的球形珠(图9E)。
通过调节微凝胶粒径和组成,能够产生多组组装的支架10。通过使用直径为30至150μm的微凝胶颗粒12,实现了中值孔径范围为约10至约35μm的网络)。筛选不同的PEG重量百分数和交联剂化学计量以证明约10至1000Pa(其跨度为对于哺乳动物软组织模拟物所需的刚度方案)的容易实现的存储模量的范围。图9B示出了不同的水凝胶重量百分数用于产生不同刚度的材料。图9C示出了用于在获得的凝胶中产生不同刚度值的不同交联剂化学计量(交联剂末端(-SH)与乙烯基基团(-VS)的比值)。图9D示出了对于无孔对照以及本文所描述的本发明多孔凝胶的%降解作为时间的函数的图。对于体外的体积相等的凝胶,显示了基于颗粒的多孔凝胶和无孔的降解动力学。由于更高的表面积和体积比以及更快的通过微孔凝胶的传输,基于颗粒的多孔凝胶比无孔凝胶降解快。使用1:1000进行降解,导致比伤口床中更高的蛋白酶浓度和更快的降解动力学。图9E示出了用FXIIIa退火的支架的SEM图像。图9F示出了不含FXIIIa的微凝胶颗粒12的SEM图像。未退火的颗粒见于图9F中。
为了评估所产生的支架支持细胞生长和网络形成的能力,开发了使用三种人细胞系的体外细胞形态学和增殖模型。这些包括:真皮成纤维细胞(HDF)、脂肪来源的间充质干细胞(AhMSC)和骨髓来源的间充质干细胞(BMhMSC)。将单细胞悬浮液动态合并于FXIIIa退火凝胶内。在支架内培养二十四(24)小时后,三种细胞系表现出高的细胞活力(≥93%)。HDF和AhMSC细胞系在6天培养期间显示出持续的增殖,具有分别为1.5天和2天的倍增时间。观察到BMhMSC也经历增殖,然而具有约12天的延长的计算倍增时间。
合并于支架的细胞在退火开始后90分钟开始表现出扩散形态。在培养两(2)天后,支架内的所有观察到的细胞显示完全扩展的形态,这持续到第六天(6)。重要的是,第二天(2)观察到所有细胞系的广泛的网络形成。细胞网络在整个实验中尺寸和复杂性增加。BMhMSC需特别值得注意,由于其广泛的网络形成和较慢的增殖速率,表明这些细胞能够传播到极长的长度,同时在微孔支架内形成高度相互连接的细胞网络。值得注意的是,在具有相同化学性能(5wt%,G’=600Pa凝胶)和机械性能(4.5wt%,G’=350Pa凝胶)的无孔凝胶中生长的细胞维持存活力,但没有显示任何可估计的网络形成,甚至在培养六天后。
假设支架在体外能够实现细胞增殖和有利网络形成的能力,表明支架能够支持体内细胞迁移,以及在支架内的本体组织整合的能力。为了测试这个假设,使用鼠皮肤伤口愈合模型,处理了感兴趣组织用于先前植入的多孔生物材料。重要的是,使用了限制组织向内生长闭合(停止,closure)的缝合的橡胶夹板来防止伤口收缩,更好地模拟人类的愈合反应。由于基于微凝胶颗粒支架的可注射性,微凝胶颗粒能够直接递送到伤口部位,随后通过外源FXIIIa进行原位退火。这通过同时将微凝胶颗粒“构建块”彼此连接以及与存在于周围组织中的内源性赖氨酸和谷氨酰胺残基连接而提供了无缝界面。类似地,观察到化学相同的无孔双侧对照的无缝界面。如在图7B中示出的,尽管它们具有相似的界面,当注射到CLR:SKH1-Hrhr小鼠的伤口中时,所产生的支架导致比无孔对照(在5天后,分别为60%相对于100%的剩余伤口面积)显著更快的伤口闭合。
伤口闭合率的差异导致了对于以下研究,即对无孔和可注射的可分开类的凝胶的组织反应的差异。使用微凝胶颗粒的支架注射在体内五(5)天后导致广泛的伤口再上皮化。在支架顶端表面上观察到具有分层鳞状形态的角蛋白-5+细胞,然而没有观察到通过无孔伤口边缘的细胞(角蛋白-5+或其他)。重要的是,支架能够维持看起来是完整的毛囊的形成,其中伤口床内的相邻皮脂腺类似于未受伤的皮肤中的这些腺体的结构。此外,在包含管状结构和上皮内陷(epithelial invagination)的支架内观察到较大的角蛋白-5+组织结构的其它情况。假设一起地,这些结果示出了对表皮再生有贡献的更高级的集体迁移(即,一致的多细胞簇的移动)。尽管细胞能够浸润无孔双侧对照(如DAPI染色所示),但在体内五(5)天后没有发现再上皮化或皮肤组织形成的迹象。
通过进一步研究,发现支架通过体内复杂的血管网络形成促进了本体整合。在五(5)天后,内皮细胞和支持性周细胞(supporting pericyte)存在于支架内,而在无孔双侧对照中仅存在没有支持性周细胞的内皮细胞的单个分支。共定位的内皮细胞和周细胞的存在是成熟血管网络形成的证据。据我们所知,这是在不包括外源性生长因子下,早期(<7天)周细胞迁移到合成的可注射材料或植入的多孔支架的第一个例子。
在研究由可注射支架提供的无缝界面时,在第一天(1)观察到整体和免疫细胞数量的差异。在注射后一(1)天,与其无孔双侧对照相比,支架含有显著更高数量的支架内的细胞。这证实了先前在我们的体外网络形成实验中观察到的细胞迁移的更大的容易性(ease)。此外,当与相同小鼠的无孔双侧对照相比时,支架及其周围组织含有显著更少数量的多形核细胞。该结果示出了在第一天(1)对于支架的总体较低的初始固有免疫应答。在注射后五(5)天后,相对于无孔对照,在周围组织和支架内存在较低分数的CD11b+细胞(活化的白细胞),表明持续较低水平的炎症免疫应答,与在体外构建和植入的微孔支架中观察到的一致。组合地,这两个结果支持了当前未充分探究的几何组分对来自化学相同的可注射生物材料的免疫刺激。
基于退火的微凝胶颗粒的支架代表了一类新型的可注射生物材料,其通过各个构建块的可靠实现的不完全的自组装(imperfect self-assembly)和退火来引入微尺度的相互连接的孔隙。这种方法允许通过确定性化学组合物和微流体颗粒产生来控制微尺度和分层的宏观尺度性能。两种合并的活细胞和周围的宿主组织能够立即浸润支架而不需要材料降解,这是在使用可注射支架之前从未实现的成就。
在体内,可注射的微凝胶颗粒完全填充组织空隙,提供与周围组织的无缝边界。与可注射的无孔对照相比,获得的支架的相互连接的微孔性促进了伤口部位的细胞迁移,导致与周围组织的更大的本体整合,同时引起减少的宿主免疫应答。最终,这导致比类似地包含的可注射无孔凝胶更快的健康组织重塑。
该凝胶系统通过利用晶格形成的负空间促进复杂三维网络在时间尺度上的发展,表现出了自底向上模块化生物材料的方法的根本变化,这在先前的使用现有的水凝胶技术所未见过的。该策略的“即插即用(plug and play)”属性允许结合广泛范围的已经建立的材料(例如,纤维蛋白)、信号(例如,生长因子)和细胞群(例如,干细胞)。具有确定的化学和物理性能的构建块的复杂组合可以使得在不同的生理位置(例如,神经、心脏、皮肤等)范围内的组织再生,其中颗粒退火的支架通过它们的构建块性能定制每个小生境。微孔隙率、可注射性和支架所固有的模块化组装的独特组合具有改变体内组织再生和组织再生的环境(landscape)的潜力。
使用如前所述的软光刻(soft lithography)制造微流体油包水液滴发生器。简言之,使用KMPR 1025或1050光致抗蚀剂(Microchem)在机械级硅晶片(University wafer)上制造主模具。根据制造商的建议,通过以不同速度旋转光致抗蚀剂,获得不同的通道高度。装置使用聚(二甲基)硅氧烷184试剂盒(Dow Corning)由母料模制。将基料和交联剂以10:1的质量比混合,倒在模具上,并脱气,然后在65℃下固化6小时。通过在50毫托和75W下用氧等离子体处理PDMS模具和玻璃显微镜载玻片(VWR)15秒来密封通道。在通道密封后,立即通过注入100μl RAIN-的溶液并在室温下反应20分钟,使通道官能化。然后通过空气干燥通道,随后干燥过夜。
使用如图3A-3F和4A-4C所示的微流体油包水分割系统产生液滴。含水相是两部分的1:1体积混合物:(i)在300mM三乙醇胺(Sigma),pH 8.25中的10%w/v的4臂(arm)PEG-VS(20kDa),被500μM的K-肽(Ac-FKGGERCG-NH2[SEQ ID NO:1])(Genscript)、500μM的Q-肽(Ac-NQEQVSPLGGERCG-NH2[SEQ ID NO:2])和1mM的RGD(Ac-RGDSPGERCG-NH2[SEQ ID NO:3])(Genscript)预官能化以及(ii)与10μM的Alexa-fluor 647-马来酰亚胺(Life Technologies)预先反应的8mM(对于三入口装置为12mM)的二半胱氨酸修饰的基质金属蛋白酶(MMP)(Ac-GCRDGPQGIWGQDRCG-NH2[SEQ ID NO:4])(Genscript)底物。在用于分割系统之前,所有溶液在Leur-Lok注射器式滤器中通过0.2μm的聚醚砜(PES)膜无菌过滤。
在37℃下在用于实时监测微凝胶质量的温育的显微镜载物台(Eclipse Ti)上进行生成。输入的水性溶液没有明显混合,直到液滴分割(佩克特数>10)。油相是补充有0.25%v/v80(Sigma-Aldrich)的重矿物(Fisher)油。在分割区域的下游,添加具有高浓度的80(5%v/v)的第二油入口,并混合到流动的液滴乳液中。最终,微凝胶-油混合物排出到较大(12mm的直径,约1mL的体积)孔中,其中微凝胶颗粒在37℃下固化最少1小时。然后通过将油溶液覆盖在HEPES缓冲盐水pH 7.4的水性缓冲液中并在台式离心机中以18000×g离心5分钟来提取和纯化该混合物。在含有10mM的CaCl2和0.01%w/v的普朗尼克F-127(Sigma)的HEPES缓冲盐水pH 7.4中洗涤基于微凝胶的颗粒。然后使微凝胶水性溶液溶胀并在37℃下用缓冲液平衡至少2小时。
为了确定液滴分割的操作方案,使用高速照像机(Phantom)实时监测装置操作,随后图像分析用于尺寸和多分散性测量(使用ImageJ软件)以及分割频率(Phantom PC2)。为了在该平台上的稳定的液滴分割:(i)以5ml/min同时引发所有的流动(含水流两者和油流两者)直到所有空气已经从装置中冲洗,(ii)将水流速率降低到所需的总体积速率(水流速率在1.5至2μL/分钟之间,并且油流速率在1至5μL/分钟之间,持续5分钟,(iii)从收集孔中吸出所有积累的液体,以确保收集单分散的微凝胶(μgel),以及(iv)运行产生。
通过在18000×g下离心五分钟,将完全肿胀的和平衡的“构建块”微凝胶颗粒造粒,并且通过吸出来去除过量的缓冲液(HEPES pH 7.4+10mM CaCl2),并且用无尘擦拭纸(cleanroom wipe)干燥。随后地,将微凝胶颗粒分成等份,每份包含50ml的浓缩的构建块。将相等体积的HEPES pH7.4+10mM CaCl2添加到浓缩的构建块溶液。这些中的一半包含2U/ml的最终浓度的凝血酶(Sigma)并且另一半包含10U/ml的最终浓度的FXIII(CSL Behring)。随后将这些溶液充分混合,并且在18000×g下旋转,随后用无尘擦拭纸(American Cleanstat)去除过量的液体。
通过使用正位移移液管(Gilson)混合等体积的含有凝血酶和FXIII的构建块溶液起始退火。通过重复上下吸移以及使用移液管吸头的搅拌来充分混合这些溶液。然后将混合溶液移液至所需位置(模具、孔板、小鼠伤口等)。
为了确定每种微凝胶的凝胶动力学,使用相同的化学组合物产生大规模(50μL)的无孔凝胶。将溶解在0.3M的TEOA中的30μL的2X PEG-VS+肽(RGD、K和Q肽)的溶液与溶解在水中的30μL的2X MMP-1交联剂组合。将混合物快速涡旋,并且将50μL的混合物置于两个8mm的间距为1mm的流变盘(rheological discs)(Anton Paar Physica MCR301流变仪)之间。然后在20分钟的时间段内,测量储能模量(2.5Hz,0.1%应变)。
为了确定预退火的微凝胶颗粒和退火后支架的体积储能模量,进行振幅扫描(0.01-10%应变)以找到各自的线性振幅范围。选择在线性范围内的振幅以运行振幅扫描(0.5-5Hz)。对于预退火的微凝胶颗粒,将50μL的微凝胶颗粒(5wt%的PEG-VS 4-臂MW=20KDa,r=0.8MMP-1交联剂,以及合成肽浓度为250μM的合成K、合成肽浓度为250μM的合成Q和合成肽浓度为500μM的合成RGD)注入两个8mm的间距为1mm的流变盘之间。对于退火后的支架测量,我们首先将50μL的掺有5U/mL最终浓度的FXIIIa和1U/mL最终浓度的凝血酶的微凝胶颗粒(N=3)(5wt%的PEG-VS 4-臂MW=20KDa,r=0.8的MMP-1交联剂,以及合成肽浓度为250μM的合成K、250μM的合成Q、500μM的合成RGD)吸移至两个载玻片之间。允许将这种混合物在移除顶部载玻片之前部分退火10分钟,并且置于在37℃的湿润培育箱中90分钟。随后将支架置于HEPES缓冲盐水(pH 7.4))过夜,以达到平衡。随后将样品置于在流变仪上的两个8mm盘之间,并且与预退火的微凝胶颗粒同样进行检测。
为了确定退火的微凝胶支架中的中值孔径,如上所述的,使用不同尺寸的微凝胶颗粒的储备溶液(母液,stock solution)以将来自每个(总共9个支架)的三个单独的支架退火。使用装备有C2激光LED共聚焦的Nikon Ti eclipse显微镜(Nikon Ti eclipse),在每个凝胶中截取单个切片,在每个切片之间分离50μm(每个凝胶10个切片,每种凝胶类型总共30个切片)。然后使用在中编写的定制脚本(custome script)分析这些图像,以识别孔区域并计算以px2计的每一个的尺寸。然后使用每个单独的孔尺寸用于计算该凝胶的中值孔径,并使用从原始显微镜图像(0.31μm/px)的像素至μm的转换将其转换为μm2。然后通过将面积压成圆形,并计算这些圆的特征直径,将这些面积转换成特征长度测量。对于30μm的微凝胶颗粒,平均孔径为约12μm。对于100μm的微凝胶颗粒,平均孔径为约19μm。对于150μm的微凝胶颗粒,平均孔径为约37μm。应注意,间隙或空隙是连续的,并且不类似于通过微颗粒浸出或反蛋白石凝胶(inverse opal gel)制造方法产生的通过圆形孔连接的明确限定的球形开放区域,然而,参考孔径可用于简单地描述空隙空间的长度规模。
为了确定在添加FXIIIa之后微凝胶颗粒是否共价连接,使用SEM直接观察支架。用FXIIIa(10U/ml)或仅用缓冲液处理微凝胶颗粒混合物。随后,将构建块溶液置于1×1的硅晶圆片中,并在SEM(Hitachi S4700)高真空室(1×10-3毫托)中干燥。然后,如图9D和9F所示的,使用10kV(最大10mA)在200x或500x上观察具有或不具有FXIIIa的构建块。
在补充有10μg/ml嘌呤霉素的DMEM(Life Technologies)中培养通过慢病毒转染组成性表达GFP的HEK293T细胞。三种细胞用于体外实验:人真皮成纤维细胞(HDF,Life Technologies)、骨髓来源的人间充质干细胞(BMhMSC,Life Technologies)和脂肪来源的人间充质干细胞(AhMSC,Life Technologies)。根据制造商的说明书(在合并至多孔或无孔的凝胶之前和之后)培养所有的细胞系。具体地,对于MSC群体减少的血清,使用基础培养基(Life Technologies)来培养干细胞。
为了定量细胞增殖和体外多孔支架中网络形成的可视化,基于颗粒的支架与如上所描述的微凝胶颗粒退火,在退火之前向构建块溶液添加细胞悬浮液。对于每种细胞系,在未补充有血清的相应培养基中制备最终浓度为25×106个细胞/ml的细胞悬浮液。随后,将2μl的细胞悬浮液添加至50μl的含FXIII的微凝胶颗粒混合物中,并与50μl的含凝血酶的微凝胶颗粒混合物(500个细胞/μl的凝胶)合并。将该混合物注入至盖玻片底部PDMS孔的角落中。用第二盖玻片覆盖孔顶部,并允许微凝胶/细胞混合物在37℃下经受退火90分钟。
退火完成后,移除顶盖玻片,将适当的完全培养基添加至PDMS孔中。对于第0天时间点,将4%的PFA直接添加至PDMS孔中,并允许在4℃下固定过夜。其他细胞在5%的CO2和37℃下生长指定的时间(2、4和6天),此时用1×PBS将它们洗涤一次,并在4℃下用4%PFA固定过夜。通过将细胞与微凝胶颗粒(如上所述)混合,并将5μl的混合物吸移至模具的中心,将HEK-293-T细胞结合至星形模具中。紧接着,将不含细胞的微凝胶颗粒吸移至模具的其余部分中,并如上所述进行退火。
通过在体外培养0、2、4和6天后,计数存在于基于颗粒的支架构建体中的细胞核的数目来评价增殖。用1×PBS中的2μg/ml DAPI溶液将细胞核染色2小时,随后使用405nm的LED激光器在Nikon C2上观察。具体地,通过在150μm的总z高度截取55个z切片并将每5个切片压缩成最大强度投影(MIP)图像来对每个支架成像。使用定制的脚本枚举MIP中的细胞核,计数细胞的总数。对于每个时间点,分析了三个单独的微凝胶支架的z堆叠图像,其中每个z堆叠图像测量总体积为1270×1270×150μm3(或约280nL)。90分钟计数导致约525个细胞/μl凝胶的计算,与添加的实验量(500个细胞/μl凝胶)一致。
为了在体外可视化微凝胶支架内的细胞网络形成,如上所述制备、生长和固定构建体。用在1X PBS中的1%BSA将支架在室温封闭1小时,随后通过鬼笔环肽的罗丹明-B缀合物(Life Technologies)在室温下对f-肌动蛋白染色3小时。然后用1X PBS中的1%BSA洗涤支架,随后在室温下用1X PBS中的2μg/ml的DAPI溶液复染色1小时。除了使用40倍放大的水浸透镜之外,与增殖成像一样进行成像。图像堆叠的总高度为130μm,切片的总数为260(体积捕获约15nL)。
将PEG-VS支架(5wt%的PEG-VS 4-臂MW=20KDa,r=0.8的MMP-1交联剂,以及合成肽浓度为250μM的合成K[SEQ ID NO:1]、250μM的合成Q[SEQ ID NO:2],500μM的合成RGD[SEQ ID NO:3])用于封装细胞(500个细胞/μL)。所用的细胞系与微凝胶支架实验中的相同。在置于合适的培养基中之前,形成凝胶20分钟(TEOA 0.3M,pH 8.25)。在预定的时间点(t=90分钟、2天、4天和6天)后,使用PFA在4℃下过夜,将凝胶固定,洗涤并存储在PBS中。将凝胶如在微凝胶支架中的那样染色。当未成像时,将所有的样品在4℃下在具有P/S的PBS中保存。使用C2共聚焦进行成像,正如在微凝胶支架体外实验中的一样。
用异氟烷(1.5%,10分钟)麻醉CLR:SKH1-Hrhr小鼠(Charles River实验室)(每次试验N=6),然后剪断指甲并注射止痛药(丁丙诺啡,0.015μg/μL下60μL/20g)。拉紧皮肤并使用4mm活检穿孔器在小鼠背部产生相同的圆形伤口。使用经由7-8针缝合到周围皮肤的橡胶夹板固定伤口的周边,以防止通过收缩伤口闭合。将包含10U/ml FXIIIa的无孔或多孔水凝胶注射到伤口床中,允许其进行凝胶化10分钟,随后通过弹性纱布包裹物覆盖伤口以防止动物相互作用。然后将小鼠分开至单独的笼中。在接下来的48小时中每12小时皮下施用疼痛药物(对于第1天,在手术后施用一次疼痛抑制剂)。
在第1天,通过异氟烷过量给药处死小鼠(N=6),然后随后进行脊柱错位。使用外科剪刀除去背部的皮肤,并通过10mm的活检穿孔器分离伤口部位。使用4%的甲醛在4℃立即地固定样品(过夜),然后转移到乙醇中并将样品包埋在石蜡块中。然后将块用超薄切片机(Leica)切成6μm的厚度,并进行苏木精和曙红(H&E)染色。为了量化水凝胶中的细胞浸润和水凝胶周围的免疫应答,对每个切片检查一系列3个随机高功率(40X)场显微(high power field)(HPF)。通过计数注射的水凝胶内的任何类型的细胞的总数(N=5,其中每个伤口分析3个切片中的细胞总数)来分析样品的细胞浸润(至凝胶中>0.1mm)。大于95%的浸润凝胶的细胞是嗜中性粒细胞。为了测量免疫应答,检查来自伤口的不同切片的3个HPF的平均值。在伤口边缘的水凝胶的0.2mm内的白细胞/HPF的总数量被定量并且对于每种伤口类型取平均值。将每个伤口的白细胞计数与其在相同动物上的双侧对照进行比较,并将相对差异记录为每只动物的总免疫应答的分数。由于每只动物具有一个注射有微凝胶支架的伤口和一个具有无孔对照的伤口,因此这种比较是可能的。
每天对伤口进行成像以跟踪伤口的闭合。使用高分辨率照相机对每个伤口部位成像。通过将伤口的像素面积与红色橡胶夹板的10mm中心孔内的像素面积进行比较来确定闭合分数。对于每种小鼠/支架类型,将闭合分数归一化为第0天(图7B)。
在第5天,处死小鼠(N=6),并如第1天的小鼠一样收集组织。将样品立即浸没在TISSUE最佳切割温度(OCT)流体中,并用液氮冷冻成固体块。然后将块用冷冻超薄切片机(Leica)冷冻切片为25μm的厚度,并且保持冷冻直至使用。然后将切片在室温下用多聚甲醛固定30分钟,用PBS水合,并保持在4℃直至染色。
含有组织切片的载玻片用1X PBS+0.05%吐温-20(PBST)中的3%正常山羊血清(NGS)封闭,或同时用在1X PBST的3%NGS的X-100封闭和透化仅用抗角蛋白-5染色的切片。然后在1X PBST中3%NGS中洗涤切片。如下在的1X PBST中3%NGS中制备初级抗体稀释液:
大鼠抗小鼠CD11b(BD Pharmingen)-1:100
大鼠抗小鼠PECAM-1(BD Pharmingen)-1:100
兔抗小鼠NG2(Millipore)-1:100
兔抗小鼠角蛋白5(Covance,Inc.)-1:250
在4℃下用第一抗体将切片染色过夜,随后用1X PBST中3%NGS洗涤。在1X PBST中3%NGS中以1:100的稀释度制备第二抗体。将切片在第二抗体中在室温下温育1小时,随后用1X PBST洗涤。用2μg/ml的1X PBST中的DAPI在室温下将切片复染色30分钟。将切片安装在Antifade Gold封片剂(mounting medium)中。
将从第5天的组织切片(来自无孔和微凝胶支架组织块)获得的共富集z-堆叠图像压缩成MIP,随后分离成对应于每个激光通道(即,Gel,DAPI,CD11b)的单个图像。凝胶通道图像用于使用Adobe illustrator跟踪凝胶-组织界面的边缘。该线的宽度从界面(总厚度150μm)扩展到组织中和凝胶中75μm。然后将该线的新边缘用于裁剪原始DAPI和CD11b图像,以从组织凝胶界面仅捕获对应于+/-75μm的区域。然后将这些图像导入ImageJ,并将其叠加以将DAPI和CD11b通道合并为单个图像。使用来自ImageJ的细胞计数插件分析该图像,其中定量细胞核的总数以及CD11b+细胞的总数。最后,报道了组织内和凝胶内二者的具有相应的CD11b+信号的细胞核的分数。
图11示出了治疗受损组织102的方法的一个实施例。图11示出了在哺乳动物的组织102中形成的伤口部位100。在操作500中,使用在其中包含微凝胶颗粒12的浆料(包含在水性溶液中)的递送装置110(例如,如图所示的管),将微凝胶颗粒12递送至伤口部位100。接下来,如操作510所示,可选的施加器122用于将微凝胶颗粒12扩散至伤口部位100中及其上方。施加器122还用于使微凝胶颗粒12的上部的暴露表面与组织102的表面大致齐平。施加器122还可用于使微凝胶颗粒12的上部的暴露表面相对于组织102的表面隆起或升高,以允许用于细胞向内生长的结构增加以及防止在完全愈合时的组织界面凹陷。接下来,如操作520所示,开始微凝胶颗粒12的退火以形成退火的微凝胶颗粒12的支架10。在该特定的实施例中,手电筒形式的光源124用于照射微凝胶颗粒12、光引发剂(例如,曙红Y)和自由基转移剂(例如,RGD肽)的混合物。当然,也可以使用如本文所描述的其他的退火方式。图11中所示的退火反应导致形成其中具有间隙空间的微凝胶颗粒12的共价稳定的支架10。然后,来自周围组织102的细胞106(如图2C所示)开始浸润支架10内的空间,生长,刺激并最终实现组织102的愈合过程。在一种实施方式中,在退火反应之后,将绷带或湿性敷料可选地置于支架填充的伤口上以保护其在愈合过程中免受损伤。在经过一段时间之后,如操作530所示,支架10已经降解,并且组织102已经返回到愈合状态。
为了评估多孔凝胶支架支持细胞生长和网络形成的能力,使用三种人细胞系开发体外的细胞形态学和增殖模型:真皮成纤维细胞(HDF)、脂肪来源的间充质干细胞(AhMSC)和骨髓来源的间充质干细胞(BMhMSC)。将单细胞悬浮液动态合并至FXIIIa退火的多孔凝胶支架内。在多孔凝胶支架内培养二十四(24)小时后,三种细胞系表现出高细胞活力(≥93%,图12B)。
合并至多孔凝胶支架中的细胞在退火开始后九十(90)分钟开始显示扩散的形态。在培养两(2)天后,在多孔凝胶支架内的所有观察到的细胞表现出完全扩散的形态,这持续到第六天。重要地,在第二天观察到所有细胞系的广泛的网络形成。细胞网络在整个实验中尺寸和复杂性增加。BMhMSC需特别值得注意,如图12A所示的,BMhMSC的扩张网络形成和较慢的增殖速率表明这些细胞能够扩散到极长的长度,在微孔支架内形成高度相互连接的细胞网络。
如图13A所示的,微凝胶颗粒12可以在退火之前与活细胞106的溶液合并且混合以产生微孔支架10,该微孔支架10包含驻留在微孔网络中并且均匀或不均匀分散在宏观的退火凝胶支架10内的活细胞106。
可以将微凝胶颗粒12纯化至等渗细胞培养基的水性溶液中用于保存,并且当用于形成多孔凝胶时,通过K和Q肽之间的非标准的酰胺键彼此退火,该非规范酰胺键由活化的因子XIII(FXIIIa)(一种负责稳定血凝块的天然存在的酶)介导。这种酶介导的退火过程允许活细胞106合并至包含相互连接的微孔网络的动态形成的多孔支架10中。在添加FXIIIa之后,但在支架退火之前,可以通过注射器施加递送微凝胶颗粒12的浆料(图13A),最终固化成它们被注入其中的腔的形状,如图13B-E所示的。
如图14A所示的,微凝胶颗粒12的微流体制造使得能够确定性地控制微凝胶尺寸和生产频率。施加到微流体系统20的入口的压力决定微凝胶产生的频率(图14B)。此外,如图14C所示的,使用不同尺寸的微凝胶颗粒12产生的多孔微凝胶支架10具有不同的多孔特性,如网络内的中值孔径。
虽然已经示出并描述了实施方式,但是在不脱离本文公开的发明构思的范围的情况下,可以进行各种修改。因此,除了所附权利要求及其等效物之外,本文描述的主题不应受到限制。
- 还没有人留言评论。精彩留言会获得点赞!