蒽环类二硫化物中间体、抗体‑药物缀合物和方法与流程
本申请要求2014年9月12日提交的美国临时申请号62/049720的优先权的权益,该美国临时申请据此以引用的方式整体并入。
序列表
本申请含有序列表,该序列表以ASCII格式电子提交并且据此以引用的方式整体并入。于2015年9月4日创建的所述ASCII副本命名为P05813-US_SL.txt并且大小为16,012字节。
发明领域
本发明总体上涉及缀合至蒽环类二硫化物中间体以形成具有治疗或诊断应用的抗体-药物缀合物的抗体。抗体可被工程化具有对与蒽环类二硫化物中间体缀合有反应性的游离半胱氨酸氨基酸。本发明还涉及使用抗体-药物缀合物化合物用于体外、原位和体内诊断或治疗哺乳动物细胞或相关病理学病状的方法。
发明背景
抗体药物缀合物(ADC)为靶向的化学治疗分子,其通过将有效的细胞毒性药物靶向至抗原表达肿瘤细胞、内化和释放药物而结合抗体和细胞毒性药物的性质,从而增强它们的抗肿瘤活性(Carter,P.和Senter,P.(2008)The Cancer Jour.14(3):154-169)。针对给定靶抗原的成功的ADC开发取决于抗体选择的优化、接头设计和稳定性、细胞毒性药物效力以及药物和接头缀合至抗体的方式(Polakis,P.(2005)Current Opinion in Pharmacology 5:382–387)。
(曲妥珠单抗emtansine,Genentech)最近已被批准用于治疗乳腺癌。曲妥珠单抗emtansine为具有美登素药物部分DM1的抗体-药物缀合物,所述美登素药物部分DM1通过稳定的非二硫化物接头MCC共价附接至抗HER2抗体曲妥珠单抗(Phillips G.等(2008)Cancer Res.68:9280-90)。曲妥珠单抗为配制成(Genentech)的抗体,所述在1998年被批准用于HER2阳性乳腺癌疗法。
蒽环类被用于治疗许多癌症诸如白血病、乳腺癌、肺癌、卵巢腺癌和肉瘤。通常使用的蒽环类包括多柔比星、表柔比星、伊达比星和柔红霉素。由糖苷氨基基团上的环化所形成的多柔比星和柔红霉素的吗啉类似物具有更大的效力(Acton等(1984)J.Med.Chem.638-645;US 4464529;US 4672057;US 5304687)。奈莫柔比星为在多柔比星的糖苷氨基上具有2-甲氧基吗啉代基团的多柔比星的半合成类似物并且已进行临床评估(Grandi等(1990)Cancer Treat.Rew.17:133;Ripamonti等(1992)Brit.J.Cancer 65:703),包括肝细胞癌的II/III期试验(Sun等(2003)Proceedings of the American Society for Clinical Oncology 22,摘要1448;Quintieri(2003)Proceedings of the American Association of Cancer Research,44:第1版,摘要4649;Pacciarini等(2006)Jour.Clin.Oncology 24:14116)。已制备并且研究了柔红霉素和多柔比星的免疫缀合物和前药(Kratz等(2006)Current Med.Chem.13:477-523;Jeffrey等(2006)Bioorganic&Med.Chem.Letters 16:358-362;Torgov等(2005)Bioconj.Chem.16:717-721;Nagy等(2000)Proc.Natl.Acad.Sci.97:829-834;Dubowchik等(2002)Bioorg.&Med.Chem.Letters 12:1529-1532;King等(2002)J.Med.Chem.45:4336-4343;US 6630579)。抗体-药物缀合物BR96-多柔比星与肿瘤相关的抗原Lewis-Y特异性反应并且已在I期和II期研究中评估(Saleh等(2000)J.Clin.Oncology 18:2282-2292;Ajani等(2000)Cancer Jour.6:78-81;Tolcher等(1999)J.Clin.Oncology 17:478-484)。
已表征来自肝微粒体的数种奈莫柔比星的代谢物(MMDX),包括PNU-159682(Quintieri等(2005)Clinical Cancer Research,11(4):1608-1617;Beulz-Riche等(2001)Fundamental&Clinical Pharmacology,15(6):373-378;EP 0889898;WO 2004/082689;WO 2004/082579)。PNU-159682在体外比奈莫柔比星和多柔比星具有更显著的细胞毒性,并且在体内肿瘤模型中有效。PNU-159682被命名为3'-脱氨基-3”,4'-脱水-[2”(S)-甲氧基-3”(R)-氧基-4”-吗啉基]多柔比星,并且具有以下结构:
PNU-159682,
已描述某些PNU-159682抗体-药物缀合物(WO 2009/099741;WO 2010/009124;US 8742076;US 8389697)。描述用于制备PNU-159682类似物的方法(US 8470984)。
概述
本发明包括具有式I的蒽环类二硫化物中间体:
Ant-L-(Z)m-X I
其中Ant选自以下结构:
其中波浪线表示与L的附接;
L为选自以下的接头:–CH2O–、–CH2N(R)–、-N(R)-、-N(R)(C1-C12亚烷基)-、-N(R)(C2-C8亚烯基)-、-N(R)(C2-C8亚炔基)-、-N(R)(CH2CH2O)n-以及以下结构:
其中波浪线表示与Ant和Z的附接;并且
Z为选自以下的任选间隔物:-CH2C(O)-、-CH2C(O)NR(C1-C12亚烷基)-以及以下结构:
其中波浪线表示与L和X的附接;
R为H、C1-C12烷基或C6-C20芳基;
Z1选自-(C1-C12亚烷基)-、-(C2-C8亚烯基)-、-(C2-C8亚炔基)-、-O(C1-C12亚烷基)-、-O(C2-C8亚烯基)-,-O(C2-C8亚炔基)-以及-(CH2CH2O)n-;
m为0或1;
n为1至6;
X为吡啶基二硫化物,其中吡啶基任选被选自以下的一个或多个基团取代:NO2、Cl、F和Br;并且
亚烷基、亚烯基、亚炔基、烷基和芳基任选被选自以下的一个或多个基团取代:F、Cl、Br、N(CH3)2和OCH3。
本发明包括共价附接至抗体以形成具有治疗或诊断应用的抗体-药物缀合物(ADC)化合物的蒽环类二硫化物中间体。
本发明的另一方面为抗体-药物缀合物化合物,其包括通过二硫化物、接头L和任选的间隔物Z共价附接至一个或多个蒽环类衍生物药物部分D的抗体,化合物具有式II:
Ab-S-S-(Zm-L-D)p II
或其药学上可接受的盐,其中:
Ab为结合至选自(1)-(53)的一个或多个肿瘤相关的抗原或细胞表面受体的抗体:
(1)BMPR1B(IB型骨形态发生蛋白受体);
(2)E16(LAT1、SLC7A5);
(3)STEAP1(六次跨膜的前列腺上皮抗原);
(4)MUC16(0772P、CA125);
(5)MPF(MPF、MSLN、SMR、巨核细胞强化因子、间皮素);
(6)Napi2b(NAPI-3B、NPTIIb、SLC34A2、溶质载体家族34(磷酸钠)、成员2、II型钠依赖性磷酸盐转运蛋白3b);
(7)Sema 5b(FLJ10372、KIAA1445、Mm.42015、SEMA5B、SEMAG、脑信号蛋白5b Hlog、sema结构域、七个血小板反应蛋白重复序列(1型和类1型)、跨膜结构域(TM)和短细胞质结构域、(脑信号蛋白)5B);
(8)PSCA hlg(2700050C12Rik、C530008O16Rik、RIKEN cDNA 2700050C12、RIKEN cDNA 2700050C12基因);
(9)ETBR(内皮缩血管肽B型受体);
(10)MSG783(RNF124、假拟蛋白FLJ20315);
(11)STEAP2(HGNC_8639、IPCA-1、PCANAP1、STAMP1、STEAP2、STMP、前列腺癌相关基因1、前列腺癌相关蛋白1、六次跨膜的前列腺上皮抗原2、六次跨膜的前列腺蛋白);
(12)TrpM4(BR22450、FLJ20041、TRPM4、TRPM4B、瞬时型受体电位阳离子通道、亚家族M、成员4);
(13)CRIPTO(CR、CR1、CRGF、CRIPTO、TDGF1、畸胎癌衍生的生长因子);
(14)CD21(CR2(补体受体2)或C3DR(C3d/爱泼斯坦-巴尔病毒受体)或Hs 73792);
(15)CD79b(CD79B、CD79β、IGb(免疫球蛋白相关β)、B29);
(16)FcRH2(IFGP4、IRTA4、SPAP1A(含有SH2结构域的磷酸酶锚定蛋白1a)、SPAP1B、SPAP1C);
(17)HER2;
(18)NCA;
(19)MDP;
(20)IL20Rα;
(21)短蛋白聚糖;
(22)EphB2R;
(23)ASLG659;
(24)PSCA;
(25)GEDA;
(26)BAFF-R(B细胞活化因子受体、BLyS受体3、BR3);
(27)CD22(B细胞受体CD22-B同种型);
(28)CD79a(CD79A、CD79α、免疫球蛋白相关α);
(29)CXCR5(伯基特淋巴瘤受体1);
(30)HLA-DOB(MHC II类分子的β亚基(Ia抗原));
(31)P2X5(嘌呤能受体P2X配体门控离子通道5);
(32)CD72(B细胞分化抗原CD72、Lyb-2);
(33)LY64(淋巴细胞抗原64(RP105)、富含亮氨酸的重复序列(LRR)家族的I型膜蛋白);
(34)FcRH1(Fc受体样蛋白1);
(35)FcRH5(IRTA2,免疫球蛋白超家族受体易位相关2);
(36)TENB2(推定跨膜蛋白聚糖);
(37)PMEL17(银同源物;SILV;D12S53E;PMEL17;SI;SIL);
(38)TMEFF1(具有EGF样结构域和两个卵泡抑素样结构域的跨膜蛋白1;脑肿瘤抑癌蛋白-1);
(39)GDNF-Ra1(GDNF家族受体α1;GFRA1;GDNFR;GDNFRA;RETL1;TRNR1;RET1L;GDNFR-α1;GFR-ALPHA-1);
(40)Ly6E(淋巴细胞抗原6复合物,基因座E;Ly67、RIG-E、SCA-2、TSA-1);
(41)TMEM46(shisa同源物2(非洲爪蟾);SHISA2);
(42)Ly6G6D(淋巴细胞抗原6复合物,基因座G6D;Ly6-D、MEGT1);
(43)LGR5(富含亮氨酸重复序列的G蛋白偶联受体5;GPR49、GPR67);
(44)RET(ret原癌基因;MEN2A;HSCR1;MEN2B;MTC1;PTC;CDHF12;Hs.168114;RET51;RET-ELE1);
(45)LY6K(淋巴细胞抗原6复合物,基因座K;LY6K;HSJ001348;FLJ35226);
(46)GPR19(G蛋白偶联的受体19;Mm.4787);
(47)GPR54(KISS1受体;KISS1R;GPR54;HOT7T175;AXOR12);
(48)ASPHD1(含天冬氨酸β羟化酶结构域的1;LOC253982);
(49)酪氨酸酶(TYR;OCAIA;OCA1A;酪氨酸酶;SHEP3);
(50)TMEM118(环指蛋白,跨膜2;RNFT2;FLJ14627);
(51)GPR172A(G蛋白偶联的受体172A;GPCR41;FLJ11856;D15Ertd747e);
(52)CD33;以及
(53)CLL-1;
D为选自以下结构的蒽环类衍生物:
其中波浪线表示与L的附接;
L为选自以下的接头:–CH2O–、–CH2N(R)–、-N(R)-、-N(R)(C1-C12亚烷基)-、-N(R)(C2-C8亚烯基)-、-N(R)(C2-C8亚炔基)-、-N(R)(CH2CH2O)n-以及以下结构:
其中波浪线表示与D和Z的附接;并且
Z为选自以下的任选间隔物:-CH2C(O)-、-CH2C(O)NR(C1-C12亚烷基)-以及以下结构:
R为H、C1-C12烷基或C6-C20芳基;
Z1选自-(C1-C12亚烷基)-、-(C2-C8亚烯基)-、-(C2-C8亚炔基)-以及-(CH2CH2O)n-,
m为0或1;
n为1至6;
p为1至8的整数;并且
亚烷基、亚烯基、亚炔基、烷基和芳基任选被选自以下的一个或多个基团取代:F、Cl、Br、N(CH3)2、NO2和OCH3。
本发明的另一方面为药物组合物,所述药物组合物包含式II的抗体-药物缀合物化合物和药学上可接受的稀释剂、载体或赋形剂。
本发明的另一方面为式II的抗体-药物缀合物化合物在制造用于治疗哺乳动物中的癌症的药剂的用途。
本发明的另一方面为通过向患者施用包含式II的抗体-药物缀合物化合物的药物组合物来治疗癌症的方法。
本发明的另一方面为制备式II的抗体-药物缀合物化合物的方法。
本发明的另一方面为制品,所述制品包括包含式II的抗体-药物缀合物化合物的药物组合物、容器和表示药物组合物可以用来治疗癌症的包装插页或标签。
附图简述
图1示出在5天时SK-BR-3体外细胞活力对Thio Hu抗Her2 7C2 HC A118C-(LD-57)114、Thio Hu抗Her2 7C2 LC K149C-(LD-57)109和Thio Hu抗CD33 15G15.3 LC K149C-(LD-57)110的浓度(μg/ml)的曲线图中的抗体-药物缀合物的功效。
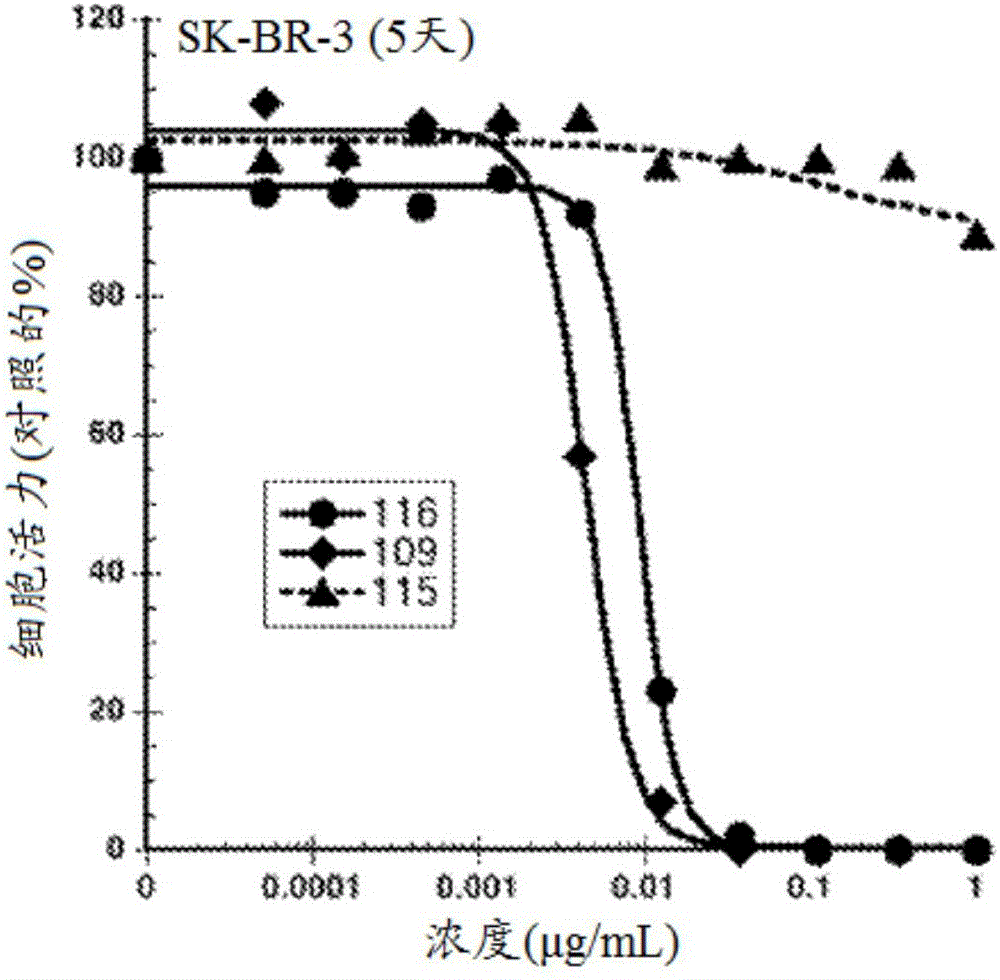
图2示出在5天时SK-BR-3体外细胞活力对Thio Hu抗Her2 7C2 LC K149C-(LD-59)116、Thio Hu抗Her2 7C2 LC K149C-(LD-57)109和Thio Hu抗CD33 15G15.3 LC K149C-(LD-59)115的浓度(μg/ml)的曲线图中的抗体-药物缀合物的功效。
图3示出在MMTV-HER2 Fo5转基因乳腺肿瘤随时间体内拟合的肿瘤体积变化的曲线图中的抗体-药物缀合物的功效,所述MMTV-HER2 Fo5转基因乳腺肿瘤在用以下物质静脉内给药一次之后被接种到CRL nu/nu小鼠的乳腺脂肪垫中:媒介物:组氨酸缓冲液#8:20mM组氨酸乙酸盐(pH 5.5)、240mM蔗糖、0.02%PS 20、Thio Hu抗Her2 7C2 HC A118C-(LD-51)107和Thio Hu抗Her2 7C2 LC K149C-(LD-51)108。在第0天以3mg/kg静脉内给药ADC一次。
图4示出在scid米色小鼠中的KPL4肿瘤模型中,在体内拟合的随时间的肿瘤体积变化的曲线图中的抗体-药物缀合物的功效,所述肿瘤以0.2ml的体积接种在胸部的乳腺脂肪垫中。当肿瘤达到平均肿瘤体积为100-250mm3时,将它们分成每组8-10个小鼠的9个组。在第0天通过尾静脉静脉内施用单一治疗,如下:(01)媒介物:组氨酸缓冲液#8:20mM组氨酸乙酸盐(pH 5.5)、240mM蔗糖、0.02%PS 20,(02)Thio Hu抗Her2 7C2 LC K149C-(乙基马来酰亚胺)0.3mg/kg 138,(03)Thio Hu抗Her2 7C2 LC K149C-(乙基马来酰亚胺)1mg/kg 138,(04)Thio Hu抗Her2 7C2 LC K149C-(乙基马来酰亚胺)3mg/kg 138,(05)Thio Hu抗Her2 7C2 LC K149C-(LD-57)0.3mg/kg 109,(06)Thio Hu抗Her2 7C2 LC K149C-(LD-57)1mg/kg 109,(07)Thio Hu抗Her2 7C2 LC K149C-(LD-57)3mg/kg 109,(08)Thio Hu抗CD33 15G15.3 LC K149C-(乙基马来酰亚胺)3mg/kg 139以及(09)Thio Hu抗CD33 15G15.3 LC K149C-(LD-57)3mg/kg 110。
图5示出在MMTV-HER2 Fo5转基因乳腺肿瘤随时间体内拟合的肿瘤体积变化的曲线图中的抗体-药物缀合物的功效,所述MMTV-HER2 Fo5转基因乳腺肿瘤在用以下物质静脉内给药一次之后被接种到CRL nu/nu小鼠的乳腺脂肪垫中:(01)媒介物:组氨酸缓冲液#8:20mM组氨酸乙酸盐(pH 5.5)、240mM蔗糖、0.02%PS 20,(02)Thio Hu抗Her2 7C2 LC K149C-(LD-57)1mg/kg 109,(03)Thio Hu抗Her2 7C2 LC K149C-(LD-57)3mg/kg 109,(04)Thio Hu抗CD33 15G15.3 LC K149C-(LD-57)1mg/kg 110,(05)Thio Hu抗CD33 15G15.3 LC K149C-(LD-57)3mg/kg 110,(06)曲妥珠单抗emtansine 3mg/kg 141以及(07)曲妥珠单抗emtansine 10mg/kg 141。
图6示出在5天时BJAB.luc体外细胞活力对Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-57)121、Thio Hu抗CD22 10F4v3 LC K149C-(LD-57)120、Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-59)123、Thio Hu抗CD22 10F4v3 LC K149C-(LD-59)122、Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-58)125、Thio Hu抗CD22 10F4v3 LC K149C-(LD-58)124、Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-60)127以及Thio Hu抗CD22 10F4v3 LC K149C-(LD-60)126的浓度(μg/ml)的曲线图中的抗体-药物缀合物的功效。
图7示出在5天时WSU-DLCL2体外细胞活力对Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-57)121、Thio Hu抗CD22 10F4v3 LC K149C-(LD-57)120、Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-59)123、Thio Hu抗CD22 10F4v3 LC K149C-(LD-59)122、Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-58)125、Thio Hu抗CD22 10F4v3 LC K149C-(LD-58)124、Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-60)127以及Thio Hu抗CD22 10F4v3 LC K149C-(LD-60)126的浓度(μg/ml)的曲线图中的抗体-药物缀合物的功效。
示例性实施方案的详细描述
现在将详细参考本发明的某些实施方案,在所附的结构和式中阐明了本发明的实例。尽管将结合所阐述的实施方案来描述本发明,但应理解,它们并不意图将本发明限制于那些实施方案。相反,本发明意图覆盖所有的替代方案、修改和等效物,它们可以被包括在如由权利要求书所限定的本发明的范围内。
本领域技术人员将会意识到与本文描述的方法和材料类似或等效的许多方法和材料,这些方法和材料可以用在本发明的实践中。本发明决不限于所描述的方法和材料。
除非另外定义,否则本文所用的技术术语和科学术语具有与本发明所属领域普通技术人员通常理解的含义相同的含义,并且与以下一致:Singleton等(1994)Dictionary of Microbiology and Molecular Biology,第2版,J.Wiley&Sons,New York,NY;以及Janeway,C.,Travers,P.,Walport,M.,Shlomchik(2001)Immunobiology,第5版,Garland Publishing,New York)。
定义
除非另有说明,否则本文所用的以下术语和短语意图具有下列含义:
当在本文中使用商品名时,申请人意图独立地包括商品名产品制剂、仿制药以及商品名产品的活性药物成分。
本文中的术语“抗体”以最广义使用,并且明确地覆盖单克隆抗体、多克隆抗体、二聚体、多聚体、多特异性抗体(例如双特异性抗体)和抗体片段,只要它们表现出所需的生物学活性(Miller等(2003)Jour.of Immunology 170:4854-4861)。抗体可以为鼠的、人的、人源化的、嵌合的或源自其他物种的抗体。抗体是由能够识别和结合特异性抗原的免疫系统所产生的蛋白质。(Janeway,C.,Travers,P.,Walport,M.,Shlomchik(2001)Immuno Biology,第5版,Garland Publishing,New York)。靶抗原通常具有由多种抗体上的CDR所识别的许多结合位点,也称为表位。每种特异性结合不同表位的抗体具有不同的结构。因此,一种抗原可具有多于一种相应的抗体。抗体包含全长免疫球蛋白分子或全长免疫球蛋白分子的免疫活性部分,即包含免疫特异性结合感兴趣的靶抗原的抗原结合位点或其部分的分子,此类靶包括但不限于癌细胞或产生与自身免疫病相关的自身免疫抗体的细胞。本文公开的免疫球蛋白可为任何类型(例如,IgG、IgE、IgM、IgD和IgA)、类别(例如,IgG1、IgG2、IgG3、IgG4、IgA1和IgA2)或亚类的免疫球蛋白分子。免疫球蛋白可源自任何物种。然而,在一个方面,免疫球蛋白为人、鼠或兔来源。
“抗体片段”包含全长抗体的一部分,一般为其抗原结合区或可变区。抗体片段的实例包括Fab、Fab'、F(ab')2和Fv片段;双价抗体;线性抗体;微抗体(Olafsen等(2004)Protein Eng.Design&Sel.17(4):315-323)、由Fab表达文库产生的片段、抗独特型(抗Id)抗体、CDR(互补决定区)以及任何以上免疫特异性结合癌细胞抗原、病毒抗原或微生物抗原的表位结合片段、单链抗体分子;以及由抗体片段形成的多特异性抗体。
本文所用的术语“单克隆抗体”是指从基本上同种抗体的群体获得的抗体,即构成所述群体的各个抗体是相同的,除了可以微量存在的可能的天然存在的突变。单克隆抗体具有高度特异性(针对单一抗原位点)。另外,与包括针对不同决定簇(表位)的不同抗体的多克隆抗体制品相反,每种单克隆抗体针对抗原上的单一决定簇。除了其特异性之外,单克隆抗体的优点在于它们可以被合成但不被其他抗体所污染。修饰语“单克隆”指示从基本上同种的抗体群体获得的抗体的特性并且不应解释为需要通过任何特定方法产生抗体。例如,根据本发明使用的单克隆抗体可以通过首先由Kohler等(1975)Nature,256:495描述的杂交瘤方法来制备,或可以通过重组DNA方法(参见例如:US 4816567;US 5807715)来制备。单克隆抗体还可以使用在Clackson等(1991)Nature,352:624-628;Marks等(1991)J.Mol.Biol.,222:581-597中描述的技术从噬菌体抗体文库中分离。
本文中的单克隆抗体具体包括“嵌合”抗体以及此类抗体的片段,其中重链和/或轻链的一部分与源自特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而链的其余部分与源自另一种物种或属于另一种抗体类别或亚类的抗体中的相应序列相同或同源,只要它们表现出所需的生物学活性(US 4816567;以及Morrison等(1984)Proc.Natl.Acad.Sci.USA,81:6851-6855)。本文中的感兴趣的嵌合抗体包括“灵长类化”抗体,其包含源自非人灵长类动物(例如旧大陆猴、猿等)的可变结构域抗原结合序列和人恒定区序列。
本文中的“完整抗体”为包含VL和VH结构域、以及轻链恒定结构域(CL)和重链恒定结构域CH1、CH2和CH3的抗体。恒定结构域可为天然序列恒定结构域(例如人天然序列恒定结构域)或其氨基酸序列变体。完整抗体可具有一种或多种“效应子功能”,其是指可归因于抗体Fc恒定区(天然序列Fc区或氨基酸序列变体Fc区)的那些生物学活性。抗体效应子功能的实例包括C1q结合;补体依赖性细胞毒性;Fc受体结合;抗体依赖性细胞介导的细胞毒性(ADCC);吞噬作用;以及细胞表面受体诸如B细胞受体和BCR的下调。
本文中的术语“Fc区”用于定义含有恒定区的至少一部分的免疫球蛋白重链的C-末端区域。术语包括天然序列Fc区和变体Fc区。在一个实施方案中,人IgG重链Fc区从Cys226或从Pro230延伸至重链的羧基末端。然而,Fc区的C末端赖氨酸(Lys447)可以或可以不存在。除非本文中另有说明,否则Fc区或恒定区的氨基酸残基的编号是根据EU编号系统,也称为EU索引,如在Kabat等,Sequences of Proteins of Immunological Interest,第5版Public Health Service,National Institutes of Health,Bethesda,MD,1991中所描述。
“框架”或“FR”是指可变结构域残基而不是高变区(HVR)残基。可变结构域的FR通常由四个FR结构域组成:FR1、FR2、FR3和FR4。因此,HVR和FR序列在VH(或VL)中通常以以下序列出现:FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4。
取决于其重链恒定结构域的氨基酸序列,可以将完整抗体指定为不同的“类别”。存在五大类的完整免疫球蛋白抗体:IgA、IgD、IgE、IgG和IgM,并且这些类别中的数种可被进一步分成“亚类”(同种型),例如IgG1、IgG2、IgG3、IgG4、IgA和IgA2。对应于不同类别抗体的重链恒定结构域分别称为α、δ、ε、γ和μ。不同类别免疫球蛋白的亚基结构和三维构型为熟知的。Ig形式包括铰链修饰或无铰链形式(Roux等(1998)J.Immunol.161:4083-4090;Lund等(2000)Eur.J.Biochem.267:7246-7256;US 2005/0048572;US 2004/0229310)。
“人抗体”为具有对应于由人或人细胞所产生的抗体的氨基酸序列或源自利用人抗体库或其他人抗体编码序列的非人来源的氨基酸序列的抗体。人抗体的此定义明确排除包含非人抗原结合残基的人源化抗体。
“人共有框架”为代表在选择人免疫球蛋白VL或VH框架序列中最通常存在的氨基酸残基的框架。通常,人免疫球蛋白VL或VH序列的选择来自可变结构域序列的亚组。通常,序列的亚组为如在Kabat等,Sequences of Proteins of Immunological Interest,第五版,NIH Publication 91-3242,Bethesda MD(1991),第1-3卷中的亚组。在一个实施方案中,对于VL,亚组为如在Kabat等,同上中的亚组κI。在一个实施方案中,对于VH,亚组为如在Kabat等,同上中的亚组III。
“人源化”抗体是指包含来自非人HVR的氨基酸残基和来自人FR的氨基酸残基的嵌合抗体。在某些实施方案中,人源化抗体将包含基本上所有的至少一个以及通常两个可变结构域,其中所有的或基本上所有的HVR(例如,CDR)对应于非人抗体的HVR,并且所有的或基本上所有的FR对应于人抗体的FR。人源化抗体任选地可以包含源自人抗体的抗体恒定区的至少一部分。抗体(例如,非人抗体)的“人源化形式”是指已经历人源化的抗体。
本文所用的术语“高变区”或“HVR”是指抗体可变结构域的每个区域,其在序列上高度可变和/或形成结构限定的环(“高变环”)。通常,天然四链抗体包含六个HVR;三个在VH中(H1、H2、H3)并且三个在VL中(L1、L2、L3)。HVR通常包含来自高变环和/或来自“互补决定区”(CDR)的氨基酸残基,后者具有最高的序列可变性和/或参与抗原识别。示例性高变环发生在氨基酸残基26-32(L1)、50-52(L2)、91-96(L3)、26-32(H1)、53-55(H2)和96-101(H3)处。(Chothia和Lesk,J.Mol.Biol.196:901-917(1987))。示例性CDR(CDR-L1、CDR-L2、CDR-L3、CDR-H1、CDR-H2和CDR-H3)发生在L1的氨基酸残基24-34、L2的氨基酸残基50-56、L3的氨基酸残基89-97、H1的氨基酸残基31-35B、H2的氨基酸残基50-65和H3的氨基酸残基95-102处。(Kabat等,Sequences of Proteins of Immunological Interest,第5版Public Health Service,National Institutes of Health,Bethesda,MD(1991))。除了VH中的CDR1之外,CDR通常包含形成高变环的氨基酸残基。CDR还包含“特异性决定残基”或“SDR”,其为接触抗原的残基。SDR包含在CDR区域内,被称为缩短的CDR或a-CDR。示例性a-CDR(a-CDR-L1、a-CDR-L2、a-CDR-L3、a-CDR-H1、a-CDR-H2和a-CDR-H3)发生在L1的氨基酸残基31-34、L2的氨基酸残基50-55、L3的氨基酸残基89-96、H1的氨基酸残基31-35B、H2的氨基酸残基50-58和H3的氨基酸残基95-102处。(参见Almagro和Fransson,Front.Biosci.13:1619-1633(2008))。除非另有说明,否则HVR残基和可变结构域中的其他残基(例如,FR残基)在本文中根据Kabat等,同上进行编号。
术语“可变区”或“可变结构域”是指参与抗体与抗原结合的抗体重链或轻链的结构域。天然抗体的重链和轻链的可变结构域(分别为VH和VL))通常具有类似结构,其中每个结构域包含四个保守的框架区(FR)和三个高变区(HVR)。(参见,例如,Kindt等Kuby Immunology,第6版,W.H.Freeman and Co.,第91页(2007))。单个VH或VL结构域可足以赋予抗原结合特异性。此外,可使用来自结合特定抗原的抗体的VH或VL结构域以分别筛选互补的VL或VH结构域文库来分离结合所述抗原的抗体。参见,例如,Portolano等,J.Immunol.150:880-887(1993);Clarkson等,Nature 352:624-628(1991)。
本文所用的术语“载体”是指能够使与其连接的另一种核酸增殖的核酸分子。术语包括作为自我复制的核酸结构的载体以及并入已引入所述载体的宿主细胞的基因组中的载体。某些载体能够引导与其可操作连接的核酸的表达。本文将此类载体称为“表达载体”。
“游离半胱氨酸氨基酸”是指半胱氨酸氨基酸残基,其已被工程化到亲本抗体中,具有巯基官能团(-SH)并且未配对成分子内或分子间二硫化物桥。
“接头”、“接头单元”或“连接”是指包含将抗体与药物部分共价附接的原子链的化学部分。在各种实施方案中,接头为指定为L的二价基团。
当表示取代基数量时,术语“一个或多个”是指在一个取代基至最高可能数量的取代基范围内,即通过取代基替换一个氢高达至替换所有氢。术语“取代基”指代替换母体分子上的氢原子的原子或原子基团。术语“取代的”指代指定的基团具有一个或多个取代基。在任何基团可以具有多个取代基并且提供各种可能的取代基的情况下,独立地选择取代基并且不需要为相同的。术语“未取代的”意指指定的基团不具有取代基。术语“任选取代的”意指指定的基团为未取代的或被一个或多个取代基取代,所述取代基独立地选自可能的取代基的组。当表示取代基数量时,术语“一个或多个”意指一个取代基至最高可能数量的取代基,即通过取代基替换一个氢高达至替换所有氢。
本文所用的术语“烷基”是指具有一至十二个碳原子(C1-C12)的任何长度的饱和的直链或支链单价烃基团,其中烷基基团可以任选被以下描述的一个或多个取代基独立地取代。在另一个实施方案中,烷基基团为一至八个碳原子(C1-C8),或一至六个碳原子(C1-C6)。烷基基团的实例包括,但不限于甲基(Me,-CH3)、乙基(Et,-CH2CH3)、1-丙基(n-Pr,正丙基,-CH2CH2CH3)、2-丙基(i-Pr,异丙基,-CH(CH3)2)、1-丁基(n-Bu,正丁基,-CH2CH2CH2CH3)、2-甲基-1-丙基(i-Bu,异丁基,-CH2CH(CH3)2)、2-丁基(s-Bu,仲丁基,-CH(CH3)CH2CH3)、2-甲基-2-丙基(t-Bu,叔丁基,-C(CH3)3)、1-戊基(正戊基,-CH2CH2CH2CH2CH3)、2-戊基(-CH(CH3)CH2CH2CH3)、3-戊基(-CH(CH2CH3)2)、2-甲基-2-丁基(-C(CH3)2CH2CH3)、3-甲基-2-丁基(-CH(CH3)CH(CH3)2)、3-甲基-1-丁基(-CH2CH2CH(CH3)2)、2-甲基-1-丁基(-CH2CH(CH3)CH2CH3)、1-己基(-CH2CH2CH2CH2CH2CH3)、2-己基(-CH(CH3)CH2CH2CH2CH3)、3-己基(-CH(CH2CH3)(CH2CH2CH3))、2-甲基-2-戊基(-C(CH3)2CH2CH2CH3)、3-甲基-2-戊基(-CH(CH3)CH(CH3)CH2CH3)、4-甲基-2-戊基(-CH(CH3)CH2CH(CH3)2)、3-甲基-3-戊基(-C(CH3)(CH2CH3)2)、2-甲基-3-戊基(-CH(CH2CH3)CH(CH3)2)、2,3-二甲基-2-丁基(-C(CH3)2CH(CH3)2)、3,3-二甲基-2-丁基(-CH(CH3)C(CH3)3、1-庚基、1-辛基等。
本文所用的术“亚烷基”是指具有一至十二个碳原子(C1-C12)的任何长度的饱和的直链或支链二价烃基团,其中亚烷基基团可以任选被以下描述的一个或多个取代基独立地取代。在另一个实施方案中,亚烷基基团为一至八个碳原子(C1-C8),或一至六个碳原子(C1-C6)。亚烷基基团的实例包括,但不限于亚甲基(-CH2-)、亚乙基(-CH2CH2-)、亚正丙基(-CH2CH2CH2-)、亚异丙基(-CH(CH3)CH2-)、亚异丁基(-C(CH3)2CH2-)等。
术语“烯基”是指具有二至八个碳原子(C2-C8)的任何长度的直链或支链单价烃基团,其中具有至少一个不饱和部位,即碳-碳sp2双键,其中烯基基团可以任选被本文所述的一个或多个取代基独立地取代,并且包括具有“顺式”和“反式”取向或替代地“E”和“Z”取向的基团。实例包括,但不限于乙烯基(ethylenyl)或乙烯基(vinyl)(-CH=CH2)、烯丙基(-CH2CH=CH2)、巴豆基(-CH(CH3)CH=CH2)等。
术语“亚烯基”是指具有二至八个碳原子(C2-C8)的任何长度的直链或支链二价烃基团,其中具有至少一个不饱和部位,即碳-碳sp2双键,其中亚烯基基团可以任选被本文所述的一个或多个取代基独立地取代,并且包括具有“顺式”和“反式”取向或替代地“E”和“Z”取向的基团。实例包括,但不限于亚乙烯基(ethylenylene)或亚乙烯基(vinylene)(-CH=CH-)、亚烯丙基(-CH2CH=CH-)、亚巴豆基(-CH(CH3)CH=CH-)等。
术语“炔基”是指具有二至八个碳原子(C2-C8)的任何长度的直链或支链单价烃基团,其中具有至少一个不饱和部位,即碳-碳sp三键,其中炔基基团可以任选被本文所述的一个或多个取代基独立地取代。实例包括,但不限于乙炔基(-C≡CH)、丙炔基(炔丙基,-CH2C≡CH)等。
术语“亚炔基”是指具有二至八个碳原子(C2-C8)的任何长度的直链或支链二价烃基团,其中具有至少一个不饱和部位,即碳-碳sp三键,其中亚炔基基团可以任选被本文所述的一个或多个取代基独立地取代。实例包括,但不限于亚乙炔基(-C≡C-)、亚丙炔基(亚炔丙基,-CH2C≡C-)、亚2-丁炔基(-CH(CH3)C≡C-)等。
术语“碳环(carbocycle)”、“碳环基”、“碳环(carbocyclic ring)”和“环烷基”是指具有作为单环的3至12个碳原子(C3-C12)或作为双环的7至12个碳原子的单价非芳香族饱和的或部分不饱和的环。具有7至12个原子的双环碳环可以例如排列成双环[4,5]、[5,5]、[5,6]或[6,6]系统,并且具有9或10个环原子的双环碳环可以排列成双环[5,6]或[6,6]系统,或排列成桥接系统诸如双环[2.2.1]庚烷、双环[2.2.2]辛烷和双环[3.2.2]壬烷。螺环部分也包括在此定义的范围内。单环碳环的实例包括,但不限于环丙基、环丁基、环戊基、1-环戊-1-烯基、1-环戊-2-烯基、1-环戊-3-烯基、环己基、1-环己-1-烯基、1-环己-2-烯基、1-环己-3-烯基、环己二烯基、环庚基、环辛基、环壬基、环癸基、环十一烷基、环十二烷基等。碳环基基团任选被本文所述的一个或多个取代基独立地取代。
“芳基”意指通过从母体芳环系统的单个碳原子中去除一个氢原子而衍生得到的6-20个碳原子(C6-C20)的单价芳烃基团。一些芳基基团以示例性结构表示为“Ar”。芳基包括双环基团,所述双环基团包括稠合至饱和的、部分不饱和的环的芳环、或芳香族碳环。通常的芳基基团包括,但不限于衍生自苯(苯基)、取代的苯、萘、蒽、联苯基、茚基、二氢茚基、1,2-二氢萘、1,2,3,4-四氢萘基等的基团。芳基基团任选被本文所述的一个或多个取代基独立地取代。
“亚芳基”意指通过从母体芳环系统的两个碳原子中去除两个氢原子而衍生得到的6-20个碳原子(C6-C20)的二价芳烃基团。一些亚芳基基团以示例性结构表示为“Ar”。亚芳基包括双环基团,所述双环基团包括稠合至饱和的、部分不饱和的环的芳环、或芳香族碳环。通常的亚芳基基团包括,但不限于衍生自苯(亚苯基)、取代的苯、萘、蒽、亚联苯基、亚茚基、亚二氢茚基、1,2-二氢萘、1,2,3,4-四氢萘基等的基团。亚芳基基团任选被本文所述的一个或多个取代基取代。
术语“杂环(heterocycle)”、“杂环基”和“杂环(heterocyclic ring)”在本文中可互换使用并且是指具有3至约20个环原子的饱和的或部分不饱和的(即,在环内具有一个或多个双键和/或三键)碳环基团,其中至少一个环原子为选自氮、氧、磷和硫的杂原子,剩余的环原子为碳,其中一个或多个环原子任选被以下所述的一个或多个取代基独立地取代。杂环可为具有3至7个环成员(2至6个碳原子和选自N、O、P和S的1至4个杂原子)的单环或具有7至10个环成员(4至9个碳原子和选自N、O、P和S的1至6个杂原子)的双环,例如:双环[4,5]、[5,5]、[5,6]或[6,6]系统。杂环描述于Paquette,Leo A.;“Principles of Modern Heterocyclic Chemistry”(W.A.Benjamin,New York,1968),具体为第1章、第3章、第4章、第6章、第7章和第9章;“The Chemistry of Heterocyclic Compounds,A series of Monographs”(John Wiley&Sons,New York,1950至今),具体为第13卷、第14卷、第16卷、第19卷和第28卷;以及J.Am.Chem.Soc.(1960)82:5566。“杂环基”还包括其中杂环基团与饱和的、部分不饱和的环、或芳香族碳环或杂环稠合的基团。杂环的实例包括,但不限于吗啉-4-基、哌啶-1-基、哌嗪基、哌嗪-4-基-2-酮、哌嗪-4-基-3-酮、吡咯烷-1-基、硫代吗啉-4-基、S-二氧代硫代吗啉-4-基、氮杂环辛烷-1-基、氮杂环丁烷-1-基、八氢吡啶并[1,2-a]吡嗪-2-基、[1,4]二氮杂环庚烷-1-基、吡咯烷基、四氢呋喃基、二氢呋喃基、四氢噻吩基、四氢吡喃基、二氢吡喃基、四氢噻喃基、哌啶基、吗啉基、硫代吗啉基、噻烷基、哌嗪基、高哌嗪基、氮杂环丁烷基、氧杂环丁烷基、硫杂环丁烷基、高哌啶基、氧杂环庚烷基、硫杂环庚烷基、氧氮杂基、二氮杂环庚烷基、硫氮杂环庚基、2-吡咯啉基、3-吡咯啉基、二氢吲哚基、2H-吡喃基、4H-吡喃基、二烷基、1,3-二氧戊环基、吡唑啉基、二噻烷基、二硫戊烷基、二氢吡喃基、二氢噻吩基、二氢呋喃基、吡唑烷基咪唑啉基、咪唑烷基、3-氮杂双环[3.1.0]己烷基、3-氮杂双环[4.1.0]庚烷基、氮杂双环[2.2.2]己烷基、3H-吲哚基喹嗪基和N-吡啶基脲。螺环部分也包括在此定义的范围内。其中2个环原子被氧代(=O)部分取代的杂环基团的实例为嘧啶酮基和1,1-二氧代-硫代吗啉基。本文中的杂环基团任选被本文所述的一个或多个取代基独立地取代。
术语“杂芳基”是指具有5元环、6元环或7元环的单价芳香族基团,并且包括5-20个原子的稠环系统(所述稠环系统中至少一个为芳香族的),含有独立地选自氮、氧和硫的一个或多个杂原子。杂芳基基团的实例为吡啶基(包括例如,2-羟基吡啶基)、咪唑基、咪唑并吡啶基、1-甲基-1H-苯并[d]咪唑、[1,2,4]三唑并[1,5-a]吡啶、嘧啶基(包括例如,4-羟基嘧啶基)、吡唑基、三唑基、吡嗪基、四唑基、呋喃基、噻吩基、异噁唑基、噻唑基、噁二唑基、噁唑基、异噻唑基、吡咯基、喹啉基、异喹啉基、四氢异喹啉基、吲哚基、苯并咪唑基、苯并呋喃基、噌啉基、吲唑基、吲嗪基、酞嗪基、哒嗪基、三嗪基、异吲哚基、蝶啶基、嘌呤基、噁二唑基、噻二唑基、噻二唑基、呋咱基、苯并呋咱基、苯并噻吩基、苯并噻唑基、苯并噁唑基、喹唑啉基、喹喔啉基、二氮杂萘基和呋喃并吡啶基。杂芳基基团任选被本文所述的一个或多个取代基独立地取代。
杂环基团或杂芳基基团在可能的情况下可为碳(碳连接)或氮(氮连接)键合的。举例而非限制,碳键合的杂环或杂芳基键合在吡啶的位置2、3、4、5或6;哒嗪的位置3、4、5或6;嘧啶的位置2、4、5或6;吡嗪的位置2、3、5或6;呋喃、四氢呋喃、硫代呋喃、噻吩、吡咯或四氢吡咯的位置2、3、4或5;噁唑、咪唑或噻唑的位置2、4或5;异噁唑、吡唑或异噻唑的位置3、4或5;氮丙啶的位置2或3;氮杂环丁烷的位置2、3或4;喹啉的位置2、3、4、5、6、7或8;或异喹啉的位置1、3、4、5、6、7或8。
举例而非限制,氮键合的杂环或杂芳基键合在氮丙啶、氮杂环丁烷、吡咯、吡咯烷、2-吡咯啉、3-吡咯啉、咪唑、咪唑烷、2-咪唑啉、3-咪唑啉、吡唑、吡唑啉、2-吡唑啉、3-吡唑啉、哌啶、哌嗪、吲哚、吲哚啉、1H-吲唑的位置1;异吲哚或异吲哚啉的位置2;吗啉的位置4和咔唑或β-咔啉的位置9。
术语“手性”是指具有镜像配偶体(mirror image partner)的不可重叠(non-superimposability)性质的分子,而术语“非手性”是指在其镜像配偶体上可以重叠的分子。
术语“立体异构体”是指具有相同化学组成,但是关于原子或基团在空间上的排列不同的化合物。
“非对映异构体”是指具有两个或更多个手性中心并且其分子不是彼此的镜像的立体异构体。非对映异构体具有不同的物理性质,例如熔点、沸点、光谱性质和反应性。可在高分辨率分析方法诸如电泳和色谱法下可分离非对映异构体的混合物。
“对映异构体”是指化合物的彼此为不可重叠的镜像的两个立体异构体。
本文使用的立体化学定义和惯例一般遵循S.P.Parker编著,McGraw-Hill Dictionary of Chemical Terms(1984)McGraw-Hill Book公司,New York;以及Eliel,E.和Wilen,S.,Stereochemistry of Organic Compounds(1994)John Wiley&Sons,Inc.,New York。许多有机化合物以光学活性形式存在,即,它们能够旋转平面偏振光的平面。在描述光学活性化合物时,前缀D和L、或R和S,用于指代分子关于其手性中心的绝对构型。前缀d和l或(+)和(-)用于表示化合物的平面偏振光的旋转标记,其中用(-)或1表示化合物为左旋的。具有(+)或d前缀的化合物为右旋的。对于给定的化学结构,这些立体异构体为相同的,不同之处在于它们为彼此的镜像。还可以将特定的立体异构体称为对映异构体,并且此类异构体的混合物经常被称为对映异构体混合物。50:50的对映异构体混合物被称为外消旋混合物或外消旋物,其可以出现在化学反应或过程中一直没有立体选择性或立体特异性的情况下。术语“外消旋混合物”和“外消旋物”是指两种没有光学活性的对映异构体种类的等摩尔混合物。
本文所用的短语“药学上可接受的盐”是指抗体-药物缀合物(ADC)的药学上可接受的有机盐或无机盐。示例性盐包括,但不限于:硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐、乳酸盐、水杨酸盐、酸式柠檬酸盐、酒石酸盐、油酸盐、单宁酸盐、泛酸盐、酒石酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐(gentisinate)、富马酸盐、葡糖酸盐、葡萄糖醛酸盐、蔗糖盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲烷磺酸盐、乙烷磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐(pamoate)(即,1,1’-亚甲基-双(2-羟基-3-萘甲酸盐))盐。药学上可接受的盐可涉及引入另一种分子诸如乙酸根离子、琥珀酸根离子或其他平衡离子。平衡离子可为使母体化合物上的电荷稳定的任何有机或无机部分。此外,药学上可接受的盐在其结构中可具有多于一个带电原子。多个带电原子为药学上可接受的盐的一部分的情况可具有多个平衡离子。因此,药学上可接受的盐可具有一个或多个带电原子和/或一个或多个平衡离子。
在本文中使用了下列缩写并且具有指定定义:BME为β-巯基乙醇,Boc为N-(叔丁氧基羰基),cit为瓜氨酸(2-氨基-5-脲基戊酸),DCC为1,3-二环己基碳二亚胺,DCM为二氯甲烷,DEA为二乙胺,DEAD为偶氮二羧酸二乙酯,DEPC为二乙基磷酰基氰酸酯,DIAD为偶氮二羧酸二异丙酯,DIEA为N,N-二异丙基乙胺,DMA为二甲基乙酰胺,DMAP为4-二甲基氨基吡啶,DME为乙二醇二甲醚(或1,2-二甲氧基乙烷),DMF为N,N-二甲基甲酰胺,DMSO为二甲亚砜,DTT为二硫苏糖醇,EDCI为1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐,EEDQ为2-乙氧基-1-乙氧基羰基-1,2-二氢喹啉,ES-MS为电喷雾质谱,EtOAc为乙酸乙酯,Fmoc为N-(9-芴基甲氧基羰基),gly为甘氨酸,HATU为O-(7-氮杂苯并三唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸盐,HOBt为1-羟基苯并三唑,HPLC为高压液相色谱,ile为异亮氨酸,lys为赖氨酸,MeCN(CH3CN)为乙腈,MeOH为甲醇,Mtr为4-茴香基二苯基甲基(或4-甲氧基三苯甲基),NHS为N-羟基琥珀酰亚胺,PBS为磷酸盐缓冲盐水(pH 7),PEG为聚乙二醇或乙二醇单元(-OCH2CH2-),Ph为苯基,Pnp为对硝基苯基,MC为6-马来酰亚氨基己酰基,phe为L-苯基丙氨酸,PyBrop为溴代三吡咯烷基膦六氟磷酸盐,SEC为大小排阻色谱,Su为琥珀酰亚胺,TFA为三氟乙酸,TLC为薄层色谱,UV为紫外线,并且val为缬氨酸。
半胱氨酸工程化的抗体
本发明的化合物包括包含半胱氨酸工程化的抗体的抗体-药物缀合物,其中野生型或亲本抗体的一个或多个氨基酸被半胱氨酸氨基酸(THIOMABTM)替换。任何形式的抗体可为如此工程化的,即突变的。例如,亲本Fab抗体片段可被工程化以形成半胱氨酸工程化的Fab。类似地,亲本单克隆抗体可被工程化以形成THIOMABTM。应注意,由于IgG抗体的二聚体性质,单个位点突变产生Fab抗体片段中的单个工程化的半胱氨酸残基,而单个位点突变产生全长THIOMABTM中的两个工程化的半胱氨酸残基。评价具有替换的(“工程化的”)半胱氨酸(Cys)残基的突变体的新引入的、工程化的半胱氨酸巯基基团的反应性。巯基反应性值为0至1.0范围内的相对数值术语并且可测量任何半胱氨酸工程化的抗体。本发明的半胱氨酸工程化的抗体的巯基反应性值在0.6至1.0;0.7至1.0;或0.8至1.0的范围内。
半胱氨酸氨基酸可在抗体的重链(HC)或轻链(LC)中的反应位点上工程化并且所述半胱氨酸氨基酸不形成链内或分子间二硫化物键(Junutula等,2008b Nature Biotech.,26(8):925-932;Dornan等(2009)Blood 114(13):2721-2729;US 7521541;US 7723485;WO2009/052249;Shen等(2012)Nature Biotech.,30(2):184-191;Junutula等(2008)Jour of Immun.Methods 332:41-52)。工程化的半胱氨酸巯基可与接头试剂或本发明的接头-药物中间体反应,所述接头-药物中间体具有巯基反应性的亲电吡啶基二硫化物基团以形成具有半胱氨酸工程化的抗体(THIOMABTM)和药物(D)部分的ADC。因此,可以设计、控制并且知道药物部分的位置。可控制药物负载,因为工程化的半胱氨酸巯基基团通常以高产率与巯基反应性的接头试剂或接头-药物中间体反应。通过在重链或轻链上的单个位点处取代而对抗体进行工程化以引入半胱氨酸氨基酸,得到对称抗体上的两个新半胱氨酸。可实现接近2的药物负载并且接近均匀的缀合产物ADC。
本发明的半胱氨酸工程化的抗体优选保留其野生型、亲本抗体对应部分的抗原结合能力。因此,半胱氨酸工程化的抗体能够结合,优选特异性地结合抗原。此类抗原包括,例如肿瘤相关的抗原(TAA)、细胞表面受体蛋白和其他细胞表面分子、跨膜蛋白、信号传导蛋白、细胞存活调节因子、细胞增殖调节因子、与组织发育或分化相关(例如,已知或怀疑在功能上有助于组织发育或分化)的分子、淋巴因子、细胞因子、涉及细胞周期调节的分、涉及血管发生的分子和与血管生成(例如,已知或怀疑在功能上有助于血管生成)的分子。肿瘤相关的抗原可为簇分化因子(即,CD蛋白)。半胱氨酸工程化的抗体能够结合的抗原可为以上提到的分类之一的子集成员,其中所述分类的其他子集包括具有相异特征(相对于感兴趣的抗原)的其他分子/抗原。
半胱氨酸工程化的抗体可以被制备用于通过还原和再氧化链内二硫化物基团而与接头-药物中间体缀合(实施例19)。
可在治疗癌症的本发明的抗体-药物缀合物中有用的半胱氨酸工程化的抗体包括,但不限于针对细胞表面受体和肿瘤相关的抗原(TAA)的抗体。肿瘤相关的抗原为本领域中已知的,并且可以使用本领域熟知的方法和信息来制备用于产生抗体。尝试发现用于癌症诊断和疗法的有效细胞靶标,研究者已寻求鉴定跨膜或其他肿瘤相关的多肽,与在一个或多个正常非癌细胞上相比,所述多肽特异性地表达在一个或多个特定类型的癌细胞的表面上。通常,与在非癌细胞表面上相比,此类肿瘤相关的多肽更丰富地表达在癌细胞表面上。此类肿瘤相关的细胞表面抗原多肽的鉴定引起通过基于抗体的疗法特异性靶向癌细胞以用于破坏的能力。
肿瘤相关的抗原TAA的实例包括,但不限于以下列出的TAA(1)-(51)。为了方便起见,关于这些抗原的信息(所述信息的全部为本领域中已知的)在以下列出,并且包括名称、替代名称、Genbank登录号和原始参考文献、下列美国国家生物技术信息中心(NCBI)的核酸和蛋白质序列鉴定惯例。对应于TAA(1)-(53)的核酸和蛋白质序列在公共数据库诸如GenBank中可获得。被抗体靶向的肿瘤相关的抗原包括相对于在引用参考中鉴定的序列而具有至少约70%、80%、85%、90%或95%序列同一性,或表现出基本上与具有引用参考中存在的序列的TAA相同的生物性质或特征的所有氨基酸序列变体和同种型。例如,具有变异序列的TAA通常能够特异性地结合抗体,所述抗体特异性地结合具有所列出的相应序列的TAA。在本文中具体列举的参考文献中的序列和公开内容明确地通过引用并入。
肿瘤相关的抗原:
(1)BMPR1B(IB型骨形态发生蛋白受体,Genbank登录号NM_001203)
ten Dijke,P.等Science 264(5155):101-104(1994),Oncogene 14(11):1377-1382(1997));WO2004063362(权利要求2);WO2003042661(权利要求12);US2003134790-A1(第38-39页);WO2002102235(权利要求13;第296页);WO2003055443(第91-92页);WO200299122(实施例2;第528-530页);WO2003029421(权利要求6);WO2003024392(权利要求2;图112);WO200298358(权利要求1;第183页);WO200254940(第100-101页);WO200259377(第349-350页);WO200230268(权利要求27;第376页);WO200148204(实施例;图4)
NP_001194 IB型骨形态发生蛋白受体/pid=NP_001194.1-
交叉引用:MIM:603248;NP_001194.1;AY065994
(2)E16(LAT1、SLC7A5,Genbank登录号NM_003486)
Biochem.Biophys.Res.Commun.255(2),283-288(1999),Nature 395(6699):288-291(1998),Gaugitsch,H.W.等(1992)J.Biol.Chem.267(16):11267-11273);WO2004048938(实施例2);WO2004032842(实施例IV);WO2003042661(权利要求12);WO2003016475(权利要求1);WO200278524(实施例2);WO200299074(权利要求19;第127-129页);WO200286443(权利要求27;第222页、第393页);WO2003003906(权利要求10;第293页);WO200264798(权利要求33;第93-95页);WO200014228(权利要求5;第133-136页);US2003224454(图3);WO2003025138(权利要求12;第150页);
NP_003477溶质载体家族7(阳离子氨基酸转运蛋白,y+
系统),成员5/pid=NP_003477.3-智人
交叉引用:MIM:600182;NP_003477.3;NM_015923;NM_003486_1
(3)STEAP1(六次跨膜的前列腺上皮抗原,Genbank登录号NM_012449)
Cancer Res.61(15),5857-5860(2001),Hubert,R.S.等(1999)Proc.Natl.Acad.Sci.U.S.A.96(25):14523-14528);WO2004065577(权利要求6);WO2004027049(图1L);EP1394274(实施例11);WO2004016225(权利要求2);WO2003042661(权利要求12);US2003157089(实施例5);US2003185830(实施例5);US2003064397(图2);WO200289747(实施例5;第618-619页);WO2003022995(实施例9;图13A,实施例53;第173页,实施例2;图2A);
NP_036581前列腺的六跨膜表皮抗原
交叉引用:MIM:604415;NP_036581.1;NM_012449_1
(4)0772P(CA125、MUC16,Genbank登录号AF361486)
J.Biol.Chem.276(29):27371-27375(2001));WO2004045553(权利要求14);WO200292836(权利要求6;图12);WO200283866(权利要求15;第116-121页);US2003124140(实施例16);US 798959。交叉引用:GI:34501467;AAK74120.3;AF361486_1
(5)MPF(MPF、MSLN、SMR、巨核细胞强化因子、间皮素,Genbank登录号NM_005823)Yamaguchi,N.等Biol.Chem.269(2),805-808(1994),Proc.Natl.Acad.Sci.U.S.A.96(20):11531-11536(1999),Proc.Natl.Acad.Sci.U.S.A.93(1):136-140(1996),J.Biol.Chem.270(37):21984-21990(1995));WO2003101283(权利要求14);(WO2002102235(权利要求13;第287-288页);WO2002101075(权利要求4;第308-309页);WO200271928(第320-321页);WO9410312(第52-57页);交叉引用:MIM:601051;NP_005814.2;NM_005823_1
(6)Napi3b(NAPI-3B、NPTIIb、SLC34A2、溶质载体家族34(磷酸钠)、成员2、II型钠依赖性磷酸盐转运蛋白3b,Genbank登录号NM_006424)
J.Biol.Chem.277(22):19665-19672(2002),Genomics 62(2):281-284(1999),Feild,J.A.等(1999)Biochem.Biophys.Res.Commun.258(3):578-582);WO2004022778(权利要求2);EP1394274(实施例11);WO2002102235(权利要求13;第326页);EP875569(权利要求1;第17-19页);WO200157188(权利要求20;第329页);WO2004032842(实施例IV);WO200175177(权利要求24;第139-140页);
交叉引用:MIM:604217;NP_006415.1;NM_006424_1
(7)Sema 5b(FLJ10372、KIAA1445、Mm.42015、SEMA5B、SEMAG、脑信号蛋白5b Hlog、sema结构域、七个血小板反应蛋白重复序列(1型和类1型)、跨膜结构域(TM)和短细胞质结构域、(脑信号蛋白)5B,Genbank登录号AB040878)
Nagase T.等(2000)DNA Res.7(2):143-150);WO2004000997(权利要求1);WO2003003984(权利要求1);WO200206339(权利要求1;第50页);WO200188133(权利要求1;第41-43页、第48-58页);WO2003054152(权利要求20);WO2003101400(权利要求11);
登录号:Q9P283;EMBL;AB040878;BAA95969.1。Genew;HGNC:10737;
(8)PSCA hlg(2700050C12Rik、C530008O16Rik、RIKEN cDNA 2700050C12、RIKEN cDNA 2700050C12基因,Genbank登录号AY358628);Ross等(2002)Cancer Res.62:2546-2553;US2003129192(权利要求2);US2004044180(权利要求12);US2004044179(权利要求11);US2003096961(权利要求11);US2003232056(实施例5);WO2003105758(权利要求12);US2003206918(实施例5);EP1347046(权利要求1);WO2003025148(权利要求20);
交叉引用:GI:37182378;AAQ88991.1;AY358628_1
(9)ETBR(内皮缩血管肽B型受体,Genbank登录号AY275463);
Nakamuta M.等Biochem.Biophys.Res.Commun.177,34-39,1991;Ogawa Y.等Biochem.Biophys.Res.Commun.178,248-255,1991;Arai H.等Jpn.Circ.J.56,1303-1307,1992;Arai H.等J.Biol.Chem.268,3463-3470,1993;Sakamoto A.,Yanagisawa M.等Biochem.Biophys.Res.Commun.178,656-663,1991;Elshourbagy N.A.等J.Biol.Chem.268,3873-3879,1993;Haendler B.等J.Cardiovasc.Pharmacol.20,s1-S4,1992;Tsutsumi M.等Gene 228,43-49,1999;Strausberg R.L.等Proc.Natl.Acad.Sci.U.S.A.99,16899-16903,2002;Bourgeois C.等J.Clin.Endocrinol.Metab.82,3116-3123,1997;Okamoto Y.等Biol.Chem.272,21589-21596,1997;Verheij J.B.等Am.J.Med.Genet.108,223-225,2002;Hofstra R.M.W.等Eur.J.Hum.Genet.5,180-185,1997;Puffenberger E.G.等Cell 79,1257-1266,1994;Attie T.等,Hum.Mol.Genet.4,2407-2409,1995;Auricchio A.等Hum.Mol.Genet.5:351-354,1996;Amiel J.等Hum.Mol.Genet.5,355-357,1996;Hofstra R.M.W.等Nat.Genet.12,445-447,1996;Svensson P.J.等Hum.Genet.103,145-148,1998;Fuchs S.等Mol.Med.7,115-124,2001;Pingault V.等(2002)Hum.Genet.111,198-206;WO2004045516(权利要求1);WO2004048938(实施例2);WO2004040000(权利要求151);WO2003087768(权利要求1);WO2003016475(权利要求1);WO2003016475(权利要求1);WO200261087(图1);WO2003016494(图6);WO2003025138(权利要求12;第144页);WO200198351(权利要求1;第124-125页);EP522868(权利要求8;图2);WO200177172(权利要求1;第297-299页);US2003109676;US6518404(图3);US5773223(权利要求1a;第31-34栏);WO2004001004;
(10)MSG783(RNF124、假拟蛋白FLJ20315,Genbank登录号NM_017763);
WO2003104275(权利要求1);WO2004046342(实施例2);WO2003042661(权利要求12);WO2003083074(权利要求14;第61页);WO2003018621(权利要求1);WO2003024392(权利要求2;图93);WO200166689(实施例6);
交叉引用:LocusID:54894;NP_060233.2;NM_017763_1
(11)STEAP2(HGNC_8639、IPCA-1、PCANAP1、STAMP1、STEAP2、STMP、前列腺癌相关基因1、前列腺癌相关蛋白1、六次跨膜的前列腺上皮抗原2、六次跨膜的前列腺蛋白,Genbank登录号AF455138)
Lab.Invest.82(11):1573-1582(2002));WO2003087306;US2003064397(权利要求1;图1);WO200272596(权利要求13;第54-55页);WO200172962(权利要求1;图4B);WO2003104270(权利要求11);WO2003104270(权利要求16);US2004005598(权利要求22);WO2003042661(权利要求12);US2003060612(权利要求12;图10);WO200226822(权利要求23;图2);WO200216429(权利要求12;图10);
交叉引用:GI:22655488;AAN04080.1;AF455138_1
(12)TrpM4(BR22450、FLJ20041、TRPM4、TRPM4B、瞬时型受体电位阳离子通道、亚家族M、成员4、Genbank登录号NM_017636)
Xu,X.Z.等Proc.Natl.Acad.Sci.U.S.A.98(19):10692-10697(2001),Cell 109(3):397-407(2002),J.Biol.Chem.278(33):30813-30820(2003));US2003143557(权利要求4);WO200040614(权利要求14;第100-103页);WO200210382(权利要求1;图9A);WO2003042661(权利要求12);WO200230268(权利要求27;第391页);US2003219806(权利要求4);WO200162794(权利要求14;图1A-D);
交叉引用:MIM:606936;NP_060106.2;NM_017636_1
(13)CRIPTO(CR、CR1、CRGF、CRIPTO、TDGF1、畸胎癌衍生的生长因子,Genbank登录号NP_003203或NM_003212)
Ciccodicola,A.等EMBO J.8(7):1987-1991(1989),Am.J.Hum.Genet.49(3):555-565(1991));US2003224411(权利要求1);WO2003083041(实施例1);WO2003034984(权利要求12);WO200288170(权利要求2;第52-53页);WO2003024392(权利要求2;图58);WO200216413(权利要求1;第94-95页、第105页);WO200222808(权利要求2;图1);US5854399(实施例2;第17-18栏);US5792616(图2);
交叉引用:MIM:187395;NP_003203.1;NM_003212_1
(14)CD21(CR2(补体受体2)或C3DR(C3d/爱泼斯坦-巴尔病毒受体)或Hs.73792Genbank登录号M26004)
Fujisaku等(1989)J.Biol.Chem.264(4):2118-2125);Weis J.J.等J.Exp.Med.167,1047-1066,1988;Moore M.等Proc.Natl.Acad.Sci.U.S.A.84,9194-9198,1987;Barel M.等Mol.Immunol.35,1025-1031,1998;Weis J.J.等Proc.Natl.Acad.Sci.U.S.A.83,5639-5643,1986;Sinha S.K.等(1993)J.Immunol.150,5311-5320;WO2004045520(实施例4);US2004005538(实施例1);WO2003062401(权利要求9);WO2004045520(实施例4);WO9102536(图9.1-9.9);WO2004020595(权利要求1);
登录号:P20023;Q13866;Q14212;EMBL;M26004;AAA35786.1。
(15)CD79b(CD79B、CD79β、IGb(免疫球蛋白相关β)、B29,Genbank登录号NM_000626或11038674)
Proc.Natl.Acad.Sci.U.S.A.(2003)100(7):4126-4131,Blood(2002)100(9):3068-3076,Muller等(1992)Eur.J.Immunol.22(6):1621-1625);WO2004016225(权利要求2、图140);WO2003087768,US2004101874(权利要求1、第102页);WO2003062401(权利要求9);WO200278524(实施例2);US2002150573(权利要求5、第15页);US5644033;WO2003048202(权利要求1、第306页和第309页);WO 99/558658;US6534482(权利要求13、图17A/B);WO200055351(权利要求11、第1145-1146页);
交叉引用:MIM:147245;NP_000617.1;NM_000626_1
(16)FcRH2(IFGP4、IRTA4、SPAP1A(含有SH2结构域的磷酸酶锚定蛋白1a)、SPAP1B、SPAP1C,Genbank登录号NM_030764、AY358130)
Genome Res.13(10):2265-2270(2003),Immunogenetics 54(2):87-95(2002),Blood 99(8):2662-2669(2002),Proc.Natl.Acad.Sci.U.S.A.98(17):9772-9777(2001),Xu,M.J.等(2001)Biochem.Biophys.Res.Commun.280(3):768-775;WO2004016225(权利要求2);WO2003077836;WO200138490(权利要求5;图18D-1-18D-2);WO2003097803(权利要求12);WO2003089624(权利要求25);
交叉引用:MIM:606509;NP_110391.2;NM_030764_1
(17)HER2(ErbB2,Genbank登录号M11730)
Coussens L.等Science(1985)230(4730):1132-1139);Yamamoto T.等Nature 319,230-234,1986;Semba K.等Proc.Natl.Acad.Sci.U.S.A.82,6497-6501,1985;Swiercz J.M.等J.Cell Biol.165,869-880,2004;Kuhns J.J.等J.Biol.Chem.274,36422-36427,1999;Cho H.-S.等Nature 421,756-760,2003;Ehsani A.等(1993)Genomics 15,426-429;WO2004048938(实施例2);WO2004027049(图1I);WO2004009622;WO2003081210;WO2003089904(权利要求9);WO2003016475(权利要求1);US2003118592;WO2003008537(权利要求1);WO2003055439(权利要求29;图1A-B);WO2003025228(权利要求37;图5C);WO200222636(实施例13;第95-107页);WO200212341(权利要求68;图7);WO200213847(第71-74页);WO200214503(第114-117页);WO200153463(权利要求2;第41-46页);WO200141787(第15页);WO200044899(权利要求52;图7);WO200020579(权利要求3;图2);US5869445(权利要求3;第31-38栏);WO9630514(权利要求2;第56-61页);EP1439393(权利要求7);WO2004043361(权利要求7);WO2004022709;WO200100244(实施例3;图4);
登录号:P04626;EMBL;M11767;AAA35808.1.EMBL;M11761;AAA35808.1。
(18)NCA(CEACAM6,Genbank登录号M18728);
Barnett T.等Genomics 3,59-66,1988;Tawaragi Y.等Biochem.Biophys.Res.Commun.150,89-96,1988;Strausberg R.L.等Proc.Natl.Acad.Sci.U.S.A.99:16899-16903,2002;WO2004063709;EP1439393(权利要求7);WO2004044178(实施例4);WO2004031238;WO2003042661(权利要求12);WO200278524(实施例2);WO200286443(权利要求27;第427页);WO200260317(权利要求2);
登录号:P40199;Q14920;EMBL;M29541;AAA59915.1.EMBL;M18728;
(19)MDP(DPEP1,Genbank登录号BC017023)
Proc.Natl.Acad.Sci.U.S.A.99(26):16899-16903(2002));WO2003016475(权利要求1);WO200264798(权利要求33;第85-87页);JP05003790(图6-8);WO9946284(图9);
交叉引用:MIM:179780;AAH17023.1;BC017023_1
(20)IL20Rα(IL20Ra、ZCYTOR7,Genbank登录号AF184971);
Clark H.F.等Genome Res.13,2265-2270,2003;Mungall A.J.等Nature 425,805-811,2003;Blumberg H.等Cell 104,9-19,2001;Dumoutier L.等J.Immunol.167,3545-3549,2001;Parrish-Novak J.等J.Biol.Chem.277,47517-47523,2002;Pletnev S.等(2003)Biochemistry 42:12617-12624;Sheikh F.等(2004)J.Immunol.172,2006-2010;EP1394274(实施例11);US2004005320(实施例5);WO2003029262(第74-75页);WO2003002717(权利要求2;第63页);WO200222153(第45-47页);US2002042366(第20-21页);WO200146261(第57-59页);WO200146232(第63-65页);WO9837193(权利要求1;第55-59页);
登录号:Q9UHF4;Q6UWA9;Q96SH8;EMBL;AF184971;AAF01320.1。
(21)短蛋白聚糖(BCAN、BEHAB,Genbank登录号AF229053)
Gary S.C.等Gene 256,139-147,2000;Clark H.F.等Genome Res.13,2265-2270,2003;Strausberg R.L.等Proc.Natl.Acad.Sci.U.S.A.99,16899-16903,2002;US2003186372(权利要求11);US2003186373(权利要求11);US2003119131(权利要求1;图52);US2003119122(权利要求1;图52);US2003119126(权利要求1);US2003119121(权利要求1;图52);US2003119129(权利要求1);US2003119130(权利要求1);US2003119128(权利要求1;图52);US2003119125(权利要求1);WO2003016475(权利要求1);WO200202634(权利要求1);
(22)EphB2R(DRT、ERK、Hek5、EPHT3、Tyro5,Genbank登录号NM_004442)
Chan,J.和Watt,V.M.,Oncogene 6(6),1057-1061(1991),Oncogene 10(5):897-905(1995),Annu.Rev.Neurosci.21:309-345(1998),Int.Rev.Cytol.196:177-244(2000));WO2003042661(权利要求12);WO200053216(权利要求1;第41页);WO2004065576(权利要求1);WO2004020583(权利要求9);WO2003004529(第128-132页);WO200053216(权利要求1;第42页);
交叉引用:MIM:600997;NP_004433.2;NM_004442_1
(23)ASLG659(B7h,Genbank登录号AX092328)
US20040101899(权利要求2);WO2003104399(权利要求11);WO2004000221(图3);US2003165504(权利要求1);US2003124140(实施例2);US2003065143(图60);WO2002102235(权利要求13;第299页);US2003091580(实施例2);WO200210187(权利要求6;图10);WO200194641(权利要求12;图7b);WO200202624(权利要求13;图1A-1B);US2002034749(权利要求54;第45-46页);WO200206317(实施例2;第320-321页,权利要求34;第321-322页);WO200271928(第468-469页);WO200202587(实施例1;图1);WO200140269(实施例3;第190-192页);WO200036107(实施例2;第205-207页);WO2004053079(权利要求12);WO2003004989(权利要求1);WO200271928(第233-234页、第452-453页);WO 0116318;
(24)PSCA(前列腺干细胞抗原前体,Genbank登录号AJ297436)
Reiter R.E.等Proc.Natl.Acad.Sci.U.S.A.95,1735-1740,1998;Gu Z.等Oncogene 19,1288-1296,2000;Biochem.Biophys.Res.Commun.(2000)275(3):783-788;WO2004022709;EP1394274(实施例11);US2004018553(权利要求17);WO2003008537(权利要求1);WO200281646(权利要求1;第164页);WO2003003906(权利要求10;第288页);WO200140309(实施例1;图17);US2001055751(实施例1;图1b);WO200032752(权利要求18;图1);WO9851805(权利要求17;第97页);WO9851824(权利要求10;第94页);WO9840403(权利要求2;图1B);
登录号:O43653;EMBL;AF043498;AAC39607.1。
(25)GEDA(Genbank登录号AY260763);
AAP14954脂肪瘤HMGIC融合-配偶类蛋白/pid=AAP14954.1-智人
物种:智人(人)
WO2003054152(权利要求20);WO2003000842(权利要求1);WO2003023013(实施例3、权利要求20);US2003194704(权利要求45);
交叉引用:GI:30102449;AAP14954.1;AY260763_1
(26)BAFF-R(B细胞活化因子受体、BLyS受体3、BR3,Genbank登录号AF116456);BAFF受体/pid=NP_443177.1-智人
Thompson,J.S.等Science 293(5537),2108-2111(2001);WO2004058309;WO2004011611;WO2003045422(实施例;第32-33页);WO2003014294(权利要求35;图6B);WO2003035846(权利要求70;第615-616页);WO200294852(第136-137栏);WO200238766(权利要求3;第133页);WO200224909(实施例3;图3);
交叉引用:MIM:606269;NP_443177.1;NM_052945_1;AF132600
(27)CD22(B细胞受体CD22-B同种型、BL-CAM、Lyb-8、Lyb8、SIGLEC-2、FLJ22814,Genbank登录号AK026467);
Wilson等(1991)J.Exp.Med.173:137-146;WO2003072036(权利要求1;图1);
交叉引用:MIM:107266;NP_001762.1;NM_001771_1
(28)CD79a(CD79A、CD79α、免疫球蛋白相关α、与Igβ(CD79B)共价相互作用并且在表面上与Ig M分子形成复合物、转导涉及B细胞分化的信号的B细胞特异性蛋白,pI:4.84,MW:25028TM:2[P]基因染色体:19q13.2,Genbank登录号NP_001774.10)
WO2003088808;US20030228319;WO2003062401(权利要求9);US2002150573(权利要求4、第13-14页);WO9958658(权利要求13、图16);WO9207574(图1);US5644033;Ha等(1992)J.Immunol.148(5):1526-1531;Mueller等(1992)Eur.J.Biochem.22:1621-1625;Hashimoto等(1994)Immunogenetics 40(4):287-295;Preud’homme等(1992)Clin.Exp.Immunol.90(1):141-146;Yu等(1992)J.Immunol.148(2)633-637;Sakaguchi等(1988)EMBO J.7(11):3457-3464;
(29)CXCR5(伯基特淋巴瘤受体1,一种G蛋白偶联的受体,其由CXCL13趋化因子活化,在淋巴细胞迁移和体液防御中发挥功能,在HIV-2感染和可能的AIDS、淋巴瘤、骨髓瘤和白血病的发展中起作用);372aa,pI:8.54MW:41959TM:7[P]基因染色体:11q23.3,Genbank登录号NP_001707.1)
WO2004040000;WO2004015426;US2003105292(实施例2);US6555339(实施例2);WO200261087(图1);WO200157188(权利要求20、第269页);WO200172830(第12-13页);WO200022129(实施例1、第152-153页、实施例2、第254-256页);WO9928468(权利要求1、第38页);US5440021(实施例2、第49-52栏);WO9428931(第56-58页);WO9217497(权利要求7、图5);Dobner等(1992)Eur.J.Immunol.22:2795-2799;Barella等(1995)Biochem.J.309:773-779;
(30)HLA-DOB(MHC II类分子的β亚基(Ia抗原),其结合肽并且将它们呈递给CD4+ T淋巴细胞);273aa,pI:6.56MW:30820TM:1[P]基因染色体:6p21.3,Genbank登录号NP_002111.1)
Tonnelle等(1985)EMBO J.4(11):2839-2847;Jonsson等(1989)Immunogenetics 29(6):411-413;Beck等(1992)J.Mol.Biol.228:433-441;Strausberg等(2002)Proc.Natl.Acad.Sci USA 99:16899-16903;Servenius等(1987)J.Biol.Chem.262:8759-8766;Beck等(1996)J.Mol.Biol.255:1-13;Naruse等(2002)Tissue Antigens 59:512-519;WO9958658(权利要求13、图15);US6153408(第35-38栏);US5976551(第168-170栏);US6011146(第145-146栏);Kasahara等(1989)Immunogenetics 30(1):66-68;Larhammar等(1985)J.Biol.Chem.260(26):14111-14119;
(31)P2X5(嘌呤能受体P2X配体门控离子通道5,一种由细胞外ATP门控的离子通道,可参与突触传递和神经发生,缺陷可促成特发性逼尿肌不稳定的病理生理);422aa),pI:7.63,MW:47206TM:1[P]基因染色体:17p13.3,Genbank登录号NP_002552.2)
Le等(1997)FEBS Lett.418(1-2):195-199;WO2004047749;WO2003072035(权利要求10);Touchman等(2000)Genome Res.10:165-173;WO200222660(权利要求20);WO2003093444(权利要求1);WO2003087768(权利要求1);WO2003029277(第82页);
(32)CD72(B细胞分化抗原CD72、Lyb-2)PROTEIN SEQUENCE Full maeaity...tafrfpd(1..359;359aa),pI:8.66,MW:40225TM:1[P]基因染色体:9p13.3,Genbank登录号NP_001773.1)
WO2004042346(权利要求65);WO2003026493(第51-52页、第57-58页);WO200075655(第105-106页);Von Hoegen等(1990)J.Immunol.144(12):4870-4877;Strausberg等(2002)Proc.Natl.Acad.Sci USA 99:16899-16903;
(33)LY64(淋巴细胞抗原64(RP105),富含亮氨酸的重复序列(LRR)家族的I型膜蛋白,调节B细胞活化和细胞凋亡,功能丧失与患有系统性红斑狼疮的患者体内的疾病活性增加相关);661aa,pI:6.20,MW:74147TM:1[P]基因染色体:5q12,Genbank登录号NP_005573.1)
US2002193567;WO9707198(权利要求11、第39-42页);Miura等(1996)Genomics 38(3):299-304;Miura等(1998)Blood 92:2815-2822;WO2003083047;WO9744452(权利要求8、第57-61页);WO200012130(第24-26页);
(34)FcRH1(Fc受体样蛋白1,一种针对含有C2型Ig样和ITAM结构域的免疫球蛋白Fc结构域的推定受体、可在B淋巴细胞分化中起作用);429aa,pI:5.28,MW:46925TM:1[P]基因染色体:1q21-1q22,Genbank登录号NP_443170.1)
WO2003077836;WO200138490(权利要求6、图18E-1-18-E-2);Davis等(2001)Proc.Natl.Acad.Sci USA 98(17):9772-9777;WO2003089624(权利要求8);EP1347046(权利要求1);WO2003089624(权利要求7);
(35)IRTA2(免疫球蛋白超家族受体易位相关2,一种可在B细胞发育和淋巴瘤生成中起作用的推定免疫受体;在一些B细胞恶性肿瘤中通过易位导致基因调节异常);977aa,pI:6.88MW:106468TM:1[P]基因染色体:1q21,Genbank登记号人:AF343662、AF343663、AF343664、AF343665、AF369794、AF397453、AK090423、AK090475、AL834187、AY358085;小鼠:AK089756、AY158090、AY506558;NP_112571.1
WO2003024392(权利要求2、图97);Nakayama等(2000)Biochem.Biophys.Res.Commun.277(1):124-127;WO2003077836;WO200138490(权利要求3、图18B-1-18B-2);
(36)TENB2(TMEFF2、脑肿瘤抑癌蛋白(tomoregulin)、TPEF、HPP1、TR、推定的跨膜蛋白聚糖,与生长因子和卵泡抑制素(follistatin)的EGF/神经生长因子(heregulin)家族有关);374aa,NCBI登录号:AAD55776、AAF91397、AAG49451,NCBI RefSeq:NP_057276;NCBI基因:23671;OMIM:605734;SwissProt Q9UIK5;Genbank登录号AF179274;AY358907;CAF85723;CQ782436
WO2004074320(SEQ ID NO 810);JP2004113151(SEQ ID NOS 2、4、8);WO2003042661(SEQ ID NO 580);WO2003009814(SEQ ID NO 411);EP1295944(第69-70页);WO200230268(第329页);WO200190304(SEQ ID NO 2706);US2004249130;US2004022727;WO2004063355;US2004197325;US2003232350;US2004005563;US2003124579;Horie等(2000)Genomics 67:146-152;Uchida等(1999)Biochem.Biophys.Res.Commun.266:593-602;Liang等(2000)Cancer Res.60:4907-12;Glynne-Jones等(2001)Int J Cancer.Oct 15;94(2):178-84;
(37)PMEL17(银同源物;SILV;D12S53E;PMEL17;SI;SIL);ME20;gp100)BC001414;BT007202;M32295;M77348;NM_006928;McGlinchey,R.P.等(2009)Proc.Natl.Acad.Sci.U.S.A.106(33),13731-13736;Kummer,M.P.等(2009)J.Biol.Chem.284(4),2296-2306;
(38)TMEFF1(具有EGF样结构域和两个卵泡抑素样结构域的跨膜蛋白1;脑肿瘤抑癌蛋白-1);H7365;C9orf2;C9ORF2;U19878;X83961;NM_080655;NM_003692;Harms,P.W.(2003)Genes Dev.17(21),2624-2629;Gery,S.等(2003)Oncogene 22(18):2723-2727;
(39)GDNF-Ra1(GDNF家族受体α1;GFRA1;GDNFR;GDNFRA;RETL1;TRNR1;RET1L;GDNFR-α1;GFR-ALPHA-1);U95847;BC014962;NM_145793NM_005264;Kim,M.H.等(2009)Mol.Cell.Biol.29(8),2264-2277;Treanor,J.J.等(1996)Nature 382(6586):80-83;
(40)Ly6E(淋巴细胞抗原6复合物,基因座E;Ly67、RIG-E、SCA-2、TSA-1);NP_002337.1;NM_002346.2;de Nooij-van Dalen,A.G.等(2003)Int.J.Cancer 103(6),768-774;Zammit,D.J.等(2002)Mol.Cell.Biol.22(3):946-952;
(41)TMEM46(shisa同源物2(非洲爪蟾);SHISA2);NP_001007539.1;NM_001007538.1;Furushima,K.等(2007)Dev.Biol.306(2),480-492;Clark,H.F.等(2003)Genome Res.13(10):2265-2270;
(42)Ly6G6D(淋巴细胞抗原6复合物,基因座G6D;Ly6-D、MEGT1);NP_067079.2;NM_021246.2;Mallya,M.等(2002)Genomics 80(1):113-123;Ribas,G.等(1999)J.Immunol.163(1):278-287;
(43)LGR5(富含亮氨酸重复序列的G蛋白偶联受体5;GPR49、GPR67);NP_003658.1;NM_003667.2;Salanti,G.等(2009)Am.J.Epidemiol.170(5):537-545;Yamamoto,Y.等(2003)Hepatology 37(3):528-533;
(44)RET(ret原癌基因;MEN2A;HSCR1;MEN2B;MTC1;PTC;CDHF12;Hs.168114;RET51;RET-ELE1);NP_066124.1;NM_020975.4;Tsukamoto,H.等(2009)Cancer Sci.100(10):1895-1901;Narita,N.等(2009)Oncogene 28(34):3058-3068;
(45)LY6K(淋巴细胞抗原6复合物,基因座K;LY6K;HSJ001348;FLJ35226);NP_059997.3;NM_017527.3;Ishikawa,N.等(2007)Cancer Res.67(24):11601-11611;de Nooij-van Dalen,A.G.等(2003)Int.J.Cancer 103(6):768-774;
(46)GPR19(G蛋白偶联的受体19;Mm.4787);NP_006134.1;NM_006143.2;Montpetit,A.和Sinnett,D.(1999)Hum.Genet.105(1-2):162-164;O'Dowd,B.F.等(1996)FEBS Lett.394(3):325-329;
(47)GPR54(KISS1受体;KISS1R;GPR54;HOT7T175;AXOR12);NP_115940.2;NM_032551.4;Navenot,J.M.等(2009)Mol.Pharmacol.75(6):1300-1306;Hata,K.等(2009)Anticancer Res.29(2):617-623;
(48)ASPHD1(含天冬氨酸β羟化酶结构域的1;LOC253982);NP_859069.2;NM_181718.3;Gerhard,D.S.等(2004)Genome Res.14(10B):2121-2127;
(49)酪氨酸酶(TYR;OCAIA;OCA1A;酪氨酸酶;SHEP3);NP_000363.1;NM_000372.4;Bishop,D.T.等(2009)Nat.Genet.41(8):920-925;Nan,H.等(2009)Int.J.Cancer 125(4):909-917;
(50)TMEM118(环指蛋白,跨膜2;RNFT2;FLJ14627);NP_001103373.1;NM_001109903.1;Clark,H.F.等(2003)Genome Res.13(10):2265-2270;Scherer,S.E.等(2006)Nature 440(7082):346-351
(51)GPR172A(G蛋白偶联的受体172A;GPCR41;FLJ11856;D15Ertd747e);NP_078807.1;NM_024531.3;Ericsson,T.A.等(2003)Proc.Natl.Acad.Sci.U.S.A.100(11):6759-6764;Takeda,S.等(2002)FEBS Lett.520(1-3):97-101。
(52)CD33,结合唾液酸的免疫球蛋白样凝集素家族的成员,为67kDa糖基化的跨膜蛋白。除了定向型骨髓单核细胞和红系祖细胞外,CD33还在大多数骨髓性和单核细胞性白血病细胞上表达。在最早的多能干细胞、成熟粒细胞、淋巴样细胞或非造血系统癌细胞上未示出(Sabbath等,(1985)J.Clin.Invest.75:756-56;Andrews等,(1986)Blood 68:1030-5)。CD33在其细胞质尾部上含有两个酪氨酸残基,所述残基中的每一个后跟类似于在许多抑制性受体中示出的基于免疫受体酪氨酸的抑制性基序(ITIM)的疏水性残基。
(53)CLL-1(CLEC12A、MICL和DCAL2),编码C型凝集素/C型凝集素样结构域(CTL/CTLD)超家族。此家族的成员共享共同的蛋白质折叠并且具有各种功能,诸如细胞粘附、细胞-细胞信号传导、糖蛋白反转并且在炎症和免疫应答上起作用。由此基因编码的蛋白质为粒细胞和单核细胞功能的阴性调节因子。替代地,已描述数种此基因的剪接转录物变体,但这些变体中的一些的全长性质尚未确定。此基因与染色体12p13上的天然杀伤基因复合物区中的其他CTL/CTLD超家族成员密切相关(Drickamer K(1999)Curr.Opin.Struct.Biol.9(5):585–90;van Rhenen A等,(2007)Blood 110(7):2659–66;Chen CH等(2006)Blood 107(4):1459–67;Marshall AS等(2006)Eur.J.Immunol.36(8):2159–69;Bakker AB等(2005)Cancer Res.64(22):8443–50;Marshall AS等(2004)J.Biol.Chem.279(15):14792–802)。已示出CLL-1为II型跨膜受体,其包含单个C型凝集素样结构域(所述结构域未被预测结合钙或糖)、柄区、跨膜结构域和含有ITIM基序的短细胞质尾部。
抗CD22抗体
表3中的ADC的抗CD22抗体包含根据US 8226945的三个轻链高变区(HVR-L1、HVR-L2和HVR-L3)和三个重链高变区(HVR-H1、HVR-H2和HVR-H3):
抗HER2抗体
在某些实施方案中,表3的ADC包含抗HER2抗体。在本发明的一个实施方案中,本发明的ADC的抗HER2抗体包括如在US 5821337的表3中所述的人源化抗HER2抗体,例如huMAb4D5-1、huMAb4D5-2、huMAb4D5-3、huMAb4D5-4、huMAb4D5-5、huMAb4D5-6、huMAb4D5-7和huMAb4D5-8,所述专利确切地以引用的方式并入本文。那些抗体含有人框架区与结合HER2的鼠抗体(4D5)的互补决定区。人源化抗体huMAb4D5-8又称为曲妥珠单抗,以商品名HERCEPTIN商业上可在本发明的另一个实施方案中,本发明的ADC的抗HER2抗体包括如在US7862817中所述的人源化抗HER2抗体,例如人源化2C4。示例性人源化2C4抗体为帕妥珠单抗,以商品名PERJETA商业上可
在本发明的另一个实施方案中,本发明的ADC的抗HER2抗体包括称为7C2的人源化抗HER2抗体。
在一些实施方案中,用于制备表3的ADC的半胱氨酸工程化的THIOMABTM抗体具有在轻链149赖氨酸位点处引入的半胱氨酸残基(LC K149C)。在其他实施方案中,半胱氨酸工程化的THIOMABTM抗体具有在重链118丙氨酸位点(EU编号)处引入的半胱氨酸残基(HC A118C)。替代地,此位点通过顺序编号为121或通过Kabat编号为114。
抗CD33抗体
表2中的ADC的抗CD33抗体15G15.33包含三个轻链高变区(HVR-L1、HVR-L2和HVR-L3)和三个重链高变区(HVR-H1、HVR-H2和HVR-H3)
表5中的ADC的抗CD33抗体15G15.33包含SEQ ID NO:13的轻链可变区和/或SEQ ID NO:14的重链可变区。
EIVLTQSPLSLPVTPGEPASISCRSSQSLLHSNGYNYLDWYLQKPGQSPQLLIYLGVNSVSGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCMQALQTPWTFGQGTKVEIK
(SEQ ID NO:13)
QVQLVQSGAEVKKPGSSVKVSCKASGGIFSNHAISWVRQAPGQGLEWMGGIIPIFGTANYAQKFQGRVTITADESTSTAFMELSSLRSEDTAVYYCAREWADVFDIWGQGTMVTVSS
(SEQ ID NO:14)
抗CD33抗体9C3和其他实施方案
9C3 VL
DIQMTQSPSSLSASVGDRVTITCRASQGIRNDLGWYQQKPGKAPKRLIYAASSLQSGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCLQHNSYPWTFGQGTKLEIK
(SEQ ID NO:21)
9C3 VH
EVQLVESGGALIQPGGSLRLSCVASGFTISGNYMSWVRQAPGKGLEWVSLIYSGDSTYYADSVKGRFNISRDISKNTVYLQMNSLRVEDTAVYYCVRDGYYVSDMVVWGKGTTVTVSS
(SEQ ID NO:22)
9C3.2 VL
DIQMTQSPSSLSASVGDRVTITCRASQGIRNDLGWYQQKPGKAPKRLIYAASSLQSGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCLQHNSYPWTFGQGTKLEIK
(SEQ ID NO:23)
9C3.2 VH
EVQLVESGGALIQPGGSLRLSCVASGFTISGNYMSWVRQAPGKGLEWVSLIYSGDSTYYADSVKGRFTISRDISKNTVYLQMNSLRVEDTAVYYCVRDGYYVSDMVVWGKGTTVTVSS
(SEQ ID NO:24)
9C3.3 VL
DIQMTQSPSSLSASVGDRVTITCRASQGIRNDLGWYQQKPGKAPKRLIYAASSLQSGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCLQHNSYPWTFGQGTKLEIK
(SEQ ID NO:25)
9C3.3 VH
EVQLVESGGALIQPGGSLRLSCVASGFTISGNYMSWVRQAPGKGLEWVSLIYSGDSTYYADSVKGRFSISRDISKNTVYLQMNSLRVEDTAVYYCVRDGYYVSDMVVWGKGTTVTVSS
(SEQ ID NO:26)
9C3.4 VL
DIQMTQSPSSLSASVGDRVTITCRASQGIRNDLGWYQQKPGKAPKRLIYAASSLQSGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCLQHNSYPWTFGQGTKLEIK
(SEQ ID NO:27)
9C3.4 VH
EVQLVESGGALIQPGGSLRLSCVASGFTISGNYMSWVRQAPGKGLEWVSLIYSGDSTYYADSVKGRFAISRDISKNTVYLQMNSLRVEDTAVYYCVRDGYYVSDMVVWGKGTTVTVSS
(SEQ ID NO:28)
在一些实施方案中,本发明提供包含至少一个、两个、三个、四个、五个或六个选自以下的HVR的抗CD33抗体:(a)包含SEQ ID NO:18的氨基酸序列的HVR-H1;(b)包含SEQ ID NO:19的氨基酸序列的HVR-H2;(c)包含SEQ ID NO:20的氨基酸序列的HVR-H3;(d)包含SEQ ID NO:15的氨基酸序列的HVR-L1;(e)包含SEQ ID NO:16的氨基酸序列的HVR-L2;和(f)包含SEQ ID NO:17的氨基酸序列的HVR-L3。
一方面,本发明提供包含至少一个、至少两个或全部三个选自以下的VH HVR序列的抗体:(a)包含SEQ ID NO:18的氨基酸序列的HVR-H1;(b)包含SEQ ID NO:19的氨基酸序列的HVR-H2;和(c)包含SEQ ID NO:20的氨基酸序列的HVR-H3。在一个实施方案中,抗体包含含有SEQ ID NO:20的氨基酸序列的HVR-H3。在另一个实施方案中,抗体包含含有SEQ ID NO:20的氨基酸序列的HVR-H3和含有SEQ ID NO:17的氨基酸序列的HVR-L3。在另一实施方案中,抗体包含含有SEQ ID NO:20的氨基酸序列的HVR-H3、含有SEQ ID NO:17的氨基酸序列的HVR-L3和含有SEQ ID NO:19的氨基酸序列的HVR-H2。在另一实施方案中,抗体包含(a)含有SEQ ID NO:18的氨基酸序列的HVR-H1;(b)含有SEQ ID NO:19的氨基酸序列的HVR-H2;和(c)含有SEQ ID NO:20的氨基酸序列的HVR-H3。
另一方面,本发明提供包含至少一个、至少两个或全部三个选自以下的VL HVR序列的抗体:(a)包含SEQ ID NO:15的氨基酸序列的HVR-L1;(b)包含SEQ ID NO:16的氨基酸序列的HVR-L2;和(c)包含SEQ ID NO:17的氨基酸序列的HVR-L3。在一个实施方案中,抗体包含(a)含有SEQ ID NO:15的氨基酸序列的HVR-L1;(b)含有SEQ ID NO:16的氨基酸序列的HVR-L2;和(c)含有SEQ ID NO:17的氨基酸序列的HVR-L3。
另一方面,本发明的抗体包含(a)含有至少一个、至少两个或全部三个选自以下的VH HVR序列的VH结构域:(i)包含SEQ ID NO:18的氨基酸序列的HVR-H1,(ii)包含SEQ ID NO:19的氨基酸序列的HVR-H2,和(iii)包含选自SEQ ID NO:20的氨基酸序列的HVR-H3;和(b)含有至少一个、至少两个或全部三个选自以下的VL HVR序列的VL结构域:(i)包含SEQ ID NO:15的氨基酸序列的HVR-L1,(ii)包含SEQ ID NO:16的氨基酸序列的HVR-L2,和(iii)包含SEQ ID NO:17的氨基酸序列的HVR-L3。
另一方面,本发明提供包含以下的抗体:(a)包含SEQ ID NO:18的氨基酸序列的HVR-H1;(b)包含SEQ ID NO:19的氨基酸序列的HVR-H2;(c)包含SEQ ID NO:20的氨基酸序列的HVR-H3;(d)包含SEQ ID NO:15的氨基酸序列的HVR-L1;(e)包含SEQ ID NO:16的氨基酸序列的HVR-L2;和(f)包含SEQ ID NO:17的氨基酸序列的HVR-L3。
在任何以上实施方案中,抗CD33抗体为人源化的。在一个实施方案中,抗CD33抗体包含如在任何以上实施方案中的HVR,并且还包含人受体框架,例如人免疫球蛋白框架或人共有框架。在某些实施方案中,人受体框架为人VLκI共有(VLKI)框架和/或VH框架VH1。在某些实施方案中,人受体框架为包含任何一种以下突变的人VLκI共有(VLKI)框架和/或VH框架VH1。
另一方面,抗CD33抗体包含与SEQ ID NO:22、SEQ ID NO:24、SEQ ID NO:26和/或SEQ ID NO:28的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的重链可变结构域(VH)序列。在某些实施方案中,与SEQ ID NO:22、SEQ ID NO:24、SEQ ID NO:26和/或SEQ ID NO:28的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的VH序列相对于参考序列含有取代(例如,保守性取代)、插入或缺失,但包含所述序列的抗CD33抗体保留结合CD33的能力。在某些实施方案中,在SEQ ID NO:22、SEQ ID NO:24、SEQ ID NO:26和/或SEQ ID NO:28中总共有1至10个氨基酸被取代、插入和/或缺失。在某些实施方案中,在SEQ ID NO:22、SEQ ID NO:24、SEQ ID NO:26和/或SEQ ID NO:28中总共有1至5个氨基酸被取代、插入和/或缺失。在某些实施方案中,取代、插入或缺失发生在HVR以外的区域(即,在FR中)。任选地,抗CD33抗体包含SEQ ID NO:22、SEQ ID NO:24、SEQ ID NO:26和/或SEQ ID NO:28的VH序列,包括所述序列的翻译后修饰。在具体实施方案中,VH包含一个、两个或三个选自以下的HVR:(a)包含SEQ ID NO:18的氨基酸序列的HVR-H1,(b)包含SEQ ID NO:19的氨基酸序列的HVR-H2和(c)包含SEQ ID NO:20的氨基酸序列的HVR-H3。
另一方面,提供抗CD33抗体,其中抗体包含与SEQ ID NO:21、SEQ ID NO:23、SEQ ID NO:25和/或SEQ ID NO:27的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的轻链可变结构域(VL)。在某些实施方案中,与SEQ ID NO:21、SEQ ID NO:23、SEQ ID NO:25和/或SEQ ID NO:27的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的VL序列相对于参考序列含有取代(例如,保守性取代)、插入或缺失,但包含所述序列的抗CD33抗体保留结合CD33的能力。在某些实施方案中,在SEQ ID NO:21、SEQ ID NO:23、SEQ ID NO:25和/或SEQ ID NO:27中总共有1至10个氨基酸被取代、插入和/或缺失。在某些实施方案中,在SEQ ID NO:21、SEQ ID NO:23、SEQ ID NO:25和/或SEQ ID NO:27中总共有1至5个氨基酸被取代、插入和/或缺失。在某些实施方案中,取代、插入或缺失发生在HVR以外的区域(即,在FR中)。任选地,抗CD33抗体包含SEQ ID NO:21、SEQ ID NO:23、SEQ ID NO:25和/或SEQ ID NO:27的VL序列,包括所述序列的翻译后修饰。在具体实施方案中,VL包含一个、两个或三个选自以下的HVR:(a)包含SEQ ID NO:15的氨基酸序列的HVR-L1,(b)包含SEQ ID NO:16的氨基酸序列的HVR-L2,和(c)包含SEQ ID NO:17的氨基酸序列的HVR-L3。
另一方面,提供抗CD33抗体,其中抗体包含如在以上提供的任何实施方案中的VH和如在以上提供的任何实施方案中的VL。
在一个实施方案中,抗体分别包含SEQ ID NO:22和SEQ ID NO:21的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,抗体分别包含SEQ ID NO:24和SEQ ID NO:23的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,抗体分别包含SEQ ID NO:26和SEQ ID NO:25的VH和VL序列,包括那些序列的翻译后修饰。在一个实施方案中,抗体分别包含SEQ ID NO:28和SEQ ID NO:27的VH和VL序列,包括那些序列的翻译后修饰。
又一方面,本文提供与本文提供的抗CD33抗体结合相同表位的抗体。例如,在某些实施方案中,提供与分别包含SEQ ID NO:22、SEQ ID NO:24、SEQ ID NO:26和/或SEQ ID NO:28的VH序列和SEQ ID NO:21、SEQ ID NO:23、SEQ ID NO:25和/或SEQ ID NO:27的VL序列的抗CD33抗体结合相同表位的抗体。
在本发明的又一方面,根据任何以上实施方案的抗CD33抗体为单克隆抗体,包括人抗体。在一个实施方案中,抗CD33抗体为抗体片段,例如Fv、Fab、Fab’、scFv、双抗体或F(ab’)2片段。在另一个实施方案中,抗体为基本上全长的抗体,例如,如本文所定义的IgG1抗体、IgG2a抗体或其他抗体类别或同种型。
又一方面,根据任何以上实施方案的抗CD33抗体可以单独或组合并入如下所述的任何特征。
亲本抗体还可为包含白蛋白结合肽(ABP)序列的融合蛋白(Dennis等(2002)J Biol Chem.277:35035-35043(表III和表IV,第35038页);和WO 2001/45746的第12-13处,所述参考文献以引用的方式并入本文。
为了通过诱变来制备半胱氨酸工程化的抗体,编码起始多肽的氨基酸序列变体的DNA通过本领域已知的多种方法来制备。这些方法包括,但不限于通过定点(或寡核苷酸介导的)诱变、PCR诱变以及之前制备的编码多肽的DNA的盒诱变。还可通过限制性片段操控或通过与合成寡核苷酸重叠延伸PCR来构建重组抗体的变体。诱变引物编码半胱氨酸密码子替换物。可采用标准诱变技术来产生编码此类突变半胱氨酸工程化的抗体的DNA。一般指导可见于Sambrook等Molecular Cloning,A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,1989;和Ausubel等Current Protocols in Molecular Biology,Greene Publishing and Wiley-Interscience,New York,N.Y.,1993。
可使用重组方法和组合物来产生抗体,例如,如US 4816567所述。在一个实施方案中,分离的核酸编码包含抗体VL的氨基酸序列和/或包含抗体VH的氨基酸序列(例如,抗体的轻链和/或重链)。在另一实施方案中,提供包含此类核酸的一种或多种载体(例如,表达载体)。在另一实施方案中,提供包含此类核酸的宿主细胞。在一个此类实施方案中,宿主细胞包含(例如,用以下载体转化):(1)包含核酸的载体,所述核酸编码包含抗体VL的氨基酸序列和包含抗体VH的氨基酸序列,或(2)包含编码含有抗体VL的氨基酸序列的核酸的第一载体和包含编码含有抗体VH的氨基酸序列的核酸的第二载体。在一个实施方案中,宿主细胞为真核的,例如中国仓鼠卵巢(CHO)细胞或淋巴样细胞(例如,Y0、NS0、Sp20细胞)。在一个实施方案中,方法包括在合适于表达抗体的条件下培养包含编码如上所提供的抗体的核酸的宿主细胞,并且任选地,从宿主细胞(或宿主细胞培养基)回收抗体。
对于重组生产,将编码例如如上所述的抗体的核酸分离,并且插入一种或多种载体中以用于在宿主细胞中进一步克隆和/或表达。可使用常规程序将此类核酸容易地分离并且进行测序(例如,通过使用寡核苷酸探针,所述寡核苷酸探针能够特异性结合编码抗体的重链和轻链的基因)。合适于克隆或表达编码抗体的载体的宿主细胞包括本文所述的原核或真核细胞。例如,可以在细菌中产生抗体,特别是在不需要糖基化和Fc效应子功能时。对于抗体片段和多肽在细菌中的表达,参见,例如,US 5648237、US 5789199和US 5840523,还有Charlton,Methods in Molecular Biology,第248卷(B.K.C.Lo编著,Humana Press,Totowa,NJ,2003),第245-254页,描述抗体片段在大肠杆菌中的表达。)表达后,可以将抗体在可溶性级分中从细菌细胞团糊中分离,并且可以进一步纯化。除了原核生物以外,真核微生物诸如丝状真菌或酵母是合适于编码抗体的载体的克隆或表达宿主,包括其糖基化途径已被“人源化”从而导致产生具有部分或完全人糖基化样式的抗体的真菌和酵母菌株。参见Gerngross,Nat.Biotech.22:1409-1414(2004)和Li等,Nat.Biotech.24:210-215(2006)。合适于表达糖基化抗体的宿主细胞也来源于多细胞生物体(无脊椎动物和脊椎动物)。无脊椎动物细胞的实例包括植物和昆虫细胞。已鉴定出许多杆状病毒株,其可以与昆虫细胞一起使用,特别是用于转染草地夜蛾(Spodoptera frugiperda)细胞。植物细胞培养物也可以用作宿主,诸如在US 5959177、US 6040498、US 6420548、US 7125978和US 6417429(描述用于在转基因植物中产生抗体的PLANTIBODIESTM技术)中描述的那些。也可以使用脊椎动物细胞作为宿主。例如,适合于在悬浮液中生长的哺乳动物细胞系可能是有用的。有用的哺乳动物宿主细胞系的其他实例为由SV40转化的猴肾CV1系(COS-7);人胚肾系(293或293细胞,如描述于例如Graham等,J.Gen Virol.36:59(1977);幼年仓鼠肾细胞(BHK);小鼠塞托利(sertoli)细(TM4细胞,如描述于例如Mather,Biol.Reprod.23:243-251(1980);猴肾细胞(CV1);非洲绿猴肾细胞(VERO-76);人宫颈癌细胞(HELA);犬肾细胞(MDCK;布法罗大鼠肝细胞(BRL 3A);人肺细胞(W138);人肝细胞(Hep G2);小鼠乳腺肿瘤(MMT 060562);TRI细胞,如描述于例如Mather等,Annals N.Y.Acad.Sci.383:44-68(1982);MRC 5细胞;和FS4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(CHO)细胞,包括DHFR-CHO细胞(Urlaub等,Proc.Natl.Acad.Sci.USA 77:4216(1980));和骨髓瘤细胞系诸如Y0、NS0和Sp2/0。关于合适于抗体产生的某些哺乳动物宿主细胞系的综述,参见,例如,Yazaki和Wu,Methods in Molecular Biology,第248卷(B.K.C.Lo编著,Humana Press,Totowa,NJ),第255-268(2003)。
定点诱变为用于制备取代变体即突变蛋白的一种方法(Carter(1985)等Nucleic Acids Res.13:4431-4443;Ho等(1989)Gene(Amst.)77:51-59;和Kunkel等(1987)Proc.Natl.Acad.Sci.USA 82:488)。起始DNA通过首先使编码所需突变的寡核苷酸与此类起始DNA的单链杂交来改变。杂交后,使用DNA聚合酶来合成整个第二链,使用杂交的寡核苷酸作为引物并且使用起始DNA的单链作为模板。因此,编码所需突变的寡核苷酸被并入在所得到的双链DNA中。定点诱变可在表达质粒中表达待诱变的蛋白质的基因内进行,并且可对所得到的质粒进行测序以证实所需半胱氨酸替换突变的引入(Liu等(1998)J.Biol.Chem.273:20252-20260)。定点诱变方案和形式为广泛可获得的,例如多定点诱变试剂盒(Stratagene,La Jolla,CA)。
PCR诱变还合适于制备起始多肽的氨基酸序列变体。参见Higuchi,(1990)的PCR方案,第177-183页,Academic Press;Ito等(1991)Gene 102:67-70;Bernhard等(1994)Bioconjugate Chem.,5:126-132;和Vallette等(1989)Nuc.Acids Res.,17:723-733。简而言之,当少量模板DNA用作PCR中的起始原料时,在序列上稍微不同于模板DNA中的相应区的引物可用于产生相对大量的特异性DNA片段,所述DNA片段仅在其中引物不同于模板的位置处不同于模板序列。
用于制备变体、盒诱变的另一种方法基于Wells等(1985)Gene,34:315-323描述的技术。起始原料为包含待突变的起始多肽DNA的质粒(或其他载体)。鉴定了待突变的起始DNA中的密码子。在鉴定的突变位点的每一侧上必须存在独特的限制性内切酶位点。如果不存在此类限制性位点,可以使用以上描述的寡核苷酸介导的诱变方法来产生所述限制性位点,以便在起始多肽DNA中的适当位置处引入它们。在这些位点处切割质粒DNA使其线性化。使用标准程序合成编码限制性位点之间的DNA序列但含有所需突变的双链寡核苷酸,其中分开合成寡核苷酸的两个链并且然后使用标准技术杂交在一起。此双链寡核苷酸称为盒。此盒被设计成具有与线性化的质粒的末端相容的5'端和3'端,这样使得它可以直接连接至质粒。现在此质粒含有突变的DNA序列。含有编码半胱氨酸替换物的突变DNA可通过DNA测序来证实。
还通过使用双链质粒DNA作为模板的寡核苷酸定向诱变通过基于PCR的诱变来产生单个突变(Sambrook和Russel,(2001)Molecular Cloning:A Laboratory Manual,第3版;Zoller等(1983)Methods Enzymol.100:468-500;Zoller,M.J.和Smith,M.(1982)Nucl.Acids Res.10:6487-6500)。
在某些实施方案中,可以将一种或多种氨基酸修饰引入本文提供的抗体的Fc区中,由此产生Fc区变体。Fc区变体可以包含在一个或多个氨基酸位置处包含氨基酸修饰(例如取代)的人Fc区序列(例如,人IgG1、IgG2、IgG3或IgG4Fc区)。
在某些实施方案中,本发明涵盖具有一些但不是所有效应子功能的抗体变体,所述效应子功能使其成为用于如下应用的期望候选物,其中抗体的体内半衰期为重要的,而某些效应子功能(诸如补体和ADCC)为不必要的或有害的。可以进行体外和/或体内细胞毒性测定来证实CDC和/或ADCC活性的减少/缺失。例如,可以进行Fc受体(FcR)结合测定来确保抗体缺乏FcγR结合(因此可能缺乏ADCC活性),但保留FcRn结合能力。
蒽环类二硫化物中间体
本发明的抗体-药物缀合物化合物包含蒽环类二硫化物中间体,其包含在酮基处用二硫化物基团衍生化的PNU-15682部分。
蒽环类二硫化物中间体具有下式:
Ant-L-(Z)m-X I
其中Ant选自以下结构:
其中波浪线表示与L的附接;
L为选自以下的接头:–CH2O–、–CH2N(R)–、-N(R)-、-N(R)(C1-C12亚烷基)-、-N(R)(C2-C8亚烯基)-、-N(R)(C2-C8亚炔基)-、-N(R)(CH2CH2O)n-以及以下结构:
其中波浪线表示与Ant和Z的附接;并且
Z为选自以下的任选间隔物:-CH2C(O)-、-CH2C(O)NR(C1-C12亚烷基)-以及以下结构:
其中波浪线表示与L和X的附接;
R为H、C1-C12烷基或C6-C20芳基;
Z1选自-(C1-C12亚烷基)-、-(C2-C8亚烯基)-、-(C2-C8亚炔基)-、-O(C1-C12亚烷基)-、-O(C2-C8亚烯基)-,-O(C2-C8亚炔基)-以及-(CH2CH2O)n-;
m为0或1;
n为1至6;
X为吡啶基二硫化物,其中吡啶基任选被选自以下的一个或多个基团取代:NO2、Cl、F、CN和Br;并且
亚烷基、亚烯基、亚炔基、烷基和芳基任选被选自以下的一个或多个基团取代:F、Cl、Br、N(CH3)2、NO2和OCH3。
X的示例性实施方案为:
其中波浪线表示与L或Z的附接;
R1为NO2、Cl、F、CN或Br,并且q为0、1或2。
不限于具体机理或作用,在蒽环类二硫化物中间体的吡啶基环上存在吸电子基团R1;NO2、Cl、F或Br加速了与半胱氨酸工程化的抗体的半胱氨酸巯基的反应。在半胱氨酸巯基被引入在抗体上的位阻或反应性较低的部位上的情况下,此类蒽环类二硫化物中间体得到相对于相应未取代的吡啶基类似物(R1=H)更有效的缀合。
示例性接头-药物中间体为式Ia-c:
和
其中R1为NO2、Cl、F、CN或Br;并且q为0、1或2。
示例性接头-药物中间体包括其中R1为NO2并且q为1。
示例性接头-药物中间体为式Id:
有用于制备本发明的抗体-药物缀合物的示例性蒽环类二硫化物、接头-药物中间体包括在表1中。蒽环类二硫化物、接头-药物(LD)中间体的合成描述于实施例1中。
表1蒽环类二硫化物、接头-药物中间体
抗体-药物缀合物(ADC)
本发明的抗体-药物缀合物(ADC)化合物包含连接至有效的蒽环类药物部分的对肿瘤相关的抗原具有特异性的抗体,并且包括具有治疗活性、对多种过度增殖性病症(包括癌症)有效的那些。药物部分的生物活性通过缀合至抗体来调节。本发明的ADC选择性地将有效剂量的蒽环类药物或毒素递送至肿瘤细胞或部位,从而可以实现更大的选择性(即更低的有效剂量),同时提高治疗指数(“治疗窗口”)。在示例性实施方案中,ADC化合物包含缀合(即通过接头共价附接)至蒽环类药物部分的半胱氨酸工程化的抗体。
本发明的抗体-药物缀合物化合物包含通过二硫化物、接头L和任选的间隔物Z共价附接至一个或多个蒽环类衍生物药物部分D的抗体,化合物具有式II:
Ab-S-S-(Zm-L-D)p II
或其药学上可接受的盐,其中:
Ab为结合至选自(1)-(53)的一个或多个肿瘤相关的抗原或细胞表面受体的抗体:
(1)BMPR1B(IB型骨形态发生蛋白受体);
(2)E16(LAT1、SLC7A5);
(3)STEAP1(六次跨膜的前列腺上皮抗原);
(4)MUC16(0772P、CA125);
(5)MPF(MPF、MSLN、SMR、巨核细胞强化因子、间皮素);
(6)Napi2b(NAPI-3B、NPTIIb、SLC34A2、溶质载体家族34(磷酸钠)、成员2、II型钠依赖性磷酸盐转运蛋白3b);
(7)Sema 5b(FLJ10372、KIAA1445、Mm.42015、SEMA5B、SEMAG、脑信号蛋白5b Hlog、sema结构域、七个血小板反应蛋白重复序列(1型和类1型)、跨膜结构域(TM)和短细胞质结构域、(脑信号蛋白)5B);
(8)PSCA hlg(2700050C12Rik、C530008O16Rik、RIKEN cDNA 2700050C12、RIKEN cDNA 2700050C12基因);
(9)ETBR(内皮缩血管肽B型受体);
(10)MSG783(RNF124、假拟蛋白FLJ20315);
(11)STEAP2(HGNC_8639、IPCA-1、PCANAP1、STAMP1、STEAP2、STMP、前列腺癌相关基因1、前列腺癌相关蛋白1、六次跨膜的前列腺上皮抗原2、六次跨膜的前列腺蛋白);
(12)TrpM4(BR22450、FLJ20041、TRPM4、TRPM4B、瞬时型受体电位阳离子通道、亚家族M、成员4);
(13)CRIPTO(CR、CR1、CRGF、CRIPTO、TDGF1、畸胎癌衍生的生长因子);
(14)CD21(CR2(补体受体2)或C3DR(C3d/爱泼斯坦-巴尔病毒受体)或Hs 73792);
(15)CD79b(CD79B、CD79β、IGb(免疫球蛋白相关β)、B29);
(16)FcRH2(IFGP4、IRTA4、SPAP1A(含有SH2结构域的磷酸酶锚定蛋白1a)、SPAP1B、SPAP1C);
(17)HER2;
(18)NCA;
(19)MDP;
(20)IL20Rα;
(21)短蛋白聚糖;
(22)EphB2R;
(23)ASLG659;
(24)PSCA;
(25)GEDA;
(26)BAFF-R(B细胞活化因子受体、BLyS受体3、BR3);
(27)CD22(B细胞受体CD22-B同种型);
(28)CD79a(CD79A、CD79α、免疫球蛋白相关α);
(29)CXCR5(伯基特淋巴瘤受体1);
(30)HLA-DOB(MHC II类分子的β亚基(Ia抗原));
(31)P2X5(嘌呤能受体P2X配体门控离子通道5);
(32)CD72(B细胞分化抗原CD72、Lyb-2);
(33)LY64(淋巴细胞抗原64(RP105)、富含亮氨酸的重复序列(LRR)家族的I型膜蛋白);
(34)FcRH1(Fc受体样蛋白1);
(35)FcRH5(IRTA2,免疫球蛋白超家族受体易位相关2);
(36)TENB2(推定跨膜蛋白聚糖);和
(37)PMEL17(银同源物;SILV;D12S53E;PMEL17;SI;SIL);
(38)TMEFF1(具有EGF样结构域和两个卵泡抑素样结构域的跨膜蛋白1;脑肿瘤抑癌蛋白-1);
(39)GDNF-Ra1(GDNF家族受体α1;GFRA1;GDNFR;GDNFRA;RETL1;TRNR1;RET1L;GDNFR-α1;GFR-ALPHA-1);
(40)Ly6E(淋巴细胞抗原6复合物,基因座E;Ly67、RIG-E、SCA-2、TSA-1);
(41)TMEM46(shisa同源物2(非洲爪蟾);SHISA2);
(42)Ly6G6D(淋巴细胞抗原6复合物,基因座G6D;Ly6-D、MEGT1);
(43)LGR5(富含亮氨酸重复序列的G蛋白偶联受体5;GPR49、GPR67);
(44)RET(ret原癌基因;MEN2A;HSCR1;MEN2B;MTC1;PTC;CDHF12;Hs.168114;RET51;RET-ELE1);
(45)LY6K(淋巴细胞抗原6复合物,基因座K;LY6K;HSJ001348;FLJ35226);
(46)GPR19(G蛋白偶联的受体19;Mm.4787);
(47)GPR54(KISS1受体;KISS1R;GPR54;HOT7T175;AXOR12);
(48)ASPHD1(含天冬氨酸β羟化酶结构域的1;LOC253982);
(49)酪氨酸酶(TYR;OCAIA;OCA1A;酪氨酸酶;SHEP3);
(50)TMEM118(环指蛋白,跨膜2;RNFT2;FLJ14627);
(51)GPR172A(G蛋白偶联的受体172A;GPCR41;FLJ11856;D15Ertd747e);
(52)CD33;以及
(53)CLL-1;
D为选自以下结构的蒽环类衍生物:
其中波浪线表示与L的附接;
L为选自以下的接头:–CH2O–、–CH2N(R)–、-N(R)-、-N(R)(C1-C12亚烷基)-、-N(R)(C2-C8亚烯基)-、-N(R)(C2-C8亚炔基)-、-N(R)(CH2CH2O)n-以及以下结构:
其中波浪线表示与D和Z的附接;并且
Z为选自以下的任选间隔物:-CH2C(O)-、-CH2C(O)NR(C1-C12亚烷基)-以及以下结构:
R为H、C1-C12烷基或C6-C20芳基;
Z1选自-(C1-C12亚烷基)-、-(C2-C8亚烯基)-、-(C2-C8亚炔基)-以及-(CH2CH2O)n-,
m为0或1;
n为1至6;并且
p为1至8的整数。
表2抗体-药物缀合物(ADC)
DAR=药物/抗体比平均值
A118C(EU编号)=A121C(顺序编号)=A114C(Kabat编号)
野生型(“WT”),半胱氨酸工程化的突变抗体(“thio”),轻链(“LC”),重链(“HC”),6-马来酰亚氨基己酰基(“MC”),马来酰亚氨基丙酰基(“MP”),缬氨酸-瓜氨酸(“val-cit”或“vc”),丙氨酸-苯丙氨酸(“ala-phe”),对氨基苄基(“PAB”)和对氨基苄氧基羰基(“PABC”)。
表3不可裂解的、非二硫化物比较物ADC:
体外细胞增殖测定
通常,通过以下方式测量抗体-药物缀合物(ADC)的细胞毒性或细胞抑制活性:使具有受体蛋白例如HER2的哺乳动物细胞暴露于细胞培养基中的ADC的抗体;将细胞培养约6小时至约5天的时期;并且测量细胞活力。基于细胞的体外测定用于测量本发明的ADC的活力(增殖)、细胞毒性和细胞凋亡诱导(半胱天东酶活化)。
通过细胞增殖测定来测量抗体-药物缀合物(ADC)的体外效力(实施例4)。本发明的ADC在抑制肿瘤细胞增殖方面示出惊人和不可预料的效力。ADC的效力与细胞的靶抗原表达相关。测试的缀合物能够结合表达在细胞表面上的特异性抗原并且在体外引起那些细胞的死亡。
发光细胞活力测定为商业上可获得的(Promega公司,Madison,WI),基于鞘翅目(Coleoptera)荧光素酶的重组表达的均相测定方法(US 5583024;US5674713;US5700670)。此细胞增殖测定基于对存在的ATP(一种代谢活性细胞的指示物)的定量来确定培养物中存活细胞的数量(Crouch等(1993)J.Immunol.Meth.160:81-88;US 6602677)。测定在96孔板中进行,使其易于自动化高通量筛选(HTS)(Cree等(1995)AntiCancer Drugs 6:398-404)。均相测定操作涉及将单一试剂(试剂)直接添加至在补充有血清的培养基中培养的细胞中。不需要细胞洗涤、去除培养基和多个移液步骤。在添加试剂并且混合之后,系统用10分钟在384孔形式下检测少至15个细胞/孔。可以用ADC连续处理细胞,或可以对所述细胞进行处理并且与ADC分离。通常,短暂处理(即3小时)的细胞示出与连续处理的细胞相同的效力。
均一的“添加-混合-测量”形式引起细胞裂解并且产生与存在的ATP量成正比的发光信号。ATP的量直接与培养物中存在的细胞数量成正比。测定产生由荧光素酶反应产生的“辉光型”发光信号,根据细胞类型和所使用的培养基,其具有通常大于五小时的半衰期。以相对发光单位(RLU)来反应存活细胞。通过重组荧火虫荧光素酶与伴随的ATP至AMP转化和光子产生来对底物甲虫荧光素进行氧化性脱羧。
基于细胞的体外测定用于测量本发明的ADC的活力(增殖)、细胞毒性和细胞凋亡诱导(半胱天东酶活化)。通常,通过以下方式测量抗体-药物缀合物(ADC)的细胞毒性或细胞抑制活性:使表达抗原诸如Her2或MUC16多肽的哺乳动物细胞暴露于细胞培养基中的ADC;将细胞培养约6小时至约5天的时期;并且测量细胞活力。有用于抗MUC16 ADC的细胞增殖测定的哺乳动物细胞包括:(1)MUC16多肽表达细胞系OVCAR-3;(2)被工程化成稳定表达其细胞表面上的MUC16的一部分的PC3衍生的细胞系(PC3/MUC16);(3)不表达MUC16多肽的亲本PC3细胞系;和(4)不表达MUC16多肽但携带用于驱动外源性MUC16表达的载体的PC3细胞系(PC3/neo)。
图1示出在5天时SK-BR-3体外细胞活力对Thio Hu抗Her2 7C2 HC A118C-(LD-57)114、Thio Hu抗Her2 7C2 LC K149C-(LD-57)109和Thio Hu抗CD33 15G15.3 LC K149C-(LD-57)110的浓度(μg/ml)的曲线图中的抗体-药物缀合物的功效。Her2抗原高度表达在SK-BR-3细胞中。抗Her2 ADC 114和抗Her2 ADC 109示出线性的、剂量响应的细胞杀伤活性。轻链K149C突变ADC 109示出与重链A118C突变ADC 114相比相同或稍微更有效的细胞杀伤活性。对照、脱靶的抗CD33 ADC 110示出较低的活性。
图2示出在5天时SK-BR-3体外细胞活力与Thio Hu抗Her2 7C2 LC K149C-(LD-59)116、Thio Hu抗Her2 7C2 LC K149C-(LD-57)109和Thio Hu抗CD33 15G15.3 LC K149C-(LD-59)115的浓度(μg/ml)的曲线图中的抗体-药物缀合物的功效。抗Her2 ADC 116和抗Her2 ADC 109示出线性的、剂量响应的细胞杀伤活性。具有未取代的、位阻较小的乙基二硫化物接头109的抗体-药物缀合物109示出与甲基取代的、较大位阻的二硫化物接头ADC-116相比相同或稍微更有效的细胞杀伤活性。
图6示出在5天时BJAB.luc体外细胞活力对Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-57)121、Thio Hu抗CD22 10F4v3 LC K149C-(LD-57)120、Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-59)123、Thio Hu抗CD22 10F4v3 LC K149C-(LD-59)122、Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-58)125、Thio Hu抗CD22 10F4v3 LC K149C-(LD-58)124、Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-60)127以及Thio Hu抗CD22 10F4v3 LC K149C-(LD-60)126的浓度(μg/ml)的曲线图中的抗体-药物缀合物的功效。
图7示出在5天时WSU-DLCL2体外细胞活力对Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-57)121、Thio Hu抗CD22 10F4v3 LC K149C-(LD-57)120、Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-59)123、Thio Hu抗CD22 10F4v3 LC K149C-(LD-59)122、Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-58)125、Thio Hu抗CD22 10F4v3 LC K149C-(LD-58)124、Thio Hu抗Napi3b 10H1.11.4B LC K149C-(LD-60)127以及Thio Hu抗CD22 10F4v3 LC K149C-(LD-60)126的浓度(μg/ml)的曲线图中的抗体-药物缀合物的功效。
体内功效
可以通过小鼠中的肿瘤异种移植物研究来测量本发明的抗体-药物缀合物(ADC)的体内功效(实施例22)。通过小鼠中的肿瘤生长抑制来测量抗体-药物缀合物(ADC)的体内功效(实施例21)。本发明的ADC在抑制肿瘤生长方面示出惊人和不可预料的效力。ADC的功效与肿瘤细胞的靶抗原表达相关。
通过将癌细胞的同种移植物或异种移植物植入在啮齿动物中并且用ADC处理肿瘤来体内测量抗体-药物缀合物的功效。取决于细胞系、ADC与存在于癌细胞上的受体的抗体结合特异性、给药方案和其他因素来预期可变结果。使用表达中等水平至高水平肿瘤相关的抗原诸如Her2、MUC16和CD33的转基因外植体小鼠模型来测量ADC的体内功效。用ADC治疗受试者一次并且在3-6周内进行监测,以便测量肿瘤倍增时间、对数细胞杀伤和肿瘤萎缩。进行后续的剂量-响应和多剂量实验。
例如,可以通过高表达HER2转基因外植体小鼠模型来测量本发明的抗HER2ADC的体内功效(Phillips等(2008)Cancer Res.68:9280-90)。同种移植物由Fo5mmtv转基因小鼠增殖,所述小鼠不响应于或较差地响应于疗法。用特定剂量水平(mg/kg)的ADC和安慰剂缓冲液对照(媒介物)治疗受试者一次并且在两周或更多的时间内进行监测,以便测量肿瘤倍增时间、对数细胞杀伤和肿瘤萎缩。
图3示出在MMTV-HER2 Fo5转基因乳腺肿瘤随时间体内拟合的肿瘤体积变化的曲线图中的抗体-药物缀合物的功效,所述MMTV-HER2 Fo5转基因乳腺肿瘤在用以下物质静脉内给药一次之后被接种到CRL nu/nu小鼠的乳腺脂肪垫中:媒介物:组氨酸缓冲液#8:20mM组氨酸乙酸盐(pH 5.5)、240mM蔗糖、0.02%PS 20、Thio Hu抗Her2 7C2 HC A118C-(LD-51)107和Thio Hu抗Her2 7C2 LC K149C-(LD-51)108。在第0天以3mg/kg静脉内给药ADC一次。抗体-药物缀合物107和抗体-药物缀合物108示出肿瘤生长抑制,而轻链K149C突变ADC 108示出比重链A118C突变ADC 107更高的功效。
图4示出在scid米色小鼠中的KPL4肿瘤模型中,在体内拟合的随时间的肿瘤体积变化的曲线图中的抗体-药物缀合物的功效,所述肿瘤以0.2ml的体积接种在胸部的乳腺脂肪垫中。当肿瘤达到平均肿瘤体积为100-250mm3时,将它们分成每组8-10个小鼠的9个组。在第0天通过尾静脉静脉内施用单一治疗,如下:(01)媒介物:组氨酸缓冲液#8:20mM组氨酸乙酸盐(pH 5.5)、240mM蔗糖、0.02%PS 20,(02)Thio Hu抗Her2 7C2 LC K149C-(乙基马来酰亚胺)0.3mg/kg 138,(03)Thio Hu抗Her2 7C2 LC K149C-(乙基马来酰亚胺)1mg/kg 138,(04)Thio Hu抗Her2 7C2 LC K149C-(乙基马来酰亚胺)3mg/kg 138,(05)Thio Hu抗Her2 7C2 LC K149C-(LD-57)0.3mg/kg 109,(06)Thio Hu抗Her2 7C2 LC K149C-(LD-57)1mg/kg 109,(07)Thio Hu抗Her2 7C2 LC K149C-(LD-57)3mg/kg 109,(08)Thio Hu抗CD33 15G15.3 LC K149C-(乙基马来酰亚胺)3mg/kg 139以及(09)Thio Hu抗CD33 15G15.3 LC K149C-(LD-57)3mg/kg 110。
抗HER2 7C2抗体-药物缀合物138和抗HER2 7C2抗体-药物缀合物109示出对肿瘤生长的剂量依赖性作用。非特异性抗CD33抗体-药物缀合物139和抗CD33抗体-药物缀合物110示出较小或没有肿瘤生长抑制。
图5示出在MMTV-HER2 Fo5转基因乳腺肿瘤随时间体内拟合的肿瘤体积变化的曲线图中的抗体-药物缀合物的功效,所述MMTV-HER2 Fo5转基因乳腺肿瘤在用以下物质静脉内给药一次之后被接种到CRL nu/nu小鼠的乳腺脂肪垫中:(01)媒介物:组氨酸缓冲液#8:20mM组氨酸乙酸盐(pH 5.5)、240mM蔗糖、0.02%PS 20,(02)Thio Hu抗Her2 7C2 LC K149C-(LD-57)1mg/kg 109,(03)Thio Hu抗Her2 7C2 LC K149C-(LD-57)3mg/kg 109,(04)Thio Hu抗CD33 15G15.3 LC K149C-(LD-57)1mg/kg 110,(05)Thio Hu抗CD33 15G15.3 LC K149C-(LD-57)3mg/kg 110,(06)曲妥珠单抗emtansine 3mg/kg 141以及(07)曲妥珠单抗emtansine 10mg/kg 141。
比较物ADC曲妥珠单抗emtansine(曲妥珠单抗-MCC-DM1(T-DM1)141位抗体-药物缀合物(CAS登记号139504-50-0;Phillips G.等(2008)Cancer Res.68:9280-90),并且具有以下结构:
抗HER2 7C2抗体-药物缀合物109示出对肿瘤生长的剂量依赖性作用。非特异性抗CD33抗体-药物缀合物110在1mg/kg下示出较小的肿瘤生长抑制并且在3mg/kg下示出中等的肿瘤生长抑制。抗HER2 7C2抗体-药物缀合物109示出在等效剂量(3mg/kg)或在较高的10mg/kg剂量下比抗HER2 4D5曲妥珠单抗emtansine 141更高的功效(Phillips G.等(2008)Cancer Res.68:9280-90)。
药物制剂
本发明的治疗性抗体-药物缀合物(ADC)的药物制剂通常被制备用于使用药学上可接受的肠胃外媒介物并且以单位可注射剂型进行肠胃外施用,即快速推注、静脉内、肿瘤内注射。具有所需纯度的抗体-药物缀合物(ADC)任选与药学上可接受的稀释剂、载体、赋形剂或稳定剂混合(Remington's Pharmaceutical Sciences第16版,Osol,A.编著),以冻干制剂或水溶液的形式。
抗体-药物缀合物治疗方法
想到本发明的抗体-药物缀合物(ADC)可用于治疗例如其特征在于肿瘤抗原的过表达的各种疾病或病症。示例性病状或过度增殖性病症包括良性或恶性实体瘤和造血病症诸如白血病和淋巴恶性肿瘤。其他病症包括神经元的、神经胶质的、星形胶质的、下丘脑的、腺的、巨噬细胞的、上皮的、基质的、囊胚的、炎症性的、血管生成的和免疫学的包括自身免疫的病症。
可以通过任何适合于待治疗的病状的途径来施用本发明的抗体-药物缀合物(ADC)。ADC将通常肠胃外地施用,即输注、皮下、肌肉内、静脉内、皮内、鞘内和硬膜外。
通常,待治疗的疾病或病症为过度增殖性疾病诸如癌症。本文中待治疗的癌症的实例包括,但不限于癌瘤、淋巴瘤、母细胞瘤、肉瘤和白血病或淋巴恶性肿瘤。此类癌症的更具体的实例包括鳞状细胞癌(例如,上皮鳞状细胞癌)、肺癌(包括小细胞肺癌、非小细胞肺癌、肺部腺癌和肺部鳞癌、腹膜癌、肝细胞癌、包括胃肠癌的胃癌(gastric cancer)或胃部癌(stomach cancer)、胰腺癌、成胶质细胞瘤、子宫颈癌、卵巢癌、肝癌、膀胱癌、肝细胞瘤、乳腺癌、结肠癌、直肠癌、结直肠癌、子宫内膜癌或子宫癌、唾液腺癌、肾癌(kidney cancer)或肾脏癌(renal cancer)、前列腺癌、外阴癌、甲状腺癌、肝癌、肛口癌、阴茎癌以及头颈癌。
可以使用ADC化合物治疗的自身免疫疾病包括风湿性病症(诸如例如类风湿性关节炎、斯耶格伦氏综合征(syndrome)、硬皮病、狼疮诸如系统性红斑狼疮(SLE)和狼疮肾炎、多肌炎/皮肌炎、冷球蛋白血症、抗磷脂抗体综合征和牛皮癣性关节炎)、骨关节炎、自身免疫肠胃和肝脏病症(诸如例如炎症性肠病(例如,溃疡性结肠炎和克罗恩氏病)、自身免疫胃炎和恶性贫血、自身免疫肝炎、原发性胆汁性肝硬化、原发性硬化性胆管炎和乳糜泻)、脉管炎(诸如例如ANCA相关的脉管炎,包括丘-施二氏血管炎(Churg-Strauss vasculitis)、韦格纳肉芽肿(Wegener's granulomatosis)和多动脉炎)、自身免疫神经病症(诸如例如多发性硬化、眼阵挛-肌阵挛综合征、重症肌无力、视神经脊髓炎、帕金森氏病、阿尔茨海默氏病和自身免疫多发性神经病)、肾病症(诸如例如肾小球肾炎、古德帕斯丘综合征和贝格尔氏病)、自身免疫皮肤病症(诸如例如,牛皮癣、荨麻疹、麻疹、寻常性天疱疮、大疱性类天疱疮和皮肤红斑狼疮)、血液学病症(诸如例如血小板减少性紫癜、血栓形成性血小板减少性紫癜、输血后紫癜和自身免疫溶血性贫血)、动脉粥样硬化、葡萄膜炎、自身免疫听力疾病(诸如例如内耳疾病和听力损失)、贝切特氏病、雷诺氏综合征、器官移植和自身免疫内分泌病症(诸如例如,糖尿病相关的自身免疫疾病诸如胰岛素依赖性糖尿病(IDDM)、阿狄森病和自身免疫甲状腺疾病(例如,格雷夫斯病和甲状腺炎))。更优选的此类疾病包括,例如类风湿性关节炎、溃疡性结肠炎、ANCA相关的脉管炎、狼疮、多发性硬化、斯耶格伦氏综合征、格雷夫斯病、IDDM、恶性贫血、甲状腺炎和肾小球肾炎。
为了预防或治疗疾病,ADC的适当剂量将取决于如上所定义的待治疗疾病的类型、疾病的严重性和病程、分子是否出于预防或治疗的目的施用、先前疗法、患者的临床史和对抗体的反应以及主治医师的判断。一次性或经过一系列治疗将分子合适地施用至患者。取决于疾病的类型和严重性,约1μg/kg至15mg/kg(例如0.1-20mg/kg)的分子为用于施用至患者的初始候选剂量,无论例如通过一个或多个分开的施用或通过连续输注。通常的日剂量范围可以为约1μg/kg至100mg/kg或更多,这取决于上面提到的因素。待施用至患者的ADC的示例性剂量在约0.1至约10毫克/患者重量千克数的范围内。
制品
在本发明的另一个实施方案中,提供含有用于治疗以上所述的病症的材料的制品或“试剂盒”。制品包括容器和在容器上或与容器相关的标签或包装插页。合适的容器包括例如瓶子、小瓶、注射器、泡罩包装等。容器可以由诸如玻璃或塑料的各种材料形成。容器装有有效于治疗病状的抗体-药物缀合物(ADC)组合物,并且可以具有无菌入口(例如,容器可为具有皮下注射针头可刺穿的塞子的静脉内溶液袋或小瓶)。组合物中的至少一种活性剂为ADC。标签或包装插页指示组合物用于治疗所选的病状,诸如癌症。或者或另外,制品还可以包括第二(或第三)容器,所述容器包含药学上可接受的缓冲液,诸如抑菌注射用水(BWFI)、磷酸盐缓冲盐水、林格氏(Ringer's)溶液和葡萄糖溶液。它还可以包括在商业和使用者看来所需的其他材料,包括其他缓冲液、稀释剂、过滤器、针头和注射器。
实施例
实施例1蒽环类二硫化物、接头-药物(LD)中间体(表1)的合成。
LD-51:(2S,4S)-4-[[(1S,3R,4aS,9S,9aR,10aS)-9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基]氧基]-2,5,12-三羟基-7-甲氧基-6,11-二氧代-N-[2-(2-吡啶基二硫烷基)乙基]-3,4-二氢-1H-并四苯-2-甲酰胺
根据US 8389697的实施例3,向WO 1998/02446和US 8470984的实施例1中报道所制备的PNU-159682(15.3mg,0.02038mmol)在3ml的甲醇和2ml的H2O中的溶液中添加NaIO4(5.1mg,0.0238mmol)在1ml的H2O中的溶液。将反应混合物在室温搅拌3小时,直到不可检查到起始材料(TLC和HPLC分析)。_在减压下去除溶剂,并且粗红色固体(2S,4S)-2,5,12-三羟基-7-甲氧基-4-{[(1S,3R,4aS,9S,9aR,10aS)-9-甲氧基-1-甲基八氢-1H-吡喃并[4',3':4,5][1,3]噁唑并[2,3-c][1,4]噁嗪-3-基]氧基}-6,11-二氧代-1,2,3,4,6,11-六氢并四苯-2-羧酸51a无需进一步纯化用于下一步骤。MS(ESI):628[M+H]+。
在氩气气氛下,向粗中间体51a在无水二氯甲烷中的溶液中添加无水三乙胺、TBTU(O-(苯并三唑-1-基)-N,N,N′,N′-四甲基脲四氟硼酸盐,又称为:N,N,N′,N′-四甲基-O-(苯并三唑-1-基)脲四氟硼酸盐,CAS号125700-67-6,Sigma-Aldrich B-2903)和N-羟基琥珀酰亚胺,以便形成51a的中间体NHS酯。或者,可以使用其他偶联试剂诸如DCC或EDC。在一小时之后,添加2-(吡啶-2-基二硫烷基)乙胺盐酸盐(CAS号106139-15-5)。将反应混合物在室温搅拌30min,直到起始材料消失(HPLC-MS分析)。在真空下蒸发溶剂并且然后通过在硅胶上进行快速柱色谱法来纯化,得到51。MS(ESI):796.88[M+H]+。
LD-52:N-[2-[[2-[(2S,4S)-4-[[(1S,3R,4aS,9S,9aR,10aS)-9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基]氧基]-2,5,12-三羟基-7-甲氧基-6,11-二氧代-3,4-二氢-1H-并四苯-2-基]-2-氧代-乙氧基]羰基-甲基-氨基]乙基]-N-甲基-氨基甲酸2-(2-吡啶基二硫烷基)乙酯的合成
2-[(2S,4S)-4-[[(1S,3R,4aS,9S,9aR,10aS)-9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基]氧基]-2,5,12-三羟基-7-甲氧基-6,11-二氧代-3,4-二氢-1H-并四苯-2-基]-2-氧代-乙基]N-甲基-N-[2-(甲基氨基)乙基]氨基甲酸酯52a根据PNU-159682,使用三光气(Cl3CO)2C=O和N1,N2-二甲基乙-1,2-二胺来制备。
在室温下,将1,2-二(吡啶-2-基)二硫烷和2-巯基乙醇在吡啶和甲醇中反应,得到2-(吡啶-2-基二硫烷基)乙醇。用4-硝基苯基羰氯化物在三乙胺和乙腈中进行酰化得到4-硝基苯基2-(吡啶-2-基二硫烷基)乙基碳酸酯52b。将中间体52a与52b反应以便形成LD-52。
LD-53:[2-甲基-2-(2-吡啶基二硫烷基)丙基]N-[2-[[2-[(2S,4S)-4-[[(1S,3R,4aS,9S,9aR,10aS)-9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基]氧基]-2,5,12-三羟基-7-甲氧基-6,11-二氧代-3,4-二氢-1H-并四苯-2-基]-2-氧代-乙氧基]羰基-甲基-氨基]乙基]-N-甲基-氨基甲酸酯的合成
根据用于LD-52的程序,将中间体52a与2-甲基-2-(吡啶-2-基二硫烷基)丙基4-硝基苯基碳酸酯进行酰化,得到LD-53。
LD-54:(2S,4S)-4-[[(1S,3R,4aS,9S,9aR,10aS)-9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基]氧基]-2,5,12-三羟基-7-甲氧基-N-[2-甲基-2-(2-吡啶基二硫烷基)丙基]-6,11-二氧代-3,4-二氢-1H-并四苯-2-甲酰胺的合成
根据用于LD-51的程序,在氩气气氛下将无水二氯甲烷中的粗中间体51a与无水三乙胺、TBTU和2-甲基-2-(吡啶-2-基二硫烷基)丙-1-胺反应,得到LD-54。
LD-55:(2S,4S)-4-[[(1S,3R,4aS,9S,9aR,10aS)-9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基]氧基]-2,5,12-三羟基-7-甲氧基-N-[2-甲基-2-[(5-硝基-2-吡啶基)二硫烷基]丙基]-6,11-二氧代-3,4-二氢-1H-并四苯-2-甲酰胺的合成
根据用于LD-60的程序,将5-硝基吡啶-2-硫醇60a添加至LD-54在DMF中的溶液中,得到LD-55。
LD-56:N-甲基-N-[2-[甲基-[2-氧代-2-[2,5,12-三羟基-7-甲氧基-4-[(9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基)氧基]-6,11-二氧代-3,4-二氢-1H-并四苯-2-基]乙氧基]羰基-氨基]乙基]氨基甲酸2-(2-吡啶基二硫烷基)丙酯的合成
根据用于LD-52的程序,将中间体52a与4-硝基苯基2-(吡啶-2-基二硫烷基)丙基碳酸酯进行酰化,得到LD-56。
LD-57:(2S,4S)-4-[[(1S,3R,4aS,9S,9aR,10aS)-9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基]氧基]-2,5,12-三羟基-7-甲氧基-N-[2-[(5-硝基-2-吡啶基)二硫烷基]乙基]-6,11-二氧代-3,4-二氢-1H-并四苯-2-甲酰胺的合成
向1,2-二(5-硝基吡啶-2-基)二硫烷57a(1.0g,3.22mmol)在无水DMF/MeOH(25mL/25mL)中的混合物中添加HOAc(0.1mL),接着添加2-氨基乙硫醇盐酸盐57b(183mg,1.61mmol)。在室温下将反应混合物搅拌过夜之后,在真空下对其进行浓缩以去除溶剂,并且用DCM(30mL×4)洗涤残余物,得到呈淡黄色固体的2-((5-硝基吡啶-2-基)二硫烷基)乙胺盐酸盐57c(300mg,69.6%)。1H NMR(400MHz,DMSO-d6)δ9.28(d,J=2.4Hz,1H),8.56(dd,J=8.8,2.4Hz,1H),8.24(s,4H),8.03(d,J=8.8Hz,1H),3.15-3.13(m,2H),3.08-3.06(m,2H)
如上制备中间体51a。或者,向PNU-159682(50mg,0.078mmol)在MeOH/H2O(5mL/5mL)中的悬浮液中添加NaIO4(17mg,0.078mmol)在H2O(2mL)中的溶液。在室温下,在黑暗中将非均质的反应混合物剧烈搅拌4h。然后在真空下浓缩混合物,并且通过在硅胶上进行柱色谱法来纯化残余物(DCM/MeOH=100/1至10/1),得到呈紫色固体的中间体51a(40mg,80%)。
向中间体51a(40mg,0.064mmol)在无水DCM(5mL)中的溶液中添加DIEA(41mg,0.32mmol)和HATU(为O-(7-氮杂苯并三唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸盐,73mg,0.19mmol)。在室温下将混合物搅拌0.5h之后,添加中间体57c(51mg,0.19mmol)。在室温下将所得到的混合物再搅拌4h。通过制备型TLC(DCM/MeOH=20/1)来纯化混合物,得到呈紫色固体的LD-57(18mg,33.3%)。LCMS(ESI):RT=0.890min,M+H+=841.2.,方法=5-95AB/1.5min。1H NMR(400MHz,CDCl3)δ13.94(s,1H),13.30(s,1H),9.33(d,J=2.0Hz,1H),8.40(dd,J=9.2,2.4Hz,1H),8.22(t,J=6.0Hz,1H),8.04(J=7.6Hz,1H),7.80-7.76(m,2H),7.40(d,J=8.8Hz,1H),5.52(d,J=5.6Hz,1H),5.34(s,1H),5.30(s,1H),5.22(s,1H),4.69(d,J=1.6Hz,1H),4.47(d,J=0.8Hz,1H),4.10(s,3H),4.07-4.01(m,2H),3.91(t,J=9.6Hz,1H),3.74(s,2H),3.70-3.55(m,4H),3.45(s,3H),3.41-3.38(m,1H),3.25(d,J=2.4Hz,2H),3.05(t,J=6.0Hz,2H),2.83-2.80(m,1H),2.73-2.68(m,1H),2.52-2.48(m,1H),2.41-2.36(m,1H),2.05-1.98(s,1H),1.81-1.75(m,1H),1.36(d,J=6.0Hz,3H)
LD-58:N-[2-[[2-[(2S,4S)-4-[[(1S,3R,4aS,9S,9aR,10aS)-9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基]氧基]-2,5,12-三羟基-7-甲氧基-6,11-二氧代-3,4-二氢-1H-并四苯-2-基]-2-氧代-乙氧基]羰基-甲基-氨基]乙基]-N-甲基-氨基甲酸2-[(5-硝基-2-吡啶基)二硫烷基]乙酯的合成
在室温下,将1,2-二(5-硝基吡啶-2-基)二硫烷57a(9.6g,30.97mmol)和2-巯基乙醇(1.21g,15.49mmol)在无水DCM/CH3OH(250mL/250mL)中的溶液在N2下搅拌24h。在真空下浓缩混合物之后,接着用DCM(300mL)稀释残余物。添加MnO2(10g)并且在室温下将混合物再搅拌0.5h。通过在硅胶上进行柱色谱法来纯化混合物(DCM/MeOH=100/1至100/1),得到呈棕色油状物的2-((5-硝基吡啶-2-基)二硫烷基)乙醇58a(2.2g,61.1%)。1H NMR(400MHz,CDCl3)δ9.33(d,J=2.8Hz,1H),8.38-8.35(dd,J=9.2,2.8Hz,1H),7.67(d,J=9.2Hz,1H),4.10(t,J=7.2Hz,1H),3.81-3.76(q,2H),3.01(t,J=5.2Hz,2H)。
向58a(500mg,2.15mmol)在无水DMF(10mL)中的溶液中添加DIEA(834mg,6.45mmol),接着添加PNP碳酸酯(二(4-硝基苯基)碳酸酯,1.31g,4.31mmol)。在室温下将反应溶液搅拌4h,并且通过制备型HPLC(FA)来纯化混合物,得到呈浅棕色油状物的4-硝基苯基2-((5-硝基吡啶-2-基)二硫烷基)乙基碳酸酯58b(270mg,33.1%)。1H NMR(400MHz,CDCl3)δ9.30(d,J=2.4Hz,1H),8.43-8.40(dd,J=8.8,2.4Hz,1H),8.30-8.28(m,2H),7.87(d,J=8.8Hz,1H),7.39-7.37(m,2H),4.56(t,J=6.4Hz,2H),3.21(t,J=6.4Hz,2H)。
[2-[(2S,4S)-4-[[(1S,3R,4aS,9S,9aR,10aS)-9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基]氧基]-2,5,12-三羟基-7-甲氧基-6,11-二氧代-3,4-二氢-1H-并四苯-2-基]-2-氧代-乙基]N-甲基-N-[2-(甲基氨基)乙基]氨基甲酸酯52a根据PNU通过对Bpoc保护的58c进行去保护来制备,其中Bpoc为2-(对联苯基)-2-丙基氧基羰基。向58c(25mg,0.025mmol)(其中胺被2-(4-联苯基)-丙-2-基4′-甲氧基羰基苯基碳酸酯(BPOC试剂,Sigma-Aldrich,CAS登记号31140-37-1)保护)在无水DCM(4mL)中的溶液中添加二氯乙酸(Cl2CHCOOH,65mg,0.50mmol)在无水DCM(1mL)中的溶液。在室温下将反应溶液搅拌2h。在真空下浓缩溶液,并且用甲基叔丁基醚(MTBE,10mL×2)洗涤残余物,得到呈红色固体的52a(25mg,100%)。
向52a(25mg,0.025mmol)和4-硝基苯基2-((5-硝基吡啶-2-基)二硫烷基)乙基碳酸酯58b(30mg,0.075mmol)在无水DMF(3mL)中的溶液中添加TEA(三乙胺,25mg,0.25mmol)。在室温下将溶液搅拌过夜之后,在真空下对其进行浓缩并且通过制备型TLC(DCM/MeOH=20/1)来纯化残余物,得到呈红色固体的LD-58(12mg,48.0%)。LCMS(ESI):RT=0.921min,M+Na+=1036.2。1H NMR(400MHz,CDCl3)δ13.88(s,1H),13.24(d,J=4.0Hz,1H),9.26-9.25(m,1H),8.40(d,J=6.0Hz,1H),8.01(d,J=7.6Hz,1H),7.89(d,J=8.8Hz,1H),7.77(t,J=8.0Hz,1H),7.38(d,J=8.4Hz,1H),5.47(s,1H),5.30-5.23(m,2H),5.15-5.11(m,1H),4.92-4.87(m,1H),4.70(s,1H),4.47(s,1H),4.35(s,2H),4.10-4.03(m,4H),3.92-3.87(m,1H),3.59-3.40(m,8H),3.25-3.22(m,1H),3.12-3.10(m,2H),3.04(s,2H),3.98(t,J=8.8Hz,4H),2.84-2.82(m,2H),2.60(d,J=14.8Hz,1H),2.07-1.98(m,1H),1.76-1.72(m,1H),1.41(d,J=5.6Hz,3H)。
LD-59:2,5,12-三羟基-7-甲氧基-4-[(9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基)氧基]-N-[2-[(5-硝基-2-吡啶基)二硫烷基]丙基]-6,11-二氧代-3,4-二氢-1H-并四苯-2-甲酰胺的合成
向1-氨基丙-2-醇59a(10g,133mmol)在MeOH(360mL)和H2O(40mL)中的搅拌溶液中添加Boc2O(37g,169mmol)。在室温下将反应混合物搅拌5h之后,对其进行浓缩并且通过色谱法来纯化(EtOAc/PE=10%-50%),得到呈无色油状物的2-羟基丙基氨基甲酸叔丁酯59b(19.8g,产率:85%)。
向59b(10g,57mmol)和Et3N(17g,171mmol)在DCM(130mL)中的搅拌溶液中添加MsCl(甲磺酰氯,13g,114mmol)的溶液。在室温下将反应混合物搅拌4h之后,用冰水(200mL x 3)和盐水(200mL)对其进行洗涤。浓缩有机层,得到呈红色油状物的1-(叔丁氧基羰基氨基)丙烷-2-基甲磺酸酯59c(12g,产率:83%)。
向59c(6g,23.7mmol)在丙酮(70mL)中的搅拌溶液中添加硫代乙酸钾(硫代乙酸钾,5.4g,47.3mmol)在H2O(100mL)中的溶液。在60℃下将反应混合物搅拌12h。浓缩混合物并且用DCM(200ml x 2)萃取。浓缩合并有机层并且通过色谱法来纯化,得到呈红色固体的S-1-(叔丁氧基羰基氨基)丙烷-2-基硫代乙酸酯59d(1.1g,产率:20%)。1H NMR(400MHz,CDCl3-d)δ1.30(d,J=7.09Hz,3H)1.44(s,9H)2.33(s,3H)3.16-3.42(m,2H)3.58-3.71(m,1H)
向59d(500mg,2.15mmol)在MeOH(5mL)中的搅拌溶液中逐滴添加HCl/MeOH(10mL)。在室温下将反应混合物搅拌3h之后,对其进行浓缩,得到直接用于下一步的1-氨基丙-2-硫醇盐酸盐59e。
向57a(1.33g,4.3mmol)在DCM(35mL)中的溶液中添加59e(273mg,2.15mmol)的溶液。在15℃下将混合物搅拌12h。将MnO2(374.1mg,4.3mmol)添加至混合物并且在15℃下搅拌10min。用DCM(100mL)和MeOH(30mL x 3)洗涤固体。浓缩溶液,得到呈黄色固体的2-((5-硝基吡啶-2-基)二硫烷基)丙-1-胺59f(300mg,57%)。LCMS(ESI):RT=0.546min,M+H+=245.7。
向中间体51a(25mg,0.040mmol)在无水DCM/DMF(5mL)中的溶液中添加DIEA(二异丙基乙胺,26mg,0.20mmol)和HATU(为O-(7-氮杂苯并三唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸盐,46mg,0.12mmol)。在室温下将混合物搅拌0.5h之后,添加59f(34mg,0.12mmol)。在室温下将所得到的混合物再搅拌4h。将混合物用DCM(30mL)稀释并且用盐水(15mL×3)洗涤。对DCM层进行干燥(Na2SO4),过滤并且浓缩。通过制备型TLC(DCM/MeOH=20/1)来纯化残余物,得到呈紫色固体的LD-59(7mg,20.6%)。LCMS(ESI):RT=0.783min,M+H+=855.2。1H NMR(400MHz,CDCl3)δ13.94(d,J=3.6Hz,1H),13.32(d,J=4.8Hz,1H),9.33(s,1H),8.63-8.47(m,1H),8.39-8.35(m,1H),8.04(d,J=7.6Hz,1H),7.78(J=8.0Hz,1H),7.74-7.71(dd,J=8.8,5.6Hz,1H),7.39(d,J=8.8Hz,1H),5.52(d,J=5.2Hz,1H),5.35(s,1H),5.27(d,J=4.8Hz,1H),4.68(d,J=4.4Hz,1H),4.46(d,J=8.0Hz,1H),4.10(s,3H),4.06(d,J=7.6Hz,1H),3.92(t,J=7.8Hz,2H),3.71-3.67(m,1H),3.59-3.55(m,2H),3.45(d,J=6.4Hz,3H),3.41-3.36(m,1H),3.28-3.22(m,3H),2.84-2.60(m,2H),2.53-2.37(m,2H),2.06-1.94(m,1H),1.81-1.77(m,1H),1.40-1.38(dd,J=6.4,2.4Hz,3H),1.35(t,J=6.0Hz,3H)
LD-60:[2-氧代-2-[2,5,12-三羟基-7-甲氧基-4-[(9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基)氧基]-6,11-二氧代-3,4-二氢-1H-并四苯-2-基]乙基]N-甲基-N-[2-[甲基-[2-[(5-硝基-2-吡啶基)二硫烷基]丙氧基羰基]氨基]乙基]氨基甲酸酯的合成
向N-甲基-N-[2-[甲基-[2-氧代-2-[2,5,12-三羟基-7-甲氧基-4-[(9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基)氧基]-6,11-二氧代-3,4-二氢-1H-并四苯-2-基]乙氧基]羰基-氨基]乙基]氨基甲酸2-(2-吡啶基二硫烷基)丙酯LD-56(10mg,10.17umol)在DMF(1mL)中的溶液中添加5-硝基吡啶-2-硫醇60a(15.89mg,101.72umol)在20℃下的溶液。在20℃下将反应混合物搅拌2h。用DCM(10mL)稀释反应混合物并且然后用水(5mL)、NaHCO3水溶液(5mL)和盐水(5mL)洗涤。对有机层进行干燥并且浓缩。通过制备型TLC(DCM:MeOH=25:1)来纯化残余物,得到呈红色固体的纯LD-60(7mg,66.94%)。LCMS:(10-80,CD,7.0min),3.782min,Ms=1028.2(M+1);1H NMR(400MHz,CDCl3)δ13.83(s,1H),13.19(s,1H),9.18(s,1H),8.31(d,1H,J=7.6Hz),7.97(d,1H,J=8.0Hz),7.86(d,1H,J=8.4Hz),7.73(t,1H,J=8.4Hz),7.33(d,1H,J=8.4Hz),5.41(s,1H),5.29-5.05(m,3H),4.89-4.75(m,1H),4.64(s,1H),4.40(s,1H),4.13(s,2H),4.09–3.80(m,6H),3.58–3.12(m,12H),3.05–2.85(m,7H),2.78–2.42(m,3H),2.12–1.85(m,2H),1.72–1.55(m,1H),1.38-1.25(m,6H)
LD-61:2,5,12-三羟基-7-甲氧基-4-[(9-甲氧基-1-甲基-3,4,4a,6,7,9,9a,10a-八氢-1H-吡喃并[1,2]噁唑并[3,4-b][1,4]噁嗪-3-基)氧基]-6,11-二氧代-N-[2-(2-吡啶基二硫烷基)丙基]-3,4-二氢-1H-并四苯-2-甲酰胺的合成
根据用于LD-51的程序,在氩气气氛下将无水二氯甲烷中的粗中间体51a与无水三乙胺、TBTU和2-(吡啶-2-基二硫烷基)丙-1-胺反应,得到LD-61。
LD-62:(2S,4S)-2,5,12-三羟基-7-甲氧基-4-(((1S,3R,4aS,9S,9aR,10aS)-9-甲氧基-1-甲基八氢-1H-吡喃并[4',3':4,5]噁唑并[2,3-c][1,4]噁嗪-3-基)氧基)-N-((R)-2-((5-硝基吡啶-2-基)二硫烷基)丙基)-6,11-二氧代-1,2,3,4,6,11-六氢并四苯-2-甲酰胺的合成
根据用于LD-59的程序,制备LD-62。
LD-63:(2S,4S)-2,5,12-三羟基-7-甲氧基-4-(((1S,3R,4aS,9S,9aR,10aS)-9-甲氧基-1-甲基八氢-1H-吡喃并[4',3':4,5]噁唑并[2,3-c][1,4]噁嗪-3-基)氧基)-N-((S)-2-((5-硝基吡啶-2-基)二硫烷基)丙基)-6,11-二氧代-1,2,3,4,6,11-六氢并四苯-2-甲酰胺的合成
根据用于LD-59的程序,制备LD-63。
实施例2通过还原和再氧化制备用于缀合的半胱氨酸工程化的抗体
在特定条件下,半胱氨酸工程化的抗体可被制成对与本发明的接头-药物中间体(诸如表1中的那些)缀合有反应性的,这通过用还原剂诸如DTT(Cleland试剂,二硫苏糖醇)或TCEP(三(2-羧乙基)膦盐酸盐;Getz等(1999)Anal.Biochem.第273卷:73-80;Soltec Ventures,Beverly,MA)在具有2mM EDTA的50mM Tris pH 7.5中,在37℃下处理3小时或在室温下处理过夜来实现。还原表达在CHO细胞中的全长、半胱氨酸工程化的单克隆抗体(THIOMABTM)(Gomez等(2010)Biotechnology and Bioeng.105(4):748-760;Gomez等(2010)Biotechnol.Prog.26:1438-1445),例如使用约50倍过量的DTT在室温下过夜来还原二硫化物键,所述二硫键可在新引入的半胱氨酸残基与存在于培养基中的半胱氨酸之间形成。稀释还原的THIOMABTM并且用10mM乙酸钠(pH 5)负载到HiTrap S柱上,并且用含有0.3M的氯化钠的PBS洗脱。或者,通过添加1/20体积的10%乙酸来酸化抗体,用10mM琥珀酸盐pH 5稀释,负载到柱上并且然后用10个柱体积的琥珀酸盐缓冲液洗涤。用50mM Tris pH7.5、2mM EDTA洗脱柱。
根据Kabat编号轻链氨基酸(Kabat等,Sequences of proteins of immunological interest,(1991)第5版,US Dept of Health and Human Service,National Institutes of Health,Bethesda,MD)。根据EU编号系统编号重链氨基酸(Edelman等(1969)Proc.Natl.Acad.of Sci.63(1):78-85),除了在标注为Kabat系统的地方。使用单字母氨基酸缩写。
表达在CHO细胞中的全长、半胱氨酸工程化的单克隆抗体(THIOMABTM)由于细胞培养条件而在工程化的半胱氨酸上具有半胱氨酸加合物(胱氨酸)或在工程化的半胱氨酸上进行谷胱甘肽化。为了释放工程化的半胱氨酸的反应性巯基基团,将THIOMABTM溶解于约pH 8.0下的500mM硼酸钠和500mM氯化钠中,并且用约50-100倍过量的1mM TCEP(三(2-羧乙基)膦盐酸盐(Getz等(1999)Anal.Biochem.第273卷:73-80;Soltec Ventures,Beverly,MA)在37℃下还原约1-2小时。或者,可以使用DTT作为还原剂。通过非还原性SDS-PAGE或通过变性反相HPLC PLRP柱色谱法来监测链间二硫键的形成。稀释还原的THIOMABTM并且用10mM乙酸钠(pH 5)负载到HiTrap SP FF柱上,并且用含有0.3M氯化钠的PBS或含有150mM氯化钠的50mM Tris-Cl(pH 7.5)洗脱。
通过进行再氧化,在存在于亲本Mab中的半胱氨酸残基之间重新建立二硫键。洗脱的还原的THIOMABTM用pH 7下的15X或2mM脱氢抗坏血酸(dhAA)处理约3小时,或在50mM Tris-Cl(pH 7.5)中处理约3小时,或在室温下用200nM至2mM硫酸铜水溶液(CuSO4)处理过夜。可以使用本领域已知的其他氧化剂(oxidant),即氧化剂(oxidizing agent)和氧化条件。周围空气氧化也可为有效的。此温和的、部分的再氧化步骤可高保真地高效形成键内二硫化物。缓冲液通过由Sephadex G25树脂洗脱来进行交换并且用含有1mM DTPA的PBS洗脱。通过确定来自溶液的280nm处的吸光度的还原抗体浓度和通过与DTNB(Aldrich,Milwaukee,WI)反应和确定412nm处的吸光度确定硫醇浓度来检验硫醇/Ab值。
在具有延长质量范围的TSQ Quantum Triple quadrupoleTM质谱仪(Thermo Electron,San Jose California)上进行液相色谱法/质谱分析。在加热至75℃的1000A微内径柱(50mm×2.1mm,Polymer Laboratories,Shropshire,UK)上对样品进行色谱分离。使用30%-40%B(溶剂A:0.05%水中的TFA,溶剂B:0.04%乙腈中的TFA)的线性梯度,并且使用电喷雾源对洗脱物进行直接离子化。通过数据系统收集数据,并且使用(Novatia,LLC,New Jersey)进行去卷积。在LC/MS分析之前,用肽N-糖苷酶F(2个单位/毫升;PROzyme,San Leandro,CA)在37℃下处理抗体或药物缀合物(50微克)持续2小时,以便去除N-连接的碳水化合物。
将疏水性相互作用色谱法(HIC)样品注射到丁基HIC NPR柱(2.5微米粒径,4.6mm×3.5cm)(Tosoh Bioscience)上并且以0.8ml/min用0至70%B的线性梯度洗脱(A:50mM磷酸钾中的1.5M硫酸铵,pH 7,B:50mM磷酸钾pH 7,20%异丙醇)。装备有多波长检测器和化学工作站软件的Agilent 1100系列HPLC系统用于分辨和定量具有每种抗体的不同药物比的抗体种类。
实施例3接头-药物中间体至抗体的缀合
在实施例2的还原和再氧化程序之后,将半胱氨酸工程化的抗体(THIOMABTM)溶解于PBS(磷酸盐缓冲盐水)缓冲液中并且在冰上冷淬。将过量的约1.5摩尔至20当量的接头-药物中间体(包括但不限于表1中的LD-51至LD-61,具有巯基反应性的吡啶基二硫化物基团)溶解于DMSO中,用乙腈和水稀释,并且添加至PBS中的冷淬的还原的、再氧化的抗体。通常接头-药物以50mM Tris(pH 8)中的约20mM浓度从DMSO储备液中添加至抗体,并且如通过LC-MS分析反应混合物所确定的监测直到约1至约24小时反应完全。当反应完全时,添加过量的马来酰亚胺来猝灭反应并且对任何未反应的抗体巯基基团进行加帽(cap)。可以负载缀合混合物并且穿过HiTrap SP FF柱洗脱以便去除过量的药物-接头中间体和其他杂质。通过离心超滤来浓缩反应混合物,并且纯化半胱氨酸工程化的抗体药物缀合物并且通过用PBS穿过G25树脂洗脱来脱盐,在无菌条件下过滤穿过0.2μm过滤器并且冷冻用于储存。
例如,在用20mM琥珀酸钠(pH 5)稀释之后,将粗抗体-药物缀合物(ADC)施加至阳离子交换柱。用至少10个柱体积的20mM琥珀酸钠(pH 5)洗涤柱,并且用PBS洗脱抗体。使用凝胶过滤柱,将抗体药物缀合物配制到具有240mM蔗糖的20mM His/乙酸盐(pH 5)中。通过UV光谱法以确定蛋白质浓度、通过分析性SEC(大小排阻色谱法)用于聚集分析并且通过在用赖氨酸C肽链内切酶处理之前和之后进行LC-MS来对抗体-药物缀合物进行表征。
使用Shodex KW802.5柱,用具有0.25mM氯化钾和15%IPA的0.2M磷酸钾pH 6.2,以0.75ml/min的流速下进行大小排阻色谱法。通过对280nm处的吸光度的洗脱峰面积进行积分来确定缀合物的聚集状态。
可以使用Agilent QTOF 6520ESI仪器进行LC-MS分析。作为举例,在37℃下,用Tris(pH 7.5)中的1:500w/w胞内蛋白酶Lys C(Promega)处理抗体-药物缀合物,持续30min。将所得到的裂解片段负载到加热至80℃的(埃)、8μm(微米)PLRP-S(高度交联的聚苯乙烯)柱上,并且用30%B至40%B的梯度用5分钟进行洗脱。流动相A为具有0.05%TFA的H2O并且流动相B为具有0.04%TFA的乙腈。流速为0.5ml/min。在电喷雾离子化和MS分析之前,通过在280nm处的UV吸光度检测来监测蛋白质洗脱。通常实现未缀合的Fc片段、残余未缀合的Fab和掺药物的Fab的色谱分辨。使用Mass HunterTM软件(Agilent Technologies)对获得的m/z谱进行去卷积,以便计算抗体片段的质量。
通过这些程序,制备表2的半胱氨酸工程化的抗体药物缀合物101-117。
实施例4体外细胞增殖测定
通过细胞增殖测定来测量ADC的功效,所述细胞增殖测定采用以下方案(CELLTITER GLOTM发光细胞活力测定,Promega公司Technical Bulletin TB288;Mendoza等(2002)Cancer Res.62:5485-5488):
1.将在培养基中含有约104个细胞(SKBR-3、BT474、MCF7或MDA-MB-468)的100μl细胞培养物等分试样沉积在96孔不透明壁的板中的每个孔中。
2.制备含有培养基但不含细胞的对照孔。
3.将ADC添加至实验孔并且孵育3-5天。
4.将板平衡至室温,持续大约30分钟。
5.添加体积等于存在于每个孔中的细胞培养基的体积的CELLTITER GLOTM试剂。
6.将内容物在定轨振荡器上混合2分钟以便诱导细胞溶解。
7.在室温下将板孵育10分钟以便使发光信号稳定。
8.在图表中记录发光并报告为RLU=相对发光单位。
对作为每组复制物的发光平均值的数据进行作图,其中具有标准偏差误差线。方案为CELLTITER GLOTM发光细胞的修正形式
培养基:SK-BR-3生长于50/50/10%FBS/谷氨酰胺/250μg/mL中,G-418OVCAR-3生长于RPMI/20%FBS/谷氨酰胺中
实施例5高表达HER2转基因外植体小鼠中的肿瘤生长抑制体内功效
在第0天进行单一处理之前,确立肿瘤并且允许生长至体积为150-200mm3(如使用卡尺所测量)。根据下式,使用卡尺测量肿瘤体积:V(mm3)=0.5A X B2,其中A和B分别为长直径和短直径。在肿瘤体积达到3000mm3之前或当肿瘤示出即将发生溃疡的迹象时处死小鼠。将从每个实验组(每组10个小鼠)收集的数据表示为平均值±SE。
采用Fo5小鼠乳腺肿瘤模型来评估本发明的抗体-药物缀合物在单一剂量静脉内注射之后的体内功效,并且如先前所述(Phillips GDL、Li GM、Dugger DL等Targeting HER2-Positive Breast Cancer with Trastuzumab-DM1,an Antibody-Cytotoxic Drug Conjugate.(2008)Cancer Res.68:9280-90),所述参考文献以引用的方式并入本文。用Fo5模型测试抗Her2 ADC,所示Fo5模型为其中如图3和图5所示的人HER2基因在鼠乳腺肿瘤病毒启动子(MMTV-HER2)的转录调节下在乳腺上皮细胞中过表达的转基因小鼠模型。HER2过表达引起自发的乳腺肿瘤发展。通过连续移植肿瘤片段(大小为大约2×2mm),将这些创始动物(founder animal)(创始#5[Fo5])之一的乳腺肿瘤在后代FVB小鼠中增殖。所有研究根据实验动物管理与使用指南来进行。在研究开始时和在移植后14天,在九个动物中静脉内给药每种抗体-药物缀合物(单一剂量)。初始肿瘤大小的体积为约200mm3。由本发明的抗体-药物缀合物得到的随时间的肿瘤生长抑制测量在图3-5中示出。
可以如下所述的采用另一种乳腺脂肪垫移植物功效模型(Chen等(2007)Cancer Res 67:4924-4932),评估单一静脉内剂量之后的肿瘤体积并且使用从具有腹腔内肿瘤的小鼠切除的肿瘤,然后连续传代到受体小鼠的乳腺脂肪垫中。
虽然出于清楚理解的目的已通过说明和实施例相当详细地描述了上述发明,但描述和实施例不应当被解释为限制本发明的范围。贯穿本说明书中引用的所有专利、专利申请和参考文献明确地以引用的方式并入。
序列表
<110> GENENTECH公司等
<120> 蒽环类二硫化物中间体、抗体-药物缀合物和方法
<130> P05813-WO
<140>
<141>
<150> 62/049,720
<151> 2014-09-12
<160> 30
<170> PatentIn 3.5 版
<210> 1
<211> 16
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 1
Arg Ser Ser Gln Ser Ile Val His Ser Val Gly Asn Thr Phe Leu Glu
1 5 10 15
<210> 2
<211> 7
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 2
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 3
<211> 9
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 3
Phe Gln Gly Ser Gln Phe Pro Tyr Thr
1 5
<210> 4
<211> 10
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 4
Gly Tyr Glu Phe Ser Arg Ser Trp Met Asn
1 5 10
<210> 5
<211> 18
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 5
Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Ser Gly Lys Phe
1 5 10 15
Lys Gly
<210> 6
<211> 11
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 6
Asp Gly Ser Ser Trp Asp Trp Tyr Phe Asp Val
1 5 10
<210> 7
<211> 16
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 7
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
1 5 10 15
<210> 8
<211> 7
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 8
Leu Gly Val Asn Ser Val Ser
1 5
<210> 9
<211> 9
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 9
Met Gln Ala Leu Gln Thr Pro Trp Thr
1 5
<210> 10
<211> 5
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 10
Asn His Ala Ile Ser
1 5
<210> 11
<211> 17
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 11
Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 12
<211> 7
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 12
Glu Trp Ala Asp Val Phe Asp
1 5
<210> 13
<211> 112
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成多肽”
<400> 13
Glu Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Val Asn Ser Val Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Gln Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 14
<211> 117
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成多肽”
<400> 14
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Ile Phe Ser Asn His
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Phe
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Trp Ala Asp Val Phe Asp Ile Trp Gly Gln Gly Thr Met
100 105 110
Val Thr Val Ser Ser
115
<210> 15
<211> 11
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 15
Arg Ala Ser Gln Gly Ile Arg Asn Asp Leu Gly
1 5 10
<210> 16
<211> 7
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 16
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 17
<211> 9
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 17
Leu Gln His Asn Ser Tyr Pro Trp Thr
1 5
<210> 18
<211> 5
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 18
Gly Asn Tyr Met Ser
1 5
<210> 19
<211> 16
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 19
Leu Ile Tyr Ser Gly Asp Ser Thr Tyr Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 20
<211> 10
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成肽”
<400> 20
Asp Gly Tyr Tyr Val Ser Asp Met Val Val
1 5 10
<210> 21
<211> 107
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成多肽”
<400> 21
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Asn Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 22
<211> 118
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成多肽”
<400> 22
Glu Val Gln Leu Val Glu Ser Gly Gly Ala Leu Ile Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Ile Ser Gly Asn
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Tyr Ser Gly Asp Ser Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Asn Ile Ser Arg Asp Ile Ser Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Gly Tyr Tyr Val Ser Asp Met Val Val Trp Gly Lys Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 23
<211> 107
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成多肽”
<400> 23
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Asn Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 24
<211> 118
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成多肽”
<400> 24
Glu Val Gln Leu Val Glu Ser Gly Gly Ala Leu Ile Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Ile Ser Gly Asn
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Tyr Ser Gly Asp Ser Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Ile Ser Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Gly Tyr Tyr Val Ser Asp Met Val Val Trp Gly Lys Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 25
<211> 107
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成多肽”
<400> 25
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Asn Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 26
<211> 118
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成多肽”
<400> 26
Glu Val Gln Leu Val Glu Ser Gly Gly Ala Leu Ile Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Ile Ser Gly Asn
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Tyr Ser Gly Asp Ser Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Ser Ile Ser Arg Asp Ile Ser Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Gly Tyr Tyr Val Ser Asp Met Val Val Trp Gly Lys Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 27
<211> 107
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成多肽”
<400> 27
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Asn Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 28
<211> 118
<212> PRT
<213> 人工序列
<220>
<221> 来源
<223> /注释=“人工序列的描述:合成多肽”
<400> 28
Glu Val Gln Leu Val Glu Ser Gly Gly Ala Leu Ile Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Ile Ser Gly Asn
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Leu Ile Tyr Ser Gly Asp Ser Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Ala Ile Ser Arg Asp Ile Ser Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Asp Gly Tyr Tyr Val Ser Asp Met Val Val Trp Gly Lys Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 29
<211> 7
<212> PRT
<213> 智人
<400> 29
Met Ala Glu Ala Ile Thr Tyr
1 5
<210> 30
<211> 7
<212> PRT
<213> 智人
<400> 30
Thr Ala Phe Arg Phe Pro Asp
1 5
- 还没有人留言评论。精彩留言会获得点赞!