金刚烷胺组合物的施用方法与流程
交叉引用本申请基于35u.s.c.§119(e)要求2014年11月4日提交的美国临时申请no.62/075,137的优先权,其全文以引用的方式并入本文。发明的
背景技术:
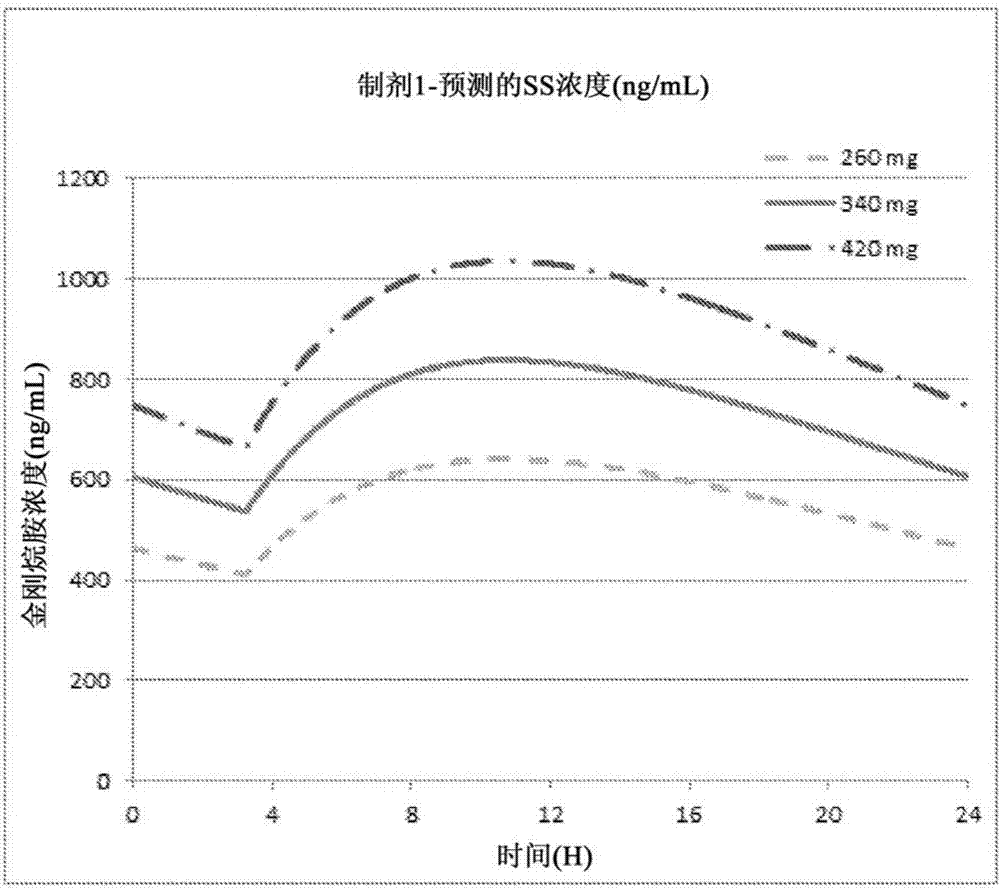
:金刚烷胺适用于包括治疗自发性帕金森症(震颤性麻痹)、脑炎后帕金森氏症和症状性帕金森症等可由nmda受体拮抗剂治疗的多种病症,这些病症可能由一氧化碳中毒对神经系统的损害导致。金刚烷胺还具有作为病毒m2通道抑制剂的活性,并用于预防和治疗病毒性疾病的感染,特别是甲型流感病毒。金刚烷胺目前市售的形式是速释剂,通常每天施用两次或更多次。由于与剂量相关的cns副作用,所以金刚烷胺的使用受到限制,所述cns副作用包括:眩晕、精神错乱、幻觉、失眠和噩梦。graciesjm,olanowcw;currentandexperimentaltherapeuticsofparkinson’sdisease;neuropsycho-pharmacology:thefifthgenerationofprogress,pp.1802;americancollegeofneuropsycho-pharmacology2002),尤其是在夜间施用金刚烷胺时,会加剧上述副作用。(jackson等,bull.panam.healthorg.,147,595-603(1967);jackson,jama,235(25),(1976),pp.2739-2742;andhayden,aac,23(3)1983,pp.458-464)。已证明速释金刚烷胺对帕金森症患者的行走速度有所改善。parkes等人,lancet,1,pp.259-62(1970)。在开放标签研究中使用速释金刚烷胺评估了stn刺激后的晚期帕金森症患者,其显示出步态的改善。chan等人,parkinsonismandrelateddisorders,19,pp.316-9(2013)。哌醋甲酯也显示出在接受stn刺激的具有严重步态障碍的患者的步态改善。moreau等人,lancetneurology11,pp.589-96(2012)。帕金森病患者步态障碍的另一项研究的结论是哌醋甲酯无效。espayetal.,neurology76,pp.1256-62(2011)。在多发性硬化中,芬太尼(4-氨基吡啶;达伐吡啶)在一些患者中表现出行走能力的改善。goodman等人,lancet,373,pp.732-8(2009)。相反,芬太尼(fampridine)在四周内对帕金森症患者的行走能力(即速度和步幅长度)没有改善(luca等人,neurology84(14)supplementp.6.049(2015))。已知的是,速释金刚烷胺可起到兴奋剂的作用,从而导致失眠和睡眠障碍。因此,金刚烷胺的最后一次施用时间通常不迟于下午4点,以使上述副作用降至最低。金刚烷胺这样给药会造成在傍晚或者夜间达到金刚烷胺的血药峰浓度,而在早晨其血药浓度很低。本领域已有对缓释型金刚烷胺的描述。guittard等人的美国专利no.5,358,721、edgren等人的美国专利no.6,217,905和vergez等人的美国专利no.8,574,626分别公开了包含抗病毒剂或抗帕金森症药物口服渗透剂型,其中在每种情况下将金刚烷胺列为可用于该剂型的药物。smith等人的美国专利no.6,194,000公开了利用nmda受体拮抗剂(例如金刚烷胺)作为活性剂的止痛速释和控释药物组合物。美国专利申请公开no.2006/0252788、us2006/0189694、us2006/0142398、us2008/0227743和us2011/0189273(均属于went等人)分别公开了nmda受体拮抗剂,例如任选的控释型金刚烷胺。有八种基本的病理性步态可归因于神经系统疾病:偏瘫的、痉挛性双瘫的、神经性的、肌病的、帕金森症的、舞蹈病样的,共济失调(小脑)的和感知性的。偏瘫步态在中风中最常见。在双侧脑室周围病变中可见双瘫步态,如脑瘫患者。神经性步态,如果是双侧的,可见于肌萎缩性侧索硬化症、charcot-marie-tooth病和其他的周围神经病变(包括与不受控制的糖尿病相关的神经病变)。肌病步态见于肌病患者,如肌营养不良症。帕金森症步态可见于帕金森症或导致帕金森综合症的任何其他情况(如药物的副作用)。舞蹈病样的步态可见于某些基底节神经失调症,包括sydenham舞蹈病、huntington病和其他形式的舞蹈病、手足徐动症或肌张力障碍。共济失调步态最常见于小脑疾病。多发性硬化症患者经常表现为共济失调的症状,包括不协调的行走、对运动范围的失控、不能保持稳定的姿势、不能保持稳定的节奏、或失去平衡。感知性步态可见于脊髓背柱疾病(例如,b12缺乏或脊髓痨)或影响周围神经的疾病(例如不受控制的糖尿病)。发明概述本发明人已出乎意料地发现金刚烷胺在某些运动功能失调症的治疗中是有用的,这些疾病包括罹患多发性硬化的患者或者中风的患者的行走障碍或步态障碍。在一些实施方案中,速释型的金刚烷胺或其药学可接受的盐、或者控释型的金刚烷胺或其药学可接受的盐在所述方法中是有用的。在一些实施方案中,优选控释型。在一个实施方案中,所述方法包括每天施用一次、二次或三次速释型的金刚烷胺或者其药学可接受的盐(包括,例如,盐酸金刚烷胺或硫酸金刚烷胺)。在一个实施方案中,所述方法包括每天早晨施用一次金刚烷胺或其药学可接受的盐的缓释型组合物(例如,患者醒来之后但不超过12pm),其中所述缓释型组合物提供5至11小时的单剂量tmax。在一些实施方案中,所述方法在傍晚(例如在就寝时间之前0到4小时)每天一次施用金刚烷胺或其药学可接受的盐的缓释组合物,其中所述缓释组合物提供9至19小时的单剂量tmax。在一些实施方案中,已发现该发明促进相对高剂量的金刚烷胺(或其药学可接受的盐)的每天一次施用,同时出乎意料地减少诸如睡眠障碍等的副作用。本文所描述的一些实施方案提供了一种方法,该方法改善行走(例如,提高行走速度)、改善步态或治疗患者的行走障碍(例如,ms患者或中风患者)。在一些实施方案中,所述方法包括每天向患者施用约50mg至约600mg的药物,该药物选自由金刚烷胺或其药学可接受的盐构成的组。在一些实施方案中,每天一次、每天两次或每天三次施用所述药物。在一些实施方案中,每天一次施用所述药物。在一些实施方案中,所述药物是包含该药物和至少一种赋形剂(例如持续释放型赋形剂)的药物组合物。在一些实施方案中,所述药物以一种、两种、三种或四种剂型施用,所述剂型由所述药物和至少一种赋形剂构成。在一些实施方案中,所述一种、两种、三种或四种剂型为口服剂型。在一些实施方案中,所述口服剂量为片剂、囊片、凝胶胶囊或其他合适的口服单位剂型。在一些实施方案中,所述患者具有正常肾脏功能,并且以每天约100至约220mg,每天约120至约200mg,每天约140至约180mg,或者每天约100、110、120、130、140、150、160、170、180、190、200、210或者220mg的初始剂量施用所述药物。在一些实施方案中,所述患者具有正常肾脏功能,并且以每天约200至约440mg,每天约240至约400mg,每天约280至约360mg,或者每天约160、170、180、200、220、240、260、280、300、320、340、360、380、400、420或者440mg的初始剂量施用所述药物。在一些实施方案中,所述患者具有肾脏损伤,并且以每天约50至约110mg,每天约60至约100mg,每天约70至约90mg,或者每天约50、55、60、65、70、75、80、85、90、95、100、105或者110mg的初始剂量施用所述药物。在一些此类实施方案中,所述ms患者具有肾脏损伤,并且在施用金刚烷胺的初始时期之后,所述剂量增加至每天约100至约220mg,每天约120至约200mg,每天约140至约180mg,或者每天约100、110、120、130、140、150、160、170、180、190、200、210或者220mg。在一些实施方案中,以缓释形式施用所述药物,所述缓释形式包括所述药物和至少一种缓释赋形剂。在一些实施方案中,所述药物在早晨施用,例如,醒来之后至不晚于12pm,或者介于5am至12pm、6am至12pm、7am至12pm、8am至12pm之间,并且所述药物具有5至8小时、5至9小时、5至10小时、5至11小时、6至9小时、6至10小时、或6至11小时的中值tmax。在一些实施方案中,所述药物在就寝时间之前施用(例如,在就寝时间之前0、1、2、3或4小时),并且所述药物的tmax为8至18小时、8至20小时、10至18小时、10至20小时、12至18小时、12至20小时。前文所述的tmax为通过单剂量、禁食、人类药代动力学研究所测定的tmax中位值。在一些实施方案中,所述药物以速释形式提供,并且每天施用二次、三次或四次。在一些实施方案中,提供了一种改善受试者行走能力的方法,所述方法包括在日间或夜间对所述患者口服施用一次这样的剂量,所述剂量包含(i)50mg至600mg选自由金刚烷胺及其药学可接受的盐构成的组中的药物、和(ii)至少一种赋形剂(例如,其中所述剂量包含含有组分(i)和(ii)的组合物)。在一些实施方案中,所述受试者为ms患者。在一些实施方案中,所述剂量包含这样的组合物,所述组合物包含(i)100mg至450mg金刚烷胺或其药学可接受的盐和(ii)至少一种赋形剂。在一些实施方案中,所述组合物可以包含约130至210mg金刚烷胺或其药学可接受的盐。在多个具体的实施方案中,剂型包含这样的组合物,所述组合物包含(i)50至75mg、70至95mg、90至115mg、110至135mg、130至155mg、150至175mg、170至195mg、190至215mg、210至235mg、230至255mg、250至275mg、270至295mg、290至305mg、300至315mg、310至325mg、320至335mg、330至345mg、340至355mg、350至365mg、360至375mg、370至385mg、380至395mg、390至405mg、400至415mg、410至425mg、420至435mg、430至445mg或440至455mg的金刚烷胺或其药学可接受的盐,和(ii)至少一种赋形剂。在一些实施方案中,所述组合物包含约110、120、130、140、150、160170、180、190、210、220或340mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物包含110mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含130mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含170mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含210mg盐酸金刚烷胺。在一些实施方案中,人类受试者具有多发性硬化。在一些实施方案中,所述剂量额外地包含一种或多种选自4-氨基吡啶、巴氯芬、右美沙芬、富马酸二甲酯、芬戈莫德、哌醋甲酯和特立氟胺、四苯并嗪和替扎尼定的药物。在一些实施方案中,所述至少一种赋形剂是释放调节赋形剂。在一些实施方案中,所述赋形剂中的至少一种调节金刚烷胺或其药学上可接受的盐的释放以提供缓释形式,并且其中所述剂量的施用提供a)金刚烷胺tmax为5至18小时,和/或b)每毫克金刚烷胺的cmax为1.0至2.8ng/ml,和/或c)由单剂量人类药代动力学研究测得每毫克金刚烷胺的auc0-inf为40至75ng·hr/ml。在一些实施方案中,所述赋形剂中的至少一种调节金刚烷胺或其药学上可接受的盐的释放以提供缓释形式,并且其中所述剂量的施用提供a)金刚烷胺tmax为5至18小时,和/或b)每毫克金刚烷胺的cmax为1.0至2.8ng/ml,和/或c)由单剂量人类药代动力学研究测得每毫克金刚烷胺的auc0-inf为40至75ng·hr/ml。在一些实施方案中,金刚烷胺这样的剂量会造成在晨间或者下午较早时间达到金刚烷胺的血药峰浓度,而在夜间其血药浓度很低。在一些实施方案中,所述药物以缓释形式提供。在其他的具体实施方案中,在施用单剂量组合物后5、6、7、8、9、10、11或12小时至约9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小时之间(例如,给药后8小时至约18小时)达到金刚烷胺血药浓度峰值。在一些实施方案中,所述金刚烷胺组合物在就寝时间之前0至4小时施用给患者。在一些实施方案中,金刚烷胺组合物在就寝时间之前0至3、0至2、或0至1小时施用给患者。在一些实施方案中,在就寝时间之前0至4小时每天一次口服施用,所述组合物的平均tmax为9至18小时。在一些实施方案中,每天一次,在醒来之后和12pm之间或在6am至12pm之间进行口服施用,所述组合物的平均tmax为5至9小时。在一些实施方案中,通过以下方法至少一种方法或其组合评估行走速度或能力:定时25步行走测试(t25fw)、定时起立和行走(tug)、2分钟行走测试、6分钟定时行走测试(6mtw)、和/或十二项多发性硬化症行走测量表(msws-12)(在实施例10中提供参考)。在一些实施方案中,受试者的行走显著改善。在一些实施方案中,改善了ms症状。在一些实施方案中,25fw、tug、2分钟行走、6mtw和/或msws-12(相对于安慰剂)显著改善。在一些实施方案中,将组合物施用于ms疾病受试者导致ms疾病行走障碍的显著减轻。在具体实施方案中,组合物的施用导致ms疾病行走障碍减轻约5%、10%、15%、20%、25%、30%、35%或40%、45%、50%、55%或60%。在具体实施方案中,组合物的施用导致ms疾病行走障碍减轻至少5%、10%、15%、20%、25%、30%、35%或40%、45%、50%、55%或60%。在具体实施方案中,组合物的施用导致上述评估分数中的一个或多个改善约5%、10%、15%、20%、25%、30%、35%或40%、45%、50%、55%或60%。在一些实施方案中,减少行走障碍是按照fda或其他监管机构使用或接受的数字量表进行测量的,以评估用于治疗行走障碍的药物的治疗有效性和药物审批。在一些实施方案中,日间一次或晚间一次以不相等或优选相等的一个、两个、三个或四个单位剂型施用所述组合物。在一些更具体的实施方案中,以一个、两个或三个单位剂型施用所述组合物,每个单位剂型各自包含75至200mg金刚烷胺或其药学上可接受的盐。在一些实施方案中,以两个单位剂型施用所述组合物,每个单位剂型各自包含100至175mg金刚烷胺或其药学上可接受的盐。在一些实施方案中,以不相等或优选相等的两个或三个单位剂型施用所述组合物,每个单位剂型各自包含85至250mg金刚烷胺或其药学上可接受的盐。在一些实施方案中,以相等剂量的两个单位剂型(例如,各自包含130-210mg金刚烷胺或其药学上可接受的盐)施用所述组合物。在一些更具体的实施方案中,以两个单位剂型施用所述组合物,每个单位剂型各自包含150至180mg金刚烷胺或其药学上可接受的盐。一些实施方案提供了一种改善受试者步态的方法,所述方法包括日间一次或夜间一次向患者口服施用这样的剂量,所述剂量包含(i)50mg至600mg选自由金刚烷胺及其药学可接受的盐构成的组中的药物、和(ii)至少一种赋形剂(例如,其中所述剂量包括含有组分(i)和(ii)的组合物)。在一些实施方案中,所述人类受试者罹患ms。在一些实施方案中,所述组合物可以包含100mg至450mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物可以包含130至210mg金刚烷胺或其药学可接受的盐。在一些实施方案中,剂型包含这样的组合物,所述组合物包含50至75mg、70至95mg、90至115mg、110至135mg、130至155mg、150至175mg、170至195mg、190至215mg、210至235mg、230至255mg、250至275mg、270至295mg、290至305mg、300至315mg、310至325mg、320至335mg、330至345mg、340至355mg、350至365mg、360至375mg、370至385mg、380至395mg、390至405mg、400至415mg、410至425mg、420至435mg、430至445mg或440至455mg的金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物包含约110、120、130、140、150、160、170、180、190、210、220或340mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物包含110mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含130mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含170mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含210mg盐酸金刚烷胺。在一些实施方案中,所述人类受试者具有多发性硬化。在一些实施方案中,所述药剂还包含一种或多种选自4-氨基吡啶、巴氯芬、右美沙芬、富马酸二甲酯、芬戈莫德、哌醋甲酯和特立氟胺、四苯并嗪和替扎尼定的药物。在一些实施方案中,所述至少一种赋形剂是释放调节赋形剂。在一些实施方案中,所述赋形剂中的至少一种调节金刚烷胺或其药学上可接受的盐的释放以提供缓释形式,并且其中所述剂量的施用提供a)金刚烷胺tmax为5至18小时,b)每毫克金刚烷胺的cmax为1.0至2.8ng/ml,和c)由单剂量人类药代动力学研究测得每毫克金刚烷胺的auc0-inf为40至75ng·hr/ml。在一些实施方案中,金刚烷胺这样的剂量会造成在晨间或者下午达到金刚烷胺的血药峰浓度,而在夜间其血药浓度很低,即,在患者睡眠期间。在一些实施方案中,以缓释形式提供所述药物。在其他的具体实施方案中,在施用单剂量组合物后5、6、7、8、9、10、11或12小时至约9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小时之间(例如,给药后8小时至约18小时)达到金刚烷胺血药浓度峰值。在一些实施方案中,所述金刚烷胺组合物在就寝时间之前0至4小时施用给患者。在一些实施方案中,金刚烷胺组合物在就寝时间之前0至3、0至2、或0至1小时施用给患者。在上述任一方面的一些实施方案中,将组合物施用于ms疾病受试者,导致ms疾病中步态障碍的显著减轻。在具体实施方案中,组合物的施用导致ms疾病中步态障碍减轻至少约5%、10%、15%、20%、25%、30%、35%或40%、45%、50%、55%或60%。在一些实施方案中,步态(或步态障碍)是按照fda或其他监管机构使用或接受的数字量表进行测量的,以评估用于治疗步态的药物的治疗有效性和药物审批。在一些实施方案中,日间一次施用金刚烷胺组合物(或包含金刚烷胺的组合)提供了影响步态的运动功能减退性运动障碍的改善。所述改善可以通过本领域已知的方法来确定,例如定时起立和行走(tug)、定时25步行测试(t25fw)或6分钟定时行走测试(6mtw)。在一些实施方案中,日间一次或晚间一次以不相等或优选相等的一个、两个、三个或四个单位剂型施用所述组合物。在一些更具体的实施方案中,以一个包含75至350mg金刚烷胺或其药学上可接受的盐的单位剂型、两个或三个各自包含85至175mg金刚烷胺或其药学上可接受的盐的单位剂型施用所述组合物。在一些实施方案中,以两个单位剂型施用所述组合物,每个单位剂型各自包含100至175mg金刚烷胺或其药学上可接受的盐。在一些实施方案中,以不相等或优选相等的两个或三个单位剂型施用所述组合物,每个单位剂型各自包含85至250mg金刚烷胺或其药学上可接受的盐。在一些更具体的实施方案中,以两个单位剂型施用所述组合物,每个单位剂型各自包含150至180mg金刚烷胺或其药学上可接受的盐。在一些实施方案中,每天一次口服施用所述组合物。本发明提供改善运动功能减退性运动功能障碍的方法,通常其特征在于躯体运动(例如行走)减退或肌肉僵直,以及与中风后多发性硬化和行走缺陷相关的问题。本发明提供了改善具有运动减退性运动障碍的人类受试者的步态的方法,所述运动障碍与多发性硬化和中风等病症相关。这些运动减退性运动障碍可能对受试者的行走有显著的不利影响,从而增加了潜在疾病的残疾。本发明提供了改善运动减退性运动障碍的方法,通常其特征在于非正常的运动增加,有时为不可控的运动,例如亨廷顿舞蹈病、迟发性运动障碍和图雷特综合征。因此,本领域需要改进的用于治疗ms和中风患者的运动波动或运动障碍的金刚烷胺治疗方法,其可以在他们即将想要睡觉之前(例如,在就寝时间之前)施用给患者而不导致失眠或睡眠障碍。此外,需要一种金刚烷胺治疗方法,其可以在患者睡觉之前服用,然后在整晚睡眠后(例如在早晨醒来时)提供合适的金刚烷胺血药浓度。本领域中需要改进的用于治疗ms和中风的运动波动或运动障碍的金刚烷胺治疗方法,其可以每天施用一次,在早晨醒来时(例如在中午之前、或者上午6点和下午12点之间的时段)提供所述治疗而不引起失眠或睡眠障碍。上述各种障碍、病症和疾病导致患者的衰弱。因此,本领域中需要用于治疗步态障碍和/或运动减退性运动障碍,以及多动症障碍的方法和组合物。在本发明的一些方面,提供了向有需要的患者施用金刚烷胺的方法,所述方法包括在就寝时间之前(即,受试者在夜间想要睡觉的时候)三小时内口服施用包含金刚烷胺或其药学上可接受的盐的某些缓释(er)组合物。该方面还包括使用这种组合物以及金刚烷胺或其药学上可接受的盐在制备下述药物中的用途。或者,在就寝时间之前不到约4小时施用组合物。在一些方面,在就寝时间之前少于四个小时、小于三个半小时、小于三个小时、小于两个半小时、小于两个小时、小于一个半小时、少于一个小时或少于半小时进行施用。在本发明的一些方面,提供了向有需要的患者施用金刚烷胺的方法,所述方法包括在患者醒来之后的早晨,优选在中午之前(例如上午6时至下午12时,上午7时至下午12时,上午8时至下午12时)每天一次口服施用包含金刚烷胺或其药学上可接受的盐的某些er组合物。该方面还包括使用这种组合物以及金刚烷胺或其药学上可接受的盐在制备下述药物中的用途。在本发明的一些方面,提供了减轻使用金刚烷胺治疗的患者的睡眠障碍的方法,所述方法包括在就寝时间之前(即,受试者在夜间想要睡觉的时候)约三小时内施用包含金刚烷胺或其药学上可接受的盐的缓释(er)组合物。该方面还包括使用这种组合物以及金刚烷胺在制备下述药物中的用途。或者,在就寝时间之前不到约4小时施用组合物。在本发明的一些方面,提供了减轻使用金刚烷胺治疗的人类受试者的睡眠障碍的方法,所述方法包括在受试者醒来后的早晨每天一次施用包含金刚烷胺或其药学上可接受的盐的缓释(er)组合物。该方面还包括这种组合物的用途以及金刚烷胺在制备下述药物中的用途。在本发明的一些方面,(例如盐酸盐)在每天一次以维持剂量施用之前至少一周以减少的量(即85至260mg/天)施用金刚烷胺或其药学上可接受的盐。该时段可以提高维持剂量的耐受性。在本发明的一个方面,患者至少一周每天服用85或170mg,然后将剂量增加至每天170或340mg。此外,许多需要金刚烷胺治疗的患者存在吞咽困难问题。因此,需要这样的金刚烷胺治疗方法,其以小尺寸的口服剂型递送治疗有效量的药物,并且不会不适当地增加用药量。优选地,这种剂型每天施用一次。优选地,这种剂型可以洒在食物(例如苹果酱上)并与食物一起食用。在一些方面,本发明提供了一种治疗脑损伤、脑外伤、中风、亨廷顿病、als、多发性硬化、神经变性疾病、脑血管病、运动障碍、颅神经障碍的方法,所述方法包括在就寝时间之前约三小时(即,受试者在夜间想要睡觉的时间)施用包含金刚烷胺或其药学上可接受的盐的某些缓释(er)组合物。例如,本发明提供了治疗这些疾病中运动功能减退障碍的方法。该方面还包括这种组合物的用途以及金刚烷胺在制备下述药物中的用途。在上述任一方面的一些实施方案中,患者罹患多发性硬化(例如,被诊断患有多发性硬化)。在上述任一方面的一些实施方案中,患者得过中风。在上述任一方面的一些实施方案中,每晚施用一次所述组合物。另一方面,日剂量超过200mg,优选为240至420mg,更优选为260至340mg(甚至更优选为340mg)。在一些实施方案中,按照正常和/或el格式以1个、2个或3个0号、1号或2号胶囊提供260至340mg的日剂量。在上述任一方面的一些实施方案中,将组合物施用给患者使得临床医生全局印象(cgi)或任何其他医师测量患者的总体状况的显著改善。在具体的实施方案中,组合物的施用导致cgi约5%、10%、15%、20%、25%、30%、35%或40%的改善。在进一步的具体实施方案中,cgi的改善是以数字量表来衡量的,fda采用该数字量表评价用于治疗cns病症的药物的有效性。在上述任一方面的一些实施方案中,在施用所述剂量至少1小时后,金刚烷胺的稳态血药浓度没有增加。在上述任一方面的一些实施方案中,在施用所述剂量后至少两个小时,金刚烷胺的稳态血药浓度没有增加。在上述任一方面的一些实施方案中,在稳态金刚烷胺血药浓度下对人类受试者施用所述组合物,金刚烷胺血浆浓度在1、2、2.5或3小时后的增加少于5%、10%、15%、20%或25%。例如,在稳态金刚烷胺血浆浓度下将组合物施用于人类受试者时,金刚烷胺血浆浓度在施用后1、2、5.5或3小时后的增加少于5%;或在施用后1、2、5.5或3小时时少于10%;或在施用后1、2、5.5或3小时时少于15%;或在施用后1、2、5.5或3小时时少于20%;或在施用后1、2、5.5或3小时时少于25%。在上述任一方面的实施方案中,在施用单剂量的组合物后,在5至16小时之间达到金刚烷胺的峰值血药浓度。在更具体的实施方案中,在施用单剂量的组合物后8至14小时达到金刚烷胺峰的峰值血药浓度。在另一个更具体的实施方案中,在施用单剂量的组合物后10至12小时达到金刚烷胺峰的峰值血药浓度。在其他的具体实施方案中,在施用单剂量组合物后5、6、7、8、9、10、11或12小时至约9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小时之间(例如,施用后8小时至约18小时)达到金刚烷胺血药浓度峰值。在上述任一方面的一些实施方案中,所述金刚烷胺的单剂量tmax为9至18小时。在更具体的实施方案中,所述金刚烷胺的单剂量tmax为施用后12至18小时。在上述任一方面的一些实施方案中,所述金刚烷胺的稳态tmax为7至13小时。在更具体的实施方案中,所述金刚烷胺的稳态tmax为施用后8至12小时。在上述任一方面的一些实施方案中,每晚一次对人类受试者口服施用所述组合物提供了稳态血药浓度分布,其特征在于施用三小时后金刚烷胺浓度的增加少于25%。在更具体的实施方案中,稳态血药浓度分布的特征在于给药4小时后金刚烷胺浓度的增加少于25%。在上述任一方面的一些实施方案中,每天施用一次所述组合物,稳态下cmax与cmin的比为1.3至3.0、1.3至2.6、1.3至2.4、1.3至2.2、1.3至3.0、1.4至2.6、1.4至2.4、1.4至2.2、1.5至3.0、1.5至2.6、1.5至2.4或1.5至2.2。在上述任一方面的一些实施方案中,每天施用一次组合物的人类受试者在多次施用后的稳态血药浓度分布的特征在于,日间平均血药浓度(“c日间平均”,定义为通过人体pk研究而测得的日间金刚烷胺的平均血药浓度)是夜间平均血药浓度(“c夜间平均”,定义为通过人体pk研究而测得的夜间金刚烷胺的平均血药浓度)的1.4至1.7倍。在更具体的实施方案中,c日间平均是在5am、6am、7am、8am或者9am至4pm、5pm、6pm、7pm或8pm之间的时段;例如在6am和4pm之间的时段、7am和6pm之间的时段、或者7am和5pm之间的时段测得的金刚烷胺的平均血药浓度。c夜间平均是在4pm、5pm、6pm、7pm、8pm、9pm、10pm或11pm至5am、6am、7am、8am或9am之间的时段;例如在10pm和6am之间的时段、7pm和6am之间的时段、或者8pm和6am之间的时段。在上述任一方面的一些实施方案中,以药学可接受的盐施用所述金刚烷胺。在更具体的实施方案中,以盐酸金刚烷胺或硫酸金刚烷胺施用所述金刚烷胺。在上述任一方面的一些实施方案中,每日一次或每晚一次的金刚烷胺或其药学上可接受的盐的剂量可以在260至420mg的范围内。在一些实施方案中,每日一次或每晚一次的金刚烷胺或其药学上可接受的盐的剂量可以在50至600mg的范围内。在其他实施方案中,每日一次或每晚一次的金刚烷胺或其药学上可接受的盐的剂量超过300mg,例如每天320至360mg,更具体地每天330至350mg。在各个具体实施方案中,金刚烷胺或其药学上可接受的盐的日剂量可为50至75mg、70至95mg、90至115mg、110至135mg、130至155mg、150至175mg、170至195mg、190至215mg、210至235mg、230至255mg、250至275mg、270至295mg、290至305mg、300至315mg、310至325mg、320至335mg、330至345mg、340至355mg或350至365mg。在一些特别优选的实施方案中,每日一次或每晚一次的金刚烷胺或其药学上可接受的盐的剂量为340mg。在一些实施方案中,所述每日一次或每晚一次的金刚烷胺或其药学上可接受的盐的剂量为360至375mg、370至385mg、380至395mg、390至405mg、400至415mg、410至425mg、420至435mg、430至445mg或者440至455mg。在上述任一方面的一些实施方案中,所述组合物包含50mg至600mg金刚烷胺或其药学上可接受的盐。在一些实施方案中,所述组合物可以包含100mg至450mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物可以包含130至210mg金刚烷胺或其药学可接受的盐。在多个具体地实施方案中,剂型包含这样的组合物,所述组合物包含50至75mg、70至95mg、90至115mg、110至135mg、130至155mg、150至175mg、170至195mg、190至215mg、210至235mg、230至255mg、250至275mg、270至295mg、290至305mg、300至315mg、310至325mg、320至335mg、330至345mg、340至355mg、350至365mg、360至375mg、370至385mg、380至395mg、390至405mg、400至415mg、410至425mg、420至435mg、430至445mg或440至455mg的金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物包含约110、120、130、140、150、160170、180、190、210或220mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物包含110mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含130mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含170mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含210mg盐酸金刚烷胺。在上述任一方面的一些实施方案中,每日一次或每晚一次以不等或优选相等的一个、两个、三个或四个单位剂型施用所述组合物。在部分更具体的实施方案中,以两个或三个单位剂型施用所述组合物,每个单位剂型各自包含85至175mg金刚烷胺或其药学上可接受的盐。在一些实施方案中,以两个单位剂型施用所述组合物,每个单位剂型各自包含100至175mg金刚烷胺或其药学上可接受的盐。在上述任一方面的一些实施方案中,以不相等或优选相等的两个或三个单位剂型施用所述组合物,每个单位剂型各自包含85至250mg金刚烷胺或其药学上可接受的盐。在一些更具体的实施方案中,以两个单位剂型施用所述组合物,每个单位剂型各自包含150至180mg金刚烷胺或其药学上可接受的盐。在上述任一方面的一些实施方案中,对处于禁食状态的人类健康志愿受试者群体口服施用单剂量的组合物提供每毫克金刚烷胺1.1至2.8ng/ml的平均最大血药浓度(cmax)。在更具体的实施方案中,对处于禁食状态的人类健康志愿受试者群体口服施用单剂量的组合物提供每毫克金刚烷胺1.4至2.6ng/ml的平均最大血药浓度(cmax)和每毫克金刚烷胺46至60ng·h/ml的auc0-inf(由t=0至t=无穷大时药物浓度曲线下的面积)。在上述任一方面的一些实施方案中,对人类受试者群体每日口服施用组合物的剂量提供了稳态血药浓度分布,其特征在于以下标准中的至少一项:(i)每毫克金刚烷胺的平均cmax为2.2至2.7ng/ml,(ii)每毫克金刚烷胺的平均cmin为1.4至1.7ng/ml,和(iii)每毫克金刚烷胺的平均auc0-24为46至60ng·h/ml。在更具体的实施例中,符合所有(i)、(ii)和(iii)三项标准。在更具体的实施方案中,稳态血药浓度分布的特征还在于:(iv)施用后至少1小时金刚烷胺的浓度不增加;和(v)cmax/cmin比为1.3至3.0。在更具体的实施方案中,符合(iv)和(v)两项标准。在一些实施方案中,稳态血药浓度分布的特征还在于以下标准中的至少一项:(iv)施用后至少两个小时金刚烷胺的血药浓度不增加;和(v)cmax/cmin比为1.3至3.0。在一些实施方案中,符合(iv)和(v)两项标准。在一些实施方案中,所述组合物中金刚烷胺的体外溶出曲线表明以下标准中的至少一项(i)2小时时溶出度不超过25%,(ii)6小时时溶出度不超过55-85%,以及(iii)12小时时溶出度至少80%,以上溶出度是通过使用500ml水(37℃)作为溶出介质,并利用usp装置ii(桨法)以50rpm的转速测得的。在一些实施方案中,满足(i)、(ii)和(iii)中的两项标准。在一些实施方案中,满足(i)、(ii)和(iii)所有三项标准。在一些实施方案中,所述组合物中金刚烷胺的体外溶出曲线表明以下标准中的至少一项(i)2小时时溶出度不超过25%,(ii)6小时时溶出度不超过25-55%,以及(iii)12小时时溶出度至少80%,以上溶出度是通过使用500ml水(37℃)作为溶出介质,并利用usp装置ii(桨法)以50rpm的转速测得的。在一些实施方案中,满足(i)、(ii)和(iii)中的两项标准。在一些实施方案中,满足(i)、(ii)和(iii)所有三项标准。在一些实施方案中,所述组合物中金刚烷胺的体外溶出曲线表明以下标准中的至少一项(i)1小时时溶出度不超过20%,(ii)2小时时溶出度约25-45%,(iii)4小时时溶出度不超过50-80%,以及(iv)8小时时溶出度至少80%,以上溶出度是通过使用500ml水(37℃)作为溶出介质,并利用usp装置ii(桨法)以50rpm的转速测得的。在一些实施方案中,满足(i)、(ii)、(iii)和(iv)中的两项标准。在一些实施方案中,满足(i)、(ii)、(iii)和(iv)所有四项标准。在一些实施方案中,金刚烷胺的体外溶出曲线的特征还在于金刚烷胺的释放:(i)1小时时不超过10%,或者(ii)4小时时为30-50%,或者(iii)12小时至少90%,这是通过使用500ml水(37℃)作为溶出介质,并利用usp装置ii(桨法)以50rpm的转速测得的。在一些实施方案中,满足(i)、(ii)和(iii)中的两项标准。在一些实施方案中,满足(i)、(ii)和(iii)所有三项标准。在一些实施方案中,本发明提供了一种包含丸粒胶囊的组合物或由丸粒胶囊构成的组合物,其中各丸粒包含丸芯以及包裹该丸芯的缓释包衣,其中所述丸芯包含芯种,并且该芯种被由金刚烷胺和粘合剂形成的混合物包裹;所述缓释包衣包含乙基纤维素、成孔剂(例如,羟丙基甲基纤维素或者聚维酮)和增塑剂。在一些实施方案中,本发明提供了用于上述方面的方法的药物组合物,其中所述组合物用于口服施用并且包括用于口服施用的胶囊,所述胶囊包含多个丸粒,每个丸粒包含:(a)丸芯,其包含金刚烷胺或者其药学上可接受的盐,和(b)包裹所述丸芯的缓释包衣。在一些实施方案中,所述缓释包衣包含乙基纤维素,并且包含聚维酮和羟丙基甲基纤维素中的至少一者、以及增塑剂。在一些实施方案中,所述缓释包衣包含乙基纤维素、聚维酮和增塑剂。在一些实施方案中,所述丸芯包含包覆到芯种上的金刚烷胺和粘合剂。在一些实施方案中,所述芯种是糖球(nonpareil)或者微晶纤维素芯种(例如)。在一些实施方案中,所述芯种是微晶纤维素芯。在一些实施方案中,所述芯种的直径在100至1,000微米的范围内(例如,至少约95%具有这样的直径)。在一些实施方案中,所述芯种的直径为100、200、300、400、500、600或者700微米。在一些实施方案中,所述芯种的直径小于500微米(例如,至少约95%具有这样的直径)。在一些实施方案中,基于丸芯和缓释包衣的总重量,金刚烷胺或者其药学上可接受的盐的含量为20重量%至80重量%,其体积密度(bulkdensity)为0.3g/cm3至1.2g/cm3。在一些实施方案中,基于丸芯和缓释包衣的总重量,金刚烷胺或者其药学上可接受的盐的含量为40重量%至60重量%,其体积密度为0.5g/cm3至1.2g/cm3。在一些实施方案中,基于丸芯和缓释包衣的总重量,金刚烷胺或者其药学上可接受的盐的含量为60重量%至80重量%,其体积密度为0.5g/cm3至1.2g/cm3。在一些实施方案中,相对于丸芯和缓释包衣的总重量,所述粘合剂的含量为8重量%至25重量%。在一些实施方案中,相对于丸芯和缓释包衣的总重量,所述芯种的含量为8重量%至25重量%。在一些实施方案中,相对于丸芯和缓释包衣的总重量,所述乙基纤维素的含量为10重量%至20重量%。在一些实施方案中,相对于丸芯和缓释包衣的总重量,所述聚维酮的含量为1重量%至4重量%。在一些实施方案中,相对于丸芯和缓释包衣的总重量,所述增塑剂的含量为1重量%至4重量%。在一些实施方案中,所述包衣丸粒的直径在200微米至1700微米范围内。在一些实施方案中,所述包衣丸粒的直径为200、300、400、500、600、700、800、900、1000、1100、1200、1300或1500微米。在一些实施方案中,所述包衣丸粒的直径小于1000微米,例如,500至1000微米。在一些实施方案中,相对于丸芯和缓释包衣的总重量,所述粘合剂的含量为5重量%至25重量%。在一些实施方案中,相对于丸芯和缓释包衣的总重量,所述芯种的含量为1重量%至15重量%。在一些实施方案中,相对于丸芯和缓释包衣的总重量,所述乙基纤维素的含量为5重量%至20重量%。在一些实施方案中,相对于丸芯和缓释包衣的总重量,所述聚维酮的含量为0.25重量%至4重量%。在一些实施方案中,相对于丸芯和缓释包衣的总重量,所述增塑剂的含量为0.25重量%至4重量%。在一些实施方案中,所述丸粒还包含位于丸芯和缓释包衣之间的密封包衣。在一些实施方案中,可在药物包衣之前将惰性包衣施加于惰性丸芯上,或者将惰性包衣施加于药物包衣的丸粒(drugcoatedpellet)或者控释包衣的丸粒上。在另一实施方案中,可将肠溶包衣施加于药物包衣的丸粒上或者施加于控释丸粒上。在一个实施方案中,所述丸芯包含粘合剂,所述粘合剂选自由羟丙基甲基纤维素、共聚维酮以及它们的混合物构成的组。在一个实施方案中,上述组合物以尺寸为3号、2号、1号、0号或者00号的胶囊形式提供,包括这些胶囊尺寸的el形式。在一个实施方案中,每日治疗有效剂量的上述组合物以不超过两个胶囊的方式施用。在另一实施方案中,每日治疗有效剂量的所述组合物以不超过3个1号胶囊的方式施用。在另一实施方案中,每日治疗有效剂量的所述组合物以不超过2个0号胶囊的方式施用。在又一更优选的实施方案中,每日治疗有效剂量的所述组合物以不超过2个1号胶囊的方式施用。在另一实施方案中,每日治疗有效剂量的所述组合物以不超过3个2号胶囊的方式施用。在一个优选的实施方案中,将上述组合物制成金刚烷胺或者其药学上可接受的盐的含量为50至110mg的2号胶囊、以及金刚烷胺或者其药学上可接受的盐的含量为110至210mg的1号胶囊。在另外的实施方案中,上述组合物包含直径为300至1000微米的包衣丸粒,其中,金刚烷胺或者其药学上可接受的盐的含量(重量%)为40%至80%,其体积密度为0.5g/cm3至1.2g/cm3。在另一优选的实施方案中,上述组合物中金刚烷胺的体外溶出曲线显示出如下标准中的至少一项:(i)2小时的时候溶出度不超过25%;(ii)6小时的时候溶出度不超过55-85%;(iii)12小时的时候溶出度为至少80%;以上溶出度是通过使用500ml水(37℃)作为溶出介质,并利用usp装置ii(桨法)以50rpm的转速测得的。在一些实施方案中,满足(i)、(ii)和(iii)中的两项标准。在一些实施方案中,满足(i)、(ii)和(iii)所有三项标准。在一些实施方案中,增塑剂选自由中链甘油三酯、邻苯二甲酸二乙酯、柠檬酸酯、聚乙二醇、甘油、乙酰化甘油酯及蓖麻油构成的组。在一些实施方案中,所述增塑剂为中链甘油三酯,例如miglyol812n。另一方面,本发明提供一种对需要金刚烷胺的人类受试者施用金刚烷胺或者其药学上可接受的盐的方法,所述方法包括口服施用上述任意方面的组合物。在一个优选方面中,本发明提供了一种对需要接受治疗的人类受试者的疾病进行治疗的方法,所述方法包括每日于夜间口服施用一次上述任意方面的组合物,施用量为1、2或者3个胶囊。在一个优选方面中,本发明提供了一种对需要接受治疗的人类受试者的疾病进行治疗的方法,所述方法包括每日于晨间口服施用一次上述任意方面的组合物,施用量为1、2或者3个胶囊。关于对需要金刚烷胺的受试者施用金刚烷胺,其包括对这样的患者进行治疗,该患者罹患可通过nmda拮抗剂进行治疗、预防或者治愈的疾病或症状。更具体而言,将金刚烷胺给予有需要的受试者包括治疗患有脑损伤、脑外伤、中风(和与之相关的行走缺陷)、亨廷顿舞蹈病(和与之相关的舞蹈病)、als、多发性硬化(以及与之相关的步行问题))、神经变性疾病,脑血管疾病,运动障碍,颅神经障碍,图雷特氏综合征,迟发性运动障碍和其他cns疾病。本发明提供了治疗这些疾病和病症的方法。本文所述的一些实施方案提供了改善患者cgi的方法,其包括在就寝前0至4小时对所述患者施用包含260至420mg金刚烷胺或其药学上可接受的盐的组合物,以及至少一种释放调节赋形剂。在一些这样的实施方案中,该方法可用于治疗本文所述的障碍和病症。在一些实施方案中,所述组合物包含260mg至340mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物可以包含260mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物可以包含340mg金刚烷胺或其药学可接受的盐。在一些实施方案中,由安慰剂对照、双盲临床研究确定所述cgi的改变。附图说明图1示出了制剂1在单剂量、禁食、pk研究中(实施例4)金刚烷胺的平均(sd)血药浓度对预定时间的曲线。图2示出了在每晚一次施用多个剂量的不同含量的金刚烷胺er之后模拟的金刚烷胺的平均血药浓度对时间的曲线。(实施例5)图3示出了实施例7中所涉及的三种金刚烷胺er制剂a、b和c的溶出曲线。图4示出了四(4)种金刚烷胺治疗的平均(sd)血药浓度对预定时间的曲线。图5示出了四(4)种金刚烷胺治疗的半对数平均(sd)血药浓度对预定时间的曲线。图6示出了在motorater分析中所用的4个测试组的临床评分。(实施例9)。图7示出了在motorater分析中所用的4个测试组的累积临床评分的散布图。(实施例9)图8示出了由motorater分析中所用的4个测试组各自表现的iba-1的累积临床评分的散布图。(实施例9)图9示出了在27天研究期间各测试组中能够完成motorater步行测试的动物百分比的曲线图。(实施例9)图10a提供示出了在研究的第14天步行60厘米的时间的条形图。图10b示出了第14天每组的平均速度。具体实施方式在一个实施方案中,本发明的方法包括对患者口服施用缓释(er)金刚烷胺组合物,所述组合物被设计为夜间施用。该组合物在就寝前不到3小时的时候施用,优选的是在就寝前不到2.5小时、不到2小时、不到1.5小时或者不到1小时的时候施用。最优选的是,在就寝(即,受试者夜间希望入睡的时间)前不到半小时的时候施用所述er金刚烷胺组合物。或者,在就寝前不到约4小时的时候施用所述组合物。在一个实施方案中,本发明的方法包括对患者口服施用缓释(er)金刚烷胺组合物,所述组合物被设计为晨间施用。所述组合物在醒来后服用,优选在中午之前,更优选在6am至12pm、7am至12pm、8am至12pm、6am至11am、7am至11am之间的时间段内服用。在一个实施方案中,本发明的方法包括对患者口服施用速释金刚烷胺组合物,所述组合物每天施用一次、两次或三次。本文所指的金刚烷胺旨在包括其药学上可接受的盐(例如,盐酸金刚烷胺或者金刚烷胺硫酸盐等)。本文中所用的“缓释”包括:“控释”、“修饰释放”(modifiedrelease)、“持续释放”(sustainedrelease)、“定时释放”、“延释”,以及“延释”、“速释”、“肠溶包衣”等与以上各种方式的混合。患者可能被诊断为患有需要用金刚烷胺治疗的任何疾病或者失调。在一些实施方案中,本发明的方法用于预防本文所述的疾病和病症,例如当患者处于疾病和病症发展的风险时。在一些实施方案中,患者具有脑损伤、脑损伤、脑创伤、中风、亨廷顿病、als、多发性硬化、神经变性疾病、脑血管病、运动障碍、迟发性运动障碍、tourette综合征或颅神经障碍。本发明还提供一种减少接受金刚烷胺治疗的患者的睡眠障碍的方法。该方法包括向有需要的患者施用金刚烷胺,使得金刚烷胺不会干扰睡眠,还能在晨间为服用金刚烷胺的患者提供最大效用(通常晨间最需要)并且还在有必要的情况下为疾病症状提供夜间覆盖。夜间覆盖包括如果患者醒来并希望返回睡眠时提供效用。在一些所述方法中,c日间平均为c夜间平均的1.2至1.7倍;在优选的方法中,c日间平均在8am至8pm的时间段内测量,c夜间平均在8pm至8am的时间段内测量。在一些所述方法中,对处于禁食状态的人类健康志愿受试者群体口服施用单剂量的组合物以提供每毫克金刚烷胺1.1至2.2ng/ml的平均最大血药浓度(cmax)或者每毫克金刚烷胺46至56ng·h/ml的auc0-inf(由t=0至t=无穷大的浓度曲线下的面积)或者同时提供这二者。在一些所述方法中,对人类受试者群体每日口服施用组合物的剂量提供了稳态血药浓度分布,其特征在于以下标准中的至少一项:(i)每毫克金刚烷胺的平均cmax为2.2至3.0ng/ml,(ii)每毫克金刚烷胺的平均cmin为1.4至1.7ng/ml,和(iii)每毫克金刚烷胺的平均auc0-24为46至56ng·h/ml;在一些具体方法中,三项标准(i)、(ii)和(iii)全部满足。本发明中所用的缓释金刚烷胺组合物适宜夜间施用,其提供的血药浓度分布情况不会影响个体的睡眠。当对人类受试者施用本发明的组合物后,金刚烷胺的血药浓度在初始时平缓增长,使得在稳态条件下施用一剂该组合物会导致在施用后三小时的时候,金刚烷胺的血药浓度的增加量小于25%。例如,如果施用一剂所述组合物时,受试者的金刚烷胺稳态血药浓度为500ng/ml,则在3小时后,该受试者的金刚烷胺血药浓度小于625ng/ml。优选的是,施用3小时后金刚烷胺血药浓度的增加量小于15%,最优选的是,增加量小于10%。特别优选的组合物的血药浓度曲线特征还在于:在施用后至少1小时、或者2小时(优选实施方案)以内,金刚烷胺的血药浓度没有增加或者甚至降低(在稳态条件下)。本发明中所用的组合物还适宜于在就寝时间(即,受试者在夜间希望入睡的时间)施用,该组合物会在晨间提供最大的金刚烷胺浓度(cmax)。在一些实施方案中,空腹状态时施用单剂量的所述组合物后,测得达到cmax的时间(tmax)为至少9小时至最多13、14、15、16、17或18小时,或者为至少10小时至最多14、15、16、17或18小时,或者为至少12小时至最多14、15、16或17小时。在具体的实施方案中,tmax为9小时至18小时,最优选为12小时至18小时。在一些实施方案中,tmax为8至18小时。在稳态时,每日施用一次所述组合物,tmax为7小时至13小时,最优选为8小时至12小时。适宜的er金刚烷胺组合物的特征还可以在于:稳态时的cmax/cmin比值为1.3至3.0,优选为1.5至2.8,这样会使所述组合物的每天的分布表现出在白天或者清醒时段出现每日峰值,并且在夜间或睡眠时段出现低谷。优选的er金刚烷胺组合物在日间(例如9am至6pm、9am至5pm、9am至4pm、10am至6pm、10am至5pm、10am至4pm)提供稳态cmax的同时提供增加的昼夜变化,(即,增加的cmax/cmin比)。在更具体的优选实施方案中,血药浓度曲线的特征还在于,施用单剂量的所述组合物后得到具有如下特征的auc曲线:0至4小时的那部分auc小于auc0-inf的5%,优选为小于auc0-inf的3%;0至8小时的那部分auc为auc0-inf的约5%至15%,优选为auc0-inf的约8%-12%;0至12小时的那部分auc为auc0-inf的约10%-40%,优选为auc0-inf的约15%-30%;0至18小时的那部分auc为auc0-inf的约25%-60%,优选为auc0-inf的约30%-50%;0至24小时的那部分auc为auc0-inf的约40%-75%,优选为auc0-inf的约50%-70%。在进一步优选的实施方案中,血药浓度曲线的特征还在于,在稳态的条件下夜间施用一次所述组合物后得到具有如下特征的auc曲线:0-4小时的那部分auc为auc0-24的约2%至25%,优选为auc0-24的约5%至20%;0-8小时的那部分auc为auc0-24的约15%至50%,优选为auc0-24的约20%至40%;0-12小时的那部分auc为auc0-24的约30%至70%,优选为auc0-24的约40%至60%;0-18小时的那部分auc为auc0-24的约60%至95%,优选为auc0-24的约75%至90%。在上述任一方面的部分实施方案中,每天施用一次组合物的人类受试者在多次施用后的稳态血药浓度分布的特征在于,日间平均血药浓度(“c日间平均”,定义为通过人体pk研究而测得的日间金刚烷胺的平均血药浓度)是夜间平均血药浓度(“c夜间平均”,定义为通过人体pk研究而测得的夜间金刚烷胺的平均血药浓度)的1.1至2.0倍。在一些实施方案中,稳态时的c日间平均/c夜间平均的比值在下述范围之一内:1.1至1.9、1.1至1.8、1.1至1.7、1.1至1.6、1.1至1.5、1.1至1.4、1.2至1.9、1.2至1.7、1.2至1.6、1.2至1.5,1.3至1.9、1.3至1.8、1.3至1.7、1.3至1.6、1.4至1.9、1.4至1.8、1.4至1.7、1.5至1.9、1.5至1.8、1.5至1.7、1.6至1.8或1.6至1.9。在一些实施方案中,稳态时的c日间平均/c夜间平均的比值为1.1、1.15、1.2、1.25、1.3、1.35、1.4、1.45、1.5、1.55、1.6、1.65、1.7、1.75、1.8、1.85或1.9。在一些实施方案中,c日间平均是在5am、6am、7am、8am或9am至4pm、5pm、6pm、7pm或8pm之间测得的金刚烷胺的平均血药浓度;c夜间平均是在4pm、5pm、6pm、7pm、8pm、9pm、10pm或11pm至5am、6am、7am、8am或9am之间测得的金刚烷胺的平均血药浓度。在一些实施方案中,c日间平均是5am至8pm之间的任意4小时至12小时的时间段内测得的金刚烷胺的平均血药浓度;c夜间平均是在8pm至5am之间的任意4小时至12小时的时间段内测得的金刚烷胺的平均血药浓度。在一些实施方案中,c日间平均是在5am至8pm之间的任意4小时内、5小时内、6小时内、7小时内、8小时内、9小时内、10小时内、11小时内或者12小时内测得的金刚烷胺的平均血药浓度;c夜间平均是在8pm至5am之间的任意4小时内、5小时内、6小时内、7小时内、8小时内、9小时内、10小时内、11小时内或者12小时内测得的金刚烷胺的平均血药浓度。在部分实施方案中,所述金刚烷胺组合物在就寝时间之前0至4小时施用给患者。在一些实施方案中,金刚烷胺组合物在就寝时间之前0至3、0至2或者0至1小时施用给患者。在一些实施方案中,在就寝前0至240分钟、0至180分钟(例如,0至120分钟、0至60分钟、0至45分钟、0至30分钟、0至15分钟或者0至10分钟)的时候对患者施用金刚烷胺组合物。在一些实施方案中,在就寝前60至240分钟、60至180分钟、60至120分钟或者60至90分钟的时候对患者施用金刚烷胺组合物。应该理解的是,对患者施用金刚烷胺组合物包括医疗专家指导施用和患者自行施用。除非另外特别说明,否则术语“就寝时间”指的是通常意义上在24小时内某人上床进入主要睡眠期的时间。对于普通人而言,就寝时间是在夜间,而对于一些患者,比如夜间工作的人,他们的就寝时间是在日间。因此,在一些实施方案中,就寝时间可能是日间或者夜间的任意时间。除非另外说明,否则本文述及的个人的血药浓度曲线或者特定的药代动力学性质(例如,cmax、cmin、auc、tmax等)指的是在为测定药物的药代动力学性质而设计的典型i期临床试验阶段中,由健康成年人获得的平均值(例如参见下面的实施例2和3)。除非另外说明,否则本文中述及的tmax和t1/2指的是禁食状态下单剂量施用后获得的数值。在本发明的一些实施方案中,根据本发明的金刚烷胺施用剂量在通常的金刚烷胺速释组合物的医嘱范围内、或者超过该范围。在其他实施方案中,根据本发明的金刚烷胺的施用单位剂量通常高于常规的金刚烷胺速释组合物的医嘱范围。例如,金刚烷胺用于治疗帕金森病的推荐剂量是每日施用两次100mg的速释金刚烷胺。在上述施用剂量并没有使患者得到足够的益处、并且患者可以承受更高剂量的限制情况中,每日剂量可增加到300mg或者400mg,以分剂量的方式施用。本发明之前,金刚烷胺最常规的处方剂量是每天200mg,通常以分剂量施用。本发明之前,通常分剂量施用超过200mg(例如300mg)。对于本发明,施用260至420mg的剂量用于治疗ms和中风患者,并且本发明的方法和组合物可以包括每晚施用由以下任意范围限定的剂量,特别是260mg至420mg,最优选340mg,每晚一次施用。在一些这样的实施方案中,这种更高剂量的施用是在夜间,即4pm后和/或在就寝时间4小时内。在另外的实施方案中,这种较高剂量的施用可以是每晚一次施用正常或el形式的1个、2个或3个0号、1号或2号胶囊的形式。在上述任一方面的一些实施方案中,所述金刚烷胺以药学可接受的盐的形式施用。在更具体的实施方案中,所述金刚烷胺以盐酸金刚烷胺或硫酸金刚烷胺的形式施用。在上述任意方面的一些实施方案中,在4pm以后和/或在就寝时间4小时内每晚一剂施用260mg至420mg的总日剂量。在一些实施方案中,所施用的金刚烷胺或其药学上可接受的盐的单次夜间剂量超过每天300mg(例如,每天300至420mg)。在不同的具体实施方案中,金刚烷胺或其药学上可接受的盐的单次日间剂型或单次夜间剂型可以为50至75mg、70至95mg、90至115mg、110至135mg、130至155mg、150至175mg、170至195mg、190至215mg、210至235mg、230至255mg、250至275mg、260至275mg、270至285mg、280至295mg、290至305mg、300至315mg、310至325mg、320至335mg、330至345mg、340至355mg、350至365mg、360至375mg、370至385mg、380至395mg、390至405mg、400至415mg或者410至420mg。在一些优选实施方案中,金刚烷胺或其药学上可接受的盐的单次日间剂量或单次夜间剂量为260至360mg、300至360mg、330至350mg或340mg、430至445mg或者440至455mg。在上述任意方面的一些实施方案中,金刚烷胺或其药学上可接受的盐的单次日间或夜间组合物包含约260mg、265mg、270mg、275mg、280mg、285mg、290mg、295mg或300mg金刚烷胺或其药学上可接受的盐至约305mg、310mg、315mg、320mg、325mg、330mg、335mg、340mg、345mg、350mg、355mg、360mg、365mg、370mg、375mg、380mg、385mg、390mg、395mg、400mg、405mg、410mg、415mg或420mg金刚烷胺或其药学上可接受的盐。在本文所述的具体实施方案中(例如,当由单次剂量、禁食人员的pk研究所确定的制剂的平均tmax为8至18小时)时,在就寝时间(即4pm以后和/或受试者在夜间希望睡觉的时间)前少于约4小时、3小时、2小时或1小时一次性施用受试者全部日剂量的金刚烷胺。在本文所述的一些实施方案中(例如,当由单次剂量、禁食人员的pk研究所确定的制剂的平均tmax为5至11小时)时,可在晨间(例如,醒后不迟于12pm)一次性施用全部日剂量的金刚烷胺。在上述任意方面的一些实施方案中,将组合物施用于ms或中风患者,导致与疾病或病症相关的症状的显著减轻。在一些具体的实施方案中,组合物的施用导致ms或中风症状、或者运动波动减轻约5%,10%,15%,20%,25%,30%,35%或40%。在其他的具体实施方案中,ms或中风症状、或者运动波动的减轻是按照fda或其他监管机构使用或接受的数字量表进行测量的,以评估用于治疗ms或中风症状、或者运动波动的药物的治疗有效性和药物审批。本文所述的一些实施方案提供了一种用于改善临床医生总体印象而不增加患者的睡眠障碍的方法,其包括在每晚一次就寝时间前0至4小时对所述患者施用包含260至420mg金刚烷胺或其药学上可接受的盐(例如,盐酸金刚烷胺)的组合物,以及至少一种释放调节赋形剂。在一些所述方法中,金刚烷胺或其药学上可接受的盐的剂量为每天300至360mg,特别是每天330至350mg,并且尤其是每天340mg。本文所述的一些实施方案提供了一种用于改善临床医生的总体印象而不增加患者的睡眠障碍的方法,其包括每日一次对所述患者施用包含260至420mg金刚烷胺或其药学上可接受的盐(例如,盐酸金刚烷胺)的组合物,以及至少一种释放调节赋形剂。在一些所述方法中,金刚烷胺或其药学上可接受的盐的剂量为每天300至360mg,特别是每天330至350mg,并且尤其是每天340mg。在一些此类方法中,c日间平均为c夜间平均的1.2至1.7倍;在优选的方法中,c日间平均在9am至5pm的时间段内测量,c夜间平均在10pm至6am的时间段内测量。在一些所述方法中,对处于禁食状态的人类健康志愿受试者群体口服施用单剂量的组合物提供每毫克金刚烷胺1.4至2.8ng/ml的平均最大血药浓度(cmax)或者每毫克金刚烷胺46至56ng·h/ml的auc0-inf(由t=0至t=无穷大的浓度曲线下的面积)或者同时提供这二者。在一些所述方法中,对人类受试者群体每日口服施用组合物的剂量提供了稳态血药浓度分布,其特征在于以下标准中的至少一项:(i)每毫克金刚烷胺的平均cmax为2.2至2.9ng/ml,(ii)每毫克金刚烷胺的平均cmin为1.4至1.7ng/ml,和(iii)每毫克金刚烷胺的平均auc0-24为46至56ng·h/ml;在一些具体方法中,三项标准(i)、(ii)和(iii)全部满足。在上述任意方面的一些实施方案中,将组合物施用于患者,获得临床医生总体印象的显著改善。在一些具体实施方案中,采用7分制评估患者的临床医生总体印象时,组合物的施用导致约0.5、1.0、1.5、2.0、2.5或者3.0分的改善(或者采用不同标准时成比例的改善)。在其他的具体实施方案中,临床医生总体印象的改善是按照fda或其他监管机构使用或接受的数字量表进行测量的,以评估给患者的药物的治疗有效性和药物审批。在其他具体实施方案中,用于测量临床医生总体印象改善的量表可以是临床医生总体印象改变评估量表(cgic)。在其他具体实施方案中,临床医生总体印象改善的是在对照临床试验中相对于安慰剂测量的。在其他实施方案中,临床医生总体印象改善的是在对照临床试验中相对于基线测量的。在本发明的一个实施方案中,对具有步态异常的患者使用包含金刚烷胺和至少一种赋形剂的组合物。在某些实施方案中,将金刚烷胺或其药学上可接受的盐的速释制剂每天一次或两次施用于多发性硬化患者或中风后的患者,以提供步态改善。在一些这样的实施方案中,金刚烷胺或其药学上可接受的盐的日剂量为100mg至300mg。在某些实施方案中,待施用的组合物中的至少一种所述赋形剂是释放调节赋形剂。在某些实施方案中,待施用的组合物包含缓释形式的金刚烷胺或其药学可接受的盐。在一些这样的实施方案中,缓释形式的金刚烷胺或其药学上可接受的盐以每日一次口服施用,以提供步态异常患者的步态改善。在一些这样的实施方案中,步态异常与患者的多发性硬化或中风相关。在某些实施方案中,金刚烷胺或其药学上可接受的盐的日剂量为220mg至600mg、220mg至445mg、240mg至445mg、240mg至420mg、240mg至340mg。在一些实施方案中,金刚烷胺或其药学上可接受的盐的日剂量为260mg至420mg。在一些实施方案中,另外对所述患者口服施用选自4-氨基吡啶、巴氯芬、右美沙芬、富马酸二甲酯、芬戈莫德、哌醋甲酯和特立氟胺、四苯并嗪和替扎尼定构成的组(包括它们的药学上可接受的盐)中的一种或多种第二试剂。在某些实施方案中,第二试剂与金刚烷胺组合物分开提供。在某些实施方案中,第二试剂与金刚烷胺或其药学上可接受的盐在同一个组合物中提供。在某些实施方案中,第二试剂以控释形式提供。在一些实施方案中,第二试剂的总日剂量为第二试剂的批准产品标签中提供的总日剂量的25%、50%、75%、100%。在一些实施方案中,第二试剂与金刚烷胺或其药学上可接受的盐分开施用、相继施用或者同时施用。在某些实施方案中,具有行走障碍的患者在日间施用金刚烷胺提供了以下测试中至少一项的改善(相对于安慰剂):tug(定时起立和行走)、t25fw(定时25步行走测试)、或者6mwt(定时6分钟行走测试)、或者2分钟行走测试、或者msws-12(12项多发性硬化症步行量表)。在一些实施方案中,提供了一种改善受试者步态的方法,所述方法包括在晨间或夜间对所述患者口服施用一次这样的剂量,所述剂量包含(i)50mg至600mg选自由金刚烷胺及其药学可接受的盐构成的组中的药物,以及(ii)至少一种赋形剂(例如,其中所述剂量包含含有组分(i)和(ii)的组合物)。在一些实施方案中,所述组合物可以包含100mg至450mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物可以包含130至210mg金刚烷胺或其药学可接受的盐。在一些实施方案中,剂型包含这样的组合物,所述组合物包含50至75mg、70至95mg、90至115mg、110至135mg、130至155mg、150至175mg、170至195mg、190至215mg、210至235mg、230至255mg、250至275mg、270至295mg、290至305mg、300至315mg、310至325mg、320至335mg、330至345mg、340至355mg、350至365mg、360至375mg、370至385mg、380至395mg、390至405mg、400至415mg、410至425mg、420至435mg、430至445mg或440至455mg的金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物包含约110、120、130、140、150、160、170、180、190、210、220或340mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物包含110mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含130mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含170mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含210mg盐酸金刚烷胺。在一些实施方案中,所述人类受试者具有多发性硬化。在一些实施方案中,所述剂量额外地包含一种或多种选自4-氨基吡啶、巴氯芬、右美沙芬、富马酸二甲酯、芬戈莫德、哌醋甲酯和特立氟胺、四苯并嗪和替扎尼定的药物。在一些实施方案中,所述至少一种赋形剂是释放调节赋形剂。在一些实施方案中,所述赋形剂中的至少一种(或至少一种赋形剂)调节金刚烷胺或其药学上可接受的盐的释放以提供缓释形式,并且其中所述剂量的施用提供a)金刚烷胺tmax为5至18小时,b)每毫克金刚烷胺的cmax为1.0至2.8ng/ml,和c)由单剂量人类药代动力学研究测得每毫克金刚烷胺的auc0-inf为40至75ng·hr/ml。在一些实施方案中,金刚烷胺这样的剂量会造成在晨间或者下午出现金刚烷胺的血药峰浓度,而在夜间其血药浓度很低。在一些实施方案中,以缓释形式提供所述药物。在其他的具体实施方案中,在施用单剂量组合物后5、6、7、8、9、10、11或12小时至约9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小时之间(例如,施用后8小时至约18小时)达到金刚烷胺血药浓度峰值。在一些实施方案中,所述金刚烷胺组合物在就寝时间之前0至4小时施用给患者。在一些实施方案中,金刚烷胺组合物在就寝时间之前0至3、0至2、或0至1小时施用给患者。在一些实施方案中,在就寝时间之前0至240分钟、0至180分钟(例如,0至120分钟、0至60分钟、0至45分钟、0至30分钟、0至15分钟或者0至10分钟)的时候对患者施用金刚烷胺组合物。在一些实施方案中,在就寝时间之前60至240分钟、60至180分钟、60至120分钟或者60至90分钟的时候对患者施用金刚烷胺组合物。在本文所述的一些实施方案中,金刚烷胺组合物在晨间施用于患者;在更具体的实施方案中,金刚烷胺组合物在所述患者醒来之后但在醒来之后3、4、5或6小时内施用于所述患者。在本文所述的一些实施方案中,在患者在早晨醒来之后且12pm之前将金刚烷胺组合物施用于患者。在上述任意方面的一些实施方案中,将组合物施用于ms疾病受试者,使得ms疾病中步态障碍的显著减轻。在具体实施方案中,组合物的施用使得ms疾病中步态障碍减轻至少约5%、10%、15%、20%、25%、30%、35%或40%、45%、50%、55%或60%。在其他具体实施方案中,步态(或步态障碍)是按照fda或其他监管机构使用或接受的数字量表进行测量的,以评估用于治疗步态障碍的药物的治疗有效性和药物审批。在一些实施方案中,日间一次施用金刚烷胺组合物(或包含金刚烷胺的组合)提供了影响步态的运动功能减退性运动障碍例如步态障碍的改善。所述改善可以通过本领域已知的方法来确定,例如定时起立和行走(tug)、定时25步行测试(t25fw)或六分钟定时行走测试(6mtw)。在一些实施方案中,日间一次或晚间一次以不相等或优选相等的一个、两个、三个或四个单位剂型施用所述组合物。在一些更具体的实施方案中,以两个或三个单位剂型施用所述组合物,每个单位剂型各自包含85至175mg金刚烷胺或其药学上可接受的盐。在一些实施方案中,以两个单位剂型施用所述组合物,每个单位剂型各自包含100至175mg金刚烷胺或其药学上可接受的盐。在一些实施方案中,以不相等或优选相等的两个或三个单位剂型施用所述组合物,每个单位剂型各自包含85至250mg金刚烷胺或其药学上可接受的盐。在一些更具体的实施方案中,以两个单位剂型施用所述组合物,每个单位剂型各自包含150至180mg金刚烷胺或其药学上可接受的盐。在一些实施方案中,提供了一种改善人类受试者行走能力的方法,所述方法包括在日间或夜间对所述患者口服施用一次这样的剂量,所述剂量包含(i)50mg至600mg选自由金刚烷胺及其药学可接受的盐构成的组中的药物,以及(ii)至少一种赋形剂(例如,其中所述剂量包含含有组分(i)和(ii)的组合物)。在一些此类的实施方案中,所述方法治疗本文所限定的障碍和疾病。在一些实施方案中,所述组合物可以包含100mg至450mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物可以包含130至210mg金刚烷胺或其药学可接受的盐。在多个具体的实施方案中,剂型包含这样的组合物,所述组合物包含50至75mg、70至95mg、90至115mg、110至135mg、130至155mg、150至175mg、170至195mg、190至215mg、210至235mg、230至255mg、250至275mg、270至295mg、290至305mg、300至315mg、310至325mg、320至335mg、330至345mg、340至355mg、350至365mg、360至375mg、370至385mg、380至395mg、390至405mg、400至415mg、410至425mg、420至435mg、430至445mg或440至455mg的金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物包含约110、120、130、140、150、160、170、180、190、210、220或340mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物包含110mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含130mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含170mg盐酸金刚烷胺。在一些实施方案中,所述组合物包含210mg盐酸金刚烷胺。在一些实施方案中,所述人类受试者具有多发性硬化。在一些实施方案中,所述剂量额外地包含一种或多种选自4-氨基吡啶、巴氯芬、右美沙芬、富马酸二甲酯、芬戈莫德、哌醋甲酯和特立氟胺、四苯并嗪和替扎尼定的药物。在一些实施方案中,所述至少一种赋形剂是释放调节赋形剂。在一些实施方案中,所述赋形剂中的至少一种(或至少一种赋形剂)调节金刚烷胺或其药学上可接受的盐的释放以提供缓释形式,并且其中所述剂量的施用提供a)金刚烷胺tmax为5至18小时,b)每毫克金刚烷胺的cmax为1.0至2.8ng/ml,和c)由单剂量人类药代动力学研究测得每毫克金刚烷胺的auc0-inf为40至75ng·hr/ml。在一些实施方案中,金刚烷胺这样的剂量会造成在晨间或者下午出现金刚烷胺的血药峰浓度,而在夜间其血药浓度很低。在一些实施方案中,所述药物以缓释形式提供。在其他的具体实施方案中,在施用单剂量组合物后5、6、7、8、9、10、11或12小时至约9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小时之间(例如,给药后8小时至约18小时)达到金刚烷胺血药浓度峰值。在一些实施方案中,在施用单剂量组合物之后5至9小时、5至10小时、5至11小时、5至12小时、5至13小时、5至14小时、5至16小时、5至18小时、5至20小时、5至22小时、5至24小时、6至9小时、6至10小时、6至11小时、6至12小时、6至13小时、6至14小时、6至16小时、6至18小时、6至20小时、6至22小时、6至24小时、7至9小时、7至10小时、7至11小时、7至12小时、7至13小时、7至14小时、7至16小时、7至18小时、7至20小时、7至22小时、7至24小时、8至9小时、8至10小时、8至11小时、8至12小时、8至13小时、8至14小时、8至16小时、8至18小时、8至20小时、8至22小时、8至24小时、9至10小时、9至11小时、9至12小时、9至13小时、9至14小时、9至16小时、9至18小时、9至20小时、9至22小时、9至24小时、10至11小时、10至12小时、10至13小时、10至14小时、10至16小时、10至18小时、10至20小时、10至22小时、10至24小时、12至13小时、12至14小时、12至16小时、12至18小时、12至20小时、12至22小时或12至24小时之间达到金刚烷胺峰值血药浓度。在一些实施方案中,所述金刚烷胺组合物在就寝时间之前0至4小时施用给患者。在一些实施方案中,金刚烷胺组合物在就寝时间之前0至3、0至2或0至1小时施用给患者。在一些实施方案中,在就寝时间之前0至240分钟、0至180分钟(例如,0至120分钟、0至60分钟、0至45分钟、0至30分钟、0至15分钟或者0至10分钟)的时候对患者施用金刚烷胺组合物。在一些实施方案中,在就寝时间之前60至240分钟、60至180分钟、60至120分钟或者60至90分钟的时候对患者施用金刚烷胺组合物。在一些实施方案中,行走速度或能力通过以下方法中至少一种或其组合进行评估:定时25步行走测试(t25fw)、定时起立和行走(tug)、2分钟行走测试、和/或十二项多发性硬化症行走测量表(msws-12)。在一些实施方案中,受试者的行走显著改善。在一些实施方案中,改善了ms症状。在一些实施方案中,25fw、tug、2分钟行走和/或msws-12(相对于安慰剂)显著改善。在一些实施方案中,将组合物施用于ms疾病受试者使得ms疾病行走障碍的显著减轻。在具体实施方案中,组合物的施用使得ms疾病中行走障碍减轻至少约5%、10%、15%、20%、25%、30%、35%或40%、45%、50%、55%或60%。在具体实施方案中,组合物的施用使得ms疾病行走障碍减轻约5%、10%、15%、20%、25%、30%、35%或40%、45%、50%、55%或60%。在其他的具体实施方案中,减少行走障碍是按照fda或其他监管机构使用或接受的数字量表进行测量的,以评估用于治疗行走障碍的药物的治疗有效性和药物审批。在一些实施方案中,日间一次或晚间一次以不相等或优选相等的一个、两个、三个或四个单位剂型施用所述组合物。在一些更具体的实施方案中,以两个或三个单位剂型施用所述组合物,每个单位剂型各自包含85至175mg金刚烷胺或其药学上可接受的盐。在一些实施方案中,以两个单位剂型施用所述组合物,每个单位剂型各自包含100至175mg金刚烷胺或其药学上可接受的盐。在一些实施方案中,以不相等或优选相等的两个或三个单位剂型施用所述组合物,每个单位剂型各自包含85至250mg金刚烷胺或其药学上可接受的盐。在一些更具体的实施方案中,以两个单位剂型施用所述组合物,每个单位剂型各自包含150至180mg金刚烷胺或其药学上可接受的盐。缓释制剂本发明的方法中适合使用的缓释金刚烷胺组合物的制备可使用多种多样的缓释技术,例如上述背景部分所引用的专利文献中所述的那些技术,其全部内容以引用方式并入本文。在一些实施方案中,本发明为丸粒胶囊剂型。在一些实施方案中,所述丸粒包含丸芯,所述丸芯被至少一层药物层和至少一层缓释包衣层包裹。在一些实施方案中,所述丸粒被至少一层药物层、中间层(例如,密封包衣)和缓释包衣层包裹。在一些实施方案中,丸粒、药物层或这两者均包含一种或者多种粘合剂。在一些实施方案中,剂量单元包括多个包衣丸粒。在一些实施方案中,丸粒直径为(例如)300至1700微米,一些情况下为500至1200微米。丸粒包含(例如)惰性基质,例如糖球、微晶纤维素(mcc)球、淀粉丸粒。在一些实施方案中,可使用其他工艺制备丸粒,例如造粒法、挤出法、滚圆法等或者采用这些方法的组合。丸芯包含盐酸金刚烷胺以及药学上可接受的赋形剂。包衣丸粒所述丸芯包覆有活性成分,例如,金刚烷胺或者其药学上可接受的盐和/或其多晶型物。在一些实施方案中,除了活性成分外,所述丸粒还包含一种或者多种粘合剂,例如羟丙基甲基纤维素、共聚维酮、聚维酮、羟丙基纤维素、羟乙基纤维素、甲基纤维素、羧甲基纤维素等。在一些实施方案中,所述丸粒还包含一种或者多种其他赋形剂,比如防粘剂(例如,滑石粉、硬脂酸镁等)。在一些实施方案中,通过常规的包衣技术(例如,流化床包衣技术、锅包衣技术)将药物层包裹于丸芯上,所述药物层包含活性成分、可任选的一种或者多种粘合剂、防粘剂和/或溶剂。中间层包衣在一些实施方案中,所述丸粒由诸如密封包衣之类的中间层包裹。在一些实施方案中,所述密封包衣用来防止缓释包衣中的成分与丸芯中的成分相互反应,并防止丸芯中的成分由丸芯扩散到缓释层中,等等。如本文所述,本发明的密封包衣可包含一种或者多种成膜聚合物,所述成膜聚合物包括(但不限于)羟丙基甲基纤维素(hpmc)、共聚维酮、聚维酮、聚乙烯吡咯烷酮、羟丙基纤维素、羟乙基纤维素、甲基纤维素、羧甲基纤维素或者它们的任意组合等。所述密封包衣还可包含其他添加剂,例如增塑剂(例如,丙二醇、甘油三乙酸酯、聚乙二醇、柠檬酸三丁酯)及任选的防粘剂(例如,硬脂酸镁、硅酸钙、硅酸镁、胶态二氧化硅或者滑石粉)。除了上述的增塑剂和防粘剂外,密封包衣还可任选地包含缓冲剂、着色剂、遮光剂、表面活性剂或者碱,这些对本领域的技术人员来说是已知的。可使用常规的包衣技术(例如,流化床包衣技术、锅包衣技术等)将密封包衣施加于丸芯上。在一些实施方案中,通过流化床包衣或锅包衣操作将密封包衣层包裹在包覆有药物的丸芯上,其中所述密封包衣层可任选地包含一种或者多种粘合剂、防粘剂和/或溶剂。粘合剂在一些实施方案中,丸芯、中间包衣层或这两者可包含一种或者多种粘合剂(例如,成膜聚合物)。本发明中适合使用的粘合剂包括(例如):海藻酸及其盐;纤维素衍生物,例如,羧甲基纤维素、甲基纤维素(例如,)、羟丙基甲基纤维素、羟乙基纤维素、羟丙基纤维素(例如,)、乙基纤维素(例如,)、以及微晶纤维素(例如);微晶右旋糖;淀粉糖;硅酸镁铝;多糖酸;膨润土;明胶;聚乙烯吡咯烷酮/醋酸乙烯酯共聚物;交聚维酮;聚维酮;淀粉;预胶化淀粉;黄芪胶;糊精;糖,例如,蔗糖(例如)、葡萄糖、右旋糖、糖蜜、甘露醇、山梨醇、木糖醇(例如)及乳糖;天然或者合成的胶,例如阿拉伯树胶、黄芪胶、茄替胶、伊沙普尔皮粘胶(mucilageofisapolhusks)、聚乙烯吡咯烷酮(例如,)、落叶松阿拉伯半乳聚糖(larcharabogalactan)、聚乙二醇、蜡、海藻酸钠等。缓释包衣所述丸粒由缓释包衣包裹。所述缓释包衣适用于在将该剂型引入使用环境后,使得药物从具有包衣的药芯中的释放能延迟一段时间。在一些实施方案中,缓释包衣包含一种或多种ph依赖型或者非ph依赖型的缓释赋形剂。非ph依赖型的缓释聚合物的实例包括乙基纤维素、羟丙基甲基纤维素、羟乙基纤维素、羟丙基纤维素、羧甲基纤维素、丙烯酸乙酯和甲基丙烯酸甲酯的共聚物(例如eudgraitrs)等。ph依赖型的缓释赋形剂的实例包括甲基丙烯酸共聚物、醋酸羟丙基甲基纤维素琥珀酸酯、羟丙基甲基纤维素邻苯二甲酸酯、邻苯二甲酸醋酸纤维素等。缓释包衣还可包括:成孔剂,例如,聚维酮、聚乙二醇、羟丙基纤维素、羟丙基甲基纤维素等;糖,例如,蔗糖、甘露醇、乳糖;盐,例如,氯化钠、柠檬酸钠等;增塑剂,例如乙酰化柠檬酸酯、乙酰化甘油酯、蓖麻油、柠檬酸酯、癸二酸二丁酯、单硬脂酸甘油酯、邻苯二甲酸二乙酯、甘油、中链甘油三酸酯、丙二醇、聚乙二醇。所述缓释包衣也可包含一种或者多种其他赋形剂,例如,润滑剂(例如,硬脂酸镁、滑石等)。可使用常规的包衣技术(例如,流化床包衣技术、锅包衣技术等)来施加缓释包衣。通过流化床包衣操作将缓释包衣包裹于包覆有药物的丸芯上,其中所述包覆有药物的丸芯可任选地具有密封包衣。缓释赋形剂(包衣聚合物)如本文所述,示例性的缓释赋形剂包括(但不限于):不溶性塑料、亲水性聚合物以及脂肪族化合物。塑料材料的实例包括(但不限于):丙烯酸甲酯-甲基丙烯酸甲酯共聚物、聚氯乙烯和聚乙烯。亲水性聚合物包括(但不限于):纤维素聚合物,例如,甲基纤维素和乙基纤维素、羟烷基纤维素(例如,羟丙基纤维素、羟丙基甲基纤维素和羧甲基纤维素钠)、交联丙烯酸聚合物(例如,934)、聚环氧乙烷、以及它们的混合物。脂肪族化合物包括(但不限于):各种蜡(例如,巴西棕榈蜡和三硬脂酸甘油酯)、以及蜡类物质(包括氢化蓖麻油、氢化植物油或者它们的混合物)。在某些实施方案中,塑料物质可为药学上可接受的丙烯酸类聚合物,其包括(但不限于):丙烯酸和甲基丙烯酸的共聚物、甲基丙烯酸甲酯、甲基丙烯酸甲酯共聚物、甲基丙烯酸乙氧基乙酯、氰乙基甲基丙烯酸酯、甲基丙烯酸氨烷基酯共聚物、聚丙烯酸、聚甲基丙烯酸、甲基丙烯酸烷基胺共聚物、聚甲基丙烯酸甲酯、聚甲基丙烯酸(酐)、聚甲基丙烯酸酯、聚丙烯酰胺、聚甲基丙烯酸酐、甲基丙烯酸缩水甘油酯共聚物。在某些其他的实施方案中,所述丙烯酸类聚合物包括一种或者多种甲基丙烯酸铵酯共聚物。所述甲基丙烯酸铵酯共聚物在本领域是总所周知的,并在nfxvii中有所描述,其为具有低含量的季铵基团的丙烯酸酯和甲基丙烯酸酯的共聚物。在还一些实施方案中,所述丙烯酸类聚合物为丙烯酸树脂漆,比如rohmpharma公司市售的商品名为的丙烯酸树脂漆。在进一步的实施方案中,丙烯酸类聚合物包含rohmpharma公司市售的商品名分别为rl30d和rs30d的这两种丙烯酸树脂漆的混合物。rl30d和rs30d是具有低含量的季铵基团的甲基丙烯酸酯和丙烯酸酯的共聚物,在rl30d和rs30d中,季铵基团与其余的中性(甲基)丙烯酸酯的摩尔比分别为1:20(rl30d)和1:40(rs30d)。其平均分子量为约150,000。这里也适合使用s-100和l-100。代码rl(高渗透性)和rs(低渗透性)指的是这些试剂的渗透性能。rl/rs混合物不溶于水和消化液。然而,所形成的包含这种混合物的多元体系在水溶液和消化液中可溶胀且具有渗透性。上述聚合物(比如rl/rs)可以按照任意所需比例混合在一起,以使得最终得到的缓释制剂具有期望的溶出曲线。本领域的技术人员会认识到,也可以使用其他的丙烯酸类聚合物,比如l。成孔剂在一些实施方案中,所述缓释包衣包括成孔剂。所述缓释包衣中适用的成孔剂可为有机或者无机试剂,并包括在使用环境中可以溶解、可以从包衣中提取或者浸出的物质。所述成孔剂的实例包括(但不限于):有机化合物,比如单糖、寡糖和多糖(包括蔗糖、葡萄糖、果糖、甘露醇、甘露糖、半乳糖、乳糖、山梨醇、支链淀粉和葡聚糖);在使用环境中可以溶解的聚合物,比如水溶性的亲水性聚合物(例如,聚维酮、交联聚维酮、聚乙二醇、羟丙基纤维素、羟丙基甲基纤维素、羟烷基纤维素、羧烷基纤维素、纤维素醚、丙烯酸树脂、聚乙烯吡咯烷酮、交联聚乙烯吡咯烷酮、聚环氧乙烷、碳蜡、等);二元醇、多羟基化合物、多元醇、聚亚烷基二醇、聚乙二醇、聚丙二醇或者其嵌段聚合物、聚乙二醇、聚(α-ω)亚烷基二醇;无机化合物,比如碱金属盐、碳酸锂、氯化钠、溴化钠、氯化钾、硫酸钾、磷酸钾、乙酸钠、柠檬酸钠、合适的钙盐等。在某些实施方案中,增塑剂也可用作成孔剂。胶囊通过使用配有丸粒投配室(pelletdosingchamber)的胶囊机将缓释丸粒装入合适的胶囊中。胶囊尺寸可为00号、0号、0el号、1号、1el号、2号、2el号、3号、4号或者5号。能提供理想的药代动力学性质和血药浓度曲线的特别优选的组合物为丸粒胶囊组合物,其包含直径通常为大约500μm至1.2mm、优选为大约700μm至1000μm的多个丸粒,其中每个丸粒均包含丸芯和包裹该丸芯的缓释包衣,其中所述丸芯包含金刚烷胺和粘合剂,所述缓释包衣延长了金刚烷胺的释放时间,从而提供了所需药代动力学性质和金刚烷胺的血药浓度曲线。在一些实施方案中,丸粒胶囊中的丸粒被装在尺寸为0号或者更小的胶囊中,优选装在1号或者更小的胶囊中。在一些实施方案中,平均丸粒直径为500μm至1200μm,例如500μm至1100μm、500μm至1000μm、500μm至900μm、500μm至800μm、500μm至700μm、600μm至1100μm、600μm至1000μm、600μm至900μm、600μm至800μm、600μm至700μm、700μm至1100μm、700μm至1000μm、700μm至900μm或者700μm至800μm。在一些实施方案中,平均粒径例如为500μm、550μm、600μm、650μm、700μm、750μm、800μm、850μm、900μm、950μm、1000μm、1050μm、1100μm、1150μm或者1200μm,在±10%的范围内。本发明的一种优选的组合物为丸粒胶囊组合物,其中各丸粒包含丸芯以及包裹该丸芯的缓释包衣,其中所述丸芯包含芯种,并且该芯种被由金刚烷胺和粘合剂形成的混合物包裹;所述缓释包衣包含乙基纤维素、成孔剂(例如,羟丙基甲基纤维素或者聚维酮)和增塑剂。在一些实施方案中,所述丸粒还包含位于丸芯和缓释包衣之间的密封包衣。所述丸粒由本领域已知的方法制成,例如下面实施例1中所述的方法。在具体的实施方案中,相对于所述丸芯和缓释包衣的总重量,金刚烷胺的含量为20重量%至80重量%、45重量%至70重量%、40重量%至50重量%、45重量%至55重量%、50重量%至60重量%、55重量%至65重量%、60重量%至70重量%、65重量%至75重量%、70重量%至80重量%、或者40重量%至60重量%;粘合剂(优选为羟丙基甲基纤维素、聚维酮或者它们的混合物)的含量为1重量%至25重量%;芯种(优选为糖球(nonpareil)或者微晶纤维素芯种(例如,))的含量为8重量%至25重量%;乙基纤维素的含量为10重量%至20重量%;成孔剂(优选为聚维酮)的含量为1重量%至4重量%;增塑剂的含量为1重量%至4重量%。在另一具体实施方案中,相对于丸芯和缓释包衣的总重量,金刚烷胺的含量为50重量%至70重量%;粘合剂(优选为羟丙基甲基纤维素、共聚维酮或者其混合物)的含量为1重量%至25重量%;芯种(优选为糖球(nonpareil)或者微晶纤维素芯种(例如,))的含量为5重量%至15重量%;乙基纤维素的含量为1重量%至15重量%;成孔剂(优选为聚维酮)的含量为0.25重量%至4重量%;增塑剂的含量为0.25重量%至4重量%。本发明的其他实施方案列举在下文的标题为“不同的金刚烷胺缓释胶囊1号制剂”的表格中。通过本文描述的方法和组合物,可制得具有本文所述的期望的溶出特性和目标药代动力学曲线的制剂。更具体地说,治疗有效剂量的金刚烷胺可以以如下方式施用来达到这些效果,所述方式为:每日一次,不超过2粒尺寸为1号(或者更小尺寸,例如2号或者3号)的使用本文所述的制造方法和组合物制备的胶囊。特别是,使用本文所述的制造方法和组合物可实现较高的载药量。在一些实施方案中,使用较小尺寸的丸芯以及在较小的丸芯上叠加层数增加的药层,而不改变缓释包衣,可实现较高的载药量以及所需的溶出曲线。在一些实施方案中,使用本文描述的其他制造方法(例如,挤出法和滚圆法),甚至可达到更高的载药量,由此实现所期望的溶出曲线,从而能够获得高的金刚烷胺载药量及合适的药代动力学曲线,由此使所述组合物的治疗效果更有效,并且至少也可被耐受,并且可以被装进相对较小尺寸的胶囊(例如,1号、2号或者3号胶囊)中,从而使患者容易服用。表1:不同的金刚烷胺er胶囊1号制剂在一些实施方案中,金刚烷胺或其药学可接受的盐以20至80wt%的含量存在(基于丸芯和缓释包衣的总重),体积密度为0.3至1.2g/cm3。在一些实施方案中,金刚烷胺或其药学可接受的盐以20至77.5wt%、20至75wt%、20至72.5wt%、20至70wt%、20至67.5wt%、20至65wt%、20至62.5wt%、20至60wt%、20至57.5wt%、20至55wt%、20至52.5wt%、20至50wt%、20至47.5wt%、20至45wt%、20至42.5wt%、20至40wt%、20至37.5wt%、20至35wt%、20至32.5wt%、20至30wt%、30至80wt%、30至77.5wt%、30至75wt%、30至72.5wt%、30至70wt%、30至67.5wt%、30至65wt%、30至62.5wt%、30至60wt%、30至57.5wt%、30至55wt%、30至52.5wt%、30至50wt%、30至47.5wt%、30至45wt%、30至42.5wt%、30至40wt%、40至80wt%、40至77.5wt%、40至75wt%、40至72.5wt%、40至70wt%、40至67.5wt%、40至65wt%、40至62.5wt%、40至60wt%、40至57.5wt%、40至55wt%、40至52.5wt%、40至50wt%、40至47.5wt%、40至45wt%、50至80wt%、50至77.5wt%、50至75wt%、50至72.5wt%、50至70wt%、50至67.5wt%、50至65wt%、50至62.5wt%、50至60wt%、50至57.5wt%、50至55wt%、60至80wt%、60至77.5wt%、60至75wt%、60至72.5wt%、60至70wt%、60至67.5wt%、60至65wt%。在一些实施方案中,所述体积密度为0.3至1.2g/cm3、0.3至1.15g/cm3、0.3至1.1g/cm3、0.3至1.05g/cm3、0.3至1.0g/cm3、0.3至0.9g/cm3、0.3至0.8g/cm3、0.3至0.7g/cm3、0.3至0.6g/cm3、0.3至0.5g/cm3、0.3至0.4g/cm3、0.4至1.2g/cm3、0.4至1.15g/cm3、0.4至1.1g/cm3、0.4至1.05g/cm3、0.4至1.0g/cm3、0.4至0.9g/cm3、0.4至0.8g/cm3、0.4至0.7g/cm3、0.4至0.6g/cm3、0.4至0.5g/cm3、0.5至1.2g/cm3、0.5至1.15g/cm3、0.5至1.1g/cm3、0.5至1.05g/cm3、0.5至1.0g/cm3、0.5至0.9g/cm3、0.5至0.8g/cm3、0.5至0.7g/cm3、0.5至0.6g/cm3、0.6至1.2g/cm3、0.6至1.15g/cm3、0.6至1.1g/cm3、0.6至1.05g/cm3、0.6至1.0g/cm3、0.6至0.9g/cm3、0.6至0.8g/cm3、0.6至0.7g/cm3、0.7至1.2g/cm3、0.7至1.15g/cm3、0.7至1.1g/cm3、0.7至1.05g/cm3、0.7至1.0g/cm3、0.7至0.9g/cm3、0.7至0.8g/cm3、0.5至1.2g/cm3、0.8至1.15g/cm3、0.8至1.1g/cm3、0.8至1.05g/cm3、0.8至1.0g/cm3、0.8至0.9g/cm3、0.9至1.2g/cm3、0.9至1.15g/cm3、0.9至1.1g/cm3、0.9至1.05g/cm3或0.9至1.0g/cm3。在一些实施方案中,所述组合物在剂量单元中包含丸粒胶囊制剂,其中胶囊尺寸为00号、0号、1号、2号或者3号。在一些优选的实施方案中,所述剂量单元包含装在0号、1号、2号或者3号胶囊中的、含有50mg至250mg金刚烷胺的丸粒。在一些实施方案中,所述剂量单元包含装在0号、1号、2号或者3号胶囊(优选装在1号、2号或者3号胶囊)中的、含有100mg至250mg(例如,100-200mg)金刚烷胺的丸粒。在一些实施方案中,所述剂量单位包含约110、120、130、140、150、160170、180、190、210或220mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述剂量单位包含110mg盐酸金刚烷胺。在一些实施方案中,所述剂量单位包含130mg盐酸金刚烷胺。在一些实施方案中,所述剂量单位包含170mg盐酸金刚烷胺。在一些实施方案中,所述剂量单位包含210mg盐酸金刚烷胺。合适的增塑剂包括中链甘油三酯、邻苯二甲酸二乙酯、柠檬酸酯、聚乙二醇、甘油、乙酰化甘油酯、蓖麻油等。所述丸粒被装进胶囊中以提供所需规格含量的金刚烷胺。所述组合物的一个优点在于其提供了期望的释放性能,使得所述组合物适合在就寝时间之前的所述时间段内施用。另一个优点在于所述缓释包衣具有足够的耐久性,从而使得可以打开胶囊并将丸粒撒在食物上,以供吞咽药丸有困难的患者施用,而不会不利地影响所述组合物的释放性能。当所述组合物被撒在食物上施用时,优选的是使用软质食物,比如苹果酱或者巧克力布丁,并在30分钟内食用完毕,优选的是在15分钟内食用完毕。上述组合物的又一优点在于其具有良好的批间重现性和储存稳定性。在其他的实施方案中,在1号胶囊中装有110mg至210mg的缓释金刚烷胺,本发明组合物中的金刚烷胺的体外溶出曲线在2小时的时候溶出度不超过25%,6小时的时候溶出度为55-85%,12小时的时候溶出度为至少80%,以上溶出度是通过使用500ml水(37℃)作为溶出介质,并利用usp装置ii(桨法)以50rpm的转速测得的。更优选的是,体外溶出度的特征还在于:金刚烷胺在1小时的时候释放率不超过10%,4小时的时候释放率为30-50%,12小时的时候释放率为至少90%。在一些实施方案中,所述组合物中金刚烷胺的体外溶出曲线表明以下标准中的至少一项(i)2小时时溶出度不超过25%,(ii)6小时时溶出度不超过25-55%,以及(iii)12小时时溶出度至少80%,以上溶出度是通过使用500ml水(37℃)作为溶出介质,并利用usp装置ii(桨法)以50rpm的转速测得的。在一些实施方案中,满足(i)、(ii)和(iii)中的两项标准。在一些实施方案中,满足(i)、(ii)和(iii)所有三项标准。在在上述任意方面的一些实施方案中,所述组合物中金刚烷胺的体外溶出曲线显示出如下标准中的至少一者:(i)1小时时溶出度不超过20%;(ii)2小时时溶出度为大约25-45%;(iii)4小时时溶出度不超过50%-80%;和(iii)8小时时溶出度为至少80%,以上溶出度是通过使用500ml水(37℃)作为溶出介质,并利用usp装置ii(桨法)以50rpm的转速测得的。在一些实施方案中,满足(i)、(ii)和(iii)中的两项标准。在一些实施方案中,满足(i)、(ii)和(iii)所有三项标准。在上述任一方面的一些实施方案中,上述组合物中金刚烷胺的体外溶出曲线表明以下标准中的至少一项(i)2小时时溶出度约35-55%,(ii)4小时时溶出度不超过60-80%,以及(iii)8小时时溶出度至少90%,以上溶出度是通过使用500ml水(37℃)作为溶出介质,并利用usp装置ii(桨法)以50rpm的转速测得的。在一些实施方案中,满足(i)、(ii)和(iii)中的两项标准。在一些实施方案中,满足(i)、(ii)和(iii)所有三项标准。本发明的优选的丸粒胶囊组合物具有上述体外溶出性质和上述任意的药代动力学性质(例如,体外释放曲线、tmax、cmax/cmin比值等),使得所述组合物适合在就寝时间之前的所述时间段内施用。除此之外,所述组合物的特征还在于:在人类受试者禁食状态下口服施用单剂量的胶囊后,每毫克金刚烷胺的cmax为1.6-2.4ng/ml,每毫克金刚烷胺的auc0-inf为40-75ng·h/ml。优选的丸粒胶囊组合物的特征还在于:人类受试者每日一次口服施用所述胶囊后,在稳态血药浓度下,每毫克金刚烷胺的cmax为2.4-4.2ng/ml,每毫克金刚烷胺的cmin为1.1-2.6ng/ml,每毫克金刚烷胺的auc0-24为48-73ng·h/ml。上述丸粒胶囊组合物可以适合金刚烷胺治疗的规格含量(strength)来提供。典型的规格含量范围为至少约50mg至约250mg。在具体的实施方案中,胶囊规格含量为70mg、80mg、85mg、90mg、110mg、120mg、125mg、130mg、140mg、150mg、160mg、160mg、170mg、180mg、190mg、210mg和220mg,使得单剂量auc0-inf/毫克相当于100mg的速释盐酸金刚烷胺药片(例如,或者其他的fda橘皮书(fdaorangebook)中的参考目录药物)。受试者可在就寝时间之前的所述时间段内服用1个、2个或者3个这样的胶囊。在优选的实施方案中,每日一次施用2个适合的缓释剂型的胶囊,其中所施用的金刚烷胺的量为220mg至650mg。其他缓释剂型本领域技术人员应当认识到,除了上述胶囊制剂之外,还可以想到缓释组合物的其他实施方案。这样的其他实施方案包括缓释的固体剂型,例如片剂、胶囊、凝胶帽、粉末、丸剂、微粒等。包括在这种缓释组合物中是可以用于本发明的具有释放特性和体内药代动力学特征的物质。在一些实施方案中,本领域技术人员可以采用guittard等人的美国专利no.5,358,721、edgren等人的美国专利no.6,217,905、vergez等人的美国专利no.8,574,626中描述的缓释技术,并对设计特征加以适当调整以实现本文所必需的药代动力学特征,上述专利分别公开了金刚烷胺的口服渗透剂型,其全部内容通过引用的方式并入本文。在其他实施方案中,本领域技术人员还可以采用smith等人的美国专利no.6,194,000、went等人的美国专利no.8,741,343或者专利申请公开no.us2006/0252788、us2006/0189694、us2006/0142398、us2008/0227743、us2011/0189273、us2015/0045446、us2015/0051292或us2014/0242163中所述的技术,并对设计特征加以适当的调整,上述文献分别公开了任选以控释形式施用nmda受体拮抗剂(例如金刚烷胺),其全部内容通过引用的方式并入本文。本发明的一些实施方案包括如下编号的实施方案:1.一种改善人类受试者步态的方法,其包括每日一次对所述患者口服施用这样的剂量,所述剂量包含(i)220mg至600mg选自由金刚烷胺及其药学可接受的盐构成的组中的药物,以及(ii)至少一种赋形剂(例如,其中所述剂量包含含有组分(i)和(ii)的组合物)。2.一种治疗人类受试者运动功能减退性运动障碍的方法,其包括每日一次对所述患者口服施用这样的剂量,所述剂量包含(i)220mg至600mg选自由金刚烷胺及其药学可接受的盐构成的组中的药物,以及(ii)至少一种赋形剂(例如,其中所述剂量包含含有组分(i)和(ii)的组合物)。3.实施方案1或2中任一项的方法,其中所述人类受试者罹患多发性硬化症。4.实施方案1或2中任一项的方法,其中所述人类受试者得过中风。5.实施方案1至4中任一项的方法,其中所述剂量额外地包含选自由4-氨基吡啶、巴氯芬、右美沙芬、富马酸二甲酯、芬戈莫德、哌醋甲酯和特立氟胺、四苯并嗪和替扎尼定构成的组中一种或多种药物。6.实施方案1至5中任一项的方法,其中至少一种赋形剂为释放调节赋形剂。7.实施方案1至6中任一项的方法,其中所述赋形剂中的至少一种调节金刚烷胺或其药学上可接受的盐的释放以提供缓释形式,并且其中所述剂量的施用提供a)金刚烷胺tmax为5至18小时,b)每毫克金刚烷胺的cmax为1.0至2.8ng/ml,和c)由单剂量、禁食、人类药代动力学研究测得每毫克金刚烷胺的auc0-inf为40至75ng·hr/ml。8.实施方案6的方法,其中所述药物以缓释形式提供。9.一种剂量的用途,该剂量包含(i)220mg至600mg选自由金刚烷胺和其药学上可接受的盐构成的组中的药物以及(ii)至少一种的赋形剂,该剂量用于上述任意实施方案的方法(例如,其中所述剂量包含含有组分(i)和(ii)的组合物)。10.一种剂量,其包含(i)220mg至600mg选自由金刚烷胺和其药学上可接受的盐构成的组中的药物以及(ii)至少一种的赋形剂,用于实施方案1-8中任意的方法(例如,其中所述剂量包含含有组分(i)和(ii)的组合物)。11.一种改善罹患cns障碍的患者的cgi的方法,其包括日间一次对所述患者施用组合物,该组合物包含260mg至420mg金刚烷胺或其药学上可接受的盐以及至少一种释放调节赋形剂。12.一种方法,其包括日间一次向有需要的患者施用260mg至340mg剂量的金刚烷胺或其药学上可接受的盐,而不增加失眠。13.一种方法,其包括日间一次向有需要的患者施用260mg至340mg剂量的金刚烷胺或其药学上可接受的盐,而不增加失睡眠障碍。14.实施方案1-4、6-8和11中任一项的方法,其中所述组合物包含260mg至340mg的金刚烷胺或其药学上可接受的盐。15.实施方案1-8和11-14中任一项的方法,其中所述组合物包含260mg的金刚烷胺或其药学上可接受的盐。16.实施方案1-8和11-14中任一项的方法,其中所述组合物包含340mg的金刚烷胺或其药学上可接受的盐。17.实施方案1-8或11中任一项的方法,其中所述方法不增加失眠。18.实施方案1-8或11中任一项的方法,其中所述方法不增加睡眠障碍。19.一种日间一次施用包含治疗有效量的、选自金刚烷胺及其药学上可接受的盐的药物和至少一种释放调节赋形剂的剂型的方法,其中所述方法包括,向所述患者施用减量药物至少一周的时间,之后立即在日间一次施用包含治疗有效量的药物的剂型。20.实施方案19的方法,其中所述治疗有效量的药物包含260mg至420mg的金刚烷胺或其药学上可接受的盐。21.实施方案19的方法,其中所述治疗有效量的药物包含260mg至340mg的金刚烷胺或其药学上可接受的盐。22.实施方案19的方法,其中所述治疗有效量的药物包含260mg的金刚烷胺或其药学上可接受的盐。23.实施方案19的方法,其中所述治疗有效量的药物包含340mg的金刚烷胺或其药学上可接受的盐。24.实施方案1-8或11-23的方法,其中所述组合物在就寝时间之前0至4小时内施用。25.实施方案1-8或11-24的方法,其中c日间平均是c夜间平均的1.4至1.7倍。26.实施方案1-8或11至25中任一项的方法,其中将单次剂量的组合物施用于禁食状态的群体或人类健康志愿受试者提供了每毫克金刚烷胺1.1至1.7ng/ml的平均cmax或每毫克金刚烷胺46至56ng·h/ml的auc0-inf。27.实施方案1-8或11至26中任一项的方法,其中日间一次口服施用所述组合物的剂量为人类受试者提供了稳态血药浓度分布,其特征在于以下内容中的至少一个:(i)每毫克金刚烷胺的平均cmax为2.2至2.7ng/ml,(ii)每毫克金刚烷胺的平均cmin为1.4至1.7ng/ml,和(iii)每毫克金刚烷胺的平均auc0-24为46至56ng·h/ml。28.实施方案11的方法,其中在安慰剂对照、双盲临床研究中测定所述cgi的改善。29.金刚烷胺或其药学上可接受的盐在制备用于治疗由nmda受体调节的疾病的药物中的用途,以用于有需要的受试者,所述药物为缓释(er)组合物,并且所述治疗包括在就寝时间(即受试者在夜间希望睡觉的时间)之前少于三小时口服施用所述组合物。30.金刚烷胺或其药学上可接受的盐在制备用于减少使用金刚烷胺治疗的人类受试者的睡眠障碍的药物中的用途,以用于有需要的受试者,所述药物为缓释(er)组合物,并且适于在就寝时间(即,受试者在夜间希望睡觉的时间)之前少于三小时施用。31.实施方案29或30中任一项的用途或组合物,其中所述施用在就寝时间之前少于1小时内进行。32.实施方案29-31中任一项的用途或组合物,其中夜间一次施用所述组合物。33.实施方案29-32中任一项的用途或组合物,其中在施用前将所述组合物添加至食物中。34.实施方案29-33中任一项的用途或组合物,其中稳态下在施用之后至少1小时内金刚烷胺的血药浓度没有增加。35.实施方案29-34中任一项的用途或组合物,其中稳态下在施用之后至少2小时内金刚烷胺的血药浓度没有增加。36.实施方案29-35中任一项的用途或组合物,其中金刚烷胺的单剂量tmax为9至18小时,和/或稳态tmax为7至13小时。37.实施方案29-36中任一项的用途或组合物,其中金刚烷胺的单剂量tmax为施用后12至18小时,和/或稳态tmax为8至12小时。38.实施方案29-37中任一项的用途或组合物,其中晚间一次对人类受试者口服施用所述组合物提供了稳态血药浓度分布,其特征在于施用三小时后金刚烷胺浓度的增加少于25%。39.实施方案29-38中任一项的用途或组合物,其cmax/cmin比为1.3至3.0。40.实施方案29-38中任一项的用途或组合物,其cmax/cmin比为1.4至2.6。41.实施方案29-40中任一项的用途或组合物,其中所述金刚烷胺为盐酸金刚烷胺或金刚烷胺硫酸盐。42.任意实施方案中的用途或组合物,其中所述组合物包含260mg至420mg金刚烷胺或其药学上可接受的盐。43.实施方案47的用途或组合物,其中以一个、两个、或者三个或者四个单位剂型施用所述组合物,每个单位剂型各自包含85至175mg金刚烷胺或其药学上可接受的盐。44.实施方案33-48中任一项的用途或组合物,其中所述组合物包含260mg至420mg金刚烷胺或其药学上可接受的盐。45.实施方案49的用途或组合物,其中以两个单位剂型施用所述组合物,每个单位剂型各自包含85至175mg金刚烷胺或其药学上可接受的盐。46.实施方案33至50中任一项的用途或组合物,其中所述组合物包含50mg至200mg金刚烷胺或其药学上可接受的盐。47.实施方案33-51中任一项的用途或组合物,其中将单剂量的组合物施用于禁食状态的人类受试者提供了每毫克金刚烷胺1.1至2.8ng/ml的金刚烷胺最大血药浓度(cmax)和每毫克金刚烷胺46至60ng·h/ml的auc0-inf。48.实施方案29-47中任一项的用途或组合物,其中对人类受试者(或者健康的人类受试者群体)日间一次口服施用一剂所述组合物提供金刚烷胺稳态血药浓度分布,其特征在于:(i)每毫克金刚烷胺的cmax为2.2至2.7ng/ml,(ii)每毫克金刚烷胺的cmin为1.4至1.7ng/ml,以及(iii)每毫克金刚烷胺的auc0-24为46至56ng·h/ml。49.实施方案48的组合物或用途,其中所述稳态血药浓度分布的特征还在于:(iv)在施用后至少1小时内金刚烷胺的血药浓度不增加;以及(v)cmax/cmin比为1.3至3.0。50.实施方案48的组合物或用途,其中所述稳态血药浓度分布的特征还在于:(iv)在施用后至少2小时内金刚烷胺的血药浓度不增加;以及(v)cmax/cmin比为1.4至2.6。51.实施方案29-50中任一项的用途,其中施用单剂量的所述组合物后得到具有如下特征的auc曲线:0至4小时部分的auc小于auc0-inf的5%;0至8小时部分的auc为auc0-inf的约5%至15%;0至12小时部分的auc为auc0-inf的约10%至40%;0至18小时部分的auc为auc0-inf的约25%至60%;0至24小时部分的auc为auc0-inf的约40%至75%。52.实施方案29-51中任一项的用途,其中稳态条件下日间一次施用所述组合物后,所述组合物具备有如下特征的auc曲线:0至4小时部分的auc为auc24的约2%至25%;0至8小时部分的auc为auc24的约15%至50%;0至12小时部分的auc为auc24的约30%至70%;0至18小时部分的auc为auc24的约60%至95%。本文的一些实施方案提供了一种对有需要的受试者夜间一次施用金刚烷胺(或其药学上可接受的盐,例如盐酸金刚烷胺),所述方法包括在就寝时间之前少于4个小时(和/或4pm之后)口服施用含有金刚烷胺或其药学上可接受的盐的缓释(er)组合物。在一些实施方案中,在就寝时间之前少于4个小时的时候进行施用。在一些实施方案中,所述方法改善了临床医生总体印象,并且不导致或增加患者的睡眠障碍。在一些实施方案中,在施用前将所述组合物添加至食物中。在一些实施方案中,在施用后至少1小时内金刚烷胺的血药浓度不增加。在一些实施方案中,在施用后至少2小时内金刚烷胺的血药浓度不增加。在一些实施方案中,金刚烷胺的单剂量tmax为9至18小时,和/或稳态tmax为7至13小时。在一些实施方案中,金刚烷胺的单剂量tmax为施用后12至18小时,和/或稳态tmax为8至12小时。在一些实施方案中,金刚烷胺的单剂量tmax为施用后12至16小时,和/或稳态tmax为9至12小时。在一些实施方案中,每晚一次对人类受试者口服施用所述组合物提供了稳态血药浓度分布,其特征在于施用三小时后金刚烷胺浓度的增加少于25%。在一些实施方案中,所述pk曲线的cmax/cmin比为1.3至3.0。在一些实施方案中,稳态下的c日间平均/c夜间平均比为1.4至1.7。在一些实施方案中,稳态下白天时金刚烷胺的平均血药浓度(c日间平均)为500至2000ng/ml。在一些实施方案中,所述金刚烷胺为盐酸金刚烷胺或硫酸金刚烷胺。在一些实施方案中,所述组合物包含260mg至420mg金刚烷胺或其药学可接受的盐。在一些实施方案中,以两个、或者三个或者四个单位剂型施用所述组合物,每个单位剂型各自包含85至175mg金刚烷胺或其药学上可接受的盐。在一些实施方案中,以两个单位剂型施用所述组合物,每个单位剂型各自包含130至210mg缓释金刚烷胺或其药学上可接受的盐。在一些实施方案中,组合物处于#1号胶囊中。在一些实施方案中,所述组合物可以包含260mg至340mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物可以包含340mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物包含170mg盐酸金刚烷胺。在一些实施方案中,将单剂量的组合物施用于禁食状态的人类受试者提供了每毫克金刚烷胺1.1至1.7ng/ml的最大血药浓度(cmax)并且每毫克金刚烷胺46至56ng·h/ml的auc0-inf。在一些实施方案中,对人类受试者夜间一次口服施用一剂组合物提供了具有如下特征的稳态血药浓度分布:(a)每毫克金刚烷胺的cmax为2.0至3.1ng/ml,(b)每毫克金刚烷胺的cmin为1.3至2.0ng/ml,和(iii)每毫克金刚烷胺的auc0-24为46至56ng·h/ml。在一些实施方案中,稳态血药浓度分布的特征还在于:(d)给药后至少1小时内金刚烷胺的血药浓度不增加;和(e)cmax/cmin比为1.3至3.0。在一些实施方案中,稳态血药浓度分布的特征还在于:(f)给药后至少2小时金刚烷胺的浓度不增加;和(g)cmax/cmin比为1.4至2.6。在一些实施方案中,所述组合物中金刚烷胺的体外溶出曲线在2小时时溶出度不超过25%,6小时时溶出度为55-85%,以及12小时时溶出度为至少80%,以上溶出度是通过使用500ml水(37℃)作为溶出介质,并利用usp装置ii(桨法)以50rpm的转速测得的。在一些实施方案中,所述组合物中金刚烷胺的体外溶出曲线在2小时时溶出度不超过25%,6小时时溶出度为25-55%,以及12小时时溶出度为至少80%,以上溶出度是通过使用500ml水(37℃)作为溶出介质,并利用usp装置ii(桨法)以50rpm的转速测得的。在一些实施方案中,所述组合物中金刚烷胺的体外溶出曲线在1小时时溶出度不超过20%,2小时时为25-45%,4小时时为50-80%,以及8小时时溶出度为至少80%,以上溶出度是通过使用500ml水(37℃)作为溶出介质,并利用usp装置ii(桨法)以50rpm的转速测得的。在一些实施方案中,金刚烷胺的体外溶出度分布的特征还在于:金刚烷胺在1小时的时候释放率不超过10%,4小时的时候释放率为30%-50%,12小时的时候释放率为至少90%。在一些实施方案中,所述体外溶出度特征有助于本文所述的药代动力学特征。在一些实施方案中,施用单剂量的所述组合物后得到具有如下特征的auc曲线:0至4小时部分的auc小于auc0-inf的5%;0至8小时部分的auc为auc0-inf的约5%至15%;0至12小时部分的auc为auc0-inf的约10%至40%;0至18小时部分的auc为auc0-inf的约25%至60%;0至24小时部分的auc为auc0-inf的约40%至75%。在一些实施方案中,稳态条件下夜间一次施用所述组合物后,所述组合物具备有如下特征的auc曲线:0至4小时部分的auc为auc0-24的约2%至25%;0至8小时部分的auc为auc0-24的约15%至50%;0至12小时部分的auc为auc0-24的约30%至70%;0至18小时部分的auc为auc0-24的约60%至95%。在一些实施方案中,本发明提供了用于上述任意方法的药物组合物,其中所述组合物用于口服施用并且包括用于口服施用的至少一个胶囊,所述胶囊包含多个丸粒,每个丸粒包含:(a)丸芯,其包含金刚烷胺或者其药学上可接受的盐,和(b)包裹所述丸芯的缓释包衣。在一些实施方案中,所述组合物包含两个所述胶囊。在一些实施方案中,所述缓释包衣包含乙基纤维素,聚维酮和羟丙基甲基纤维素中的至少一者,以及增塑剂。在一些实施方案中,所述丸芯包含包覆到芯种上的金刚烷胺或其药学上可接受的盐和粘合剂。在一些实施方案中,相对于丸芯和缓释包衣的总重量,金刚烷胺的含量为40重量%至60重量%;粘合剂的含量为8重量%至25重量%;芯种的含量为1重量%至25重量%;乙基纤维素的含量为10重量%至20重量%;聚维酮的含量为1重量%至4重量%;增塑剂的含量为1重量%至4重量%。在一些实施方案中,所述组合物还包含位于丸芯和缓释包衣之间的密封包衣。在一些实施方案中,所述丸芯包含粘合剂,所述粘合剂选自由羟丙基甲基纤维素、共聚维酮、以及它们的混合物构成的组。在一些实施方案中,增塑剂选自由中链甘油三酯、邻苯二甲酸二乙酯、柠檬酸酯、聚乙二醇、甘油、乙酰化甘油酯及蓖麻油构成的组。本文的一些实施方案提供了一种对有需要的人类受试者施用金刚烷胺或其药学上可接受的盐,所述方法包括口服施用药物组合物,所述组合物包含处于至少一个口服施用的胶囊(例如,一个胶囊)中的金刚烷胺,所述胶囊包含多个丸粒,每个丸粒包含:(a)丸芯,其包含金刚烷胺或者其药学上可接受的盐,和(b)包裹所述丸芯的缓释包衣。在一些实施方案中,所述组合物包含两个所述胶囊。在一些实施方案中,所述缓释包衣包含乙基纤维素,聚维酮和羟丙基甲基纤维素中的至少一者,以及增塑剂。在一些实施方案中,所述丸芯包含包覆到芯种上的金刚烷胺或其药学上可接受的盐和粘合剂。在一些实施方案中,相对于丸芯和缓释包衣的总重量,金刚烷胺的含量为40重量%至60重量%;粘合剂的含量为8重量%至25重量%;芯种的含量为1重量%至25重量%;乙基纤维素的含量为10重量%至20重量%;聚维酮的含量为1重量%至4重量%;增塑剂的含量为1重量%至4重量%。在一些实施方案中,所述组合物还包含位于丸芯和缓释包衣之间的密封包衣。在一些实施方案中,所述丸芯包含粘合剂,所述粘合剂选自由羟丙基甲基纤维素、共聚维酮、以及它们的混合物构成的组。在一些实施方案中,增塑剂选自由中链甘油三酯、邻苯二甲酸二乙酯、柠檬酸酯、聚乙二醇、甘油、乙酰化甘油酯及蓖麻油构成的组。本文的一些实施方案提供了一种适于向有需要的患者日间一次口服施用的药物组合物,所述组合物包含治疗有效量的、缓释形式的金刚烷胺或其药学上可接受的盐,在日间单次施用时可以以不超过两个0号或更小号胶囊施用。在一些实施方案中,所述组合物可以包含110-220mg金刚烷胺或其药学可接受的盐。在一些实施方案中,所述组合物中金刚烷胺的体外溶出曲线在2小时时溶出度不超过25%,6小时时溶出度为40-80%,以及12小时时溶出度为至少80%,以上溶出度是通过使用500ml水(37℃)作为溶出介质,并利用usp装置ii(桨法)以50rpm的转速测得的。在一些实施方案中,所述组合物包含多个丸粒,每个丸粒包含:(a)丸芯,其包含金刚烷胺或者其药学上可接受的盐,和(b)包裹所述丸芯的缓释包衣。在一些实施方案中,所述缓释包衣包含乙基纤维素,聚维酮和羟丙基甲基纤维素中的至少一者,以及增塑剂。在一些实施方案中,所述丸芯包含包覆到芯种上的金刚烷胺或其药学上可接受的盐和粘合剂。在一些实施方案中,所述组合物包含金刚烷胺,相对于丸芯和缓释包衣的总重量,所述金刚烷胺的含量为40重量%至70重量%。在一些实施方案中,所述丸芯包含含有糖或微晶纤维素的芯种,所述芯种的直径在100至500微米之间。在一些实施方案中,体积密度在0.5至1gm/cm3之间。在一些实施方案中,所述组合物包含位于丸芯和缓释包衣之间的密封包衣。在一些实施方案中,所述丸芯包含粘合剂,所述粘合剂选自由羟丙基甲基纤维素、共聚维酮、以及它们的混合物构成的组。在一些实施方案中,增塑剂选自由中链甘油三酯、邻苯二甲酸二乙酯、柠檬酸酯、聚乙二醇、甘油、乙酰化甘油酯及蓖麻油构成的组。本文的一些实施方案提供了一种减少接受金刚烷胺治疗的人类受试者的睡眠障碍的方法,所述方法包括在就寝时间之前少于4个小时(和/或4pm以后)口服施用含有金刚烷胺或其药学上可接受的盐的缓释(er)组合物。在一些实施方案中,在施用前将所述组合物添加至食物中。在一些实施方案中,在施用后至少1小时内金刚烷胺的血药浓度不增加。在一些实施方案中,在施用前将所述组合物添加至食物中。在一些实施方案中,在施用后至少1小时内金刚烷胺的血药浓度不增加。在一些实施方案中,在施用后至少2小时内金刚烷胺的血药浓度不增加。在一些实施方案中,日间一次施用金刚烷胺组合物(或包含金刚烷胺的组合)提供了影响步态的运动功能减退性运动障碍(例如步态)的改善。所述改善可以通过本领域已知的方法来确定,例如定时起立和行走(tug)、定时25步行测试(t25fw)或六分钟定时行走测试(6mtw)。在多发性硬化症患者中,金刚烷胺组合物或者包含金刚烷胺的组合提供了疲劳改善,这种改善可以通过疲劳量表运动认知(fsmc)确定。在抑郁症患者中,金刚烷胺组合物或者包含金刚烷胺的组合提供了抑郁的改善,这种改善可由贝克抑郁量表-2(bdi-2)确定。在多发性硬化症的患者中,金刚烷胺组合物或者包含金刚烷胺的组合提供了行走方面的改善,这种改善可以通过定时25步行走测试(t25fw)、定时起立和行走(tug)、2分钟步行测试和/或、十二项多发性硬化症步行量表(msws-12)确定。在多发性硬化症患者中,金刚烷胺组合物或包含金刚烷胺的组合提供了认知的改善,这种改善可通过符号数字模态测试(sdmt)、具有延迟回忆的加州语言学习测试第二版(cvlt-ii)、具有延迟回忆的简短视空间记忆测试修订版(bvmt-r)、和/或多发性硬化症的简要国际认知评估(bicams)。例如,在一些实施方案中,本发明可以提供由实施例10和/或实施例11中的评估所确定的改善。参考以下实施例可以更好地理解本发明,但这些实施例并非旨在限制本发明权利要求的范围。实施例1:金刚烷胺缓释包衣丸剂采用下表2所示的组分和相对含量制备设计为夜间施用的盐酸金刚烷胺缓释包衣丸剂组合物。针对各组合物,通过在连续搅拌的同时,将5cps的hpmc和共聚维酮添加到异丙醇中,从而制得药物包衣液。将纯净水添加到上述分散液中,并持续搅拌直至形成澄清溶液。然后将药物(盐酸金刚烷胺)加到该粘合剂溶液中,并持续搅拌至药物完全溶解。最后加入滑石粉,并搅拌至分散均匀。将celphere珠粒(筛分粒度:#35-#50,即300-500微米)装载到wurster包衣单元中。将药物包衣分散液喷至珠粒上,随后干燥一段时间。将所得的药物包衣丸粒过筛,保留筛分粒度在#18至#24之间的那部分(直径为大约700μm至1mm)。通过将5cps的hpmc添加到异丙醇中,并不断搅拌,来制备密封包衣液。然后将纯净水添加到该分散液中,并持续搅拌至形成澄清溶液。然后添加滑石粉并搅拌至均匀分散。将过筛后的药物包衣丸粒装载至wurster包衣单元中。将密封包衣分散液喷洒至药物包衣丸粒上,然后干燥一段时间以除去丸粒中的残余溶剂和水分。将所得的具有密封包衣的丸粒过筛,保留筛分粒度在#18和#24之间的那部分。通过将乙基纤维素(粘度:7cps)溶解在异丙醇和纯净水中,并搅拌至形成澄清溶液,来制备缓释包衣液。然后将聚维酮k-90溶解在该澄清溶液中,随后加入增塑剂miglyol812n,并持续搅拌至形成澄清溶液。将过筛后的具有密封包衣的丸粒装载于wurster包衣单元中。将缓释包衣液喷洒至具有密封包衣的丸粒上,然后干燥一段时间,从而形成缓释包衣并除去丸粒中的残余溶剂和水分。干燥后,将硬脂酸镁分散到环形区域中的包衣丸粒的顶层(topbed)上,然后使包衣丸粒在wurster单元中再循环,从而使硬脂酸镁与包衣丸粒混合。将所得的缓释包衣丸粒过筛,保留筛分粒度在#18和#24之间的那部分。使用装配有丸粒投配室的胶囊机,将含有单位剂量的、所需重量的er包衣丸粒填充至空的1号硬明胶胶囊壳(1号的含量为60-140mg)中。表2:盐酸金刚烷胺er胶囊组合物nf=美国药典1在加工过程中除去纯水和异丙醇。使用usp装置ii(paddles)以50rpm的速度用37℃、500ml水作为溶出介质测试上述制备的胶囊的体外溶出度。满足所需溶出度规格的胶囊在2小时内释放不超过25%的药物,6小时内释放40-80%的药物,12小时释放至少80%的药物。在示例性的溶出曲线中,1小时释放0%的药物,2小时释放12%的药物,4小时释放43%的药物,6小时释放68%的药物,8小时释放83%的药物,10小时释放92%的药物,12小时时释放97%。根据上述方法制备的胶囊显示出良好的储存稳定性,以及在扩大生产时的批次间再现性。实施例2:具有更高载药量的金刚烷胺缓释包衣丸剂采用表3所示的组分和相对含量和实施例1所述的制造方法制备设计为夜间施用的盐酸金刚烷胺缓释包衣丸剂组合物。惰性芯的直径为200–300微米。包衣丸粒的直径为600-1200微米。包衣丸粒的体积密度为0.7-1.2g/cm3。采用装配有丸粒配量室的封装器将所需重量的含有单位剂量的er包衣丸粒填充至空的硬质明胶胶囊壳(尺寸1、用于170mg含量)中。表3:盐酸金刚烷胺er胶囊组合物nf=美国药典1在加工过程中除去纯水和异丙醇。使用usp装置ii(paddles)在50rpm速度下用37℃、500ml水作为溶出介质测试上述制备的胶囊的体外溶出度,其在2小时内释放不超过25%的药物,6小时内40-80%的药物,12小时至少80%的药物。实施例3:金刚烷胺缓释包衣丸剂采用下表4所示的组分和相对含量和实施例1所述的制造方法制备适于用于夜间施用的盐酸金刚烷胺缓释包衣丸剂组合物。表4:盐酸金刚烷胺er胶囊组合物nf=美国药典1在加工过程中除去纯水和异丙醇。采用装配有丸粒配量室的封装器将所需重量的含有单位剂量的er包衣丸粒填充至空的#1硬质明胶胶囊壳(60mg含量、140mg含量)中。这些剂型用于提供下文实施例4中所述研究用金刚烷胺,下述实施例4根据下表5中所示的组合:表5:用于给药的胶囊用于研究的剂量60mg胶囊140mg胶囊260mg21340mg12420mg03实施例4:与ir金刚烷胺相比,金刚烷胺er制剂的药代动力学测试目的:该研究的主要目的是,相对于在禁食条件下对健康成人受试者以单次剂量给予100mg薄膜包衣的ir盐酸金刚烷胺片剂评估er盐酸金刚烷胺的标准剂型(制剂1)的药代动力学特征、安全性和耐受性。研究设计:这是一项1期、随机、单次剂量、开放标签、两期、两种治疗交叉、禁食药代动力学研究,其中将单一340mg剂量的金刚烷胺er胶囊制剂1与单一100mg剂量的市售金刚烷胺片剂进行比较。方法:让受试者进入研究单位,以在21天的研究筛选中进行第一周期的给药。在1期和2期的给药之间会有7天的排出期。在每个给药期间,受试者将在报到后的第二天给药,并在给药后72小时离开。在第二期给药后14天内进行最终的随访。经过一夜禁食之后,受试者以坐姿用240ml水服用所述制剂。在每个剂量施用的0(给药前)、1、2、3、4、6、7、8、9、10、11、12、13、14、15、16、18、24、30、36、48、60、72小时后采集血样。通过有效的液相色谱/串联质谱(lc/ms/ms)方法测定血浆样品中的金刚烷胺。使用winnonlin软件(5.3版或更高版本;pharsight公司)的非分区分析计算药代动力学参数。使用线形混合效应模型,对cmax和auc0-∞的自然对数进行方差分析(anova),其中cmax和auc0-∞是由施用单剂量的研究药物后获得的数据而确定的。所述模型包括受试者、顺序、周期和治疗方案的影响。顺序、周期和治疗方法的影响是固定的,而受试者的影响是随机的。计算对于auc(er制剂的相对生物利用度)和cmax二者的er与ir的比率。在整个研究中监测不良事件。在研究期间的不同时间点收集生命体征(脉搏速率、血压和体温)、临床实验室检测(生物化学、血液学和尿分析)和ecg。预期的结果:共有20名受试者参与研究,受试者包括健康男性和女性成年人。该研究的pk结果证明了,相对于ir形式,er金刚烷胺的cmax(以剂量比例计算)降低(er形式约1.1至1.7ng/ml/mg的金刚烷胺,而ir形式约2.7ng/ml/mg的金刚烷胺)。此外,er金刚烷胺的tmax为9至18小时,而ir形式约为4小时。基于剂量调整基础,通过auc0-inf测量的金刚烷胺er制剂的总金刚烷胺暴露量为的80%至100%。图1示出了er制剂中每毫克金刚烷胺的估计的金刚烷胺血药浓度与预定时间的关系图。高的曲线和低的曲线归纳了在给药后不同时间预测的平均值范围。这些结果总结于下表6中。表6:与(ir制剂)相比,金刚烷胺er(制剂1)的单剂量药代动力学参数实施例5:日间一次施用260mg、340mg和420mg剂量的er盐酸金刚烷胺(制剂1)后的稳态金刚烷胺血药浓度(ng/ml)基于使用来自在先单剂量研究(研究5103-c-101)的观察数据的winnonlin所获得的模型,预测每天一次给予金刚烷胺制剂1(260mg、340mg和420mg)的金刚烷胺稳态血药浓度。使用观察到的单剂量数据通过叠加原理进行稳态预测,并进行线性动力学假设以产生在不同剂量水平(260mg、340mg和420mg)下的曲线。图2示出了每天一次给予er金刚烷胺制剂1(260mg、340mg和420mg)的曲线。实施例6:金刚烷胺缓释组合物按照实施例1所述的方法制备适合用于晚间施用的盐酸金刚烷胺缓释包衣丸粒组合物,并且将其填充至如下表7所述的空的硬质明胶胶囊壳中。表7:盐酸金刚烷胺er胶囊实施例7:金刚烷胺缓释包衣丸剂采用下表8所示的组分和相对量和实施例1所述的制造方法制备适于用于每天一次施用的盐酸金刚烷胺缓释包衣丸剂组合物。采用装配有球丸配量室的封装器将所需重量的含有单位剂量的er包衣球丸填充至空的#1硬质明胶胶囊壳(100mg含量)中。表8:盐酸金刚烷胺er胶囊组合物nf=美国药典1在加工过程中除去纯水和异丙醇。使用usp装置ii(桨法)在50rpm下以37℃、500ml的水作为溶出介质测试上述制备的胶囊的体外溶出度。结果示于表3中。实施例8:与ir金刚烷胺相比,金刚烷胺er制剂的药代动力学测试目的:本研究的主要目的是证实实施例7中缓释制剂的pk性能,相对于在禁食条件下对健康成人受试者以单次剂量给予100mg薄膜包衣的ir盐酸金刚烷胺片剂确定实施例7中具有不同释放性能的盐酸金刚烷胺er胶囊的三种标准制剂的药代动力学曲线、安全性和耐受性。研究设计:这是一项1期、随机、单剂量、开放标签、四期、交叉、禁食药代动力学研究,其中将单次100mg剂量的、具有不同缓释特性的三种金刚烷胺er胶囊制剂与单次100mg剂量的市售金刚烷胺片剂进行比较。三种er制剂具有不同的金刚烷胺体外释放速度(示于表3中)。方法:让受试者进入研究单位,以在21天的研究筛选中进行第一周期的给药。在每个给药期间,受试者在登记进入研究单位后的第二天给药,并在给药24小时后离开。受试者给药后56小时和152小时被叫回随访。每个给药周期间隔至少7天的排出期。经过一夜禁食之后,受试者以坐姿用240ml水服用所述制剂。每次给药后在0(用药前)、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、18、24小时(离开时)和56小时的时候采集血样。使用校正的液相色谱/串联质谱(lc/ms/ms)方法检测血浆样品中的金刚烷胺。通过winnonlin软件(4.1版本或者更高版本;pharsight公司),使用非房室分析计算得到药代动力学参数。使用线形混合效应模型,对cmax和auc0-∞的自然对数进行方差分析(anova),其中cmax和auc0-∞是由施用单剂量的研究药物后获得的数据而确定的。所述模型包括受试者、顺序、周期和治疗方案的影响。顺序、周期和治疗方法的影响是固定的,而受试者的影响是随机的。计算er与ir的auc比值(er制剂的相对生物利用度)和cmax比值。在研究的过程中监测不良事件。在研究的不同时间采集生命体征(脉搏速率、血压和体温)、临床实验室测量(生物化学、血液学和尿分析)和ecg。结果:共有20个受试者参加了该研究。平均年龄为25.5岁(范围:20-38岁)。该研究由8名男性受试者(40%)和12名女性受试者(60%)组成,平均体重指数(bmi)为23.6kg/m2±2.85。其种族构成为100%白种人。15名受试者接受了全部4项治疗。该研究的pk结果显示,与相比,3种金刚烷胺缓释制剂的cmax值降低且tmax值增加,从而表明全部3种金刚烷胺缓释制剂的吸收速率均降低(表9,图4、5)。ir制剂具有最高的平均cmax(277±73.9ng/ml)和最短的平均tmax值(4小时)。制剂a、b和c的cmax逐渐降低,而tmax逐渐延长。制剂a、b和c的cmax从204±61.4ng/ml降低到166±34.8ng/ml,再降低到149±34.4ng/ml,其平均tmax分别由7.0小时升至11.0小时,再升至14.0小时。三种金刚烷胺er制剂各自的金刚烷胺暴露总量(由auc0-∞测得)均略低于制剂,但是这三种制剂均具有可接受的生物利用度(85%至95%)。表10总结了er制剂a、b和c与ir制剂的cmax和auc0-∞比(er/ir)。表9:与(ir制剂)相比,三种金刚烷胺er制剂(制剂a、b和c)的单剂量药代动力学参数a除了tmax以平均值(最小至最大范围内)报告之外,所有参数以平均方差±(sd)报告。表10:cmax和auc0-∞的er/ir比a几何平均比的点评估(er/ir).实施例9:多发性硬化的eae小鼠模型的步态参数评价本研究的主要目的是确定c57bl/6小鼠中(多发性硬化动物模型),mog35-55诱导的实验性自身免疫性脑脊髓炎(eae)的步态紊乱的时间和程度,以及金刚烷胺对所述模型的影响。主要评价项目是疾病严重度和通过动态的步态分析测量的精细动作参数的变化。研究材料试验动物本研究使用来自charlesriver(德国)的雌性c57bl/6小鼠,10-12周龄,体重16-22克。在使用前至少4天对小鼠分笼养殖,每笼4只,并在动物设施中保持标准的啮齿动物食物和自来水。试验对象盐酸金刚烷胺(amt)由moehscatalana、s.l.(西班牙巴塞罗那)生产。达伐吡啶(4-氨基吡啶,dal)由crl购自sigma。实验过程试验组根据表11中的研究设计将动物分配至各治疗组。将动物分配至各治疗组以确保所有组的体重相近(各组间平均体重的差为±10%)。表11:研究设计aamt和dal剂量是基于各组的平均动物体重。如果一个动物的体重与其所在组的平均动物体重相差>10%,则将该动物的泵浓度调整至其体重。b在第0天植入alzet微型泵。2.剂量选择在表12中列出的所选择的金刚烷胺剂量基于上文在小鼠中进行的alzet渗透微型泵研究,从而实现约1200ng/ml的稳态血药浓度。表12中列出的达伐吡啶的剂量基于等人的研究,从而达到约50ng/ml的小鼠稳态血药浓度。试验样品制备、管理、分析和处置3.1.给药溶液的制备向乙酸溶液中添加乙酸钠溶液直至ph达到5.0,用25mm乙酸溶液和25mm乙酸钠溶液在0.9%无菌生理盐水中制备乙酸钠缓冲液(ph5.0)。在使用前,用0.2μm过滤器过滤最终的溶液。称重盐酸金刚烷胺,并加入无菌容量瓶中,用0.9%生理盐水中ph5.0的25mm乙酸钠调节体积,以产生表12中规定的浓度。用4m乙酸钠将ph调节至ph5.0。称重达伐吡啶,并加入无菌容量瓶中,用无菌水调节体积,以产生表12中规定的浓度。在无菌条件下用0.2μm过滤器过滤所有溶液。3.2.制剂采集在制备后收集化合物制剂,每批次两个100μl的等分试样。终止(第27天)时,在从小鼠身上取出泵后,从每个泵中采集一个等分试样。将制剂样品采集至玻璃瓶中,并储存在-70至-80℃,直到研究分析完成为止。3.3.alzet微型泵制备通过皮下植入将alzet#2004渗透微型泵(0.25μl/h、28天泵)植入动物体内,所述泵装填有以表11中指定浓度的金刚烷胺或达伐吡啶。在手术之前,通过以下方案装填微型泵。使用灭菌器和注射器向微型泵中填充适当的药物溶液。然后将渗透囊置于微型泵上。然后,用异丙醇浸泡的纸巾清洁微型泵,使其干燥,然后在37℃下放入无菌0.9%生理盐水的容器中6-16小时以装填泵。来自同组的泵在一个容器中一起装填。生命体内程序4.1.alzet微型泵植入手术对动物植入渗透泵、所述渗透泵含有表11中指定浓度的amt或dal。用5%异氟烷麻醉小鼠,然后氧气/一氧化二氮(nitrousoxygen)中异氟烷含量降低至1.5-2%,用于维持整个手术过程。使用家用电热毯和直肠探针保持直肠温度在36.9±1.0。将麻醉的小鼠放置在外科手术台上,对其背部皮肤进行剃毛并用聚维酮碘溶液(碘伏、leiras、457028)消毒。在切口前,对小鼠施用镇痛药(疼即息(temgesic)、1ml/kg、皮下、rb药物有限公司、2014-07)。然后,进行小切口以露出用于安装alzet微型泵的皮下空间。用异丙醇擦拭经装填的渗透微型泵。在醇挥发之后,将泵插入口中,首先终止输送入口,从而使所输送的测试化合物与切口愈合之间的相互作用最小化。用7-0单丝缝合线缝合皮肤,使小鼠在单个笼中恢复,然后返回居住笼(3-4只小鼠/笼)。另外,在第0天(手术后6小时)、第1天(上午和下午)和第2天(上午)对小鼠施用止痛剂(疼即息、1ml/kg、皮下、rb药物有限公司、2014-07)。在同一天(第0天)同时进行植入手术和mog接种。4.2.归纳和eae临床评分使用市售即用型接种物(ek-0115,hooke实验室,usa)对小鼠进行接种,所述接种物包含处于100μl矿物油中的100μgmog35-55、200μg热灭活结核分枝杆菌。通过对每只小鼠背部的较高处和较低处实施2×100μl的皮下注射完成接种。在接种时和接种后24小时分别给予腹膜内注射100μl百日咳毒素(4μg/ml)。如表12所示,研究人员每天对各治疗组进行临床症状评分(盲测)。表12:eae的临床评分分值临床表现0.5局部尾巴软弱1.0尾巴完全瘫痪(全尾拖行)1.5松垂的尾巴和非正常步态2松垂的尾巴和明显的后腿软弱2.5一个后肢部分瘫痪–(受影响的肢体无活动)3双后肢完全瘫痪4后肢完全瘫痪和前肢部分软弱5前肢和后肢完全瘫痪(四肢瘫痪),垂死的4.3.体重和总体临床观察在第0天(微型泵植入之前和之后)测量体重,此后每天测量一次。记录时间和重量。对动物的植入部位进行一般临床观察和检查,每日记录一次。每天对动物植入部位进行温和的颤动,以防止在泵周围形成瘢痕组织。使用co2窒息对显示出严重毒性迹象(即俯卧、低体温)和/或处于濒死状态的动物进行安乐死,然后在预定的处死之前实施断头术。需要安乐死的可接受终点的含义包括:在24小时观察期内无自发运动并且无法饮水或饮食、大量出血、自发性炎症、缺失解剖结构、肿胀或大于20毫米的肿瘤、以及在30秒钟内无法正反射。模型(eae)具体的终点包括:4分的临床评分(所有肢体部分偏瘫或虚弱)超过1天并且没有改善(评分低于4)、正反射>30秒、体重下降超过基准的25%。4.4.运动步态分析第1、5、8、11、14、17、20、23、26天,在motorater(tsesystems,hamburg,germany)中使用步行模式使每组的所有小鼠活动。对每只小鼠采集的视频首先被转换至simimotion软件以跟踪身体的标记点(例如爪子、臀部、尾巴等),并且这些不同的身体点相对于地面的移动被记录为不同级别。使用定制的自动分析系统分析不同的步态图案和精细的运动动作。动力学端点记录于表13中。表13:动力学终点行走模式4.5.终端程序和组织处理在终止时间点(第27天),所有小鼠用戊巴比妥深度麻醉,并通过心脏穿刺收集血液样品。在500μl塑料淡紫色k2edta抗凝血试管中采集约0.4-0.5ml血液,并储存在湿冰中直到离心。在4℃下以3000g对血液样品离心10分钟(15分钟内收集)。注意到溶血迹象(血浆为粉色或红色)。将每只动物的血浆等分到的单个1.5ml微量离心管中,并放入具有分离器的储存箱中,在-70至-80℃储存至装载。没有收集其他组织以用于该研究。生物学分析通过lc/ms/ms使用已建立的用于金刚烷胺和达伐吡啶的方法进行血浆和制剂的生物学分析,从而分别测定金刚烷胺和达伐吡啶的浓度。数据分析对每个动物终止时间点的血浆化合物浓度进行列表,并计算各组的平均(±sd)浓度。对个体和平均(±sd)绝对体重、以及从第一天起的体重变化进行列表,并且作为时间的函数进行绘制。对于临床评分,以平均得分(±sem)作为时间的函数制图。以散点图中的个体值和/或条形图中的平均值(±sem)对疾病发作时间和累积疾病评分进行制图。以散点图中的个体值和/或条形图中的平均值(±sem)对运动参数(表13)进行制图。统计学分析所有值均以平均值±标准偏差(sd)或平均值标准误差(sem)表示,差异在p<0.05的水平则认为是统计学上显著的。使用statsdirect统计软件进行统计学分析。平均值之间的差异通过使用单因素方差分析进行分析,随后进行dunnet’s检验(与对照组比较)。通过双因素方差分析进行与基线的组内比较。非参数数据分别用kruskal-wallis方差分析或friedman方差分析进行分析。结果:在研究中共使用34只小鼠,其中10只用作假载体(sham-vehicle)对照,10只用作载体对照,10只用金刚烷胺处理,10只用达伐吡啶处理。该研究的结果表明,金刚烷胺处理降低了ms小鼠模型的症状严重程度。图6示出了对于ms的eae小鼠模型中疾病的进展,eae小鼠中临床评分从12-13天开始升高,在18-20天达到峰值。与未处理的eae小鼠相比,用金刚烷胺和达伐吡啶处理的小鼠显示较低的临床评分,这表明与未处理的对照组相比,这些药物减轻了这些组的症状。在对于ms的eae小鼠模型中,用药物治疗的组均未显示延迟性疾病的发作。与未处理对照组相比,用金刚烷胺处理的组和用达伐吡啶处理的组的各组(图7-27)的累积临床评分(第18-27天)的散点图降低了累积临床评分。图8示出了各个测定组中iba-1表达(小胶质细胞活化的标志物)的表达。金刚烷胺处理组显示出显著较低的表达,表明金刚烷胺在ms动物模型中显著降低神经炎症。图9提供了显示出对动物受试者的疾病进展的影响以及其在步行测试中的表现的损害的曲线图。未经处理的eae对照组在第14天后完成行走测试的能力大幅降低,第16天只有40%能完成该测试。相比之下,60%的金刚烷胺处理组和50%的达伐吡啶处理组能够在第16天完成行走试验。第14天的行走测试提供了具有最完整的步态数据的最终时间点。步态研究结果的分析进一步表明,金刚烷胺在第14天时提高了行走速度。与未处理的eae对照组相比,金刚烷胺处理的小鼠和达伐吡啶处理组在60cm行走时间测试中显示出更少的时间(图10a)和更快的平均行走速度(图10b)。实施例10:金刚烷胺用于治疗多发性硬化症患者的步态障碍的评估在双盲、2组研究中对具有行走缺陷的ms受试者进行实施例2的盐酸金刚烷胺缓释包衣丸粒组合物和安慰剂的比较,所述行走缺陷通过edss(扩展的残疾状态量表-kurtzke1983)定义。所有受试者在筛选前至少30天接受ms药物(不含4-氨基吡啶)的稳定方案,并在研究期间继续使用相同的剂量和方案。研究中的受试者随机分为两个处理组:安慰剂或340mg缓释剂型的金刚烷胺。每天晚上在就寝时间服用研究的药物。最初随机分配到安慰剂的受试者在最初的1周试行期和整个4周随机治疗期间接受安慰剂。最初随机接受积极治疗的受试者在最初的1周试行期内接受安慰剂,随后1周接受170mg金刚烷胺缓释制剂1周,然后在剩余的3周治疗期间接受340mg金刚烷胺缓释制剂。从第一剂研究药物开始记录不良事件,并继续直至最后一次回访。在整个研究中记录联合用药。结果测量定时25步行走测试(t25fw–kieseier和pozzili2012)定时起立和行走(tug-learmonth,paul等人,2012)6分钟行走测试(6mwt–goldman,marrie等人,2008)运动和认知功能疲劳量表(fsmc-pennerraselli等人,2009)beck抑郁症量表-2(bdi-2–smarr和keefer2011;watson,ford等人,2014)积极治疗组的预期结果是在上述结果测量的至少一项中有改善。预计积极治疗组的t25fw、tug或6mwt结果将优于安慰剂。实施例11:金刚烷胺用于治疗多发性硬化症患者的行走缺陷的评估对具有行走缺陷的ms受试者施用盐酸金刚烷胺缓释包衣丸粒组合物(例如,实施例2中的组合物),所述行走缺陷通过edss(扩展的残疾状态量表-kurtzke1983)定义。所有受试者在筛选前至少30天接受ms药物(不含4-氨基吡啶)的稳定方案,并在研究期间继续使用相同的剂量和方案。受试者随机分为两个处理组:安慰剂或340mg缓释剂型的金刚烷胺。每天晚上在就寝时间服用研究的药物。最初随机分配到安慰剂的受试者在最初的1周试行期和整个4周随机治疗期间接受安慰剂。最初随机接受积极治疗的受试者在最初的1周试行期内接受安慰剂,随后1周接受170mg金刚烷胺缓释制剂1周,然后在剩余的3周治疗期间接受340mg金刚烷胺缓释制剂。从第一剂研究药物开始记录不良事件,并继续直至最后一次回访。在整个研究中记录联合用药。行走速度或能力通过以下方法中至少一种或其组合进行评估:定时25步行走测试(t25fw)、定时起立和行走(tug)、2分钟行走测试、6分钟定时行走测试(6mtw)、和/或十二项多发性硬化症行走测量表(msws-12)。在一些实施方案中,受试者的行走显著得到改善。积极治疗组的结果是在上述结果测量的至少一项中有改善。积极治疗组的t25fw、tug、2分钟行走测试、6mwt或msws-12结果优于安慰剂组。ms症状改善。相对于安慰剂组,t25fw、tug、2分钟行走测试、6mwt和/或msws-12得以改善。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1