稳定的低粘度抗体配制品的制作方法
本发明涉及稳定的低粘度抗体配制品,其中该配制品包括高浓度的抗-IL6抗体。在一些实施例中,本发明是针对稳定的低粘度抗体配制品,所述抗体配制品包括约50mg/mL至约400mg/mL的抗-IL6抗体以及精氨酸,其中该抗体配制品是在水性溶液中并且在23℃下具有小于20cP的粘度。还提供了制造方法和使用此类抗体配制品的方法。
发明背景
抗体由于它们的靶标识别的特异性已经用于治疗不同疾病和病症,由此随着全身性给予而产生高度选择性的结果。虽然抗体可以具有高度特异性,治疗患者(尤其对于慢性病症)所需的剂量通常是大量的。已经开发了新的生产和纯化技术以提供有待生产的大量高度纯化的单克隆抗体。然而,对这些抗体进行稳定化的挑战仍然存在,并且在提供处于适用于给药的剂型的抗体方面还有更多的挑战存在。
为了用大剂量的特异抗体治疗受试者,增加剂量配制品中的抗体的浓度是所希望的。较高浓度一般提供用于针对注射的较小注射体积。然而,在较高的浓度时,抗体常展现出特有的问题,包括聚集、沉淀、胶凝、降低的稳定性、和/或增加的粘度。
已经提出了不同方法来克服与高浓度剂型相关的挑战。例如,为了解决与高浓度抗体配制品相关联的稳定性问题,常将抗体冻干,并且进而在给予之前不久进行重构。重构一般不是最优的,因为其向给予方法中增加了额外的步骤,并且可能将污染物引入至配制品中。此外,甚至重构的抗体可能遭受聚集和高粘度。
还存在着对于给予抗体配制品的其他问题。在一些例子中,将抗体配制品从其容器中抽出并且在给予之前稀释至适当的静脉(IV)输注袋中。包含抗体配制品的IV袋被称为‘复合的无菌制剂’(CSP)。该CSP在被给予至受试者之前常保持短的时间。通常在将CSP输注至患者之前,对CSP进行沉淀或污染迹象的视觉检查。与抗体配制品相比,CSP的针对稳定性的所希望的时间限制更短,例如在室温下约4至8小时以及在冷冻的条件下是24至36小时。
抗体配制品于IV袋中的放置可以引起稳定性的降低。对于抗体产品,沉淀或颗粒形成可以发生,并且可以通过IV溶液的目视检查、通过紫外-可见光吸光度的剂量回收率以及通过尺寸排阻色谱法(SEC)的相对于高分子量种类(HMWS)的形成的稳定性来评估。还可以对效价进行测量,并且基本上通过产品-特异性测试来评估。
多个潜在来源可导致CSP的不稳定。蛋白的胶体和构象稳定性受溶液条件(如离子强度、pH和赋形剂(如二糖或氨基酸)的存在)的影响。常将表面活性剂添加至蛋白质配制品中,用以保护免于由界面应力引起的聚集或用以抑制颗粒形成。如果配制品赋形剂被稀释到低于其必需水平的话,蛋白质稳定性的降低可能发生。此外,暴露于盐水IV袋中的高离子强度环境可以加速一些蛋白质特定的降解途径。
因此,存在一种提供可以克服许多这些挑战的高浓度抗体配制品的需要。此外,存在一种将抗体配制品添加至IV袋中的方法的需要,其中在稀释期间该抗体配制品不会降解、沉淀、或以其他方式降低效力。
发明概述
本发明是针对稳定的、低粘度、高浓度的抗体配制品。
在一些实施例中,本发明是针对稳定的低粘度抗体配制品,该抗体配制品包括:(a)约150mg/mL至约400mg/mL的抗-IL-6抗体,以及(b)大于约150mM的精氨酸,其中该抗体配制品是在水性溶液中并且在23℃下具有小于20cP的粘度。
在一些实施例中,该抗-IL-6抗体包括可变的重结构域(VH)和可变的轻结构域(VL),其中该VH结构域包括含有SEQ ID NO:7、8和9的互补决定区(CDR),并且该VL结构域包括含有SEQ ID NO.10、11和12的CDR。在一个实施例中,该抗-IL-6抗体包括SEQ ID NO:1和SEQ ID NO:2。
在一些实施例中,如通过SEC HPLC所确定的,该抗体在2℃至8℃下持续12个月是稳定的。
在一些实施例中,该抗体配制品的粘度是在23℃下小于14cP。
可以使用不同浓度的精氨酸。在一些实施例中,该抗体配制品包括大于200mM的精氨酸。在一些实施例中,该抗体配制品包括大于220mM的精氨酸。在一些实施例中,该抗体配制品包括150mM至400mM的精氨酸。
各种其他组分可以被包含在该抗体配制品中。在一些实施例中,该抗体配制品进一步包括表面活性剂。在一些实施例中,该表面活性剂选自下组,该组由以下各项组成:聚山梨醇酯、普朗尼克类(pluronic)、苄泽类(Brij)、和其他非离子表面活性剂。在一些实施例中,该表面活性剂是聚山梨醇酯80。在一些实施例中,该抗体配制品进一步包括组氨酸。在一些实施例中,该配制品基本上不含海藻糖。在一些实施例中,该配制品基本上不含二糖。在一些实施例中,该配制品基本上不含还原糖、非还原糖、或糖醇。在一些实施例中,该配制品基本上不含渗压剂。
在一些实施例中,当通过27号薄壁PFS针时(相当于25号或26号针)该配制品具有小于8N的注射力。在一些实施例中,该配制品具有在300和450mosm/kg之间的摩尔渗透压浓度(osmolarity)。
该抗体配制品中的抗体可以具有不同的纯度水平。在一些实施例中,该抗体占到该抗体配制品的总多肽组合物的大于90%(w/w)。
在一些实施例中,本发明是针对稳定的低粘度抗体配制品,该抗体配制品包括:(a)约150mg/mL至约400mg/mL的抗体,其中该抗体包括SEQ ID NO:1和2的氨基酸序列,(b)约150mM至约400mM精氨酸,(c)约0.01%至约0.1%聚山梨醇酯80,(d)约20mM至约30mM组氨酸,其中该抗体配制品在23℃下具有小于20cP的粘度。
在一些实施例中,本发明是针对稳定的低粘度抗体配制品,该抗体配制品包括:(a)约150mg/mL至约400mg/mL的抗体,其中该抗体包括可变的重结构域(VH)和可变的轻结构域(VL),其中该VH结构域包括含有SEQ ID NO:7、8和9的互补决定区(CDR),并且VL结构域包括含有SEQ ID NO.10、11和12的CDR,(b)约150mM至约400mM的精氨酸,(c)约0.01%至约0.1%聚山梨醇酯80,以及(d)约20mM至约30mM的组氨酸,其中该抗体配制品在23℃下具有小于20cP的粘度。
在一些实施例中,本发明是针对稳定的低粘度抗体配制品,该抗体配制品包括:(a)约150mg/mL的抗体,其中该抗体包括可变的重结构域(VH)和可变的轻结构域(VL),其中该VH结构域包括含有SEQ ID NO:7、8和9的互补决定区(CDR),并且VL结构域包括含有SEQ ID NO.10、11和12的CDR,(b)约220mM的精氨酸,(c)约0.07%的聚山梨醇酯80,以及(d)约25mM的组氨酸,其中该抗体配制品在23℃下具有小于20cP的粘度。
在一些实施例中,本发明是针对稳定的低粘度抗体配制品,该抗体配制品包括:(a)约150mg/mL的抗体,其中该抗体包括可变的重结构域(VH)和可变的轻结构域(VL),其中该VH结构域包括含有SEQ ID NO:7、8和9的互补决定区(CDR),并且VL结构域包括含有SEQ ID NO.10、11和12的CDR,(b)约150mM的精氨酸,(c)约0.07%的聚山梨醇酯80,以及(d)约25mM的组氨酸,其中该抗体配制品在23℃下具有小于20cP的粘度。
在一些实施例中,本发明是针对稳定的低粘度抗体配制品,该抗体配制品包括:(a)约50mg/mL至约200mg/mL的抗体,其中该抗体包括可变的重结构域(VH)和可变的轻结构域(VL),其中该VH结构域包括含有SEQ ID NO:7、8和9的互补决定区(CDR),并且VL结构域包括含有SEQ ID NO.10、11和12的CDR,(b)约20mM至约400mM的精氨酸,(c)约0.01%至约0.1%聚山梨醇酯80,(d)约5mM至约100mM的组氨酸,以及任选地,(e)约50mM至约400mM的海藻糖,其中该抗体配制品在23℃下具有小于20cP的粘度。
在一些实施例中,本发明是针对稳定的低粘度抗体配制品,该抗体配制品包括:(a)约50mg/mL的抗体,其中该抗体包括可变的重结构域(VH)和可变的轻结构域(VL),其中该VH结构域包括含有SEQ ID NO:7、8和9的互补决定区(CDR),并且VL结构域包括含有SEQ ID NO.10、11和12的CDR,(b)约0.05%的聚山梨醇酯80,(c)约25mM的组氨酸,以及(d)约225mM的海藻糖,其中该抗体配制品在23℃下具有小于20cP的粘度。
在一些实施例中,本发明是针对稳定的低粘度抗体配制品,该抗体配制品包括:(a)约100mg/mL的抗体,其中该抗体包括可变的重结构域(VH)和可变的轻结构域(VL),其中该VH结构域包括含有SEQ ID NO:7、8和9的互补决定区(CDR),并且VL结构域包括含有SEQ ID NO.10、11和12的CDR,(b)约25mM的精氨酸,(c)约0.07%的聚山梨醇酯80,(d)约25mM的组氨酸,以及(e)约180mM的海藻糖,其中该抗体配制品在23℃下具有小于20cP的粘度。
在一些实施例中,本发明是针对治疗与受试者体内的骨性关节炎相关联的疼痛的方法,该方法包括给予在此所描述的抗体配制品。在一些实施例中,本发明是针对治疗与受试者体内的慢性下背痛相关联的疼痛的方法,该方法包括给予在此所描述的抗体配制品。在一些实施例中,本发明是针对治疗与受试者体内的类风湿关节炎的方法,该方法包括给予在此所描述的抗体配制品。
在一些实施例中,本发明是针对制备稳定的低粘度抗体配制品的方法,该方法包括:(a)将抗体浓缩至约150mg/mL至约400mg/mL,其中该抗体包括SEQ ID NO:1和2的氨基酸序列;并且(b)将精氨酸添加至(a)的抗体以获得具有大于约150mM的精氨酸浓度的抗体配制品,其中(b)的抗体配制品是在水性溶液中并且在23℃下具有小于20cP的粘度,并且其中如通过SEC HPLC所确定的,(b)的抗体配制品在2℃至8℃下持续12个月是稳定的。
附图简要说明
图1是显示预测的抗-IL6(YTE)抗体的不同赋形剂的稳定能力的图。它证实精氨酸不被预测为是这个抗体的胶体最稳定的赋形剂。预测最稳定的赋形剂是蔗糖和海藻糖,而预测最不稳定的是NaCl和硫酸钠。
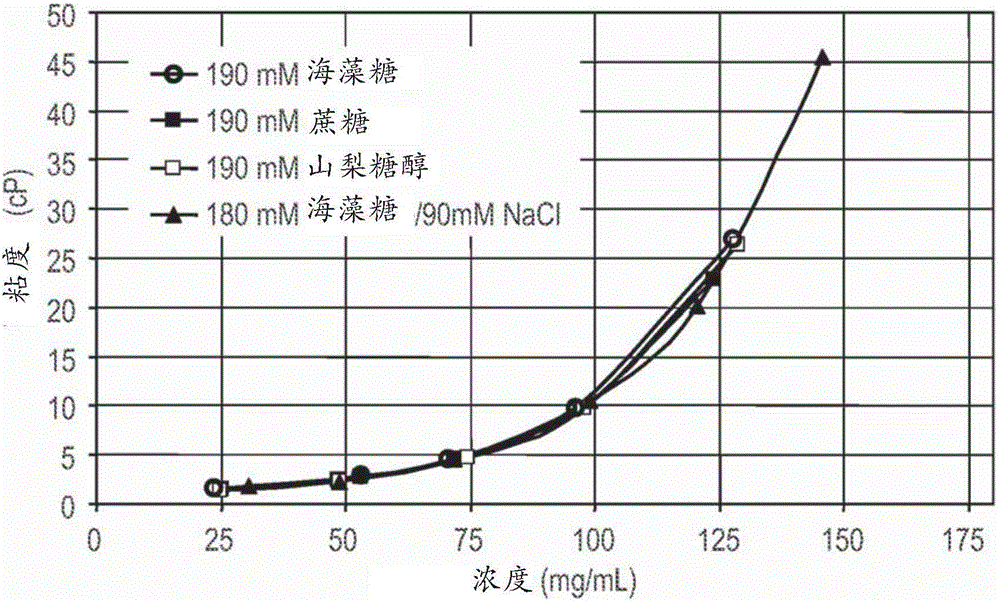
图2是针对海藻糖、蔗糖、山梨糖醇和海藻糖/NaCl的粘度对浓度曲线。
图3是针对抗体配制品在具有以下项的情况下的粘度对浓度曲线:(i)210mM海藻糖,(ii)180mM海藻糖/25mM精氨酸,(iii)170mM海藻糖/50mM精氨酸,(iv)180mM海藻糖/90mM精氨酸,(v)150mM精氨酸,或(vi)220mM精氨酸。
图4是针对抗体配制品在具有以下项的情况下的粘度对浓度曲线:(i)210mM海藻糖,(ii)180mM海藻糖/25mM精氨酸,(iii)170mM海藻糖/50mM精氨酸,(iv)180mM海藻糖/90mM精氨酸,(v)150mM精氨酸,或(vi)220mM精氨酸。
图5是针对抗体配制品在具有以下项的情况下的粘度对浓度曲线:(i)210mM海藻糖,(ii)180mM海藻糖/25mM精氨酸,(iii)150mM精氨酸,或(iv)220mM精氨酸。
图6是针对抗体配制品在具有以下项的情况下的粘度对浓度曲线:(i)150mM精氨酸,(ii)220mM精氨酸,或(iii)75mM海藻糖/100mM精氨酸。
图7是抗体配制品在150mM精氨酸和220mM精氨酸的情况下的粘度比较。
图8证实了对于包含不同赋形剂的100mg/mL和150mg/mL的抗体配制品的粘度与温度的相关性。
图9是针对在25mM L-组氨酸/L-组氨酸盐酸盐一水合物、220mM精氨酸盐酸盐、0.07%(w/v)聚山梨醇酯80(pH 6.0)中的抗-IL6(YTE)抗体的热稳定性曲线。
图10是自IV在模拟-输注通过0.2微米串联过滤器并收集至3cc玻璃小瓶(起始时间点)中之后抗-IL6(YTE)抗体的低剂量样品的图。
图11是自IV袋在模拟-输注通过0.2微米串联过滤器并收集至3cc玻璃小瓶(起始时间点)中之后抗-IL6(YTE)抗体的低剂量样品的图,其中将该IV袋用0.012%w/v聚山梨醇酯80进行处理。
发明详细说明
应该领会的是在此展示和描述的这些具体的实现方式是实例,并且不旨在以任何方式在其他方面限制本申请的范围。还应当理解的是,在此所描述的本发明的每个实施例和特征可以按任何和所有方式组合。
在此提及的这些公开的专利、专利申请、网站、公司名称、以及科学文献特此以其全文形式通过引用而结合,达到如同每个被确切并单独地表明而通过引用结合的相同程度。在此引用的任何参考文件与本说明书的具体传授之间的任何冲突应以有利于后者的方式来解决。同样,在单词或短语的领域理解的定义与如在本说明书中确切传授的该单词或短语的定义之间的任何冲突应以有利于后者的方式来解决。
如在本说明书中所使用的,单数形式“一个/种(a,an)”以及“该”具体地还涵盖它们所提及的术语的复数形式,除非本内容清楚地另外指明。
贯穿本披露,除非另外指明,所有百分数、比率以及类似物的表达是“按重量计”。如在此使用的,“按重量计”与术语“按质量计”是同义的并且指示在此所定义的比率或百分比是根据重量而不是体积、厚度或一些其他量度来表示的。
在此使用术语“约”以意指大约(approximately)、在附近(in the region of)、粗略地(roughly)、或左右(around)。当术语“约”与一个数值范围结合使用时,它通过扩展列举的数值的上限和下限将该范围加以修饰。通常,在此使用术语“约”以将一个数值以高于和低于该规定值的10%的变化加以修饰。
在此使用的技术术语和科学术语具有由本申请涉及的领域的普通技术人员通常理解的含义,除非另外定义。在此参考了本领域的普通技术人员已知的不同方法和材料。阐明重组DNA技术的一般原则的标准参考文献包括萨姆布鲁克(Sambrook)等人,“分子克隆:实验室手册(Molecular Cloning:A Laboratory Manual),”第二版,冷泉港实验室出版社(Cold Spring Harbor Laboratory Press),纽约(1989);考夫曼(Kaufman)等人,编著,“医学生物学中的分子和细胞方法手册(Handbook of Molecular and Cellular Methods in Biology in Medicine),”CRC出版社,博卡拉顿(Boca Raton)(1995);以及麦克弗森(McPherson),编著,“定向诱变:实用方法(Directed Mutagenesis:A Practical Approach),”IRL出版社,牛津(1991),将其中每个的披露通过引用以其全文结合在此。
本发明是针对稳定的低粘度抗体配制品。如在此描述的,术语“抗体配制品”是指包括一种或多种抗体分子的组合物。不特别限制在本发明中的术语“抗体”。为了清楚起见,“抗体”以其最广泛的意义来理解,并且包含任何免疫球蛋白(Ig)、其活性的或所希望的变体、以及其活性的或所希望的片段(例如Fab片段、骆驼科抗体(单链抗体)和纳米抗体)。术语“抗体”还可以指的是二聚体或多聚体。该抗体可以是多克隆的或单克隆的并且可以是天然存在的或重组产生的。因此,人类、非人类、人源化的和嵌合抗体全部被包含在术语“抗体”中。典型地,抗体是以下类别之一的单克隆抗体:IgG、IgE、IgM、IgD和IgA;并且更典型地是IgG或IgA。
本发明的抗体可以来自任何动物来源,包括鸟类和哺乳动物。在一些实施例中,本发明的方法的抗体是人类、鼠类(例如小鼠和大鼠)、驴、绵羊、兔、山羊、豚鼠、骆驼、马或鸡的。如在此使用的,“人类”抗体包括具有人类免疫球蛋白的氨基酸序列的抗体,并且包括从人类免疫球蛋白文库分离的抗体或来自针对一种或多种人类免疫球蛋白的转基因的且不表达内源性免疫球蛋白的动物。参见例如库彻拉帕廷(Kucherlapati)等人的美国专利号5,939,598。
本发明的抗体可以包括例如天然的抗体、完整单克隆抗体、多克隆抗体、由至少两个完整抗体形成的多特异性抗体(例如,双特异性抗体)、抗体片段(例如结合至和/或识别一种或多种抗原的抗体片段)、人源化抗体、人类抗体(雅克布维茨(Jakobovits)等人,《美国科学院院刊》(Proc.Natl.Acad.Sci.USA)90:2551(1993);雅克布维茨(Jakobovits)等人,《自然》(Nature)362:255-258(1993);布鲁格曼(Bruggermann)等人,免疫学之年(Year in Immunol.)7:33(1993);美国专利号5,591,669和5,545,807)、抗体以及从抗体时期文库中分离的抗体片段(麦卡菲蒂(McCafferty)等人,《自然》(Nature)348:552-554(1990);克拉克森(Clackson)等人,《自然》(Nature)352:624-628(1991);玛尔柯斯(Marks)等人,《分子生物学杂志》(J.Mol.Biol.)222:581-597(1991);玛尔柯斯(Marks)等人,《生物技术》(Bio/Technology)10:779-783(1992);沃特豪斯(Waterhouse)等人,《核酸研究》(Nucl.Acids Res.)21:2265-2266(1993))。通过本发明的方法纯化的抗体可以重组地融合至异源多肽的N-或C-末端或用化学方法轭合(包括共价地和非共价地轭合)至多肽或其他组合物上。例如,通过本发明的方法纯化的抗体可以重组地融合或轭合至在检测测定中可用作标签的分子和效应分子(诸如异源多肽、药物或毒素)上。参见例如PCT公开案WO 92/08495;WO 91/14438;WO 89/12624;美国专利号5,314,995;以及EP 396,387。
在一些实施例中,该抗体可以针对一种或多种抗原,如在本领域中熟知的。适合的抗炎性抗体的实例包括但不限于抗-TNFα抗体,诸如阿达木单抗、英利昔单抗、依那西普、戈利木单抗、和培舍珠单抗;抗-IL1β抗体,诸如康纳单抗;抗-IL12/23(p40)抗体,诸如优特克单抗和布雷奴单抗(briakinumab);以及抗-IL2R抗体,诸如达利珠单抗。适合的抗-癌症抗体的实例包括但不限于抗-BAFF抗体,诸如贝利木单抗;抗-CD20抗体,诸如利妥昔单抗;抗-CD22抗体,诸如依帕珠单抗;抗-CD25抗体,诸如达利珠单抗;抗-CD30抗体(诸如伊妥木单抗)、抗-CD33抗体(诸如吉妥珠单抗)、抗-CD52抗体(诸如阿来组单抗);抗-CD152抗体,诸如易普利姆玛;抗-EGFR抗体,诸如西妥昔单抗;抗-HER2抗体,诸如曲妥珠单抗和帕妥珠单抗;抗-IL6抗体,诸如司妥昔单抗(siltuximab);和抗-VEGF抗体,诸如贝伐单抗;抗-IL6受体抗体,诸如塔西单抗。在具体的实施例中,该抗体配制品包括抗-IL6抗体。
在一些实施例中,该抗体配制品包括抗-IL6抗体,其中该抗-IL6抗体包括可变的重结构域(VH)和可变的轻结构域(VL),其中该VH结构域包括含有SEQ ID NO:7、8和9的互补决定区(CDR),并且该VL结构域包括含有SEQ ID NO.10、11和12的CDR。
SEQ ID NO:7
抗-IL6重链CDR1
SNYMI
SEQ ID NO:8
抗-IL6重链CDR2
DLYYYAGDTYYADSVKG
SEQ ID NO:9
抗-IL6重链CDR3
WADDHPPWIDL
SEQ ID NO:10
抗-IL6轻链CDR1
RASQGISSWLA
SEQ ID NO:11
抗-IL6轻链CDR2
KASTLES
SEQ ID NO:12
抗-IL6轻链CDR3
QQSWLGGS
在一些实施例中,该抗体配制品包括抗-IL6抗体,其中该抗-IL6抗体包括VH结构域和VL结构域,分别包括SEQ ID NO;5和6。
SEQ ID NO:5
抗-IL6可变重链
EVQLVESGGGLVQPGGSLRLSCAASGFTISSNYMIWVRQAPGKGLEWVSDLYYYAGDTYYADSVKGRFTMSRDISKNTVYLQMNSLRAEDTAVYYCARWADDHPPWIDLWGRGTLVTVSS
SEQ ID NO:6
抗-IL6可变轻链
DIQMTQSPSTLSASVGDRVTITCRASQGISSWLAWYQQKPGKAPKVLIYKASTLESGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQSWLGGSFGQGTKLEIK
在一些实施例中,该抗体配制品包括抗-IL6抗体,如通过SEQ ID NO.3-4所描述的。
SEQ ID NO:3
抗-IL6抗体重链
EVQLVESGGGLVQPGGSLRLSCAASGFTISSNYMIWVRQAPGKGLEWVSDLYYYAGDTYYADSVKGRFTMSRDISKNTVYLQMNSLRAEDTAVYYCARWADDHPPWIDLWGRGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:4
抗-IL6抗体轻链
DIQMTQSPSTLSASVGDRVTITCRASQGISSWLAWYQQKPGKAPKVLIYKASTLESGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQSWLGGSFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYE KHKVYACEVTHQGLSSPVTKSFNRGEC
在一些实施例中,在抗体配制品中的抗体是可商购的抗体,该抗体选自下组,该组由以下各项组成:阿达木单抗(雅培公司)、依库珠单抗(亚力兄制药公司)、利妥昔单抗(罗氏公司/百健艾迪公司/中外制药)、英利昔单抗(强生公司/先灵葆雅公司/田边公司)、曲妥珠单抗(罗氏公司/中外制药)、贝伐单抗(中外制药/罗氏公司)、帕利珠单抗(医学免疫公司/雅培公司)、阿来组单抗(健赞公司)、以及莫维珠单抗(医学免疫公司)。
在一些实施例中,该抗-IL6抗体是修饰的抗-IL6抗体。例如,在一些实施例中,该抗-IL6抗体是抗-IL6(YTE)抗体,其在Fc结构域的CH2结构域中包含3个氨基酸取代(M252Y/S254T/T256E),已经显示所述氨基酸取代增加了抗-IL6(YTE)(如通过SEQ ID NO.1-2所代表的)的血清半衰期。
SEQ ID NO:1
抗-IL6(YTE)抗体重链
EVQLVESGGGLVQPGGSLRLSCAASGFTISSNYMIWVRQAPGKGLEWVSDLYYYAGDTYYADSVKGRFTMSRDISKNTVYLQMNSLRAEDTAVYYCARWADDHPPWIDLWGRGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLYITREPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SEQ ID NO:2
抗-IL6(YTE)抗体轻链
DIQMTQSPSTLSASVGDRVTITCRASQGISSWLAWYQQKPGKAPKVLIYKASTLESGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQSWLGGSFGQGTKLEIKRTVAAPSVFIFPPSDE QLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
参见例如多尔阿夸(Dall’Acqua)等人,《免疫学杂志》(J.Immunol)169:5171-5180(2002)。抗-IL6(YTE)抗体是具有大约148kDa的总分子量的人类IgG1κ单克隆抗体,在Fc区域中在残基Asn-300处包含一个N联寡糖附着位点。认为抗-IL6(YTE)抗体阻断IL-6受体α配体相互作用以及随后的功能性事件。抗-IL6(YTE)抗体的序列可以发现于SEQ ID NO:1和2。对于抗-IL-6抗体的非限制性实例还描述于WO 2008/065378、WO2010/088444、美国专利号8,198,414和美国专利申请号20120034212中,将其通过引用以其全文特此结合。
例如,人类IL-6的核苷酸序列可以发现于基因银行(GenBank)数据库(参见例如登录号NM 000600.2)。人类IL-6的氨基酸序列可以发现于基因银行(GenBank)数据库(参见例如登录号P05231)和美国专利申请号10/496,793(2002年12月4日提交,作为美国专利号7,414,024发布(见1栏));以及美国专利申请号12/470,753(2009年5月22日提交,作为美国专利号7,833,755发布(见19栏))(人类IL-6的氨基酸序列通过引用具体地结合在此)。人类IL-6还被描述于海瑞尼(Hirano)等人,《自然》(Nature)324(6092),73-76(1986)中。这些登录号、专利申请以及杂志文章通过引用清楚地结合在此。
在一个实施例中,IL-6多肽是人类IL-6、其类似物、衍生物或片段。
在一些实施例中,本发明的抗体配制品包括抗-IL-6抗体。本发明的抗体特异性地结合至感兴趣的抗原或其片段上,并且不会特异性地结合至其他抗原或其片段上。例如,抗-I6抗体将会免疫专一地结合至白细胞介素-6的多肽上并且不会特异地结合至其他多肽上。优选地,当与对其他多肽或其他多肽的片段的亲和力相比较时,免疫专一地结合至IL-6的抗体或抗体片段对IL-6或IL-6多肽的片段具有更高的亲和力。抗体的亲和力是其在单一抗原-抗体位点与特异性抗原的结合的量度,并且在本质上是在抗体的抗原-结合位点和特定的表位之间的相互作用中存在的所有的吸引力和斥力之和。抗体对特定的抗原(例如IL-6多肽或IL-6多肽的片段)的亲和力可以通过平衡常数K表示、通过方程式K=[Ag Ab]/[Ag][Ab]定义,该方程式是抗体-结合位点的亲和力,其中[Ag]是游离抗原的浓度,[Ab]是游离抗体的浓度并且[Ag Ab]是抗原-抗体复合物的浓度。在抗原和抗体强烈地一起进行反应的情况下,将有非常少的游离抗原或游离抗体,并且因此平衡常数或抗体的亲和力将是高的。高亲和力的抗体发现于抗原和抗体之间有良好的配合的情况中(对于有关抗体亲和力的讨论,参见西加尔(Sigal)和罗恩·埃德(Ron ed.),1994,《免疫学和炎症—基本机制和临床后果》(Immunology and Inflammation-Basic Mechanisms and Clinical Consequences),麦格劳-希尔公司(McGraw-Hill,Inc.)纽约于第56-57页;以及西摩(Seymour)等人,1995,《免疫学—健康科学的介绍》(Immunology-An Introduction for the Health Sciences),麦格劳-希尔图书公司(McGraw-Hill Book Company),澳大利亚于第31-32页)。优选地,免疫专一地结合至IL-6多肽或其片段的抗体或抗体片段不会与其他抗原发生交叉反应。即,以比针对其他多肽或其他多肽的片段更高的能量免疫专一地结合至IL-6多肽或其片段的抗体或抗体片段(参见例如保罗·埃德(Paul ed.),1989,《基础免疫学》(Fundamental Immunology),第二版,雷文出版社(Raven Press),纽约于第332-336页对于有关抗体特异性的讨论)。免疫专一地结合至IL-6多肽的抗体或抗体片段可以例如通过免疫测定(诸如放射性免疫测定(RIA)、酶连免疫吸附测定(ELISA)以及BIAcore测定或本领域普通技术人员已知的其他技术来鉴定(参见例如西摩尔(Seymour)等人,1995,《免疫学—健康科学的介绍》(Immunology-An Introduction for the Health Sciences),麦格劳-希尔图书公司(McGraw-Hill Book Company),澳大利亚于第33-41页对于不同测定以确定体内抗体-抗原的相互作用的讨论)。免疫专一地结合至IL-6多肽或其片段的抗体或抗体片段仅仅对抗IL-6多肽并且不会显著地对抗其他活动。
如在此使用的,在抗体的背景下术语“类似物”或“抗体类似物”指的是第二抗体,即抗体类似物,其具有与抗体相似的或一致的功能,但是不一定包括抗体相似的或一致的氨基酸序列,或具有抗体相似或一致的结构。具有相似氨基酸序列的抗体指的是这样一种抗体类似物,其满足至少以下之一:(a)抗体类似物具有与该抗体的氨基酸序列至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少99%一致的氨基酸序列;(b)由核苷酸序列编码的抗体类似物,该核苷酸序列在严格条件下杂交至对该抗体的至少5个连续氨基酸残基、至少10个连续氨基酸残基、至少15个连续氨基酸残基、至少20个连续氨基酸残基、至少25个连续氨基酸残基、至少40个连续氨基酸残基、至少50个连续氨基酸残基、至少60个连续氨基酸残基、至少70个连续氨基酸残基、至少80个连续氨基酸残基、至少90个连续氨基酸残基、至少100个连续氨基酸残基、至少125个连续氨基酸残基、或至少150个连续氨基酸残基进行编码的核苷酸序列;以及(c)由具有与编码该抗体的核苷酸序列至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少99%的一致性的核苷酸序列编码的抗体类似物。与抗体具有相似结构的抗体类似物指的是蛋白质剂,其具有与该抗体相似的二级、三级或四级结构。抗体类似物或抗体的结构可以通过本领域普通技术人员已知的方法来确定,包括但不限于肽测序、X射线衍射晶体分析法、核磁共振、圆二色谱、以及晶体电子显微镜。
为了确定两个氨基酸序列或两个核酸序列的百分比一致性,以最优比较为目的将序列进行比对(例如可以将缺口导入第一氨基酸或核酸序列的序列中,用于与第二氨基酸或核酸序列进行最优比对)。然后对在相应的氨基酸位置或核苷酸位置处的氨基酸残基或核苷酸进行比较。当在第一序列中的一个位置被与在第二序列中的相应位置相同的氨基酸残基或核苷酸占据时,那么这些分子在那个位置是相同的。这两个序列之间的百分比一致性是由这些序列所共有的相同位置的数目的函数(即%一致性=相同的重叠位置的数目/位置的总数目x 100%)。在一个实施例中,这两个序列是相同长度的。
在两个序列之间的百分比一致性的确定还可以使用数学算法来完成。用于两个序列的比较的数学算法的一个非限制性实例是卡尔林(Karlin)和阿尔丘尔(Altschul),1990,《美国国家科学院院刊》(Proc.Natl.Acad.Sci U.S.A.)87:2264-2268的算法,按照在卡尔林和阿尔丘尔,1993,《美国国家科学院院刊》90:5873-5877中的进行修改。这种算法被结合到阿尔丘尔等人,1990,《分子生物学杂志》(J.Mol.Biol.)215:403的NBLAST和XBLAST程序中。BLAST核苷酸搜索可以用NBLAST核苷酸程序参数设置(例如对于得分=100、字长=12)来进行,以获得与本发明的核酸分子同源的核苷酸序列。BLAST蛋白质搜索可以用XBLAST程序参数设置(例如得分-50、字长=3)来进行,以获得与本发明的蛋白分子同源的氨基酸序列。为获得用于比较目的的空位比对,可以如阿特休尔(Altschul)等人,1997,《核酸研究》(Nucleic Acids Res.)25:3389-3402中所描述的来使用Gapped BLAST。可替代地,可以使用PSI-BLAST进行迭代搜索,该迭代搜索检测在分子(Id)之间的远缘关系。当使用BLAST、空位BLAST、以及PSI-Blast程序时,可以使用对应程序的(例如XBLAST和NBLAST的)缺省参数(参见例如NCBI网站)。用于比较序列的数学算法的另一个优选的、非限制性实例是迈尔斯(Myers)和米勒(Miller),1988,《生物科学中的计算机应用》(CABIOS)4:11-17的算法。将这样一种算法结合到ALIGN程序(版本2.0)中,它是GCG序列比对软件包的一部分。当利用ALIGN程序来比较多个氨基酸序列时,可以使用PAM 120权重残基表、空位长度罚分12、以及空位罚分4。
在一些实施例中,将抗体配制品中的抗体在添加至抗体配制品中之前进行纯化。术语“分离,”和“纯化”指的是将抗体从含有抗体的组合物中的杂质或其他污染物中分离,例如该组合物包含宿主细胞蛋白。在一些实施例中,至少杂质的50%、70%、80%、90%、95%、98%、99%、99.5%或99.9%(w/w)被纯化与抗体分离。例如,在一些实施例中,抗体(例如抗-IL6(YTE)抗体)的纯化包括将抗体与最初存在于组合物中的99%(w/w)的宿主细胞蛋白进行分离。
在一些实施例中,术语“分离”和“纯化”指的是将抗体(例如抗-IL6(YTE)抗体)从组合物中的杂质或其他污染物中进行分离以在一定程度上与政府组织(例如世界卫生组织或美国食品和药物管理局)的准则一致。
本发明的抗体配制品可以用于药用目的。在药物应用中使用的抗体通常必须具有高水平的纯度,尤其关于来自细胞培养的污染物,包括细胞蛋白污染物、细胞DNA污染物、病毒和其他可传递的试剂。参见“世卫组织对使用动物细胞作为体外底物用于生产生物制剂的要求:生物物质要求编号50”编号878附件1,1998。针对有关污染物的考虑,世界卫生组织(WHO)确立了不同污染物的水平限值。例如,WHO建议对于蛋白产品而言每个剂量的DNA限值小于10ng。同样地,美国食品与药品管理局(FDA)设定了小于或等于0.5pg/mg蛋白的DNA限值。因此,在一些实施例中,本发明针对满足或低于如由一个或多个政府组织(例如美国食品和药物管理局和/或世界卫生组织)所限定的污染物限值的抗体配制品。
在一些实施例中,在此所描述的抗体配制品是药学上可接受的。“药学上可接受的”指的是抗体配制品,其在合理的医学判断力范围内适合用于与人类和动物的组织接触而没有过度的毒性、或其他与合理益处/风险比相称的并发症。
抗体配制品的纯度可以变化。在一些实施例中,感兴趣的治疗性抗体(例如抗-IL6(YTE)抗体)占到存在于抗体配制品中的总多肽的大于90%(wt/wt)。在一些实施例中,感兴趣的治疗性抗体(例如抗-IL6(YTE))占到存在于抗体配制品中的总多肽的大于95%(wt/wt)、98%(wt/wt)、99%(wt/wt)、99.5%(wt/wt)或99.9%(wt/wt)。
在抗体配制品中的抗体的浓度可以变化。在一些实施例中,在抗体配制品中的抗体浓度是大于约20mg/mL、大于约50mg/mL、大于约75mg/mL、大于约100mg/mL、大于约125mg/mL、大于约150mg/mL、大于约175mg/mL、或大于约200mg/mL。在一些实施例中,在抗体配制品中的抗体浓度是约20mg/mL至300mg/mL、约50mg/mL至约250mg/mL、约75mg/mL至约200mg/mL、约100mg/mL至约175mg/mL、约125mg/mL至约175mg/mL、约50mg/mL、约100mg/mL、或约150mg/mL。
本发明的抗体配制品可以包括精氨酸。精氨酸是条件上非必需的氨基酸,其可以由下式表示:
精氨酸,如在此使用的,可以包括精氨酸的游离碱形式以及其任何及所有的盐。在一些实施例中,精氨酸包括其药学上可接受的盐。例如,精氨酸将包括精氨酸盐酸盐。精氨酸,如在此使用的,还包括所有对映异构体(例如L-精氨酸和D-精氨酸)、以及对映异构体的任何组合(例如50%L-精氨酸和50%D-精氨酸;90%-100%L–精氨酸和10%-0%D-精氨酸,等)。在一些实施例中,术语“精氨酸”包括大于99%的L-精氨酸以及小于1%的D-精氨酸。在一些实施例中,术语“精氨酸”包括对映异构体纯的L-精氨酸。在一些实施例中,精氨酸是医药级精氨酸。
精氨酸被预期为在热力学上使不同抗体例如抗-IL6(YTE)抗体去稳定。参见例如图1。本领域的技术人员将预期对于给定的蛋白(例如抗-IL6(YTE)抗体)增加去稳定剂(例如精氨酸)的数量,将能够提高从蛋白质天然形式改变其结构(例如使其变性)的能力。尽管不受限于任何具体理论,诸位发明人已经发现即使增加抗体配制品中精氨酸的数量事实上确实降低了熔解温度(通过DSC测量),该精氨酸实际上提供对于抗-IL6(YTE)抗体的稳定效应,而不是去稳定效应,如通过在存储时SE-HPLC降解速率所测量的。因此,在一些实施例中,高浓度的精氨酸可以存在于抗体配制品中并且对配制品中的抗体提供稳定效应。
不同浓度的精氨酸可以存在于该抗体配制品中。在一些实施例中,该抗体配制品包括大于20mM的精氨酸、大于25mM的精氨酸、大于50mM的精氨酸、大于75mM的精氨酸、大于100mM的精氨酸、大于125mM的精氨酸、大于150mM的精氨酸、大于175mM的精氨酸、大于200mM的精氨酸、205mM的精氨酸、大于210mM的精氨酸、大于215mM的精氨酸、大于220mM的精氨酸、大于230mM的精氨酸、大于240mM的精氨酸、大于250mM的精氨酸、大于275mM的精氨酸、大于300mM的精氨酸、或大于350mM的精氨酸。在一些实施例中,该抗体配制品包括大于200mM的精氨酸。在一些实施例中,该抗体配制品包括大于220mM的精氨酸。
在一些实施例中,该抗体配制品包括高达800mM的精氨酸、高达700mM的精氨酸、高达650mM的精氨酸、高达600mM的精氨酸、高达550mM的精氨酸、高达500mM的精氨酸、高达450mM的精氨酸、或高达400mM的精氨酸。
在一些实施例中,该抗体配制品包括25mM至600mM的精氨酸、50mM至600mM的精氨酸、75mM至600mM的精氨酸、100mM至600mM的精氨酸、125mM至500mM的精氨酸、150mM至400mM的精氨酸、175mM至400mM的精氨酸、200mM至350mM的精氨酸。在一些实施例中,该抗体配制品包括150mM至400mM的精氨酸。
如在此所描述的,包括升高浓度的精氨酸的抗体配制品随着时间具有增加的稳定性。抗体配制品中的抗体的稳定性可以通过不同方式来确定。在一些实施例中,该抗体稳定性是通过尺寸排阻色谱法(SEC)来确定。SEC基于分析物的流体动力学大小、扩散系数和表面性能的组合来分离分析物(例如大分子,诸如蛋白和抗体)。因此,例如,SEC可以将处于其天然三维构象的抗体从处于不同变性状态的抗体和/或已经被降解的抗体中分离。在SEC中,固定相通常是由装入至在玻璃或钢柱内的密集型三维基质中的惰性颗粒组成。该流动相可以是纯水、水性缓冲液、有机溶剂、这些的混合物、或其他溶剂。固定相颗粒具有小孔和/或通道,这些小孔和/或通道将仅允许一定尺寸以下的种类进入。因此大颗粒被排除在这些孔和通道之外,但是较小的颗粒从流动的流动相中去除。颗粒在固定相孔中固定所花费的时间部分地取决于它们可以渗透进入孔中的距离。它们从流动相流中去除使得它们需花费更长时间来进行从柱的洗脱,并且导致颗粒之间基于其尺寸的不同而分离。
在一些实施例中,将SEC与鉴定技术组合以鉴定或表征蛋白或其片段。蛋白鉴定和表征可以通过以下不同技术来完成,包括但不限于色谱技术,例如高效液相色谱(HPLC)、免疫测定、电泳、紫外-可见光/可见/红外光谱、拉曼光谱、表面增强拉曼光谱、质谱、气相色谱、静态光散射(SLS)、傅里叶变换红外光谱(FTIR)、圆二色谱(CD)、尿素诱导的蛋白解折叠技术、固有色氨酸荧光、差示扫描量热法、和/或ANS蛋白结合。
在一些实施例中,蛋白鉴定是通过高压液相色谱法来实现的。各种仪器和设备是本领域普通技术人员用以进行HPLC所已知的。一般地,HPLC涉及将包含感兴趣的蛋白的液体溶剂装载至分离柱上,在该分离柱中发生分离。HPLC分离柱装满了固体颗粒(例如二氧化硅、聚合物、或吸附剂),并且将样品混合物在其与柱颗粒相互作用时分离出化合物。HPLC分离受到以下项的影响:液体溶剂的条件(例如压力、温度)、样品混合物与液体溶剂之间的化学相互作用(例如疏水性、质子化等)、以及样品混合物与装配在分离柱内部的固体颗粒之间的化学相互作用(例如配体亲和力、离子交换,等)。
在一些实施例中,SEC和蛋白鉴定在相同设备之内或同时地发生。例如,SEC和HPLC可以组合,常被称为SE-HPLC。
通过使用已知的技术(诸如在此鉴别的那些技术)分离不同抗体和抗体降解产品,可以确定抗体配制品中抗体的稳定性。如在此使用的,术语“稳定性”通常与维持完整性或与使得降解、变性、聚集或生物活性剂(诸如蛋白、多肽或另外的生物活性大分子)的解折叠最小化相关。如在此使用的,“改进的稳定性”通常表示在已知的导致降解、变性、聚集或解折叠的条件下,与对照蛋白、肽或另外的生物活性大分子相比,蛋白(例如抗体,诸如抗-IL6(YTE))、肽或感兴趣的另外的生物活性大分子维持了更高的稳定性。例如,短语“存在精氨酸时改进的稳定性”将反映在精氨酸的存在下,感兴趣蛋白(例如抗-IL6(YTE)抗体)相对于相同的抗体(其中不存在精氨酸)将具有降低的量的抗-IL6(YTE)抗体的降解、变性、聚集或解折叠。
在一些实施例中,稳定性指的是具有低至聚集的不可检测水平的抗体配制品。如在此使用的,短语“低至聚集的不可检测水平”指的是包含按蛋白的重量计,不多于5%、不多于4%、不多于3%、不多于2%、不多于1%以及不多于0.5%聚集的样品,如通过高效尺寸排阻色谱(HPSEC)、静态光散射(SLS)、傅里叶变换红外光谱(FTIR)、圆二色谱(CD)、尿素诱导的蛋白解解折叠技术、固有色氨酸荧光、差示扫描量热法、以及l-苯胺基-8-萘磺酸(ANS)蛋白结合技术所测量的。
在一些实施例中,该抗体配制品具有低至不可检测水平的片段化。如在此使用的,术语“低至不可检测水平的片段化”指的是例如在如通过HPSEC确定的单峰中、或通过还原毛细管凝胶电泳(rCGE)的两个峰(例如重链或轻链)(或因存在多个亚基,作为许多峰)中占到总蛋白的等于或多于80%、85%、90%、95%、98%或99%的样品,代表非-降解的抗体或其非-降解的片段并且不包含另外的各自占到总蛋白的多于5%、多于4%、多于3%、多于2%、多于1%、或多于0.5%的单一峰。如在此使用的,术语“还原毛细管凝胶电泳”指的是在足以还原抗体中的二硫键的还原条件下的毛细管凝胶电泳。
本领域的普通技术人员将会理解的是蛋白的稳定性不仅取决于配制品的组成,还取决于其他特征。例如,稳定性可以受温度、压力、湿度以及辐射的外部形式的影响。因此,除非另外说明,在此提及的稳定性被认为是在2℃-8℃、一个大气压、60%相对湿度和自然背景水平的辐射下进行测量的。
术语“稳定的”是相对的并且不是绝对的。因此,对于在此的目的,在一些实施例中,当抗体被储存在2℃至8℃下持续6个月时,如通过SEC HPLC所确定的,如果低于20%、低于15%、低于10%、低于5%或低于2%的抗体被降解、变性、凝集或解折叠的话,该抗体是稳定的。在一些实施例中,当抗体被储存在2℃至8℃下持续12个月时,如通过SEC HPLC所确定的,如果低于20%、低于15%、低于10%、低于5%或低于2%的抗体被降解、变性、凝集或解折叠的话,该抗体是稳定的。在一些实施例中,当抗体配制品中的抗体被储存在2℃至8℃下持续18个月时,如通过SEC HPLC所确定的,如果低于20%、低于15%、低于10%、低于5%或低于2%的抗体被降解、变性、凝集或解折叠的话,该抗体是稳定的。在一些实施例中,当抗体配制品中的抗体被储存在2℃至8℃下持续24个月时,如通过SEC HPLC所确定的,如果低于20%、低于15%、低于10%、低于5%或低于2%的抗体被降解、变性、凝集或解折叠的话,该抗体是稳定的。
在一些实施例中,当抗体被储存在23℃至27℃下持续3个月时,如通过SEC HPLC所确定的,如果低于20%、低于15%、低于10%、低于5%或低于2%的抗体被降解、变性、凝集或解折叠的话,该抗体是稳定的。在一些实施例中,当抗体被储存在23℃至27℃下持续6个月时,如通过SEC HPLC所确定的,如果低于20%、低于15%、低于10%、低于5%或低于2%的抗体被降解、变性、凝集或解折叠的话,该抗体是稳定的。在一些实施例中,当抗体被储存在23℃至27℃下持续12个月时,如通过SEC HPLC所确定的,如果低于20%、低于15%、低于10%、低于5%或低于2%的抗体被降解、变性、凝集或解折叠的话,该抗体是稳定的。在一些实施例中,当抗体被储存在23℃至27℃下持续24个月时,如通过SEC HPLC所确定的,如果低于20%、低于15%、低于10%、低于5%或低于2%的抗体被降解、变性、凝集或解折叠的话,该抗体是稳定的。
在一些实施例中,当抗体被储存在40℃下时,如通过SEC HPLC所确定的,如果每月低于6%、低于4%、低于3%、低于2%或低于1%的抗体被降解、变性、凝集或解折叠的话,该抗体是稳定的。在一些实施例中,当抗体被储存在5℃下时,如通过SEC HPLC所确定的,如果每月低于6%、低于4%、低于3%、低于2%或低于1%的抗体被降解、变性、凝集或解折叠的话,该抗体是稳定的。
在一些实施例中,如通过本领域普通技术人员已知的抗体结合测定(如例如ELISA等)所测量的,与参考抗体相比,如果抗体历经8周、4个月、6个月、9个月、12个月或24个月的时期中展现出配制品中的抗体(包括其抗体片段)的结合活性具有非常小的损失乃至没有损失,则本发明的抗体配制品可以被认为是稳定的。
在此所描述的抗体配制品可以具有不同粘度。测量抗体配制品粘度的方法对本领域普通技术人员是已知的,并且可以包括,例如具有50mm、40mm或20mm锥形配件的流变仪(例如安东帕(Anton Paar)MCR301流变仪)。在本发明的一些实施例中,粘度的高剪切极限被报道为每秒1000的剪切速率。在一些实施例中,抗体配制品具有小于20cP、小于18cP、小于15cP、小于13cP、或小于11cP的粘度。在一些实施例中,该抗体配制品具有小于14cP的粘度。本领域的普通技术人员将会理解的是粘度依赖于温度,因此,除非另外说明,在此提供的粘度是在23℃下(除非另外说明)测量的。在一些实施例中,该抗体配制品的粘度是在23℃下小于14cP。
术语“注射力”是将抗体配制品通过针所需要的压力的量(用牛顿表示)。当向受试者给予抗体配制品时,注射力与由该抗体配制品提供的阻力量相关。注射力将取决于进行给予的针的规格号以及温度。在一些实施例中,当抗体配制品穿过27号薄壁PFS针(例如在国际标准化协会(ISO)文件“用于生产医疗器械的不锈钢针管”(“Stainless steel针tubing for the manufacture of medical devices”)(ISO 9626:1991)所定义的以及由BD医疗制药系统(富兰克林湖,新泽西州)生产的)时,其具有小于15N、12N、10N、或8N的注射力。在一些实施例中,当抗体配制品穿过25或26号注射针时,其具有小于15N、12N、10N、或8N的注射力。
抗体配制品可以具有不同的摩尔渗透压浓度。测量抗体配制品的摩尔渗透压浓度的方法对本领域普通技术人员来说是已知的,并且可以包括例如渗压计(例如先进仪器公司有限公司(Advance Instrument Inc)2020冰点降低渗压计)。在一些实施例中,配制品具有在200和600mosm/kg之间、在260和500mosm/kg之间、或在300和450mosm/kg之间的摩尔渗透压浓度。在一些实施例中,配制品不包括渗压剂。
本发明的抗体配制品可以具有不同pH水平。在一些实施例中,抗体配制品的pH是在4和7之间、在4.5和6.5之间、或在5和6之间。在一些实施例中,抗体配制品的pH是6.0。不同方式(包括但不限于适当的缓冲液的添加)可以在实现所希望的pH水平中使用。
各种其他组分可以被包含在该抗体配制品中。在一些实施例中,抗体配制品可以包括缓冲液(例如乙酸盐、磷酸盐或柠檬酸盐缓冲液)、表面活性剂(例如聚山梨醇酯)、和/或稳定剂(例如人类白蛋白)等。在一些实施例中,抗体配制品可以包括药学上可接受的载体,包括例如离子交换剂、氧化铝、硬脂酸铝、卵磷脂、血清蛋白(如人类血清白蛋白)、缓冲物质(如磷酸盐)、蔗糖、甘氨酸、山梨酸、山梨酸钾、饱和的植物脂肪酸的部分甘油酯混合物、水、盐或者电解质(诸如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐)、聚乙烯-聚氧丙烯-嵌段聚合物、以及聚乙二醇。
在一些实施例中,该抗体配制品进一步包括表面活性剂。在一些实施例中,该表面活性剂选自下组,该组由以下各项组成:聚山梨醇酯、普朗尼克类、苄泽类、和其他非离子表面活性剂。在一些实施例中,该表面活性剂是聚山梨醇酯80。在配制品中的表面活性剂浓度可以变化。例如,在一些实施例中,配制品中的表面活性剂浓度是约0.001%至约1%、约0.005%至约0.5%、约0.0.01%至约0.1%、或约0.05%至约0.07%。
在一些实施例中,该抗体配制品进一步包括组氨酸。在一些实施例中,配制品中组氨酸浓度是约5mM至约200mM、约10mM至约100mM、约20mM至约50mM、或约25mM。
在一些实施例中,不同组分可以从抗体配制品中省略,或可以是“基本上不含”的组分。如在此使用的,术语“基本上不含”指的是这样的抗体配制品,所述配制品包含低于0.01%、低于0.001%、低于0.0005%、低于0.0003%、或低于0.0001%的所指定的组分。
在一些实施例中,该配制品基本上不含海藻糖,即该抗体配制品包含低于0.01%、低于0.001%、低于%0.0005%、低于0.0003%、或低于0.0001%的海藻糖。在一些实施例中,该配制品包括约10mM至约1000mM、约50mM至约500mM、约100mM至约350mM、约150mM至约250mM、约180mM至约225mM浓度的海藻糖。在一些实施例中,组合使用海藻糖与精氨酸。精氨酸和海藻糖的浓度可以变化并且可以是彼此独立的。在一些实施例中,精氨酸:海藻糖的摩尔比可以是约0:1、约1:20、约1:10、约1:8、约1:5、约1:2、约1:1、约2:1、约5:1、约10:1、或约10:0。
在一些实施例中,抗体配制品基本上不含糖类,即抗体配制品,所述配制品包含低于0.01%、低于0.001%、低于0.0005%、低于0.0003%、或低于0.0001%的糖类。如在此使用的,术语“糖类”指的是多元醇衍生物的一类分子。糖类通常被称为碳水化合物并且可以包含不同量的糖(糖(saccharide))单位,例如单糖、二糖和多糖。在一些实施例中,该配制品基本上不含二糖。在一些实施例中,该配制品基本上不含还原糖、非还原糖、或糖醇。在一些实施例中,该抗体配制品基本上不含组氨酸、脯氨酸、谷氨酸盐、山梨糖醇、二价金属离子、和/或琥珀酸盐。
在一些实施例中,本发明是针对稳定的低粘度抗体配制品,包括(a)约150mg/mL至约400mg/mL的抗体,例如抗-IL6抗体,(b)150mM至400mM的精氨酸,(c)0.01%至0.1%聚山梨醇酯80,(d)5mM至100mM的组氨酸,其中该抗体配制品在23℃下具有小于20cP的粘度。在一些实施例中,该抗体配制品包括(a)150mg/mL的抗体,例如抗-IL6抗体,(b)25mM组氨酸(例如L-组氨酸/L-组氨酸盐酸盐一水合物),(c)220mM精氨酸(例如精氨酸HCl)以及(d)0.07%(w/v)聚山梨醇酯80,pH为6.0。在一些实施例中,该抗体配制品包括(a)150mg/mL的抗体,例如抗-IL6抗体,(b)25mM组氨酸(例如L-组氨酸/L-组氨酸盐酸盐一水合物),(c)150mM精氨酸(例如精氨酸HCl)以及(d)0.07%(w/v)聚山梨醇酯80,pH为6.0。
在一些实施例中,本发明是针对稳定的低粘度抗体配制品,包括(a)约50mg/mL至约200mg/mL的抗体,例如抗-IL6抗体,(b)20mM至400mM的精氨酸,(c)0.01%至0.1%聚山梨醇酯80,(d)5mM至100mM的组氨酸,以及任选地,(e)约50mM至约400mM的海藻糖,其中该抗体配制品在23℃下具有小于20cP的粘度。在一些实施例中,该抗体配制品包括(a)50mg/mL的抗体,例如抗-IL6抗体,(b)25mM组氨酸(例如L-组氨酸/L-组氨酸盐酸盐一水合物),(c)225mM海藻糖,以及(d)0.05%(w/v)聚山梨醇酯80,pH为6.0。在一些实施例中,该抗体配制品包括(a)100mg/mL的抗体,例如抗-IL6抗体,(b)25mM组氨酸(例如L-组氨酸/L-组氨酸盐酸盐一水合物),(c)180mM海藻糖,(d)25mM精氨酸,以及(e)0.07%(w/v)聚山梨醇酯80,pH为6.0。
在一些实施例中,本发明是针对稳定的低粘度抗体配制品,包括:(a)约150mg/mL至约400mg/mL的抗体,其中该抗体包括SEQ ID NO:1和2的氨基酸序列,(b)150mM至400mM的精氨酸,(c)0.01%至0.1%聚山梨醇酯80,(d)10mM至50mM的组氨酸,其中该抗体配制品在23℃下具有小于20cP的粘度。在一些实施例中,该抗体配制品包括(a)150mg/mL的抗体,其中该抗体包括SEQ ID NO:1和2的氨基酸序列,(b)25mM组氨酸(例如L-组氨酸/L-组氨酸盐酸盐一水合物),(c)220mM精氨酸(例如精氨酸HCl)以及(d)0.07%(w/v)聚山梨醇酯80,pH为6.0。在一些实施例中,该抗体配制品包括(a)150mg/mL的抗体,其中该抗体包括SEQ ID NO:1和2的氨基酸序列,(b)25mM组氨酸(例如L-组氨酸/L-组氨酸盐酸盐一水合物),(c)150mM精氨酸(例如精氨酸HCl)以及(d)0.07%(w/v)聚山梨醇酯80,pH为6.0。
在一些实施例中,本发明是针对稳定的低粘度抗体配制品,包括:(a)约50mg/mL至约200mg/mL的抗体,其中该抗体包括SEQ ID NO:1和2的氨基酸序列,(b)20mM至400mM的精氨酸,(c)0.01%至0.1%聚山梨醇酯80,(d)5mM至100mM的组氨酸,以及任选地,(e)约50mM至约400mM的海藻糖,其中该抗体配制品在23℃下具有小于20cP的粘度。在一些实施例中,该抗体配制品包括(a)50mg/mL的抗体,其中该抗体包括SEQ ID NO:1和2的氨基酸序列,(b)25mM组氨酸(例如L-组氨酸/L-组氨酸盐酸盐一水合物),(c)225mM海藻糖,以及(d)0.05%(w/v)聚山梨醇酯80,pH为6.0。在一些实施例中,该抗体配制品包括(a)100mg/mL的抗体,其中该抗体包括SEQ ID NO:1和2的氨基酸序列,(b)25mM组氨酸(例如L-组氨酸/L-组氨酸盐酸盐一水合物),(c)180mM海藻糖,(d)25mM精氨酸,以及(e)0.07%(w/v)聚山梨醇酯80,pH为6.0。
在一些实施例中,本发明是针对通过给予在此所描述的抗体配制品治疗患有炎症痛的患者的方法。在一些实施例中,本发明是针对通过给予在此所描述的抗体配制品治疗具有活化的IL-6依赖途径的患者的方法。在一些实施例中,本发明是针对治疗受试体内疼痛的方法,该方法包括给予在此所描述的抗体配制品。在一些实施例中,本发明是针对治疗与受试者体内的骨性关节炎相关联的疼痛的方法,该方法包括给予在此所描述的抗体配制品。在一些实施例中,本发明是针对治疗与受试者体内的慢性下背痛相关联的疼痛的方法,该方法包括给予在此所描述的抗体配制品。
如在此使用的,“受试者”可以与“患者”互换使用并且指的是被分类为哺乳动物的任何动物,包括人类和非人类,例如但不限制于家畜和农畜、动物园动物、体育用动物以及宠物。在一些实施例中,受试者指的是人类。
术语“治疗”(“treat”和“treatment”)指的是治疗性治疗和预防、保持或防止性措施,其中目标是预防或延缓(减轻)不希望的生理病症、失调或疾病,或者获得有益的或希望的临床结果。术语“治疗”(“treat”,“treatment”和“treating”)指的是此类疾病或失调(例如表征为IL-6多肽的异常表达和/或活性的疾病或失调、表征为IL-6受体或其一个或多个亚基的异常表达和/或活性的疾病或失调、自身免疫性疾病、炎性疾病、增生性疾病、或感染(优选呼吸道感染))的进展、严重性和/或持续时间的降低或改善,或给予一种或多种疗法(包括但不限于给予一种或多种预防剂或治疗剂)导致的其一种或多种症状的改善。在某些实施例中,此类术语指的是减少与不同病症相关联的疼痛。在其他实施例中,此类术语指的是通过肥大细胞降低致炎因子的释放,或降低此类致炎因子的生物效应。在其他实施例中,此类术语指的是降低超增生性细胞(例如癌细胞)的生长、形成和/或数量增加。在又另外的实施例中,此类术语指的是根除、去除或控制原发的、区域的或转移性癌症(例如癌症蔓延的最小化或延迟)。在又另外的实施例中,此类术语指的是非小细胞肺癌的根除、去除或控制(例如癌症的蔓延的最小化或延迟)。在又另外的实施例中,此类术语指的是根除、去除或控制类风湿性关节炎。在一些实施例中,本发明是针对治疗与受试者体内的类风湿关节炎的方法,该方法包括给予在此所描述的抗体配制品。
在一些实施例中,给予治疗有效量的在此所述的抗体配制品以治疗病症。如在此使用的,术语“治疗有效量”指的是一种疗法(例如免疫专一地结合至IL-6多肽的抗体)的量,该量足以降低疾病或失调(例如表征为IL-6多肽的异常表达和/或活性的疾病或失调、表征为IL-6受体或其一个或多个亚基的异常表达和/或活性的疾病或失调、自身免疫性疾病、炎性疾病、增生性疾病、或感染(优选呼吸道感染))或其一种或多种症状的严重性、降低呼吸道病症的持续时间、改善此类疾病或失调的一种或多种症状、预防此类疾病或失调的发展、引起此类疾病或病症的消退、或增强或改进其他疗法的一种或多种治疗效应。在一些实施例中,治疗有效量不能事先指定,并且可以由照护者(例如,由医师或其他医疗服务提供者)使用各种方式(例如剂量调整)确定。适当的治疗有效量还可以通过常规实验使用例如动物模型来确定。
术语“疗法”(“therapies”和“therapy”)可以指的是任何可以用于预防、治疗、管理或改善疾病或失调(例如表征为IL-6多肽的异常表达和/或活性的疾病或失调、表征为IL-6受体或其一个或多个亚基的异常表达和/或活性的疾病或失调、自身免疫性疾病、炎性疾病、增生性疾病、或感染(优选呼吸道感染))或其一种或多种症状的一种或多种方案、一种或多种方法、和/或一种或多种药剂。在某些实施例中,术语“疗法”(“therapy”和“therapy”)指的是在治疗、管理、预防或改善此类疾病或失调或熟练医务人员已知的一种或多种症状中有用的抗-病毒疗法、抗-细菌疗法、抗-真菌疗法、生物疗法、支持疗法、和/或其他疗法。
如在此使用的,术语“治疗方案”指的是用于定量和按时间安排来给予一种或多种治疗有效的疗法(例如治疗剂)的方案。
本发明的抗体配制品的给药途径可以例如经由口服、经肠胃外、经吸入或局部给药模式。如在此所用的术语肠胃外包括例如静脉、动脉、腹膜内、肌内、皮下、直肠或经阴道给药。在一些实施例中,经分离的抗体是抗-IL6抗体(例如抗-IL6(YTE)抗体),并且给药途径是皮下注射。虽然所有这些给药形式可清楚地考虑为是在本发明的范围之内,在一些实施例中,抗体配制品适合于经由注射给予,特别是适合于静脉或动脉注射或滴注。
在一些实施例中,在给予至受试者之前,将抗体配制品稀释至静脉配制品中。在一些实例中,当将抗体配制品稀释至静脉配制品(例如IV袋)的时候,可见颗粒形成可以发生。为了解决颗粒配制品,在一些实施例中,提供了用于在将抗体配制品稀释至静脉输注袋中时减少颗粒的形成的方法,该方法包括在添加抗体配制品之前,向静脉输注袋中添加缓冲液和表面活性剂。
术语“IV袋保护剂”指的是在将在此所述的抗体配制品稀释至静脉输注袋中之前,将表面活性剂添加至静脉输注袋中。还可以在添加本领域普通技术人员已知的其他抗体配制品(例如冻干的抗体配制品)之前将该IV袋保护剂添加至静脉输注袋中。
适合用作IV袋保护剂的表面活性剂通常是适合在IV配制品中使用的那些。在一些实施例中,在IV袋保护剂中使用的表面活性剂与在抗体配制品中使用的缓冲液是相同的。例如,如果该抗体配制品包括作为表面活性剂的聚山梨醇酯80,则在将抗体配制品添加至静脉输注袋中之前,聚山梨醇酯80将被添加至静脉输注袋中。
在一些实施例中,该IV袋保护剂包括表面活性剂,当将该表面活性剂添加至IV配制品中时它将在IV配制品中产生约0.006%至约0.018%表面活性剂、约0.008%至约0.015%表面活性剂、约0.009%至约0.012%表面活性剂、约0.009%表面活性剂、约0.010%表面活性剂、约0.011%表面活性剂或约0.012%表面活性剂的范围内的表面活性剂浓度。在一些实施例中,该表面活化剂是聚山梨醇酯80(PS80),当将该表面活化剂添加至IV配制品时将在IV配制品中产生约0.006%至约0.018%表面活性剂、约0.008%至约0.015%表面活性剂、约0.009%至约0.012%表面活性剂、约0.009%表面活性剂、约0.010%表面活性剂、约0.011%表面活性剂或约0.012%表面活性剂的范围内的表面活性剂浓度。在一些实施例中,在添加IV保护剂而得到的IV袋中的表面活性剂浓度将是与抗体配制品中的表面活性剂浓度大约相同的、大约是它的一半、或约七分之一。
已知了IV袋中所希望的表面活性剂最终浓度,技术人员即可以配制IV袋保护剂中所希望的表面活性剂浓度。例如,在一些实施例中,IV袋保护剂可以包括约0.01%至约10.0%的表面活性剂、约0.05%至约5%的表面活性剂、约0.1%至约2%的表面活性剂、或约0.5%至约1%的表面活性剂。
在一些实施例中,本发明可以针对试剂盒,该试剂盒包括(1)抗体配制品,以及(2)IV保护剂配制品。在一些实施例中,本发明可以针对试剂盒,该试剂盒包括(1)抗体配制品,以及(2)IV保护剂,该IV保护剂包括表面活性剂。在一些实施例中,该表面活性剂是聚山梨醇酯80。在一些实施例中,本发明可以针对试剂盒,该试剂盒包括(1)如在此所描述的抗体配制品,以及(2)IV保护剂。在一些实施例中,本发明可以针对试剂盒,该试剂盒包括(1)如在此所描述的抗体配制品,以及(2)IV保护剂,其中(i)该IV保护剂包括一个量的聚山梨醇酯80,当添加至IV配制品中时该量足以产生约0.006%至约0.018%范围中的聚山梨醇酯80。
在一些实施例中,本发明是针对IV配制品预处理的方法,例如在将抗体配制品稀释至IV配制品中之前的IV袋,该方法包括(1)将如在此所描述的IV保护剂添加至IV配制品中,并且(2)添加抗体配制品。
在一些实施例中,本发明是针对制备稳定的低粘度抗体配制品的方法,该方法包括:(a)将抗体浓缩至约150mg/mL至约400mg/mL;并且(b)将精氨酸添加至(a)的抗体中,以获得具有大于约150mM精氨酸浓度的抗体配制品。在一些实施例中,该方法进一步包括(c)添加组氨酸以获得具有10mM至100mM组氨酸浓度的抗体配制品。在一些实施例中,该方法进一步包括(d)添加表面活性剂,例如聚山梨醇酯80,以获得具有0.02%至0.1%的表面活性剂浓度的抗体配制品。
在一些实施例中,本发明是针对制备稳定的低粘度抗体配制品的方法,该方法包括:(a)将抗体浓缩至约100mg/mL至约400mg/mL;并且(b)将精氨酸添加至(a)的抗体中,以获得具有约100mM至约200mM精氨酸浓度的抗体配制品。在一些实施例中,该方法进一步包括(c)添加组氨酸以获得具有10mM至100mM组氨酸浓度的抗体配制品。在一些实施例中,该方法进一步包括(d)添加表面活性剂,例如聚山梨醇酯80,以获得具有0.02%至0.1%的表面活性剂浓度的抗体配制品。在一些实施例中,该方法进一步包括添加海藻糖以获得具有约100mM至约300mM海藻糖浓度的抗体配制品。
在一些实施例中,本发明是针对制备稳定的低粘度抗体配制品的方法,该方法包括:(a)将抗体浓缩至约50mg/mL至约400mg/mL;并且(b)将海藻糖添加至(a)的抗体中,以获得具有约100mM至约400mM海藻糖浓度的抗体配制品。在一些实施例中,该方法进一步包括(c)添加组氨酸以获得具有10mM至100mM组氨酸浓度的抗体配制品。在一些实施例中,该方法进一步包括(d)添加表面活性剂,例如聚山梨醇酯80,以获得具有0.02%至0.1%的表面活性剂浓度的抗体配制品。
在一些实施例中,本发明是针对制备稳定的低粘度抗体配制品的方法,该方法包括:(a)将抗体浓缩至约150mg/mL至约400mg/mL,其中该抗体包括SEQ ID NO:1和2的氨基酸序列;并且(b)将精氨酸添加至(a)的抗体以获得具有大于约150mM的精氨酸浓度的抗体配制品,其中(b)的抗体配制品是在水性溶液中并且在23℃下具有小于20cP的粘度,并且其中如通过SEC HPLC所确定的,(b)的抗体配制品在2℃至8℃下持续12个月是稳定的。
在一些实施例中,本发明的组合物和方法使得制造商能够以更有效的方式生产适用于向人类给予的抗体配制品,该方式为通过降低成本、减少方法步骤、降低错误机会、降低不安全或不适当添加剂引入的机会等等。在本发明中,可以不需冻干抗体的重构来给予抗体配制品。
实例
实例1
材料与方法
材料
使用的所有材料都是USP或多药典(Multicompendial)级别的。所有溶液和缓冲液是使用USP或HPLC水来制备,并且在进一步使用之前,通过0.2μm PVDF过滤器(密理博(Millipore),Millex GV,SLG033RB)进行过滤。将经纯化的抗-IL6(YTE)进行纯化。将用于稳定性研究的经纯化的抗-IL6(YTE)样品在消毒的无菌条件下在生物安全柜罩(Biosafety Cabinet Hood)(BSC)中进行制备。将散装材料储存在2℃-8℃下。
方法
i.蛋白浓度测定
通过使用安捷伦(Agilent)UV-Vis分光光度计在280nm下测定吸光度来确定抗-IL6(YTE)抗体浓度。使用测量的消光系数1.71(mg/mL)-1cm-1来计算蛋白质浓度。
ii.通过尺寸排阻色谱法进行纯度测定
在安捷伦(Agilent)HPLC系统上使用TSK-GEL G3000SWXL柱和SW保护柱(东曹生物科学公司(Tosoh Bioscience),蒙特哥梅里维尔(Montgomeryville),宾夕法尼亚州(PA))、使用在280nm处的UV检测来进行尺寸排阻色谱(SEC)分析。使用pH 6.8的流动相(包含0.1M磷酸钠、0.1M硫酸钠和0.05%(w/v)叠氮化钠),使用1.0mL/min的流速持续20分钟来测定样品。注射约250微克的蛋白。可溶的凝集体、单体和片段的洗脱分别发生在大约6至8分钟、8.5分钟和9至11.5分钟。
iii.通过反相色谱进行片段化水平的测定
使用安捷伦(Agilent)HPLC系统、用美国Michrom生物资源公司PLRP-S CM810092/00柱来测量片段化水平。
iv.视觉外观
对于可见颗粒、澄清度/乳光、和颜色遵循由PhEur(分别为第2.9.20、2.2.1和2.2.2节)改编的程序来进行目视检查。
v.不可见的颗粒分析
使用光遮蔽(HIAC 9705)或流式显微镜(布赖特威尔公司(Brightwell)微流成像仪,MFI)来进行不可见的颗粒分析。
vi.重量摩尔渗透压浓度(Osmolality)
使用先进仪器公司有限公司(Advance Instrument Inc.)2020冰点降低渗压计来测量重量摩尔渗透压浓度。
vii.粘度评估
使用安东帕(Anton Paar)MCR301流变仪来测量不同浓度的抗-IL6(YTE)配制品的粘度。
viii.配制品稳定性研究
将用不同赋形剂配制的抗-IL6(YTE)抗体装入透明的3cc、13mm玻璃小瓶中。为了加速筛选,将样品放置于在40℃/75%RH和25℃/60%RH以及5℃中以研究稳定性。通过SEC HPLC、RP HPLC来分析样品并且对这些小瓶针对颗粒进行视觉检查。此外,在适当的时候,针对效价、重量摩尔渗透压浓度、pH、HIAC和MFI来分析所选择的时间点。
ix.使用浊度进行胶体稳定性筛选
胶体稳定性是通过以下方式来筛选:在抗体配制品经受约62℃的升高的温度时,使用卡里伊柯丽斯多单元(Cary Eclipse multicell)紫外-可见分光光度计来测量不同的抗-IL6抗体配制品对时间的浊度。随时间的推移,当不太稳定的配制品形成微粒和沉淀(即在360nm处具有更高的吸光度)时其变得混浊,然而胶体更稳定的配制品保持透明持续较长的持续时间。
x.使用差示扫描量热法研究热稳定性
在VP-DSC超灵敏的差示扫描量热计(微量热公司,北安普顿,马萨诸塞州(Microcal,Northampton,MA))上使用96孔板以1mg/mL的蛋白浓度进行差示扫描量热法(DSC)实验。以每小时90℃的速率将样品从20℃加热到100℃。将归一化的热容(Cp)数据针对缓冲液基线进行校正。根据赋形剂对蛋白质构象稳定性的稳定作用,使用第一熔化转变(Tm1)和第二熔化转变(Tm2)来对赋形剂进行排列次序。
xi.使用差示扫描荧光测定法研究热稳定性
以约0.5mg/mL的蛋白浓度使用宝石橙(Sypro Orange)染料(英杰公司(Invitrogen),S6651)以5X水平(起始浓度是5000X)来进行差示扫描荧光测定法(DSF)实验。将赋形剂母液与蛋白/染料母液(约5mg/mL蛋白和50X染料)以9:1的比率混合以实现在不同赋形剂的等渗溶液中配制的目标水平。将染料连同蛋白溶液和缓冲液/赋形剂一起在96孔板中每孔25μl彻底混合。使用BioRad C1000热循环仪PCR酶标仪来测量由于染料-结合至解折叠的蛋白分子而造成的荧光增加。将样品以一式三份进行试验,并且每次读数持续10s的增量为0.2℃(导致1.2℃/min的速率)从20℃加热到90℃。将荧光中的拐点报道为Th,为蛋白构象稳定性的量度。
实例2
构象热稳定性
如在实例1中所描述的,研究了不同赋形剂对抗-IL6(YTE)抗体的构象(热)稳定性的作用。结果呈现在表1中。
表1:构象(热)稳定性:经排序的赋形剂作用
表1:构象(热)稳定性:经排序的赋形剂作用
如在表1中可见,精氨酸是最差的构象稳定赋形剂,尤其当与25mM组氨酸的碱性缓冲液条件相比时。
另外的研究证明精氨酸甚至不被预测为是抗-IL6(YTE)抗体的胶体最稳定的赋形剂,如在图1中可见。胶体最稳定的赋形剂是蔗糖和海藻糖,而最不稳定的是NaCl和硫酸钠。
实例3
粘度和稳定性筛选评估
将多重抗-IL6(YTE)抗体配制品的粘度特性和稳定性如在实例1中所描述的进行评估,并且从稳定性和预测的注射器功能性两个角度发现是可接受的。对于预先装满的注射器产物(约7N注射力和9-16s注射时间),使用薄-壁的27号针,预期14cP的粘度会导致可接受的注射器滑动力特性。
表2概述了pH、缓冲液类型、组氨酸水平以及精氨酸水平对100mg/mL的抗-IL6(YTE)配制品的稳定性和粘度的影响的研究。
表2
样品1、2和3显示了抗-IL6(YTE)抗体配制品在较低的pH处是不太稳定并且具有更高的粘性。样品5、4和3显示在抗-IL6(YTE)抗体配制品中的精氨酸水平的增加导致更高的稳定性和更低的粘度,两者均为所希望的特性。样品5和6显示组氨酸缓冲液强度的增加还可以降低粘度并且增加稳定性。添加组氨酸的方法由于具有随着时间泛黄的已知潜在问题而未进一步探究。这些结果显示对于测试的所有组合,粘度和稳定性在pH 5至6的范围上是可接受的。在pH 6.0处的较高精氨酸水平对于抗-IL6(YTE)的稳定性和粘度似乎最优。
对使用了不同赋形剂的抗-IL6(YTE)抗体配制品的粘度特性进行评估以确定什么条件对于150mg/mL配制品将是最佳的。参见图2A。海藻糖、蔗糖和山梨糖醇彼此具有相似的粘度特性,并且盐无法有效地降低粘度。数据指示盐不能够降低抗体配制品的粘度。图2B表明了精氨酸、谷氨酸盐、氯化钠和海藻糖对粘度具有的作用。
研究了不同的另外的赋形剂对抗-IL6(YTE)抗体配制品粘度的作用。结果见于表3。
表3
增加的精氨酸水平导致了更低的粘度特性(图3和图4)。在100mg/mL时,低至25mM精氨酸能够将粘度降低至10cP标称值之下。为了获得150mg/mL抗体配制品,150mM精氨酸和220mM精氨酸两者均能够将粘度降低至约15cP标称值之下,其中更高的220mM精氨酸选项则是显著更低的,在约10cP(图5)。数据表明150mM精氨酸对满足<20cP的目标是必需的,如试图在100mM精氨酸与75mM海藻糖的尝试中所示(图6)。在约185mg/mL(高浓度水平)时,220mM精氨酸抗-IL6(YTE)配制品比150mM精氨酸具有更低的粘度特性,低约5cP,参见图7。图8显示了粘度对于主导的100和150mg/mL配制品的温度相关性。
实例4
赋形剂对稳定性和粘度的影响的研究
进行实验以评估海藻糖和精氨酸对多重配制品参数的影响。将抗体配制品储存在40℃或5℃,并且确定在不同的时间下纯度的损失。如实例1中所描述的,使用TSK-GEL G3000SWXL柱和SW保护柱(东曹生物科学公司(Tosoh Bioscience),蒙特哥梅里维尔(Montgomeryville),宾夕法尼亚州(PA))、使用在280nm处的UV检测来进行高效尺寸排阻色谱法。结果在表4中提供。
表4
“通过”表明了配制品几乎没有可见的颗粒。这些评估证明了抗-IL6(YTE)在100mg/mL或以上在以上提供的海藻糖和精氨酸配制品中是稳定的。
实例5
抗-IL6(YTE)热稳定性
抗-IL6抗体配制品被制备为以150mg/mL包含在25mM L-组氨酸/L-组氨酸盐酸盐一水合物、220mM精氨酸盐酸盐、0.07%(w/v)聚山梨醇酯80、pH 6.0中的抗-IL6抗体。该配制品的组成概述于表5中。
表5
EP=欧洲药典;NA=不适用的;NF=国家处方集;USP=美国
药典
抗-IL6抗体配制品被制备为以150mg/mL包含在25mM L-组氨酸/L-组氨酸盐酸盐一水合物、150mM精氨酸盐酸盐、0.07%(w/v)聚山梨醇酯80、pH 6.0中的抗-IL6抗体。该配制品的组成概述于表6中。
表6
EP=欧洲药典;NA=不适用的;NF=国家处方集;USP=美国药
典
将药物产品无菌地装入3cc玻璃小瓶中,用塞子塞住并且用铝密封件密封。
抗-IL6(YTE)抗体的热稳定性
对在表5中呈现的配制品(25mM L-组氨酸/L-组氨酸盐酸盐一水合物,220mM精氨酸盐酸盐,0.07%(w/v)聚山梨醇酯80,pH 6.0)中的约1mg/mL的抗-IL6(YTE)运行DSC。热稳定性特性在图9中给出。
实例6
IV袋保护剂
i.材料
使用冻干的配制品来评估抗-IL6(YTE)抗体在静脉输注(IV)袋和自多个供应商的一系列不同类型中的配伍性。该抗-IL6(YTE)抗体是冻干的形式,当其重构时,生成在25mM L-组氨酸/L-组氨酸盐酸盐一水合物、225mM(8.5%[w/v])海藻糖二水合物、0.05%(w/v)聚山梨醇酯80、pH 6.0中的50mg/mL抗-IL6(YTE)抗体。
ii.方法
(a)配伍性测试程序。
对使用了在临床中可获得的IV袋(或瓶)、IV过滤延伸装置以及不同类型的相关接触材料来保持和递送的抗-IL6(YTE)抗体CSP在使用中的稳定性进行评估。测试范围是使用100mL IV袋在20mg和600mg之间(0.2mg/mL至6mg/mL)。将计算的抗-IL6(YTE)抗体剂量体积添加至这些袋中并且轻轻地混合。将IV袋未覆盖地储存在室温(RT,约23℃)以及还在冷冻的条件(2℃-8℃)下持续24小时。在该适当的孵育时间之后,以100mL/hr通过模拟-输注(通过泵或通过重力)通过IV给予、过滤器和具有针的延伸装置来收集IV袋中的CSP。通过目视检查、HPSEC和紫外-可见光(UV-Vis)吸光度来评估在CSP中的颗粒形成/沉淀稳定性以及抗-IL6(YTE)抗体的回收率。
(b)目视检查。
对于可见颗粒、澄清度/乳光、和颜色遵循由PhEur(分别为第2.9.20、2.2.1和2.2.2节)改编的程序对IV袋以及还在模拟-输注至3cc玻璃药物小瓶中的材料直接进行目视检查。起始的抗-IL6(YTE)抗体配制品是淡乳色的及无色-至-淡黄色的。在模拟-输注之后,对于所有CSP样品,抗-IL6(YTE)抗体CSP是透明的以及无色-至-淡黄色的。然而,如果不使用IVBP,当抗-IL6(YTE)抗体稀释至IV袋中时,观察到增加的颗粒水平。IVBP的使用减少了CSP中的颗粒形成。
(c)纯度和可溶性聚集。
使用TSK-GEL G3000SWXL柱和SW保护柱(东曹生物科学公司(Tosoh Bioscience),蒙特哥梅里维尔(Montgomeryville),宾夕法尼亚州(PA))进行高效尺寸排阻色谱法(HPSEC)以评估CSP样品的纯度和可溶性聚集。
(d)浓度和回收率。
使用安捷伦(Agilent)型号8453UV-Vis分光光度计(圣克拉拉,加利福尼亚州)通过在280nm处的紫外-可见光(UV-Vis)吸光度以测定蛋白浓度来评估蛋白回收率。对于UV-Vis的定量限之下的剂量,使用具有在280nm处荧光激发和在335nm处发射的HPSEC采用线性峰面积标准标准曲线来测定蛋白。
iii.结果与讨论
(a)在盐水IV袋中的颗粒形成
在没有使用IVBP的初始测试中,对于在100mL盐水IV袋中和通过0.2微米串联过滤器模拟-输注之后收集至3cc玻璃小瓶中的材料中的抗-IL6(YTE)抗体,观察到了可见颗粒(图10)。所有其他测试结果都是可接受的。因为可见颗粒通常大于70μm,这些可见颗粒在0.22微米串联过滤器之后必定已经形成。事实上,观察到收集在3cc玻璃小瓶中的样品在人工目视检查程序期间在翻转和涡旋搅动的历程中出现了增加水平的颗粒。我们假设颗粒的形成是由于溶液中存在的表面活性剂不够充分的事实。为了对此进行研究,将另外的聚山梨醇酯加入IV袋中。
(c)表面活性剂水平对颗粒形成的影响的研究
对高达大约250-倍稀释的聚山梨醇酯(100mL/0.4mL=250倍稀释)的作用进行了评估。在定量给予抗-IL6(YTE)抗体至IV袋中之前,用聚山梨醇酯80的添加来调节盐水IV液体。所添加的聚山梨醇酯80从0%至0.018%w/v变化并且进行目视检查(表7)。
表7
应注意,对于20mg剂量,残留的0.0002%PS80来自于添加的抗-IL6(YTE)抗体配制品体积中的聚山梨醇酯的稀释(0.05%/250=0.0002%)。基于这些数据,大于0.009%w/v的聚山梨醇酯80能有效地减少CSP中观察到的颗粒形成。图11显示具有0.012%w/v的添加的聚山梨醇酯80的盐水中抗-IL6(YTE)抗体的照片。
(d)IV袋保护剂(IVBP)用以减少IV袋中的颗粒形成的用途
使用IVBP来提供对维持抗-IL6(YTE)抗体的稳定性而言是必需的较高水平的聚山梨醇酯。当解释错误和袋过满变异性的原因时,对于水平中的稳健性,将0.012%w/v聚山梨醇酯80的最终水平作为目标。使用的IV袋保护剂(IVBP)是在柠檬酸缓冲液中在pH 6.0配制的0.65%(w/v)聚山梨醇酯80。将IV袋制备程序改变以使得可添加1.8mL体积的IVBP,在添加抗-IL6(YTE)抗体剂量之前轻轻地混合。这导致约0.012%w/v的聚山梨醇酯水平用于低剂量并且0.018%w/v用于高剂量。用IVBP在五个不同盐水IV袋类型中进行配伍性研究。发现当使用IVBP时,这些可与抗-IL6(YTE)抗体配伍。
iv.结论
在这个案例研究中,在IV袋中的CSP中蛋白质颗粒的形成是由聚山梨醇酯80在其保护水平之下的稀释引起的。确定的是袋稀释剂的IV袋保护剂(IVBP)预处理是所需要的,从而将IV袋中的聚山梨醇酯水平保持在对减少抗-IL6(YTE)抗体临床无菌制品(CSP)的颗粒形成所需的水平之上(在约0.009%之上)。使用的IV袋保护剂(IVBP)是在pH 6.0的柠檬酸盐缓冲液中配制的0.65%(w/v)聚山梨醇酯80并且在抗-IL6(YTE)抗体之前添加至该袋中。包含聚山梨醇酯的IV袋保护剂(IVBP)的实施完全地减少了抗-IL6(YTE)抗体CSP的颗粒形成。
实例7
赋形剂对非-抗-IL6抗体的稳定性和粘度的影响的研究
进行实验以评估脯氨酸和精氨酸对多重配制品参数的影响。将抗-IL6抗体和非-抗-IL6抗体(抗体X)配制品储存在40℃和5℃下并且确定不同时间下纯度损失率和可见颗粒形态。使用DSC(VP-DSC,微量热公司,北安普顿,马萨诸塞州(Microcal,Northampton,MA))来确定热稳定性。使用安东帕(Anton Paar)MCR301流变仪来测量配制品的粘度。如实例1中所描述的,使用TSK-GEL G3000SWXL柱和SW保护柱(东曹生物科学公司(Tosoh Bioscience),蒙特哥梅里维尔(Montgomeryville),宾夕法尼亚州(PA))、使用在280nm处的UV检测来进行高效尺寸排阻色谱法。使用DSC来确定热稳定性。
结果在表8中提供。比较了两种抗体X配制品。两种抗体X配制品除了一种具有50mM精氨酸而另一种具有50mM脯氨酸之外是相同的。结果显示对于抗体X,在精氨酸配制品中可见的颗粒外观在5℃下在11周之后是不可接受的,然而包含脯氨酸的配制品仍保持几乎没有可见的颗粒。因此,精氨酸对抗体X配制品的颗粒形成具有负面影响。两种抗体X配制品在稳定性上都具有相似的纯度损失率,指示精氨酸既不稳定也不去稳定抗体X,如通过HP-SEC所测量的。精氨酸确实降低了抗体X配制品的粘度。值得注意的是,对于海藻糖/精氨酸配制品中的抗体X,Tm1是显著高于精氨酸配制品中的抗-IL6抗体,然而抗-IL6抗体的稳定性是更强的,如通过较低的纯度损失率和其保留几乎没有可见颗粒的事实所指示的。这些对比实例显示精氨酸不是以与抗-IL6抗体被稳定的相同方式来稳定抗体X。抗体X的纯度损失率在具有精氨酸的情况下没有更低(保持不变),而精氨酸确实导致了对于颗粒配制品的不稳定性。
表8
实例8
精氨酸和其他赋形剂对四种不同抗体的稳定性的影响
以多种浓度进行实验以评估不同赋形剂对抗-IL6抗体还有几种不同非-抗-IL6抗体的稳定性的影响。研究的赋形剂是基础缓冲液(没有赋形剂)、海藻糖、盐和精氨酸盐酸盐。使用DSC来确定不同抗体的热稳定性。将抗体配制品储存在40℃下并且使用HP-SEC来测量纯度损失率。如实例1中所描述的,使用TSK-GEL G3000SWXL柱和SW保护柱(东曹生物科学公司(Tosoh Bioscience),蒙特哥梅里维尔(Montgomeryville),宾夕法尼亚州(PA))、使用在280nm处的UV检测来进行高效尺寸排阻色谱法。
在表9中概述了研究的结果。与缓冲液的基础方案相比,精氨酸仅针对抗体的影响在表10中进行了概述。即使对于所有抗体,精氨酸确实引起Tm1的降低,但在精氨酸对四种抗体的纯度损失率的影响中没有一致的趋势。在这四种抗体中,抗-IL6抗体是仅有的显著地由精氨酸稳定的抗体。精氨酸对两种抗体的纯度损失率不具有影响(在每个月纯度损失率差异在约0.2%的测定变异性之内,或更小)。一种抗体通过精氨酸去稳定(抗体B,表9,第14行)。
对于抗-IL6抗体(表9,第1-6行),精氨酸配制品具有较低的测量的Tm1,但是当评估纯度损失率时,它们是最稳定的。与此相反,精氨酸降低了抗体B的Tm1并且还增加了纯度损失率,然而海藻糖增加了Tm1并且降低了纯度损失率(表9,第11-14行)。对于抗体A和C,Tm1对于海藻糖增加并对于盐和精氨酸两者减小,然而纯度损失率保持每个月0.2%(在测定的期望变异性之内),表明所有配制品具有相似的稳定性。
表9
表10
在此说明的所有各个实施例或选择可以按任一或所有变体相组合。虽然本发明参考其一些实施例已经进行了具体示出和描述,但本领域普通技术人员应当理解的是,它们仅借助于实例来呈现,并不具有限制性,并且可以在不背离本发明的精神和范围的情况下在其中进行形式和细节上的各种改变。因此,本发明的宽度和范围应当不限于以上描述的示例性实施例中的任一个,而应当仅根据以下权利要求书和它们的等效物来限定。
将在此引用的所有文件(包括期刊文章或摘要、公开的或相应的美国或国外专利申请书、颁布或国外专利、或任何其他文献)各自通过引用(包括在引用的文献中呈现的所有数据、表、图和正文)而完整地结合于此。
- 还没有人留言评论。精彩留言会获得点赞!