γ‑氨基丁酸在制备肝脏保护药物制剂中的应用的制作方法
本发明涉及生物医学技术领域,具体涉及γ-氨基丁酸在制备肝脏保护药物制剂中的应用。
背景技术:
海洋可食性鱼类营养丰富,味道鲜美,而且还有很多保健功能,具有重要食用价值和经济价值。随着现代分离技术和生物技术的发展使人们对鱼类资源的利用不再局限于海水养殖业,其研究内容涉及生态、养殖、医药、毒理、遗传和分子生物学等诸多领域。对低值鱼类资源进行高值化开发利用,为人类提供理想的海洋食品及海洋药物,并创造出宏观的经济效益,将有助于推动我国海洋产业的迅速发展。
肝脏是身体内以代谢功能为主的一个器官,并在身体里面起着吸收营养、代谢、清除毒素、去氧化、储存肝糖、分泌性蛋白质的合成等作用。当今社会中,熬夜、酗酒、服药、感染和空气污染等一些列不良的生活习惯或疾病侵袭,会促进肝细胞凋亡,使肝脏功能受损。对于老年人来说,人衰老不只表现在外部体态容貌上,身体各内脏器官都会发生变化,其中肝脏改变亦很明显。首先肝血流量要减少。男过25岁,肝脏循环血流量平均每年下降0.3%~1.5%。女过20岁以后,60岁时的肝内血流量约比20岁时减少40%~50%。其实,研究表明,人在60岁后,肝细胞数量随年龄增长而锐减。肝脏趋向硬变,重量明显下降,90岁老年人肝脏的平均重量只有30岁左右青年人肝重的51.8%。
血液是护肝养肝的基础,血流量的减少使肝内血液循环功能下降,肝脏吸收营养、代谢和清除毒素的能力也相应减退。由此可见,保肝护肝的关键是加强肝细胞的抗氧化性能,抑制其细胞凋亡,促进肝脏的血液循环。
γ-氨基丁酸(γ-Aminobutiric acid,GABA)是哺乳动物、甲壳类动物、昆虫和某些寄生蠕虫神经系统中重要的抑制性神经递质。少数植物中含有这种非蛋白质氨基酸。GABA参与多种代谢活动,具有抗氧化、降血压、改善睡眠、抗焦虑、改善脂质代谢、降低体重、防止动脉硬化等功效,因此受到越来越多的科学工作者的关注。
技术实现要素:
本发明的目的是提供γ-氨基丁酸在制备肝脏保护药物制剂中的应用。
本发明实现目的的方案如下:
γ-氨基丁酸(GABA)在制备肝脏保护药物制剂中的应用。
优选的;γ-氨基丁酸(GABA)在制备保护氟离子诱导所致肝脏损伤药物中的应用。
优选的;所述GABA的制备方法:以低值鱼类或其加工废料为原料,经具有谷氨酸脱羧酶活性的微生物进行发酵,所得发酵物分离提纯即得。
具体是:
1)将原料低值鱼类或其加工废料磨成匀浆,向匀浆中添加匀浆质量5-10倍体积(w/v)蒸馏水,配制成匀浆液,再向匀浆液中加入匀浆液体积的0-5wt%葡萄糖(v/w),调节溶液pH值4.5-6.0,获得微生物培养液。培养液灭菌后冷却,而后接种具有谷氨酸脱羧酶活性的微生物,置于30℃-40℃条件下培养24-72小时,即得到富含具有谷氨酸脱羧酶活性微生物的菌悬液(溶液A);
2)调节溶液A的pH值为5.5-6.5,加入溶液A体积的0.5%-2wt%谷氨酸钠(v/w),配成富含谷氨酸钠的培养液(溶液B),溶液B置于35℃-40℃条件下培养72-120小时,即得到富含GABA的发酵液;
3)富含GABA的发酵液去菌体、去油脂:将步骤2)获得发酵液以2000-5000r/min的速度,离心5-20分钟,取上层液体置于高压灭菌锅中,进一步灭菌,得无菌体发酵液,无菌体发酵液经索氏提取法去油脂后,得到无菌体、无油脂的发酵液;
4)无菌体、无油脂发酵液脱色:采用活性炭或SD300树脂脱色得无色透明发酵液,待用;
5)无色透明发酵液中GABA的分离纯化:将步骤4)获得无色透明发酵液上预处理过的732树脂(氢型)交换柱,以2-5mL/min的流速充分进行交换吸附,吸附后经去离子水洗涤至pH6.0,用100-200ml 0.1-0.2mol/L碱性溶液洗,再用1-2mol/L碱性溶液以2-5mL/min的流速进行洗脱;洗脱过程中用茚三酮丙酮溶液进行显色,收集茚三酮反应呈蓝色,pH6.0左右的流出液,以高效液相色谱法检测每管流出液中GABA含量,将GABA含量较高的流出液合并,减压浓缩,即为分离纯化后的GABA。
优选的;所述步骤4)采用活性炭对无菌体、无油脂发酵液脱色处理是向无菌体、无油脂发酵液中添加0.5%-5%(w/v)的活性炭,于60-90℃水浴10-30分钟,趁热真空抽滤,得无色透明发酵液;
SD300树脂脱色对无菌体、无油脂发酵液脱色处理是向无菌体、无油脂发酵液中添加5%-10%SD300树脂,20-30℃,摇床100rpm脱色3小时,抽滤得无色透明发酵液。
优选的;步骤5)所述减压浓缩到1/20-1/10体积后,得到分离纯化后的GABA浓缩液,利用高效液相色谱法检测浓缩液中GABA的纯度。
优选的;步骤5)所述碱性溶液为氢氧化钠溶液或氨水。
肝脏受损模型,喂食以氟化钠造模的肝脏损伤模型小鼠浓度为0.1-2.0g/L分离纯化的GABA 5-20天,通过肝细胞细胞形态结构、肝脏组织丙二醛、谷胱甘肽还原酶水平的变化以及肝脏脱碘酶DⅠmRNA表达量的变化情况,表明GABA具有明显的保护肝脏作用。
检测分离纯化的GABA保护肝脏能力:
1)以氟化钠建立肝脏受损小鼠模型;
2)喂食模型小鼠浓度为0.1-2.0g/L分离纯化的GABA 5-20天;
3)通过肝细胞细胞形态结构、肝脏组织丙二醛、谷胱甘肽还原酶水平的变化以及肝脏脱碘酶DⅠmRNA表达量的变化情况,表明GABA具有明显的肝脏保护作用。
本发明的优点:
1)卫生部2009年第十二号令食品级GABA生产工艺:以L-谷氨酸钠为底物经安全菌株发酵、加热杀菌、冷却、活性炭处理、过滤、喷雾干燥等步骤生产而成。目前生产线普遍以20%纯度批量生产食品级GABA,本发明分离纯化所得GABA为安全菌株生物转化L-谷氨酸钠制得,纯度为60%以上,其纯度远高于目前市面所售食品级GABA纯度。
2)本发明提供了GABA的新用途,GABA对肝脏的保护作用从多个方面得以实现:(1)GABA对肝脏细胞具有显著的营养、保护作用;(2)GABA的抗氧化性能对肝细胞的非正常凋亡起到抑制作用;(3)肝脏是甲状腺激素代谢的主要场所,GABA能显著改善肝脏内脱碘酶DⅠmRNA的表达量,使其趋近于正常水平,对维持肝脏正常功能起到了关键作用。
3)本发明获得的GABA是从低值鱼类或其加工废弃物发酵液中分离纯化所得GABA,具有无毒性,易吸收的显著特点。
附图说明
图1为本发明实施例提供的肝细胞在显微镜40倍物镜下的显微结构图,其中(a)正常组肝脏显微结构;(b)阴性对照组肝脏显微结构;(c)阳性对照组肝脏显微结构;(d)分离纯化GABA组肝脏显微结构;
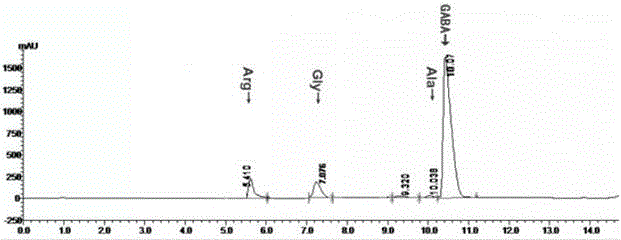
图2为高效液相色谱法检测分离纯化GABA的纯度。
具体实施方式
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1
1.新鲜红娘鱼用粉碎机磨成匀浆后,添加红娘鱼匀浆质量10体积的(w/v)蒸馏水,配制成匀浆液,再向匀浆液中加入匀浆液体积的1wt%葡萄糖(v/w),调节溶液pH值为5.5,配制成微生物培养基。该培养基经121℃,灭菌15分钟。冷却后按1%接种量(v/v)接种乳酸链球菌,置于30℃条件下发酵培养1天,得到富含乳酸链球菌的菌悬液。
2.将富含乳酸链球菌的菌悬液pH值调制6.0,并向菌悬液中添加菌悬液体积的1wt%谷氨酸钠(v/w),置于37℃恒温箱,静置培养72小时,得到GABA含量为4.8g/L的红娘鱼发酵液。
所述乳酸链球菌购买于中国普通微生物菌种保藏管理中心,北京,编号为bio-52538。
3.对富含GABA的红娘鱼发酵液中的GABA进行分离提纯。
1)富含GABA的红娘鱼发酵液去菌体、去油脂:将步骤2获得发酵液以4000r/min的速度离心10分钟,取上层液体高压灭菌,得无菌体发酵液。无菌发酵液经索氏提取法去除油脂后,得到无菌体、无油脂发酵液。
2)无菌体、无油脂发酵液脱色:以SD300树脂进行脱色处理,具体是向上述获得无菌体、无油脂发酵液中添加5%SD300树脂(w/v),25℃,摇床100rpm,脱色3小时,抽滤得无色透明发酵液。
3)无色透明发酵液中GABA的分离纯化:将上述无色透明液上预处理过的732树脂(氢型)交换柱,以3mL/min的流速,让其充分进行交换吸附。吸附完毕后用去离子水洗涤至pH6.0。先用150ml 0.1mol/L氢氧化钠洗,再用1mol/L氢氧化钠以3mL/min的流速进行洗脱。在洗脱过程中不断用茚三酮丙酮溶液进行显色测试,并用pH试纸检测pH的变化。当茚三酮反应呈蓝色,pH6.0左右时,保留流出液,直至茚三酮蓝色反应消失为止,以高效液相色谱法检测收集管中GABA含量,合并GABA含量较高的收集管中的流出液(GABA水溶液pH值约为6,且与茚三酮反应呈蓝色,由此可判断流出液pH值为6,且与茚三酮反应呈蓝色,其内所含的氨基酸为GABA),经减压浓缩至1/20体积,得分离提纯GABA浓缩液。
实施例2
1.红娘鱼内脏(加工废弃物),添加其5倍体积(w/v)蒸馏水,配成溶液,向溶液中添加溶液体积的2.0wt%葡萄糖(v/w),调节pH值为5.0,配制成微生物培养液。该培养液经121℃,灭菌20分钟。冷却后按1%接种量(v/v)接种鸟肠球菌,置于37℃条件下发酵培养36小时,得到富含鸟肠球菌的菌悬液。
2.向富含鸟肠球菌的菌悬液中添加菌悬液体积的2wt%谷氨酸钠(v/w),调节pH值为5.5,配成富含谷氨酸钠培养液。该培养液置于37℃恒温箱中静置培养96小时,获得GABA含量为5.7g/L的红娘鱼内脏发酵液。
所述鸟肠球菌购买于中国普通微生物菌种保藏管理中心,北京,编号为CGMCC9184。
3.对富含GABA的红娘鱼内脏发酵液中的GABA进行分离提纯。
1)富含GABA的红娘鱼内脏发酵液去菌体、去油脂:3000r/min,离心15分钟,取上层液体高温高压灭菌,得无菌体发酵液。无菌体发酵液经索氏提取法去除油脂,得无菌体、无油脂发酵液。
2)无菌体、无油脂发酵液脱色:SD300树脂进行脱色处理,具体向上述获得的无菌体、无油脂发酵液中添加10%SD300树脂(w/v),25℃,摇床100rpm,脱色4小时,抽滤得无色透明发酵液。
3)无色透明发酵液中GABA的分离纯化:将上述无色透明液上预处理过的732树脂(氢型)交换柱,流速取3mL/min,让其充分进行交换吸附。吸附完毕后用去离子水洗涤至pH6.0。先用150ml 0.1mol/L氨水洗,再用1mol/L氨水以3mL/min的流速进行洗脱。在洗脱过程中不断用茚三酮丙酮溶液进行显色测试,并用pH试纸检测pH的变化。当茚三酮反应呈蓝色,pH6.0左右时,保留流出液,以高效液相色谱法检测收集管中GABA含量,合并GABA含量较高的收集管中的流出液(GABA水溶液pH值约为6,且与茚三酮反应呈蓝色,由此可判断流出液pH值为6,且与茚三酮反应呈蓝色,其内含有GABA),经减压浓缩至1/10体积,得分离提纯GABA浓缩液。
实施例3
1.鳀鱼水煮浓缩废弃液,添加该废弃液5倍体积的(v/v)蒸馏水,配制成稀释液,再向稀释液中加入稀释液体积的1wt%葡萄糖(v/w),调节pH值为6.0,配制成微生物培养液。该培养液经121℃,灭菌20分钟。冷却后按1%接种量(v/v)接种短乳杆菌,置于37℃条件下发酵培养24小时,得到富含短乳杆菌的菌悬液。
2.向富含短乳杆菌的菌悬液中添加菌悬液体积的1.5wt%谷氨酸钠(v/w),调节pH值为6.5,配成富含谷氨酸钠培养液。该培养液置于37℃恒温箱中静置培养100小时,获得GABA含量为5.81g/L的鳀鱼水煮废弃液发酵液。
所述短乳杆菌购买于中国普通微生物菌种保藏管理中心,北京,编号为CGMCC1.2028。
3.对富含GABA的鳀鱼水煮废弃液发酵液中的GABA进行分离提纯。
1)富含GABA的鳀鱼水煮废弃液发酵液去菌体、去油脂:5000r/min,离心10分钟,取上层液体高温高压进一步灭菌,得无菌体发酵液。无菌体发酵液经索氏提取法去除油脂,得无菌体、无油脂发酵液。
2)无菌体、无油脂发酵液活性炭脱色:无菌体、无油脂发酵液中添加1.5%活性炭(w/v),80℃,脱色30分钟,抽滤得无色透明发酵液。
3)无色透明发酵液中GABA的分离纯化:将上述无色透明发酵液上预处理过的732树脂(氢型)交换柱,流速取3mL/min,让其充分进行交换吸附。吸附完毕后用去离子水洗涤至pH6.0。先用150ml 0.1mol/L氨水洗,再用1mol/L氨水以3mL/min的流速进行洗脱。在洗脱过程中不断用茚三酮丙酮溶液进行显色测试,并用pH试纸检测pH的变化。当茚三酮反应呈蓝色,pH6.0左右时,保留流出液,以高效液相色谱法检测收集管中GABA含量,合并GABA含量较高的收集管中的流出液(GABA水溶液pH值约为6,且与茚三酮反应呈蓝色,由此可判断流出液pH值为6,且与茚三酮反应呈蓝色,其内含有GABA)。经减压浓缩至1/10体积,得分离提纯GABA浓缩液。
将上述实施例1、2和3分离提纯的GABA浓缩液合并,采用高效液相色谱法检测GABA的纯度,结果如图2所示,其中GABA的含量为63%,其他可检测出的氨基酸的含量为:Ala丙氨酸2%、Gly甘氨酸8%、Arg精氨酸5%。丙氨酸、甘氨酸、精氨酸均为人体内常见氨基酸,其含量较低,均在安全摄入范围之内,不会对人体或受试动物产生不良生理影响。
实施例4
利用上述合并的分离提纯的GABA浓缩液作为制备肝脏保护药物制剂中的应用,其保护肝脏作用的试验及其效果如下:
分离提纯GABA的抗甲减试验:
实验动物:120只昆明种雄性小鼠18-22g/只。
动物模型:100只小鼠喂食0.1g/L NaF 30天,创建肝脏受损模型小鼠。
药物配制:将上述实施例1、2和3分离提纯的GABA浓缩液合并,然后向合并液中添加纯净水配制成GABA含量为0.1g/L,0.5g/L,1.0g/L的溶液。
实验分组:20只正常组(健康小鼠每日喂食纯净水);20只阴性对照组(肝脏受损小鼠每日喂食纯净水);20只阳性对照组(甲减小鼠每日喂食澳洲swisse护肝片,服用剂量参照服用说明书);20只低剂量分离提纯GABA组(肝脏受损小鼠每日喂食GABA含量为0.1g/L溶液);20只中剂量分离提纯GABA组(肝脏受损小鼠每日喂食GABA含量为0.5/L溶液);20只高剂量分离提纯GABA组(肝脏受损小鼠每日喂食GABA含量为1.0g/L溶液)。
实验方法:肝脏受损小鼠喂食纯净水,澳洲swisse护肝片,不同浓度分离提纯GABA溶液14天后取肝脏组织检测肝细胞形态结构,肝脏组织丙二醛、谷胱甘肽还原酶水平的变化以及肝脏脱碘酶DⅠmRNA表达量的变化情况。丙二醛检测试剂盒(南京建成生物工程有限公司,检测方法参考说明书)检测肝脏组织丙二醛含量变化;谷胱甘肽还原酶检测试剂盒(南京建成生物工程有限公司,检测方法参考说明书)检测肝脏组织谷胱甘肽还原酶含量变化;肝脏脱碘酶DⅠmRNA表达量检测采用实时荧光定量PCR法(由上海生物工程股份有限公司代为检测);肝脏细胞结构观察采用常规切片HE染色,显微镜下镜检。
检测指标:肝细胞形态结构变化情况,肝脏组织丙二醛、谷胱甘肽还原酶水平的变化以及肝脏脱碘酶DⅠmRNA表达量的变化情况。
(1)肝细胞形态结构变化结果如图1所示:正常组肝细胞排列紧密,细胞核位于细胞中央,细胞膜界限清晰;阴性对照组肝细胞密度变小,排列松散,细胞膜界限不清晰;阳性对照组和喂食1g/L分离提纯GABA组的肝脏损伤现象有明显改善,肝细胞密度高于阴性对照组,且细胞膜界限清晰,细胞核位于细胞中央。因此高浓度GABA(1g/L)对NaF诱导的肝脏损伤具有明显的改善作用,使肝细胞组织结构趋于正常化,且与阳性对照组之间无明显差异。
(2)肝脏脱碘酶DⅠmRNA表达量的变化结果显示:喂食1g/L分离提纯GABA组小鼠Dio1表达量得到显著恢复,接近于正常组数值,显著高于阴性对照组,且与阳性对照组无显著性差异,结果如表1所示;喂食0.1g/L和0.5g/L分离提纯GABA组小鼠Dio1表达量与阴性对照组无显著性差异,证明低值鱼或其加工废弃物发酵液中分离提纯的GABA在高浓度(1g/L)下对脱碘酶DⅠ的合成有明显的促进作用,能保障肝脏甲状腺激素代谢作用的正常发挥。
表1肝脏脱碘酶DⅠ基因Dio1相对定量结果
*1.正常组小鼠每日喂食纯净水;2.阴性对照组为肝脏受损模型小鼠每日喂食纯净水;3.阳性对照组为肝脏受损模型小鼠每日喂食澳洲swisse护肝片(服用剂量参照说明书);4.分离提纯GABA组为甲减模型小鼠每日喂食1g/L分离提纯所得GABA。
(3)丙二醛是膜脂过氧化最重要的产物之一,它的产生还能加剧膜的损伤因此在组织脏器衰老生理和抗性生理研究中丙二醛含量是一个常用指标,可通过丙二醛了解膜脂过氧化的程度,以间接测定膜系统受损程度以及组织脏器的抗逆性。服用1g/L分离提纯的GABA后,肝脏组织中的丙二醛含量要明显低于阴性对照组,且与正常组和阳性对照组之间无显著性差异,结果如表2所示;服用0.1g/L和0.5g/L分离提纯GABA组小鼠肝脏组织中的丙二醛含量与阴性对照组之间无显著性差异,证明分离提纯的GABA在高浓度(1g/L)下对被氟离子损害的肝脏组织具有保护作用,可降低肝细胞膜系统受损程度,提升肝组织的抗逆性。
表2 GABA对肝脏组织匀浆中丙二醛含量的影响
*正常组小鼠每日喂食纯净水;阴性对照组为肝脏受损模型小鼠每日喂食纯净水;阳性对照组为肝脏受损模型小鼠每日喂食澳洲swisse护肝片(服用剂量参照说明书);分离提纯GABA组为甲减模型小鼠每日喂食1g/L分离提纯所得GABA。
(4)谷胱甘肽是一种重要的细胞抗氧化剂。缺失谷胱甘肽还原酶会使细胞对氧化剂更为敏感。服用1g/L分离纯化的GABA后,肝脏组织中的谷胱甘肽还原酶含量要明显高于阴性对照组,虽然稍低于正常组和阳性对照组,但统计学之间无显著性差异,结果如表3所示;喂食0.1g/L和0.5g/L分离提纯GABA组小鼠肝脏组织中的谷胱甘肽还原酶含量与阴性对照组之间无显著性差异。证明分离提纯的GABA在高浓度(1g/L)下对被氟离子损害的肝脏组织具有保护作用,可降低肝细胞对氧化剂的敏感性,提升肝组织的抗逆性。
表3 GABA对肝脏组织中谷胱甘肽还原酶含量的影响
*正常组小鼠每日喂食纯净水;阴性对照组为肝脏受损模型小鼠每日喂食纯净水;阳性对照组为肝脏受损模型小鼠每日喂食澳洲swisse护肝片(服用剂量参照说明书);分离提纯GABA组为甲减模型小鼠每日喂食1g/L分离提纯所得GABA。
由上述试验结果显示,低值鱼或其加工废弃物生物转化的GABA具有显著的保护肝脏作用。
- 还没有人留言评论。精彩留言会获得点赞!