水溶性纳米缓释功能性辅酶Q10微胶囊及其制备方法与应用与流程
本发明涉及辅酶Q10微胶囊的制备领域。
背景技术:
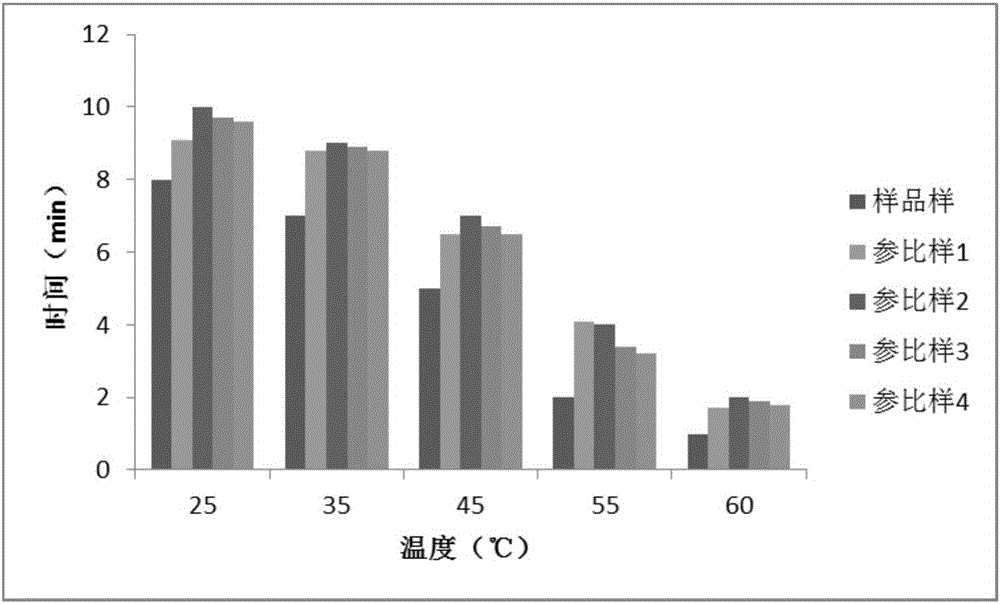
::辅酶Q10(CoenzymeQ10,CoQ10)是一种生物体内广泛存在的脂溶性醌类化合物,化学名称为2,3-二甲氧基-5-甲基-6-癸异戊烯基-1,4-苯醌,这种脂溶性抗氧化剂存在于细胞的线粒体中,是生物体内最重要的抗氧化剂之一,辅酶Q10是人体内产生能量的要素,存在于各脏器细胞膜中,能够改进心肌代谢、加强心脏功能;而且它的强抗氧化功能能保护机体细胞免受自由基的破坏,提高机体的免疫力。随着辅酶Q10在生物学方面的重要功能和保健作用的不断被揭示,再加上其无毒性、无致畸作用和无明显副作用的特点,近几年在国际范围内,已被广泛用于各类心脏病,糖尿病、帕金森症等疾病的治疗,并可预防动脉硬化、中风和高血压,对心脏、肝脏和肾均有良好的保健作用,辅酶Q10的实际应用范围被不断扩大。辅酶Q10在欧美国家被广泛地用于食品、化妆品、营养补充剂等,我国现今市场上也有着各种相关的软胶囊产品。辅酶Q10作为脂溶性的类维生素物质,具备良好的生理功效,然而它的水不溶性却使其在人体的消化吸收方面存在困难。另外,辅酶Q10结构中存在醌基,对光和氧相当敏感,暴露于光下容易分解。因此,如何提高辅酶Q10在水相介质中的溶解性、贮藏稳定性和生物利用度,成为其在生产和消费过程中的关键技术问题。将辅酶Q10制成微胶囊,可解决其水不溶性问题,并改善其不稳定性。在现今的众多关于辅酶Q10的微胶囊化现有技术中,大部分都采用单一的乳化喷雾干燥法、喷雾冻结法等造粒方法,并且都或多或少的存在一些缺陷。中国专利CN200410040078.2《辅酶Q10微囊及其制备方法》中提到辅酶Q10微胶囊的制备方式,其中的溶剂或非溶剂法、喷雾冻结法、空气悬浮法、界面缩聚法、辐射化学法等都会涉及到一些溶剂、非溶剂的残留或者是造粒方法对人体造成安全隐患,而该专利申请的实施例1、实施例2制备工艺用到甲醛,实施例3制备工艺用到丁酮、异丙醚,实施例4制备工艺用到氯仿、环己烷、乙醇,实施例6制备工艺用到乙醚、乙醇,实施例7为溶剂喷雾干燥法制备工艺用到异丙醇等,制备工艺中用到的溶剂易带来生产安全隐患和溶剂残留。中国专利申请CN200710068191.5《辅酶Q10水分散体及其制备方法》中提到辅酶Q10微胶囊的制备方式,采用单一的乳化喷雾干燥法但是或多或少的存在一些缺陷,添加或使用在片剂压片中,存在着流动性差异造成松片或者压片后易冒油等情况。技术实现要素::本发明的目的是针对现有的辅酶Q10产品的水溶性差、生物利用度低、不稳定等技术问题,提供一种水溶性纳米缓释功能性辅酶Q10微胶囊及其制备方法与应用。一种水溶性纳米缓释功能性辅酶Q10微胶囊,按重量百分比计,包括:1~20%辅酶Q10、0.1~1%胡椒碱、0.05~5%抗氧化剂、30~60%载体油、0.05~5%油相表面活性剂、0.05~5%水相表面活性剂、20~50%水相壁材。所述水溶性纳米缓释功能性辅酶Q10微胶囊,按重量百分比计,优选包括:2~12%辅酶Q10、0.2~0.8%胡椒碱、0.5~2.5%抗氧化剂、35~50%载体油、2~4%油相表面活性剂、0.5~3.5%水相表面活性剂、30~45%水相壁材。所述水溶性纳米缓释功能性辅酶Q10微胶囊,按重量百分比计,更优选包括:6~12%辅酶Q10、0.2~0.5%胡椒碱、2.0~2.5%抗氧化剂、40~45%载体油、2.5~4%油相表面活性剂、2.5~3.5%水相表面活性剂、40~45%水相壁材。所述的抗氧化剂为天然VE、迷迭香提取物或2,6-二叔丁基对甲酚等中的至少一种,优选天然VE。所述的油相表面活性剂为蔗糖酯(HLB值5~7)、维生素E聚乙二醇琥珀酸酯(TPGS)、吐温类、甘油酯类、卵磷脂中的至少一种,优选卵磷脂。所述的载体油不仅可以选自安全稳定的天然植物油,如大豆油、花生油、橄榄油、蓖麻油、红花油等一种或多种;还可选自对药物溶解能力强的、经过结构改造、水解后的植物油或脂肪酸酯,如肉豆蔻酸异丙酯(IPM)、油酸乙酯、中链脂肪酸甘油酯(MCT)、油酸聚乙二醇甘油酯、单亚油酸甘油酯和聚丙二醇辛酸酯等中的一种或多种;所述的水相壁材选自改性阿拉伯胶、麦芽糊精、明胶、改性淀粉、改性大豆分离蛋白中的一种或多种;所述改性淀粉是辛烯基琥珀酸淀粉钠或十二烯基琥珀酸淀粉钠;所述的水相表面活性剂选自蔗糖酯(HLB值13~16)、泊洛沙姆188、壳聚糖及其衍生物中的一种或多种;所述的水溶性纳米缓释功能性辅酶Q10微胶囊,其口服给药后在体内通过胃肠道的蠕动自发形成油滴为纳米级的微乳液。所述的水溶性纳米缓释功能性辅酶Q10微胶囊的制备方法,包括以下步骤:1)将辅酶Q10、载体油、胡椒碱、抗氧化剂、油相表面活性剂等一起在研磨机中0~25℃进行研磨至结晶颗粒粒径为5微米以下,得到辅酶Q10分散液;2)将水相壁材、水相表面活性剂溶于水中,配成水相溶液,加热至35~45℃并保温;3)将辅酶Q10分散液升温至35~50℃,待辅酶Q10分散液溶解完全后,冷却至30~40℃,加入水相溶液中混合、高速剪切,乳化至油滴粒径≤2微米后,进入设定压力为60~80MPa的高压均质机均质至油滴粒径小于100纳米的乳液;4)将所得的辅酶Q10纳米乳液在30~40℃中保温并在喷雾干燥器中喷雾流化双包被即制备所需的水溶性纳米缓释功能性辅酶Q10微胶囊。所述水溶性纳米缓释功能性辅酶Q10微胶囊在制备增强免疫力药物、保健品中的应用。本发明的有益效果:1)本发明通过引入双相乳化剂,乳液经研磨、高压均质、流化双包被,形成水溶性纳米缓释功能性微胶囊,在胃肠道中能自发形成10-100纳米的乳滴,有利于增加芯材对组织的附着力,提高辅酶Q10的生物利用度。2)本发明通过添加处方量的胡椒碱促进肠胃吸收作用以增强机体对辅酶Q10的有效吸收,进一步促进提高辅酶Q10的生物利用度。3)通过双包被微胶囊技术,使微胶囊的稳定性和溶解性得到进一步的提高,双包被微胶囊具有更好的缓释性,且释放更为彻底。双包被技术也能进一步改善微胶囊的水溶性进而进一步提高辅酶Q10的生物利用度。4)本发明的纳米微胶囊的稳定性好,可防止组分的破坏,且便于加工。附图说明图1为本发明一个实施方式的辅酶Q10微胶囊的体外释放曲线图;图2为本发明一个实施方式的辅酶Q10微胶囊在不同温度下的溶解性试验结果。具体实施方式:以下结合具体实例对本发明做进一步补充,对本发明予以详细说明。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行,所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。以下实施例中辅酶Q10的含量根据《中国药典》(2010年版)二部中所记载的HPLC法进行检测。实施例1将240Kg辅酶Q10结晶与16Kg胡椒碱、40Kg卵磷脂、40Kg天然VE、654Kg大豆油一起在纳米研磨机中温度25℃下研磨至结晶粒径为5μm以下,得到辅酶Q10分散液。将1000Kg改性淀粉(T809)、10Kg蔗糖酯(HLB值13~16)溶于3000Kg的水中,配成改性淀粉水溶液,保温至40℃备用。将辅酶Q10分散液升温至50℃,待辅酶Q10分散液溶解完全后,冷却至40℃,保温备用。将上述的辅酶Q10分散液加入到改性淀粉水溶液中在10000rpm转速下剪切30分钟,并且在60MPa下均质3次,在出口得到纳米分散的辅酶Q10乳液。将上述纳米分散的辅酶Q10乳液进行喷雾流化双包干燥,以玉米淀粉为包裹壁材进行双包被,喷雾塔进风口温度控制在180℃,出风口温度控制在90℃,雾化器转速1400r/min,喷雾干燥得水溶性纳米缓释功能性辅酶Q10微胶囊。经检测,该双包被的玉米淀粉上粉率为15%,微胶囊中辅酶Q10的含量为10.26%,油滴粒径分布表明产品中辅酶Q10的D90为90nm。实施例2将20Kg辅酶Q10结晶与2Kg胡椒碱、30Kg卵磷脂、4Kg天然VE、10Kg单甘酯、1Kg迷迭香提取物(含10%鼠尾草酸)、498Kg橄榄油一起在纳米研磨机中温度20℃下研磨至结晶粒径为5μm以下,得到辅酶Q10分散液。将400Kg改性淀粉(T809)、35Kg蔗糖酯(HLB值13~16)溶于1500Kg的水中,配成改性淀粉水溶液,保温至45℃备用。将辅酶Q10分散液升温至35℃,待辅酶Q10分散液溶解完全后,冷却至30℃,保温备用。将上述的辅酶Q10分散液加入到改性淀粉水溶液中在10000rpm转速下剪切30分钟,并且在80MPa下均质3次,在出口得到纳米分散的辅酶Q10乳液。将上述纳米分散的辅酶Q10乳液进行喷雾流化双包干燥,以玉米淀粉为包裹壁材进行双包被,喷雾塔进风口温度控制在180℃,出风口温度控制在90℃,雾化器转速1400r/min,喷雾干燥得水溶性纳米缓释功能性辅酶Q10微胶囊。经检测,该双包被的玉米淀粉上粉率为17%,微胶囊中辅酶Q10的含量为1.69%,油滴粒径分布表明产品中辅酶Q10的D90为95nm。实施例3将400Kg辅酶Q10结晶与20Kg胡椒碱、40Kg卵磷脂、80Kg天然VE、20Kg2,6-二叔丁基对甲酚、60Kg乙酸异丁酸蔗糖酯、880Kg肉豆蔻酸异丙酯一起在纳米研磨机中温度15℃下研磨至结晶粒径为5μm以下,得到辅酶Q10分散液。将400Kg改性阿拉伯胶(A-2010)、100Kg泊洛沙姆188溶于2000Kg的水中,配成改性阿拉伯胶水溶液,保温至35℃备用。将辅酶Q10分散液升温至45℃,待辅酶Q10分散液溶解完全后,冷却至35℃,保温备用。将上述的辅酶Q10分散液加入到改性阿拉伯胶水溶液中在10000rpm转速下剪切30分钟,并且在65MPa下均质3次,在出口得到纳米分散的辅酶Q10乳液。将上述纳米分散的辅酶Q10乳液进行喷雾流化双包干燥,以玉米淀粉为包裹壁材进行双包被,喷雾塔进风口温度控制在180℃,出风口温度控制在90℃,雾化器转速1400r/min,喷雾干燥得水溶性纳米缓释功能性辅酶Q10微胶囊。经检测,该双包被的玉米淀粉上粉率为14%,微胶囊中辅酶Q10的含量为17.36%,油滴粒径分布表明产品中辅酶Q10的D90为85nm。实施例4将60Kg辅酶Q10结晶与1Kg胡椒碱、0.4Kg卵磷脂、0.4Kg天然VE、0.1Kg2,6-二叔丁基对甲酚、0.1Kg吐温-80、487.5KgMCT一起在纳米研磨机中温度10℃下研磨至结晶粒径为5μm以下,得到辅酶Q10分散液。将450Kg鱼明胶、0.5Kg壳聚糖溶于2000Kg的水中,配成鱼明胶水溶液,保温至40℃备用。将辅酶Q10分散液升温至40℃,待辅酶Q10分散液溶解完全后,冷却至30℃,保温备用。将上述的辅酶Q10分散液加入到鱼明胶水溶液中在10000rpm转速下剪切30分钟,并且在80MPa下均质3次,在出口得到纳米分散的辅酶Q10乳液。将上述纳米分散的辅酶Q10乳液进行喷雾流化双包干燥,以玉米淀粉为包裹壁材进行双包被,喷雾塔进风口温度控制在180℃,出风口温度控制在90℃,雾化器转速1400r/min,喷雾干燥得水溶性纳米缓释功能性辅酶Q10微胶囊。经检测,该双包被的玉米淀粉上粉率为18%,微胶囊中辅酶Q10的含量为5.02%,油滴粒径分布表明产品中辅酶Q10的D90为89nm。实施例5将10Kg辅酶Q10结晶与5Kg胡椒碱、15Kg卵磷脂、20Kg天然VE、5Kg2,6-二叔丁基对甲酚、10KgTPGS、600Kg油酸聚乙二醇甘油酯一起在纳米研磨机中温度0℃下研磨至结晶粒径为5μm以下,得到辅酶Q10分散液。将310Kg改性大豆分离蛋白、25Kg壳聚糖溶于1000Kg的水中,配成改性大豆分离蛋白水溶液,保温至45℃备用。将辅酶Q10分散液升温至50℃,待辅酶Q10分散液溶解完全后,冷却至40℃,保温备用。将上述的辅酶Q10分散液加入到改性大豆分离蛋白水溶液中在10000rpm转速下剪切30分钟,并且在70MPa下均质3次,在出口得到纳米分散的辅酶Q10乳液。将上述纳米分散的辅酶Q10乳液进行喷雾流化双包干燥,以玉米淀粉为包裹壁材进行双包被,喷雾塔进风口温度控制在180℃,出风口温度控制在90℃,雾化器转速1400r/min,喷雾干燥得水溶性纳米缓释功能性辅酶Q10微胶囊。经检测,该双包被的玉米淀粉上粉率为15%,微胶囊中辅酶Q10的含量为0.85%,油滴粒径分布表明产品中辅酶Q10的D90为93nm。实施例6:稳定性实验:1、光照的影响取实施例1制备得到的水溶性纳米缓释功能性辅酶Q10微胶囊和辅酶Q10原料(辅酶Q10的质量含量:99%)分别装入密封无色透明的小瓶中置于4500Lx光照强度照射、无氧灌装(25℃恒温)条件下,1份作为对照,一份放置10天,一份放置20天,一份放置30天,用HPLC法测定辅酶Q10含量,考察光照对辅酶Q10含量(%)和外观的影响。结果如表1所示:表1光照对水溶性纳米缓释功能性辅酶Q10微胶囊稳定性的影响表1结果显示,本发明所制备的水溶性纳米缓释功能性辅酶Q10微胶囊粉体经光照后,辅酶Q10未出现明显破坏,表明其在上述环境下较稳定,说明水溶性纳米缓释功能性辅酶Q10微胶囊可大大的提高辅酶Q10的光稳定性。2、温度的影响取实施例1制备得到的水溶性纳米缓释功能性辅酶Q10微胶囊和辅酶Q10原料(辅酶Q10质量含量:99%)分别装入密封无色透明的小瓶中置于60℃(恒温箱)条件下,1份作为对照,一份放置10天,一份放置20天,一份放置30天,用HPLC法测定辅酶Q10含量,考察温度条件对辅酶Q10含量(%)和外观的影响。结果如表2所示:表2温度对水溶性纳米缓释功能性辅酶Q10微胶囊稳定性的影响表2结果显示,本发明所制备的水溶性纳米缓释功能性辅酶Q10微胶囊粉体在高温环境下,辅酶Q10未出现明显破坏,表明其在上述环境下较稳定,说明水溶性纳米缓释功能性辅酶Q10微胶囊可大大的提高辅酶Q10的高温稳定性。3、氧气的影响取实施例1制备得到的水溶性纳米缓释功能性辅酶Q10微胶囊和辅酶Q10原料(辅酶Q10质量含量:99%)分别装入棕色的小瓶中充氧灌装(25℃恒温))避光放置,1份作为对照,一份放置10天,一份放置20天,一份放置30天,用HPLC法测定辅酶Q10含量,考察充氧条件对辅酶Q10含量(%)和外观的影响。结果如表3所示:表3氧气对水溶性纳米缓释功能性辅酶Q10微胶囊稳定性的影响表3结果显示,本发明所制备的水溶性纳米缓释功能性辅酶Q10微胶囊粉体在充氧环境下,辅酶Q10未出现明显破坏,表明其在上述环境下较稳定,说明水溶性纳米缓释功能性辅酶Q10微胶囊可大大的提高辅酶Q10的充氧稳定性。由上述影响因素实验结果表明,本发明的水溶性纳米缓释功能性辅酶Q10微胶囊在光照、充氧、高温破坏条件下,外观性状和含量均没有明显变化。在光照、充氧、高温破坏条件下外观性状一致,水溶性纳米缓释功能性辅酶Q10微胶囊为淡黄色粉末,颜色上没有明显改变。光照、充氧、高温破坏条件下辅酶Q10的HPLC分析色谱图未出现降解产物峰,表明其在上述环境下稳定。以上说明本发明的水溶性纳米缓释功能性辅酶Q10微胶囊具有较好的稳定性,降低了光照、氧气、温度对其辅酶Q10性质的影响。实施例7:增强免疫力功能的试验本发明水溶性纳米缓释功能性辅酶Q10微胶囊经动物性实验证实,可以增强免疫力功能试验,其实验步骤和结果如下:1.1样品:样品1:实施例1制备的水溶性纳米缓释功能性辅酶Q10微胶囊;参比样:实施例1配方中的胡椒碱替换成同等质量的大豆油,其余组分及制备方法与实施例1一致,制备得到辅酶Q10微胶囊参比样。原料样:辅酶Q10原料(辅酶Q10的质量含量为99%)。总共3个样品进行动物性实验。1.2实验动物与分组:由长沙市开福区东创实验动物科技服务部(实验动物使用许可证号为SYXK(湘)2010-0010)提供的SPF级昆明种雄性小鼠,鼠龄3个月,体重18~22g。按照国际实验动物实验准则对动物进行操作,以减少实验动物在实验过程中的痛苦。采用完全随机设计将小鼠随机每40只分为一组,共六组。免疫Ⅰ组,进行ConA诱导鼠脾淋巴细胞转化实验;免疫Ⅱ组,进行迟发型变态反应实验;免疫Ⅲ组,进行体比值测定,血清溶血素测定和抗体生成细胞数测定;免疫Ⅳ-Ⅵ组,分别进行碳实验、腹腔巨噬细胞吞噬鸡红细胞实验和NK细胞活性测定。1.3主要仪器与试剂:二氧化碳培养箱:日本三洋;紫外可见分光光度计:岛津有限公司;酶标仪:美国宝特;等。绵羊红细胞(SRBC)、Hank's液(pH7.2-7.4)、RPMI1640培养液、小牛血清、ConA、吩嗦二甲酯硫酸盐、氧化型辅酶I等。1.4受试物给予方式:根据人口服推荐用量,设样品1、参比样、原料样组(分别相当于人体推荐用量),设一个阴性对照组,每组10只动物。分别称取样品,混匀、配成溶液剂后,给予相应剂量组动物灌胃,阴性对照组予以等体积的空白溶液剂,每天灌胃一次,连续灌胃30d。1.5实验方法:1.5.1脏器/体重比值测定称重后处死小鼠,取出胸腺和脾脏,在电子分析天平上称重,计算脏/体比值。1.5.2其他免疫指标的测定根据《保健食品检验与评价技术规范》-2003免疫功能检测的程序,分别测定下列各项免疫指标:ConA诱导的小鼠脾淋巴细胞转化实验(MTT法)、二硝基氟苯诱导的小鼠DTH实验(耳肿胀法)、抗体生成细胞检测(Jerne改良玻片法)、血清溶血素的测定(血凝法)、小鼠碳廓清实验、NK细胞活性测定(乳酸脱氢酶测定法)。1.6实验数据统计应用SPSS统计软件进行方差分析统计处理。1.7结果判定根据《保健食品检验与评价技术规范》增强免疫力功效的判定标准,在细胞免疫功能、体液免疫功能、单核-巨噬细胞功能、NK细胞活性四方面任两个方面结果阳性,可判定该受试样品具有增强免疫力功能作用。表4辅酶Q10增强免疫力功能试验对小鼠(免疫Ⅰ组)体重的影响(x±S)作用药物动物数初始体重/g中期体重/g末期体重/g增重/g样品11019.9±1.230.7±1.042.9±1.523.0±2.3参比样1020.1±1.330.1±1.140.7±1.620.6±2.5原料样1020.2±1.332.1±1.042.1±1.821.9±2.1阴性对照组1019.7±1.231.9±1.141.5±1.921.8±2.0表5辅酶Q10增强免疫力功能试验对小鼠(免疫Ⅱ组)体重的影响(x±S)作用药物动物数初始体重/g中期体重/g末期体重/g增重/g样品11020.0±1.231.7±1.341.1±1.621.1±1.9参比样1019.7±1.331.1±1.241.7±1.722.0±2.1原料样1020.3±1.132.0±1.143.1±1.822.8±2.0阴性对照组1020.3±1.232.1±1.242.4±1.922.1±1.7表6辅酶Q10增强免疫力功能试验小鼠的免疫器官脏器/体重比值(x±S)作用药物动物数胸腺/体重/%P值脾脏/体重/%P值样品1100.218±0.0170.3500.388±0.0460.894参比样100.218±0.0190.8900.392±0.0260.897原料样100.219±0.0160.9120.408±0.0510.899阴性对照组100.222±0.015----0.405±0.038----由表4、5、6所示,不同免疫组实验期间小鼠的体重增长与阴性对照组间的比较,差异均无显著性(P>0.05),表明该样品对小鼠的体重增长无明显影响。经口给予小鼠不同样品组的辅酶Q10溶液剂30d,小鼠的胸腺/体重及脾脏/体重比值与阴性对照组比较,差异均无显著性(P>0.05),表明该样品对小鼠的免疫器官重量无明显影响。表7辅酶Q10对小鼠脾淋巴细胞转化实验结果的影响(x±S)由表7所示,经口给予小鼠不同样品组的辅酶Q10溶液剂30d,各样品组的小鼠淋巴细胞转化能力均高于阴性对照组,其中的样品1组与阴性对照组的差异具有显著性(P<0.05),表明该样品具有促进小鼠的淋巴细胞增值、转化能力的作用。表8辅酶Q10对小鼠迟发型变态反应(DTH)实验结果的影响(x±S)由表8所示,经口给予小鼠不同样品组的辅酶Q10溶液剂30d,各样品组的小鼠左右耳片重量差值均高于阴性对照组,其中的样品1组与阴性对照组的差异具有非常显著性(P<0.01),表明该样品具有促进小鼠的迟发型变态反应的作用。表9辅酶Q10对小鼠抗体生成细胞检测测定结果的影响(x±S)由表9所示,经口给予小鼠不同样品组的辅酶Q10溶液剂30d,各样品组的小鼠抗体生成细胞数均高于阴性对照组,其中的样品1组、参比样组与阴性对照组的差异具有显著性(分别P<0.01和P<0.05),表明该样品具有促进小鼠的抗体生成细胞增殖的作用。表10辅酶Q10对小鼠溶血素测定结果的影响(x±S)作用药物动物数抗体积数P值样品110202.8±13.70.030参比样10193.2±21.90.316原料样10192.1±31.50.357阴性对照组10179.2±23.6----由表10所示,经口给予小鼠不同样品组的辅酶Q10溶液剂30d,各样品组的小鼠的抗体积数均高于阴性对照组,其中的样品1组与阴性对照组的差异具有显著性(P<0.05),表明该样品具有提高小鼠的血清溶血素水平的作用。表11辅酶Q10对小鼠单核-巨噬细胞碳廓清测定结果的影响(x±S)作用药物动物数吞噬指数P值样品1108.37±1.250.021参比样107.14±1.370.876原料样107.09±1.280.929阴性对照组106.76±0.95----由表11所示,经口给予小鼠不同样品组的辅酶Q10溶液剂30d,各样品组的小鼠的吞噬指数均高于阴性对照组,其中的参比样组与阴性对照组的差异具有显著性(P<0.05),表明该样品具有促进小鼠的单核巨噬细胞碳廓清功能的作用。表12辅酶Q10对小鼠腹腔巨噬细胞吞噬鸡红细胞测定结果的影响(x±S)作用药物动物数吞噬率//%吞噬率转换数据P值吞噬指数P值样品11024.1±3.40.511±0.0410.0430.47±0.080.001参比样1020.8±3.50.467±0.0480.8760.40±0.070.086原料样1021.7±5.290.484±0.0360.4430.39±0.080.211阴性对照组1020.1±2.20.462±0.025----0.36±0.05----由表12所示,口给予小鼠不同样品组的辅酶Q10溶液剂30d,各样品组的小鼠的腹腔巨噬细胞对鸡红细胞的吞噬率及吞噬指数均高于阴性对照组,其中的样品1的吞噬率和吞噬指数与阴性对照组的差异具有显著性(分别P<0.05和P<0.01),表明该样品具有促进小鼠的腹腔巨噬细胞的吞噬功能的作用。表13辅酶Q10对小鼠NK细胞活性测定结果的影响(x±S)由表13所示,经口给予小鼠不同样品组的辅酶Q10溶液剂30d,各样品组的小鼠的NK细胞活性均高于阴性对照组,但各剂量组与阴性对照组的差异均无显著性(P>0.05),表明该样品对小鼠的NK细胞活性无明显的提高作用。以样品1、参比样、原料样的辅酶Q10溶液剂给小鼠连续灌胃30d,能促进小鼠的脾淋巴细胞增殖、转化作用,促进小鼠的抗体生成细胞增殖,提高小鼠的血清溶血素水平,促进小鼠的迟发型变态反应及其单核-巨噬细胞的吞噬功能,对小鼠的体重增长、胸腺/体重比值、脾脏/体重比值及其NK细胞活性无明显影响。从显著性差异的统计分析判断添加胡椒碱的水溶性纳米缓释功能性辅酶Q10微胶囊增强免疫力功能优于未添加胡椒碱的辅酶Q10微胶囊。根据《保健食品检验与评价技术规范》,可判定本发明辅酶Q10、胡椒碱的组合具有良好的增强免疫力的性能。实施例8:辅酶Q10体内药代动力学实验本发明水溶性纳米缓释功能性辅酶Q10微胶囊经动物性实验证实,可以明显提高辅酶Q10的吸收性能,其实验步骤和结果如下:1.1样品:样品样:实施例1制备的水溶性纳米缓释功能性辅酶Q10微胶囊;参比样:采用与实施例7相同的参比样;原料样:辅酶Q10原料(辅酶Q10的质量含量为99%)。总共3个样品进行动物性实验。1.2实验动物与分组:由长沙市开福区东创实验动物科技服务部(实验动物使用许可证号为SYXK(湘)2010-0010)提供的SPF级昆明种雄性小鼠,鼠龄3个月,体重18~22g。按照国际实验动物实验准则对动物进行操作,以减少实验动物在实验过程中的痛苦。采用完全随机设计将大鼠随机每10只分为一组,共三组。1.3实验条件:为屏蔽环境,实验期间环境温度23℃~24℃,湿度50%~56%,每日自由摄取去离子水和标准饲料。1.4口服给药及样品采集取禁食12h的小鼠随机10只分为一组,共三组。分别将实施例样品样,参比样,原料样,按30mg/kg剂量给予小鼠灌胃处理,使每组每个时间点5只小鼠,于给药5、15、30min及1、2、4、6、12h分别取血于肝素抗凝管中,离心分离处理后进行测样。1.5药代动力学实验小鼠经口服(30mg/kg)给予实施例样品样、参比样、原料样后,对实验所得的血浆样品处理后进样HPLC分析测定。根据血药浓度结果进行拟合分析,计算血药浓度数据。表14小鼠经口服给药样品药动力学参数血药浓度-时间曲线下面积(AUC)是评定生物利用度的最可靠的指标。由表14,可知样品样的AUC比参比样和原料样的比值大。药物制剂的生物利用度测定,一般是用非血管途径给药(如口服,op)的药-时曲线下的面积(AUC)与该药参比制剂如静注(iv)或相同途径给药(po)后的比值,以吸收百分率表示。样品样的F值为146.0%,即本发明的水溶性纳米缓释功能性辅酶Q10微胶囊的生物利用度是原料药的1.46倍,参比样的F值为122.3%,即参比辅酶Q10微胶囊的相对生物利用度是原料药的1.223倍。生物利用度是用来评价制剂吸收程度的指标,说明本发明的水溶性纳米缓释功能性辅酶Q10微胶囊在体内吸收过程得到改善,胡椒碱的添加,可进一步提高辅酶Q10的生物利用度。实施例9:辅酶Q10微胶囊的体外释放实验样品样:实施例1制备的水溶性纳米缓释功能性辅酶Q10微胶囊;参比样:采用与实施例1相同的配方,喷雾干燥方式有所不同,制备方法如下:将240Kg辅酶Q10结晶与16Kg胡椒碱、40Kg卵磷脂、40Kg天然VE、654Kg大豆油一起在纳米研磨机中温度25℃下研磨至结晶粒径为5μm以下,得到辅酶Q10分散液。将1000Kg改性淀粉(T809)、10Kg蔗糖酯(HLB值13~16)溶于3000Kg的水中,配成改性淀粉水溶液,保温至40℃备用。将辅酶Q10分散液升温至50℃,待辅酶Q10分散液溶解完全后,冷却至40℃,保温备用。将上述的辅酶Q10分散液加入到改性淀粉水溶液中在10000rpm转速下剪切30分钟,并且在60MPa下均质3次,在出口得到纳米分散的辅酶Q10乳液。将上述纳米分散的辅酶Q10乳液进行喷雾干燥,喷雾塔进风口温度控制在180℃,出风口温度控制在90℃,雾化器转速1400r/min,喷雾干燥即得。称取适量的样品样和参比样(相当于辅酶Q1030mg),分别撒布于释放仪中,在(37±1)℃1000ml扩散介质中,以桨法转速为50r·min-1搅拌,分别在5min、10min、15min、20min、30min、1h、2h、3h、4h、5h、8h取样10ml,同时补加同温同量的扩散介质;在设定时间点取样,微孔滤膜过滤,过滤液在505nm波长处测吸收度,代入标准曲线,计算累积释放百分率,绘制释放曲线,见附图1。由附图1释放曲线可得到,由于本发明的水溶性纳米缓释功能性辅酶Q10微胶囊粉末双包埋壁材更厚实,缓释效果更好,体外释放时间有所延长。实施例10:辅酶Q10微胶囊在不同温度下的溶解性实验样品样:实施例1制备的水溶性纳米缓释功能性辅酶Q10微胶囊;参比样1:采用与实施例9相同的参比样;以下参比样2、3、4为随机从市场上购买的10%水溶性辅酶Q10微胶囊:参比样2:购自西安某医药有限公司的10%水溶性辅酶Q10微胶囊;参比样3:购自河南某食品添加剂有限公司的10%水溶性辅酶Q10微胶囊;参比样4:购自西安某生物技术有限公司的10%水溶性辅酶Q10微胶囊。分别称取0.1g样品样和参比样,加入烧杯中,置于恒温水浴锅中,再分别加入10ml与水浴同温的蒸馏水,分别测定在25℃、35℃、45℃、55℃、60℃条件下完全溶解所需要的时间。试验结果见附图2。由附图2可见,同一温度下,本发明水溶性纳米缓释功能性辅酶Q10微胶囊的水溶性能明显优于市售的其它辅酶Q10水溶性微胶囊,也明显优于参比样1的单层包被微胶囊,说明本发明的水溶性纳米缓释功能性辅酶Q10微胶囊的水溶性能优越,双包被技术可改善微胶囊的水溶性,有利于进一步提高辅酶Q10的生物利用度。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1