肿瘤微酸性敏感的铜‑药物共配位自组装纳米粒及应用的制作方法
(一)技术领域
本发明涉及一种用于肿瘤微酸性敏感的铜离子-药物共配位自组装纳米粒及应用。
(二)
背景技术:
肿瘤(tumor)是一种常见病、多发病,其中恶性肿瘤(cancer)是目前危害人类健康最严重的一类疾病。在欧美一些国家,恶性肿瘤的死亡率仅次于心血管系统疾病而居第二位。而我国最为常见和危害性严重的肿瘤为肺癌、鼻咽癌、食管癌、胃癌、大肠癌、肝癌、乳腺癌、宫颈癌、白血病及淋巴瘤等。而目前恶性肿瘤的治疗多以手术切除为主,但很多患者在确诊时因肿瘤部位,身体耐受状态影响而失去手术治疗机会。而局部放疗、化疗等辅助治疗会诱发病人机体对放疗、化疗产生耐受性,并且治疗所带来的毒副作用,影响病人的生存期与生活质量。其中,耐药的本质在于恶性肿瘤的快速增殖,导致新生血管生长不完全,发生局部血管畸形,导致肿瘤组织的血液循环不畅,致使机体对实体肿瘤实质的血氧供应不足,致使肿瘤组织局部的含氧量在0.1%以下缺氧环境,而这一普遍而独特的性质会诱导肿瘤细胞启动缺氧诱导因子hif-1α的高表达,而hif-1α的高表达与肿瘤细胞对放、化疗的耐受性有很高相关性。因此,急需开发一种新药用于抑制或对抗肿瘤微氧或缺氧环境下存活的肿瘤细胞。
近年来,肿瘤乏氧选择性活化前药——生物还原类新药,以肿瘤特有的内源酶为靶标引起医学和科学界的广泛关注和深度研究。banoxantrone(aq4n)是一种针对低氧或缺氧状态发生生物还原类新药(蒽环类药物),此药已经进入临床三期试验。其原理是,aq4n在低氧或缺氧状态,还原活化成细胞毒素aq4,aq4与细胞核内dna具有高亲和性,其对dna拓扑异构酶ii具有强烈的抑制作用,抑制dna的转录与复制,导致细胞死亡;而在正常氧分压下,aq4n与dna无亲和性,且仅定位于细胞质内及内质网中,并容易被肿瘤细胞外排,降低药物生物利用率。而阿霉素dox(doxorubicin)是一类广谱抗肿瘤药物(蒽环类药物),其可定位于细胞核内,抑制rna和dna的合成,对rna的抑制作用最强,对多种肿瘤均有作用,属周期非特异性药物,对各种生长周期的肿瘤细胞都有杀灭作用。但在低氧或缺氧条件下,dox容易被肿瘤细胞外排以及诱发肿瘤产生耐受性。因此,将生物还原类前药aq4n与dox联用,通过纳米技术,将其制备成纳米级药物共载体,改善肿瘤对药物的摄取方式,并以优势互补为原则,将有助于提高临床对癌症的治疗效果。
(三)
技术实现要素:
本发明涉及一种用于肿瘤微酸性敏感的铜离子-药物共配位自组装纳米粒及应用。
本发明采用的技术方案是:
一种用于肿瘤微酸性敏感的铜离子-药物共配位自组装nanodrug纳米粒,由生物还原类肿瘤增敏剂aq4n和阿霉素dox共同与二价铜离子配位自组装而成,所述纳米粒直径为80~100nm,其中增敏剂aq4n、阿霉素dox、二价铜离子质量之比为1∶1~3:0.1~0.5。cu(ii)分别与aq4n和dox的羰基c=o与甲氧基c-o配位,并在亲-疏水作用力,π堆积力,范德华力作用、金属配位作用力共同作用下,自组装形成nanodrug纳米粒。
所述nanodrug纳米粒可由如下方法制得:
(1)由dox-hcl和aq4n按比例混合,并向其中加入一定量的cucl2中性溶液,得到含有配体aq4n-cu(ii)-dox-hcl的混合液;
(2)将(1)得到的混合液中,加入适量三乙胺脱盐24~36h,得到两性的aq4n-cu(ii)-dox,然后将其逐滴加入到10ml的去离子水中,搅拌12~24h,然后用10000~20000da的透析袋透析1~2天,得到所述纳米粒nanodrug。
具体方法如下:在去离子水中,加入一定比例的aq4n与dox-hcl粉末,强烈搅拌1~2hrs后,加入cucl2(ph7.4)溶液,并强烈搅拌1hr后,加入三乙胺并持续搅拌24~36hrs后,然后,将混合液逐滴加入到去离子水中,并搅拌12~24hrs;然后放入透析袋中透析,每4hrs更换一次1l的去离子水,透析1~2天后,低速离心去除大聚集体,然后高速离心获得沉淀后,分散在pbs缓冲溶液中备用。
铜是参与人体内多种酶类所必须的微量元素,微量对人体有益。本发明基于aq4n和dox同属蒽环类化合物,在空间上具有一定的平面结构,并且aq4n与dox的羰基c=o和甲氧基c-o均与二价金属铜离子cu(ii)配位,设计合成了一种用于肿瘤微环境ph敏感性成像、药物缓释及协同抗肿瘤作用的nanodrug纳米粒。其合成操作简便,aq4n与dox的羰基c=o和甲氧基c-o均与二价金属铜离子cu(ii)配位,并利用aq4n的亲水性、脱盐后dox的疏水性、以及aq4n与dox范德华力作用、π堆积力及配位作用力下,在水中自组装而制备出纳米尺度均匀的nanodrug纳米粒。实验发现nanodrug纳米粒具有良好的生物相容性、生理稳定性和ph梯度敏感性,以及良好的药物渗透作用,可用于肿瘤微环境ph敏感性成像、药物缓释,降低对正常组织、细胞的毒副作用,并在有氧、缺氧条件下对肿瘤发挥良好的协同抗肿瘤作用,具有良好的临床应用前景。
为提高肿瘤细胞对其纳米粒的摄取,降低网状内皮系统(reticuloendothelialsystem)的吞噬作用,本发明利用aq4n电中性,其可有效提高药物体循环时间,降低网状内皮系统的吞噬。因此,本发明纳米粒具有良好的肿瘤组织富集与治疗选择性。
本发明构建的nanodrug纳米粒,可依据肿瘤微酸环境,智能调节纳米尺度,有效渗透入肿瘤实质,并靶向定位于肿瘤细胞核内,在有氧、低氧状态下,发挥其良好的协同化疗作用。同时,dox与aq4n的荧光因聚集而引起淬灭,当其被肿瘤细胞摄取后,由于肿瘤细胞内的低ph条件下,引起nanodrug纳米粒快速崩解,释放出大量aq4n与dox,导致荧光恢复,可用于实时监测药物释放与细胞成像。
优选的,所述增敏剂aq4n、阿霉素dox、二价铜离子质量之比为1∶2.4∶0.25。
所述的nanodrug纳米粒在制备抗肿瘤药物中的应用。进一步,所述药物为控释药物或梯度酸性敏感药物。
本发明还涉及所述nanodrug纳米粒在肿瘤细胞荧光成像中的应用。进一步,所述成像为肿瘤微环境ph成像。所述的荧光成像可用于细胞的近红外荧光成像。
本发明以临床应用的分子药物dox与临床二期前药aq4n通过cu(ii)配位搭桥,形成具有均一纳米尺度、良好的生物相容性的纳米粒,其设计独特,在于以,cu(ii)配位作用力,以及亲疏水作用力为前提,设计合成可自组装的纳米粒,其药物生理条件下稳定性高,改善了肿瘤细胞摄取药物途径,降低了蒽环类药物正常细胞与心肌细胞的毒副作用,提高了肿瘤细胞对纳米药物的摄取效率,提高了化疗药物对有氧或缺氧环境下的肿瘤组织细胞的治疗效率。
本发明所构建的nanodrug纳米粒可通过不同的剂量给药,这取决于早期成像诊断的癌症患者临床状况。本发明的nanodrug纳米粒的给药剂量和浓度,可由临床医生例行确定。用药方案取决于各种因素,例如成像的癌细胞,组织或肿瘤是分散还是局部,患者的健康程度,年龄等。
本发明所构建的nanodrug纳米粒可通过三种已知的给药途径给药,包括静脉给药,腹腔给药,以及局部给药的区域递送形式。
本发明的nanodrug纳米粒,可根据肿瘤微环境ph,智能调节纳米尺度,有效渗透肿瘤实质,并在有氧、低氧或缺氧条件下,发挥药物缓释与协同抗肿瘤活性,降低癌症患者因肿瘤实质性缺氧而导致的药力下降或耐药性,提高肿瘤细胞的药物敏感性,降低用药剂量,减轻蒽环类化疗药物对患者潜在的毒副作用。
(四)附图说明
图1为nanodrug纳米粒的扫描电镜图;
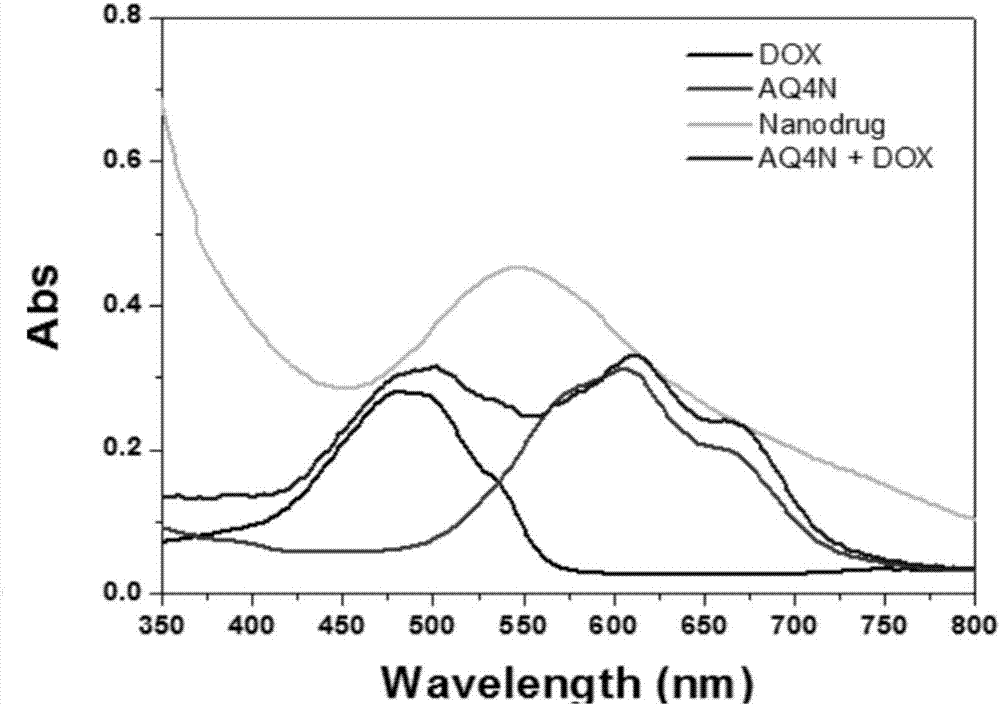
图2为aq4n,dox,nanodrug,aq4n与dox的混合液的紫外可见近红外吸收光谱;
图3为nanodrug纳米粒在不同ph条件下dox(a)与aq4n(b)的可控释放曲线。
图4为nanodrug纳米粒在肝癌细胞中的定位。
图5为nanodrug纳米粒在缺氧条件下对肝癌细胞的联合治疗效果。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:
利用电子天平称取1mg的阿霉素盐酸盐doxorubicin-hcl((2r,4s)-4-(3-amino-2,3,6-trideoxy-α-l-lyxo-hexopyranosyloxy)-2-hydroxyacetyl-1,2,3,4-tetrahydro-2,5,12-trihydroxy-7-methoxynaphthacene-6,11-dione,sigma公司)的红色粉末和1mg的banoxantrone(1,4-bis[2-(dimethylamino-n-oxide)ethylamino]-5,8-dihydroxyanthracene-9,10-dione,abcam公司)蓝色粉末溶解在盛有2ml去离子水中,搅拌1h后,加入0.1ml的1mg/mlcucl2-ph7.4(用naoh调节ph),并搅拌4h,然后加入0.45ml的三乙胺溶液于混合液中脱盐。在避光条件下搅拌24hrs后,将混合液逐滴加入到10ml的去离子水中,并1000rpm/min搅拌。然后置于14400da的透析袋中进行透析,每间隔4h更换一次1l的去离子水。透析2天后,将其中溶液以1000rpm/min低速离心,去除聚集体,然后再利用13500rpm/min收集纳米粒,并分散在pbs缓冲液中备用。
实施例2:
实施例1制备的nanodrug纳米粒的直径约80~100nm,并具备了ph敏感的近红外荧光成像、药物控释,及有氧、乏氧性协同抗肿瘤作用。
使用扫描电镜(sem)、紫外-可见分光光度计(uv-vis-nir)对nanodrug纳米粒进行表征,并利用共聚焦显微镜研究nanodrug纳米粒的细胞器定位。并利用细胞活力检测试剂盒(cck8)检测nanodrug纳米粒对肝癌细胞的协同化疗效果。具体测试结果如下:
(1)扫描电镜(sem)
扫描电镜图像表示nanodrug纳米粒的形貌和纳米尺寸。结果参照图1,表示在1μm的标尺下,检测nanodrug纳米粒分布及形貌,其说明nanodrug纳米粒束尺寸均一,形貌一致。
(2)紫外-可见-近红外分光光度计(uv-vis-nir)
紫外-可见-近红外吸收光谱,表示nanodrug纳米粒的特征光谱。结果参照图2,dox的吸收峰在498nm,aq4n的吸收峰在600nm,nanodrug纳米粒的吸收峰在540nm并高于dox和aq4n的吸收峰,其原因在于配位的cu(ii)的特征吸收在540nm,其特征吸收同时高于dox与aq4n的混合液的吸收。证明通过配位作用制备出新的药物剂型nanodrug纳米粒。
(3)nanodrug纳米粒在不同ph条件下的可控释放曲线
结果见图3。由图可见,制备的nanodrug纳米粒具有不同ph敏感性,中性ph7.4条件下,极为稳定;ph6.5下,微量释放,ph5.0下大量释放;ph2.5下,全部释放,并在释放过程中,其dox荧光恢复,aq4n的荧光恢复用于成像诊断与药物释放指示。
(4)共聚焦显微镜研究nanodrug纳米粒在肝癌细胞中的定位
结果见图4。由图可见,nanodrug纳米粒进被肿瘤细胞摄取后,其因肿瘤细胞内的低ph条件下,导致aq4n与dox显著释放,其中aq4n主要定位于细胞质及内质网膜,dox主要定位于细胞质与细胞核内,为进一步发挥药效提供有利条件。
(5)细胞活力检测试剂盒(日本同仁化工)检测nanodrug纳米粒在缺氧条件下(1%o2)对肝癌细胞的协同治疗效果
按照试剂盒操作规程进行操作,结果见图5。由图可见,nanodrug纳米粒的肿瘤细胞抑制率(63.8%)高于同等浓度下的aq4n(37.6%)以及dox(58.3%),证明nanodrug纳米粒具有良好的联合治疗效果。
- 还没有人留言评论。精彩留言会获得点赞!