一种miR‑146a纳米粒子及其在制备治疗糖尿病周围神经病变的药物中的应用的制作方法
本发明涉及生物医药技术领域,具体地说,涉及一种mir-146a纳米粒子及其在制备治疗糖尿病周围神经病变的药物中的应用。
背景技术:
糖尿病(diabetesmellitus,dm)是一种常见的由多因素相互作用导致的以慢性高血糖为特征的代谢性疾病。由高血糖诱发的代谢紊乱可引起多种组织器官的病理生理改变,神经系统损伤是糖尿病并发症之一,其中以周围神经受累最常见即dpn。dpn病程隐匿、呈渐进性进展,病理学改变主要表现为,有髓神经纤维的节段性或弥散性皱缩或脱髓鞘和无髓神经纤维的轴突变性。临床上发病主要表现为慢性远端对称性感觉运动性多发神经病变,严重者出现足部溃疡、坏疽,甚至导致截肢。严重影响了患者的生活质量,增加了家人及社会的经济负担。因此,寻找有效治疗dpn的方法是目前亟待解决的问题。
至今dpn的发病机制仍未得到明确的阐释,但目前研究已证实,糖尿病周围神经病变与基因突变、代谢紊乱、神经营养因子缺乏、氧化应激、自身免疫异常和炎症反应等因素密切相关。近来国内外研究发现炎症反应和糖尿病周围神经病变存在密切关系。糖尿病患者体内长期高血糖状态可以激活多元醇,蛋白激酶c,ages/rages和己糖胺通路诱导氧化应激和炎症反应,诱导细胞的凋亡,最终导致神经纤维组织结构和功能的变化。
研究认为,tnf-α在糖尿病周围神经病变中是一个强有力的促炎细胞因子。tnf-α的过表达会增强胶质细胞的毒性,导致神经脱髓鞘,并且可以促进炎症因子il-6和il-1β的表达。在yamakawa的研究中发现,与正常小鼠相比,tnf-α+/+糖尿病小鼠中的cleavedcaspase-3表达增加,从而损伤周围神经。敲除tnf-α基因(tnf-α-/-)的糖尿病小鼠和正常小鼠比较,坐骨神经传导速度并无明显差异,即沉默tnf-α基因可以缓解糖尿病小鼠周围神经的损伤。我们前期研究发现,当dpn大鼠皮下注射rhtnfr:fc(tnf-αreceptor-antibodyfusionprotein)后,治疗组大鼠和dpn大鼠相比,神经传导速度得到明显改善。
研究证实,cox-2参与了糖尿病周围神经病变的发生和发展。高浓度葡萄糖可以诱导氧化应激的发生,激活pkc和ar通路(aldosereductase醛糖还原酶),导致cox-2的过表达,引起txa2/pgi2的比例失调,诱发组织缺血缺氧,从而导致神经组织的结构完整性和功能的破坏。aaron的研究发现,cox-2-/-小鼠的感觉和运动神经传导速度显著高于cox-2+/+和cox-2+/-糖尿病小鼠,接近于正常组小鼠的神经传导速度。研究发现在cox-2的启动子区域有nf-κb的结合位点,可以直接参与炎症反应的调控。予以塞来昔布治疗后,cox-2+/+糖尿病小鼠的坐骨神经tnf-α的表达降低。因此,cox-2抑制剂可以延缓糖尿病周围神经病变的发生发展。
综上所述,炎症发应在糖尿病周围神经病变中具有重要的作用。
目前,非甾体类抗炎药因其明显的毒副作用和组织非特异性限制了其在临床上的广泛应用,因此寻求内源性调控炎症反应的小分子,将有助于解决这一难题。
microrna(mirna)是一类长度约为18-25个核苷酸的非蛋白编码的内源性小分子rna,其通过碱基互补配对可以特异的结合mrna的3’端非翻译区,抑制靶mrnas的降解或者翻译而负性调节转录后的基因表达,是天然存在的基因调控小分子。生物信息学预测显示,30%的人类基因受microrna调控。根据前期的大量研究发现,mirna通过调控各种基因的表达,广泛参与细胞增殖、分化、凋亡、炎症、免疫应答、肿瘤形成等疾病过程。近来研究发现mirnas可对炎症反应及免疫反应的多个层面进行调控。mirna-146a是重要的内源性炎症调控小分子,可以负性调节炎性细胞因子的表达。
dna、sirna(smallinterferingrna)、mirna等核酸物质的分子量较大,因本身带有负电荷和高度的亲水性等理化性质不容易透过细胞的双分子膜。而核酸类物质如果直接入血,体内存在的核酸酶会将核酸类物质在到达靶细胞前降解掉,而无法发挥其生物学作用,所以将核酸物质输送到靶细胞需要借助基因载体。目前,基因输送载体主要有三种类型:重组病毒载体、非病毒载体和物理导入载体。由于病毒载体和物理导入载体的毒副作用高,转染效率低和制作成本高等限制了二者的临床应用。非病毒载体一般分两类:阳离子脂质体和阳离子聚合物(聚阳离子,cationicpolymer)。
目前还未见采用阳离子聚合物作为基因输送载体,将具有抗炎作用的小分子mir-146a输送到大鼠体内,通过基因治疗的方法实现对炎症反应的抑制,以治疗糖尿病周围神经病变的相关报道。
技术实现要素:
本发明的目的是针对现有技术中的不足,提供一种mir-146a纳米粒子及其制备方法和用途。
本发明提供了一种mir-146a纳米粒子,它包含mir-146a和间-2,6吡啶精胺,所述的mir-146a序列如seqidno:1所示,所述的间-2,6吡啶精胺结构式为:
优选地,所述的间-2,6吡啶精胺n=40~200。
优选地,所述的间-2,6吡啶精胺n=40~80。
优选地,所述的间-2,6吡啶精胺与mir-146a的质量比为89.8。
本发明还提供了所述的mir-146a纳米粒子的制备方法,包括以下步骤:
a)使用无菌去离子水配制间-2,6吡啶精胺溶液;
b)使用无菌的无酶水配制mir-146a溶液;
c)将同体积的间-2,6吡啶精胺溶液和mir-146a溶液混合均匀,室温下孵育,即得。
优选地,所述的间-2,6吡啶精胺n=40~200。
优选地,所述的间-2,6吡啶精胺n=40~80。
优选地,所述的间-2,6吡啶精胺与mir-146a的质量比为89.8。
本发明还提供了所述的mir-146a纳米粒子在制备治疗糖尿病周围神经病变的药物中的应用。
本发明还提供了所述的mir-146a纳米粒子在制备治疗糖尿病引起的炎症发应的药物中的应用。
本发明优点在于:
1、使用间-2,6吡啶精胺制备了mir-146a纳米粒子,并对该纳米粒子进行了表征;研究了mir-146a对糖尿病周围神经病变大鼠坐骨神经的保护作用及具体机制,结果表明本发明的mir-146a纳米粒子改善了糖尿病周围神经病变大鼠的ncv、形态学表现,对大鼠坐骨神经具有保护作用,并能够显著抑制糖尿病周围神经病变大鼠的炎症反应。
2、进一步研究了不同质量比和聚合度制备的mir-146a纳米粒子对糖尿病周围神经病变的影响,筛选得到质量比为89.8~224.5,聚合度为10~1000的条件下,对糖尿病周围神经病变大鼠的ncv、形态学表现的改善作用均十分明显,效果显著优于其他参数条件下,且以质量比为89.8,聚合度为40~80为最佳,取得了预料不到的技术效果,这可能与该条件下聚阳离子能够更好的压缩包裹mir-146a,稳定性更强,在体内高效转染细胞,并有效释放mirna-146a有关,还和该条件下的细胞毒性较弱有关。该条件下制备的mirna-146a纳米粒子在制备治疗糖尿病周围神经病变的药物方面具有广阔的应用前景。
附图说明
图1.大鼠实验的技术路线图。
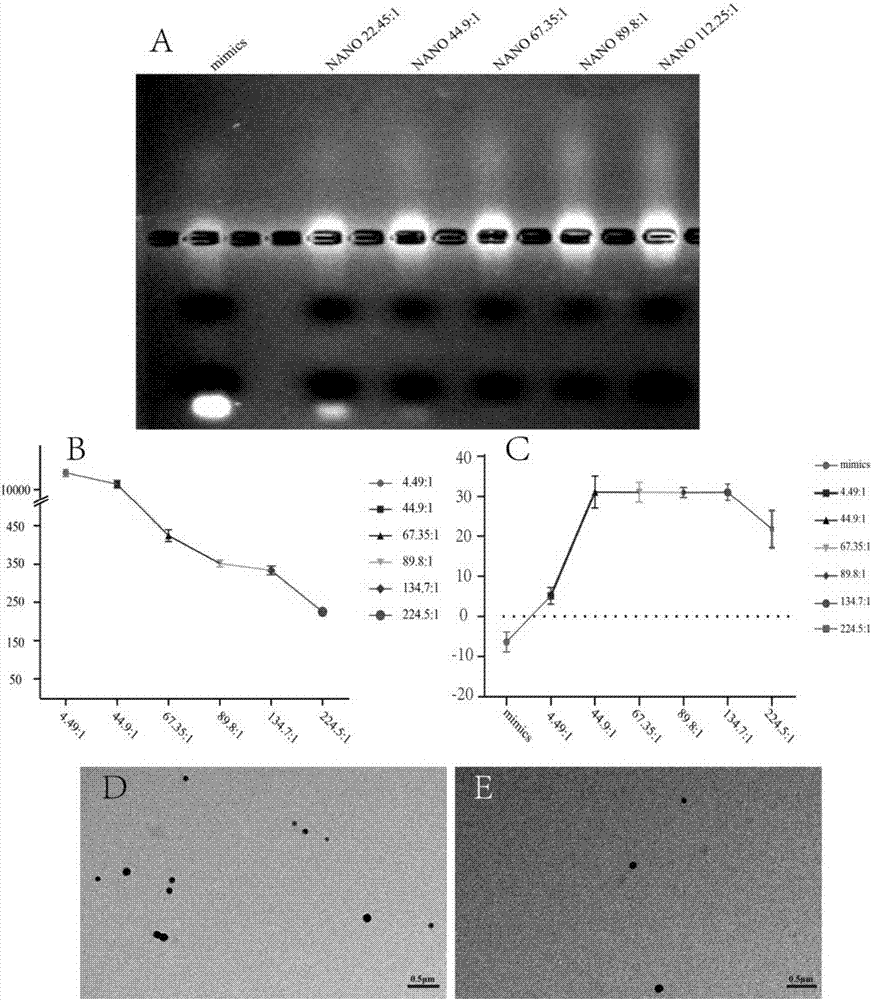
图2.pdasp-mirna复合物表征及比例选择。a图是pdasp-mirna复合物在不同质量比条件下的琼脂糖凝胶电泳图。b图是pdasp-mirna复合物在不同质量比条件下的粒径图。c图是pdasp-mirna复合物在不同质量比条件下的zetapotential图。d和e图是pdasp-mirna复合物在不同质量比条件下的原子力显微镜图(放大倍数:30000×)。
图3.纳米粒子对rsc96细胞毒性的影响。*p<0.05,**p<0.01和正常组比较。
图4.pdasp的体外细胞转染效率。a显示的是细胞背景,b显示的是cy3自带的红色荧光,c是将a、b两图叠加所显示的图,d图是不同聚阳离子复合物在不同质量比条件下的转染效率柱状图。**p<0.01和对照组比较。
图5.mir-146a对大鼠坐骨神经传导速度的影响。**p<0.01和正常组比较;#p<0.05和dpn组和dpn+nano组比较。横坐标:时间weeks;纵坐标:m/s。
图6.劳可-坚牢蓝染色。a、b:正常组;c、d:t2dm组;e、f:dpn组;g、h:dpn+nano组;i、j:dpn+mir-146a组;k、l:dpn+vitb12组。放大倍数:200×和400×。
图7.电镜观察。a、b:正常组;c、d:dpn组;e、f:dpn+mir-146a组;g、h:dpn+vitb12组。放大倍数:7500×和15000×。
图8.mir-146a对大鼠坐骨神经cox-2,tnf-α,caspase-3,cleavedcaspase-3蛋白表达水平的影响。a:westernblot电泳图示cox-2,tnf-α,caspase-3,cleavedcaspase-3表达。b:cox-2,tnf-α,caspase-3,cleavedcaspase-3的灰度值相对柱状图。**p<0.01,*p<0.05和dpn组相比;##p<0.01,#p<0.05和dpn+nano组相比。
具体实施方式
下面结合附图对本发明提供的具体实施方式作详细说明。
实施例1
一、实验材料
链脲佐菌素(stz):购于美国sigma公司。
mirna-146amimics:mirna-146a碱基序列为ugagaacugaauuccauggguu(seqidno:1),摩尔质量为6691.25mol,购于美国thermofisherscientific公司。
纳米粒子:间-2,6吡啶精胺pdasp,结构式为:
劳可-坚牢蓝染色试剂:购于美国sigma公司。
westernblot试剂、caspase-3兔多克隆抗体购于中国万类公司。
二、实验方法
1聚阳离子基因载体与microrna复合物的制备
所有操作均在无菌操作台中进行。
(1)稀释纳米材料:使用无菌去离子水溶解聚阳离子pdasp,终浓度为1.0mg/ml;
(2)稀释mirna:将mirna-146amimics用无菌的无酶水稀释成100pmol/μl的储存液,根据mirna-146a的摩尔质量,将部分mirna-146amimics稀释成10ng/μl工作浓度于-20℃保存。
(3)制备pdasp-mirna复合物:依照设定浓度梯度,稀释pdasp,和同体积的mirna-146a工作液混合均匀(mirna-146amimics终浓度是5ng/μl),轻轻吹打混匀,室温下孵育30分钟,即可得到不同质量比的pdasp-mirna复合物溶液。
(4)pdasp-cy3oligo的复合物制备:cy3oligo的加入量和mirna-146amimics的摩尔量一样。
(5)体外转染复合物的操作方法:
转染6孔板:每孔加入2ml的无酚红的dmem,再加入400μl的复合物溶液(6孔板为400μl,96孔板为25μl,其他孔板按比例计算),轻轻米字型震摇培养板,放入培养箱中孵育4小时后,弃去培养基,用pbs缓冲液漂洗1-2次后,加入基础培养基,继续培养48小时后,进行下面的检测。
2聚阳离子-microrna复合物的相关表征
2.1复合物的琼脂糖凝胶电泳
(1)配胶:使用1×tae缓冲液,配制3.0%琼脂糖溶液,倒入制胶槽中,插入样品梳,室温放置30-60分钟等胶凝固,拔出样品梳,把tae缓冲液加入电泳槽中没过凝胶,等待上样。
(2)上样:配制不同质量比的复合物溶液,复合物质量比依次为0,4.49,44.9,67.36,89.8,134.7,224.5。每孔上样总量为6μl:按照4(复合物溶液):1(gel-red染料):1(上样缓冲液),混匀后加样。
(3)电泳及成像:电泳条件:110mv,45min。电泳结束后,使用紫外凝胶成像系统记录。
2.2复合物粒径测定
(1)按照上述方法配制质量比依次为4.49,44.9,67.36,89.8,134.7,224.5的复合物溶液,样品量为2ml。
(2)预热粒度分析仪,向微量样品池中加入1ml复合物溶液,然后放入测试槽中。根据实验要求设置参数,检测659nm处的波长。
(3)记录。
2.3复合物zetapotential测定
(1)按照上述方法配制质量比依次为4.49,44.9,67.36,89.8,134.7,224.5的复合物溶液,样品量为2ml。
(2)预热粒度分析仪,向微量样品池中加入1ml复合物溶液,然后放入测试槽中。根据实验要求设置参数,检测。
(3)记录。
2.4复合物的透射电镜观察
(1)根据上述结果,选择质量比为89.8:1的复合物溶液为检测样本。
(2)吸取样本滴于铜网上晾干,观察并记录。
当pdasp转染细胞时,pdasp和mir-146a,cy3oligo稀释溶液使用无酚红的dmem;测表征时:使用去离子水;转染大鼠时,使用灭菌的去离子水。
3cck-8法检测纳米粒子对rsc96细胞的毒性
cck-8试剂中含有wst-8〔2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2h-四唑单钠盐〕,细胞线粒体中的脱氢酶可将电子载体1-methoxypms(1-甲氧基-5-甲基吩嗪硫酸二甲酯)还原成高度水溶性的formazan(黄色甲臌产物)。活细胞数和formazan数量成正比。使用酶标仪检测450nm波长处的吸光度值,来间接反映活细胞数量。
4检测pdasp的转染效率
4.1转染荧光sirnaoligocy3检测转染效率
取对数生长期,状态良好的正常组细胞铺板,pdasp转染cy3,根据复合物表征的相关数据,我们最后选择89.8:1,134.7:1,224.5:1三个质量比梯度;cy3的量恒定为2000ng,约62.5pm。(cy3是rnaduplex1od=2.5nm=40μg),转染4小时后换液漂洗,继续避光处理48小时,后可至confocal下观察。4.2real-timepcr检测mir-146a的表达
取对数生长期,状态良好的正常组细胞,pdasp转染mir-146a:按照上述pdasp-cy3复合物的制备方法配制复合物,根据复合物表征的相关数据,我们最后选择89.8:1,134.7:1两个质量比梯度;cy3的量恒定为2000ng,约66.6pm。转染4小时后换液漂洗,继续避光处理48小时提取细胞rna,逆转录和进行pcr操作。
5dpn模型的建立以及分组
5.1实验动物
实验动物选用6周龄(130-150g)的wistar大鼠,雄性,共120只。购自上海斯莱克实验动物有限责任公司。动物的使用遵照上海市动物管理委员会条例。安静环境下单笼饲养、温度为20±2℃、相对湿度保持为60%,光照时间每日12小时,清洁饮水,造模前给予普通饲料并适应性饲养一周。
5.2dpn动物模型的建立
正常组食用清洁级普通饲料。实验组食用清洁级高糖高脂饲料。高糖高脂饲料喂养大鼠6周后,造模组禁食12-16小时(不禁水),予以腹腔注射stz27.5mg/kg。造模72h后检测大鼠空腹血糖(测试前禁食12h,不禁水),当空腹血糖>16.7mmol/l,认为造模成功,纳入实验组;造模不成功者从实验组中剔除。造模成功后继续高脂高糖饲料喂养6周,即建立dpn模型(测定神经传导速度)。
5.3实验动物分组和给药
(1)将120只大鼠随机分成三组,正常组,每组12只;t2dm组,每组12只,造模组共96只。造模组按照上述方法进行2型糖尿病造模,造模成功后,有18只因血糖过高死亡,有24只未达到实验标准,从造模组中去除。最后获得造模成功的大鼠共54只。最后将54只大鼠随机分为4组(n=12):dpn组,dpn+nano组,dpn+mir-146a组,dpn+vitb12组。注射药物过程中dpn+nano组,dpn+mir-146a组各死亡2只,t2dm组死亡2只。
(2)分别在stz造模前和取材前测定大鼠ncv。正常组一直予以正常饲料喂养。t2dm组大鼠先予以正常饲料喂养,取材前最后6周给予高糖高脂饲料喂养,并予以stz造模,造模成功的纳入实验。所有dpn组大鼠,造模成功的第2周到第5周予以相应干预,治疗期间予以高糖高脂饲料喂养,治疗结束后,继续高糖高脂饲料喂养1周。实验中保证各组大鼠在测定ncv及取材时,月龄处于相同水平。
(3)正常组于造模时予以注射同等剂量的柠檬酸-柠檬酸钠缓冲液(stz溶剂);dpn组注射同等剂量的无菌去离子水(纳米粒子和mir-146a的溶剂);dpn+nano组(每只老鼠最终注射量为0.95mgpdasp,其中pdasp的聚合度n=40~80);dpn+mir-146a组(每只老鼠最终注射量为0.95mgpdasp,mir-146amimics1nmol;即质量比为89.8:1;其中pdasp的聚合度n=40~80);dpn+vitb12组(550μg/kg);四周内分8次注射,每周注射两次。
5.4血糖测定
分别于腹腔注射stz72小时后和取材标本前,静脉采血,采用美国abbott公司freestyle血糖仪及试纸条测定大鼠空腹血糖。
6标本采集
6.1电镜标本
腹腔注射10%水合氯醛麻醉大鼠,分离双侧坐骨神经,取样1*1*3-4mm,两端用刀平切,勿剪;神经纵向分成4部分,浸泡在戊二醛中,保存于0-4℃冰箱,勿使戊二醛结冰。
6.2形态学标本
4%多聚甲醛心脏灌注,取左侧梨状肌下缘坐骨神经剥,用4%多聚甲醛(4℃)固定24-48h,后放入20%蔗糖多聚甲醛溶液进行后固定24h,可见组织块沉底,再置于30%蔗糖0.1mol/lpbs溶液中脱水24h,组织块沉底后取出作冰冻或石蜡切片,片厚30μm。
6.3分子实验标本
剥离神经,放液氮中冷冻,标本收集完成后,移入到-80℃冰箱长期保存,实验时,于室温解冻。7实验方法
7.1ncv测定
麻醉大鼠后,感觉神经传导速度:刺激踝部,于坐骨窝记录,采用方波(5-10ma,40μs脉波宽)刺激神经。运动神经传导速度:坐骨窝为第一刺激部位,踝部为第二刺激部位。电极间距2mm,接地于尾部。
7.2坚牢蓝染色
切片脱蜡,lfb(坚牢蓝)60度2-5h瓶密封(新配时),95%酒精(冲洗,洗净),然后0.05%碳酸锂溶液5秒。70%酒精2次。蒸馏水洗(流水冲洗干净),显微镜下观察。
7.3电镜方法
取样1*1*3-4mm,用2.5%戊二醛固定,1%锇酸固定液固定2-3小时,0.1mpbs漂洗15分三次,50%乙醇脱水15-20分,70%乙醇脱水15-20分,90%乙醇脱水15-20分,90%乙醇+90%丙醇(1:1)处理15-20分,90%丙醇处理15-20分以上,4℃冰箱内进行,100%丙醇室温下处理15-20分三次,纯丙醇+包埋液(2:1)室温下处理3-4小时,纯丙醇+包埋液(1:2)室温过夜,纯包埋液37℃下处理2-3小时,切片,透射电镜观察。
7.4westernblot测定神经组织cox-2,tnf-α,caspase-3,cleavedcaspase-3蛋白的表达
蛋白提取,常规步骤先后加入一抗及二抗,转膜,显色测定。
8统计分析
所有实验数据以
三、实验结果
1pdasp-mirna复合物表征及比例选择
图2a显示了不同浓度的pdasp-mirna复合物在琼脂糖凝胶电泳时,纳米粒子和microrna的结合情况,当pdasp-mirna复合物的比例大于67.35:1时,纳米粒子可以将mirna完全包裹。如图2b所示:不同pdasp-mirna复合物的粒子直径的大小,当比例大于67.35:1时,复合物的粒径可以稳定在200nm-400nm之间;如图2c所示:不同pdasp-mirna复合物的zetapotential,当复合物比例大于44.9:1时,zetapotential的值稳定在20-35mv之间。如图2d和图2e所示:89.8:1的复合物,予以原子力显微观察复合物形态均匀、规则,成类球形,致密均匀的颗粒,粒径大小:200-350nm,与粒径结果基本保持一致。
2纳米粒子对rsc96细胞毒性的影响
我们设置了不同的pdasp浓度梯度来检测其对雪旺细胞增殖抑制的影响,实验中增设了pei,pei是常用的纳米粒子转染试剂,作为阳性对照。normal组加入等量的无酚红dmem,结果(图3)显示,pdasp对雪旺细胞的增殖存在抑制作用,当pdasp的浓度大于22.45ng/μl,对细胞增殖能力出现显著的抑制效应(p<0.05)。和pei相比,在44.9ng/l时,pei对细胞的毒性逐渐大于pdasp(p<0.01)。提示pei毒性大于pdasp。
3pdasp的体外细胞转染效率
结合复合物的表征结果,我们选择89.8:1的复合物比例,予以体外转染雪旺细胞rsc96,结果见图4,可见pdasp的转染效率>95%。使用pcr检测不同质量比的pdasp-mirna复合物转染后,mir-146a的表达水平。上述实验结果说明,pdasp的体外转染效率达到实验要求(p<0.01)。
4mir-146a纳米粒子对糖尿病周围神经病变模型大鼠在治疗前后血糖的影响
结果显示,治疗前dpn各组空腹血糖水平均较正常组显著升高具有统计学差异(p<0.05);而dpn组、dpn+nano组、dpn+mir-146a组和dpn+vitb12组之间无显著差异(p>0.05)。治疗后,dpn组、dpn+nano组和dpn+mir-146a组及dpn+vitb12组血糖均较治疗前降低,同时治疗后dpn各组间无明显统计学差异(p>0.05)。
表1mir-146a对糖尿病周围神经病变模型大鼠在治疗前后血糖的影响
5mir-146a纳米粒子对大鼠坐骨神经传导速度的影响
结果(图5)显示,在mir-146a治疗前各组间ncv数值无统计学差异(p>0.05);随着时间延长,正常组神经传导速度无明显改变(p>0.05);与正常组相比,dpn组ncv下降(p<0.05)。治疗后,dpn+mir-146a组的感觉及运动神经传导速度明显高于dpn组及dpn+nano组(p<0.05)。进一步分析结果发现dpn+mir-146a组的运动神经传导速度(mncv)改善程度较dpn+vitb12组高,并有统计学差异(p<0.05);而dpn+mir-146a组的感觉神经传导速度改善和dpn+vitb12组相近。
6mir-146a纳米粒子对坐骨神经的形态学影响
6.1劳可-坚牢蓝染色
结果(图6)显示:正常组大鼠的坐骨神经纤维排列整齐、规则;其外有髓鞘、雪旺细胞及基底膜,神经内膜连续性良好。黑色点状为神经纤维,浅色点状为轴突,外周围深蓝色环状包裹为髓鞘,最外层为神经束膜。dpn组和dpn+nano组横断面上可见神经纤维数量较正常组明显减少,排列紊乱、稀疏,髓鞘肿胀,呈空泡状,轴突萎缩、部分消失。dpn+mir-146a组介于正常和dpn组和dpn+nano组之间。
6.2透射电镜
电镜下观察,结果(图7)显示:正常组大鼠坐骨神经有髓神经纤维的横断面上,可见髓鞘结构完整而规则、呈致密均匀的同心圆板层状结构,轴突无萎缩及肿胀。神经纤维外周可见形态规则的雪旺细胞,其内部线粒体无空泡形成。dpn组可见有髓神经纤维结构肿胀松散,髓鞘板层厚薄不均,排列紊乱,部分可见板层断裂、分离、呈严重的脱髓鞘现象;轴突内微丝微管排列紊乱,萎缩明显,线粒体多呈空泡状表现。神经纤维外侧雪旺细胞明显减少。dpn+mir-146a和dpn+vitb12组介于二者之间,dpn+mir-146a组形态学表现优于dpn+vitb12组。
7mir-146a纳米粒子对大鼠坐骨神经cox-2,tnf-α,caspase-3,cleavedcaspase-3蛋白表达的影响
western-blot结果(图8)显示:与dpn组和dpn+nano组相比,dpn+mir-146a组cox-2,tnf-α,caspase-3,cleavedcaspase-3的表达水平明显减低(p<0.05)。说明mir-146a对大鼠糖尿病周围神经病变的炎症反应及凋亡具有抑制作用。
本发明还检测了pdasp的聚合度为40~80时,pdasp与mir-146a的质量比为67.36、134.7、224.5、292.1时的dpn大鼠坐骨神经传导速度。与质量比为89.8相比,质量比为89.8制备的纳米粒子对坐骨神经传导速度的改善作用显著优于其他质量比,差异具有统计学意义(p<0.05),而质量比为134.7和224.5制备的纳米粒子对坐骨神经传导速度的改善作用显著优于质量比为67.36和292.1,差异也具有统计学意义(p<0.05)。表明pdasp的聚合度为40~80,pdasp与mir-146a的质量比为89.8~224.5条件下制备的纳米粒子具有重要的临床应用前景。
sequencelisting
<110>复旦大学附属金山医院
<120>一种mir-146a纳米粒子及其在制备治疗糖尿病周围神经病变的药物中的应用
<130>/
<160>1
<170>patentinversion3.3
<210>1
<211>22
<212>rna
<213>人工序列
<400>1
ugagaacugaauuccauggguu22
- 还没有人留言评论。精彩留言会获得点赞!