包含格拉默或其药用盐的储药系统的制作方法
本申请是申请日为2010年08月19日,申请号为201080060632.7,发明名称为“包含格拉默或其药用盐的储药系统”的申请的分案申请。
本发明涉及醋酸格拉默(glatirameracetate)和格拉默(glatiramer)的其它药用盐的长效剂型。特别优选的是用于醋酸格拉默的延长释放的储药系统(depotsystem)和其它可植入系统。
背景技术:
醋酸格拉默
共聚物-1,还称作醋酸格拉默并以商标
(glu,ala,lys,tyr)xch3cooh(c5h9no4_c3h7no2_c6h14n2o2_c9h11no3)xc2h4o2[cas-147245-92-9],大约比率为glu14ala43tyr10lyz34x(ch3cooh)20。
作用机制
醋酸格拉默是无规聚合物(平均分子质量为6.4kd),包括4种在髓磷脂碱性蛋白中发现的氨基酸。醋酸格拉默的作用机制是未知的,虽然已出现这种共聚物的一些重要的免疫学特性。给予共聚物-1会使t细胞群体从促炎th1细胞移动到调节th2细胞,其抑制炎性反应(fda
共聚物-1是非自身抗原,已证明其可以抑制由各种致脑炎因子(包括小鼠脊髓匀浆(msch))诱导的实验性变应性脑脊髓炎(eae),其包括髓磷脂抗原,如髓磷脂碱性蛋白(mbp)(selametal.,bullinstpasteur(1990)88303-314)、蛋白脂质蛋白(plp)(teitelbaumdetal.,jneuroimmunol(1996)64209-217)和在各种物种中的髓磷脂少突胶质细胞糖蛋白(mog)(ben-nunaetal.,jneurol(1996)243(suppl1)s14-s22)。eae是多发性硬化症的接受模型。
已证明,当皮下、腹腔内、静脉内或肌内注射时,共聚物-1是活性的(teitelbaumdetal.,eurjimmunol(1971)1242-248;teitelbaumdetal.,eurjimmunol(1973)3273-279)。在iii期临床试验中,发现,每日皮下注射共聚物-1会放慢无能的进展并降低加剧-缓解多发性硬化症的复发率(johnsonkp,neurology(1995)165-70;www.copaxone.com)。共聚物-1治疗目前限于每日皮下给予。在us6,214,791中披露了通过摄入或吸入共聚物-1来进行治疗,但还未表明这些给予途径在人患者中可以获得临床疗效。
疗效
在患有复发-缓解多发性硬化症(rrms)的患者中支持醋酸格拉默在降低复发频率方面的有效性的证据来自两项安慰剂对照试验,其均使用20mg/天的醋酸格拉默剂量。在rrms的安慰剂对照试验中没有研究其它剂量或剂量方案(www.copaxone.com)。认可的20mg剂量和40mg剂量的比较试验表明,在这些剂量之间疗效没有显着性差异(the9006trial;cohenjaetal.,neurology(2007)68939-944)。醋酸格拉默的各种临床试验正在进行中。这些临床试验包括用较高剂量的醋酸格拉默进行的研究(40mg–forte研究);对临床孤立性综合征患者进行的研究(precise研究);以及许多组合和诱导方案,其中和另一种活性产物一起或在其以后给予醋酸格拉默。
副作用
目前,多发性硬化症的所有特别认可的治疗涉及活性物质的自我注射。经常观察到的注射部位问题包括刺激、超敏感性、炎症、疼痛和甚至坏死(在干扰素1β治疗的情况下)以及低水平的患者依从性。
副作用通常包括在注射部位的团块(注射部位反应)、疼痛、发热、和寒战。这些副作用的特性通常是温和的。偶尔在注射以后数分钟发生反应,其中存在潮红、呼吸短促、焦虑和快速心搏。这些副作用在30分钟内减退。随着时间的推移,可以在注射部位发展可见凹痕,这是由于脂肪组织的局部破坏,称作皮下脂肪萎缩。因而,期望一种可替换的给予方法。
按照fda的处方标注,已报道了醋酸格拉默的更严重的副作用,它们包括对身体的心血管系统、消化系统(包括肝脏)、造血及淋巴系统、肌肉骨骼系统、神经系统、呼吸系统、特殊感官(尤其是眼)、泌尿生殖系统的严重的副作用;还报道了代谢和营养障碍;然而,还没有明确建立在醋酸格拉默和这些不利影响之间的联系(fda
储药系统(depotsystem)
通过静脉内(iv)、肌内(im)、或皮下(sc)注射的胃肠道外途径是递送较小和较大分子量药物的最常见和最有效的形式。然而,起因于针扎的疼痛、不适和不方便使得这种药物递送方式成为患者最少优选的。因而,可以在最低限度减少注射总数的任何药物递送技术是优选的。在实践中,可以通过使用可注射的储药制剂来减小给予药物的频率,上述储药制剂能够以缓慢但可预见的方式来释放药物,因而可以改善依从性。对于大多数药物,取决于剂量,可以减小注射频率:从每日一次到每月一次或两次或甚至更长时间(6个月)。除改善患者舒适度以外,通过消除高峰和低谷,储药制剂的药性的较小频繁注射可以缓和血浆浓度-时间曲线。血浆分布的上述缓和有可能在大多数情况下不仅提高治疗效果,而且可以减少任何不需要的事件,如免疫原性等(经常伴随较大分子量药物)。
微颗粒、植入物和凝胶是在实践中使用的可生物降解聚合物装置的最常见形式,用于延长药物在体内的释放。在注射以前立刻将微颗粒悬浮在水介质中,并且可以在悬浮液中加载多达40%固体。借助于处于干燥状态的特殊针而不需要水介质,来将植入物/棒剂型递送到sc/im组织。棒/植入物的这种特点便于递送较高质量的剂型以及药物含量。另外,在棒/植入物中,最初爆发的问题被最小化,这是由于和微颗粒相比,植入物的小得多的面积。除可生物降解系统之外,还有不可生物降解植入物和可以佩戴在体外的输注泵。不可生物降解植入物需要医生的访问:不仅为了将装置植入sc/im组织,而且为了在药物释放期以后除去它们。
包含微颗粒制剂的可注射组合物特别容易出现问题。和在其它类型的可注射悬浮液中的0.5-5%固体相比,微颗粒悬浮液可以包含多达40%的固体。另外,和建议用于im或sc给予的小于5μm的颗粒尺寸相比,在可注射储药产品中所使用的微颗粒的尺寸高达约250μm(平均60-100μm)。更高浓度的固体、以及更大的固体颗粒尺寸需要更大尺寸的针(约18-21号规格)来注射。总之,尽管很少使用较大的和不舒服的针,但和用较小针每天药物注射相比,患者还是喜欢不经常给予剂型。
聚乳酸(pla)的可生物降解聚酯以及丙交酯和乙交酯的共聚物,称作聚(丙交酯-乙交酯)(plga),是用于可生物降解剂型的最常见的聚合物。pla是疏水性分子并且plga比pla更快地降解,这是因为更具亲水性的乙交酯基团的存在。这些生物相容性聚合物经受酯键的随机的非酶促的水解切割以形成乳酸和乙醇酸,其是体内的正常代谢化合物。可吸收缝线、小夹和植入物是这些聚合物的最早应用。在1970年,南方研究所(southernresearchinstitute)开发了第一种合成的可吸收缝线
今天,plga聚合物可商业上获自多个供应商:alkermes(medisorb聚合物)、absorbablepolymersinternational[先前的birminghampolymers(durect的一个部门)]、purac和boehringeringelheim。除plga和pla之外,天然纤维素聚合物如淀粉、淀粉衍生物、葡聚糖和非plga合成聚合物,也被开发为在上述系统中的可生物降解聚合物。
目前,不能获得醋酸格拉默的长效剂型。这是巨大的未满足的医疗需求,因为这些剂型将极为有利于许多患者,尤其是有利于具有神经系统症状或身体残疾的那些患者。
技术实现要素:
本发明提供了长效胃肠道外药物组合物,该组合物包含治疗有效量的格拉默的药用盐,例如,醋酸格拉默。尤其是,本发明提供了长效药物组合物,该组合物包含治疗有效量的储药形式(depotform)的格拉默盐,适用于在医疗上可接受的位置胃肠道外给予对其需要的主体。本发明进一步提供了一种用于治疗多发性硬化症的方法,该方法包括胃肠道外给予或植入组合物,该组合物包含治疗有效量的格拉默的药用盐,优选醋酸格拉默。
出乎预料地,现已发现,根据本发明的原则的长效药物组合物相对于市售每日注射剂型可以提供相同或更好的疗效,并在局部和/或全身水平具有降低的副作用的发生率和/或严重性。
根据一些实施方式,醋酸格拉默包含l-丙氨酸、l-谷氨酸、l-赖氨酸、和l-酪氨酸的醋酸盐,摩尔比率为约0.14谷氨酸、约0.43丙氨酸、约0.10酪氨酸和约0.33赖氨酸。
根据其它实施方式,醋酸格拉默或格拉默的其他药用盐包含约15至约100个氨基酸。
根据某些实施方式,可植入储药适合于皮下或肌内植入。
根据可替换的实施方式,长效胃肠道外药物组合物包含用于格拉默盐如醋酸格拉默的药用可生物降解或不可生物降解载体。
根据一些实施方式,载体选自plga、pla、pga、聚己内酯、聚羟基丁酸酯、聚原酸酯、聚链烷酸酐、明胶、胶原、氧化纤维素、和聚磷腈。每个可能性表示本发明的单独的实施方式。
根据具体实施方式,本发明的长效药物组合物具有通过水包油包水双重乳化工艺(water-inoil-inwaterdoubleemulsificationprocess)制备的微颗粒的形式。在目前优选的实施方式中,本发明的长效药物组合物包括:内部水相,其包含治疗有效量的格拉默的药用盐;水不混溶的聚合物相,其包含选自可生物降解和不可生物降解聚合物的载体;以及外部水相。在其它目前优选的实施方式中,水不混溶的聚合物相包含选自pla和plga的可生物降解聚合物。每个可能性表示本发明的单独的实施方式。在另外的实施方式中,外部水相包含表面活性剂,其选自聚乙烯醇(pva)、聚山梨酯、聚氧化乙烯-聚氧化丙烯嵌段共聚物和纤维素酯。每个可能性表示本发明的单独的实施方式。
本发明涵盖适用于植入对其需要的个体的储药形式的醋酸格拉默或格拉默的任何其它药用盐用于治疗多发性硬化症的用途。
本发明进一步涵盖使用醋酸格拉默的可植入储药,其适用于提供格拉默在主体中的延长释放或延长作用。
在本发明范围内的是储药形式的格拉默的药用盐,其适合用于治疗多发性硬化症或提供格拉默在主体中的延长释放或延长作用。
本发明还包括醋酸格拉默与至少一种另外药物,优选地,免疫抑制剂,尤其是芬戈莫德(fingolimod)的组合。
根据一些实施方式,长效药物组合物适用于每周一次到每6个月一次的给药时间表。
根据特定的实施方式,组合物适合于从每2周一次到每月一次的给药。
根据一些实施方式,长效组合物包括20-750mg醋酸格拉默/注射的剂量。
长效组合物的具体实例将包括可生物降解或不可生物降解微球体、任何适宜几何形状的植入物、可植入棒、可植入胶囊、可植入环、延长释放凝胶和易侵蚀基质。每个可能性表示本发明的单独的实施方式。
本申请还涉及以下内容:
1)一种长效胃肠道外药物组合物,包含治疗有效量的格拉默的药用盐。
2)一种长效药物组合物,包括治疗有效量的储药形式的格拉默的药用盐,所述储药形式适合于在医疗上可接受的位置植入对其需要的主体。
3)根据1)或2)所述的药物组合物,其中,所述格拉默的药用盐是醋酸格拉默。
4)根据1)或2)所述的药物组合物,适合于皮下或肌内植入。
5)根据1)或2)所述的药物组合物,其中,所述格拉默包含l-丙氨酸、l-谷氨酸、l-赖氨酸、和l-酪氨酸,摩尔比率为约0.14谷氨酸、约0.43丙氨酸、约0.10酪氨酸和约0.33赖氨酸。
6)根据1)或2)所述的药物组合物,其中,所述格拉默包含约15至约100个氨基酸。
7)根据1)或2)所述的药物组合物,其中,所述格拉默的药用盐的剂量为约20至约750mg范围。
8)根据1)或2)所述的药物组合物,进一步包含药用可生物降解或不可生物降解载体。
9)根据8)所述的药物组合物,其中,所述载体选自plga、pla、pga、聚己内酯、聚羟基丁酸酯、聚原酸酯、聚链烷酸酐、明胶、胶原、氧化纤维素、和聚磷腈。
10)根据1)或2)所述的药物组合物,具有通过水包油包水双重乳化工艺制备的微颗粒的形式。
11)根据1)或2)所述的药物组合物,包含:内部水相,所述内部水相包含治疗有效量的格拉默的药用盐;水不混溶的聚合物相,所述水不混溶的聚合物相包含可生物降解或不可生物降解聚合物;以及外部水相。
12)根据11)所述的药物组合物,其中,所述水不混溶的聚合物相包含选自pla和plga的可生物降解聚合物。
13)根据11)所述的药物组合物,其中,所述外部水相包含表面活性剂,所述表面活性剂选自聚乙烯醇(pva)、聚山梨酯、聚氧化乙烯-聚氧化丙烯嵌段共聚物和纤维素酯。
14)根据1)或2)所述的药物组合物,适合于每周一次至每6个月一次的给药时间表。
15)根据14)所述的药物组合物,适合于每2周一次至每月一次的给药时间表。
16)根据1)或2)所述的药物组合物,具有以下形式:可生物降解微球体、不可生物降解微球体、任何适宜几何形状的植入物、可植入棒、可植入胶囊、可植入环、或延长释放凝胶或易侵蚀基质。
17)根据1)或2)所述的药物组合物,其中,相对于醋酸格拉默的市售每日注射剂型,所述组合物提供相同或更好的疗效,在局部和/或全身水平,副作用的发生率降低和/或副作用的严重性降低。
18)根据17)所述的药物组合物,其中,与大致相同剂量的醋酸格拉默的立即释放剂型相比,所述组合物提供格拉默在主体中的延长释放或延长作用。
19)一种用于治疗多发性硬化症的方法,其中,通过胃肠道外给予根据1)所述的长效药物组合物。
20)一种用于治疗多发性硬化症的方法,包括以下步骤:将根据2)所述的长效药物组合物植入对其需要的主体。
21)根据19)或20)所述的方法,包括以下步骤:皮下给予或肌内植入所述药物组合物。
22)根据19)或20)所述的方法,其中,所述药物组合物包含醋酸格拉默。
23)根据22)所述的方法,其中,所述醋酸格拉默包含l-丙氨酸、l-谷氨酸、l-赖氨酸、和l-酪氨酸,摩尔比率为约0.14谷氨酸、约0.43丙氨酸、约0.10酪氨酸和约0.33赖氨酸。
24)根据23)所述的方法,其中,所述格拉默包含约15至约100个氨基酸。
25)根据19)或20)所述的方法,其中,所述药物组合物包含剂量范围为约20至约750mg的格拉默的药用盐。
26)根据19)或20)所述的方法,其中,所述药物组合物进一步包含药用可生物降解或不可生物降解载体。
27)根据26)所述的方法,其中,所述载体选自由plga、pla、pga、聚己内酯、聚羟基丁酸酯、聚原酸酯、聚链烷酸酐、明胶、胶原、氧化纤维素、和聚磷腈组成的组。
28)根据19)或20)所述的方法,其中,所述药物组合物具有通过水包油包水双重乳化工艺制备的微颗粒的形式。
29)根据19)或20)所述的方法,其中,所述药物组合物包含:内部水相,所述内部水相包含治疗有效量的格拉默的药用盐;水不混溶的聚合物相,所述水不混溶的聚合物相包含可生物降解或不可生物降解聚合物;以及外部水相。
30)根据29)所述的方法,其中,所述水不混溶的聚合物相包含选自pla和plga的可生物降解聚合物。
31)根据29)所述的方法,其中,所述外部水相包含表面活性剂,所述表面活性剂选自聚乙烯醇(pva)、聚山梨酯、聚氧化乙烯-聚氧化丙烯嵌段共聚物和纤维素酯。
32)根据19)或20)所述的方法,其中,以每周一次至每6个月一次的给药时间表进行所述给予或所述植入步骤。
33)根据32)所述的方法,其中,所述给药时间表是每2周一次至每月一次。
34)根据19)或20)所述的方法,其中,所述药物组合物具有以下形式:可生物降解微球体、不可生物降解微球体、任何适宜几何形状的植入物、可植入棒、可植入胶囊、或可植入环、延长释放凝胶或易侵蚀基质。
35)根据19)或20)所述的方法,其中,相对于市售每日注射剂型,所述药物组合物提供相同或更好的疗效,在局部和/或全身水平副作用的发生率降低和副作用的严重性降低。
36)根据35)所述的方法,其中,与大致相同剂量的醋酸格拉默的立即释放剂型相比,所述药物组合物提供格拉默在主体中的延长释放或延长作用。
37)适用于植入对其需要的个体的储药形式的格拉默的药用盐用于治疗多发性硬化症的应用。
38)根据37)所述的可植入储药的应用,用于提供格拉默在主体中的延长释放或延长作用。
39)根据37)至38)中任一项所述的应用,其中,所述格拉默的药用盐是醋酸格拉默。
40)一种储药形式的格拉默的药用盐,适合用于治疗多发性硬化症。
41)一种储药形式的格拉默的药用盐,适合用于提供格拉默在主体中的延长释放或延长作用。
根据下文给出的详细描述,本发明的另外的实施方式和应用的全部范围将是显而易见的。然而,应当明了,详细描述和具体实施例,虽然指出本发明的优选实施方式,仅是说明性的,因为对于本领域技术人员来说,根据这种详细描述,在本发明的精神和范围内的各种变化和改进将是显而易见的。
附图说明
图1.在pbs中并在37℃下,醋酸格拉默自plga微颗粒制剂mpg-02-07的释放。表示的数据被归一化到存储在相同条件下的标准肽溶液。
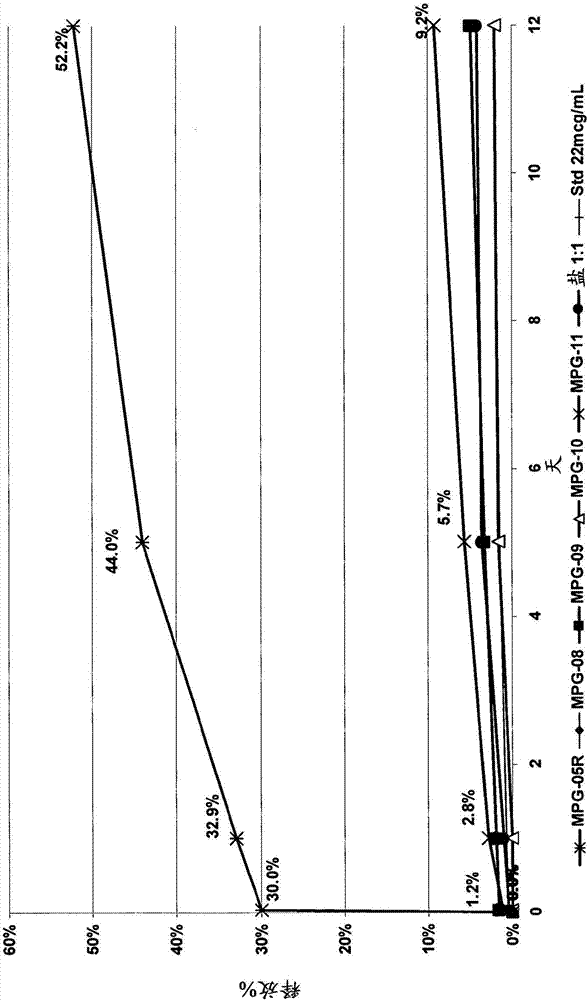
图2.在pbs中并在37℃下,醋酸格拉默自plga微颗粒制剂mpg-05r、08-11和格拉默的生育酚琥珀酸盐(1:1)的释放。表示的数据被归一化到存储在相同条件下的标准肽溶液。
图3.在pbs中并在37℃下,醋酸格拉默自plga微颗粒制剂mpg-12–15的释放。表示的数据被归一化到存储在相同条件下的标准肽溶液。
图4.在体外在pbs中并在37℃、ph7.4下,醋酸格拉默自plga微颗粒制剂mpg-14su-1和mpg-15su-1的释放。
图5.在体外在pbs中并在37℃、ph7.4下,醋酸格拉默自plga微颗粒制剂mpg-14su-2和mpg-15su-2的释放。
具体实施方式
本发明提供了格拉默的药用盐(优选醋酸格拉默)的长效胃肠道外药物制剂,相比于每天注射,其可以提供相同或更好的疗效,因而导致改善的患者依从性。除提供相同疗效以外,长效注射剂或植入物还可以降低起源于频繁注射的格拉默副作用(局部和/或全身)。
根据第一方面,本发明提供了长效胃肠道外药物组合物,该组合物包含治疗有效量的醋酸格拉默或格拉默的任何其它药用盐。如在本文中所使用的,术语“胃肠道外”是指途径,其选自皮下(sc)、静脉内(iv)、肌内(im)、皮内(id)、腹腔内(ip)等途径。每个可能性表示本发明的单独的实施方式。如在本文中所使用的,术语"治疗有效量"用来限定共聚物的量,其将实现缓和多发性硬化症的症状的目标。适宜剂量包括但不限于每剂型20-750mg。然而,应当明了,给予的共聚物的量将由医生根据各种参数来确定,包括所选的给予途径、年龄、体重、和患者症状的严重性。根据本发明的各种实施方式,至少一种共聚物的治疗有效量为约1mg至约500mg/天。可替换地,至少一种共聚物的上述治疗有效量为约20mg至约100mg/天。
在另一个方面,本发明提供了长效药物组合物,该组合物包含治疗有效量的储药形式的醋酸格拉默或格拉默的任何其它药用盐,其适用于在医疗上可接受的位置给予对其需要的主体。如在本文中所使用的,术语“长效”是指一种组合物提供格拉默盐到主体的一般全身循环或到主体的局部作用部位的长期、持续或延长释放。此术语可以进一步指一种组合物提供格拉默盐在主体中的长期、持续或延长的作用持续时间(药代动力学)。尤其是,本发明的长效药物组合物提供了每周一次到每6个月一次的给药方案。根据目前更优选的实施方式,给药方案是一周一次、每月两次(大约每两周一次)到每月一次。取决于所需要的作用的持续时间,本发明的各储药或可植入装置将通常包含约20至750mg的活性组分,设计成经两周至数月时间范围加以释放。
在一些实施方式中,本发明的储药制剂包括但不限于:格拉默或其药用盐在水、油或蜡相中的悬浮体;格拉默或其药用盐的不易溶解的聚合物电解质复合物(polyelectrolytecomplexes);基于水混溶性溶剂与格拉默或其药用盐的组合的“原位”凝胶形成基质;以及结合有格拉默或其药用盐的可生物降解聚合物微颗粒。每个可能性表示本发明的单独的实施方式。尤其是,本发明的组合物具有可注射微颗粒的形式,其中格拉默或其药用盐被截留在可生物降解或不可生物降解载体中。本发明的微颗粒组合物可以包含水包油包水双重乳液。在本发明的范围内,微颗粒组合物包含:内部水相,其包含格拉默或其任何药用盐;油相或水不混溶相,其包含可生物降解或不可生物降解聚合物;以及外部水相。外部水相可以进一步包含表面活性剂,优选聚乙烯醇(pva)、聚山梨酯、聚氧化乙烯-聚氧化丙烯嵌段共聚物或纤维素酯。在本文中可以互换使用术语“油相”和“水不混溶相”。
本发明进一步提供了通过将长效药物组合物胃肠道外给予对其需要的主体治疗多发性硬化症的方法,该长效药物组合物包含治疗有效量的醋酸格拉默或格拉默的任何其它药用盐。本发明的范围内的是治疗多发性硬化症的方法,该方法将储药形式的醋酸格拉默或格拉默的任何其它药用盐给予对其需要的个体。如在本文中所使用的,术语“治疗”是指在多发性硬化症的发作以后症状的抑制或缓和。在多发性硬化症的发作以后的常见症状包括但不限于视力的降低或丧失、跌跌撞撞和不平衡的步态、言语不清、以及尿频和尿失禁。此外,多发性硬化症可以引起心境变化和抑郁、肌肉痉挛和严重瘫痪。药物所给予的"主体"是哺乳动物,优选但不限于人。如在本文中所使用的,术语“多发性硬化症”是指中枢神经系统的自身免疫病,其伴随上述一种或多种症状。
如在本文中所使用的,术语“醋酸格拉默”是指以前称为共聚物1的化合物,其以商标名称
在一些实施方式中,组合物可以包含格拉默的任何其它药用盐,包括但不限于硫酸盐、焦硫酸盐、硫酸氢盐、亚硫酸盐、亚硫酸氢盐、磷酸盐、磷酸一氢盐、磷酸二氢盐、偏磷酸盐、焦磷酸盐、盐酸盐、氢溴酸盐、氢碘化物、醋酸盐、硝酸盐、丙酸盐、癸酸盐、辛酸盐、丙烯酸盐、甲酸盐、异丁酸盐、癸酸盐、庚酸盐、丙炔酸盐、草酸盐、丙二酸盐、琥珀酸盐、生育酚琥珀酸盐、辛二酸盐、癸二酸盐、富马酸盐、马来酸盐、丁炔-1,4-二酸盐、己炔-1,6-二酸盐、苯甲酸盐、氯苯甲酸盐、甲基苯甲酸盐、二硝基苯甲酸盐、羟基苯甲酸盐、甲氧基苯甲酸盐、邻苯二甲酸盐、对苯二甲酸盐、磺酸盐、二甲苯磺酸盐、苯基醋酸盐、苯基丙酸盐、苯基丁酸盐、柠檬酸盐、乳酸盐、β-羟基丁酸盐、乙醇酸盐、酒石酸盐、甲磺酸盐、丙烷磺酸盐、萘-2-磺酸盐、对甲苯磺酸盐、扁桃酸盐以及类似盐。每个可能性表示本发明的单独的实施方式。
可以通过本领域技术人员可获得的任何程序来制备共聚物。例如,可以在缩合条件下利用在溶液中的所期望摩尔比率的氨基酸、或通过固相合成程序,来制备共聚物。缩合条件包括适当温度、ph、和溶剂条件,用于缩合一个氨基酸的羧基与另一个氨基酸的氨基以形成肽键。缩合剂,例如,二环己基碳二亚胺,可以用来促进肽键的形成。
保护基团可以用来保护官能团,如侧链部分和一些氨基或羧基避免不希望的副反应。在美国专利号3,849,550(其全部内容以引用方式结合于本文)中披露的方法可以用于制备本发明的共聚物。例如,在环境温度下在无水二氧杂环己烷中并用二乙胺作为引发剂,来聚合酪氨酸的n-羧基酸酐、丙氨酸、γ-苄基谷氨酸和n,ε-三氟乙酰基-赖氨酸。可以通过在冰醋酸中的溴化氢来解封谷氨酸的γ-羧基。通过1摩尔哌啶来从赖氨酸除去三氟乙酰基。本领域技术人员容易明了,该方法可以加以调节以制备包含所期望的氨基酸的肽和多肽,即,在共聚物1中四种氨基酸中的三种,其中通过选择性地消除涉及谷氨酸、丙氨酸、酪氨酸、或赖氨酸的任何一种的反应。美国专利号6,620,847、6,362,161、6,342,476、6,054,430、6,048,898和5,981,589(其全部内容以引用方式结合于本文)披露了用于制备醋酸格拉默(cop-1)的改进方法。对于本申请的目的来说,术语“环境温度”和“室温”通常是指约20℃至约26℃的温度。
可以在多肽合成期间或在已制备聚合物以后来调节共聚物的分子量。为了在多肽合成期间调节分子量,调节合成条件或氨基酸的量,使得当多肽达到近似所期望的长度时停止合成。在合成以后,可以通过任何可获得的尺寸选择程序来获得具有所期望的分子量的多肽,如用分子量分级柱(molecularweightsizingcolumn)或凝胶对多肽进行的层析法,以及所期望的分子量范围的收集。还可以部分地水解多肽以除去高分子量物质,例如,通过酸或酶水解,然后加以纯化以除去酸或酶。
在一种实施方式中,可以通过一种方法来制备具有所期望的分子量的共聚物,该方法包括反应受保护多肽和氢溴酸以形成具有所期望的分子量分布的三氟乙酰基-多肽。在由一种或多种测试反应预先确定的温度下进行反应一定时间。在测试反应期间,变化时间和温度,并确定给定批的测试多肽的分子量范围。为该批多肽提供最佳分子量范围的测试条件用于上述批。因此,可以通过一种方法来制备具有所期望的分子量分布的三氟乙酰基-多肽,该方法包括在由测试反应预先确定的温度下反应受保护多肽和氢溴酸一定时间。然后用哌啶水溶液进一步处理具有所期望的分子量分布的三氟乙酰基-多肽,以形成具有所期望的分子量的去保护多肽。
在一种优选实施方式中,在约20-28℃的温度下,使来自给定批的受保护多肽的测试样品和氢溴酸反应约10-50小时。通过运行若干测试反应来确定用于该批的最佳条件。例如,在一种实施方式中,在约26℃的温度下,使受保护多肽和氢溴酸反应约17小时。
在某些实施方式中,剂型包括但不限于可生物降解可注射储药系统(depotsystem)如,基于plga的可注射储药系统、基于非plga的可注射储药系统、和可注射可生物降解凝胶或分散体。每个可能性表示本发明的单独的实施方式。如在本文中所使用的,术语“可生物降解”是指这样的成分,其随着时间的推移在其表面会发生侵蚀或降解,这至少部分地起因于与存在于周围组织液中的物质的接触,或通过细胞作用。尤其是,可生物降解成分是聚合物如但不限于基于乳酸的聚合物如聚丙交酯例如聚(d,l-丙交酯)即pla;基于乙醇酸的聚合物如聚乙交酯(pga)例如来自durect的
在一些实施方式中,本发明的组合物包含可生物降解聚合物,其选自但不限于plga、pla、pga、聚己内酯、聚羟基丁酸酯、聚原酸酯、聚链烷酸酐、明胶、胶原、氧化纤维素、聚磷腈等。每个可能性表示单独的实施方式。
目前优选的可生物降解聚合物是基于乳酸的聚合物,更优选聚丙交酯、或聚(d,l-丙交酯-乙交酯)即plga。优选地,可生物降解聚合物的存在量为组合物的约10%至约98%w/w。基于乳酸的聚合物具有100:0至约0:100的乳酸与乙醇酸的单体配比,优选100:0至约10:90,并具有约1,000至200,000道尔顿的平均分子量。然而,应当明了,可生物降解聚合物的量是由参数如应用的持续时间等来确定。
本发明的组合物可以进一步包含一种或多种药用赋形剂,其选自但不限于辅助表面活性剂、溶剂/共溶剂、水不混溶性溶剂、水、水混溶性溶剂、油性成分、亲水性溶剂、乳化剂、防腐剂、抗氧化剂、防泡剂、稳定剂、缓冲剂、ph调节剂、渗透剂、通道形成剂、渗透调节剂、或本领域已知的任何其它赋形剂。适宜的辅助表面活性剂包括但不限于聚乙二醇、聚氧乙烯-聚氧丙烯嵌段共聚物(称作“泊洛沙姆”)、聚甘油脂肪酸酯如单月桂酸十甘油酯(decaglycerylmonolaurate)和单肉豆寇酸十甘油酯(decaglycerylmonomyristate)、山梨聚糖脂肪酸酯如脱水山梨醇单硬脂酸酯、聚氧乙烯山梨坦脂肪酸酯如聚氧乙烯脱水山梨醇单油酸酯(吐温)、聚乙二醇脂肪酸酯如聚氧乙烯单硬脂酸酯、聚氧乙烯烷基醚如聚氧乙烯月桂基醚、聚氧乙烯蓖麻油和硬化蓖麻油如聚氧乙烯硬化蓖麻油等或它们的混合物。每个可能性表示本发明的单独的实施方式。适宜溶剂/共溶剂包括但不限于醇、三乙酸甘油酯、二甲基异山梨醇、四氢呋喃聚乙二醇醚(glycofurol)、碳酸丙二酯、水、二甲基乙酰胺等或它们的混合物。每个可能性表示本发明的单独的实施方式。适宜的防泡剂包括但不限于硅酮乳液或倍半油酸山梨聚糖。用来在本发明的组合物中防止或减少成分的恶化的适宜的稳定剂包括但不限于抗氧化剂如甘氨酸、α-生育酚或抗坏血酸、bha、bht等或它们的混合物。每个可能性表示本发明的单独的实施方式。适宜的张力调节剂包括但不限于甘露醇、氯化钠、和葡萄糖。每个可能性表示本发明的单独的实施方式。适宜的缓冲剂包括但不限于醋酸盐、磷酸盐、和柠檬酸盐(具有适宜的阳离子)。每个可能性表示本发明的单独的实施方式。
可以通过本领域已知的任何方式来制备本发明的组合物。目前优选的是将格拉默或其盐共聚物加入胶体递送系统,例如,可生物降解微颗粒,从而便于借助于通过颗粒的聚合物壁的扩散和通过在体内的水介质或生物流体中的聚合物降解来实现释放迟缓。可以通过称作“双重乳化”的工艺并以可注射微颗粒的形式来制备本发明的组合物。简要地,将水溶性共聚物的浓缩溶液分散于可生物降解或不可生物降解聚合物在水不混溶性挥发性有机溶剂(例如二氯甲烷、氯仿等)中的溶液。然后将如此获得的“油包水”(w/o)乳液分散在包含表面活性剂(例如聚乙烯醇-pva、聚山梨酯、聚氧化乙烯-聚氧化丙烯嵌段共聚物、纤维素酯等)的连续外部水相中,以形成“水包油包水(w/o/w)双重乳液”小滴。在蒸发有机溶剂以后,固化微颗粒并通过过滤或离心加以收集。用纯化水洗涤收集的微颗粒(mp)以消除大多数表面活性剂和非结合肽,然后再次离心。在没有添加剂或添加冷冻保护剂(甘露醇)的条件下,收集和冷冻干燥经洗涤的mp,以促进它们随后的重建。
可以通过各种参数来确定“水包油包水(w/o/w)双重乳液”的颗粒尺寸,包括但不限于在此步骤中外加力的量、混合速度、表面活性剂类型和浓度等。适宜的颗粒尺寸为约1至100μm。
本发明的储药系统包括本领域技术人员已知的任何形式。适宜的形式包括但不限于可生物降解或不可生物降解微球体、可植入棒、可植入胶囊、和可植入环。每个可能性表示本发明的单独的实施方式。另外包括延长释放凝胶储药和易侵蚀基质。每个可能性表示本发明的单独的实施方式。适宜的可植入系统描述于例如us2008/0063687,其全部内容以引用方式结合于本文。如在本领域已知的,可以利用适宜的微型挤出机如那些例如在http://www.randcastle.com/prodinfo.html中描述的微型挤出机,来制备可植入棒。
根据本发明的原则,相对于市售每日注射剂型,本发明的长效药物组合物可以提供相同或更好的疗效,并在局部和/或全身水平下,具有降低的副作用的发生率和降低的副作用的严重性。在一些实施方式中,和大致相同剂量的醋酸格拉默的立即释放制剂相比,本发明的组合物可以提供格拉默在主体中的延长释放或延长作用。
本发明包括醋酸格拉默或格拉默的任何其它药用盐与至少一种其它活性剂的联合疗法。在本发明的范围内的活性剂包括但不限于干扰素,例如聚乙二醇化或非聚乙二醇化α-干扰素、或β-干扰素,例如干扰素β-1a或干扰素β-1b、或τ-干扰素;具有可选的抗增生/抗肿瘤活性的免疫抑制剂,例如米托蒽醌(mitoxantrone)、甲氨蝶呤、硫唑嘌呤(azathioprine)、环磷酰胺、或类固醇,例如甲泼尼龙、泼尼松或地塞米松,或类固醇分泌剂,例如acth;腺苷脱氨酶抑制剂,例如克拉屈滨(cladribine);相对于各种t细胞表面标记的iv免疫球蛋白g(例如如在neurology,1998,may50(5):1273-81中所披露的)单克隆抗体,例如那他珠单抗(natalizumab)
以下实施例用来更充分说明本发明的某些实施方式。然而,决不应将它们看作是限制本发明的范围。本领域技术人员可以容易地设计本文披露的原则的许多变化和改进而不偏离本发明的范围。
实施例
实施例1:一般制备方法
基于plga的可注射长效颗粒
通过溶剂萃取/蒸发方法(单乳液)来制备微颗粒。将包含250mg的plga和200mg醋酸格拉默的50:50的二氯甲烷/乙醇溶液慢慢倒入包含2%pva的水溶液(200ml)并在25℃下利用机械搅拌器(300rpm)加以乳化。在搅拌(100rpm)下蒸发有机溶剂2h。通过离心来收集如此形成的微颗粒并用蒸馏水洗涤以除去过多的乳化剂。然后冷冻干燥最终悬浮液以获得细粉。
基于聚己内酯的可注射储药(depot)颗粒
通过溶剂萃取/蒸发方法(单乳液)来制备微颗粒。将包含500mg聚己内酯和200mg醋酸格拉默的70:30的二氯甲烷/丙酮溶液慢慢倒入包含2%pva、1%吐温80的水溶液(200ml),然后在25℃下利用机械搅拌器(500rpm)加以乳化。在搅拌(300rpm)下蒸发有机溶剂4h。通过离心来收集形成的微颗粒并用蒸馏水洗涤,以除去过多的乳化剂。然后冷冻干燥最终悬浮液以获得细粉。
基于plga的植入棒
通过溶剂萃取/蒸发方法来制备长度为20mm和直径为2mm的基于plga的可生物降解棒状植入物。将包含250mg的plga和200mg醋酸格拉默的50:50的二氯甲烷/乙醇溶液慢慢倒入特制的棒状模具。在室温的真空烘箱中蒸发有机溶剂12小时。可替换地,通过在85-90℃下挤出250mg的plga和200mg格拉默的混合物来制备棒状植入物,其中利用模具直径为0.8或1.0mm的螺杆式挤出机(microtruderrancastlercp-0250或类似挤出机)。
实施例2:分析方法–醋酸格拉默的测定
设备
分光光度计
分析天平,能够精确地称量到0.01mg
材料和试剂
醋酸格拉默83%,作为参考标准
2,4,6-三硝基苯磺酸(tnbs,苦基磺酸(picrylsulfonicacid),170.5mm),5%在meoh中
0.1m硼酸盐缓冲液ph9.3(十水四硼酸钠mw381.37)
纯化水
0.5、1.0、2.0和7.0ml的容量吸移管
各种各样的玻璃器皿。
制备
格拉默储备溶液400μg/ml的制备
将4.8mg醋酸格拉默(效力83%,作为参考标准的基础)称量到10ml容量瓶。添加大约7ml的0.1m硼酸盐缓冲液以在超声波浴中溶解醋酸格拉默。用0.1m硼酸盐缓冲液进一步稀释溶液以获得格拉默储备溶液400μg/ml(作为基础)。
0.25%tnbs工作溶液的制备
在使用前,用水(20倍;例如50μl和950μl水)稀释tnbs的5%储备溶液,以获得0.25%tnbs工作溶液。
校准曲线标准制备
按照表1来制备8个格拉默校准标准溶液(cstd;各自4ml)。
表1.醋酸格拉默的标准溶液
光密度测量
将1.0ml的各种格拉默校准标准溶液、样品(两份)和试剂空白(0.1m硼酸盐缓冲液)转移到1.5ml聚丙烯离心管,其中添加50μl的0.25%tnbs工作溶液。充分混合溶液并将溶液保持在室温下30分钟。在420nm和700nm处读每种获得的溶液的光密度,并计算这些密度的差异,以避免起因于胶体系统的光散射的误差。计算了所选浓度范围的校准曲线。
接受标准
按照以下公式的计算,重复样品制备的结果之间的差异是nmt5%:
式中,rspl1是获自样品1的结果以及rspl2是获自样品2的结果。
实施例3:加载有醋酸格拉默的plga微颗粒的制备
外部(连续)水相:在纯化水中的30ml的0.75%nacl溶液,进一步包含0.5%部分地水解(87-89%)的聚乙烯醇(pva)作为表面活性剂,0.2%聚山梨酯-80(吐温-80)用于mpg-10以及2%pva用于空白mp制剂。
内部水相(用于肽溶液):150-200μl纯化水/25-30mg醋酸格拉默。利用超声波浴来将醋酸格拉默溶解于水。
有机聚合物溶液(油相):在2-5ml二氯甲烷中的165-300mg的plga。可选地,将反离子进一步溶解或分散于有机相。
制备程序
油包水(w/o)乳液制备:在试管中,直接混合包含溶解的醋酸格拉默的内部水相和包含在ch2cl2中的plga溶液的油相。充分摇动混合物并用超声波压头(钛尖端,最大功率为120瓦,工作功率为10-15%,3-5个循环,每个循环为5秒)加以处理。可选地,利用冰或冰水来进行冷却以避免二氯甲烷的沸腾。
双重乳液(w/o/w)制备:在各种速度下,用高剪切混合器(小型混合器,vdi-12,轴直径10mm,和较大混合器,omni-1100,轴直径18mm)进一步处理如此获得的在聚合物plga有机溶液中的醋酸格拉默溶液的w/o乳液30-120秒。
溶剂消除:将具有如此形成的双重乳液的敞口烧杯放置在磁板搅拌器上并在室温下在通风橱中搅拌3-4小时,直到蒸发所有二氯甲烷并且微颗粒已固化。
微颗粒的离心:在2000-5000g下离心固化微颗粒的悬浮液10分钟,将上清转移到分开的容器并分析醋酸格拉默含量,以估算肽掺入和结合。
微颗粒的洗涤:利用漩涡和超声波浴将按照上述程序的沉降的微颗粒悬浮在10ml纯化水中,然后摇晃或声处理2-3分钟。在2000-5000g下再次离心分离微颗粒的悬浮液10分钟,将上清转移到分开的容器并分析醋酸格拉默含量。
冷冻干燥:将微颗粒的洗涤沉淀物再悬浮于3-5ml纯化水或5%甘露醇,转移到10ml预先称重的玻璃小瓶,利用在-37至-43℃下的冷冻干燥板装置加以冷冻,然后冷冻干燥(在-20℃和真空0.05巴下主要干燥16-48小时,在+20℃和0.025巴下最后干燥12-16小时)。在冷冻干燥以后称量小瓶,用溴化丁基橡胶瓶塞封闭,然后在冰箱的储存条件下存放直到使用。
颗粒尺寸的估算:利用光场和相衬显微术(leutzorthoplantm,德国)来评估微颗粒的颗粒尺寸,其中物镜为40x和10x,以及台式测微计的量程为1-1000μm。
利用包含0.75%氯化钠的水相来制备所有微颗粒制剂,以增加外部渗透压以及改善水溶性带电荷药物的掺入。借助于2%pva作为表面活性剂来获得空白微颗粒(第一个实验),而对于所有加载肽的制剂的制备则使用0.5%pva。
制备工艺的组成和参数列于表2-5。
表2.用于醋酸格拉默(ga)的缓释的plga微颗粒(制剂1-4)
将来自德国ika的具有定子的较小直径(轴12mm)和速度范围8-30,000rpm的vwrvdi-12高剪切混合器设定在#5位置(大约24,000rpm)。在2%pva相中,在二氯甲烷中的大约10%plga溶液的短期处理(30秒)用来制备空白mp样品,其导致具有相对较宽尺寸分布(10-50μm)的光滑球形微颗粒。由于发泡,在表面活性剂的较低浓度下进行进一步处理。还延长均化时间(1或2分钟处理)以获得更窄的尺寸分布。
由于在双重乳液中内部水相的存在,所以,当在光学显微镜下观测时,用格拉默肽制备的所有微颗粒在mp表面上或在颗粒内具有可见夹杂物和孔隙标志。
表3.用于缓释醋酸格拉默(ga)的plga微颗粒(制剂5-7)
离心形成的加载有醋酸格拉默的微颗粒,将颗粒重新悬浮于纯化水,洗涤并重复离心分离。分析上清液和(在一些情况下)洗涤水的醋酸格拉默含量。将经离心的沉淀物重新悬浮于纯化水或5%甘露醇溶液,然后冷冻干燥。
表4:用于缓释醋酸格拉默(ga)的plga微颗粒(制剂05r、08-011和格拉默的生育酚琥珀酸盐)
借助于超声波压头60秒(6x10秒)和冰冷却,通过将格拉默的水溶液悬浮于包含先前溶解的等摩尔量的生育酚琥珀酸的二氯甲烷,来制备生育酚琥珀酸(mw530,一个cooh当量,265道尔顿)和醋酸格拉默(mw4,700-11,000,一个nh2当量,~693道尔顿)的等摩尔复合物(盐)的制剂。在蒸发有机溶剂和水以后,收集如此形成的水不溶性产物,用纯化水和用干乙醇洗涤,然后用于进一步研究而没有另外的纯化。
表5.用于缓释醋酸格拉默(ga)的plga微颗粒(制剂mpg-12-15)
冷冻干燥
在离心和洗涤以后,在沉降物再悬浮液于纯化水以后“原样”地,或在一些情况下借助于添加冷冻保护剂(将沉降物重新悬浮于5%甘露醇溶液),来冷冻干燥微颗粒制剂。利用冷冻干燥器板在-37至-43℃下冷冻样品1小时,然后在0.050毫巴和-20℃下利用冷冻干燥器“alpha2-4lsc”(christ,德国)冷冻干燥24-48小时,最后在0.025毫巴和+20℃下干燥10-16小时。在两种再悬浮程序中,均可以容易地重建冷冻干燥产物。和没有冷冻保护剂的制剂相比,甘露醇的使用导致容易重建的产物,但这样的组成包含显著量的压载材料,因而需要更加复杂的计算来确定活性物质的真实浓度。
实施例4:来自plga微颗粒的醋酸格拉默的体外释放
设备
20ml小瓶
多点磁性搅拌器
恒温箱
吸移管
uv-vis分光光度计shimadzu1601
试剂和塑料/玻璃器皿
试验样品
制剂mpg-02、03、04、05、05r、06、07、12、13、14、和15-50mg干燥的冷冻干燥微颗粒。
制剂mpg-08、09、10、和11:对应于50mg干燥的微颗粒的量,用5%甘露醇加以冷冻干燥。
对照醋酸格拉默溶液20-50μg/ml(作为基础),在具有0.05%叠氮化钠的pbs中)
温度:37℃
为了评估掺入的醋酸格拉默自加载有醋酸格拉默的可生物降解plga微颗粒(各种制剂)的释放,已采用了以下工艺。
工艺描述:将20ml的pbs(0.01m磷酸盐,0.05%nan3)ph7.4加入每个小瓶。将小瓶置于37℃下并用小磁体搅拌。在10,000g下离心600μl样品5分钟。将500μl上清转移到1.5ml微管,接着添加500μl的0.1m硼酸盐缓冲液(2倍稀释)和50μl的tnbs。强烈地混合获得的组合物并保持在工作台上30分钟。利用tnbs方法进行分析。
将用500μl新鲜pbs(含有nan3)重新悬浮的剩余的沉淀颗粒返回到小瓶。在另外的释放工艺(对于每个时间点,2.5%)中,进行醋酸格拉默的释放量的正确计算。
利用装备有多点磁性搅拌器的37℃的恒温箱,在紧密封闭的20ml玻璃小瓶中,进行掺入的醋酸格拉默的释放。磷酸盐缓冲盐水(pbs)(ph7.4)用作释放介质。
在10-32天期间,测试醋酸格拉默的释放。
计算用于在1-200μg/ml范围内的校准曲线的方程(shimadzuuv-1601)为:
od=0.035+0.0132*c(r2=0.9985)
式中od–光密度(在420和700nm处的差异)
c–醋酸格拉默基质的浓度,μg/ml
制剂mpg01-mpg07的肽释放的结果示于图1。在制剂mpg-05中,其基于具有酸性端基(resomerrg502h)和没有疏水性相反离子的低分子量plga聚合物,获得掺入醋酸格拉默的最快释放(1-10天,40%)。具有相对少量的生育酚琥珀酸作为相反离子(mpg-03)的中性聚合物rg502也呈现显著释放(2-12天,~30%),但具有较低绝对释放值。包含较高量相反离子的制剂显示药物释放的抑制。不受限于任何理论或作用机制,这可以归因于所形成的复合物的高疏水性。另外,包含dcp或dmpg的微颗粒的制备伴随聚集体的形成和较宽的颗粒尺寸分布。
代替vdi-12(12mm轴),更大和更强大高剪切混合器omniglh(轴直径20mm,5000-30000rpm)的使用导致微颗粒(制剂8-11)的尺寸的显着下降和增加的表面平滑度。增加有机溶剂的量(mpg-02)会减少肽掺入微颗粒。不受限于任何理论或作用机制,这可能归因于中间o/w/o双重乳化小滴尺寸的增加。类似地,使用聚山梨酯作为非离子型表面活性剂还负面影响药物加载(mpg-10,具有0.2%吐温-80)。和没有相反离子的制剂(mpg-05、mpg-05r)相比,疏水性相反离子(生育酚琥珀酸、双肉豆蔻酰磷脂酰甘油dmpg、双十六烷基磷酸酯dcp)的添加会显著阻碍自聚合物微颗粒的肽释放。不受限于任何理论或作用机制,疏水性相反离子的添加可以提供具有妥协特性的微颗粒(mpg-06)。
和plga的分子量相比,所使用的聚合物的化学结构显示对释放性能的更大影响。resomersrg502h和rg502(mw约17,000道尔顿)具有非常类似的扩散系数,但确定所包括肽自聚合物基质的释放的主要因素是在醋酸格拉默的正电荷的lys部分和在plga聚合物中的羧酸端基之间的多点离子相互作用。中性
对于这样的小规模批次,自分别制备的相同制剂(mpg-05和mpg-05r)的重复释放实验显示合理的类似行为和良好的重现性。醋酸格拉默与
生育酚琥珀酸(tocopherylsuccinate)的等摩尔复合物(盐)的制剂具有高结合和极低的水溶性(~5μg/ml)。不受限于任何理论或作用机制,这可以起因于二酸(生育酚琥珀酸)和聚合物的聚胺分子的离子交联。聚合物自在pbs中的这种盐的释放是极其缓慢的。对于聚合物微颗粒,当生育酚琥珀酸掺入plga基质时,仅部分的这种二酸可以相互作用于聚合物,并且为了完全释放抑制,需要较高量的生育酚琥珀酸。所以,可以通过格拉默和plga的比例来调节释放速率。所使用的有机溶剂的量也可以具有重要性(但在较低程度上)。
制剂12-15,其基于在药物和聚合物之间具有不同比例的
实施例5:比例放大
醋酸格拉默微颗粒制剂的冷冻干燥样品
mpg-14su-1–mpg-014的制剂,是利用更大的反应容器和在低速下的更大的均化器(omniglh)来制备。
共计–13个小瓶;每个小瓶包含大约235mg冷冻干燥制剂,其中醋酸格拉默的总含量为~18.2mg/小瓶,等于~75μg/mg冷冻干燥制剂。
mpg-15su-1–mpg-015的制剂,是利用更大的反应容器和在低速下的更大的均化器(omniglh)来制备。
共计–10个小瓶;每个小瓶饮食大约145mg冷冻干燥制剂,其中醋酸格拉默的总含量为~14.9mg/小瓶,等于~100μg/mg冷冻干燥制剂。
mpg-14su-2–mpg-014的制剂,是利用相同反应容器、相同均化器(vdi12)和相同参数、并重复工艺若干次来制备。充分洗涤组合物以降低初始爆发。
共计–12个小瓶;每个小瓶包含大约88mg冷冻干燥制剂,其中醋酸格拉默的总含量为~6.3mg/小瓶,等于~72μg/mg冷冻干燥制剂。
mpg-15su-2–mpg-015的制剂,是利用相同反应容器、相同均化器(vdi12)和相同参数、并重复工艺若干次来制备。充分洗涤组合物以降低初始爆发。
共计–12个小瓶;每个小瓶包含大约55mg冷冻干燥制剂,其中醋酸格拉默的总含量为~5.6mg/小瓶,等于~100μg/mg冷冻干燥制剂。
将所有冷冻干燥样品存储于+4℃的冰箱,并在使用前加以重建。
制剂和稀释剂(葡萄糖溶液)之间的比例为至少1:5,优选1:10和更高。在给予重建样品以前,进行剧烈摇晃。这些制剂的释放曲线示于图4和5。
因而,证明了醋酸格拉默的高度水溶性肽掺入可生物降解聚合物微颗粒。微颗粒显示聚合物的良好结合、合理的药物加载和降低的初始释放爆发,其可以通过采用不同的组成和制备工艺来调节。在37℃下,在搅拌水介质(磷酸盐缓冲盐水,ph7.4)中,制备自
实施例6:实验性自身免疫性脑脊髓炎(eae)模型
实验性自身免疫性脑脊髓炎(eae)是一种炎性自身免疫性脱髓鞘病,其可以在实验动物中通过注射髓磷脂碱性蛋白来诱导。上述疾病已变成用来研究临床和实验性自身免疫性疾病的标准实验模型。事实上,许多文章(例如,abramskyet.al.,jneuroimmunol(1982)21和boltonetal.,jneurolsci.(1982)56147)注意到,在动物中的慢性复发eae和人类中的多发性硬化症的相似性尤其牵涉eae用于研究自身免疫性脱髓鞘病如多发性硬化症的价值。因此,eae试验模型用来建立本发明的制剂相对于多发性硬化症的活性。按照以下程序来进行上述测试。
在雌性lewis大鼠的脚掌中注射在完全弗氏佐剂中的12.5μg髓磷脂碱性蛋白(mbp)(制备自豚鼠脊髓)。以各种剂量,通过注射,将本发明的制剂给予实验动物,每周/两周/月一次。将对照制剂给予某些其它实验动物。然后称量动物并按照0至3的级别(0=没有变化;1=弛缓性尾巴;2=后肢无能;以及3=髂腹间髂腹间麻痹/濒死)每日评分eae的症状。如果达到3的评分,则处死动物。
实施例7:利用eae模型进行体内研究
为了确定本发明的制剂对ms的鼠模型的效应,诱导实验性自身免疫性脑脊髓炎(eae)。在eae免疫以前,用包含0.87%钙和1ng的1,25-(oh)2d3(vitd)的纯化膳食供养25-羟基维生素d3-1α-羟化酶敲除小鼠(1α-ohko)两至三周。通过对6至10周龄小鼠皮下免疫200μg的相对于髓磷脂少突胶质细胞糖蛋白(mog35-55)的免疫显性肽来诱导eae。
通过标准的9-芴基-甲氧基-羰基化学作用来合成肽。将肽溶解于包含4mg/ml热灭活结核分枝杆菌h837a的弗氏完全佐剂(cfa;sigma)。
采用以下评分系统来每日检查小鼠的eae的临床体征:0,没有体征;1,跛行尾巴;2,后肢无力;3,后肢麻痹;4,前肢麻痹;5,濒死或死亡。
对于发展eae的临床体征并且评分≥2的小鼠,通过注射,给予不同剂量的本发明的制剂加以治疗,其中注射是每周/两周/月一次。用安慰剂或用醋酸格拉默的gold标准方案[例如pnas,2005,vol.102,no.52,19045–19050]来治疗对照组。然后称量小鼠并每日评分eae的症状。利用对发生率的双尾费希尔恰当概率实验和对所有其它测量结果的不成对t检验来进行统计分析。p<0.05的数值被认为是统计显著的。
虽然已特别描述了本发明,但本领域技术人员将明了,可以进行许多变化和改进。因而,本发明并不限于特别描述的实施方式,并且通过参考权利要求将可以更容易地明了本发明的范围和构想。
- 还没有人留言评论。精彩留言会获得点赞!