一种叶黄素冻干脂质体制剂及其制备方法与流程
本发明涉及一种药物制剂领域,具体涉及一种叶黄素冻干脂质体制剂及其制备方法。
背景技术:
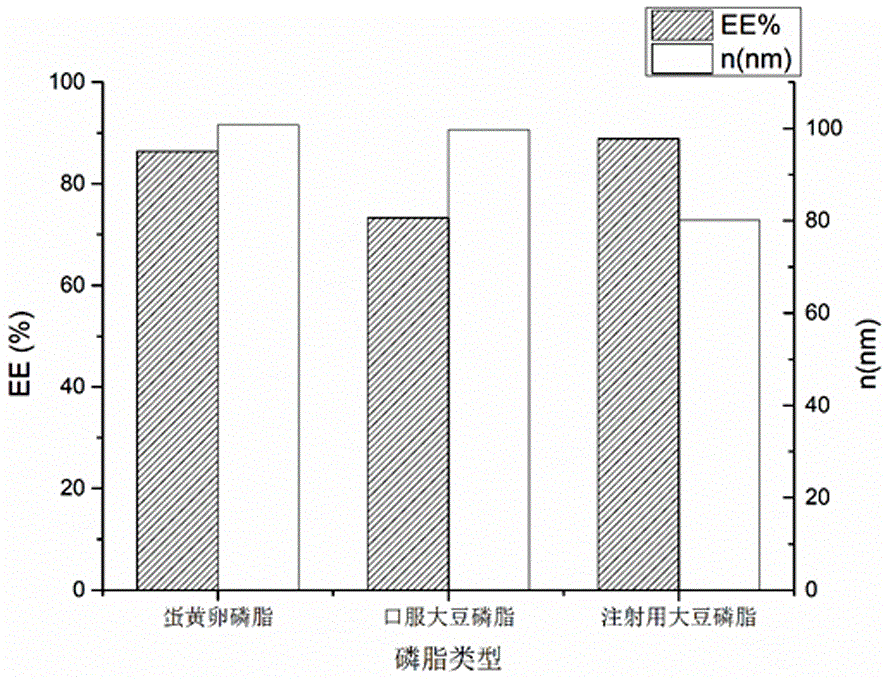
:目前,叶黄素是一类含氧类胡萝卜素,广泛存在于深绿色叶蔬菜、橙子等黄色水果中,是人眼视网膜组织色素层的重要组成部分[1]。天然叶黄素是由一个含十八碳原子的共轭长链接两个不同的紫罗酮环(βiononeringandεiononering)构成,具有清除氧自由基和光屏蔽能力,可以作为强抗氧剂淬灭单线态氧和吸收短波长的蓝紫光。叶黄素的摄入可有效的预防和治疗年龄相关性黄斑变性、视网膜光损伤等疾病(璐姚,林嵩齐.叶黄素类物质对视觉功能的保护作用及其在青少年视力维护中的应用[j].眼科学报,2017,32(3):171-175.);叶黄素在水中的溶解度低,叶黄素不溶于水,主要与脂类结合被人体吸收;且稳定性差,易受光、热、酸、溶剂、金属离子等影响,易发生氧化降解、光分解和热异构化反应;生物利用率差,在生物体内的血浆半衰期短,有研究表明游离叶黄素的生物利用度只有2%~9.4%。叶黄素的水不溶性和不稳定性限制了其在各领域的应用。脂质体是磷脂双分子层膜形成的囊泡将药物包裹后形成的一种新剂型,具有亲水性和疏水性,易与生物膜融合,安全无刺激等特点。利用脂质体作为载体,将叶黄素包埋在磷脂双分子层膜形成的囊泡中,提高了叶黄素的稳定性,增加了叶黄素在水中的溶解度;而且脂质体中的双分子层膜,与人体细胞膜结构相似,容易渗透进入细胞并释放药物,促进包裹药物跨角膜转运。叶黄素脂质体具备生理相容性好、载药能力强、物理化学存储稳定、进一步提高药物的生物利用度,且成本低、利于大规模生产等优点。研究表明最佳的冻干保护剂是蔗糖,糖脂比为3:1。对冻干脂质体进行显微形态观察发现为圆球状,得到的冻干叶黄素脂质体包封率为73.85%,粒径为202nm,pdi为0.167,渗漏率为7.26%。通过对各个指标进行对比,尽管包封率有所下降,粒径增大至200nm左右,冻干后明显抑制了脂质体的泄露,有效的降低了渗漏率和提高了稳定性,并不影响叶黄素的抗氧化特性。通过mda和体外抗dpph实验,发现叶黄素脂质体比叶黄素抗氧化效果更佳,在体外消化实验中,观察脂质体在模拟胃肠液中的形貌变化、磷脂水解程度和芯材的释放行为,对胃肠液中叶黄素和进一步运用相关性分析发现,叶黄素的生物可给率受其载入双分子层的能力和脂质体载体理化特性的影响。技术实现要素:本发明所要解决的技术问题是提供一种叶黄素冻干脂质体制剂及其制备方法,该制剂中的叶黄素具有良好的水溶性、脂质体粒度均匀、稳定性好,延长体内消除半衰期,从而一定程度上提高药效。本发明解决技术问题所采用的技术方案是:一种叶黄素冻干脂质体制剂,由以下重量百分比成分组成:叶黄素:0.5~15%;磷脂:20~50%;胆固醇:1~10%;表面活性剂:0.5~8%;支撑剂:1~15%;ph缓冲液至全量,缓冲液溶媒部分在冰冻干燥过程中除去。作为一种优选,所述磷脂为蛋黄卵磷脂、口服大豆磷脂和注射用大豆磷脂中的一种或两种的复合。作为一种优选,所述注射用大豆磷脂的用量为5mg/ml、10mg/ml、15mg/ml或20mg/ml。作为一种优选,所述磷脂与胆固醇的比为5:1、10:1、15:1、20:1或25:1。作为一种优选,所述表面活性剂为span80、tween80和泊洛沙姆188或f68中的一种或两种的组合。作为一种优选,所述支撑剂由蔗糖、乳糖、葡萄糖、山梨醇和甘露醇中的一种或两种以上的组合,其质量比为1:1~6。作为一种优选,所述缓冲液为磷酸盐缓冲液pbs、醋酸钠缓冲液、枸橼酸盐缓冲液、硼酸钠缓冲液中的一种或两种的复合缓冲液,所述缓冲液的ph值为6.5~7.4作为一种优选,所述的溶剂是三氯甲烷。一种制备如上所述叶黄素冻干脂质体制剂的制备方法,包括以下步骤,1)将叶黄素、磷脂、胆固醇、表面活性剂溶于有机溶剂,制备叶黄素脂质体混悬液,所述叶黄素脂质体混悬液的制备采用薄膜超声法,具体步骤如下:将叶黄素、磷脂、胆固醇、表面活性剂溶解到有机溶剂中,将混合溶液减压于40℃下旋蒸除去有机溶剂直至在容器内壁形成一层黄色薄膜,继续旋蒸除去残余有机溶剂,然后加入ph为6.5~7.4的缓冲液,先在40~70℃条件下搅拌10~30min,随后在冰浴条件下超声3~10min,最后用微孔滤膜过滤整粒3次得到脂质体混悬液;2)向叶黄素脂质体混悬液中加入冻干支撑剂剂,进行冷冻干燥,所述冷冻干燥包括预冻、升华、干燥阶段,每个阶段的操作步骤如下:预冻:先将物料温度迅速降至-35~-45℃,保温3~5小时;升华:将已预冻的叶黄素冻干脂质体温度升至-20~-15℃,升华8~15小时;干燥:将物料温度升高到30~40℃,保温8~15小时。作为一种优选,所述微孔滤膜的孔径为0.22μm,粒径控制于80~250nm。本发明的有益效果是:脂质体作为新型的载体给药系统,具有生物膜特性和药物传输能力,将难溶性叶黄素药物包裹在脂质双分子层中,使其具有较强的两亲性,可以显著提高药物的口服跨膜吸收率及体内生物利用度,且具有生物相容性、低毒、易制备、可提高药物治疗指数等优点。附图说明图1为本发明磷脂种类对ee%和n影响的参考图。图2为本发明磷脂浓度对脂质体粒径大小影响的参考图。图3为本发明膜材比对ee%和n影响的参考图。图4为本发明表面活性剂对ee%和n影响的参考图。图5为本发明旋蒸转数对脂质体粒径大小影响的参考图。图6为本发明水化液种类对脂质体粒径大小影响的参考图。图7为本发明水化液浓度对脂质体粒径大小影响的参考图。图8为本发明缓冲液ph对ee%和n影响的参考图。图9为本发明超声功率对ee%和n影响的参考图。图10为本发明超声时间对ee%和n影响的参考图。图11为本发明冻干脂质体粒径分析图。图12为本发明冻干脂质体释放率曲线图。图13为本发明抗氧化实验结果的参考图。下面结合附图对本发明做进一步说明。具体实施方式一种叶黄素冻干脂质体由以下配比成分组成:叶黄素:0.5~15%;磷脂:20~50%;胆固醇:1~10%;表面活性剂:0.5~8%;支撑剂:1~15%;ph缓冲液至全量,缓冲液溶媒部分在冰冻干燥过程中除去。所述的磷脂为口服大豆磷脂、注射用大豆磷脂和蛋黄卵磷脂中的一种或二种;本发明磷脂选择注射用大豆磷脂,见图1;本发明所述的注射用大豆磷脂的使用浓度为5mg/ml、10mg/ml、15mg/ml、20mg/ml,优选地选用15mg/ml;见图2。本发明使用的磷脂与胆固醇的比为5:1、10:1、15:1、20:1、和25:1。其中磷脂与胆固醇的最优比为15:1左右,见图3。所述表面活性剂为span80、tween80和泊洛沙姆188(f68)中的一种或两种以上的组合。优选为土温-80,见图4。所述的土温-80的用量为0.25%、0.5%、0.75%和1%,优选地采用0.75%得用量。所述支撑剂由蔗糖、乳糖、葡萄糖、山梨醇和甘露醇,其质量比为1:1-6。优选的冻干保护剂是蔗糖,糖脂比为3:1。见表-1。表-1支撑剂对叶黄素冻干脂质体的影响结果序号保护剂ee%n(nm)pdi外观复溶性1甘露醇21.52208.80.156++++++2蔗糖74.35191.90.178++++++3乳糖70.52204.30.144++++++4葡萄糖52.31187.10.130++++本发明所述在减压下旋蒸成膜的时间为1.5h、2h、2.5h、3h,优选地旋蒸2h成膜;本发明所述旋蒸转数为75、100、125、150、175rpm,优选100rpm旋蒸成膜,见图5。本发明的水化液选择的缓冲液为磷酸盐缓冲液(pbs)、醋酸钠缓冲液、枸橼酸盐缓冲液、硼酸钠缓冲液中的一种或两种复合缓冲液。优选地,选择磷酸盐缓冲液。见图6。pbs缓冲液的使用浓度为0.01、0.02、0.03、0.04、0.05mol/ml,优选地采用0.05mol/ml,其ph值为6.5~7.0的pbs缓冲液见图7。本发明所用磷酸盐缓冲液的ph值为6.5、6.8、7.0、7.2和7.4,优选地为磷酸盐缓冲液的ph值为7.0。见图8。本发明还提供了一种制备叶黄素冻干脂质体的工艺方法:1)采用有机溶剂三氯甲烷溶解含叶黄素、磷脂、胆固醇和适量表面活性剂,得到混合溶液;2)混合溶液减压下以75~175rpm,温度为30~50℃,时间为60~120min,旋蒸去除混合溶液中的三氯甲烷有机溶剂,最佳温度为40℃,旋转速度100rpm、时间为2h,至形成一层均匀的黄色薄膜。3)本发明的最佳水化液为pbs液,结合叶黄素的稳定性,优选地采用0.05mol/ml的磷酸盐缓冲溶剂,ph约为7.0,薄膜水化1h,得到符合要求的脂质体混悬液。4)本发明所述脂质体混悬液超声功率为200、300、400、500、600w,优选地选择400w,超声时间为3min,见图9、10;5)本发明所述过滤采用0.22µm滤膜,过滤三次后,得到所述含叶黄素脂质体混悬液。6)本发明所述支撑剂加入到叶黄素脂质体混悬液中溶解,并分装入西林瓶中,塞上半塞,按设定的冻干条件冷冻干燥即得;7)为进一步提高叶黄素脂质体性状外观和稳定性,改善其溶解性,本发明进一步优选地采用冷冻干燥工艺,所述冷冻干燥工艺的操作步骤如下:①预冻:先将叶黄素脂质体混悬液放入冷冻干燥机中,将温度迅速降至-40~-45℃,保温3~5小时;②升华:经测定本品的共晶点-19.31℃、共熔点-18.45℃,在减压下将预冻的叶黄素脂质体的温度升至-19.5℃~-20℃(一般升华温度不高于共熔点温度),升华时间15小时;③干燥:在减压下,将升华的叶黄素脂质体的温度升高到30~40℃,保温12小时;④本发明的叶黄素冻干脂质体的复溶性在即刻~2秒钟内溶解。本发明的叶黄素冻干脂质体固体呈黄色疏松块状,复溶性好,水溶性好,制得的含叶黄素脂质体粒径较小,大小均一,(见图11)分散性好,提高了稳定性,能在避光下冷藏保存。本发明的叶黄素冻干脂质体在肠液中的释放曲线,在60分钟前有一定缓释作用,之后快速释放,见图12。取浓度分别为35、70、105、135、175µg/ml的叶黄素溶液、叶黄素脂质体和复溶后的冻干脂质体作抗氧化试验,结果叶黄素溶液、叶黄素脂质体和冻干叶黄素脂质体都随着叶黄素浓度增大而抗氧化作用增强,但在相同浓度下,叶黄素脂质体和冻干叶黄素脂质体的抗氧化作用明显优于叶黄素溶液,且叶黄素脂质体和冻干叶黄素脂质体的抗氧化能力没有明显区别,说明冻干技术不会影响叶黄素脂质体的抗氧化作用。见图13。以上结果表明:脂质体作为新型的载体给药系统,具有生物膜特性和药物传输能力,将难溶性叶黄素药物包裹在脂质双分子层中,使其具有较强的两亲性,可以显著提高药物的口服跨膜吸收率及体内生物利用度,且具有生物相容性、低毒、易制备、可提高药物治疗指数等优点。实施例1:叶黄素冻干脂质体处方:叶黄素60mg注射用大豆卵磷脂750mg胆固醇150mg土温-800.375mg(0.5mg/ml土温-80的溶液0.75ml)三氯甲烷10ml蔗糖2.25g磷酸盐缓冲液加至50ml配制方法:称取处方量的叶黄素、注射用大豆磷脂、胆固醇和吐温-80,用10ml三氯甲烷充分溶解,所得溶液置于旋蒸瓶中;将装有上述混合溶液的旋蒸瓶置于40℃,100rpm的旋转蒸发仪上减压旋蒸120min,充分除去三氯甲烷,使形成一层均匀的黄色薄膜;将0.05mol/mlph约为7的磷酸盐缓冲液50ml加入旋蒸瓶中,然后在常温下以100rpm速度旋转1h充分水化,水化后得到叶黄素脂质体混悬液;将叶黄素脂质体混悬液置于超声功率为400w的超声仪中水浴超声3min;将超声后的叶黄素脂质体混悬液经0.22μm的亲水性微孔滤膜反复过滤3次,即得含叶黄素脂质体混悬液。加入支撑剂蔗糖2.25g,使溶解,搅拌均匀,冷冻干燥,该冻干方法为:①预冻:先将叶黄素脂质体混悬液放入冷冻干燥机中,将温度迅速降至-40~-45℃,保温3~5小时;②升华:经测定本品的共晶点-19.31℃、共熔点-18.45℃,在减压下将预冻的叶黄素脂质体的温度升至-19.5℃(一般升华温度不高于共熔点温度),升华时间15小时;③干燥:在减压下,将升华后的叶黄素脂质体的温度升高到30~40℃,保温12小时;即获得叶黄素冷冻干燥的脂质体。经测试,本发明制得的含叶黄素脂质体的平均粒径为100~187nm,制备的含叶黄素脂质体粒径均一,结构稳定。实施例2:叶黄素冻干脂质体处方:叶黄素60mg注射用大豆卵磷脂750mg胆固醇75mg土温-800.375mg(0.5mg/ml土温-80的溶液0.75ml)。三氯甲烷10ml蔗糖2.25g磷酸盐缓冲液加至50ml配制方法:称取处方量的叶黄素、注射用大豆磷脂、胆固醇和吐温-80,用10ml三氯甲烷充分溶解,所得溶液置于旋蒸瓶中;将装有上述混合溶液的旋蒸瓶置于40℃,100rpm的旋转蒸发仪上减压旋蒸120min,充分除去三氯甲烷,使形成一层均匀的黄色薄膜;将0.05mol/mlph约为7的磷酸盐缓冲液50ml加入旋蒸瓶中,然后在常温下以100rpm速度旋转1h充分水化,水化后得到叶黄素脂质体混悬液;将叶黄素脂质体混悬液置于超声功率为400w的超声仪中水浴超声3min;将超声后的叶黄素脂质体混悬液经0.22μm的亲水性微孔滤膜反复过滤3次,即得含叶黄素脂质体混悬液。加入支撑剂蔗糖2.25g,使溶解,搅拌均匀,冷冻干燥,该冻干方法为:①预冻:先将叶黄素脂质体混悬液放入冷冻干燥机中,将温度迅速降至-40~-45℃,保温3~5小时;②升华:在减压下将预冻的叶黄素脂质体的温度升至-19.5℃(一般升华温度不高于共熔点温度),升华时间15小时;③干燥:在减压下,将升华后的叶黄素脂质体的温度升高到30~40℃,保温12小时;即获得叶黄素冷冻干燥的脂质体。经测试,本发明制得的含叶黄素脂质体粒径均一,结构稳定。实施例3:叶黄素冻干脂质体处方:叶黄素60mg注射用大豆卵磷脂750mg胆固醇50mg土温-800.375mg(0.5mg/ml土温-80的溶液0.75ml)。三氯甲烷10ml蔗糖2.25g磷酸盐缓冲液加至50ml配制方法:称取处方量的叶黄素、注射用大豆磷脂、胆固醇和吐温-80,用10ml三氯甲烷充分溶解,所得溶液置于旋蒸瓶中;将装有上述混合溶液的旋蒸瓶置于40℃,100rpm的旋转蒸发仪上减压旋蒸120min,充分除去三氯甲烷,使形成一层均匀的黄色薄膜;将0.05mol/mlph约为7的磷酸盐缓冲液50ml加入旋蒸瓶中,然后在常温下以100rpm速度旋转1h充分水化,水化后得到叶黄素脂质体混悬液;将叶黄素脂质体混悬液置于超声功率为400w的超声仪中水浴超声3min;将超声后的叶黄素脂质体混悬液经0.22μm的亲水性微孔滤膜反复过滤3次,即得含叶黄素脂质体混悬液。加入支撑剂蔗糖2.25g,使溶解,搅拌均匀,冷冻干燥,该冻干方法为:①预冻:先将叶黄素脂质体混悬液放入冷冻干燥机中,将温度迅速降至-40~-45℃,保温3~5小时;②升华:在减压下将预冻的叶黄素脂质体的温度升至-19.5℃(一般升华温度不高于共熔点温度),升华时间15小时;③干燥:在减压下,将升华后的叶黄素脂质体的温度升高到30~40℃,保温12小时;即获得叶黄素冷冻干燥的脂质体。经测试,本发明制得的含叶黄素脂质体粒径均一,结构稳定。实施例4:叶黄素冻干脂质体处方:叶黄素60mg注射用大豆卵磷脂750mg胆固醇37.5mg土温-800.375mg(0.5mg/ml土温-80的溶液0.75ml)。三氯甲烷10ml蔗糖2.25g磷酸盐缓冲液加至50ml配制方法:称取处方量的叶黄素、注射用大豆磷脂、胆固醇和吐温-80,用10ml三氯甲烷充分溶解,所得溶液置于旋蒸瓶中;将装有上述混合溶液的旋蒸瓶置于40℃,100rpm的旋转蒸发仪上减压旋蒸120min,充分除去三氯甲烷,使形成一层均匀的黄色薄膜;将0.05mol/mlph约为7的磷酸盐缓冲液50ml加入旋蒸瓶中,然后在常温下以100rpm速度旋转1h充分水化,水化后得到叶黄素脂质体混悬液;将叶黄素脂质体混悬液置于超声功率为400w的超声仪中水浴超声3min;将超声后的叶黄素脂质体混悬液经0.22μm的亲水性微孔滤膜反复过滤3次,即得含叶黄素脂质体混悬液。加入支撑剂蔗糖2.25g,使溶解,搅拌均匀,冷冻干燥,该冻干方法为:①预冻:先将叶黄素脂质体混悬液放入冷冻干燥机中,将温度迅速降至-40~-45℃,保温3~5小时;②升华:在减压下将预冻的叶黄素脂质体的温度升至-19.5℃(一般升华温度不高于共熔点温度),升华时间15小时;③干燥:在减压下,将升华后的叶黄素脂质体的温度升高到30~40℃,保温12小时;即获得叶黄素冷冻干燥的脂质体。经测试,本发明制得的含叶黄素脂质体粒径均一,结构稳定。实施例5:叶黄素冻干脂质体处方:叶黄素60mg注射用大豆卵磷脂750mg胆固醇30mg土温-800.375mg(0.5mg/ml土温-80的溶液0.75ml)。三氯甲烷10ml蔗糖2.25g磷酸盐缓冲液加至50ml配制方法:称取处方量的叶黄素、注射用大豆磷脂、胆固醇和吐温-80,用10ml三氯甲烷充分溶解,所得溶液置于旋蒸瓶中;将装有上述混合溶液的旋蒸瓶置于40℃,100rpm的旋转蒸发仪上减压旋蒸120min,充分除去三氯甲烷,使形成一层均匀的黄色薄膜;将0.05mol/mlph约为7的磷酸盐缓冲液50ml加入旋蒸瓶中,然后在常温下以100rpm速度旋转1h充分水化,水化后得到叶黄素脂质体混悬液;将叶黄素脂质体混悬液置于超声功率为400w的超声仪中水浴超声3min;将超声后的叶黄素脂质体混悬液经0.22μm的亲水性微孔滤膜反复过滤3次,即得含叶黄素脂质体混悬液。加入支撑剂蔗糖2.25g,使溶解,搅拌均匀,冷冻干燥,该冻干方法为:①预冻:先将叶黄素脂质体混悬液放入冷冻干燥机中,将温度迅速降至-40~-45℃,保温3~5小时;②升华:在减压下将预冻的叶黄素脂质体的温度升至-19.5℃(一般升华温度不高于共熔点温度),升华时间15小时;③干燥:在减压下,将升华后的叶黄素脂质体的温度升高到30~40℃,保温12小时;即获得叶黄素冷冻干燥的脂质体。经测试,本发明制得的含叶黄素脂质体粒径均一,结构稳定。实施例6:叶黄素冻干脂质体处方叶黄素50mg蛋黄卵磷脂650mg胆固醇43.3mg土温-800.375mg(0.5mg/ml土温-80的溶液0.75ml)。三氯甲烷10ml葡萄糖1.95g磷酸盐缓冲液加至50ml称取处方量的叶黄素、蛋黄卵磷脂、胆固醇、土温-80用10ml三氯甲烷充分溶解上述注射用大豆卵磷脂和胆固醇及叶黄素和土温-80,所得溶液置于旋蒸瓶中;将装有上述叶黄素混合溶液的旋蒸瓶置于40℃,100rpm的旋转蒸发仪上减压旋蒸120min,充分除去三氯甲烷,使形成一层均匀的黄色薄膜;将0.05mol/mlph约为7的磷酸盐缓冲液50ml加入旋蒸瓶中,然后在常温下以100rpm速度旋转1h充分水化,水化后得到叶黄素脂质体混悬液;将叶黄素脂质体混悬液置于超声功率为400w的超声仪中水浴超声3min;将超声后的叶黄素脂质体混悬液经0.22μm的亲水性微孔滤膜反复过滤3次,即得含叶黄素脂质体混悬液。加入支撑剂葡萄糖1.95g,使溶解,搅拌均匀,并分装入西林瓶中,塞上半塞;再按设定的冷冻条件冷冻干燥,获得冻干的叶黄素脂质体,该冻干方法为:①预冻:先将叶黄素脂质体混悬液放入冷冻干燥机中,将温度迅速降至-40~-45℃,保温3~5小时;②升华:在减压下将预冻的叶黄素脂质体的温度升至-19.5℃(一般升华温度不高于共熔点温度),升华时间15小时;③干燥:在减压下,将升华的叶黄素脂质体的温度升高到30~40℃,保温12小时;即获得叶黄素冷冻干燥的脂质体。经测试,本发明制得的含叶黄素脂质体的粒径均一,结构稳定。实施例7:叶黄素冻干脂质体处方叶黄素60mg口服大豆磷脂700mg胆固醇46.7mg司盘-800.5mg(0.5mg/ml司盘-80的溶液1.0ml)。三氯甲烷10ml甘露醇2.10g枸橼酸盐缓冲液加至50ml称取处方中的叶黄素、注射用大豆卵磷脂、胆固醇、司盘-80。用10ml三氯甲烷充分溶解上述注射用大豆卵磷脂和胆固醇及叶黄素和土温-80,所得溶液置于旋蒸瓶中;将装有上述混合溶液的旋蒸瓶置于40℃,100rpm的旋转蒸发仪上减压旋蒸120min。充分除去三氯甲烷,使形成一层均匀的黄色薄膜;将ph约为7的枸橼酸盐缓冲液加入旋蒸瓶中,然后在常温下以100rpm速度旋转1h充分水化,水化后得到叶黄素脂质体混悬液;将叶黄素脂质体混悬液置于超声功率为400w的超声仪中水浴超声3min;将超声后的叶黄素脂质体混悬液经0.22μm的亲水性微孔滤膜反复过滤3次,即得含叶黄素脂质体混悬液。加入支撑剂蔗糖168mg,使溶解,搅拌均匀,并分装入西林瓶中,塞上半塞;再按设定的冷冻条件冷冻干燥,获得冻干的叶黄素脂质体,该冻干方法为:①预冻:先将叶黄素脂质体混悬液放入冷冻干燥机中,将温度迅速降至-40~-45℃,保温3~5小时;②升华:经测定本品的共晶点-19.31℃、共熔点-18.45℃,在减压下将预冻的叶黄素脂质体的温度升至-19.5℃(一般升华温度不高于共熔点温度),升华时间15小时;③干燥:在减压下,将升华的叶黄素脂质体的温度升高到30~38℃,保温12小时;即获得叶黄素冷冻干燥的脂质体。经测试,本发明制得的含叶黄素脂质体粒径均一,结构稳定。实施例8:叶黄素冻干脂质体处方:叶黄素40mg注射用大豆磷脂650mg胆固醇43.0mg土温-800.375mg(0.5mg/ml土温-80的溶液0.75ml)。三氯甲烷10ml蔗糖1.95g磷酸盐缓冲液加至50ml配制方法:称取处方量的叶黄素、注射用大豆磷脂、胆固醇和吐温-80,用10ml三氯甲烷充分溶解,所得溶液置于旋蒸瓶中;将装有上述混合溶液的旋蒸瓶置于40℃,100rpm的旋转蒸发仪上减压旋蒸120min,充分除去三氯甲烷,使形成一层均匀的黄色薄膜;将0.05mol/mlph约为7的磷酸盐缓冲液50ml加入旋蒸瓶中,然后在常温下以100rpm速度旋转1h充分水化,水化后得到叶黄素脂质体混悬液;将叶黄素脂质体混悬液置于超声功率为400w的超声仪中水浴超声3min;将超声后的叶黄素脂质体混悬液经0.22μm的亲水性微孔滤膜反复过滤3次,即得含叶黄素脂质体混悬液。加入支撑剂蔗糖1.95g,使溶解,搅拌均匀,冷冻干燥,该冻干方法为:①预冻:先将叶黄素脂质体混悬液放入冷冻干燥机中,将温度迅速降至-40~-45℃,保温3~5小时;②升华:在减压下将预冻的叶黄素脂质体的温度升至-19.5℃(一般升华温度不高于共熔点温度),升华时间15小时;③干燥:在减压下,将升华后的叶黄素脂质体的温度升高到30~40℃,保温12小时;即获得叶黄素冷冻干燥的脂质体。经测试,本发明制得的含叶黄素脂质体粒径均一,结构稳定。实施例9:叶黄素冻干脂质体处方:叶黄素50mg注射用大豆磷脂680mg胆固醇45mg土温-800.375mg(0.5mg/ml土温-80的溶液0.75ml)。三氯甲烷10ml蔗糖2.04g磷酸盐缓冲液加至50ml配制方法:称取处方量的叶黄素、注射用大豆磷脂、胆固醇和吐温-80,用10ml三氯甲烷充分溶解,所得溶液置于旋蒸瓶中;将装有上述混合溶液的旋蒸瓶置于40℃,100rpm的旋转蒸发仪上减压旋蒸120min,充分除去三氯甲烷,使形成一层均匀的黄色薄膜;将0.05mol/mlph约为7的磷酸盐缓冲液50ml加入旋蒸瓶中,然后在常温下以100rpm速度旋转1h充分水化,水化后得到叶黄素脂质体混悬液;将叶黄素脂质体混悬液置于超声功率为400w的超声仪中水浴超声3min;将超声后的叶黄素脂质体混悬液经0.22μm的亲水性微孔滤膜反复过滤3次,即得含叶黄素脂质体混悬液。加入支撑剂蔗糖2.04g,使溶解,搅拌均匀,冷冻干燥,该冻干方法为:①预冻:先将叶黄素脂质体混悬液放入冷冻干燥机中,将温度迅速降至-40~-45℃,保温3~5小时;②升华:在减压下将预冻的叶黄素脂质体的温度升至-19.5℃(一般升华温度不高于共熔点温度),升华时间15小时;③干燥:在减压下,将升华后的叶黄素脂质体的温度升高到30~40℃,保温12小时;即获得叶黄素冷冻干燥的脂质体。经测试,本发明制得的含叶黄素脂质体粒径均一,结构稳定。实施例10:叶黄素冻干脂质体处方:叶黄素60mg注射用大豆磷脂750mg胆固醇50mgf680.75mg三氯甲烷10ml蔗糖2.25g磷酸盐缓冲液加至50ml配制方法:称取处方量的叶黄素、注射用大豆磷脂、胆固醇和f68,用10ml三氯甲烷充分溶解,所得溶液置于旋蒸瓶中;将装有上述混合溶液的旋蒸瓶置于40℃,100rpm的旋转蒸发仪上减压旋蒸120min,充分除去三氯甲烷,使形成一层均匀的黄色薄膜;将0.05mol/mlph约为7的磷酸盐缓冲液50ml加入旋蒸瓶中,然后在常温下以100rpm速度旋转1h充分水化,水化后得到叶黄素脂质体混悬液;将叶黄素脂质体混悬液置于超声功率为400w的超声仪中水浴超声3min;将超声后的叶黄素脂质体混悬液经0.22μm的亲水性微孔滤膜反复过滤3次,即得含叶黄素脂质体混悬液。加入支撑剂蔗糖2.25g,使溶解,搅拌均匀,冷冻干燥,该冻干方法为:①预冻:先将叶黄素脂质体混悬液放入冷冻干燥机中,将温度迅速降至-40~-45℃,保温3~5小时;②升华:在减压下将预冻的叶黄素脂质体的温度升至-19.5℃(一般升华温度不高于共熔点温度),升华时间15小时;③干燥:在减压下,将升华后的叶黄素脂质体的温度升高到30~40℃,保温12小时;即获得叶黄素冷冻干燥的脂质体。经测试,本发明制得的含叶黄素脂质体粒径均一,结构稳定。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1