一种pH响应与肿瘤靶向的抗癌药物载体及其制备方法与流程
本发明涉及一种ph响应与肿瘤靶向的抗癌药物载体及其制备方法,属于医药化学领域。
背景技术:
癌症一直以来都是人们闻风丧胆的最可怕的疾病之一,而由于化疗过程中药物的副作用对人体损伤较大,改善药物对癌细胞的特异性则变得至关重要。癌细胞周围环境ph值与正常组织细胞相比较低,且癌细胞表面存在过度表达的特异性受体,例如对ha特异性的cd44受体,这在正常组织细胞中是没有的。癌细胞的耐药性也是人们最头疼的特性之一。
药物载体自从被发现以来就广泛研究于抗癌药物方面,它可以利用其自身的ph敏感性以及靶向性减少药物对人体正常细胞的毒副作用并提高药物的利用率。氨基酸类药物载体具有较好的生物相容性,可生物降解等优点,因而广泛受到研究学者们的认可,天冬氨酸由于具有易于修饰的优点被广泛地关注,并通过改性获得ph敏感性及靶向性。例如陈秋池等人对聚天冬氨酸进行修饰得到可负载阿霉素的靶向载体,但该研究疏水段利用了组氨酸,接枝率最大仅达到17%,载药率最高仅达到19.2%,载药率低。himabinduruttala等人利用天冬氨酸、酪氨酸与乙二醇形成具有ph响应及氧化还原效应的三嵌段共聚物载体,同时负载了氯尼达明和多烯紫杉醇两种药物,但仍然存在载药率低的问题,最高仅达到25%。
技术实现要素:
本发明旨在提供一种ph响应与肿瘤靶向的抗癌药物载体及其制备方法,该抗癌药物载体实现了两种药物同时负载,利用药物的协同作用来应对肿瘤的耐药性。
本发明利用聚天冬氨酸接枝酪氨酸形成自组装纳米胶束,并用透明质酸进行靶向修饰,得到了性能优良的ph响应与肿瘤靶向的双药抗癌药物载体;本发明以聚氨基酸为基础,提高了对疏水性药物载药率,可同时负载两种药物,并赋予药物释放的ph敏感性以及靶向性。
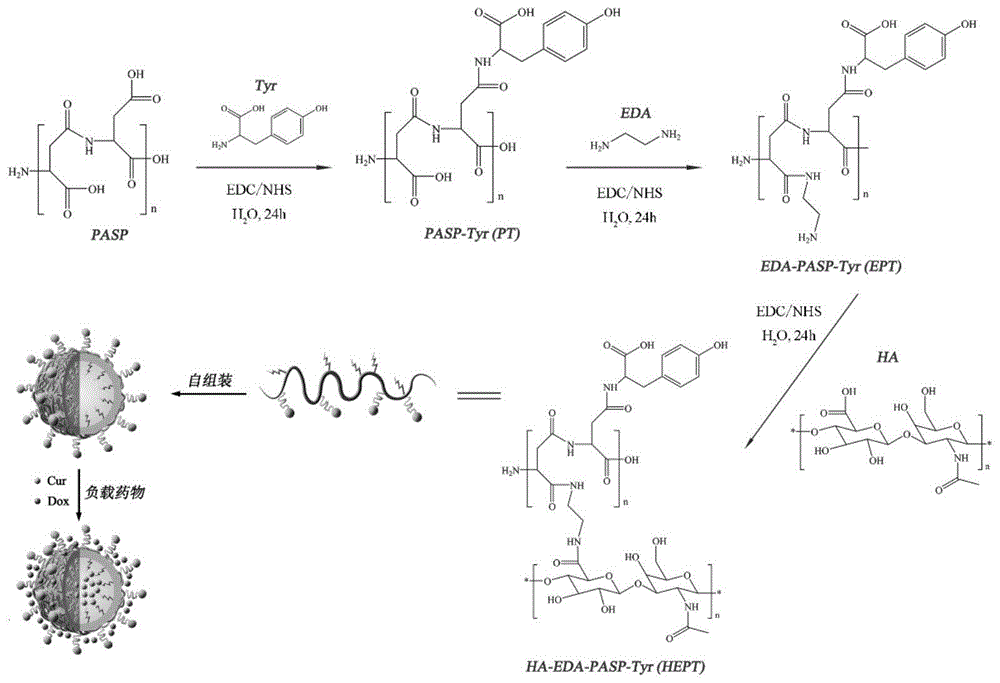
本发明提供了一种ph响应与肿瘤靶向的抗癌药物载体,聚天冬氨酸(pasp)作为亲水段,酪氨酸(tyr)作为疏水段,透明质酸(ha)作为靶向配体,该双亲聚合物自组装形成胶束,作为抗癌药物载体。具体地说,以聚天冬氨酸为原料,通过酰胺化反应将酪氨酸接枝到聚天冬氨酸侧链形成具有双亲性的聚天冬氨酸-酪氨酸接枝物,该接枝物在水相中自组装形成纳米胶束,在此基础上通过酰胺化反应在聚天冬氨酸侧链接枝乙二胺,并以乙二胺作为桥梁接枝透明质酸作为靶向配体,赋予胶束对癌细胞的靶向作用,在此基础上能同时负载两种抗癌药物。
本发明提供了上述ph响应与肿瘤靶向的抗癌药物载体的制备方法,包括以下步骤:
(1)聚天冬氨酸-酪氨酸接枝物(pt)的制备:取酪氨酸加入水中(浓度为0.006~0.1mol/l)进行超声分散20min备用,另取聚天冬氨酸溶解于水中(浓度为0.002~0.01mol/l),加入碳二亚胺(edc)与n-羟基琥珀酰亚胺(nhs)搅拌反应40min,再加入之前备用的酪氨酸水分散液,搅拌反应24h,过滤除去未反应的酪氨酸,将滤液透析三天(透析袋截留分子量为2000da),干燥,研磨得到pt粉末;
(2)乙二胺-聚天冬氨酸-酪氨酸(ept)的制备:将步骤(1)所制备的pt溶解于水中,加入edc/nhs搅拌反应40min,再滴加乙二胺(eda),搅拌反应24h,透析三天,干燥、研磨得到ept粉末;
(3)透明质酸-乙二胺-聚天冬氨酸-酪氨酸(hept)的制备:将透明质酸(ha)溶解于水中(浓度为0.8~4mmol/l),加入edc/nhs搅拌反应40min,再加入ept粉末,搅拌反应24h,透析三天,干燥、研磨得到hept粉末,即为ph响应与肿瘤靶向的抗癌药物载体。
上述的制备方法,步骤(1)中聚天冬氨酸分子量为4000~5000da,聚天冬氨酸溶液浓度为0.002~0.01mol/l,酪氨酸分散液浓度为0.006~0.1mol/l,反应摩尔比pasp:tyr:edc:nhs为1:3~10:1~5:1~5,反应温度常温。
上述的制备方法,步骤(2)中反应摩尔比pt:eda:edc:nhs为1:3~10:1~5:1~5,反应温度常温。
上述的制备方法,步骤(3)中透明质酸溶液浓度为0.8~4mmol/l,反应摩尔比ha:ept:edc:nhs为1:3~10:1~5:1~5,反应温度常温。
本发明提供了上述ph响应与肿瘤靶向的抗癌药物载体的应用,其特征在于:以姜黄素作为疏水药物模型,盐酸阿霉素作为亲水药物模型,实现对两种药物的同时负载,且载药率较高。
所述的应用,包括以下步骤:
(1)负载姜黄素纳米粒的制备:将hept粉末加入到姜黄素(cur)的乙醇溶液中(浓度为0.4~0.6mg/ml),超声10min,搅拌24h后转移到透析袋中用去离子水透析两天以上除去未负载上的姜黄素,冷冻干燥后得到负载姜黄素cur@hept粉末;
(2)同时负载姜黄素及盐酸阿霉素(dox)纳米粒(cur@dox@hept)的制备:将cur@hept粉末加入到盐酸阿霉素的水溶液中(浓度为0.4~0.6mg/ml),超声10min,搅拌24h后离心,除去上清液,冷冻干燥后得到cur@dox@hept粉末。
上述应用中,步骤(1)利用渗析法对姜黄素进行负载,姜黄素的乙醇溶液浓度为0.4~0.6mg/ml。
上述应用中,步骤(2)通过物理共混方法对盐酸阿霉素进行负载,盐酸阿霉素溶液浓度为0.4~0.6mg/ml。
本发明的有益效果:
(1)本发明使用位阻更大的酪氨酸,使得胶束空间更大,接枝率更高(可达26%),载药率更是提高30%以上;提供的抗癌药物载体的制备方法得到的载药纳米颗粒载药率较高;
(2)本发明能同时负载亲疏水性不同的两种以上药物,从而在实现药物联合治疗的同时可降低肿瘤细胞对药物的抗药性,对疏水性药物具有明显的ph敏感性,对cd44受体过表达的肿瘤细胞具有靶向性,且无毒无害,操作简便;
(3)本发明使用透明质酸作为靶向配体,可解决陈秋池等人研究中使用叶酸引起的溶解性差、反应效果差的问题;
(4)本发明充分利用了载体兼具亲水部分和疏水部分的特点,实现了两种亲疏水性不同药物的同时负载,一方面可利用两种药物不同的抗癌机理实现联合治疗,同时可降低肿瘤细胞对药物的抗药性,而且对疏水性药物的高效负载可解决这类药物由于水溶性差而难以递送的难题。
附图说明
图1是本发明纳米粒反应合成流程示意图。
图2是实施例1中pasp、pt、hept的核磁氢谱对比图。
图3是实施例1中药物载体的透射电镜图。
图4是实施例1中载双药纳米粒对姜黄素和阿霉素的体外缓释曲线图。
图5是实施例1中空载体hept、姜黄素与阿霉素按比例混合、载双药纳米粒三种材料对hct-116细胞的细胞毒性图。
具体实施方式
下面通过实施例来进一步说明本发明,但不局限于以下实施例。
实施例1:
本实施例提供一种ph响应及肿瘤靶向的双药抗癌药物载体及其制备方法,该制备过程如附图1所示,具体步骤如下:
(1)聚天冬氨酸-酪氨酸接枝物(pt)的制备:称取0.36g酪氨酸加入到20ml水中进行超声分散20min备用,另取0.8g聚天冬氨酸溶解于20ml水中,再加入0.192g碳二亚胺(edc)与0.115gn-羟基琥珀酰亚胺(nhs)搅拌反应40min,再加入之前备用的酪氨酸水分散液,搅拌反应24h,过滤除去未反应的酪氨酸,将滤液用2000da的透析袋透析三天,50°c条件下干燥后研磨得到pt粉末;
(2)乙二胺-聚天冬氨酸-酪氨酸(ept)的制备:将步骤(1)所制备的pt粉末取80mg溶解于30ml水中,加入19.2mgedc与14mgnhs搅拌反应40min,再滴加一滴乙二胺(eda),搅拌反应24h,用2000da的透析袋透析三天,50°c条件下干燥后研磨得到ept粉末;
(3)透明质酸-乙二胺-聚天冬氨酸-酪氨酸(hept)的制备:将30mg透明质酸(ha)溶解于30ml水中,加入58mgedc与48mgnhs搅拌反应40min,再加入100mgept粉末,搅拌反应24h,用2000da的透析袋透析三天,50°c条件下干燥后研磨得到hept粉末,如附图2核磁共振氢谱图所示,在2.4-2.7ppm处为化学式图中聚天冬氨酸部分1号亚甲基的质子化学位移,在3.0处对应酪氨酸部分2号亚甲基的质子化学位移,在1.9ppm处为透明质酸部分3号甲基质子的化学位移,3.2-3.8ppm对应ha中4,5,6,7号质子化学位移,由此可证明成功得到hept载体;
(4)负载姜黄素(cur)纳米粒(cur@hept)的制备:将12mg姜黄素加乙醇溶解并定容至20ml,配制成浓度为0.6mg/ml的姜黄素乙醇溶液,取10mghept粉末加入到配制好的姜黄素乙醇溶液中,超声10min,搅拌24h后,转移到2000da的透析袋中用去离子水透析两天以上除去未负载上的姜黄素,冷冻干燥后得到cur@hept粉末;
(5)同时负载姜黄素及盐酸阿霉素(dox)纳米粒(cur@dox@hept)的制备:将12mg盐酸阿霉素加水溶解并定容至20ml,配制成浓度为0.6mg/ml的盐酸阿霉素水溶液,取10mgcur@hept粉末加入到配制好的盐酸阿霉素的水溶液中,超声10min,搅拌24h后离心,倒掉上清液后冷冻干燥得到cur@dox@hept粉末,载药纳米粒的透射电镜图如附图3所示,在中性条件下纳米粒子主要呈球形,且粒径在200nm以内,而在酸性条件下纳米粒子体积显著胀大,结构受到破坏,有利于药物释放。由此可以看出具有明显的ph响应性。
性能测试:
(1)载药率测试:取实施例1步骤(4)中制得的cur@hept粉末3mg,加无水乙醇定容至20ml,超声10min后用紫外分光光度计对上清液测试425nm吸光度为,利用标准曲线换算出姜黄素的浓度,从而获得3mgcur@hept粉末中姜黄素的载药量为2.066mg。在实施例1步骤(5)中离心过程后利用紫外分光光度计测定上清液中290nm的吸光度为,利用标准曲线换算出阿霉素的浓度,从而获得未载上的阿霉素的质量,进而换算出阿霉素的载药量3.52mg。根据载药率公式:
计算得出载体对姜黄素的载药率为68.8%,对阿霉素的载药率为53.0%。cur@dox@hept纳米粒中含姜黄素50.9%,含阿霉素26%。
(2)缓释性能测试:取10mgcur@dox@hept粉末均分为两份分别溶于ph为7.4和ph为5.4的磷酸盐缓冲液(pbs)中,于37℃恒温水浴振荡条件下利用透析法进行体外缓释实验。由附图4可知,载体对姜黄素的释放存在较明显的ph响应性,在ph7.4条件下,姜黄素的释放速度缓慢且最终释放量仅达到23%左右,而在ph5.4条件下则释放速度快,最终释放量达到80%左右。对阿霉素的释放,ph响应性不明显,但累计释放量均达到80%以上。
(3)细胞毒性测试:细胞生长培养基按照90%mccoy’s5a+10%fbs+1xp/s配制,储存在4℃备用。将hct-116按2000细胞/孔,接种于96孔板中,细胞板置于37°c,5%co2培养箱,孵育过夜。测试组每孔加入实施例1中的纯hept溶液,cur+dox溶液和cur@dox@hept溶液,于37°c条件下,5%co2培养箱,避光分别孵育72小时。结束孵育后,在细胞中加入cck8(10μl/孔),置于37°c,5%co2培养箱中孵育2~4小时。在酶标仪上测定450nm波长处的吸光度,根据以下公式计算存活率:
其中odtreated为有实施例1样品的细胞的吸光度,odcontrolled为无实施例1样品的细胞的吸光度(细胞+培养基+dmso)。
由附图5中细胞毒性结果可以看出,加入纯hept载体的细胞存活率普遍较高,甚至在高浓度条件下细胞生长较迅速,由此可见载体本身对hct-116细胞几乎没有毒性,对组织基本没有损害。纯药物对hct-116有较高的毒性,在2μg/ml时细胞存活率仅为12%。加入hept载药纳米粒子的hct-116细胞毒性则更大,与纯药物相比,癌细胞的存活率更低,在0.08μg/ml浓度下表现更为明显,二者细胞存活率相差达到20%左右。而实际上在实验过程中载体的存在使得相同浓度条件下载药纳米粒子中药物浓度比纯药物较低,而即使在这样的条件下载药纳米粒子的毒性仍然更强,由此可见靶向载体hept对药效有较好的促进作用,这是因为载体的ha靶向配体可与hct-116细胞上的受体结合,更容易被细胞吞噬,使药物进入细胞内部进而杀死细胞。以上测试结果证明靶向载体对癌细胞的确有靶向结合及促进药效的作用。
实施例2:
本实施例提供一种ph响应及肿瘤靶向的双药抗癌药物载体及其制备方法,具体步骤如下:
(1)聚天冬氨酸-酪氨酸接枝物(pt)的制备:称取0.108g酪氨酸加入到20ml水中进行超声分散20min备用,另取0.8g聚天冬氨酸溶解于50ml水中,再加入0.038g碳二亚胺(edc)与0.023gn-羟基琥珀酰亚胺(nhs)搅拌反应40min,再加入之前备用的酪氨酸水分散液,搅拌反应24h,过滤除去未反应的酪氨酸,将滤液用2000da的透析袋透析三天,50°c条件下干燥后研磨得到pt粉末;
(2)乙二胺-聚天冬氨酸-酪氨酸(ept)的制备:将步骤(1)所制备的pt粉末取80mg溶解于水中,加入3.8mgedc与2.8mgnhs搅拌反应40min,再滴加一滴乙二胺(eda),搅拌反应24h,用2000da的透析袋透析三天,50°c条件下干燥后研磨得到ept粉末;
(3)透明质酸-乙二胺-聚天冬氨酸-酪氨酸(hept)的制备:将30mg透明质酸(ha)溶解于40ml水中,加入11.6mgedc与9.6mgnhs搅拌反应40min,再加入30mgept粉末,搅拌反应24h,用2000da的透析袋透析三天,50°c条件下干燥后研磨得到hept粉末;
(4)负载姜黄素(cur)纳米粒(cur@hept)的制备:将8mg姜黄素加乙醇溶解并定容至20ml,配制成浓度为0.4mg/ml的姜黄素乙醇溶液,取10mghept粉末加入到配制好的姜黄素乙醇溶液中,超声10min,搅拌24h后,转移到2000da的透析袋中用去离子水透析两天以上除去未负载上的姜黄素,冷冻干燥后得到cur@hept粉末;
(5)同时负载姜黄素及盐酸阿霉素(dox)纳米粒(cur@dox@hept)的制备:将8mg盐酸阿霉素加水溶解并定容至20ml,配制成浓度为0.4mg/ml的盐酸阿霉素水溶液,取10mgcur@hept粉末加入到配制好的盐酸阿霉素水溶液中,超声10min,搅拌24h后离心,倒掉上清液后冷冻干燥得到cur@dox@hept粉末。
实施例3:
本实施例提供一种ph响应及肿瘤靶向的双药抗癌药物载体及其制备方法,具体步骤如下:
(1)聚天冬氨酸-酪氨酸接枝物(pt)的制备:称取0.18g酪氨酸加入到20ml水中进行超声分散20min备用,另取0.8g聚天冬氨酸溶解于20ml水中,再加入0.038g碳二亚胺(edc)与0.023gn-羟基琥珀酰亚胺(nhs)搅拌反应40min,再加入之前备用的酪氨酸水分散液,搅拌反应24h,过滤除去未反应的酪氨酸,将滤液用2000da的透析袋透析三天,50°c条件下干燥后研磨得到pt粉末;
(2)乙二胺-聚天冬氨酸-酪氨酸(ept)的制备:将步骤(1)所制备的pt粉末取80mg溶解于水中,加入3.8mgedc与2.8mgnhs搅拌反应40min,再滴加一滴乙二胺(eda),搅拌反应24h,用2000da的透析袋透析三天,50°c条件下干燥后研磨得到ept粉末;
(3)透明质酸-乙二胺-聚天冬氨酸-酪氨酸(hept)的制备:将30mg透明质酸(ha)溶解于50ml水中,加入11.6mgedc与9.6mgnhs搅拌反应40min,再加入50mgept粉末,搅拌反应24h,用2000da的透析袋透析三天,50°c条件下干燥后研磨得到hept粉末;
(4)负载姜黄素(cur)纳米粒(cur@hept)的制备:将10mg姜黄素加乙醇溶解并定容至20ml,配制成浓度为0.5mg/ml的姜黄素乙醇溶液,取10mghept粉末加入到配制好的姜黄素乙醇溶液中,超声10min,搅拌24h后,转移到2000da的透析袋中用去离子水透析两天以上除去未负载上的姜黄素,冷冻干燥后得到cur@hept粉末;
(5)同时负载姜黄素及盐酸阿霉素(dox)纳米粒(cur@dox@hept)的制备:将10mg盐酸阿霉素加水溶解并定容至20ml,配制成浓度为0.5mg/ml的盐酸阿霉素水溶液,取10mgcur@hept粉末加入到配制好的盐酸阿霉素的水溶液中,超声10min,搅拌24h后离心,倒掉上清液后冷冻干燥得到cur@dox@hept粉末。
实施例4:
本实施例提供一种ph响应及肿瘤靶向的双药抗癌药物载体及其制备方法,具体步骤如下:
(1)聚天冬氨酸-酪氨酸接枝物(pt)的制备:称取0.36g酪氨酸加入到20ml水中进行超声分散20min备用,另取0.8g聚天冬氨酸溶解于50ml水中,再加入0.192g碳二亚胺(edc)与0.115gn-羟基琥珀酰亚胺(nhs)搅拌反应40min,再加入之前备用的酪氨酸水分散液,搅拌反应24h,过滤除去未反应的酪氨酸,将滤液用2000da的透析袋透析三天,50°c条件下干燥后研磨得到pt粉末;
(2)乙二胺-聚天冬氨酸-酪氨酸(ept)的制备:将步骤(1)所制备的pt粉末取80mg溶解于40ml水中,加入19.2mgedc与14mgnhs搅拌反应40min,再滴加一滴乙二胺(eda),搅拌反应24h,用2000da的透析袋透析三天,50°c条件下干燥后研磨得到ept粉末;
(3)透明质酸-乙二胺-聚天冬氨酸-酪氨酸(hept)的制备:将30mg透明质酸(ha)溶解于30ml水中,加入58mgedc与48mgnhs搅拌反应40min,再加入100mgept粉末,搅拌反应24h,用2000da的透析袋透析三天,50°c条件下干燥后研磨得到hept粉末;
(4)负载姜黄素(cur)纳米粒(cur@hept)的制备:将12mg姜黄素加乙醇溶解并定容至20ml,配制成浓度为0.6mg/ml的姜黄素乙醇溶液,取10mghept粉末加入到配制好的姜黄素乙醇溶液中,超声10min,搅拌24h后,转移到2000da的透析袋中用去离子水透析两天以上除去未负载上的姜黄素,冷冻干燥后得到cur@hept粉末;
(5)同时负载姜黄素及盐酸阿霉素(dox)纳米粒(cur@dox@hept)的制备:将12mg盐酸阿霉素加水溶解并定容至20ml,配制成浓度为0.6mg/ml的盐酸阿霉素水溶液,取10mgcur@hept粉末加入到配制好的盐酸阿霉素水溶液中,超声10min,搅拌24h后离心,倒掉上清液后冷冻干燥得到cur@dox@hept粉末。
实施例5:
本实施例提供一种ph响应及肿瘤靶向的双药抗癌药物载体及其制备方法,具体步骤如下:
(1)聚天冬氨酸-酪氨酸接枝物(pt)的制备:称取0.36g酪氨酸加入到30ml水中进行超声分散20min备用,另取0.8g聚天冬氨酸溶解于40ml水中,再加入0.192g碳二亚胺(edc)与0.115gn-羟基琥珀酰亚胺(nhs)搅拌反应40min,再加入之前备用的酪氨酸水分散液,搅拌反应24h,过滤除去未反应的酪氨酸,将滤液用2000da的透析袋透析三天,50°c条件下干燥后研磨得到pt粉末;
(2)乙二胺-聚天冬氨酸-酪氨酸(ept)的制备:将步骤(1)所制备的pt粉末取80mg溶解于30ml水中,加入19.2mgedc与14mgnhs搅拌反应40min,再滴加一滴乙二胺(eda),搅拌反应24h,用2000da的透析袋透析三天,50°c条件下干燥后研磨得到ept粉末;
(3)透明质酸-乙二胺-聚天冬氨酸-酪氨酸(hept)的制备:将30mg透明质酸(ha)溶解于50ml水中,加入58mgedc与48mgnhs搅拌反应40min,再加入100mgept粉末,搅拌反应24h,用2000da的透析袋透析三天,50°c条件下干燥后研磨得到hept粉末;
(4)负载姜黄素(cur)纳米粒(cur@hept)的制备:将12mg姜黄素加乙醇溶解并定容至20ml,配制成浓度为0.6mg/ml的姜黄素乙醇溶液,取10mghept粉末加入到配制好的姜黄素乙醇溶液中,超声10min,搅拌24h后,转移到2000da的透析袋中用去离子水透析两天以上除去未负载上的姜黄素,冷冻干燥后得到cur@hept粉末;
(5)同时负载姜黄素及盐酸阿霉素(dox)纳米粒(cur@dox@hept)的制备:将12mg盐酸阿霉素加水溶解并定容至20ml,配制成浓度为0.6mg/ml的盐酸阿霉素水溶液,取10mgcur@hept粉末加入到配制好的盐酸阿霉素水溶液中,超声10min,搅拌24h后离心,倒掉上清液后冷冻干燥得到cur@dox@hept粉末。
实施例6:
本实施例提供一种ph响应及肿瘤靶向的双药抗癌药物载体及其制备方法,具体步骤如下:
(1)聚天冬氨酸-酪氨酸接枝物(pt)的制备:称取0.36g酪氨酸加入到50ml水中进行超声分散20min备用,另取0.8g聚天冬氨酸溶解于30ml水中,再加入0.192g碳二亚胺(edc)与0.115gn-羟基琥珀酰亚胺(nhs)搅拌反应40min,再加入之前备用的酪氨酸水分散液,搅拌反应24h,过滤除去未反应的酪氨酸,将滤液用2000da的透析袋透析三天,50°c条件下干燥后研磨得到pt粉末;
(2)乙二胺-聚天冬氨酸-酪氨酸(ept)的制备:将步骤(1)所制备的pt粉末取80mg溶解于30ml水中,加入19.2mgedc与14mgnhs搅拌反应40min,再滴加一滴乙二胺(eda),搅拌反应24h,用2000da的透析袋透析三天,50°c条件下干燥后研磨得到ept粉末;
(3)透明质酸-乙二胺-聚天冬氨酸-酪氨酸(hept)的制备:将40mg透明质酸(ha)溶解于50ml水中,加入58mgedc与48mgnhs搅拌反应40min,再加入100mgept粉末,搅拌反应24h,用2000da的透析袋透析三天,50°c条件下干燥后研磨得到hept粉末;
(4)负载姜黄素(cur)纳米粒(cur@hept)的制备:将12mg姜黄素加乙醇溶解并定容至20ml,配制成浓度为0.6mg/ml的姜黄素乙醇溶液,取10mghept粉末加入到配制好的姜黄素乙醇溶液中,超声10min,搅拌24h后,转移到2000da的透析袋中用去离子水透析两天以上除去未负载上的姜黄素,冷冻干燥后得到cur@hept粉末;
(5)同时负载姜黄素及盐酸阿霉素(dox)纳米粒(cur@dox@hept)的制备:将12mg盐酸阿霉素加水溶解并定容至20ml,配制成浓度为0.6mg/ml的盐酸阿霉素水溶液,取10mgcur@hept粉末加入到配制好的盐酸阿霉素的水溶液中,超声10min,搅拌24h后离心,倒掉上清液后冷冻干燥得到cur@dox@hept粉末。
- 还没有人留言评论。精彩留言会获得点赞!