双配体靶向协同调控肾素血管紧张素系统的共组装纳米药物的制备方法与用途与流程
[0001]
本发明属于纳米医药技术领域,尤其涉及一种双配体靶向协同调控肾素血管紧张素系统的共组装纳米药物的制备方法与用途,本发明还涉及该药物的制备方法以及在制备治疗心梗药物中的用途。
背景技术:
[0002]
人体内的肾素-血管紧张素系统(ras)在心肌梗塞的发生发展中起到了重要作用,该系统的失衡会加速疾病的发展。该系统中存在两个作用轴,分别是以血管紧张素ⅱ受体1为靶点的负性作用轴,以及以mas受体为靶点的正性作用轴。既往已有针对两轴的研究,如使用替米沙坦和血管紧张素1-7治疗心血管疾病,但在心梗治疗上,目前还没有针对ras双受体的协同调控的应用,另外由于arb药物与血管紧张素1-7的理化性质差异,使得两者难以单纯结合应用。
[0003]
本发明提出一种了双配体靶向协同调控肾素血管紧张素系统的共组装纳米药物的制备方法与用途,目前未见对此类化合物的任何报道。
技术实现要素:
[0004]
本发明提出了双配体靶向协同调控肾素血管紧张素系统的共组装纳米药物的制备方法与用途,以解决在心梗治疗上,缺乏针对ras双受体协同调控药物的问题,本发明的另一个目的是研究该新型纳米药物改善心梗的用途。
[0005]
本发明提出双配体靶向协同调控肾素血管紧张素系统的共组装纳米药物的制备方法与用途,包括以下步骤:
[0006]
替米沙坦溶于二甲基亚砜得到替米沙坦溶液并加热备用;
[0007]
制备第一多肽;
[0008]
所述第一多肽加入磷酸盐缓冲液,用碳酸盐溶液调节其酸碱值,并超声溶解,得到第一多肽溶液;
[0009]
将所述第一多肽溶液加热至沸腾后冷却,加入所述替米沙坦溶液,混匀后置于水中反应,得到共组装纳米水凝胶;
[0010]
最后通过高速离心去除所述共组装纳米水凝胶中未反应的替米沙坦,冻干后以制得双配体靶向协同调控肾素血管紧张素系统的共组装纳米药物。
[0011]
其中,所述制备第一多肽包括以下步骤:
[0012]
制备nbd封端基团;
[0013]
用二氯甲烷将二氯树脂溶胀;
[0014]
以所述二氯树脂作为固相载体,并按照预设顺序依次加fmoc系列保护氨基酸和所述nbd封端基团,并经n,n-二甲基甲酰胺处理后得到含肽链的树脂;
[0015]
用二氯甲烷洗净树脂中的n,n-二甲基甲酰胺,加入三氟乙酸将肽链从树脂上切下
来;
[0016]
真空旋转蒸发除去三氟乙酸,得到粘稠的液体后加入无水乙醚析出的沉淀即为产物;
[0017]
产物经高效液相色谱提纯后即可得到第一多肽。
[0018]
其中,所述制备nbd封端基团包括如下步骤:
[0019]
将β-丙氨酸和碳酸钾按第一质量比溶入甲醇和水的混合液中,并在氮气保护下进行搅拌,得到第一混合溶液;
[0020]
将nbd-cl溶入甲醇中,得到第二混合溶液;
[0021]
将所述第二混合液缓慢注入到所述第一混合溶液中,在室温下进行反应,直到反应完成,得到第一反应液;
[0022]
除去所述第一反应液中的甲醇,并用盐酸将剩余水溶液的酸碱值调节至预设范围得到第三混合溶液;
[0023]
过滤所述第三混合溶液,得到滤液和棕黄色固体沉淀,收集棕黄色固体沉淀,得到第一产物;
[0024]
将所述滤液用无水乙醚或二氯甲烷萃取,收集有机相层,所述有机相层用无水硫酸镁干燥后除去有机溶剂,得到第二产物;
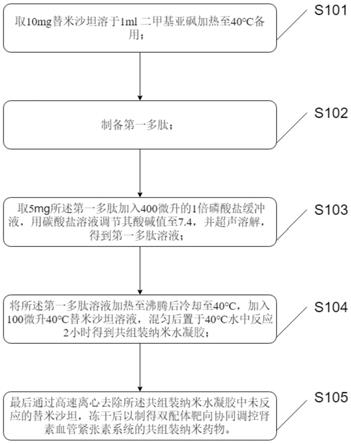
[0025]
所述第一产物和所述第二产物均为nbd封端基团。
[0026]
其中,所述第一多肽的序列为nbd-f
d
f
d
y
d-e
d
e
d-g-drvyihp。
[0027]
其中,所述预设顺序为fmoc脯氨酸、fmoc组氨酸、fmoc异亮氨酸、fmoc酪氨酸、fmoc缬氨酸、fmoc精氨酸、fmoc天冬氨酸、fmoc甘氨酸、d构型的fmoc谷氨酸、d构型的fmoc谷氨酸、d构型的fmoc酪氨酸、d构型的fmoc苯丙氨酸、d构型的fmoc苯丙氨酸、nbd封端基团。
[0028]
其中,所述以所述二氯树脂作为固相载体,并按照预设顺序依次加fmoc系列保护氨基酸和所述nbd封端基团,并经n,n-二甲基甲酰胺处理后得到含有肽链的树脂是指:
[0029]
称取fmoc脯氨酸与n,n-二异丙基乙胺,溶解在二氯甲烷中;
[0030]
用甲醇和n,n-二异丙基乙胺封闭二氯树脂;
[0031]
用二氯甲烷清洗后,再换用n,n-二甲基甲酰胺清洗,加入哌啶反应脱除fmoc脯氨酸上的氨基保护基;
[0032]
用n,n-二甲基甲酰胺清洗残余的哌啶,再加入下一个fmoc氨基酸,同时加入偶联剂和n,n-二异丙基乙胺,直到反应完成;
[0033]
用二氯甲烷清洗,再换用n,n-二甲基甲酰胺清洗,加入哌啶反应脱除fmoc氨基酸上的氨基保护基;
[0034]
按照预设顺序重复操作,直到所有fmoc氨基酸和nbd封端基团都被加入后,加入哌啶反应脱除nbd封端基团上的氨基保护基,用n,n-二甲基甲酰胺清洗,即得到含肽链的树脂。
[0035]
其中,所述酸碱值的预设范围为1-2。
[0036]
其中,所述第一质量比为0.489质量份的β-丙氨酸和2.07质量份的碳酸钾,所述第一混合溶液包括β-丙氨酸、碳酸钾、甲醇和水,所述第二混合溶液包括nbd-cl和甲醇。
[0037]
本发明还提出基于双配体靶向协同调控肾素血管紧张素系统的共组装纳米药物的制备方法制备的共组装纳米药物,包括1体积份的替米沙坦和4体积份的第一多肽。
[0038]
本发明还提出基于双配体靶向协同调控肾素血管紧张素系统的共组装纳米药物的制备方法制备的共组装纳米药物的用途在于调控治疗心梗疾病。
[0039]
本发明的有益效果为:通过制得第一多肽,使其通过加热—冷却自组装,并在该过程中加入替米沙坦,可以形成新的纳米粒子,从而实现针对ras的双受体协同调控,另外心梗过程中的生物分子学变化,使得含有替米沙坦的共组装纳米药物能富集心梗部位,从而赋予新的纳米粒子一定的靶向性能。
附图说明
[0040]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0041]
图1是本发明双配体靶向协同调控肾素血管紧张素系统的共组装纳米药物的制备方法与用途的流程结构示意图。
[0042]
图2是第一多肽合成的流程结构示意图。
[0043]
图3是nbd封端基团的制备流程示意图。
[0044]
图4是第一多肽中添加氨基酸的流程示意图。
[0045]
图5a左侧为修饰后的血管紧张素1-7多肽分子结构,右侧为替米沙坦分子结构;图5b为共组装纳米药物的合成过程。
[0046]
图6为双药在透射电镜记录下,随着时间推移,新的纳米药物逐渐形成的过程;
[0047]
图7a为替米沙坦的释放曲线与saa1-7的酶解曲线;图7b为替米沙坦的载药率与包载效率。
[0048]
图8为药物靶向性试验,a图为小鼠活体成像结果,b图为离体的脏器荧光显像结果。
[0049]
图9为各组药物治疗4周后心梗小鼠的超声结果及马松染色结果,a图为各组小鼠心脏b型超声及m型超声结果;b图为射血分数;c图为缩短分数;d图为左室舒张末径;e图左室收缩末径;f图为各组小鼠心脏马松染色。
具体实施方式
[0050]
下面详细描述本发明的实施例,所述实施例的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
[0051]
请参阅图1至图9,本发明提供一种技术方案:
[0052]
s101:取10mg替米沙坦溶于1ml二甲基亚砜加热至40℃备用;
[0053]
在本实施方式中,由于替米沙坦不溶于很多试剂,因此选择二甲基亚砜,通过将替米沙坦溶于二甲基亚砜,并保持一定的温度,能让替米沙坦与所述第一多肽的组装反应更充分,所述替米沙坦结构如下式:
[0054][0055]
s102:制备第一多肽;
[0056]
所述第一多肽的序列为nbd-f
d
f
d
y
d-e
d
e
d-g-drvyihp。
[0057]
在本实施方式中,所述第一多肽结构如下式:
[0058][0059]
通过合理修饰肾素-血管紧张素系统中的功能性生物分子——血管紧张素1-7多肽,使其通过加热—冷却自组装形成超分子水凝胶,在不改变其生物效能的基础上增加了共组装性能。
[0060]
s201:制备nbd封端基团;
[0061]
s301:将489mgβ-丙氨酸和2.07g的碳酸钾溶入50ml甲醇和少量水的混合液中,并在氮气保护下进行搅拌,得到第一混合溶液;
[0062]
s302:将1g nbd-cl溶于20ml甲醇中,得到第二混合溶液;
[0063]
s303:将所述第二混合液缓慢注入到所述第一混合溶液中,在室温下进行反应,直到反应完成,得到第一反应液;
[0064]
s304:真空旋转蒸发除去第一反应液中的甲醇,用2m hcl将剩余水溶液ph调节至1~2左右;
[0065]
s305:过滤所述第三混合溶液,得到滤液和棕黄色固体沉淀,收集棕黄色固体沉淀,得到第一产物;
[0066]
s306:滤液用无水乙醚或二氯甲烷萃取3次,收集有机相层,无水mgso4干燥2h后除去有机溶剂,得到第二产物;
[0067]
s307:所述第一产物和所述第二产物均为nbd封端基团,约980mg。
[0068]
在本实施方式中,通过按照0.489质量份的β-丙氨酸与2.07质量份的碳酸钾的质量比往甲醇中添加,能使得反应更充分,同时,多余产物尽可能的少,同时,由于甲醇的沸点较低,所以使用真空旋转蒸发的方式,将甲醇除去,将ph调节至酸性的目的在于便于沉淀的生成,使用无水乙醚或二氯甲烷萃取的目的是将水和盐酸等杂质粗略除去,使用无水硫酸镁则是进一步的除去有机层中的水分。
[0069]
s202:用二氯甲烷将二氯树脂溶胀5分钟;
[0070]
在本实施方式中,将二氯树脂溶胀的目的在于预处理二氯树脂,削弱二氯树脂上的大分子之间的作用力,使得其链段和分子整链的运动加速,分子链松动、解缠结能缩短二氯树脂的溶解时间。
[0071]
s203:以所述二氯树脂作为固相载体,并按照预设顺序依次加fmoc系列保护氨基酸和所述nbd封端基团,并经n,n-二甲基甲酰胺处理后得到含肽链的树脂;
[0072]
所述预设顺序为fmoc脯氨酸、fmoc组氨酸、fmoc异亮氨酸、fmoc酪氨酸、fmoc缬氨酸、fmoc精氨酸、fmoc天冬氨酸、fmoc甘氨酸、d构型的fmoc谷氨酸、d构型的fmoc谷氨酸、d构型的fmoc酪氨酸、d构型的fmoc苯丙氨酸、d构型的fmoc苯丙氨酸、nbd封端基团。
[0073]
所述以二氯树脂作为固相载体,并按照预设顺序依次加fmoc系列保护氨基酸和所述nbd封端基团,并经n,n-二甲基甲酰胺处理后得到树脂是指:
[0074]
s401:称取fmoc脯氨酸与相当于其2当量的n,n-二异丙基乙胺,溶解在二氯甲烷中,并在室温下与二氯树脂反应2小时;
[0075]
s402:用甲醇和n,n-二异丙基乙胺封闭二氯树脂,反应15~30分钟;
[0076]
s403:用二氯甲烷清洗5次,再换用n,n-二甲基甲酰胺清洗5次,加入20%的哌啶反应30min脱除fmoc脯氨酸上的氨基保护基fmoc;
[0077]
s404:用n,n-二甲基甲酰胺清洗残余的哌啶,加入下一个fmoc氨基酸,同时加入相同当量的偶联剂hbtu和相当于其2当量的n,n-二异丙基乙胺,反应2小时;
[0078]
s405:按照预设顺序重复操作步骤s403和s404,直到所有fmoc氨基酸和nbd封端基团都被加入后,加入20%的哌啶反应30分钟,脱除nbd封端基团上的氨基保护基,用n,n-二甲基甲酰胺清洗5次,即得到含有肽链的树脂。
[0079]
在本实施方式中,使用二氯树脂作为固相载体,通过固相合成方法,按照预设顺序,依次往二氯树脂上添加氨基酸,在添加第一个氨基酸后,封闭二氯树脂,并脱去第一个氨基酸的保护基,并添加第二个氨基酸、偶联剂和n,n-二异丙基乙胺,让第二个氨基酸被添加到第一个氨基酸上,如此按顺序添加,最后形成多肽链,即得到含有肽链的树脂。
[0080]
s204:用二氯甲烷洗净树脂中的n,n-二甲基甲酰胺,加入10ml的95%的三氟乙酸反应30分钟,将肽链从树脂上切下来;
[0081]
在本实施方式中,用三氟乙酸水解肽链和二氯树脂之间的酯键,即可得到粗产物。
[0082]
s205:真空旋转蒸发除去三氟乙酸,得到粘稠的液体后加入无水乙醚析出的沉淀即为产物;
[0083]
在本实施方式中,由于三氟乙酸的沸点较低,所以使用真空旋转蒸发的方式,将三氟乙酸除去,同时又利用无水乙醚,对第一多肽粗产物进行了干燥。
[0084]
s206:产物经液相色谱提纯后即可得到第一多肽。
[0085]
将粗产物通过高效液相色谱来进行提纯,以得到第一多肽。
[0086]
s103:取5mg所述第一多肽加入400微升的1倍磷酸盐缓冲液,用碳酸盐溶液调节其酸碱值至7.4,并超声溶解,得到第一多肽溶液;
[0087]
在本实施方式中,将酸碱值调节至7.4有利于第一多肽的溶解,并且有利于与替米沙坦共组装。
[0088]
s104:将所述第一多肽溶液加热至沸腾后冷却至40℃,加入100微升40℃替米沙坦溶液,混匀后置于40℃水中反应2小时得到共组装纳米水凝胶;
[0089]
s105:最后通过高速离心去除所述共组装纳米水凝胶中未反应的替米沙坦,冻干后以制得双配体靶向协同调控肾素血管紧张素系统的共组装纳米药物。
[0090]
本发明还提出基于双配体靶向协同调控肾素血管紧张素系统的共组装纳米药物
的制备方法制备的共组装纳米药物,包括1体积份的替米沙坦和4体积份的第一多肽。
[0091]
在本实施方式中,将所述第一多肽溶液加热至沸腾后冷却,能促发所述第一多肽自组装形成水凝胶,在加热冷却过程当中加入疏水药物替米沙坦,能够使两种药物共组装形成新的纳米药物,从而实现双药的协同运输,又由于心梗过程中的生物分子学变化,使得替米沙坦能富集心梗部位,从而赋予新的纳米粒子一定的靶向性能,优选的,替米沙坦所占摩尔比例为50%。
[0092]
s105:最后通过高速离心去除未反应的替米沙坦。
[0093]
基于双配体靶向协同调控肾素血管紧张素系统的共组装纳米药物的制备方法制备的共组装纳米药物在制备针对调控治疗心梗疾病的药物的应用。
[0094]
在本实施方式中,与单纯的物理混合相比,共组装纳米药物使双药能协同递送,各自发挥作用的同时,增加了一定靶向治疗性能。
[0095]
图5a中左侧为第一多肽,分为两部分,第一部分是自组装多肽序列,可以促使修饰后的多肽通过加热冷却自组装形成水凝胶;第二部分是血管紧张素1-7多肽序列,具有心脏保护功能;a图的右侧是替米沙坦的分子结构。b图为双药以成核-伸长的组装过程形成共组装纳米纤维。
[0096]
图6中使用透射电镜观察双药共组装过程。(1)按照上述制备好第一多肽与替米沙坦共组装的水凝胶,室温静置待检测用。(2)取出带有支持碳膜的铜网,用显微镊夹住铜网边缘,将静置0分钟,30分钟,60分钟,120分钟的共组装混合物吸出,轻轻滴加在铜网上。(3)1分钟后,用滤纸吸干铜网周围多余的液体,并用超纯水洗涤两次。(4)吸取10μl醋酸铀溶液滴到铜网上,染色30秒后,用滤纸吸干多余液体。(5)样品置于干燥器中过夜,可使用透射电镜观察。a图为加热冷却后0min双药分子尚处于游离状态,随着时间推移,b图中溶液中分子逐渐成核聚拢形,c图纤维结构逐渐形成,d图120min后双药共组装形成网格状纤维。
[0097]
图7a为替米沙坦的释放效率与saa1-7的酶解曲线。(1)将25mg得到的共组装纳米药物溶于5ml的pbs中,将ph调至7.4。(2)加入蛋白酶k(0.138毫克/毫升)后在37℃孵育24h。(3)在预定的时间点(0h-4h-8h-12h-16h-20h-24h)吸取500μl的样本,使用lc-ms分析替米沙坦的释放量及saa1-7的残余量。在加入蛋白酶k 24小时后,替米沙坦被完全释放,saa1-7还残余约50%,提示共组装纳米纤维一旦开始降解后,内部平衡被打破,替米沙坦会被缓慢释放,同时saa1-7有显著的抗酶解能力。图7b为共组装纳米纤维中替米沙坦的载药率与装载效率。(1)配制梯度tel标准品至少10管;取5mg提纯后的第一多肽充分溶于pbs中,随后与含有0.25mg,0.5mg,1mg,2mg质量tel混合使最终体积为0.5ml。(2)酒精灯加热至沸腾后冷却至40℃,40℃孵育2小时后。(3)未反应的tel通过高速离心15000xg,20分钟去除。(4)冻干所得最后产物经过lc-ms检测tel标准品及样品当中tel的含量。(5)绘制标准曲线计算样品中tel的含量,通过以下公式计算药物装载率(dl)及有效药物包裹率(ee)。
[0098][0099][0100]
结果显示替米沙坦的摩尔比例在50%时,载药量及包载效率达到最高;
[0101]
图8为c57bl/6小鼠(8
–
10周龄)心肌梗塞造模后,尾静脉注射各组药物后,对各组动物进行活体成像。(1)建立小鼠心梗模型。(2)手术后,以相同剂量(2mg/ml)通过尾静脉注射
cy5.5
tdcnfs,
cy5.5
saa1-7,
cy5.5
ang1-7。(3)在注射后1小时,12小时,24小时,使用活体成像仪检测药物分布。(4)24小时后将小鼠处死,解剖心脏及其他主要脏器,在激发波长630nm,发射波长700nm检测图像并分析。a图显示,mi+
cy5.5
tdcnfs组心脏区域显示出更强的信号,提示药物有明显的心脏部位聚集;b图为处死动物后,离体脏器的荧光信号结果,结果提示mi+
cy5.5
tdcnfs组心脏部位聚集明显,与体内结果一致。
[0102]
图9为c57bl/6小鼠(8
–
10周龄)心肌梗塞造模后,隔日尾静脉注射各组药物,28天后行心脏超声检查,评估心梗后心脏功能及马松染色。a图显示单纯造模组(mi)心腔扩大,心室壁变薄,搏动明显减弱,tdcnfs组较其他用药组能更好保护心脏收缩功能;b-e分别为射血分数、缩短分数、左室舒张末径、左室收缩末径,均显示tdcnfs组显示更好的心脏保护功能,延缓心室重塑;f图为各组心梗小鼠干预结束后心脏马松染色,tdcnfs组的梗死面积明显少于单纯造模组及其他用药组。
[0103]
其中,mi(单纯造模组),tdcnfs(共组装纳米药物),t+a(单纯物理混合替米沙坦+血管紧张素1-7),tel(替米沙坦),ang1-7(血管紧张素1-7),vehicle(乱序空载体)。
[0104]
本发明通过理性设计提供了一种与疏水药物替米沙坦共组装,形成新的纳米纤维的方法,利用该方法制备的纳米粒子,表现出不同的纳米纤维结构,更重要的在其改善心梗应用上表现出了更显著的效果,由于共组装的方式可以实现双药递送,所以能发挥各自药效的同时有协同靶向治疗的效果,而通过这种方式构建的材料将会比传统物理混合方法具备更好的生物学功能,本发明提供了一种双药共组装递送的策略,将引导开发出更出色治疗效果的纳米药物。
[0105]
以上所揭露的仅为本发明一种较佳实施例而已,当然不能以此来限定本发明之权利范围,本领域普通技术人员可以理解实现上述实施例的全部或部分流程,并依本发明权利要求所作的等同变化,仍属于发明所涵盖的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1