一种使用双光纤光镊实现细胞串列调整的光控技术的制作方法
本发明属于光电技术领域,具体涉及一种使用双光纤光镊实现细胞串列调整的光控技术。
背景技术:
邻近细胞间的相互作用对于细胞命运和功能调节具有极其重要的意义,包括细胞生长、组织分化、细胞间信号传递及机制力传导等,因而日益引起研究人员关注。细胞间相互作用方式主要包括两种:即通过可溶性信号分子交换和直接的胞间接触。然而,以上两种作用方式都随时间和空间而不断变化,具体而言:不同种类的细胞倾向于特定的细胞作用方式,同一种类细胞在距离不同时占优的作用方式也各不相同。当两个细胞紧密接触时,其倾向于采用直接接触所诱导的应力来对周围细胞施加力的作用及对周围环境变化作出反应;然而随着细胞间距逐渐增大,其倾向于分泌可溶性信号分子来对周围细胞施加影响。因此,实现细胞作用距离和连接顺序的动态调整,进而研究细胞间相互作用对于不同胞外环境因素的时空依赖性,对于细胞生物学及临床医学具有重要意义和潜在的应用价值。
目前,微阵列及微机械系统在多细胞结构化排列和组织形成的动态操控方面应用广泛:基于微纳加工技术制作特定的图案衬底,可将细胞有效局域安置在特定位置,进而实现接触间距不同时细胞相互作用方式的探索研究。最近研究表明,全息光镊在细胞排列和特定结构组装方面性能优越,通过精心设计的全息算法可实现任意三维结构的细胞排列。同时,通过控制激光束移动,可实现细胞阵列中特定细胞的取出和放回。除全息光镊之外,基于表面等离子体的等离纳米光镊在细胞排列和结构组织方面也具有重要应用。其利用特定纳米结构(蝴蝶结、单孔、双孔等)表面的等离子体共振可将光强增大几千倍,进而实现纳米级颗粒的稳定捕获与操控。目前为止,等离子体光镊已成功实现细胞、纳米颗粒(小至12nm)及单个蛋白质分子的捕获和排列。
目前报道的细胞串列调整方案中大多存在一定的局限性:基于微阵列及微机械系统实现细胞串列的组织过程中,细胞局限于精心制作的衬底表面,且细胞与衬底表面直接接触将引发潜在的细胞污染,进而影响系统的重复利用。而对于全息光镊,全息算法设计较为繁杂,且对于细胞特定排列结构的可控调整更具挑战性:因为在保持其余光束位置不变的同时需操控某一特定光束来移动细胞,从而给全息算法设计增加挑战。此外,全息光镊通常需要复杂的光学聚焦系统,包含二向分光镜、空间光束调制器和高数值孔径聚焦透镜等,从而在微纳光电平台的集成应用上面临挑战;并且,聚焦透镜较短的工作距离进一步限制了细胞在液体环境中的操控深度。对于等离纳米光镊,特定细胞组装类型仍取决于精心设计的光刻纳米基底,因而,细胞一旦被稳定捕获,位置相对固定,难以实现有效的动态调整。而且,细胞捕获范围局限于衬底表面,不利于大范围的细胞捕获和操控。
技术实现要素:
有鉴于此,本发明提供了一种基于双光纤光镊实现细胞串列有效组织和调整方案,其无需精心制作的光刻衬底且无操控深度限制,从而避免了潜在的样品污染,实现操控范围和捕获灵活性的有效提升。此外,通过精确调整光纤光镊的位置,可实现细胞串列的精确操控,包括调整细胞作用距离和改变细胞连接顺序等。
因此,本发明的第一目的在于提供一种用于调整细胞串列的双光纤光镊的制作方法,即通过熔融拉锥法制备双光纤光镊,并在末端具有不同的锥形结构。
优选地,本发明用于调整细胞串列的双光纤光镊的制作方法中,所述双光纤光镊的制作方法包括以下步骤:
1)将两个单模光纤分别去除缓冲层和聚合物涂覆层,并套上毛细玻璃管;
2)将两个步骤1)去除缓冲层和聚合物涂覆层的光纤置于氢氧火焰加热至光纤熔点后沿光轴方向进行拉伸;
3)两个光纤将折断为两部分,并在末端形成不同的锥形结构。
优选地,本发明用于调整细胞串列的双光纤光镊的制作方法中,所述步骤2)中对两个光纤的拉伸速度需保证拉伸速度范围分别在:0.47-0.53mm/s及0.57-0.63mm/s;更优选地,对两个光纤的拉伸速度分别为0.5mm/s和0.6mm/s。
优选地,本发明用于调整细胞串列的双光纤光镊的制作方法中,所述步骤2)中所述不同的锥形结构应能保证细胞串列组织和特定细胞调节能力,两种光纤的尺寸也需要局限在一定范围里面,未拉伸的光纤直径为125μm,对于第一光纤而言(形成细胞串列):其应在1.9-2.1mm范围内减至5.2-5.8μm,以有效聚焦出射激光并在末端形成较强光学梯度捕获细菌。而对于第二光纤而言(其尖端更为尖锐,用于操控单细胞),其应在2.4-2.6mm范围内从125μm减至3.6-4.2μm,以将出射激光聚焦在光纤尖端,操控单个细胞;更优选地,第一光纤的末端直径从125μm在2mm的长度内减至5.5μm;第二光纤的末端直径在2.5mm的长度内从125μm减至4μm。
本发明的另一目的在于提供上述制作方法获得双光纤光镊,所述双光纤光镊为通过熔融拉锥法制备,并在末端具有不同的锥形结构。
优选地,本发明用于调整细胞串列的双光纤光镊的末端的锥形结构,对于第一光纤而言(形成细胞串列):其应在1.9-2.1mm范围内减至5.2-5.8μm,以有效聚焦出射激光并在末端形成较强光学梯度捕获细菌。而对于第二光纤而言(其尖端更为尖锐,用于操控单细胞),其应在2.4-2.6mm范围内从125μm减至3.6-4.2μm,以将出射激光聚焦在光纤尖端,操控单个细胞;更优选地,本发明中第一光纤的末端直径从125μm在2mm的长度内减至5.5μm;第二光纤的末端直径在2.5mm的长度内从125μm减至4μm。
本发明的另一方面为提供双光纤光镊在调整细胞串列顺序及细胞串列中特定细胞接触端的可控翻转的方法,其特征在于,包括以下步骤:
1)制备如上述方法制备的双光纤光镊,分别连接到两个激光器的输出端,将含有细胞溶液的载玻片放置于x-y手动调节台;
2)向第一光纤光镊通入激光后,用于捕获第一光纤光镊前端细胞溶液中的细胞串列;向第二光纤光镊通入激光,操控第二光纤光镊靠近细胞串列中细胞,沿-x轴方向取出捕获细胞;
3)操纵被捕获细胞的第二光纤光镊,关闭第二光纤光镊激光光源,被捕获细胞重新回到原序列中。
优选地,本发明所述的调整细胞串列顺序及细胞串列中特定细胞接触端的可控翻转的方法中,第一光纤光镊激光功率的范围取决于细胞串列中细胞数量及细胞生物活性:激光功率越大,形成细胞串列中细胞数量越多,但同时将对细胞产生的潜在光学损伤也越大,实验中证明第一光纤光镊的激光范围应控制在20-100mW之间。而第二光纤光镊需要从第一光纤光镊所形成的细胞串列中取出特定细胞,故其功率范围依赖于第一光纤光镊的输入功率:当第一光纤光镊输入功率为30mW时,第二光纤光镊的输入功率范围为32-90mW;更优选地,所述第一光纤光镊的激光功率为30mW,波长为980nm;所述第一光纤光镊的激光功率为50mW,波长为980nm。
优选地,本发明所述的调整细胞串列顺序及细胞串列中特定细胞接触端的可控翻转的方法中,所述被捕获细胞回到原细胞串列中的顺序可通过第二光纤光镊的位置进行调整。
优选地,本发明所述的调整细胞串列顺序及细胞串列中特定细胞接触端的可控翻转的方法中,所述被捕获细胞与原细胞串列接触端可通过第二光纤光镊操纵翻转。
由上可见,本发明至少有以下优点:
1.本发明的光纤光镊具有制作简易、操控灵活、非接触及无损伤捕获等优势,从而避免其余技术方案所需的复杂光刻衬底制作及体材料微纳加工,在血管等狭小的生物微管操控中具有潜在的重要应用;
2.在本发明的技术方案中,细胞串列组织和排列过程中无需局限在衬底表面,从而避免潜在的细胞样品污染,并可实现系统的重复利用;
3.本发明的双光纤光镊系统,特别适用于较低浓度下的细胞溶液,可以在低细胞浓度的细胞溶液中,实现细胞串列的可控调整,包括从细胞串列中移除或添加目标细胞,调整细胞间作用距离及改变细胞连接顺序等;此外,基于双光纤光镊还可实现不同大小及形状(例如球形)细胞的细胞串列有效组织和可控调整。
4.本发明的技术方案避免复杂的全息算法设计,并可实现细胞串列的动态调整。由于光纤光镊本身集成化及微型化的优势,通过进一步将其与微流芯片设备相结合,有望为细胞生长,组织分化、细胞间信号传递等过程提供强有力的研究工具。
附图说明
图1为本发明基于双光纤光镊实现细胞串列调整原理示意图;
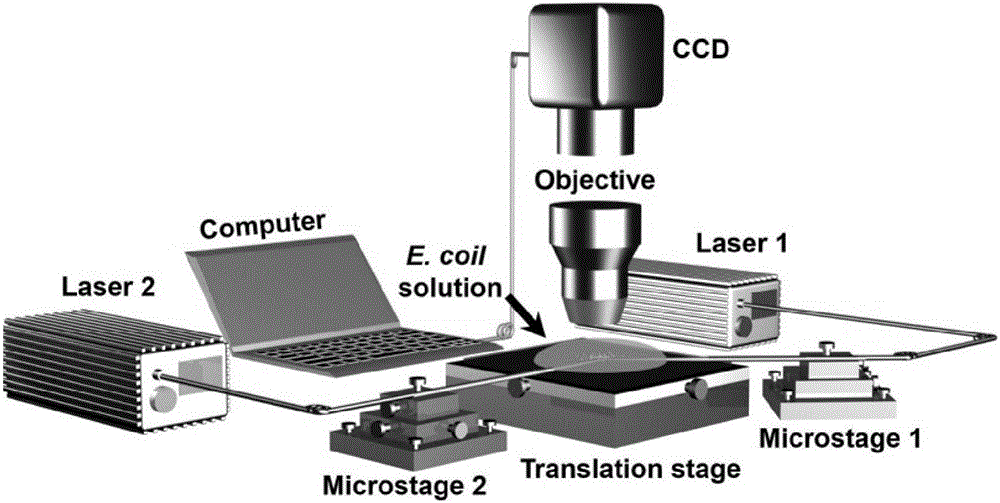
图2为本发明的一个实施例中双光纤光镊实验装置示意图;
图3为本发明的一个实施例中从包含6个大肠杆菌细胞串列中取出E.coli 6的光学显微图片;
图4为本发明的一个实施例中从包含6个大肠杆菌细胞串列中取出E.coli 6放回原串列的光学显微图片;
图5为本发明的一个实施例中大肠杆菌串列中取出E.coil 3并放置于E.coil 4和5之间的光学显微图片。
图6为本发明的一个实施例中大肠杆菌串列中旋转E.coil 3的光学显微图片。
具体实施方式
本发明的设计思路如下:
如图1所示:当980nm激光通入第一光纤光镊(下简称FP 1)时,溶液中的细胞(以大肠杆菌为例)将在光力作用下被捕获并沿FP 1轴向排列形成一组细胞串列(包含6个大肠杆菌);调节第二光纤光镊(下简称FP 2)靠近串列中特定细胞(以第5个大肠杆菌细胞为例),当FP 2中通入激光后,E.coli 5将朝向FP 2旋转并最终取向沿FP 2光轴方向,也即被捕获至光纤光镊FP 2的前端。此时移动光纤光镊FP 2,E.coli 5将随之从细胞串列中取出,对应细胞串列的连接顺序从1-2-3-4-5-6变成1-2-3-4-6(图1b);进一步可将E.coli 5放回原细胞串列中的E.coli 3和E.coli 4之间(图1c);关闭通入光纤光镊FP 2的激光,E.coli 5将在FP 1的作用下旋转并调整取向沿光纤光镊FP 1的轴向方向(图1d),对应细胞连接顺序将从1-2-3-4-6变为1-2-3-5-4-6。
基于上述设计思路,本发明的一个实施例中提供了一种用于调整细胞串列的双光纤光镊的制作方法,即通过熔融拉锥法制备双光纤光镊,并在末端具有不同的锥形结构。
优选地,在本发明的一个实施例中,所述双光纤光镊的制作方法包括以下步骤:
1)将两个单模光纤分别去除缓冲层和聚合物涂覆层,并套上毛细玻璃管;
2)将两个步骤1)去除缓冲层和聚合物涂覆层的光纤置于氢氧火焰加热至光纤熔点后沿光轴方向进行拉伸;
3)两个光纤将折断为两部分,并在末端形成不同的锥形结构。
优选地,在本发明的一个实施例中,所述步骤2)中对两个光纤的拉伸速度分别为0.5mm/s和0.6mm/s。
优选地,在本发明的一个实施例中,所述步骤2)中所述不同的锥形结构为第一光纤的末端直径从125μm在2mm的长度内减至5.5μm;第二光纤的末端直径在2.5mm的长度内从125μm减至4μm。
优选地,在本发明的一个实施例中,还提供上述制作方法获得双光纤光镊,所述双光纤光镊为通过熔融拉锥法制备,并在末端具有不同的锥形结构。
优选地,在本发明的一个实施例中,用于调整细胞串列的双光纤光镊的末端的锥形结构分别为第一光纤的末端直径从125μm在2mm的长度内减至5.5μm;第二光纤的末端直径在2.5mm的长度内从125μm减至4μm。
优选地,在本发明的另一个实施例中,提供双光纤光镊在调整细胞串列顺序及细胞串列中特定细胞接触端的可控翻转的方法,其特征在于,包括以下步骤:
1)制备如上述方法制备的双光纤光镊,分别连接到两个激光器的输出端,将含有细胞溶液的载玻片放置于x-y手动调节台;
2)向第一光纤光镊通入激光后,用于捕获第一光纤光镊前端细胞溶液中的细胞串列;向第二光纤光镊通入激光,操控第二光纤光镊靠近细胞串列中细胞,沿-x轴方向取出捕获细胞;
3)操纵被捕获细胞的第二光纤光镊,关闭第二光纤光镊激光光源,被捕获细胞重新回到原序列中。
优选地,在本发明的另一个实施例中,所述的调整细胞串列顺序及细胞串列中特定细胞接触端的可控翻转的方法中,所述第一光纤光镊的激光功率为30mW,波长为980nm;所述第一光纤光镊的激光功率为50mW,波长为980nm。
优选地,在本发明的另一个实施例中,本发明所述的调整细胞串列顺序及细胞串列中特定细胞接触端的可控翻转的方法中,所述被捕获细胞回到原细胞串列中的顺序可通过第二光纤光镊的位置进行调整。
优选地,在本发明的另一个实施例中,本发明所述的调整细胞串列顺序及细胞串列中特定细胞接触端的可控翻转的方法中,所述被捕获细胞与原细胞串列接触端可通过第二光纤光镊操纵翻转。
以下通过具体实施例进一步对本发明的技术方案进行说明,应理解以下仅为本发明的示例性说明,并不用于限制本发明权利要求的保护范围。
实施例1用于调整细胞串列顺序的双光纤光镊及其实验装置的制作方法
制备双光纤光镊及其实验装置如图2所示:
一、光纤光镊FP 1和2通过火焰熔融拉锥法制备:
第一步,将单模光纤(连接类型:FC/PC,纤芯直径:9μm,包层直径:125μm;Corning Inc.)用光纤剥线钳去除缓冲层和聚合物涂覆层,并套上毛细玻璃管(内径:~0.9mm,管壁厚:~0.1mm,长度:~120mm)以防止光纤折断和损伤。
第二步,将裸光纤至于酒精灯火焰上方加热约1分钟,到达光纤熔点后沿光轴方向进行拉伸。由于光纤光镊FP 1和2具有不同的锥形结构,故需在拉伸过程中施加不同的拉伸速度。针对光纤光镊FP 1和2,初始拉伸速度分别为0.5mm/s(FP 1)和0.6mm/s(FP 2)。
此时对于FP 1,光纤直径将从125μm在2mm的长度内减至5.5μm;而对于FP 2,光纤直径将在2.5mm的长度内从125μm减至4μm。最后,针对两根光纤光镊分别施加2mm/s(FP 1)和3mm/s(FP 2)的拉伸速度,光纤将折断为两部分,并在末端形成不同的锥形结构。
二、用于调整细胞串列顺序的双光纤光镊实验装置的制作方法
光纤光镊制作完毕后,将其分别连接在激光器1和2的输出端上并置于三维微调节架1和2上,以便实现对其精确操控。激光器出射波长为980nm,选择该波长是由于生物细胞在该波段吸收系数较小,且对细菌和哺乳动物细胞的光学损伤最小。
大肠杆菌溶液配置过程如下:大肠杆菌(DH5α)首先在37℃的LB培养基上进行培养,取对数态的细菌至于含有LB的磷酸盐(PBS)缓冲液中。进一步,在PBS缓冲液中将细菌重悬浮后,加入去离子水将细菌稀释至特定的细胞浓度(~1×105个/mL)。细胞溶液配制完毕后,使用注射器将其滴到玻璃载玻片上。该载玻片放置于调节精度为50nm的x-y手动调节台上,进而可在实验过程中实现精确的位置调节。除此之外,实验中采用集成CCD的光学显微镜,进行图像捕捉和视频录制,且整个过程可在与其相连接的电脑上进行实时监控。
实施例2双光纤光镊实验装置捕获并迁移细胞串列中的特定细胞
1、双光纤光镊实验装置捕获细胞串列中的特定细胞
细胞串列具体实验操控如图3所示:当向光纤光镊FP 1中通入980nm激光后(P1=30mW),FP 1前端的大肠杆菌将在光力作用下被逐个捕获,并在光纤光镊FP 1的末端形成一串包含6个大肠杆菌的细胞串列(图3a)。接着,向光纤光镊FP 2中通入功率为50mW的980nm激光,操控光纤光镊FP 2逐渐靠近细胞串列末端,此时E.coli 6(图3中黑色环形虚线)逆时针旋转50°并最终稳定取向沿FP 2的轴向方向,如图3b和c所示。进一步沿-x方向移动光纤光镊FP 2(图3d,e),E.coli 6与E.coli 5间距可动态调整。进而,可将E.coli 6从原细胞串列中取出,并随光纤光镊FP 2沿-x方向平移5.74μm(图3f)。
图3展示了基于双光纤光镊实验装置从包含6个大肠杆菌细胞串列中取出E.coli 6的光学显微图片。(a~c)光纤光镊FP 2通入激光后,E.coli 6旋转并最终稳定取向沿FP 2轴向方向。(d~f)沿-x方向平移光纤光镊FP 2,可将E.coli 6从原细胞串列中予以取出,其中,插图示意具体取出过程。
2、将取出细胞放回原串列
为进一步调整细胞串列,我们将图3中取出的E.coli 6放回至原串列中,如图4所示:在t=0s,关闭通入光纤光镊FP 2的激光(图4a)。此后,E.coli6重新被光纤光镊FP 1所施加的光梯度力所捕获,并随之顺时针旋转(图4b-d),其中,插图示意具体取出过程。
3、细胞串列连接顺序的可控调整
除可在细胞串列中取出并放回特定细胞外,基于双光纤光镊,还可实现细胞串列连接顺序的可控调整。如图5所示,我们通过双光纤光镊调整10个大肠杆菌细胞串列的连接顺序:当t=0s时,调节光纤光镊FP 2,使其靠近细胞串列中E.coli 3的下端(图5a)。在t=1s时,向光纤光镊FP 2中通入980nm激光(P2=50mW),此时E.coli 3的下端将在光力作用下被光纤光镊FP 2所捕获。然而,其上端(图5标白部分所示)仍保持静止(图5b)。进一步,沿-x方向移动光纤光镊FP 2,当移动距离达到1.9μm时,E.coil 3和x轴正方向夹角将变为50°(图5c)。此时,E.coil 3将随之顺时针旋转并最终取向沿光纤光镊FP 2的轴向方向(图5d)。沿-x方向继续平移光纤光镊FP 2,E.coil 3将从细胞串列中予以取出,对应光纤光镊FP 2总移动距离为7.1μm。进一步,沿+y方向平移光纤光镊FP 2约1μm(图5e)。此后,沿+x方向平移光纤光镊FP 2约9μm后,将E.coli 3放置于E.coils 4和5之间(图5f,g)。关闭通入光纤光镊FP 2的激光,E.coli 3将逐渐旋转并最终取向沿光纤光镊FP 1的轴向方向。与此同时,细胞串列的连接顺序也调整为1-2-4-3-5-6-7-8-9-10(图5h,i)。
注意在以上调整过程中,细胞E.coil 3总的旋转角度为180°而不是0°,也即细胞两端在串列中发生了翻转。因而,基于双光纤光镊操控技术,亦可实现细胞串列中特定细胞接触端的可控翻转,如图6所示:当t=0s时,调节光纤光镊FP 2使其靠近细胞串列中E.coil 3的下端(未标白部分)。接着,向光纤光镊FP 2中通入980nm激光,此时E.coil 3的下半部将被FP 2所捕获,且细胞将在光力矩作用下朝向FP 2顺时针旋转,并最终取向沿FP 2的轴向方向(图6c)。接着关闭通入光纤光镊FP 2的激光(图6d),E.coil 3将在光纤光镊FP 1所施加光力矩的作用下继续顺时针旋转,并最终稳定取向沿FP 1的轴向方向(图6e)。但是,其相对最初的状态旋转180°,也即其与E.colis 2和4的接触端被成功调换(图6f)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!