菱镁矿制备氧化镁或氧化镁与纤维状氢氧化镁的方法与流程
本发明属于矿物加工技术领域,具体涉及一种菱镁矿制备氧化镁或氧化镁与纤维状氢氧化镁的方法。
背景技术:
我国菱镁矿资源十分丰富,储量居世界首位,占世界总储量三分之一,主要分布在辽宁、河北、山东等多个省市。菱镁矿用途广泛,用于耐火材料、炼铁添加剂、氯氧镁水泥、烟气脱硫、酸性废水处理等多个领域。高纯氧化镁一般指氧化镁含量高于98%的氧化镁,白度高,分散性好,高温下具有膨胀性、电绝缘性、导热性等优异性能,用于涂料、橡胶、塑料等填料,及制造取向硅钢片、高性能陶瓷、氧化镁单晶等材料,在电子、电器、光学、仪表、冶金、国防及航空航天领域中运用前景广阔。氢氧化镁可以作为阻燃剂填充于塑料、橡胶、建材中,具有无毒、抑烟、阻滴的效果,被誉为“绿色环保阻燃剂”,其开发利用亦受到国内外广泛关注,然而氢氧化镁填充时用量大,与有机物相容性差,选择粒度小、片状或纤维状形貌的氢氧化镁能改善材料强度,减少氢氧化镁填充量。
国内菱镁矿生产高纯氧化镁的方法主要为碳化法,工艺为煅烧菱镁矿,再加入到消化槽消化,通入二氧化碳得到碳酸氢镁溶液,固液分离后热解重镁水得到碳酸镁产物,煅烧碳酸镁即获得氧化镁,该工艺能耗高,碳化过程少量碳酸氢钙会溶解而进入氧化镁产品,故含钙较高,因此产品使用范围受一定限制。
用铵盐循环使用从菱镁矿提取氧化镁是一种较好的方法,该工艺为铵盐焙烧或浸出菱镁矿,产生氨气和镁盐固体或者溶液,吸收氨气获得氨水,过滤镁盐溶液,用氨水和镁盐溶液反应,可以获得氢氧化镁和铵盐,过滤氢氧化镁再煅烧获得高纯氧化镁,铵盐循环使用。该方法的优点在于:(1)铵盐和氨水能循环使用,理论上没有损耗,能大幅度降低成本;(2)铵盐浸出选择性好,硅、铝、铁离子不会被浸出,同时,氨气的沉淀的选择性好,不会将浸出的少量钙离子沉淀而混入氢氧化镁中,因此最终所得氧化镁纯度很高;(3)生产率高,硫酸镁、硝酸镁、氯化镁溶解度比碳酸氢镁大,可以在浸出设备单位生产体积中提纯较大量氧化镁。但目前报道均为常压操作,由于氨分子溶解度大常压下难以溢出溶液,导致蒸氨时间长,能耗高,未实现实际应用。
专利公开号CN101372402A公开了一种用铵盐与含镁矿石煅烧制取氧化镁的方法,该方法用铵盐和粉碎后的菱镁矿、水镁石或滑石等含镁矿物煅烧,获得固体镁盐与氨气和二氧化碳,用水吸收气体得到碳酸氢铵溶液或者氨水,固体镁盐溶解,过滤再与碳酸氢铵溶液或者氨水反应,得到碳酸镁或者氢氧化镁和铵盐,过滤,煅烧碳酸镁得到高纯度氧化镁。铵盐溶液蒸干,得到固体铵盐循环使用。该工艺每个工艺循环中需要溶解焙烧得到的固体镁盐才能分离杂质,然后在溶液中制备氢氧化镁,需要蒸干铵盐溶液才能用于煅烧,水耗和能耗都很大,最终需要成本高。
专利公布号CN103232047A公开了一种低能耗氧化镁的制备方法,该方法为用铵盐浸出轻烧镁溶液,蒸氨中产生的大量蒸气推动汽轮机发电,用来节能降耗。该工艺未给出汽轮机的相关参数,但引入汽轮机不可避免地增加了固定投资和运行成本,可行性不大。
专利公布号CN102502722A公开了一种高纯氧化镁的生产方法,该方法煅烧低品位菱镁矿收集二氧化碳,用铵盐溶液浸出轻烧镁,获得镁盐和氨水,过滤镁盐溶液,氨水与收集的二氧化碳反应得到碳酸氢铵溶液,溶液与镁盐反应获得碳酸镁和铵盐溶液,过滤,干燥煅烧碳酸镁即获得氧化镁,铵盐溶液重复使用。该工艺的关键问题在于常温下铵盐溶液浸出氧化镁浸出时间长,短时间内浸出率很低,且用碳酸氢铵沉淀镁盐溶液时,会不可避免将浸出的钙离子沉淀,引入杂质,专利申请号CN103241751A所述方法原理与CN102502722A基本相同,不能有效提高浸出率,同时钙离子沉淀进入氧化镁产品中。
专利公布号CN103011630A公开了一种低品位菱镁矿生产高纯氢氧化镁和氧化镁的方法,该工艺煅烧低品位菱镁矿,再用铵盐浸出获得氨气和镁盐溶液,镁盐溶液过滤,再通入一部分氨气和二氧化碳反应生成碳酸钙沉淀除钙,再过滤加入氨水反应获得高纯度氢氧化镁。为了提高氧化镁浸出率,该工艺提高了浸出温度至100至120摄氏度,浸出时间为2~4h,该工艺浸出温度超过了水的沸点,且反应时间长,水耗和能耗大,会增加成本,同时最后未浸出的菱镁矿渣作为镁水泥原料,附加值低。
专利公布号CN102745724A公开了一种用轻烧镁粉生产高纯氧化镁的方法,该工艺用醋酸铵溶液作为浸出剂,浸出获得醋酸镁溶液和氨气,浸出时间不大于1h,氨气再与醋酸镁作用得到氢氧化镁,过滤,煅烧,获得氧化镁。该专利提及目前常压下蒸氨法蒸氨时间长,镁离子浸出率低,能耗高的问题,旨在降低浸出时间,节约能源,提高生产率,但用醋酸铵浸出轻烧镁粉,原理与硫酸铵,氯化铵或硝酸铵浸出相同,并不能从根本上提高浸出率,而且醋酸铵粘度大容易粘附在氢氧化镁产物上,当氢氧化镁中有微量有机物醋酸铵或醋酸镁未被洗涤彻底,煅烧后会碳化,氧化镁会变色,降低白度,影响外观。
综上所述,用铵盐循环使用从菱镁矿提取氧化镁能节约原料,有效降低生产成本,且容易生产高纯度氧化镁。但是,目前的方法中,存在浸出温度高,时间长,能耗高的弊端,且部分工艺存在碳酸钙进入杂质,目前应用并不广泛。
技术实现要素:
本发明的目的在于针对上述技术问题,提供一种成本低、生产周期短、能耗低、产品纯度高的菱镁矿制备氧化镁的方法。
为实现上述目的所采用的技术方案是:一种菱镁矿制备氧化镁的方法,包括如下步骤:
1)煅烧菱镁矿,破碎、筛分,得到轻烧镁粉;
2)将轻烧镁粉加到铵盐溶液中浸出,浸出过程在减压、水浴加热、搅拌条件下进行,减压为相对真空度-0.07~-0.098Mp,加热温度为70~95℃,搅拌速度为60~300rpm,浸出1~3h,得到氨气和固液混合体系,产生的氨气用水吸收得到氨水,轻烧镁粉和铵盐溶液的固液比为25~120g/L,铵根离子与轻烧镁粉中氧化镁的摩尔比为NH4+:MgO=1.7~5.6:1;
3)过滤固液混合体系,洗涤沉淀渣,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾;
4)将步骤3)得到的镁盐浸出液与步骤2)得到的氨水反应,得到氢氧化镁沉淀和铵盐溶液,分离、烘干沉淀,进行煅烧,即得到氧化镁粉末。
步骤2)中所述铵盐为硫酸铵、氯化铵、硝酸铵中的一种或多种。
在上述技术方案中,当所述铵盐为氯化铵或者硝酸铵时,在铵盐溶液中加入硫酸铵或者硫酸镁,硫酸铵或者硫酸镁在铵盐溶液中的浓度为0.1~1mol/L。
所述步骤1)中煅烧菱镁矿的温度为700~1100℃,时间为0.5~2h,轻烧镁粉为200目筛下产物。
作为优选地,步骤2)中所述减压相对真空度为-0.08~-0.098Mp,浸出时间为1.5~2.5h。
本发明的另一目的在于提供一种成本低、生产周期短、能耗低、产品纯度高的菱镁矿制备氧化镁和纤维状氢氧化镁的方法,包括如下步骤:
1)煅烧菱镁矿,破碎、筛分,得到轻烧镁粉;
2)将轻烧镁粉加到铵盐溶液中浸出,浸出过程在减压、水浴热、搅拌条件下进行,减压为相对真空度-0.065~-0.098Mp,加热温度为60~95℃,搅拌速度为60~300rpm,浸出1~3h,得到氨气和固液混合体系,产生的氨气用水吸收得到氨水,轻烧镁粉和铵盐溶液的固液比为60~160g/L,铵根离子与轻烧镁粉中氧化镁的摩尔比为NH4+:MgO=1.7~3.5:1;
3)抽取固液混合体系的上中层悬浮液抽滤,获得滤液和滤饼,烘干滤饼,即可得纤维状氢氧化镁,浸出沉淀渣洗涤,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾;
4)将步骤3)得到的镁盐浸出液与步骤2)得到的氨水反应,得到氢氧化镁沉淀和铵盐溶液,分离、烘干沉淀,进行煅烧,即得到氧化镁粉末。
步骤2)中所述铵盐为硫酸铵、氯化铵、硝酸铵中的一种或多种。
在上述技术方案中,当所述铵盐为氯化铵或者硝酸铵时,在铵盐溶液中加入硫酸铵或者硫酸镁,硫酸铵或者硫酸镁在铵盐溶液中的浓度为0.1~1mol/L。
所述步骤1)中煅烧菱镁矿的温度为700~1100℃,时间为0.5~2h,轻烧镁粉为200目筛下产物。
作为优选地,步骤2)中所述减压相对真空度为-0.08~-0.098Mp,浸出时间为1.5~2.5h。
本发明涉及的主要化学反应如下:
煅烧菱镁矿,碳酸镁和碳酸钙分解:
MgCO3=MgO+CO2↑
CaCO3=CaO+CO2↑
用铵盐溶液浸出轻烧镁粉,镁离子和钙离子先水化,然后被浸出:
MgO+H2O=Mg(OH)2
CaO+H2O=Ca(OH)2
Mg(OH)2+2NH4+=Mg2++2NH3↑+2H2O
Ca(OH)2+2NH4+=Ca2++2NH3↑+2H2O
其中,氧化钙很容易浸出,氧化镁浸出反应较困难,在常压、低温或较短时间内浸出率较低,通过强化条件,提高温度,提高铵盐浓度,减压条件及时抽出溶液中氨气,延长时间可提高浸出后镁离子浓度。
在铵盐体系中铵盐作为晶型调整剂,在合适的温度下氧化镁水化时能沿着特定方向生长,生成纤维状氢氧化镁。同时,由于生成的纤维状氢氧化镁粒径细,密度小,而铵盐和镁盐混合溶液浓度高,密度较大,因此纤维状氢氧化镁能悬浮在溶液中,而密度较大的二氧化硅,氧化铁,氧化铝沉淀在溶液底部,从而能有效分离。
镁盐溶液与氨水反应,生成氢氧化镁:
Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+
该反应中,钙离子虽然不能被沉淀生成杂质,但多次循环后累积在溶液中浓度升高,破坏溶液中离子组成,降低铵离子含量,在过滤洗涤中可能有少量混入氨水沉淀得到的氢氧化镁中,通过在溶液加入硫酸根离子,可以生成硫酸钙沉淀来抑制浓度。
本发明的有益效果是:原料来源广、成本低、设备要求低,利用廉价菱镁矿,能够得到高纯氧化镁,或者同时获得高纯氧化镁和纤维状氢氧化镁产品,纤维状氢氧化镁有较大长径比,为15~40,可以作为阻燃剂填料提高利用价值;制备过程中使用的铵盐和氨水可以循环使用,能耗低,降低了生产成本,固体尾渣废弃物少,能带来很好的经济效益和环保效益。
附图说明
图1为用菱镁矿制备氧化镁和纤维状氢氧化镁的工艺流程图。
图2为实施例1中实验1氨水沉淀所得氢氧化镁的XRD图谱。
图3为图2中氢氧化镁煅烧所得氧化镁XRD图谱。
图4为实施例1中实验1获得的纤维状氢氧化镁XRD图谱。
图5为实施例1中实验1获得的纤维状氢氧化镁的SEM图。
图6为常压与减压下不同浸出时间对镁离子浓度的影响。
图7为常压与减压下不同浸出时间对浸出率的影响。
具体实施方式
下面结合附图说明本发明的具体实施方式。
本发明所有实施例中所用的菱镁矿原料组成如表1所示,另外,经过煅烧成分分析,表明高温煅烧菱镁矿烧失量稳定,氧化镁含量均为90%,实施例中氧化镁添加质量以此为依据。
表1.菱镁矿原料化学组分
用表1的菱镁矿原料制备高纯氧化镁和纤维状氢氧化镁,见实施例1-5。
实施例1 用菱镁矿制备高纯氧化镁和纤维状氢氧化镁
实验1
按照如下步骤操作(该方法的工艺流程图如图1所示):
1)用表1的菱镁矿为原料,在1100℃下煅烧0.5h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉。
2)取硫酸铵固体2.4kg,加入水充分溶解,配置溶液体积为6.1L,再加入轻烧镁粉970g(轻烧镁粉与硫酸铵溶液固液比为159g/L,NH4+:MgO摩尔比为1.7:1),加入到反应釜中,调节水浴温度60℃,反应过程中不断搅拌、转速为300rpm,并调节负压为相对真空度-0.065Mp,所蒸出的氨气用水吸收得到氨水,浸出时间3h,得到固液混合体系。
3)抽取固液混合体系的上中层悬浮液抽滤,获得滤液和滤饼,烘干滤饼,即可得纤维状氢氧化镁,浸出沉淀渣洗涤,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。
4)将步骤3)得到的镁盐浸出液与步骤2)得到的氨水反应,得到氢氧化镁沉淀和铵盐溶液,分离沉淀、烘干、在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末。
经称量得到的纤维状氢氧化镁质量为577g,氧化镁质量为126g。
实验2
用前面实验1的步骤4)中回收的铵盐溶液来进行轻烧镁粉浸出:
将实验1步骤4)中沉淀氢氧化镁后过滤所得铵盐溶液浓缩至6.1L,与970g轻烧镁粉加入到反应釜中,反应时间设为3h,调节水浴温度60℃,反应过程中不断搅拌转速为300rpm,并调节负压为相对真空度-0.065Mp,所蒸出的氨气用水吸收,待浸出结束,抽取固液体系上中层悬浮液抽滤,获得滤液和滤饼,烘干滤饼,可得纤维状氢氧化镁,浸出沉淀渣洗涤,洗涤液与滤液合并得到浸出液,沉淀渣抛尾。用吸收所得氨水与浸出液反应,分离沉淀,烘干,在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末,得到的铵盐溶液收集备下次实验浸出镁盐使用。获得纤维状氢氧化镁668g,氧化镁212g。
实验3
用实验2最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验2相同,得到纤维状氢氧化镁682g,氧化镁粉末201g。
实验4
用实验3最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验3相同,得到纤维状氢氧化镁660g,氧化镁粉末223g。
通过实验2-4的循环试验可知,用表1的菱镁矿为原料在1100℃下煅烧0.5h,获得煅烧氧化镁混料,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉,在该条件下硫酸铵溶液可以循环浸出,产生的氨水可以循环沉淀获得氢氧化镁,进一步煅烧则能获得氧化镁,且在3次循环实验中,纤维状氢氧化镁和氧化镁产量稳定,说明该循环工艺确实可行,纤维状氢氧化镁与高纯氧化镁质量和与原料相近,原料利用率高、产率高。
实施例2 用菱镁矿制备高纯氧化镁和纤维状氢氧化镁
实验1
按照如下步骤操作:
1)用表1的菱镁矿为原料,在700℃下煅烧2h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉。
2)取硝酸铵固体5.4kg,七水硫酸镁1.48kg,加入水充分溶解,配置溶液体积为10L,再加入轻烧镁粉1200g(固液比为120g/L,NH4+:MgO为2.5:1),加入到反应釜中,调节水浴温度95℃,反应过程中不断搅拌转速120rpm,并调节负压为相对真空度-0.098Mp,所蒸出的氨气用水吸收,浸出时间1h,得到固液混合体系。
3)抽取固液混合体系的上中层悬浮液抽滤,获得滤液和滤饼,烘干滤饼,即可得纤维状氢氧化镁,浸出沉淀渣洗涤,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。
4)将步骤3)得到的镁盐浸出液与步骤2)得到的氨水反应,得到氢氧化镁沉淀和铵盐溶液,分离沉淀、烘干、在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末。
经称量得到纤维状氢氧化镁质量为673g,氧化镁质量为266g。
实验2
用前面实验1的步骤4)中回收的铵盐溶液来进行轻烧镁粉浸出:
将实验1步骤4)中沉淀氢氧化镁后过滤所得铵盐溶液浓缩至体积约10L,再与1200g轻烧镁粉加入到反应釜中,反应时间设为1h,调节水浴温度95℃,反应过程中不断搅拌转速120rpm,并调节负压为相对真空度-0.098Mp,所蒸出的氨气用水吸收,待浸出结束,抽取固液体系上中层悬浮液抽滤,获得滤液和滤饼,烘干滤饼,可得纤维状氢氧化镁,浸出沉淀渣洗涤,洗涤液与滤液合并得到浸出液,沉淀渣抛尾。用吸收所得氨水与浸出液反应,分离沉淀,烘干,在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末。获得纤维状氢氧化镁739g,氧化镁367g。
实验3
用实验2最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验2相同,得到纤维状氢氧化镁713g,氧化镁粉末389g。
实验4
用实验3最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验3相同,得到纤维状氢氧化镁732g,氧化镁粉末372g。
通过实验2-4的循环试验可知,用所述菱镁矿为原料在700℃下煅烧2h,获得煅烧氧化镁混料,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉,在该条件下硝酸铵溶液可以循环浸出,产生的氨水可以循环沉淀获得氢氧化镁,进一步煅烧则能获得氧化镁,且在3次循环中,纤维状氢氧化镁和氧化镁产量稳定,说明该循环工艺确实可行,纤维状氢氧化镁与高纯氧化镁质量和与原料相近,原料利用率高、产率高。
实施例3 用菱镁矿制备高纯氧化镁和纤维状氢氧化镁
实验1
按照如下步骤操作:
1)用表1的菱镁矿为原料,在750℃下煅烧2h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉。
2)取氯化铵固体5.4kg,硫酸铵0.61kg,加入水充分溶解,调节溶液体积为10L,再加入轻烧镁粉1400g(固液比为140g/L,NH4+:MgO为3.5:1),加入到反应釜中,调节水浴温度90℃,反应过程中不断搅拌速度180rpm,并调节负压为相对真空度-0.09Mp,所蒸出的氨气用水吸收,浸出时间1.5h,得到固液混合体系。
3)抽取固液混合体系的上中层悬浮液抽滤,获得滤液和滤饼,烘干滤饼,即可得纤维状氢氧化镁,浸出沉淀渣洗涤,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。
4)将步骤3)得到的镁盐浸出液与步骤2)得到的氨水反应,得到氢氧化镁沉淀和铵盐溶液,分离沉淀、烘干、在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末。
经称量得到纤维状氢氧化镁质量为783g,氧化镁质量为277g。
实验2
用前面实验1的步骤4)中回收的铵盐溶液来进行轻烧镁粉浸出:
将实验1步骤4)中沉淀氢氧化镁后过滤所得铵盐溶液浓缩至至体积10L,与1400g轻烧镁粉加入到反应釜中,反应时间设为1.5h,调节水浴温度90℃,反应过程中不断搅拌速度180rpm,并调节负压为相对真空度-0.09Mp,所蒸出的氨气用水吸收,待浸出结束,抽取固液体系上中层悬浮液抽滤,获得滤液和滤饼,烘干滤饼,可得纤维状氢氧化镁,浸出沉淀渣洗涤,洗涤液与滤液合并得到浸出液,沉淀渣抛尾。用吸收所得氨水与浸出液反应,分离沉淀,烘干,在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末。可获得纤维状氢氧化镁839g,氧化镁397g。
实验3
用实验2最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验2相同,得到纤维状氢氧化镁812g,氧化镁粉末409g。
实验4
用实验3最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验3相同,得到纤维状氢氧化镁782g,氧化镁粉末414g。
通过实验2-4的循环试验可知,用所述菱镁矿为原料在750℃下煅烧2h,获得煅烧氧化镁混料,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉,在该条件下氯化铵溶液可以循环浸出,产生氨水可以循环沉淀获得氢氧化镁,进一步煅烧则能获得氧化镁,且在3次循环实验中,纤维状氢氧化镁和氧化镁产量稳定,说明该循环工艺确实可行,纤维状氢氧化镁与高纯氧化镁质量和与原料相近,原料利用率高、产率高。
实施例4 用菱镁矿制备高纯氧化镁和纤维状氢氧化镁
实验1
按照如下步骤操作:
1)用表1的菱镁矿为原料,在900℃下煅烧1.5h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉。
2)取硝酸铵固体3.6kg,七水硫酸镁2.46kg,加入水充分溶解,配置溶液体积为10L,再加入轻烧镁粉1000g(固液比为100g/L,NH4+:MgO为2.0:1),加入到反应釜中,调节水浴温度80℃,反应过程中不断搅拌转速150rpm,并调节负压为相对真空度-0.09Mp,所蒸出的氨气用水吸收,浸出时间2h,得到固液混合体系。
3)抽取固液混合体系的上中层悬浮液抽滤,获得滤液和滤饼,烘干滤饼,即可得纤维状氢氧化镁,浸出沉淀渣洗涤,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。
4)将步骤3)得到的镁盐浸出液与步骤2)得到的氨水反应,得到氢氧化镁沉淀和铵盐溶液,分离沉淀、烘干、在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末。
经称量得纤维状氢氧化镁质量为573g,氧化镁质量为215g。
实验2
用前面实验1的步骤4)中回收的铵盐溶液来进行轻烧镁粉浸出:
将实验1步骤4)中沉淀氢氧化镁后过滤所得铵盐溶液浓缩至体积约10L,再与1000g轻烧镁粉加入到反应釜中,反应时间设为2h,调节水浴温度80℃,反应过程中不断搅拌转速150rpm,并调节负压为相对真空度-0.09Mp,所蒸出的氨气用水吸收,待浸出结束,抽取固液体系上中层悬浮液抽滤,获得浸出液和滤饼,烘干滤饼,可得纤维状氢氧化镁,浸出沉淀渣洗涤,洗涤液与滤液合并得到浸出液,沉淀渣抛尾。用吸收所得氨水与浸出液反应,分离沉淀,烘干,在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末。获得纤维状氢氧化镁612g,氧化镁314g。
实验3
用实验2最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验2相同,得到纤维状氢氧化镁602g,氧化镁粉末321g。
实验4
用实验3最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验3相同,得到纤维状氢氧化镁610g,氧化镁粉末324g。
通过实验2-4的循环试验可知,用所述菱镁矿为原料在900℃下煅烧1.5h,获得煅烧氧化镁混料,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉,在该条件下硝酸铵溶液可以循环浸出,产生的氨水可以循环沉淀获得氢氧化镁,进一步煅烧则能获得氧化镁,且在3次循环中,纤维状氢氧化镁和氧化镁产量稳定,说明该循环工艺确实可行,纤维状氢氧化镁与高纯氧化镁质量和与原料相近,原料利用率高、产率高。
实施例5 用菱镁矿制备高纯氧化镁和纤维状氢氧化镁
实验1
按照如下步骤操作:
1)用表1的菱镁矿为原料,在1000℃下煅烧1h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉。
2)取氯化铵固体2.18kg,七水硫酸镁1.23kg,加入水充分溶解,配置溶液体积为10L,再加入轻烧镁粉600g(固液比为60g/L,NH4+:MgO为3.0:1),加入到反应釜中,调节水浴温度80℃,反应过程中不断搅拌转速60rpm,并调节负压为相对真空度-0.08Mp,所蒸出的氨气用水吸收,浸出时间2.5h,得到固液混合体系。
3)抽取固液混合体系的上中层悬浮液抽滤,获得滤液和滤饼,烘干滤饼,即可得纤维状氢氧化镁,浸出沉淀渣洗涤,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。
4)将步骤3)得到的镁盐浸出液与步骤2)得到的氨水反应,得到氢氧化镁沉淀和铵盐溶液,分离沉淀、烘干、在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末。
经称量得纤维状氢氧化镁质量为276g,氧化镁质量为153g。
实验2
用前面实验1的步骤4)中回收的铵盐溶液来进行轻烧镁粉浸出:
将实验1步骤4)中沉淀氢氧化镁后过滤所得铵盐溶液浓缩至体积约10L,再与600g轻烧镁粉加入到反应釜中,反应时间设为2.5h,调节水浴温度80℃,反应过程中不断搅拌转速60rpm,并调节负压为相对真空度-0.08Mp,所蒸出的氨气用水吸收,待浸出结束,抽取固液体系上中层悬浮液抽滤,获得浸出液和滤饼,烘干滤饼,可得纤维状氢氧化镁,浸出沉淀渣洗涤,洗涤液与滤液合并得到浸出液,沉淀渣抛尾。用吸收所得氨水与浸出液反应,分离沉淀,烘干,在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末。获得纤维状氢氧化镁302g,氧化镁255g。
实验3
用实验2最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验2相同,得到纤维状氢氧化镁308g,氧化镁粉末242g。
实验4
用实验3最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验3相同,得到纤维状氢氧化镁301g,氧化镁粉末249g。
通过实验2-4的循环试验可知,用所述菱镁矿为原料在1000℃下煅烧1h,获得煅烧氧化镁混料,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉,在该条件下氯化铵溶液可以循环浸出,产生的氨水可以循环沉淀获得氢氧化镁,进一步煅烧则能获得氧化镁,且在3次循环中,纤维状氢氧化镁和氧化镁产量稳定,说明该循环工艺确实可行,纤维状氢氧化镁与高纯氧化镁质量和与原料相近,原料利用率高、产率高。
实施例6 用菱镁矿制备高纯氧化镁
实验1
按照如下步骤操作:
1)用表1的菱镁矿为原料,在1100℃下煅烧0.5h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉。
2)取氯化铵固体0.914kg,七水硫酸镁0.74kg,加入水充分溶解,调节溶液体积为15L,再加入轻烧镁粉450g(固液比为30g/L,NH4+:MgO为1.7:1),加入到反应釜中,调节水浴温度70℃,反应过程中不断搅拌速度为90rpm,并调节负压为相对真空度-0.09Mp,所蒸出的氨气用水吸收,浸出时间1.5h,得到固液混合体系。
3)过滤固液混合体系,洗涤沉淀渣,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。
4)在步骤2)得到的氨水中加入3.0kg含氨25%的氨水(补充的氨水和步骤2)中浸出用的铵盐摩尔比NH3:NH4+为2.6:1),然后将步骤3)得到的镁盐浸出液与氨水反应,得到氢氧化镁沉淀和铵盐溶液,分离沉淀、烘干、在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末,称量得到氧化镁质量为230g。
实验2
用前面实验1的步骤4)中回收的铵盐溶液来进行轻烧镁粉浸出:
将实验1步骤4)中沉淀氢氧化镁后过滤所得铵盐溶液浓缩至原体积15L,与450g轻烧镁粉加入到反应釜中,反应时间设为1.5h,调节水浴温度70℃,反应过程中不断搅拌速度为90rpm,并调节负压为相对真空度-0.09Mp,所蒸出的氨气用水吸收,待浸出结束,过滤固液混合体系,洗涤沉淀渣,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。用吸收所得氨水与镁盐浸出液反应,分离沉淀,烘干,在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末,称量氧化镁质量为281g。
实验3
用实验2最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验2相同,得到氧化镁粉末288g。
实验4
用实验3最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验3相同,得到氧化镁粉末278g。
通过实验2-4的循环试验可知,用所述菱镁矿为原料在1100℃下煅烧0.5h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉,在该条件下氯化铵溶液可以循环浸出,产生氨水中额外补加一定量氨水可以循环沉淀获得氢氧化镁,进一步煅烧则能获得氧化镁,且在3次循环中,氧化镁产量较稳定,说明该条件下,用煅烧菱镁矿为原料,循环生产高纯氧化镁工艺可行性高,高纯氧化镁质量和与原料相近,因此原料利用率高、产率高。
实施例7 用菱镁矿制备高纯氧化镁
实验1
按照如下步骤操作:
1)用表1的菱镁矿为原料,在850℃下煅烧1.5h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉。
2)取硝酸铵固体8.1kg,七水硫酸镁1.5kg加入水充分溶解,调节溶液体积为15L,再加入轻烧镁粉1800g(固液比为120g/L,NH4+:MgO为2.5:1),加入到反应釜中,调节水浴温度95℃,反应过程中不断搅拌速度为300rpm,并调节负压为相对真空度-0.098Mp,所蒸出的氨气用水吸收,浸出时间2.5h,得到固液混合体系。
3)过滤固液混合体系,洗涤沉淀渣,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。
4)在步骤2)得到的氨水中加入10.2kg含氨25%的氨水(补充的氨水和步骤2)中浸出用的铵盐摩尔比NH3:NH4+为1.5:1),然后将步骤3)得到的镁盐浸出液与氨水反应,得到氢氧化镁沉淀和铵盐溶液,分离沉淀、烘干、在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末,称量氧化镁质量为935g。
实验2
用前面实验1的步骤4)中回收的铵盐溶液来进行轻烧镁粉浸出:
将实验1步骤4)中沉淀氢氧化镁后过滤所得铵盐溶液浓缩至原体积15L,与1800g轻烧镁粉加入到反应釜中,反应时间设为2.5h,调节水浴温度95℃,反应过程中不断搅拌速度为300rpm,并调节负压为相对真空度-0.098Mp,所蒸出的氨气用水吸收,待浸出结束,过滤固液混合体系,洗涤沉淀渣,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。用吸收所得氨水与镁盐浸出液反应,分离沉淀,烘干,在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末,称量氧化镁质量为1145g。
实验3
用实验2最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验2相同,得到氧化镁粉末1138g。
实验4
用实验3最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验3相同,得到氧化镁粉末1141g。
通过实验2-4的循环试验可知,用所述菱镁矿为原料在850℃下煅烧1.5h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉,在该条件下硝酸铵溶液可以循环浸出,产生氨水中额外补加一定量氨水可以循环沉淀获得氢氧化镁,进一步煅烧则能获得氧化镁,且在3次循环中,氧化镁产量较稳定,说明该条件下,用煅烧菱镁矿为原料,循环生产高纯氧化镁工艺可行。
实施例8 用菱镁矿制备高纯氧化镁
实验1
按照如下步骤操作:
1)用表1的菱镁矿为原料,在850℃下煅烧1.5h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉。
2)取硫酸铵固体2.65kg,加入水充分溶解,调节溶液体积为15L,再加入轻烧镁粉900g(固液比为60g/L,NH4+:MgO为2.0:1),加入到反应釜中,调节水浴温度90℃,反应过程中不断搅拌速度为180rpm,并调节负压为相对真空度-0.07Mp,所蒸出的氨气用水吸收,浸出时间2h,得到固液混合体系。
3)过滤固液混合体系,洗涤沉淀渣,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。
4)在步骤2)得到的氨水中加入5.5kg含氨25%的氨水(补充的氨水和步骤2)中浸出用的铵盐摩尔比NH3:NH4+为2:1),然后将步骤3)得到的镁盐浸出液与氨水反应,得到氢氧化镁沉淀和铵盐溶液,分离沉淀、烘干、在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末,称量得到氧化镁质量为524g。
实验2
用前面实验1的步骤4)中回收的铵盐溶液来进行轻烧镁粉浸出:
将实验1步骤4)中沉淀氢氧化镁后过滤所得铵盐溶液浓缩至原体积15L,与900g轻烧镁粉加入到反应釜中,反应时间设为2h,调节水浴温度90℃,反应过程中不断搅拌速度为180rpm,并调节负压为相对真空度-0.07Mp,所蒸出的氨气用水吸收,待浸出结束,过滤固液混合体系,洗涤沉淀渣,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。用吸收所得氨水与镁盐浸出液反应,分离沉淀,烘干,在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末,称量氧化镁质量为572g。
实验3
用实验2最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验2相同,得到氧化镁粉末577g。
实验4
用实验3最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验3相同,得到氧化镁粉末569g。
通过实验2-4的循环试验可知,用所述菱镁矿为原料在850℃下煅烧1.5h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉,在该条件下硫酸铵溶液可以循环浸出,产生氨水中额外补加一定量氨水可以循环沉淀获得氢氧化镁,进一步煅烧则能获得氧化镁,且在3次循环中,氧化镁产量较稳定,说明该条件下,用煅烧菱镁矿为原料,循环生产高纯氧化镁工艺可行性高,高纯氧化镁质量和与原料相近,因此原料利用率高、产率高。
实施例9 用菱镁矿制备高纯氧化镁
实验1
按照如下步骤操作:
1)用表1的菱镁矿为原料,在750℃下煅烧2h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉。
2)取氯化铵固体1.31kg,硫酸铵595g,加入水充分溶解,调节溶液体积为15L,再加入轻烧镁粉375g(固液比为25g/L,NH4+:MgO为4.0:1),加入到反应釜中,调节水浴温度95℃,反应过程中不断搅拌速度为120rpm,并调节负压为相对真空度-0.098Mp,所蒸出的氨气用水吸收,浸出时间1h,得到固液混合体系。
3)过滤固液混合体系,洗涤沉淀渣,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。
4)在步骤2)得到的氨水中加入9.1kg含氨25%的氨水(补充的氨水和步骤2)中浸出用的铵盐摩尔比NH3:NH4+为4:1),然后将步骤3)得到的镁盐浸出液与氨水反应,得到氢氧化镁沉淀和铵盐溶液,分离沉淀、烘干、在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末,称量得到氧化镁质量为227g。
实验2
用前面实验1的步骤4)中回收的铵盐溶液来进行轻烧镁粉浸出:
将实验1步骤4)中沉淀氢氧化镁后过滤所得铵盐溶液浓缩至原体积15L,与375g轻烧镁粉加入到反应釜中,反应时间设为1h,调节水浴温度95℃,反应过程中不断搅拌速度为120rpm,并调节负压为相对真空度-0.098Mp,所蒸出的氨气用水吸收,待浸出结束,过滤固液混合体系,洗涤沉淀渣,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。用吸收所得氨水与镁盐浸出液反应,分离沉淀,烘干,在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末,称量氧化镁质量为271g。
实验3
用实验2最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验2相同,得到氧化镁粉末267g。
实验4
用实验3最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验3相同,得到氧化镁粉末282g。
通过实验2-4的循环试验可知,用所述菱镁矿为原料在750℃下煅烧2h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉,在该条件下氯化铵溶液可以循环浸出,产生氨水中额外补加一定量氨水可以循环沉淀获得氢氧化镁,进一步煅烧则能获得氧化镁,且在3次循环中,氧化镁产量较稳定,说明该条件下,用煅烧菱镁矿为原料,循环生产高纯氧化镁工艺可行性高,高纯氧化镁质量和与原料相近,因此原料利用率高、产率高。
实施例10 用菱镁矿制备高纯氧化镁
实验1
按照如下步骤操作:
1)用表1的菱镁矿为原料,在700℃下煅烧2h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉。
2)取硝酸铵固体12.0kg,七水硫酸镁740g,加入水充分溶解,调节溶液体积为15L,再加入轻烧镁粉1200g(固液比为80g/L,NH4+:MgO为5.6:1),加入到反应釜中,调节水浴温度90℃,反应过程中不断搅拌速度为300rpm,并调节负压为相对真空度-0.08Mp,所蒸出的氨气用水吸收,浸出时间3h,得到固液混合体系。
3)过滤固液混合体系,洗涤沉淀渣,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。
4)在步骤2)得到的氨水中加入20.4kg含氨25%的氨水(补充的氨水和步骤2)中浸出用的铵盐摩尔比NH3:NH4+为2:1),然后将步骤3)得到的镁盐浸出液与氨水反应,得到氢氧化镁沉淀和铵盐溶液,分离沉淀、烘干、在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末,称量得到氧化镁质量为685g。
实验2
用前面实验1的步骤4)中回收的铵盐溶液来进行轻烧镁粉浸出:
将实验1步骤4)中沉淀氢氧化镁后过滤所得铵盐溶液浓缩至原体积15L,与1200g轻烧镁粉加入到反应釜中,反应时间设为3h,调节水浴温度90℃,反应过程中不断搅拌速度为300rpm,并调节负压为相对真空度-0.08Mp,所蒸出的氨气用水吸收,待浸出结束,过滤固液混合体系,洗涤沉淀渣,洗涤液与滤液合并得到镁盐浸出液,沉淀渣抛尾。用吸收所得氨水与镁盐浸出液反应,分离沉淀,烘干,在750℃煅烧2h,常温冷却,即获得白色氧化镁粉末,称量氧化镁质量为862g。
实验3
用实验2最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验2相同,得到氧化镁粉末875g。
实验4
用实验3最后一步回收的铵盐溶液来进行轻烧镁粉浸出,其余步骤与实验3相同,得到氧化镁粉末869g。
通过实验2-4的循环试验可知,用所述菱镁矿为原料在700℃下煅烧2h,获得轻烧镁粉,再经过破碎,筛分,获得粒度为-200目煅烧氧化镁矿粉,在该条件下硝酸铵溶液可以循环浸出,产生氨水中额外补加一定量氨水可以循环沉淀获得氢氧化镁,进一步煅烧则能获得氧化镁,且在3次循环中,氧化镁产量较稳定,说明该条件下,用煅烧菱镁矿为原料,循环生产高纯氧化镁工艺可行性高,高纯氧化镁质量和与原料相近,因此原料利用率高、产率高。
实施例11 产品质量检测
对上述实施例制得的产品进行检测:
如图2所示,为实施例1中实验1中步骤4)氨水沉淀所得氢氧化镁的XRD图谱,对称性好,波峰尖锐,并无杂峰,与标准图谱PDF74-2220对比吻合十分好,氢氧化镁纯度十分高,为煅烧获得高纯氧化镁提供基础。
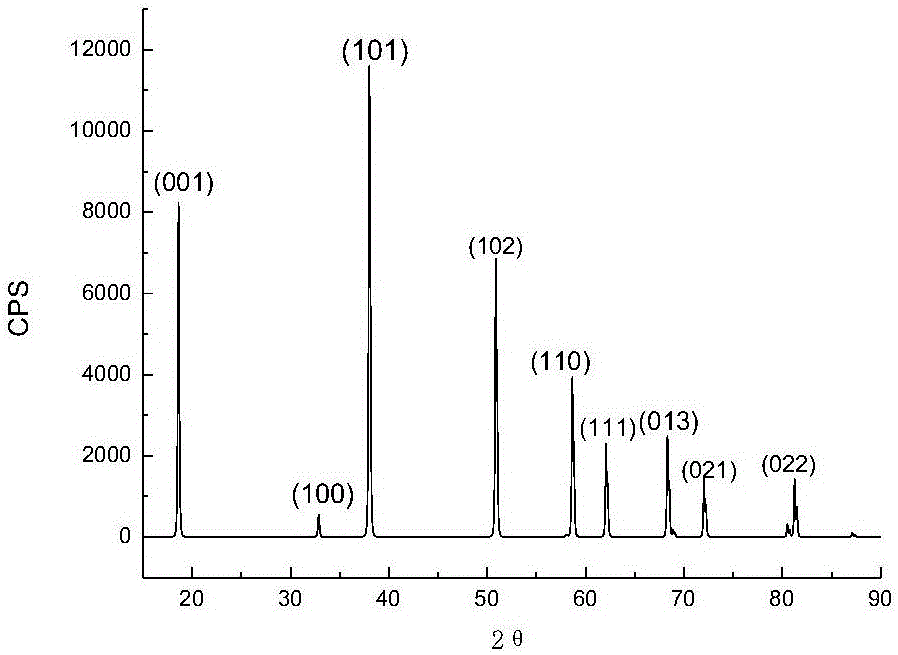
如图3所示,为图2中氢氧化镁煅烧所得氧化镁XRD图谱,对称性好,波峰尖锐,并无杂峰,与标准图谱PDF77-2364对比吻合十分好,氧化镁纯度十分高,将有着广阔的应用前景。
如图4所示,为实施例1中实验1中步骤3)获得的纤维状氢氧化镁XRD图谱,由图可知,对称性好,波峰尖锐,并无氧化铁,氧化铝或二氧化硅等杂峰,与标准图谱PDF74-0239对比吻合较好,说明煅烧氧化镁在溶液中已水化转化为氢氧化镁,且通过上中层悬浮液与下层铁,铝,硅杂质分离较完全。
如图5所示,为实施例1中实验1中步骤3)获得的纤维状氢氧化镁SEM图,由图可知,该纤维状氢氧化镁有较大长径比,为15~40,为作为阻燃剂降低用量能提供条件。
实施例1-10所得氧化镁XRF成分定量分析结果如表2所示,进一步表明纯度高,杂质少。
表2 氧化镁产品XRF化学成分分析
实施例12
申请人做了轻烧镁粉用铵盐溶液常压下浸出的验证试验和减压下浸出试验作对比,硝酸铵为浸出剂,在常压下浸出条件为,硝酸铵800.4g,加水溶解定容至1L,轻烧镁粉222.2g,即铵盐与氧化镁摩尔比为2:1,铵盐浓度高达10mol/L浸出温度95℃,转速120rpm,及时补加蒸发水保证溶液体积一定,以容量法测定了不同时间下溶液中镁离子浓度和浸出率;在减压试验中,硝酸铵160g,摩尔比为2:1,加水溶解定容至1L,轻烧镁粉44.4g,设定浸出温度90℃,相对真空度-0.09Mp,转速120rpm,及时补加蒸发水保证溶液体积一定,以容量法测定了不同时间下溶液中镁离子浓度和浸出率。最后将浸出4h后常压下浸出液过滤,中加入25%氨水370ml,将浸出2h后减压条件下浸出液过滤,加入25%氨水370ml。分别过滤,干燥滤饼,在750℃下煅烧2h,称量氧化镁质量,计算产率。
通过图6和图7可知,减压下低浓度铵盐和氧化镁含量溶液中,镁盐浸出浓度和浸出率在短时间内明显超过常压高浓度铵盐浸出率。在常压95℃下浸出,0.5~4h中镁离子浓度变化很小,即使浸出4h,镁离子浓度为1.25mol/L,浸出4h后浸出液中加入370ml氨水,此时氨水已经过量,并无白色氢氧化镁沉淀生成,过1h后才出现沉淀,氧化镁质量21.2g,产率10.6%;减压中,铵离子浓度更小,浸出温度略低,在0~3h内镁离子浓度和浸出率持续增加,镁离子浓度更高,试验时在减压浸出1h浸出液中加入氨水立即出现白色沉淀,在浸出2h后滤液中加入370ml氨水,此时氨水已经过量,氧化镁质量为29.4g,产率为73.5%,随着浸出时间的延长,浸出率和产率还可以进一步提高。原因是铵盐浸出镁离子为可逆反应,生成的氨分子在水中溶解度较大,常压下蒸氨难以溢出,即使延长时间,反应平衡仍然难以正向移动,加入浓氨水,由于浸出液中铵盐浓度很高,会抑制氨水电离表现碱性,因此镁离子浓度虽然可以达到1.25mol/L,仍然沉淀量很少。因此常压浸出可行性不大,减压能有效浸出并沉淀出氢氧化镁,提高产率。
- 还没有人留言评论。精彩留言会获得点赞!