亚铁‑硅酸配合物活化分子氧原位产生过氧化氢的方法与流程
本发明属于环保领域,具体涉及一种亚铁-硅酸配合物活化分子氧原位产生过氧化氢的水处理方法。
背景技术:
过氧化氢是一种同时具有氧化和还原特性的化合物,遇到氧化性物质,显示还原性;遇到还原性物质,显示出一定的氧化性。同时,由于过氧化氢的氧化产物是氧气,还原产物是水,所以被认为是一种绿色、无二次污染的化学品,在生产和生活领域有广泛应用。在化工领域,过氧化氢可以用于化学品的合成原料;在环保领域,过氧化氢能够产生消毒效应、氧化效应,同时能够与亚铁离子产生Fenton效应(形成的羟基自由基,能够产生强烈的高级氧化效应);在社会生活领域,过氧化氢的稀溶液被用于消毒和脱色等等。
工业上过氧化氢的生产方式主要是乙基蒽醌法,通过这一方法能够产生质量浓度30%的过氧化氢。在实际的应用中,使用高浓度的过氧化氢存在腐蚀和爆炸的安全风险。因此,原位合成或者生成过氧化氢更加安全可靠,成为各种环保应用的首选。所谓原位合成,是指在应用的场所通过物理化学或者生物反应直接产生过氧化氢,而不是通过外加过氧化氢的方式产生。原位合成低浓度的过氧化氢,不会产生安全风险,同时,在铁离子或者其他过渡金属催化剂存在的条件下,能够产生Fenton高级氧化效应,用于污水处理、氧化消毒、污泥脱水、环境修复等等。因此,寻求成本节约、简便易行的过氧化氢原位生成方法,一直是环保领域的热点领域。
目前,原位产生过氧化氢的有多种,大致可以分为电化学过程和非电化学过程,其基本的原理都是对分子氧(O2)进行还原,产生过氧化氢。其中电化学过程主要采用阴极还原过程(气体扩散电极、石墨和碳阴极、金属泡沫阴极等),阴极的电子直接传递给O2,产生过氧化氢。非电化学方式,主要包括化学还原氧分子、酶催化还原氧分子和微生物还原氧分子产生过氧化氢的几种方式。其中,采用化学还原性物质对氧分子进行还原产生过氧化氢,是近年来发现的一个新现象,又称为氧分子活化方法。目前发现,具有氧分子活化效应的化学还原性物质主要包括了零价铁金属、铁的硫化物和亚铁的配合物等。其中,零价铁和铁的硫化物产生的过氧化氢浓度不高,且由于零价铁和铁硫化物是强还原性的异相催化剂,使得产生的过氧化氢缺乏环保应用价值。零价铁亚铁配合物主要包括了亚铁-乙二胺四乙酸配合物(Fe(II)-EDTA)和亚铁-四聚磷酸等,这几种配合物,具有更强的还原能力(即更低的氧化还原电位),同时,因为在水体中呈现溶解态,能够与产生的过氧化氢进一步作用,产生强烈的均相Fenton效应,所以,这两种配合物能够在分子氧存在的条件下,降解有机污染物。但是,由于EDTA和四聚磷酸在水体中会产生二次污染,使得现有的铁配合物还原产生过氧化氢的方法并不能在污水处理等环保领域得到应用。
技术实现要素:
为克服现有技术方法的不足,本发明提出了一种亚铁-硅酸配合物活化分子氧,产生过氧化氢的方法。硅酸和层状二硅酸,可以与亚铁离子在pH 5-9的区间内,形成溶解性的配合物(以SIL-Fe2+表示),该配合物具有更低的氧化还原电位,能够将溶解在水体中的氧分子直接还原,产生过氧化氢。
一种亚铁-硅酸配合物活化分子氧原位产生过氧化氢的水处理方法,如图1所述,包括以下步骤:向有机废水中加入可溶性硅酸盐,调节溶液的pH值为5-9,然后加入亚铁离子,硅酸根和亚铁离子形成亚铁-硅酸配合物(SIL-Fe2+配合物);持续通入氧气或空气,亚铁-硅酸配合物对O2进行单电子还原,生成超氧阴离子自由基·O2-,超氧阴离子自由基进一步被还原为H2O2,从而使有机废水中原位产生均相Fenton氧化效应。
所述的可溶性硅酸盐为偏硅酸钠或二硅酸钠。
所述的亚铁离子通过以下方式添加:(i)直接加入二价铁盐;(ii)由铁阳极电解产生或(iii)由零价铁腐蚀产生。
所述的二价铁盐包括硫酸亚铁、氯化亚铁、硫酸亚铁铵等。
所述的零价铁,为微米零价铁或纳米零价铁。
所述的亚铁离子由铁阳极电解产生时,整个水处理过程持续通电流,阳极采用铸铁电极。
体系中可溶性硅酸盐浓度为2-50mmol/L。
体系中亚铁离子的浓度为1-10mmol/L。
本发明的化学原理如下:
[SIL-Fe2+]+O2→[SIL-Fe3+]+·O2-
[SIL-Fe2+]+·O2-+2H2O→[SIL-Fe3+]+H2O2+2OH-
[SIL-Fe2+]+H2O2→[SIL-Fe3+]+·OH+OH-
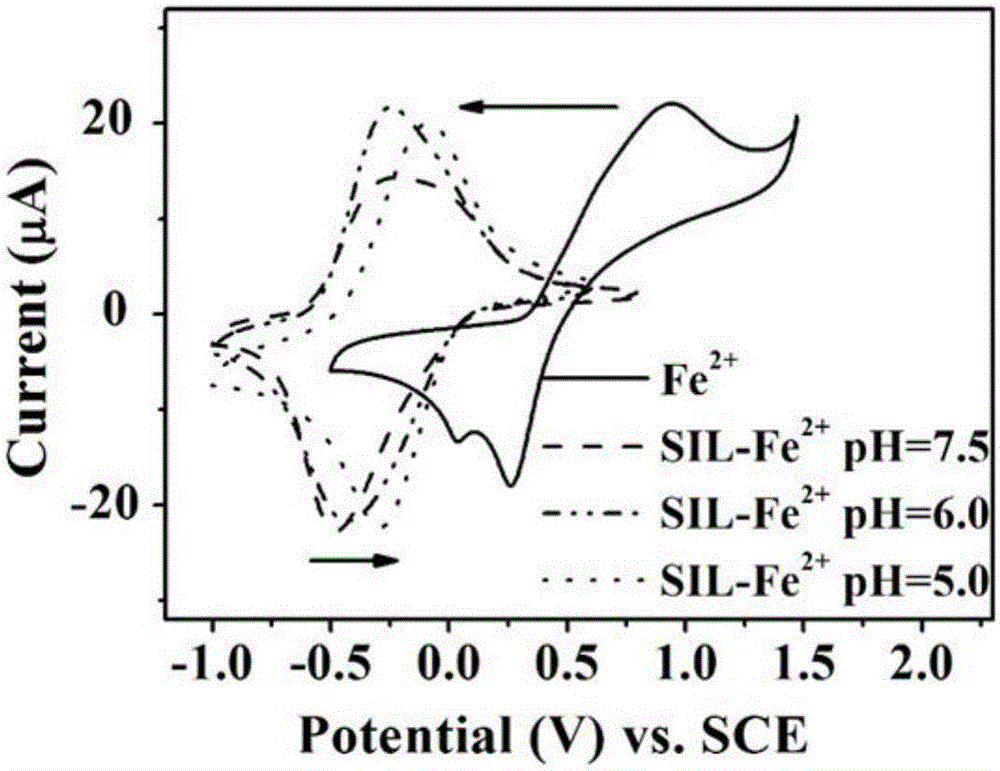
图2给出了SIL-Fe2+与酸性溶液中Fe3+/Fe2+电对的对比,证实这一配合物的氧化还原电位确实比pH=3的亚铁离子/铁离子的氧化还原电位低了将近1.1V vs.SCE.由于SIL-Fe2+配合物的存在,水中的溶解氧发生单电子还原,生成的过氧化氢最终与亚铁配合物反应,生成大量的羟基自由基,可以对污染物进行高效的降解矿化。相比较现有的亚铁配合物体系相比,硅酸盐作为一种无毒、无害的无机配合剂,首先,自身不会发生分解,也不会与待降解的含碳有机污染物竞争羟基自由基,用于水处理完全符合国家的现有各种污水排放标准(硅含量不是排水水质检测指标)。
本发明中,能够与亚铁形成配合物的硅酸盐包括偏硅酸钠、二硅酸钠,体系中硅酸盐的浓度为2-50mmol/L。同时,要求溶液的pH范围为5~9,在这一区间外,pH过低,则亚铁离子主要以自由的非配合形式存在,pH过高,亚铁离子与氢氧根结合,形成氢氧化铁,也不能形成良好的SIL-Fe2+配合物。
初始亚铁离子浓度为1-10mmol/L的情况下,能够在水溶液中产生的过氧化氢的平衡浓度为0.1mM-2mM。产生的过氧化氢可以通过以下反应,产生均相Fenton效应:
[SIL-Fe2+]+H2O2→[SIL-Fe3+]+·OH+OH-
Fenton反应可进一步氧化染料、农药、抗生素等有机物质,实现废水处理的目标。这一方法中,亚铁离子可以来源于自然水体,可以由人工投加到溶液中的二价铁盐产生,可以由零价铁与水溶液反应发生,还可以由铁阳极电解产生。本发明在环境修复、水处理等领域有广泛的应用前景。
附图说明
图1为亚铁-硅酸配合物活化分子氧原位产生过氧化氢的水处理方法示意图;
图2为不同条件下的SIL-Fe2+与酸性溶液中Fe3+/Fe2+电对的循环伏安图(氧化还原电位对比)。
图3为有无二硅酸钠存在条件下H2O2浓度随时间变化的对比图。
图4为有无亚铁-二硅酸配合物存在条件下氯酚残留率随时间变化的对比图。
图5为不同电流密度下H2O2浓度随时间变化的对比图。
图6为不同电流密度下氯酚的残留率随时间变化的对比图。
具体实施方式
以下通过具体实施例来进一步阐述本发明的技术方案,但本发明的保护范围并不局限于以下实施例。
实施例1
采用外加的硫酸亚铁作为亚铁源。在500mL烧杯中加入250mL含氯酚20mg/L的水溶液,并加入20mmol/L的二硅酸钠,采用硫酸调节初始的pH值为7.5,然后加入5mmol/L的硫酸亚铁,并通过纯氧气(速率为2mL/s)。在特定的取样时间,测定体系中氯酚和过氧化氢的浓度。其中氯酚的浓度由液相色谱测定,过氧化氢由钛盐法测定。作为对照,另一组实验,不加入二硅酸钠,只是将溶液的pH调节为7.5,并加入5mmol/L硫酸亚铁,并在相同的反应时间取样,测定氯酚浓度和过氧化氢。从图3可以看出,在有二硅酸钠存在的溶液中,产生了0.2mmol/L的过氧化氢浓度峰值,这一浓度的过氧化氢随着污染物氯酚的分解而逐渐消耗。从图4中可以看到,在有亚铁-二硅酸配合物存在的溶液中,氯酚的浓度下降了40%,说明产生的过氧化氢和亚铁-二硅酸配合物作用,产生了均相Fenton效应,有效地降解了氯酚污染物。
实施例2
采用电解的方式产生亚铁离子作为亚铁源。采用铸铁阳极和钌钛阴极组成电解系统,电解池内装175mL氯酚溶液,其中氯酚的浓度为20mg/L,外部循环水的温度为25℃,使用二硅酸钠作为螯合剂,二硅酸钠的浓度为5mmol/L,体系初始pH值为7.5,电流为5mA(或者10mA,或者20mA),通入氧气。在特定的时间点测定体系中过氧化氢及氯酚的浓度,测试方法同实施例2。结果如图5和图6所示,可以看出,使用二硅酸钠作为电解质时,溶液中的过氧化氢累积浓度不断升高,经过三小时的电解反应,20mA条件下,过氧化氢的浓度上升到了0.85mmol/L。同时,氯酚被降解了95%以上(20mA条件),说明该方法对于氯酚的降解十分有效。
实施例3
采用微米级零价铁的方式产生亚铁离子。在500mL烧杯中加入250mL含苯酚20mg/L的水溶液,并加入10mmol/L的二硅酸钠,采用硫酸调节初始的pH值为7.5,然后加入5g的微米级粒径的零价铁,并通过纯氧气(2mL/s),并搅拌溶液,使溶液中的零价铁颗粒处于悬浮状态。在特定的取样时间,通过液相色谱测定体系中苯酚的浓度。作为对照,另一组不加入二硅酸钠,只加入零价铁,其他条件相同。结果表明,经过2小时的反应,在含有10mmol/L的二硅酸钠的溶液中,苯酚的去除率超过了80%,而在对照实验组,苯酚的去除率只有20%。这一结果说明,在含有二硅酸钠的溶液中,存在强烈的苯酚氧化降解过程,即由过氧化氢原位产生所诱导的Fenton氧化过程。
- 还没有人留言评论。精彩留言会获得点赞!