具有降血糖作用的化合物、组合物及其用途的制作方法
本发明属于生物制药领域,具体涉及具有降血糖作用的化合物、组合物及它们的用途。
背景技术:
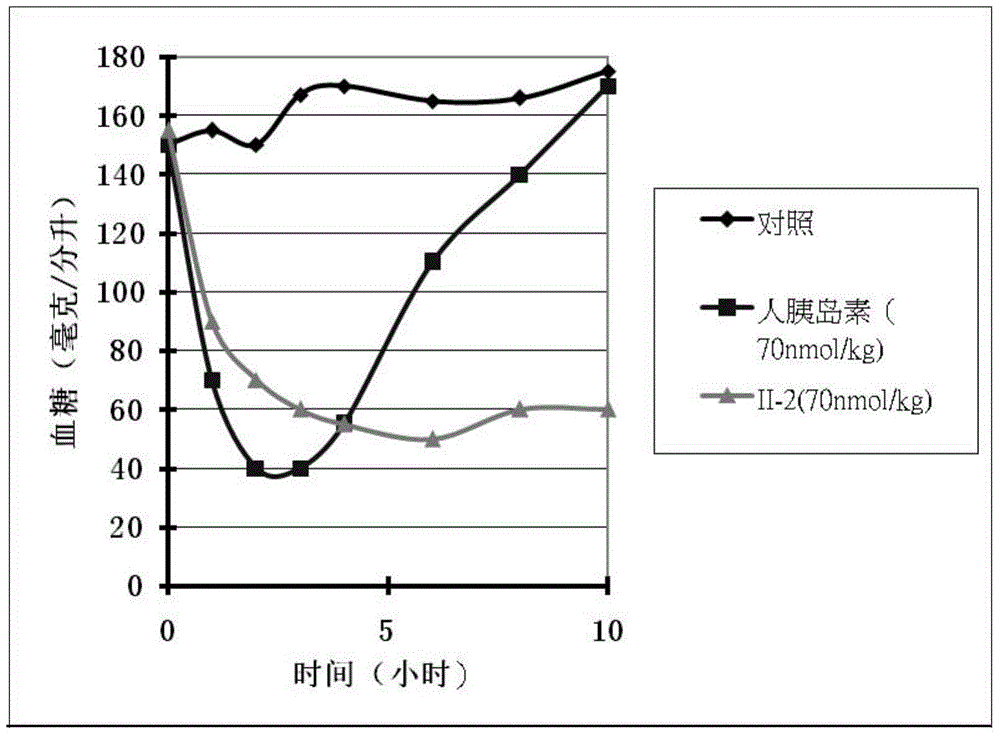
:胰岛素作为治疗糖尿病的特效和首选药物,到目前为止已经历了三代的历史演变:第一代产品是从猪或牛等动物胰脏提取而来。由于异源性过敏反应,该类产品疗效较差。第二代产品为重组人胰岛素,是从人类细胞中获取胰岛素基因,然后将其插入酵母菌或大肠杆菌中进行培养,通过复杂的现代化生物基因技术生产而成。第三代为胰岛素类似物,是通过对人的胰岛素进行结构修改获得,包括速效胰岛素和长效胰岛素。本世纪初美国的NHANS研究、欧洲的CODE研究等大型临床研究表明,对糖尿病及其并发症越来越严格的控制,使得糖尿病患者的高血压、高血脂、总胆固醇达标率越来越高,而最根本的血糖达标率却不升反降,主要问题在于现有的胰岛素药物仍然不能够很好地模拟生理性胰岛素分泌模式。因此,开发在疗效、抗免疫源、治疗达标、模拟生理分泌等方面都有大幅度提高的新型胰岛素类似物将是改善糖尿病治疗效果的主要解决方法之一。美国糖尿病学会(ADA)与欧洲糖尿病学会(EASD)指南均建议,在生活方式干预和口服降糖药物治疗后,如果糖尿病患者的血糖控制仍然不理想,应尽早开始胰岛素治疗,而且首选基础胰岛素与口服降糖药合用。若此疗法仍不能控制血糖,建议在此基础上在就餐时加用速效胰岛素。基础胰岛素用于维持空腹时的正常血糖分泌。很多代谢研究发现在正餐之间和夜晚时间,保持基本胰岛素水平可以减少甘油三磷酯分解,抑制肝脏输出葡萄糖,使空腹血糖保持稳定,从而降低整体血糖水平。理想的基础胰岛素,如长效胰岛素类似物,应该能够模拟生理性胰岛素分泌模式,避免发生低血糖尤其是夜间低血糖,不增加体重。目前使用的最多的中长效胰岛素可以分为三大种类。第一类是人胰岛素与锌离子或基础鱼精蛋白形成的晶体的悬浮液,例如NPH胰岛素,lente胰岛素等。这些胰岛素制剂的疗效不稳定,正逐渐被长效胰岛素类似物取代。第二种是地特胰岛素(detemir)。它是十四烷酸链接至B29赖氨酸的胰岛素类似物。地特胰岛素在注射后吸收缓慢。注射处的消失时间T50%大约是10小时。它与血液中的白蛋白通过B29位的脂肪酸结合,然后从复合体中缓慢解离。双六聚体化(Dihexamerization),六聚体和二聚体与白蛋白结合都延长了地特胰岛素在注射处的留存时间。地特胰岛素进入血液循环后,与白蛋白结合,进一步延长了体内停留时间。第三种是甘精胰岛素药物在pH3.0时溶解在制剂中,而注射后当pH上升到大约7.4时结晶。注射位点的缓慢分解带来了延迟的效果。但是吸收性质和药物动力学在人群中和个体内变化都很大。甘精胰岛素和地特胰岛素是目前市场上仅有的两种长效胰岛素类似物,最长作用时间不超过24小时。甘精胰岛素在胰岛素样生长因子-1受体(IGF-1R)上活性远高于天然人胰岛素。因为胰岛素样生长因子-1受体与多种癌症的发生密切相关,所以一直有争议长期使用甘精胰岛素是否会增加病人患癌症的风险。地特胰岛素在人体内的生物活性大约是天然人胰岛素的20%,因此它的使用剂量是常规胰岛素剂量的5倍,这显著增加了生产和使用成本。重组人胰岛素难以满足餐时胰岛素需求。人胰岛素分子通常形成六聚体结构,皮下注射后逐渐解聚成二聚体,进一步解离为单体才能透过毛细血管进入循环,发挥降糖作用。由于存在解聚、吸收过程,重组人胰岛素在皮下注射后约30分钟才起效,达峰时间长,作用持续大约6~7小时。而且因个体差异,注射相同剂量人胰岛素后最终进入循环的量也会有明显差异。人胰岛素的局限性带来两个不利后果。一方面,为保证降低餐后血糖,糖尿病人必须在餐前30分钟皮下注射人胰岛素,进餐时间提前易导致血糖控制不佳,延后则易引起低血糖。另一方面,由于人胰岛素皮下注射后存在解聚和个体吸收差异,最终进入循环的胰岛素量无法精确预估,容易造成胰岛素过量或不足。速效胰岛素类似物(如门冬胰岛素、赖脯胰岛素等)的研发正是为了弥补人胰岛素的不足。速效胰岛素类似物吸收快,达峰时间短,峰值更高,峰浓度持续1~3小时,作用持续时间为3~5小时,明显优于人胰岛素。但门冬胰岛素和赖脯胰岛素的起效时间大约是20分钟,对于糖尿病人来说仍然不够方便,仍然有很大改进余地。因此,开发新型胰岛素类似物,提高生物活性和生物利用度、延长作用时间(长效胰岛素)或缩短起效时间(速效胰岛素)、改善水溶解度、降低了用药时的个体差异、更有效地防止低血糖风险、增加稳定性是胰岛素类药物开发的重要方向。技术实现要素:本发明的目的是提供具有胰岛素活性、能够与胰岛素受体高度结合、具有降血糖作用的化合物、药物学可接受的组合物及其在降血糖中的应用。本发明的第一个方面是提供一种具有降血糖作用的化合物,所述化合物的氨基酸序列为:X107HLC[1]GSX108LVEALYLVC[2]GEX109GFX110X111X112X113X114X115-CL-GIVEQC[3]C[4]X116SIC[5]SLYQLENYC[6]X117X118,其中,X107是苯丙氨酸-缬氨酸-天冬酰胺-谷氨酰胺四肽、缬氨酸-天冬酰胺-谷氨酰胺三肽、天冬酰胺-谷氨酰胺二肽、或谷氨酰胺,或是以赖氨酸或精氨酸取代上述二、三、四肽序列中任何一个氨基酸残基后的序列,或缺失;X108是组氨酸、苯丙氨酸、精氨酸或谷氨酰胺;X109是精氨酸、丙氨酸、谷氨酸或天冬氨酸;X110是苯丙氨酸、酪氨酸或组氨酸;X111是酪氨酸、苯丙氨酸或缺失;X112是苏氨酸、天冬酰胺、谷氨酸、天冬氨酸或缺失;X113是脯氨酸、赖氨酸、谷氨酸、天冬氨酸或缺失;X114是赖氨酸、脯氨酸、精氨酸、谷氨酸、天冬氨酸或缺失;X115是苏氨酸或缺失;X116是苏氨酸、组氨酸或精氨酸;X117是丙氨酸、甘氨酸或天冬酰胺;X118是赖氨酸、精氨酸-赖氨酸二肽或缺失;CL是本文中所定义的连接片段。在第二个方面,本发明进一步提供一种具有降血糖作用的、在多肽基础上进行修饰的化合物,以进一步提高所述化合物的溶解度、稳定性、体内循环作用时间等。所述修饰是将修饰侧链连接至本发明的化合物的N-末端氨基酸残基的α-氨基,或者连接至本发明的化合物中存在的赖氨酸的ε-氨基。所述化合物的结构为:X300VNQHLC[1]GSHLVEALYLVC[2]GERGFX301X302X303X304X305X306GX307X308X309X310X311X312X313X314X315X316X317GIVEQC[3]C[4]X318X319X320C[5]X321LX322X323LX324X325YC[6]X326X327,其中,X300是苯丙氨酸或UL-苯丙氨酸;X301是苯丙氨酸、组氨酸或酪氨酸;X302是酪氨酸、苯丙氨酸或缺失;X303是苏氨酸、天冬酰胺、谷氨酸、天冬氨酸或缺失;X304是脯氨酸、赖氨酸、谷氨酸、天冬氨酸或缺失;X305是天冬氨酸、谷氨酸、脯氨酸、精氨酸、赖氨酸或缺失,或通式(I)结构;X306是苏氨酸、通式(I)结构或缺失;X307是赖氨酸、丝氨酸、丙氨酸、甘氨酸、通式(I)结构或缺失;X308是甘氨酸、通式(I)结构或缺失;X309是赖氨酸、甘氨酸、丝氨酸、通式(I)结构或缺失;X310是赖氨酸、甘氨酸、丝氨酸、通式(I)结构或缺失;X311是赖氨酸、甘氨酸、丝氨酸、丙氨酸、通式(I)结构或缺失;X312是赖氨酸、精氨酸、丙氨酸、脯氨酸、甘氨酸、通式(I)结构或缺失;X313是甘氨酸、丙氨酸、精氨酸、赖氨酸、谷氨酰胺、脯氨酸、通式(I)结构或缺失;X314是精氨酸、丙氨酸、脯氨酸、苏氨酸、谷氨酰胺、甘氨酸、通式(I)结构或缺失;X315是脯氨酸、谷氨酰胺、精氨酸、甘氨酸或缺失或通式(I)结构;X316是谷氨酰胺、苏氨酸、精氨酸、甘氨酸或缺失或通式(I)结构;X317是苏氨酸、精氨酸、赖氨酸或缺失;X318是苏氨酸、组氨酸、精氨酸或通式(I)结构;X319是丝氨酸或通式(I)结构;X320是异亮氨酸或通式(I)结构;X321是丝氨酸或通式(I)结构;X322是酪氨酸或通式(I)结构;X323是谷氨酰胺或通式(I)结构;X324是谷氨酸或通式(I)结构;X325是天冬酰胺或通式(I)结构;X326是丙氨酸、甘氨酸或天冬酰胺;X327是赖氨酸、精氨酸-赖氨酸二肽或缺失,或为通式(I)结构;当X327为二肽时,其中一个氨基酸为通式(I)结构;UL和通式(I)结构如本文中所定义。本发明的第三个方面是提供一种药物组合物,由本发明的具有降糖作用的化合物和药物学可接受的载体混合而成,混合比例可以是大约90/10%、大约80/20%、大约70/30%、大约60/40%、大约50/50%、大约40/60%、大约30/70%、大约20/80%或者大约10/90%;优选地,所述组合物进一步包含速效胰岛素类似物;所述速效胰岛素类似物可以是AspB28人胰岛素、LysB28ProB29人胰岛素或LysB3GluB29人胰岛素。本发明的第四个方面是提供本发明的化合物在制备治疗糖尿病或高血糖症等药物中的应用。本发明的第五个方面是提供一种治疗糖尿病或高血糖症等的方法,包括对需要的病患施用本发明的化合物或组合物。与现有的胰岛素及其类似物相比,本发明的化合物水溶性好,具有结合胰岛素受体的高活性,毒副作用低,制备容易。修饰后的化合物在体内的循环时间明显延长。附图说明图1是小鼠皮下注射生理盐水、人胰岛素和本发明的Ⅱ-2化合物后血糖随时间变化值;图2是小鼠皮下注射生理盐水和本发明的Ⅱ-17化合物后血糖随时间变化值;图3是小鼠皮下注射生理盐水、人胰岛素和本发明的Ⅱ-11化合物后血糖随时间变化值。具体实施方式定义及术语除非另外说明,下述定义适用于本发明全文。未定义的术语可以根据行业内约定俗成的定义理解。“氨基酸”指任何同时包含氨基和羧基官能团的分子,α-氨基酸的氨基和羧基连接在同一个碳原子上(α碳)。α碳可以有1-2个有机取代基。氨基酸包含L和D同分异构体和消旋混合物。如无特别说明,本发明中多肽序列中的氨基酸残基都是L同分异构体即L-氨基酸,D-氨基酸在氨基酸名称或缩写前加小写字母“d”表示,如dK。表达方式“可编码氨基酸”或“可编码氨基酸残基”用于表示可以由核苷酸三联体编码的氨基酸或氨基酸残基。hGlu为高谷氨酸;α-hGlu为–HNCH(CO-)CH2CH2CH2COOH的L同分异构体;δ-hGlu为–HNCH(COOH)CH2CH2CH2CO-的L同分异构体;α-Asp为–HNCH(CO-)CH2COOH的L同分异构体;β-Asp为–HNCH(COOH)CH2CO-的L同分异构体;α-Glu为–HNCH(CO-)CH2CH2COOH的L同分异构体;γ-Glu为–HNCH(COOH)CH2CH2CO-的L同分异构体;β-Ala为–HN-CH2-CH2-COOH;Sar为肌氨酸。氨基酸残基可以用三字母氨基酸编码或者单字母氨基酸编码表示;氨基酸表如下所示:表一:氨基酸名称及简写中文名称英文名称三字母单字母中文名称英文名称三字母单字母甘氨酸GlycineGlyG苏氨酸ThreonineThrT丙氨酸AlanineAlaA半胱氨酸CysteineCysC缬氨酸ValineValV甲硫氨酸MethionineMetM亮氨酸LeucineLeuL天冬酰胺AsparagineAsnN异亮氨酸IsoleucineIleI谷氨酰胺GlutamineGlnQ脯氨酸ProlineProP色氨酸TryptophanTrpW苯丙氨酸PhenylalaninePheF丝氨酸SerineSerS酪氨酸TyrosineTyrY赖氨酸LysineLysK天冬氨酸AsparticacidAspD精氨酸ArginineArgR谷氨酸GlutamicacidGluE组氨酸HistidineHisH“天然胰岛素”指来源于天然、化学合成、基因工程生产的哺乳动物胰岛素(如人胰岛素,牛胰岛素,猪胰岛素等)。人胰岛素包含21个氨基酸组成的A链和30个氨基酸组成的B链。两条链通过3条二硫键相连:A7和B7、A20和B19、A6和A11。B7、A7指的是天然胰岛素B链位置7(从N端数起)的氨基酸残基以及胰岛素A链位置7(从N端数起)的氨基酸残基。“胰岛素类似物”是修改过的胰岛素多肽的通称,包括与天然胰岛素有同源序列的由A链和B链组成的双链分子,以及单链胰岛素类似物。“胰岛素类似物”具有天然胰岛素的部分、全部或增强活性,或者在体内或体外能够转化为具有天然胰岛素的部分、全部或增强活性的多肽,例如比天然胰岛素增加、减少或替换一个或多个氨基酸残基的多肽。人、动物乃至非哺乳动物的胰岛素原、前胰岛素原、胰岛素前体、单链胰岛素前体和类似物都称为"胰岛素类似物"。很多胰岛素类似物见诸于文献。除非特别另外说明,“胰岛素类似物”广义包括天然胰岛素和胰岛素类似物。如无特殊说明,本申请中涉及的胰岛素指人胰岛素。人胰岛素A链序列是SEQIDNO:124所示序列,人胰岛素B链序列是SEQIDNO:125所示序列。化合物的氨基酸编号规则:单链化合物指的是具有一般结构B链-CL-A链的多肽序列或修饰的多肽序列,其中B链是胰岛素的B链或类似物,A链是胰岛素的A链或类似物,CL是连接B链C末端氨基酸残基与A链N末端的肽链。如无特殊说明,本申请中以A链或B链位置说明的氨基酸,如A14、B28等表示与胰岛素的A链或B链相对应位置的氨基酸或其变化,其中胰岛素的A链或B链的编号从1开始。胰岛素A链和B链序列分别见SEQIDNO:124和125。化合物中半胱氨酸的编号:为方便描述,对本发明中的各化合物中的半胱氨酸进行编号,分别为C[1]~C[6],依次对应所述单链化合物从N端至C端的6个半胱氨酸。本发明的化合物是基于胰岛素的结构,因此本发明任何一个化合物的三级结构中都包含二硫键,且以与胰岛素相同的方式形成二硫键,即,C[1]和C[4]形成二硫键,C[2]和C[6]形成二硫键,C[3]和C[5]形成二硫键。本领域技术人员基于上述解释和公知常识完全可以理解并知晓本发明中任何一个化合物的二硫键位置。“修饰基团”胰岛素类似物可以包含1个或多个修饰基团。修饰基团能够提供胰岛素类似物需要的特征。例如,修饰基团可以降低胰岛素类似物在各种环境下(如消化道,血液)的降解速率。优选的修饰基团是那些允许胰岛素类似物保留相当胰岛素受体结合活性的基团。优选的修饰基团包括两性基团、水溶性基团,或者使胰岛素类似物比非修饰的类似物更低亲脂性、更高亲脂性、更高水溶性的基团。修饰基团可以包含可降解连接基。例如PAG;可以包括易于水解的连接基,如丙交酯、乙交酯、碳酸、酯、氨基甲酸酯。这种方法可以使聚合物降解成小分子量片段。修饰基团可以包括一个或多个亲水基团、亲脂基团、两性基团、成盐基团、间隔基团、连接基团、封端基团或这些基团的组合。各种基团可以以共价键,或以可水解或不可水解的键连接在一起。代表性亲水基团和亲脂基团介绍如下。亲水基团亲水基团的实例包括PAG基团、多糖、聚山梨醇酯以及这些基团的组合物。聚亚烷基二醇基团(PolyalkyleneGlycol,PAG)由多个亚烷基二醇单体组成。在一个实施例中,所有单体是相同的(例如聚乙二醇(PEG)或聚丙二醇(PPG))。在另一个实施例中,亚烷基二醇是不同的。聚合体可以是无规共聚物(例如环氧乙烷和环氧丙烷的共聚物),或者分枝或接枝共聚物。本文使用的“PEG”或聚乙二醇指任何水溶性聚乙二醇或聚氧化乙烯。聚乙二醇的化学结构式为-(CH2CH2O)n-,其中n可以是从2到2000的整数。PEG的一端通常是相对没有活性的官能团,如烷基或烷氧基等。烷基包括饱和的直链或支链烃基。烷氧基代表性的例子是甲氧基、乙氧基、丙氧基(例如1-丙氧基和2-丙氧基)、丁氧基(例如1-丁氧基、2-丁氧基和2-甲基-2-丙氧基)、戊氧基、己氧基等。使用甲氧基封端的PEG命名为mPEG,结构式CH3O(CH2CH2O)n-,但一般仍然称为PEG。PEG20K指分子量为20,000聚乙二醇分子。PEG另一端通常是活化官能团或者易于形成共价键的官能团,例如氨基、羧基、羟基、巯基、醛等。PEG-马来酰亚胺、PEG-乙烯砜和PEG-碘代乙酰基(CO-CH2-I)等可以与半胱氨酸侧链的巯基-SH反应形成稳定的共价键;PEG-NHS(琥珀酰亚胺)可以与多肽N末端α氨基或赖氨酸侧链氨基通过亲核取代反应(酰化)接合;PEG-醛与多肽的氨基在还原剂(如氰基硼氢化钠)作用下可以通过还原性烷基化反应接合。本发明中的PEG分子可以是直链的、支链的、分叉的或哑铃状的PEG。在一个实施例中,支链PEG可以用通式R(-PEG-nOH)m表示,其中R(通常是多羟基的)是核心基团,例如季戊四醇、糖、赖氨酸或甘油。m代表支链数,可以是从2起到核心基团附着位点最大数目,n代表PEG片段的数量,每个支链上的PEG片段的数量可以不等。一般情况下,n是2-1800的整数。在另一个实施例中,支链PEG可以用通式(CH3O-PEG-n)pR-Z表示,p等于2或3,R是赖氨酸或甘油,Z代表可以进行反应的活化官能团。在一个实施例中,分叉PEG用通式PEG(-L-X)n表示,L是连接基,X是末端活化官能团。PEG一般是多分散的,多分散指数小于1.05。PEG基团也可以是单分散的。单分散指PEG具有单一的长度(分子量),而不是各种长度(分子量)的混合物。糖基团代表性糖基团包括,但不局限于,甘油、单糖、二糖、三糖、寡糖和多糖如淀粉、糖原、纤维素和/或多糖树胶。特别的单糖包括C6及以上(特别是C6和C8)糖如葡萄糖、果糖、甘露糖、半乳糖、核酸糖或景天庚糖;二糖和三糖包括含有二或三个单糖单元(特别是C5至C8)的基团、例如蔗糖、纤维二糖、麦芽糖、乳糖和/或蜜三糖。其它亲水基团生物适合的聚阳离子基团包括骨架或侧链上具有多个氨基的聚胺基团,例如聚赖氨酸和其它天然或合成的氨基酸构成的具有多个正电荷的氨基酸聚合物,包括聚鸟氨酸、聚精氨酸、聚组氨酸,非多肽聚胺如聚氨基苯乙烯、聚氨基丙烯酸酯、聚-N甲基氨基丙烯酸酯、季胺聚合物等。生物适合的聚阴离子基团包括骨架或侧链上具有多个羧基的基团,如聚天冬氨酸、聚谷氨酸等。其它亲水基团包括天然或合成多糖,如壳聚糖、葡聚糖等。聚阴离子生物粘附剂某些亲水基团有潜在的生物粘附特性。这样的例子可见于美国专利US6,197,346。这些具有多个羧基的聚合物显示生物粘附特性。降解时显露出多个羧基的快速生物降解聚合物,如乳酸羟基乙酸共聚物、聚酐、聚原酸酯,也都是生物粘附剂。这些聚合物可以把胰岛素类似物投放到胃肠道。聚合物降解时暴露出来的羧基可以牢固附着在胃肠道,协助投放胰岛素类似物。亲脂基团在一个实施例中,修饰基团包括一个或多个亲脂基团。亲脂基团可以是本领域人员众所周知的,包括但不限于:烷基、链烯基、炔基、芳基、芳基烷基、烷基芳香基、脂肪酸、胆甾醇以及亲脂多聚物和低聚物。烃基可以是饱和、非饱和、直链的、支链的或环烃,具有一个或多个碳原子。在一个实施例中,烃基有1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30或更多的碳原子。烃基可以是无取代、或有一个或者多个取代基,这些取代基最好不会使结合物失去生物活性。亲脂基团也可以是脂肪酸,如天然的、合成的、饱和的、不饱和的、直链的或支链的脂肪酸。在一个实施例中,脂肪酸有2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或更多个碳原子。结合(Conjugation)策略修饰基团与多肽的结合程度、结合点的选择、修饰基团的选择要根据需要而变化,例如使结合物在体内不易降解,从而延长血浆半衰期。例如胰岛素类似物修饰后具有一个、两个、三个、四个或更多修饰基团。结合部位可能包括一个氨基酸残基,比如赖氨酸残基。在一个实施例中,胰岛素结合物是单结合物。在另一个实施例中,胰岛素结合物是多结合物。在另一个实施例中,胰岛素结合物是单结合物、双结合物、三结合物、四结合物等的混合物。修饰基团可以相同,也可以不同。当胰岛素结合物具有多个修饰基团时,一个或多个修饰基团最好通过可水解键与胰岛素结合物相连而其它一个或多个修饰基团最好通过不可水解键与胰岛素结合物相连。或者,所有修饰基团都通过可水解键与胰岛素结合物相连,但各个修饰基团在体内的水解速率有快有慢。理想的结合策略是使结合物具有原胰岛素类似物部分或全部生物活性。优选的结合部位包括N末端α氨基和赖氨酸侧链氨基另外可以通过在单链化合物的连接片段或A链、B链嵌入具有氨基或巯基的天然或非天然氨基酸残基来创造其它结合位点。修饰基团与胰岛素类似物可以通过可水解键(如酯,碳酸,可水解氨基甲酸酯)结合。可水解键使胰岛素结合物具有前药的效果。如果希望修饰基团与胰岛素结合物没有活性,比如修饰基团的结合部位在胰岛素类似物对胰岛素受体结合区,前药策略就是优选方法。当一个或多个修饰基团在一段时间内从胰岛素结合物脱离,从而释放出活性胰岛素类似物,使用可水解键能够提供延时释放或缓释的效果。在一个实施例中,胰岛素类似物通过非水解键(如酰胺键,醚键)与修饰基团相连。必要时,非水解键有助于延长胰岛素结合物在血浆中的循环时间。胰岛素同系物可以通过各种亲核官能团与修饰基团相连,包括但不局限于,亲核羟基或氨基。例如丝氨酸、苏氨酸、酪氨酸具有亲核羟基,组氨酸、赖氨酸或胰岛素类似物A链、B链N-末端都具有亲核氨基。胰岛素同系物也可以通过自由巯基-SH与修饰基团相连,例如形成硫酯、硫醚、磺胺键。分子量较小的多肽化合物在血浆中的循环时间短的一个重要因素就是肾清除。增加多肽化合物分子量直至超过肾清除临界点,可以显著降低肾清除率,延长多肽在体内作用时间。常用的方法是使多肽与天然或合成大分子形成可水解或不可水解键。生物大分子包括白蛋白、多糖、抗体(如IgG)等。血管中70%的白蛋白是巯基白蛋白(mercaptalbumin),其半胱氨酸-34的侧链巯基是血浆中活性最强的巯基。胰岛素类似物可以通过一个一端带有马来酰亚胺等活化官能团的连接基与其反应生成胰岛素-白蛋白结合物。连接基本身可以是长链脂肪酸或PEG分子。具体实例可以参照BioconjugateChem.2005,16,1000-1008。合成大分子包括聚乙二醇和葡聚糖。另一种方式是脂肪酸酰化,将在酰化胰岛素类似物部分讨论。近年来出现了以蛋白酶sortase催化使两个分子通过酰胺键结合的方法。Sortase是一种介导革兰阳性细菌细胞壁与表面蛋白共价结合的转肽酶,主要存在于革兰阳性细菌中。对GeneBankCDS和NCBI资料库的蛋白序列分析显示,sortase家族包括150多种蛋白序列,其中StaphylococcusaureussortaseA(SrtA或SrtAStaph)是目前研究最多的同种型(isoform)。有多篇文献揭示SrtA催化的转肽反应的分子机制。SrtA识别包含LPXTG(Leu-Pro-X-Thr-Gly)基序的底物,其184位的半胱氨酸作为亲核基团攻击LPXTG基序中的肽键Thr-Gly,由此产生一个酰基-酶中间体。苏氨酸羧基的硫酯中间体通过与底物的低聚甘氨酸(在S.aureus中是支链脂质II的前体交连桥的五甘氨酸(Gly5))的氨基基团发生亲核反应,产生新的连接产物。另一相关的Streptococcuspyogenessortase可以接受由两个丙氨酸构成的亲核基团,但S.aureus酶不能。这种sortase(SrtAstrep)切断LPXTA基序中的肽键Thr-Ala,允许以丙氨酸为基础的亲核基团。SrtAstrep也可以识别LPXTG基序,但活性较低。LPXTA基序不会被SrtAStaph切断。为简单起见,以下方法论述均以SrtAStaph为例,但SrtAstrep等同种型也可以用相同或相似的方法。SrtA对LPXTG基序和N端带有自由氨基的甘氨酸重复(a-Glyn)高度专一。X位可以是除半胱氨酸和色氨酸以外(尚未测试)的所有天然氨基酸。尽管有实验表明N端带有一个甘氨酸的多肽能够参与sortase催化的转肽反应,N端带有两个或两个以上的甘氨酸的底物可以达到最大反应效率。Sortase辅助连接(Sortasemediatedligation)一项主要应用就是将非天然功能团引入蛋白或多肽。非天然功能团可以是小分子、合成多肽或蛋白、聚合物等。这些功能团与LPXTG或a-Glyn融合而成的分子都可以成为SrtA的底物。具体方法和反应条件可以参照相关文献(如Tsukiji等,“Sortase-MediatedLigation:AGiftfromGram-PositiveBacteriatoProteinEngineering”,ChemBioChem,2009,10,787-798;Popp等,“Sortase-catalyzedtransformationsthatimprovethepropertiesofcytokines”,PNAS,2011,108,3169-3174)。SrtA能够在胰岛素类似物上引入非天然功能团,具体策略要根据胰岛素类似物的结构而定。对于双链胰岛素类似物,一般较少影响生物活性的结合位点是B链的N端或A链、B链的C端。如果结合位点是B链的N端,那么胰岛素B链的N端最好引入多个甘氨酸,如GGGGG-胰岛素B链,而要引入的修饰基团如PEG、长链脂肪酸或白蛋白等的C端要有LPXTG基序,比如PEG-LPATGGGG、白蛋白-LPETGGG或脂肪酸LPGTGGGGG等。如果结合位点是A或B链的C端,那么A或B链的C端氨基酸序列要包含LPXTG基序,比如可以变为胰岛素A-LPATGGGGG或胰岛素B-LPGTGGGG等,而要引入的修饰基团如PEG、长链脂肪酸或白蛋白等的N端要有一个或多个甘氨酸,如GGG-PEG、GGGG-长链脂肪酸、GGGGG-白蛋白等。对于单链胰岛素类似物,最容易的结合位点是B链的N端或A链的C末端,方法和双链类似物基本相同。单链化合物(基于胰岛素的单链化合物)在哺乳动物中,胰岛素在胰腺中的胰岛的β细胞中合成。胰岛素原是含有86个氨基酸的的单链前体,构造为:B链-ArgArg-C肽-LysArg-A链。C肽是由31个氨基酸组成的“连接肽”。Arg-Arg和Lys-Arg是蛋白水解酶作用使C肽从A和B链中分裂的分裂点,已知蛋白水解酶是激素原转化酶(PC1和PC2),以及外型蛋白酶羧肽酶E。胰岛素原的这些改变移去了C肽,剩余的B链和A链通过二硫键结合在一起。胰岛素的双链结构使得胰岛素具有多种构象。胰岛素具有相当大的构象变化的潜能,对这些变化的限制明显地降低胰岛素受体对配体的亲合力。封闭GlyA1的氨基端同样消弱受体结合能力。胰岛素原与胰岛素受体亲和力只有胰岛素的1-2%。目前还不清楚C肽在胰岛素原折叠中的作用。在不同动物种类中C肽的长度在26-38个氨基酸之间变化。在B链-C肽(B-C)和C肽-A链(C-A)连接处的二元氨基酸残基是保守的,并认为对于胰岛素保守性的需要是最小的。胰岛素的三维结构显示A链和B链可以通过比31个氨基酸的C肽小很多的连接肽结合。胰岛素分子内在的物理和化学稳定性是糖尿病的胰岛素疗法的先决条件,也是胰岛素构象、可应用的胰岛素给药方法以及药物制剂的保存期限和保存条件的基础。在胰岛素给药时使用溶液使得胰岛素分子暴露于多种因素,如升高的温度、气-液-固相间变化和剪切力,可能导致胰岛素分子不可恢复的构象变化,如原纤化作用。这与注射泵中的胰岛素溶液关系密切,因为无论是外用还是植入,都将胰岛素分子暴露于这些因素以及来自泵长期移动过程中的产生剪切力中。因此,当使用注射泵作为胰岛素递送系统时,原纤维化作用是一个很大的问题。此外,胰岛素的溶解度受多种因素影响,并在pH4.2-6.6的范围内明显降低。pH沉降区通常给配方带来限制。因此,胰岛素的稳定性和可溶性是目前胰岛素治疗的重要因素。本发明致力于这些问题,通过在B和A链之间引入C肽提供稳定的单链化合物,降低分子柔性并同时减少原纤维化倾向,限制或修改pH沉降区,从而为制剂和配方提供更广阔的选择。此外,目前基因工程生产胰岛素的主要方法是首先生产由胰岛素B链和A链通过短肽首尾连接的单链胰岛素前体,然后胰岛素前体被酶切后生成双链胰岛素。如果直接生产单链胰岛素类似物,则大大简化了生产过程,降低了成本。作为胰岛素家族的成员,胰岛素样生长因子-1(IGF-1)是具有70个氨基酸残基的单链肽,包含A、B、C和D域。IGF-1的A域和B域的基本结构与胰岛素的A链和B链高度相似,分别有52%和45%同源性。它们的三维结构也非常相似。IGF-1的C域在胰岛素受体结合中作用很小。去掉全部的IGF-1C域,用4个甘氨酸组成的桥取代,导致胰岛素受体结合力与野生型相比增加两倍,而将IGF-1C域加至胰岛素B链的C末端引起胰岛素受体亲合力与野生型相比减少3.5倍。由胰岛素和IGF-1C域组成的单链胰岛素/IGF-1混合体的胰岛素结合力与天然人胰岛素没有显著差异。有意思的是,IGF-1CII混合体对IR-A和IR-B都具有增加的亲合力,而IGF-2CI具有较弱的亲合力,显示C域决定IR结合特异性。IGF-1中Tyr31对于保持IGF-1的受体高亲合力至关重要,但是它似乎阻碍与胰岛素受体结合,因为当酪氨酸被丙氨酸取代,导致了很小但明显的人胎盘胰岛素受体结合的双倍增加。连接片段发明人在研究中发现,通过连接片段将胰岛素分子的双链连接形成的单链化合物,同样具有胰岛素活性,并且具有易制备、提供更多的多肽修饰位点等优势。连接片段CL是6-60个氨基酸组成的肽序列,其中每一个氨基酸都独立选自甘氨酸、丙氨酸、丝氨酸、苏氨酸、脯氨酸。适用的连接片段CL具有三点特征:第一,连接片段需要适当的长度。当B链为30个氨基酸全长时,连接片段长度最好不少于6个氨基酸;当B链为25个氨基酸时,连接片段长度最好不少于10个氨基酸。连接片段长度短于上述氨基酸数目,或者长于60个氨基酸时,单链类似物的胰岛素受体结合能力有降低趋势;第二,连接片段最好没有二级结构,空间构象可以灵活变化;第三,连接片段本身没有生物活性,但可以提供多肽修饰位点,如酰化、糖基化等。用以上方法设计的连接片段CL可以通过氨基酸残基取代和插入包含1个或1个以上天冬氨酸、谷氨酸、精氨酸、赖氨酸、半胱氨酸或天冬酰胺。CL可以包括1、2、3、4个天冬氨酸、谷氨酸、精氨酸或赖氨酸以调节多肽序列的电荷平衡,改善溶解度。该序列可以包括1、2、3、4、5个天冬酰胺和相同数量的丝氨酸或苏氨酸,从而组成构成N糖基化所需的N-X-S/T共有序列(X为可编码的天然氨基酸)。进一步地,该肽还可以包含1、2、3或4个赖氨酸或半胱氨酸,其侧链氨基或巯基可以与脂肪酸、聚乙二醇、白蛋白等天然或合成的修饰基团通过水解键或非水解键相连,从而使修饰后的胰岛素分子具有不同的物理、化学和生物特性。根据一种实施方式,CL的C末端氨基酸可以选自由甘氨酸-赖氨酸、甘氨酸-精氨酸、精氨酸-精氨酸、赖氨酸-赖氨酸、精氨酸-赖氨酸、赖氨酸-精氨酸、脯氨酸-谷氨酰胺-苏氨酸、脯氨酸-谷氨酰胺-赖氨酸、或脯氨酸-谷氨酰胺-精氨酸组成的组。根据一种实施方式,CL的C末端氨基酸选自赖氨酸或精氨酸。在具体的实施方式中,CL可以是以下多肽片段的全部或部分序列,或者与以下多肽片段有1,2或3个氨基酸残基的差异,或者与以下多肽片段有70%、80%、90%类似,或者是以下多肽片段的全部或部分序列的1、2、3、4或5次重复序列:(GASPGGSSGS)nGR,其中n是1、2、3、4或5;GSSGSSGPGSSR;GSSGSGSSAPQT;GSGGAPSRSGSSR;GSPAGSPTSTGR;GGSGGSGGR;GSSPATSGSPQR;GASSSATPSPQR;GSGSSSRAPPSAPSPQR;GSSSESPSGAPQT;GAGTPASGSAPGR;GSSPSGGSSAPQT;GSTSSTARSPGR;GAGPSGTASPSR;GSSTPSGAPQT;SSSSAPPPSAPSPSRAPQR;GSGSSSAAAPQT;GSGSSSAAPQT;GASPGTSSTSGR;GSGSSSAPQT;GSGSSSRRA;GSPAGSPTSTSR;GSGPSSATPASR;GSGSSSRGR;GSGPSTRSAPQR;GPETPSGPSSAPQT;GAGSSSRAPPPSAPSPSRAPGPSAPQR;GSGSSAGR;GASSPSTSRPGR;GSSSGSSGSPSGR;GSSPSASTGTGR;GAGSSSAPSAPSPSRAPGPSAPQR;GSGSGSGR;GSPSSPTRGSAPQT;GASTSSRGAPSR;GSGSSSAGR;GPSGTSTSAPGR;GAGSSSAPQT;SSSSAPSAPSPSRPQR;GSGASSPTSPQR;GAGGSGSGR;GSSPATSATPQT;GAGSSSAPPPSAPSPSRAPGPSAPQR;GASTSPSRPSGR;GSTAGSRTSTGR;GSTAGSRTSPQR;GSGTATSGSPQT;GASSSATSASGR;GAGSATRGSASR;GSSSRSPSGSGR;SSSSAPPPSAPSPSRAPGPSAPQR;GSSPSGRSSSPGR;GSPAGSPSSSAGSSASASPASPGR;GSPAGSPSSSAGSSASASPASGPGSSSAPSAGSPGR;RREAEDGGGPGAGSSQRK;GGGSGGGR;RRGGGPGAGSSQRK;RGGGPGAGSSQRK;SSSAPPPSAPSPSRAPGPSPQR;SAASSSASSSSASSASAGR;GAGGPSSGAPPPSPQT;GSGSSGGR;GAGSPAAPASPAPAPSAGR;SSSAPSPSRSPGPSPQR;SSSAPSAPSPSPQR;GSGSSSRRAPQT;SSSSAASAASASSSASGR;SSSRAPPSAPSPQR;GGPSSGAPPPSR;SSSSGAPPPGR;GPSSGAPSR;GPSSGAPQT;GGPSSGAPPPSPQT;SSSAPPPSAPSPSRAPQT;GAGPSSGAPPPSPQT;GGGGAPQT;GAGGPSSGAPPPQT;GGPSSGAPPPSPSPSRPGPSPQR;SSASSASSSSAGR;GAGSSR;SSASSSAASSSASSSASGR;SSSGAPPPSPSRAPGPSPQR;GSGSASRGR;SSSSAASSASGR;SASASASASSASSGR;SASSPSPSAPSSPSPAS;GPSSPSPSAPSSPSPASPSSGR;SSSAPPPASPSPSRAPGPQR;SASASASASASSAGR;GSGASSRGR;GSGAAPASPAAPAPSAGR;GGPSSGAPPPSGR;SSPSASPSSPASPSSGR;GAPASPAPSAPAPAAPSGR;GPSSPSPSAPSSPSPASPSSAPQT;SSASSASSSSSASAGR;SAPSSPSPSAPSSPSASPSGR;SSSAPPPSAPSPSAPQR;GASSPSPSAPSSPSPASGR;SSPSAPSPSSPASPSSGR;GAGPAAPSAPPAASPAAPSAGR;SSSSPSAPSPSSPASPSPSSAPQR;GSGSSR;GSGSSSAR;GSGSSSGR;GSGAPQR;SSSSAPSAPSPSRAPGPSPAPQR;GSGSSSR;GSGSSAPQT;GGGGAPQR;GSGSSSAAR;GSGSSAAPQR;SSSSRRAPQR;SSSGSGSSAPQR;SSGSGSSSAPQR;GSGSSSRS;SSSSRAPQR;GASPGGSSGSGR;GSGSSSAAAPQR;GAGSSSAAAPQR;GAGSSSAAAPQT;GSSGGSGR;GAGGGSSGR;GSGSSGSR;GSGSSSSR;GSGSGGGR;GAGSSGR;GSGSSGR;SSSSRAPPPSAPSPSRAPGPSAPQR;GGGSSR;GSGSSSAAPQR;GASPGGSSGSSR;GSGSSSRSGR;GTGPSSATPASR;GAGPSGTASPSS;SSSSAPSAPSPSRAPQR;GSPSSPTRGSAT;GPETPSGPSSAT;GSSPATSGTPQT;GSGSSSRAPPPSAPSPSRAPGPSPAPQR;GSSTPSGAGPQT;GSGSSSRAPPPSAPSPSRAPQR;GSPAGSPSSSAGSSASASPASGPGSSSAPSAGSPAR;GAGSSSRAPPPSAPSPSRAPGPSPQR;GSGSSSRAPPSAPSAPQR;GSTAGSRTSTAR;GSSPSGRSSSPAR;SSASSASSSSSAASAGR;GSSSGSSGSPSAR;SSSAPSPSRAPGPSPQR;GAGSSSRAPPPSAPSPSRAPQR;GSPAAPAPASPAAPAPSAGR;SSSAPSAPSPSAPQR;GGPSSGAPPPSPSPSRPGPSDTPPQR;SASASASASASASSASSGR;SASSPSPSAPSSPSPASGR;SASASASASASASSAGR;SSPSASPSSPASPSPSSGR;GAPASPAPAAPSAPAPAAPSGR;GAGSPAAPAPASPAPAPSAGR;SSSRAPPPSAPSPSAPQT;GASPAAPSAPPAASPAAPSAGR;SSSAPPPSPSRAPGPSPQR;SSPSAPSPSSPASPSPSSGR;SSSSGPSSGAPPPSGR;GSSSRSPSGSPR;GGGPGAGSSPQR。基于上述内容,本发明提供一种具有降血糖效果的单链的化合物,所述化合物根据胰岛素的结构进行改造,所述化合物的结构为:X107HLC[1]GSX108LVEALYLVC[2]GEX109GFX110X111X112X113X114X115-CL-GIVEQC[3]C[4]X116SIC[5]SLYQLENYC[6]X117X118,其中,X107是苯丙氨酸-缬氨酸-天冬酰胺-谷氨酰胺四肽、缬氨酸-天冬酰胺-谷氨酰胺三肽、天冬酰胺-谷氨酰胺二肽、或谷氨酰胺,或是以赖氨酸或精氨酸取代上述二、三、四肽序列中任何一个氨基酸残基后的序列,或缺失;X108是组氨酸、苯丙氨酸、精氨酸或谷氨酰胺;X109是精氨酸、丙氨酸、谷氨酸或天冬氨酸;X110是苯丙氨酸、酪氨酸或组氨酸;X111是酪氨酸、苯丙氨酸或缺失;X112是苏氨酸、天冬酰胺、谷氨酸、天冬氨酸或缺失;X113是脯氨酸、赖氨酸、谷氨酸、天冬氨酸或缺失;X114是赖氨酸、脯氨酸、精氨酸、谷氨酸、天冬氨酸或缺失;X115是苏氨酸或缺失;X116是苏氨酸、组氨酸或精氨酸;X117是丙氨酸、甘氨酸或天冬酰胺;X118是赖氨酸、精氨酸-赖氨酸二肽或缺失;CL结构如本文中所定义的。同样地,在该化合物的三级结构中,该单链中的半胱氨酸形成二硫键,具体为:C[1]和C[4]形成二硫键,C[2]和C[6]形成二硫键,C[3]和C[5]形成二硫键。需要特别指出的是,X108、X109、X112、X113、X114的氨基酸残基关系到化合物是否像人胰岛素一样产生自联(selfassociation)。人胰岛素一般通过自联形成六聚体存储在胰岛β细胞中。重组人胰岛素分子皮下注射后逐渐由六聚体解聚成二聚体,进一步解离为单体才能透过毛细血管进入循环,发挥降糖作用。由于存在解聚、吸收过程,重组人胰岛素在皮下注射后起效时间长(Brange等,“Monomericinsulinsandtheirexperimentalandclinicalimplications”DiabetesCare,Vol13No.9,923-54,1990)。如果X108是组氨酸,那么有利于化合物在锌离子的协助下形成六聚体结构。如果X108是天冬氨酸、谷氨酸、苯丙氨酸、谷氨酰胺、精氨酸等氨基酸残基,则无法形成稳定的六聚体结构。如果X109、X112、X113、X114等位点的氨基酸残基是天冬氨酸或谷氨酸,也不易形成稳定的自联。因此,如果X108是非组氨酸氨基酸残基,或X109、X112、X113、X114等位点的氨基酸残基之一或多个位点是天冬氨酸或谷氨酸,则相应化合物更易于以二聚体或单体形式存在,皮下注射后快速进入血液,可以达到在短时间内降低血糖的效果。在一种具体的实施方式中,所述单链化合物的结构是:FVNQHLCGSHLVEALYLVCGERGFFX111X112X113X114X115-CL-GIVEQCCTSICSLYQLENYCN,其中,X111是酪氨酸或缺失;X112是苏氨酸或缺失;X113是脯氨酸或缺失;X114是赖氨酸或缺失;X115是苏氨酸或缺失;CL是本文中所定义的连接片段。在进一步的实施方式中,所述单链化合物的结构是:FVNQHLCGSHLVEALYLVCGERGFFYTPKT-CL-GIVEQCCTSICSLYQLENYCN。根据这一方面的实施方式,本发明的具有降血糖作用的单链化合物选自以下化合物:Ⅰ-1:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGYGSSSRRAPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:1);Ⅰ-2:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSSAAAPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:2);Ⅰ-3:FVNQHLCGSHLVEALYLVCGERGFFYTPTGSGSSSAAAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:3);Ⅰ-4:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSSAAAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:4);Ⅰ-5:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGSSSAAAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:5);Ⅰ-6:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGSSSAAAPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:6);Ⅰ-7:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSSRRAGIVEQCCTSICSLYQLENYCN(SEQIDNO:7);Ⅰ-8:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSSAARGIVEQCCTSICSLYQLENYCN(SEQIDNO:8);Ⅰ-9:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSSRGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:9);Ⅰ-10:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSSAGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:10);Ⅰ-11:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGGSGSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:11);Ⅰ-12:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGGGSSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:12);Ⅰ-13:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:13);Ⅰ-14:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSGSRGIVEQCCTSICSLYQLENYCN(SEQIDNO:14);Ⅰ-15:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSSSRGIVEQCCTSICSLYQLENYCN(SEQIDNO:15);Ⅰ-16:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSGGGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:16);Ⅰ-17:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGGSGGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:17);Ⅰ-18:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSGSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:18);Ⅰ-19:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSSGGSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:19);Ⅰ-20:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSSRGIVEQCCTSICSLYQLENYCN(SEQIDNO:20);Ⅰ-21:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGSSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:21);Ⅰ-22:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:22);Ⅰ-23:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGSSRGIVEQCCTSICSLYQLENYCN(SEQIDNO:23);Ⅰ-24:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGGGSSRGIVEQCCTSICSLYQLENYCN(SEQIDNO:24);Ⅰ-25:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSRGIVEQCCTSICSLYQLENYCN(SEQIDNO:25);Ⅰ-26:FVNQHLCGSHLVEALYLVCGERGFFGSGSSSAAAPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:26);Ⅰ-27:FVNQHLCGSHLVEALYLVCGERGFFSSSSRAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:27);Ⅰ-28:FVNQHLCGSHLVEALYLVCGERGFFYGSGSSSAAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:28);Ⅰ-29:FVNQHLCGSHLVEALYLVCGERGFFYTGSGSSSAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:29);Ⅰ-30:FVNQHLCGSHLVEALYLVCGERGFFYTGSGSSAAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:30);Ⅰ-31:FVNQHLCGSHLVEALYLVCGERGFFYGSGSSSRSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:31);Ⅰ-32:FVNQHLCGSHLVEALYLVCGERGFFYTGSGSSSRGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:32);Ⅰ-33:FVNQHLCGSHLVEALYLVCGERGFFYNDSSSSRAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:33);Ⅰ-34:FVNQHLCGSHLVEALYLVCGERGFFYTPGGGGAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:34);Ⅰ-35:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGASPGGSSGSSRGIVEQCCTSICSLYQLENYCN(SEQIDNO:35);Ⅰ-36:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSSGSSGPGSSRGIVEQCCTSICSLYQLENYCN(SEQIDNO:36);Ⅰ-37:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSSGSGSSAPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:37);Ⅰ-38:FVNQHLCGSHLVEALYLVCGERGFFSSSSAPSAPSPSRAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:38);Ⅰ-39:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSPAGSPTSTGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:39);Ⅰ-40:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSSPATSGSPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:40);Ⅰ-41:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGASSSATPSPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:41);Ⅰ-42:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGASTSSRGAPSRGIVEQCCTSICSLYQLENYCN(SEQIDNO:42);Ⅰ-43:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSSSESPSGAPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:43);Ⅰ-44:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGTPASGSAPGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:44);Ⅰ-45:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSSPSGGSSAPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:45);Ⅰ-46:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSTSSTARSPGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:46);Ⅰ-47:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGPSGTASPSSGIVEQCCTSICSLYQLENYCN(SEQIDNO:47);Ⅰ-48:FVNQHLCGSHLVEALYLVCGERGFFSSSSRAPPPSAPSPSRAPGPSAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:48);Ⅰ-49:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSSPSASTGTGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:49);Ⅰ-50:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGASPGTSSTSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:50);Ⅰ-51:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSPAGSPTSTSRGIVEQCCTSICSLYQLENYCN(SEQIDNO:51);Ⅰ-52:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGTGPSSATPASRGIVEQCCTSICSLYQLENYCN(SEQIDNO:52);Ⅰ-53:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGPSTRSAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:53);Ⅰ-54:FVNQHLCGSHLVEALYLVCGERGFFGAGSSSRAPPPSAPSPSRAPGPSAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:54);Ⅰ-55:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGPSGTSTSAPGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:55);Ⅰ-56:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSPSSPTRGSATGIVEQCCTSICSLYQLENYCN(SEQIDNO:56);Ⅰ-57:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGASSPTSPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:57);Ⅰ-58:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSSPATSGTPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:58);Ⅰ-59:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGASSPSTSRPGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:59);Ⅰ-60:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSSRAPPPSAPSPSRAPGPSPAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:60);Ⅰ-61:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGPETPSGPSSATGIVEQCCTSICSLYQLENYCN(SEQIDNO:61);Ⅰ-62:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSSTPSGAGPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:62);Ⅰ-63:FVNQHLCGSHLVEALYLVCGERGFFGSGSSSRAPPPSAPSPSRAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:63);Ⅰ-64:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSPAGSPSSSAGSSASASPASGPGSSSAPSAGSPARGIVEQCCTSICSLYQLENYCN(SEQIDNO:64);Ⅰ-65:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGGAPSRSGSSRGIVEQCCTSICSLYQLENYCN(SEQIDNO:65);Ⅰ-66:FVNQHLCGSHLVEALYLVCGERGFFGSGSSSRAPPSAPSAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:66);Ⅰ-67:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGASTSPSRPSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:67);Ⅰ-68:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSTAGSRTSTARGIVEQCCTSICSLYQLENYCN(SEQIDNO:68);Ⅰ-69:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSTAGSRTSPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:69);Ⅰ-70:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGTATSGSPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:70);Ⅰ-71:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGASSSATSASGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:71);Ⅰ-72:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGSATRGSASRGIVEQCCTSICSLYQLENYCN(SEQIDNO:72);Ⅰ-73:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGSSSRAPPPSAPSPSRAPGPSPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:73);Ⅰ-74:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSSSGSSGSPSARGIVEQCCTSICSLYQLENYCN(SEQIDNO:74);Ⅰ-75:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSSPSGRSSSPARGIVEQCCTSICSLYQLENYCN(SEQIDNO:75);Ⅰ-76:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSPAGSPSSSAGSSASASPASPGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:76);Ⅰ-77:FVNQHLCGSHLVEALYLVCGERGFFGAGSSSAPSAPSPSRAPGPSAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:77);Ⅰ-78:FVNQHLCGSHLVEALYLVCGERGFFYTPKTRREAEDGGGPGAGSSQRKGIVEQCCTSICSLYQLENYCN(SEQIDNO:78);Ⅰ-79:FVNQHLCGSHLVEALYLVCGERGFFYTPKTRRGGGPGAGSSQRKGIVEQCCTSICSLYQLENYCN(SEQIDNO:79);Ⅰ-80:FVNQHLCGSHLVEALYLVCGERGFFGGGPGAGSSPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:80);Ⅰ-81:FVNQHLCGSHLVEALYLVCGERGFFYTPRGGGPGAGSSQRKGIVEQCCTSICSLYQLENYCN(SEQIDNO:81);Ⅰ-82:FVNQHLCGSHLVEALYLVCGERGFFSSSAPPPSAPSPSRAPGPSPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:82);Ⅰ-83:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGASSPSPSAPSSPSPASGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:83);Ⅰ-84:FVNQHLCGSHLVEALYLVCGERGFFSSASSSAASSSASSSASGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:84);Ⅰ-85:FVNQHLCGSHLVEALYLVCGERGFFSSASSASSSSSAASAGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:85);Ⅰ-86:FVNQHLCGSHLVEALYLVCGERGFFSSSAPSPSRAPGPSPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:86);Ⅰ-87:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGGPSSGAPPPSPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:87);Ⅰ-88:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSPAAPAPASPAAPAPSAGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:88);Ⅰ-89:FVNQHLCGSHLVEALYLVCGERGFFSSSRAPPSAPSPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:89);Ⅰ-90:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGGPSSGAPPPSRGIVEQCCTSICSLYQLENYCN(SEQIDNO:90);Ⅰ-91:FVNQHLCGSHLVEALYLVCGERGFFSSSSGAPPPGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:91);Ⅰ-92:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGPSSGAPSRGIVEQCCTSICSLYQLENYCN(SEQIDNO:92);Ⅰ-93:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGPSSGAPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:93);Ⅰ-94:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGGPSSGAPPPSPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:94);Ⅰ-95:FVNQHLCGSHLVEALYLVCGERGFFSSSAPSAPSPSAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:95);Ⅰ-96:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGPSSGAPPPSPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:96);Ⅰ-97:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGGPSSGAPPPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:97);Ⅰ-98:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGGPSSGAPPPSPSPSRPGPSDTPPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:98);Ⅰ-99:FVNQHLCGSHLVEALYLVCGERGFFSSASSASSSSAGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:99);Ⅰ-100:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGSSSRAPPPSAPSPSRAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:100);Ⅰ-101:FVNQHLCGSHLVEALYLVCGERGFFSSSSAASAASASSSASGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:101);Ⅰ-102:FVNQHLCGSHLVEALYLVCGERGFFSSSSAASSASGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:102);Ⅰ-103:FVNQHLCGSHLVEALYLVCGERGFFYTPKTSASASASASASASSASSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:103);Ⅰ-104:FVNQHLCGSHLVEALYLVCGERGFFYTPKTSASSPSPSAPSSPSPASGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:104);Ⅰ-105:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGPSSPSPSAPSSPSPASPSSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:105);Ⅰ-106:FVNQHLCGSHLVEALYLVCGERGFFYTPKTSAASSSASSSSASSASAGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:106);Ⅰ-107:FVNQHLCGSHLVEALYLVCGERGFFYTPKTSASASASASASASSAGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:107);Ⅰ-108:FVNQHLCGSHLVEALYLVCGERGFFSSSGAPPPSPSRAPGPSPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:108);Ⅰ-109:FVNQHLCGSHLVEALYLVCGERGFFSSPSASPSSPASPSPSSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:109);Ⅰ-110:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAPASPAPAAPSAPAPAAPSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:110);Ⅰ-111:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGPSSPSPSAPSSPSPASPSSAPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:111);Ⅰ-112:FVNQHLCGSHLVEALYLVCGERGFFSSSRAPPPSAPSPSAPQTGIVEQCCTSICSLYQLENYCN(SEQIDNO:112);Ⅰ-113:FVNQHLCGSHLVEALYLVCGERGFFYTPKTSAPSSPSPSAPSSPSASPSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:113);Ⅰ-114:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGSPAAPAPASPAPAPSAGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:114);Ⅰ-115:FVNQHLCGSHLVEALYLVCGERGFFSSSAPPPSPSRAPGPSPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:115);Ⅰ-116:FVNQHLCGSHLVEALYLVCGERGFFSSPSAPSPSSPASPSPSSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:116);Ⅰ-117:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGASPAAPSAPPAASPAAPSAGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:117);Ⅰ-118:FVNQHLCGSHLVEALYLVCGERGFFSSSSPSAPSPSSPASPSPSSAPQRGIVEQCCTSICSLYQLENYCN(SEQIDNO:118);Ⅰ-119:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGAGPSSGAPPPSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:119);Ⅰ-120:FVNQHLCGSHLVEALYLVCGERGFFGAGPSSGAPPPSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:120);Ⅰ-121:FVNQHLCGSHLVEALYLVCGERGFFGGPSSGAPPPSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:121);Ⅰ-122:FVNQHLCGSHLVEALYLVCGERGFFSSSSGPSSGAPPPSGRGIVEQCCTSICSLYQLENYCN(SEQIDNO:122);Ⅰ-123:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSSSRSPSGSPRGIVEQCCTSICSLYQLENYCN(SEQIDNO:123)。修饰的化合物(基于胰岛素的化合物的修饰)多肽化学家为了解决血浆中分子量小于67kDa的药物分子被肾脏快速清除的难题,已经使用了几种方法。1、注射部位建“仓”(depot);2、与血浆中的载体蛋白以非共价键联合以阻止肾小球过滤;3、与载体蛋白以共价键连接;4、与大分子量修饰基团结合,例如大分子量PEG、多糖等(如在本申请文件之前章节中公开的)。“疏水窖藏”(hydrophobicdepoting)大幅度增加肽的疏水性以减少可溶性,并使它在注射部分形成“仓”。肽仓缓慢解离后,多肽结合至细胞膜和/或全身的载体蛋白(如白蛋白等)。载体蛋白分子量大于肾小球过滤最大分子量,因此不易被肾脏清除,可以在血浆中循环多日。因此,与载体蛋白结合的多肽不易被肾小球过滤或被内膜上的蛋白酶降解。脂肪酸一般通过三种方式延长多肽在体内作用时间。第一,脂肪酸能够在药物注射部位与白蛋白以非共价键结合,形成的多肽-脂肪酸-白蛋白大分子结合物释放缓慢;第二,多肽-脂肪酸-白蛋白结合物的大分子量使肾清除率降低;第三,白蛋白为多肽提供保护,不易被蛋白酶降解。第四,脂肪酸减少多肽的免疫原性。后三个特点与长链PEG修饰的效果类似。更多的机理和实验支持可以参照Biochem.J.(1995)312,725-731;PharmaceuticalResearch,(2004),21,8,1498-1504;CurrentMedicinalChemistry(2009),16,4399-4418;WO95/07931;Diabetes,ObesityandMetabolism,2007,9,290–299;Diabetes,1997,46,637-642。典型例子是糖尿病治疗多肽药物地特胰岛素(detemir)和利拉鲁肽(liraglutide)。它们利用了基于脂肪酸修饰的疏水窖藏,使体内作用时间延长(地特胰岛素t1/2=14小时)。而未修饰的胰岛素的作用时间仅有几个小时。此外,用聚乙二醇(PEG,分子量不小于20K)和人白蛋白等大分子修饰胰岛素,也可以达到和上述脂肪酸修饰类似的延长体内作用时间的效果。因此,在所有可以用脂肪酸酰化的位点,都可以用聚乙二醇或人白蛋白等大分子修饰。本发明基于这样一种认识:本发明的具有降血糖作用的化合物的总体疏水性在该化合物的体内功效方面起重要作用。本发明进一步提供一种具有降血糖作用的、在多肽基础上进行修饰的化合物,以进一步提高所述化合物体内循环作用时间。所述修饰是将修饰侧链连接至本发明的单链化合物的N-末端氨基酸残基的α-氨基、或连接至单链化合物中的赖氨酸的ε-氨基。本发明的修饰的化合物也可以基于胰岛素或其类似物进行修饰而形成。在这一方面,本发明提供基于胰岛素的修饰的单链化合物,所述化合物的结构是:X300VNQHLC[1]GSHLVEALYLVC[2]GERGFX301X302X303X304X305X306GX307X308X309X310X311X312X313X314X315X316X317GIVEQC[3]C[4]X318X319X320C[5]X321LX322X323LX324X325YC[6]X326X327,其中,X300是苯丙氨酸或UL-苯丙氨酸;X301是苯丙氨酸、组氨酸或酪氨酸;X302是酪氨酸、苯丙氨酸或缺失;X303是苏氨酸、天冬酰胺、谷氨酸、天冬氨酸或缺失;X304是脯氨酸、赖氨酸、谷氨酸、天冬氨酸或缺失;X305是天冬氨酸、谷氨酸、脯氨酸、精氨酸、赖氨酸或缺失,或通式(I)结构;X306是苏氨酸、通式(I)结构或缺失;X307是赖氨酸、丝氨酸、丙氨酸、甘氨酸、通式(I)结构或缺失;X308是甘氨酸、通式(I)结构或缺失;X309是赖氨酸、甘氨酸、丝氨酸、通式(I)结构或缺失;X310是赖氨酸、甘氨酸、丝氨酸、通式(I)结构或缺失;X311是赖氨酸、甘氨酸、丝氨酸、丙氨酸、通式(I)结构或缺失;X312是赖氨酸、精氨酸、丙氨酸、脯氨酸、甘氨酸、通式(I)结构或缺失;X313是甘氨酸、丙氨酸、精氨酸、赖氨酸、谷氨酰胺、脯氨酸、通式(I)结构或缺失;X314是精氨酸、丙氨酸、脯氨酸、苏氨酸、谷氨酰胺、甘氨酸、通式(I)结构或缺失;X315是脯氨酸、谷氨酰胺、精氨酸、甘氨酸或缺失或通式(I)结构;X316是谷氨酰胺、苏氨酸、精氨酸、甘氨酸或缺失或通式(I)结构;X317是苏氨酸、精氨酸、赖氨酸或缺失;X318是苏氨酸、组氨酸、精氨酸或通式(I)结构;X319是丝氨酸或通式(I)结构;X320是异亮氨酸或通式(I)结构;X321是丝氨酸或通式(I)结构;X322是酪氨酸或通式(I)结构;X323是谷氨酰胺或通式(I)结构;X324是谷氨酸或通式(I)结构;X325是天冬酰胺或通式(I)结构;X326是丙氨酸、甘氨酸或天冬酰胺;X327是赖氨酸、精氨酸-赖氨酸二肽或缺失,或为通式(I)结构;当X327为二肽时,其中一个氨基酸为通式(I)结构;其中,所述通式(I)结构为:UL是-W-X-Y-Z结构、脂肪酸、聚乙二醇、白蛋白、Ln-ML结构、氢原子或Nα-(Nα-(HOOC(CH2)nCO)-γ-Glu)-、Nα-(Nα-(CH3(CH2)nCO)-γ-Glu)-,其中n是8-20的整数,如8、10、12、14、16、18或20,Nα表示氨基酸或氨基酸残基的α-氨基,或为通式(II)结构。所述通式(II)结构是:J是-W-X-Y-Z结构、Ln-ML结构或氢原子。ML是修饰基团,包括但不局限于-W-X-Y-Z、脂肪酸、聚乙二醇、白蛋白、IgGFc、糖基团等。在本发明中,Ln是可选的连接基、共价键或不存在。可选的连接基包括但不局限于:聚乙二醇、长链脂肪酸或一个或多个聚乙二醇分子和长链脂肪酸分子通过共价键连接形成的长链。Ln可以是-NH-(CH2)n-CO-、-NH-(CH2CH2O)n-CH2-CO-、-NH-(CH2CH2O)n-(CH2)r-CO-,n是1-20的整数,r是1-10的整数;在一种实施方式中,Ln是-NH-(CH2CH2O)2-CH2-CONH-(CH2CH2O)2-CH2-CO-;在一种实施方式中,Ln是-NH-(CH2)n1-O-(CH2CH2O)n2-(CH2)n3-CO-,n1、n2、n3分别是1-16的整数;在一种实施方式中,Ln是-NH-(CH2)n1-(OCH2CH2)n2-CO-,n1、n2分别是1-16的整数。在以上实施方式中,Ln通过来自加下划线的羰基碳的键与多肽化合物的氨基形成酰胺键,另一端与ML形成共价键。在一种实施方式中,Ln通过来自加下划线的羰基碳的键与与多肽化合物的氨基形成酰胺键,另一端与-W-X-Y-Z形成酰胺键。在本文中,-W-X-Y-Z结构是:W是侧链具有羧基的α-氨基酸残基,该残基以一个羧基与本发明中多肽化合物的N-末端氨基酸残基的α-氨基或与多肽化合物的赖氨酸残基的ε-氨基一起形成酰胺基;或者W是由2、3或4个α-氨基酸残基通过酰胺键连接起来的链,该链通过酰胺键连接至多肽化合物的N-末端氨基酸残基的α-氨基或多肽化合物的赖氨酸残基的ε-氨基,W的氨基酸残基选自具有中性侧链的氨基酸残基和侧链具有羧基的氨基酸残基组成的组,使得W含有至少一个在侧链具有羧基的氨基酸残基;或者W是从X到多肽化合物的N-末端氨基酸残基的α-氨基或到多肽化合物的赖氨酸残基的ε-氨基的共价键;X是-CO-、-CH(COOH)CO-、-N(CH2COOH)CH2CO-、-N(CH2COOH)CH2CON(CH2COOH)CH2CO-、-N(CH2CH2COOH)CH2CH2CO-、-N(CH2CH2COOH)CH2CH2CON(CH2CH2COOH)CH2CH2CO-、-NHCH(COOH)(CH2)4NHCO-、-N(CH2CH2COOH)CH2CO-或者-N(CH2COOH)CH2CH2CO-,其中a)当W是氨基酸残基或氨基酸残基链时,上述X通过由加下划线的羰基碳的键与W中的氨基形成酰胺键;或者b)当W是共价键时,上述X通过来自加下划线的羰基碳的键与多肽化合物的N-末端氨基酸残基的α-氨基或多肽化合物的赖氨酸残基的ε-氨基形成酰胺键;Y是-(CH2)m,其中m是6-32的整数;或包含1、2或3个-CH=CH-基团和多个-CH2-基团的二价烃链,所述多个-CH2-基团的个数满足烃链中的碳原子总数范围是10-32;或通式-(CH2)VC6H4(CH2)w-的二价烃链,其中v和w是整数,或者它们之一是零,使得v和w总和的范围是6-30;且Z是-COOH、-CO-Asp、-CO-Glu、-CO-Gly、-CO-Sar、-CH(COOH)2、-N(CH2COOH)2、-SO3H、-PO3H或不存在;条件是当W是共价键且X是-CO-时,Z不是-COOH。侧链-W-X-Y-Z的中W可以是共价键。另一方面,W可以是侧链具有羧基的α-氨基酸残基,包括一共4-10个碳原子。W可以是由遗传密码子编码的α-氨基酸残基。例如,W可以选自α-Asp、β-Asp、α-Glu和γ-Glu组成的组。W的其它选择例如是α-hGlu或者δ-hGlu。在另一个实施方式中,W是由两个α-氨基酸残基组成的链,其中一个α-氨基酸残基具有4-10个碳原子且侧链具有羧基,而另一个具有2-11个碳原子但没有自由羧基。所述的没有自由羧基的α-氨基酸残基可以是中性的可编码的α-氨基酸残基。根据这种实施方式的W的例子是:α-Asp-Gly、Gly-α-Asp、β-Asp-Gly、Gly-β-Asp、α-Glu-Gly、Gly-α-Glu、γ-Glu-Gly、Gly-γ-Glu、α-hGlu-Gly、Gly-α-hGlu、δ-hGlu-Gly和Gly-δ-hGlu。在另一个实施方式中,W是由两个α-氨基酸残基组成的链,两个α-氨基酸残基分别具有4-10个碳原子,侧链上均具有羧基。这些α-氨基酸残基之一或两个可以是可编码的α-氨基酸残基。根据这一实施方式的W的例子是:α-Asp-α-Asp、α-Asp-α-Glu、α-Asp-α-hGlu、α-Asp-β-Asp、α-Asp-γ-Glu、α-Asp-δ-hGlu、β-Asp-α-Asp、β-Asp-α-Glu、β-Asp-α-hGlu、β-Asp-β-Asp、β-Asp-γ-Glu、β-Asp-δ-hGlu、α-Glu-α-Asp、α-Glu-α-Glu、α-Glu-α-hGlu、α-Glu-β-Asp、α-Glu-γ-Glu、α-Glu-δ-hGlu、γ-Glu-α-Asp、γ-Glu-α-Glu、γ-Glu-α-hGlu、γ-Glu-β-Asp、γ-Glu-γ-Glu、γ-Glu-δ-hGlu、α-hGlu-α-Asp、α-hGlu-α-Glu、α-hGlu-α-hGlu、α-hGlu-β-Asp、α-hGlu-γ-Glu、α-hGlu-δ-hGlu、δ-hGlu-α-Asp、δ-hGlu-α-Glu、δ-hGlu-α-hGlu、δ-hGlu-β-Asp、δ-hGlu-γ-Glu和δ-hGlu-δ-hGlu。在另一个实施方式中,W是由三个分别具有4-10个碳原子的α-氨基酸残基组成的链,该链的氨基酸残基选自具有中性侧链的残基和侧链具有羧基的残基,使得该链含有至少一个侧链具有羧基的残基。在一个实施方式中,所述氨基酸残基是可编码的残基。在另一个实施方式中,W是由四个分别具有4-10个碳原子,α-氨基酸残基组成的链,该链的氨基酸残基选自具有中性侧链的残基和侧链具有羧基的残基,使得该链含有至少一个侧链具有羧基的残基。在一个实施方式中,所述氨基酸残基是可编码的残基。在一个实施方式中,-W-X-Y-Z中的W可以通过脲衍生物连接至赖氨酸残基的ε-氨基。侧链-W-X-Y-Z中的X可以是通式-CO-的基团,通过来自加下划线的羰基碳的键与W中的氨基形成酰胺键;或当W是共价键时,X通过来自加下划线的羰基碳的键与多肽化合物的N-末端的α-氨基或与多肽化合物中的赖氨酸残基的ε-氨基形成酰胺键。在进一步的实施方式中,所述侧链-W-X-Y-Z中的X可以是通式-CH(COOH)CO-的基团,通过来自加下划线的羰基碳的键与W中的氨基形成酰胺键;或当W是共价键时,X通过来自加下划线的羰基碳的键与多肽化合物的N-末端的α-氨基或与多肽化合物中的赖氨酸残基的ε-氨基形成酰胺键。在进一步的实施方式中,侧链-W-X-Y-Z中的X可以是通式-N(CH2COOH)CH2CO-的基团,通过来自加下划线的羰基碳的键与W中的氨基形成酰胺键;或当W是共价键时,X通过来自加下划线的羰基碳的键与多肽化合物的N-末端的α-氨基或与多肽化合物中的赖氨酸残基的ε-氨基形成酰胺键。在进一步的实施方式中,侧链-W-X-Y-Z中的X可以是通式-N(CH2CH2COOH)CH2CO-的基团,通过来自加下划线的羰基碳的键与W中的氨基形成酰胺键;或当W是共价键时,X通过来自加下划线的羰基碳的键与多肽化合物的N-末端的α-氨基或与多肽化合物中的赖氨酸残基的ε-氨基形成酰胺键。在进一步的实施方式中,-W-X-Y-Z中的X可以是通式-N(CH2COOH)CH2CH2CO-的基团,通过来自加下划线的羰基碳的键与W中的氨基形成酰胺键;或当W是共价键时,X通过来自加下划线的羰基碳的键与多肽化合物的N-末端的α-氨基或与多肽化合物中的赖氨酸残基的ε-氨基形成酰胺键。在进一步的实施方式中,-W-X-Y-Z中的X可以是通式-N(CH2COOH)CH2CON(CH2COOH)CH2CO-的基团,通过来自加下划线的羰基碳的键与W中的氨基形成酰胺键;或当W是共价键时,X通过来自加下划线的羰基碳的键与多肽化合物的N-末端的α-氨基或与多肽化合物中的赖氨酸残基的ε-氨基形成酰胺键。在进一步的实施方式中,-W-X-Y-Z中的X可以是通式-N(CH2CH2COOH)CH2CH2CO-的基团,通过来自加下划线羰基碳的键与W中的氨基形成酰胺键;或当W是共价键时,X通过来自加下划线的羰基碳的键与多肽化合物的N-末端的α-氨基或与多肽化合物中的赖氨酸残基的ε-氨基形成酰胺键。在进一步的实施方式中,-W-X-Y-Z中的X可以是通式-N(CH2CH2COOH)CH2CH2CON(CH2CH2COOH)CH2CH2CO-的基团,通过来自加下划线的羰基碳的键与W中的氨基形成酰胺键;或当W是共价键时,X通过来自加下划线的羰基碳的键与多肽化合物的N-末端的α-氨基或与多肽化合物中的赖氨酸残基的ε-氨基形成酰胺键。侧链-W-X-Y-Z中的Y可以是通式-(CH2)m基团,其中m是6-32、8-20、12-20或12-16的整数。在另一种实施方式中,-W-X-Y-Z中的Y是包含1、2或3个-CH=CH-基团和多个-CH2-基团的二价烃链,所述多个-CH2-基团的个数满足烃链中的碳原子总数范围是6-32、10-32、12-20或12-16。在另一种实施方式中,-W-X-Y-Z中的Y是通式-(CH2)VC6H4(CH2)w-的二价烃链,其中v和w是整数,或者其中之一是零,使得v和w总和的范围是6-30、10-20或12-16。在一种实施方式中,侧链-W-X-Y-Z中的Z是-COOH,条件是当W是共价键而X是-CO-时,Z不是-COOH。在另一种实施方式中,-W-X-Y-Z中的Z是-CO-Asp、-CO-Glu、-CO-Gly、-CO-Sar、-CH(COOH)2、-N(CH2COOH)2、-SO3H或-PO3H。在进一步的实施方式中,-W-X-Y-Z中的W是α-Asp、β-Asp、α-Glu或γ-Glu;X是-CO-或者-CH(COOH)CO-;Y是-(CH2)m,其中m是12-18的整数;Z是-COOH-、-CH(COOH)2或不存在。在另一种实施方式中,-W-X-Y-Z中的W是α-Asp、β-Asp、α-Glu或γ-Glu;-X-Y-Z是-CO(CH2)n,通过来自加下划线的羰基碳的键与W中的氨基形成酰胺键,其中n是10-20中的整数。在更具体的实施方式中,-W-X-Y-Z中的W是α-Asp、β-Asp、α-Glu或γ-Glu;-X-Y-Z是-CO(CH2)14。在更具体的实施方式中,-W-X-Y-Z中的W是α-Asp、β-Asp、α-Glu或γ-Glu;-X-Y-Z是-CO(CH2)16。在更具体的实施方式中,-W-X-Y-Z中的W是α-Asp、β-Asp、α-Glu或γ-Glu;-X-Y-Z是-CO(CH2)18。在更具体的实施方式中,-W-X-Y-Z中的W是α-Asp、β-Asp、α-Glu或γ-Glu;-X-Y-Z是胆固醇、胆汁酸(如胆酸、鹅脱氧胆酸、肝胆酸、牛磺胆酸、脱氧胆酸、石胆酸)。上述化合物结构中,[1]-[6]表示半胱氨酸的编号。本发明的单链化合物在三级结构中,以胰岛素的结构方式形成链内的二硫键,具体为:C[1]和C[4]形成二硫键,C[2]和C[6]形成二硫键,C[3]和C[5]形成二硫键。在一种具体的实施方式中,所述化合物的结构为:X300VNQHLC[1]GSHLVEALYLVC[2]GERGFFX302X303X304X305X306GX307X308X309X310X311X312X313X314X315X316X317GIVEQC[3]C[4]TSIC[5]SLYQLENYC[6]NX327,其中,X300是苯丙氨酸或UL-苯丙氨酸;X302是酪氨酸或缺失;X303是苏氨酸或缺失;X304是脯氨酸或缺失;X305是天冬氨酸、脯氨酸、精氨酸、赖氨酸或缺失,或通式(I)结构;X306是苏氨酸、通式(I)结构或缺失;X307是赖氨酸、丝氨酸、丙氨酸或通式(I)结构;X308是甘氨酸或通式(I)结构;X309是赖氨酸、丝氨酸或通式(I)结构;X310是赖氨酸、丝氨酸或通式(I)结构;X311是赖氨酸、丝氨酸、丙氨酸或通式(I)结构;X312是赖氨酸、精氨酸、丙氨酸、脯氨酸或通式(I)结构;X313是甘氨酸、丙氨酸、精氨酸、赖氨酸、谷氨酰胺、脯氨酸或通式(I)结构;X314是精氨酸、丙氨酸、脯氨酸、苏氨酸或谷氨酰胺或通式(I)结构;X315是脯氨酸、谷氨酰胺、精氨酸或缺失或通式(I)结构;X316是谷氨酰胺、苏氨酸、精氨酸或缺失或通式(I)结构;X317是苏氨酸、精氨酸、赖氨酸或缺失;X327是通式(I)结构或缺失;UL和通式(I)结构如本文中所定义。在这个方面,本发明的修饰的单链化合物选自:Ⅱ-1:FVNQHLCGSHLVEALYLVCGERGFFYTPTGK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]GSSSRGRGIVEQCCTSICSLYQLENYCN;Ⅱ-2:FVNQHLCGSHLVEALYLVCGERGFFYTPTGK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]GSSSAAAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-3:FVNQHLCGSHLVEALYLVCGERGFFYTPTGSGK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]SSAAAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-4:F(Nα-dPEG12-马来酰亚胺-白蛋白)VNQHLCGSHLVEALYLVCGERGFFYTPDTGSGSSSAAAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-5:FVNQHLCGSHLVEALYLVCGERGFFYTPPTGSGSSK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]AAAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-6:FVNQHLCGSHLVEALYLVCGERGFFYTPTGSGSSSAK[Nε--(Nα-(HOOC(CH2)14CO)-γ-Glu)]APQTGIVEQCCTSICSLYQLENYCN;Ⅱ-7:FVNQHLCGSHLVEALYLVCGERGFFYTPRTGSGSSSK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]AAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-8:FVNQHLCGSHLVEALYLVCGERGFFGSGSSSK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]AAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-9:FVNQHLCGSHLVEALYLVCGERGFFGSGSSSAK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]APQTGIVEQCCTSICSLYQLENYCN;Ⅱ-10:FVNQHLCGSHLVEALYLVCGERGFFGSGK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]SSAAAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-11:FVNQHLCGSHLVEALYLVCGERGFFGSGSK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]SAAAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-12:FVNQHLCGSHLVEALYLVCGERGFFGSGSSK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]AAAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-13:FVNQHLCGSHLVEALYLVCGERGFFYTGSGK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]SAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-14:FVNQHLCGSHLVEALYLVCGERGFFYGSGSSK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]AAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-15:FVNQHLCGSHLVEALYLVCGERGFFGSGSSSAAAPQTGIVEQCCTSICSLYQLENYCNK-[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)];Ⅱ-16:F[Nα-(Nα-(HOOC(CH2)14CO)-γ-L-Glu)]VNQHLCGSHLVEALYLVCGERGFFGSGSSSAAAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-17:FVNQHLCGSHLVEALYLVCGERGFFYTPTGSGSSK(Nε-PEG20K)AAAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-18:F(Nα-PEG20K)VNQHLCGSHLVEALYLVCGERGFFGSGSSSAAAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-19:FVNQHLCGSHLVEALYLVCGERGFFYTPK[Nε-(Nα-(HOOC(CH2)14CO)-γ-L-Glu)]GSGSSSAAAPQTGIVEQCCTSICSLYQLENYCN;Ⅱ-20:FVNQHLCGSHLVEALYLVCGERGFFYTPTGK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]GSSSAPQRGIVEQCCTSICSLYQLENYCN;Ⅱ-21:FVNQHLCGSHLVEALYLVCGERGFFYTPTGK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]GSSSAAPQRGIVEQCCTSICSLYQLENYCN;Ⅱ-22:FVNQHLCGSHLVEALYLVCGERGFFYTPTGK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]GSSSPQRGIVEQCCTSICSLYQLENYCN;II-23:FVNQHLCGSHLVEALYLVCGERGFFYTPTGK[Nε-(Nα-(HOOC(CH2)16CO)-γ-Glu-N-(γ-Glu))]GSSSAAAPQTGIVEQCCTSICSLYQLENYCN;II-24:FVNQHLCGSHLVEALYLVCGERGFFYTPTGK[Nε-CO-(CH2CH2O)5-(CH2)2-NH-(Nα-(HOOC(CH2)16CO)-γ-Glu)]GSSSAAAPQTGIVEQCCTSICSLYQLENYCN;其中Nα表示氨基酸或氨基酸残基的α-氨基;Nε表示氨基酸或氨基酸残基的ε-氨基,例如赖氨酸侧链的ε-氨基。可以以基本不含锌的化合物形式或锌的复合物形式提供本发明的具有降血糖作用的化合物。当提供本发明的化合物的锌复合物时,其中本发明的化合物可以形成六聚体,每个六聚体可以结合2个Zn2+,3个Zn2+或4个Zn2+。药物组合物及用途在本发明的另一方面中,提供了一种药物组合物,所述药物组合物包括治疗有效量的根据本发明的化合物和制药学上可接受的载体,用于治疗1型糖尿病、2型糖尿病和引起高血糖症的其它情况。根据本发明的胰岛素受体结合类似物可以用于治疗1型糖尿病、2型糖尿病和引起高血糖症的其它情况的药物组合物的制备。在本发明的另一方面中,提供了一种治疗1型糖尿病、2型糖尿病和引起高血糖症的其它情况的药物组合物,所述药物组合物包括治疗有效量的根据本发明的化合物,混合有具有快速作用效果的胰岛素或胰岛素类似物,及制药学上可接受的载体和添加剂。可以使用制药工业的常规技术制备本发明胰岛素类似物的可注射组合物,包括溶解和混合适当组分而得到所需终产品。因此,按照一套操作步骤,将本发明的胰岛素类似物溶于一定量的水,其体积稍低于待制备的组合物的最终体积。如果需要,加入防腐剂、等渗剂和缓冲剂。如果有必要,使用酸(例如盐酸)或碱(例如氢氧化钠)调节溶液的pH。最终用水将溶液的体积调节到所需浓度。在本发明的另一个实施方案中,缓冲剂选自乙酸钠、碳酸钠、柠檬酸盐、甘氨酰甘氨酸、组氨酸、甘氨酸、赖氨酸、精氨酸、磷酸二氢钠、磷酸氢二钠、磷酸钠和三(羟甲基)-氨基甲烷、N-二(羟乙基)甘氨酸、N-(羟甲基)甲基甘氨酸、苹果酸、琥珀酸盐、马来酸、富马酸、酒石酸、天冬氨酸或其混合物。这些具体缓冲剂中的每一种构成了本发明的备选实施方案。在本发明的另一个实施方案中,所述制剂包含药学上可接受的防腐剂,它选自苯酚、邻-甲酚、间-甲酚、对-甲酚、对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、对羟基苯甲酸丁酯、2-苯氧基乙醇、苄醇、氯丁醇、硫柳汞、溴硝丙二醇、苯甲酸、咪脲、双氯苯双胍己烷、脱氢醋酸钠、氯甲酚、苄索氯胺、氯苯甘醚或其混合物。在本发明的另一个实施方案中,防腐剂的浓度为0.1mg/mL-20mg/mL。在本发明的另一个实施方案中,防腐剂的浓度为0.1mg/mL-5mg/mL。在本发明的另一个实施方案中,防腐剂的浓度为5mg/mL-10mg/mL。这些具体防腐剂中的每一种构成了本发明的备选实施方案。在药物组合中应用防腐剂是本领域技术人员众所周知的。参照Remington:TheScienceandPracticeofPharmacy,第19版,1995。在本发明的另一个实施方案中,所述制剂进一步包括等渗剂,选自盐(例如氯化钠)、糖或糖醇、氨基酸、醛糖醇(例如甘油、丙二醇、1,3-丙二醇、1,3-丁二醇)、聚乙二醇(例如PEG400)或其混合物。任何糖,如单糖、二糖、多糖或水溶性葡聚糖,包括例如果糖、葡萄糖、甘露糖、山梨糖、木糖、麦芽糖、乳糖、蔗糖、海藻糖、葡聚糖、普鲁蓝、糊精、环糊精、可溶性淀粉、羟乙基淀粉和羧甲基纤维素-Na。在一个实施方案中,糖添加剂为蔗糖。将糖醇定义为具有至少一个-OH基团的C4-C8烃,包括例如甘露糖醇、山梨醇、肌醇、半乳糖醇、卫矛醇、木糖醇和阿拉伯糖醇。在一个实施方案中,该糖醇添加剂为甘露糖醇。上述糖类或糖醇类可以单独使用或组合使用。对用量没有固定限制,只要所述糖或糖醇溶于液体制剂而且不会对使用本发明方法获得的稳定化作用产生不良影响即可。在一个实施方案中,糖或糖醇的浓度为1mg/mL-150mg/mL。在另一个实施方案中,等渗剂的浓度为1mg/mL-50mg/mL。在另一个实施方案中,等渗剂的浓度为1mg/mL-7mg/mL。在另一个实施方案中,等渗剂的浓度为8mg/mL-24mg/mL。在另一个实施方案中,等渗剂的浓度为25mg/mL-50mg/mL。这些具体等渗剂中的每一种构成了本发明的备选实施方案。在药物组合物中应用等渗剂是本领域人员众所周知的。参照Remington:TheScienceandPracticeofPharmacy,第19版,1995。典型的等渗剂为氯化钠、甘露糖醇、二甲亚砜和甘油,典型的防腐剂为苯酚、间-甲酚、对羟基苯甲酸甲酯和苄醇。表面活性剂的实例包括乙酸钠、甘氨酰甘氨酸、羟乙基哌嗪乙磺酸(HEPES)和磷酸钠。实施例保护基:Acmacetamidomethyl:乙酰胺甲基;Alloc或AOCallyloxycarbonyl:烯丙氧羰基;Bom,benzyloxymethyl:苄氧甲基;2-Br-Z,2-bromobenzyloxycarbonyl:2-溴苄氧羰基;tBu,t-butyl:叔丁基;Bz,benzoyl:苯甲酰基;Bzl,benzyl:苄基;Boc:叔丁氧羰基;CHOformyl:甲酰基;cHx,cyclohexyl:环己基;Cbz或Zbenzyloxycarbonyl:苄氧羰基;Cl-Z,2-chlorobenzyloxycarbonyl:2-氯苄氧羰基;Fm,9-fluorenylmethyl:9-芴基甲基;Fmoc,9-fluorenylmethoxycarbonyl:9-芴甲氧羰基;Mtt,4-methyltrityl:4-甲基三苯甲基;Npys,3-nitro-2-pyridinesulfenyl:3-硝基-2-吡啶亚磺酰基;Pmc,(2,2,5,7,8-pentametylchroman-6-sulphonyl:2,2,5,7,8-五甲基-6-羟基色满;Tos,4-toluenesulphonyl:对甲苯磺酰;Trt,tripheylmethyl:三苯甲基;Xan,xanthyl:吨基,氧(杂)蒽基。试剂和溶剂:ACN,acetonitrile:乙腈;BOP,benzotriazol-1-yloxytris(dimethylamino)phosphoniumhexafluorophosphate:苯并三唑-1-三(三甲氨基)-六氟磷酸酯(卡特缩合剂);DCC,N,N'-Dicyclohexylcarbodiimide:二环己基碳化二亚胺;DCM:二氯甲烷;DEPBT,3-(Diethoxyphosphoryloxy)-1,2,3-benzotriazin-4(3H)-one:3-(二乙氧基邻酰氧基)-1,2,3-苯并三嗪-4-酮;DIC,N,N'-Diisopropylcarbodiimide:N,N'-二异丙基碳二亚胺;DIPEA(或DIEA),diisopropylethylamine:二异丙基乙胺;DMAP,4-N,N-dimethylaminopyridine:4-N,N二甲氨基吡啶;DMF:N,N-二甲基甲酰胺;DMSO:二甲亚砜;DTT,dithiothreitol:二硫苏糖醇;EDC或EDCI,1-ethyl-3-(3-dimethylaminopropyl)carbodiimide:1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐;EtOAc:乙酸乙酯;HBTUO-(1H-benzotriazole-1-yl)-N,N,N',N'-tetramethyluroniumhexafluorophosphate苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐;HOBT1-hydroxybenzotriazole:1-羟基-苯并-三氮唑;NMM,N-Methylmorpholine:N-甲基吗啉;NMP,N-methylpyrrolidinone:N-甲基吡咯烷酮;Piperidine:哌啶;Susuccinimide:琥珀酰亚胺;TEA,triethylamine:三乙胺;TFA,trifluoroaceticacid三氟乙酸;TFE2,2,2-Trifluoroethanol三氟代乙醇;THFtetrahydrofuran四氢呋喃;TIStriisopropylsilane三异丙基硅烷。多肽化学合成方法线性多肽使用Boc或Fmoc固相多肽合成法。如果使用Fmoc化学合成C-末端是羧基的多肽,一般选用Wang树脂;C-末端是酰胺的多肽通常选用Rinkamide树脂。如果使用Boc化学合成C-末端是羧基的多肽,一般选用Pam树脂;C-末端是酰胺的多肽通常选用MBHA树脂。缩合剂和活化剂是DIC和HOBT,其他可选肽键缩合剂包括BOP、HBTU、DEPBT等。氨基酸5倍过量。缩合时间为1小时。Fmoc保护基用50%哌啶/DMF脱除。Boc保护基用TFA脱除。肽键缩合反应用茚三酮(Ninhydrin,2,2-Dihydroxyindane-1,3-dione)试剂监测。使用Fmoc固相多肽合成法时,通用氨基酸及保护基如下:Fmoc-Cys(Trt)-OH、Fmoc-Asp(OtBu)-OH、Fmoc-Glu(OtBu)-OH、Fmoc-His(Trt)-OH、Fmoc-Lys(Boc)-OH、Fmoc-Asn(Trt)-OH、Fmoc-Gln(Trt)-OH、Fmoc-Arg(Pmc)-OH、Fmoc-Ser(tBu)-OH、Fmoc-Thr(tBu)-OH、Boc-Trp(Boc)-OH、Fmoc-Tyr(tBu)-OH。固相Fmoc化学合成多肽后,常用的切割试剂是TFA。将干树脂放在一个摇瓶中,加入适当量TFA/TIS/H2O(95:2.5:2.5,10-25mL/g树脂),盖上盖子,在室温下进行间歇式旋转震荡。2小时后抽滤树脂,以新的TFA清洗树脂2-3次,合并滤液,滴加8-10倍体积的冰乙醚。最后,离心收集沉淀出来的多肽粗品。使用Boc固相多肽合成法时,通用氨基酸和保护基如下:Boc-Cys(4-MeBzl)-OH、Boc-Asp(OcHx)-OH、Boc-Glu(OcHx)-OH、Boc-His(Bom)-OH、Boc-Lys(2-Cl-Z)-OH、Boc-Asn(Xan)-OH、Boc-Gln(Xan)-OH、Boc-Arg(Tos)-OH、Boc-Ser(Bzl)-OH、Boc-Thr(Bzl)-OH、Boc-Trp(CHO)-OH和Boc-Tyr(2-Br-Z)-OH。固相Boc化学合成多肽后,对于PAM、MBHA树脂,一般采用HF切割,每0.1毫摩尔树脂加5毫升HF,同时加入对甲苯酚、对巯基苯酚或苯甲醚等试剂,混合物在冰浴条件下搅拌1小时。HF真空抽干后,多肽用冰乙醚沉淀,离心收集沉淀,经过HPLC分离纯化,冷冻干燥得到最后产品。单链化合物的合成自然化学连接文献方法(Kent,S.B.H.等,“ComparativePropertiesofInsulin-likeGrowthFactor1(IGF-1)and[Gly7D-Ala]IGF-1PreparedbyTotalChemicalSynthesis.”Angew.Chem.Int.Ed.2008,47,1102–1106)根据氨基酸序列进行部分改进。基于胰岛素的单链化合物分成两个片段合成。一段用Boc化学合成胰岛素B链片段1-18:EEEEEEM-[1-18]-COS-(CH2)2CO-(Arg)4A。硫酯残基合成时用S-三苯甲基-3-巯基丙酸。第二段包括从B19Cys(对应于通式中的C[2])起到B链C末端全部氨基酸,C链和A链氨基酸。两段多肽用通用方法固相合成,切割,纯化。自然化学连接反应在缓冲液中进行。缓冲液含6M胍盐酸盐,200mM磷酸盐,200mM4-羧甲基苯硫酚(MPAA,(4-carboxymethyl)thiophenol),20mM三(2-甲酰乙基)膦(TCEP,tris-(2-carboxyethyl)phosphine),pH6.9,多肽按1:1摩尔比溶解,浓度2mM。反应用HPLC检测、纯化。纯化的IGF(SH)6溶解于0.5M胍盐酸盐、20mMTris、8mM半胱氨酸、1mM胱氨酸盐酸盐缓冲液,pH7.8,多肽浓度0.5mg/mL。当HPLC显示折叠完成后,缓冲液用0.1N盐酸酸化至pH3。多肽用制备HPLC纯化。化合物Ⅰ-2的合成:Ⅰ-2:FVNQHLCGSHLVEALYLVCGERGFFYTPKTGSGSSSAAAPQTGIVEQCCTSICSLYQLENYCN。第一片段EEEEEEMFVNQHLCGSHLVEALYLV-(COS-CH2CH2-CO)-RRA用Boc化学合成,粗肽用RP-HPLC纯化。分子量计算值3419.9,质谱测试分子量3421.3。第二片段CGERGFFYTPKTGSGSSSAAAPQTGIVEQCCTSICSLYQLENYCN按通用方法合成。分子量计算值4773.4.,质谱测试分子量4775.0。第一片段34mg(10μmol)和第二片段48mg(10μmol)溶解于缓冲液(5mL)。缓冲液包含6M胍盐酸盐,200mM磷酸盐,200mM4-羧甲基苯硫酚,20mM三(2-甲酰乙基)膦,pH6.9。10小时后反应完成。分子量计算值7703.6,质谱测试分子量7704.2。将混合物转移到尺寸排阻层析柱,洗脱缓冲液是0.5M胍盐酸盐,20mMTris,pH7.8。收取包含正确多肽分子量的部分,合并后加入8mM半胱氨酸,1mM胱氨酸盐酸盐缓冲液,2小时后多肽折叠完毕。将缓冲液用0.1N盐酸酸化至pH3,然后用RP-HPLC纯化。分子量计算值7697.6,质谱测试分子量7699.5。多肽溶解于70%甲酸(或0.1M盐酸),加入溴化氰(30倍量),在室温下培养。HPLC检测反应完成后,用氮气挥发大部分甲酸和溴化氰后,用10%醋酸稀释,然后RP-HPLC纯化。最终,化合物Ⅰ-2的分子量计算值6791.7,质谱测试分子量6792.3。经测序,该化合物的氨基酸序列即是SEQIDNO:2。以相同的方法合成其它基于胰岛素的单链化合物。进一步确认化合物的结构,尤其是三对二硫键的连接方式,使用文献(Chance等,“TheproductionofhumaninsulinusingrecombinantDNAtechnologyandanewchaincombinationprocedure”,Pept.:Synth.,Struct.,Funct.,Proc.Am.Pept.Symp.,7th,1981,Vol.721,Issue8,Page721)中的HPLC“指纹”分析法。简而言之,2mg多肽样品溶于0.2ml0.01N盐酸,加入0.8ml含有100μgS.aureusV8蛋白酶的0.05MNH4HCO3,使pH达到7.9。在37℃培养24小时。小部分样品加入DTT培养30分钟。使用LC-MS对比样品和标准品的各个片段的保留时间(retentiontime)和分子量确定二硫键和化合物的结构。合成结果:利用上述方法合成基于胰岛素的单链化合物,通过质谱检测各化合物的分子量,通过测序的方法检测各化合物的结构,结果如下:Ⅰ-1:分子量计算值7038.0,质谱测试分子量7038.2;经测序,该化合物的氨基酸序列即是SEQIDNO:1;Ⅰ-3:分子量计算值6718.6,质谱测试分子量6719.7;经测序,该化合物的氨基酸序列即是SEQIDNO:3;Ⅰ-4:分子量计算值6846.8,质谱测试分子量6848.1;经测序,该化合物的氨基酸序列即是SEQIDNO:4;Ⅰ-5:分子量计算值6830.8,质谱测试分子量6829.9;经测序,该化合物的氨基酸序列即是SEQIDNO:5;Ⅰ-6:分子量计算值6775.7,质谱测试分子量6776.9;经测序,该化合物的氨基酸序列即是SEQIDNO:6;Ⅰ-7:分子量计算值6635.6,质谱测试分子量6536.8;经测序,该化合物的氨基酸序列即是SEQIDNO:7;Ⅰ-8:分子量计算值6550.4,质谱测试分子量6551.5;经测序,该化合物的氨基酸序列即是SEQIDNO:8;Ⅰ-9:分子量计算值6621.5,质谱测试分子量6622.3;经测序,该化合物的氨基酸序列即是SEQIDNO:9;Ⅰ-10:分子量计算值6536.4,质谱测试分子量6538.0;经测序,该化合物的氨基酸序列即是SEQIDNO:10;Ⅰ-11:分子量计算值6476.4,质谱测试分子量6477.6;经测序,该化合物的氨基酸序列即是SEQIDNO:11;Ⅰ-12:分子量计算值6476.4,质谱测试分子量6477.2;经测序,该化合物的氨基酸序列即是SEQIDNO:12;Ⅰ-13:分子量计算值6465.3,质谱测试分子量6466.7;经测序,该化合物的氨基酸序列即是SEQIDNO:13;Ⅰ-14:分子量计算值6465.3,质谱测试分子量6466.0;经测序,该化合物的氨基酸序列即是SEQIDNO:14;Ⅰ-15:分子量计算值6495.4,质谱测试分子量6495.9;经测序,该化合物的氨基酸序列即是SEQIDNO:15;Ⅰ-16:分子量计算值6405.3,质谱测试分子量6406.2;经测序,该化合物的氨基酸序列即是SEQIDNO:16;Ⅰ-17:分子量计算值6405.3,质谱测试分子量6406.8;经测序,该化合物的氨基酸序列即是SEQIDNO:17;Ⅰ-18:分子量计算值6435.3,质谱测试分子量6436.5;经测序,该化合物的氨基酸序列即是SEQIDNO:18;Ⅰ-19:分子量计算值6435.3,质谱测试分子量6437.0;经测序,该化合物的氨基酸序列即是SEQIDNO:19;Ⅰ-20:分子量计算值6408.3,质谱测试分子量6409.7;经测序,该化合物的氨基酸序列即是SEQIDNO:20;Ⅰ-21:分子量计算值6362.3,质谱测试分子量6362.9;经测序,该化合物的氨基酸序列即是SEQIDNO:21;Ⅰ-22:分子量计算值6378.3,质谱测试分子量6379.1;经测序,该化合物的氨基酸序列即是SEQIDNO:22;Ⅰ-23:分子量计算值6305.2,质谱测试分子量6306.5;经测序,该化合物的氨基酸序列即是SEQIDNO:23;Ⅰ-24:分子量计算值6291.2,质谱测试分子量6292.6;经测序,该化合物的氨基酸序列即是SEQIDNO:24;Ⅰ-25:分子量计算值6321.2,质谱测试分子量6422.4;经测序,该化合物的氨基酸序列即是SEQIDNO:25;Ⅰ-26:分子量计算值6201.0,质谱测试分子量6202.2;经测序,该化合物的氨基酸序列即是SEQIDNO:26;Ⅰ-27:分子量计算值6156.0,质谱测试分子量6157.1;经测序,该化合物的氨基酸序列即是SEQIDNO:27;Ⅰ-28:分子量计算值6348.2,质谱测试分子量6348.7;经测序,该化合物的氨基酸序列即是SEQIDNO:28;Ⅰ-29:分子量计算值6378.2,质谱测试分子量6379.5;经测序,该化合物的氨基酸序列即是SEQIDNO:29;Ⅰ-30:分子量计算值6362.2,质谱测试分子量6363.4;经测序,该化合物的氨基酸序列即是SEQIDNO:30;Ⅰ-31:分子量计算值6281.1,质谱测试分子量6280.9;经测序,该化合物的氨基酸序列即是SEQIDNO:31;Ⅰ-32:分子量计算值6295.1,质谱测试分子量6296.0;经测序,该化合物的氨基酸序列即是SEQIDNO:32;Ⅰ-33:分子量计算值6548.4,质谱测试分子量6549.8;经测序,该化合物的氨基酸序列即是SEQIDNO:33;Ⅰ-34:分子量计算值6241.1,质谱测试分子量6242.3;经测序,该化合物的氨基酸序列即是SEQIDNO:34;Ⅰ-35:分子量计算值6777.7,质谱测试分子量6778.2;经测序,该化合物的氨基酸序列即是SEQIDNO:35;Ⅰ-36:分子量计算值6793.7,质谱测试分子量6795.0;经测序,该化合物的氨基酸序列即是SEQIDNO:36;Ⅰ-37:分子量计算值6793.7,质谱测试分子量6793.9;经测序,该化合物的氨基酸序列即是SEQIDNO:37;Ⅰ-38:分子量计算值6850.8,质谱测试分子量6851.2;经测序,该化合物的氨基酸序列即是SEQIDNO:38;Ⅰ-39:分子量计算值6845.8,质谱测试分子量6846.6;经测序,该化合物的氨基酸序列即是SEQIDNO:39;Ⅰ-40:分子量计算值6902.9,质谱测试分子量6904.4;经测序,该化合物的氨基酸序列即是SEQIDNO:40;Ⅰ-41:分子量计算值6916.7,质谱测试分子量6917.6;经测序,该化合物的氨基酸序列即是SEQIDNO:41;Ⅰ-42:分子量计算值6904.9,质谱测试分子量6905.8;经测序,该化合物的氨基酸序列即是SEQIDNO:42;Ⅰ-43:分子量计算值6962.8,质谱测试分子量6964.3;经测序,该化合物的氨基酸序列即是SEQIDNO:43;Ⅰ-44:分子量计算值6856.8,质谱测试分子量6858.5;经测序,该化合物的氨基酸序列即是SEQIDNO:44;Ⅰ-45:分子量计算值6890.8,质谱测试分子量6891.9;经测序,该化合物的氨基酸序列即是SEQIDNO:45;Ⅰ-46:分子量计算值6934.9,质谱测试分子量6936.7;经测序,该化合物的氨基酸序列即是SEQIDNO:46;Ⅰ-47:分子量计算值6746.7,质谱测试分子量6747.0;经测序,该化合物的氨基酸序列即是SEQIDNO:47;Ⅰ-48:分子量计算值7610.6,质谱测试分子量7612.0;经测序,该化合物的氨基酸序列即是SEQIDNO:48;Ⅰ-49:分子量计算值6835.8,质谱测试分子量6837.1;经测序,该化合物的氨基酸序列即是SEQIDNO:49;Ⅰ-50:分子量计算值6835.8,质谱测试分子量6836.7;经测序,该化合物的氨基酸序列即是SEQIDNO:50;Ⅰ-51:分子量计算值6875.8,质谱测试分子量6876.6;经测序,该化合物的氨基酸序列即是SEQIDNO:51;Ⅰ-52:分子量计算值6859.8,质谱测试分子量6860.4;经测序,该化合物的氨基酸序列即是SEQIDNO:52;Ⅰ-53:分子量计算值6972.0,质谱测试分子量6973.8;经测序,该化合物的氨基酸序列即是SEQIDNO:53;Ⅰ-54:分子量计算值7708.7,质谱测试分子量7710.4;经测序,该化合物的氨基酸序列即是SEQIDNO:54;Ⅰ-55:分子量计算值6845.8,质谱测试分子量6846.9;经测序,该化合物的氨基酸序列即是SEQIDNO:55;Ⅰ-56:分子量计算值6875.8,质谱测试分子量6876.2;经测序,该化合物的氨基酸序列即是SEQIDNO:56;Ⅰ-57:分子量计算值6902.8,质谱测试分子量6903.5;经测序,该化合物的氨基酸序列即是SEQIDNO:57;Ⅰ-58:分子量计算值6861.8,质谱测试分子量6863.1;经测序,该化合物的氨基酸序列即是SEQIDNO:58;Ⅰ-59:分子量计算值6930.9,质谱测试分子量6932.6;经测序,该化合物的氨基酸序列即是SEQIDNO:59;Ⅰ-60:分子量计算值8412.5,质谱测试分子量8413.9;经测序,该化合物的氨基酸序列即是SEQIDNO:60;Ⅰ-61:分子量计算值6858.8,质谱测试分子量6860.0;经测序,该化合物的氨基酸序列即是SEQIDNO:61;Ⅰ-62:分子量计算值6817.7,质谱测试分子量6818.8;经测序,该化合物的氨基酸序列即是SEQIDNO:62;Ⅰ-63:分子量计算值7315.3,质谱测试分子量7316.5;经测序,该化合物的氨基酸序列即是SEQIDNO:63;Ⅰ-64:分子量计算值8745.7,质谱测试分子量8746.9;经测序,该化合物的氨基酸序列即是SEQIDNO:64;Ⅰ-65:分子量计算值6933.9,质谱测试分子量6935.1;经测序,该化合物的氨基酸序列即是SEQIDNO:65;Ⅰ-66:分子量计算值6877.8,质谱测试分子量6879.3;经测序,该化合物的氨基酸序列即是SEQIDNO:66;Ⅰ-67:分子量计算值6930.9,质谱测试分子量6931.7;经测序,该化合物的氨基酸序列即是SEQIDNO:67;Ⅰ-68:分子量计算值6922.9,质谱测试分子量6924.4;经测序,该化合物的氨基酸序列即是SEQIDNO:68;Ⅰ-69:分子量计算值6975.9,质谱测试分子量6776.5;经测序,该化合物的氨基酸序列即是SEQIDNO:69;Ⅰ-70:分子量计算值6821.7,质谱测试分子量6823.2;经测序,该化合物的氨基酸序列即是SEQIDNO:70;Ⅰ-71:分子量计算值6809.7,质谱测试分子量6810.8;经测序,该化合物的氨基酸序列即是SEQIDNO:71;Ⅰ-72:分子量计算值6848.8,质谱测试分子量6850.4;经测序,该化合物的氨基酸序列即是SEQIDNO:72;Ⅰ-73:分子量计算值8228.3,质谱测试分子量8230.1;经测序,该化合物的氨基酸序列即是SEQIDNO:73;Ⅰ-74:分子量计算值6894.8,质谱测试分子量6896.9;经测序,该化合物的氨基酸序列即是SEQIDNO:74;Ⅰ-75:分子量计算值7004.0,质谱测试分子量7005.5;经测序,该化合物的氨基酸序列即是SEQIDNO:75;Ⅰ-76:分子量计算值7788.7,质谱测试分子量7790.2;经测序,该化合物的氨基酸序列即是SEQIDNO:76;Ⅰ-77:分子量计算值7358.3,质谱测试分子量7360.8;经测序,该化合物的氨基酸序列即是SEQIDNO:77;Ⅰ-78:分子量计算值7586.6,质谱测试分子量7587.7;经测序,该化合物的氨基酸序列即是SEQIDNO:78;Ⅰ-79:分子量计算值7142.2,质谱测试分子量7143.0;经测序,该化合物的氨基酸序列即是SEQIDNO:79;Ⅰ-80:分子量计算值6208.1,质谱测试分子量6209.2;经测序,该化合物的氨基酸序列即是SEQIDNO:80;Ⅰ-81:分子量计算值6756.7,质谱测试分子量6757.8;经测序,该化合物的氨基酸序列即是SEQIDNO:81;Ⅰ-82:分子量计算值7296.3,质谱测试分子量7297.5;经测序,该化合物的氨基酸序列即是SEQIDNO:82;Ⅰ-83:分子量计算值7455.4,质谱测试分子量7457.6;经测序,该化合物的氨基酸序列即是SEQIDNO:83;Ⅰ-84:分子量计算值6812.6,质谱测试分子量6813.8;经测序,该化合物的氨基酸序列即是SEQIDNO:84;Ⅰ-85:分子量计算值6638.4,质谱测试分子量6639.0;经测序,该化合物的氨基酸序列即是SEQIDNO:85;Ⅰ-86:分子量计算值6846.8,质谱测试分子量6848.2;经测序,该化合物的氨基酸序列即是SEQIDNO:86;Ⅰ-87:分子量计算值7136.1,质谱测试分子量7137.9;经测序,该化合物的氨基酸序列即是SEQIDNO:87;Ⅰ-88:分子量计算值7472.6,质谱测试分子量7474.9;经测序,该化合物的氨基酸序列即是SEQIDNO:88;Ⅰ-89:分子量计算值6605.5,质谱测试分子量6606.8;经测序,该化合物的氨基酸序列即是SEQIDNO:89;Ⅰ-90:分子量计算值6837.8,质谱测试分子量6839.1;经测序,该化合物的氨基酸序列即是SEQIDNO:90;Ⅰ-91:分子量计算值6770.7,质谱测试分子量6772.4;经测序,该化合物的氨基酸序列即是SEQIDNO:91;Ⅰ-92:分子量计算值6586.5,质谱测试分子量6587.7;经测序,该化合物的氨基酸序列即是SEQIDNO:92;Ⅰ-93:分子量计算值6572.5,质谱测试分子量6573.0;经测序,该化合物的氨基酸序列即是SEQIDNO:93;Ⅰ-94:分子量计算值7008.0,质谱测试分子量7009.2;经测序,该化合物的氨基酸序列即是SEQIDNO:94;Ⅰ-95:分子量计算值6607.5,质谱测试分子量6608.7;经测序,该化合物的氨基酸序列即是SEQIDNO:95;Ⅰ-96:分子量计算值7079.1,质谱测试分子量7080.6;经测序,该化合物的氨基酸序列即是SEQIDNO:96;Ⅰ-97:分子量计算值6951.9,质谱测试分子量6953.4;经测序,该化合物的氨基酸序列即是SEQIDNO:97;Ⅰ-98:分子量计算值8239.3,质谱测试分子量8241.1;经测序,该化合物的氨基酸序列即是SEQIDNO:98;Ⅰ-99:分子量计算值6322.1,质谱测试分子量6322.7;经测序,该化合物的氨基酸序列即是SEQIDNO:99;Ⅰ-100:分子量计算值7890.0,质谱测试分子量7891.4;经测序,该化合物的氨基酸序列即是SEQIDNO:100;Ⅰ-101:分子量计算值6709.5,质谱测试分子量6710.6;经测序,该化合物的氨基酸序列即是SEQIDNO:101;Ⅰ-102:分子量计算值6235.0,质谱测试分子量6235.9;经测序,该化合物的氨基酸序列即是SEQIDNO:102;Ⅰ-103:分子量计算值7371.3,质谱测试分子量7372.5;经测序,该化合物的氨基酸序列即是SEQIDNO:103;Ⅰ-104:分子量计算值7485.5,质谱测试分子量7487.0;经测序,该化合物的氨基酸序列即是SEQIDNO:104;Ⅰ-105:分子量计算值7752.7,质谱测试分子量7754.2;经测序,该化合物的氨基酸序列即是SEQIDNO:105;Ⅰ-106:分子量计算值7387.3,质谱测试分子量7388.7;经测序,该化合物的氨基酸序列即是SEQIDNO:106;Ⅰ-107:分子量计算值7197.1,质谱测试分子量7198.6;经测序,该化合物的氨基酸序列即是SEQIDNO:107;Ⅰ-108:分子量计算值7098.1,质谱测试分子量7099.0;经测序,该化合物的氨基酸序列即是SEQIDNO:108;Ⅰ-109:分子量计算值7124.0,质谱测试分子量7124.8;经测序,该化合物的氨基酸序列即是SEQIDNO:109;Ⅰ-110:分子量计算值7640.7,质谱测试分子量7641.4;经测序,该化合物的氨基酸序列即是SEQIDNO:110;Ⅰ-111:分子量计算值7936.9,质谱测试分子量7938.5;经测序,该化合物的氨基酸序列即是SEQIDNO:111;Ⅰ-112:分子量计算值6902.8,质谱测试分子量6903.1;经测序,该化合物的氨基酸序列即是SEQIDNO:112;Ⅰ-113:分子量计算值7669.7,质谱测试分子量7671.1;经测序,该化合物的氨基酸序列即是SEQIDNO:113;Ⅰ-114:分子量计算值7529.6,质谱测试分子量7531.8;经测序,该化合物的氨基酸序列即是SEQIDNO:114;Ⅰ-115:分子量计算值7041.0,质谱测试分子量7041.6;经测序,该化合物的氨基酸序列即是SEQIDNO:115;Ⅰ-116:分子量计算值7007.9,质谱测试分子量7009.2;经测序,该化合物的氨基酸序列即是SEQIDNO:116;Ⅰ-117:分子量计算值7630.7,质谱测试分子量7631.9;经测序,该化合物的氨基酸序列即是SEQIDNO:117;Ⅰ-118:分子量计算值7421.3,质谱测试分子量7423.3;经测序,该化合物的氨基酸序列即是SEQIDNO:118;Ⅰ-119:分子量计算值6965.9,质谱测试分子量6967.0;经测序,该化合物的氨基酸序列即是SEQIDNO:119;Ⅰ-120:分子量计算值6375.3,质谱测试分子量6376.7;经测序,该化合物的氨基酸序列即是SEQIDNO:120;Ⅰ-121:分子量计算值6304.2,质谱测试分子量6305.6;经测序,该化合物的氨基酸序列即是SEQIDNO:121;Ⅰ-122:分子量计算值6595.4,质谱测试分子量6597.8;经测序,该化合物的氨基酸序列即是SEQIDNO:122;Ⅰ-123:分子量计算值6932.9,质谱测试分子量6934.1;经测序,该化合物的氨基酸序列即是SEQIDNO:123。化合物的修饰酰化反应叔丁基十六烷二酰基-L-Glu(OSu)-OtBu制备十六烷二酸(5.72g,20mmol)溶解于无水DMF(240mL),用冰浴冷却。逐次添加2-甲基-2-丙醇(1.48g,20mmol)、DIC(2.7g,2.25mL,21.4mmol)、HOBT(2.88g,21.4mmol)、NMM(2.16g,2.34mL,21.4mmol)、DMAP(244mg,2mmol)。混合物在室温下搅拌过夜。加入80mL水,酸化到pH3,用乙酸乙酯萃取,有机层用0.1NHCl和饱和食盐水洗,硫酸镁干燥后,溶剂减压蒸发得到十六烷二酸一叔丁酯(3.32g,产率47%)。核磁共振数据为1H-NMR(CDCl3)δ:2.35(t,2H),1.56-1.66(m,4H),1.44(s,9H),1.21-1.35(m,20H)。Fmoc-Glu-OtBu(4.25g,10mmol)溶解于DCM(30mL),加到3克2-CTC树脂(2-chlorotritylchlorideresin,sub.1mmol/g),继续加入DIPEA(1.29g,10mmol,1.74mL)。混合物在摇动器振动5分钟后,再加入DIPEA(1.93g,15mmol,2.6mL)。混合物剧烈振动1小时。为了封住活性三苯甲游基,树脂中加入HPLC级甲醇(2.4mL),混合15分钟。树脂过滤,用DCM(3X30mL),DMF(2X30mL),DCM(3X30mL),甲醇(3X30mL)清洗后,在真空中干燥。用哌啶脱除Fmoc后,3g树脂(3mmol)与十六烷二酸一叔丁酯(3.43g,10mmol)加入无水DMF(50mL),逐次加入DIC(1.35g,1.12mL,10.7mmol),HOBT(1.44g,10.7mmol),DIPEA(1.3g,10mmol,1.74mL)。在室温振动过夜后,树脂用DMF(2X30mL)和DCM(2X30mL)清洗。准备AcOH/TFE/DCM(1:1:8)的切割液(20mL/g树脂)。树脂悬浮在一半的切割液,室温下放置30分钟。过滤树脂,用另一半切割液洗涤树脂三次。混合滤液加入15倍体积的正己烷,旋蒸去除多余醋酸,得到叔丁基十六烷二酰基-L-Glu-OtBu。核磁共振数据为1H-NMR(CDCl3)δ:6.25(d,1H),4.53(m,1H),2.42(m,2H),2.21(m,4H),1.92(m,1H),1.58(m,4H),1.47(s,9H),1.22-1.43(m,18H)。叔丁基十六烷二酰基-L-Glu-OtBu(1g,1.9mmol)溶于无水DMF/DCM(1mL:4mL).加入DCC(0.412g,2mmol)和N-羟基丁二酰亚胺(0.23g,2mmol)。混合物在室温搅拌过夜。过滤混合物,滤液用乙酸乙酯稀释,用0.1NHCl和饱和食盐水洗涤,硫酸镁干燥后,减压蒸发得到叔丁基十六烷二酰基-L-Glu(OSu)-OtBu。核磁共振数据为:1H-NMR(CDCl3)δ:6.17(d,1H),4.60(m,1H),2.84(s,4H),2.72(m,1H),2.64(m,1H),2.32(m,1H),2.20(m,4H),2.08(m,1H),1.6(m,4H),1.47(s,9H),1.43(s,9H),1.20-1.33(m,20H)。化合物Ⅱ-2的合成:Ⅱ-2:FVNQHLCGSHLVEALYLVCGERGFFYTPTGK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]GSSSAAAPQTGIVEQCCTSICSLYQLENYCN。第一片段EEEEEEMFVNQHLCGSHLVEALYLV-(COS-CH2CH2-CO)-RRA用Boc化学合成。分子量计算值3419.9,质谱测试分子量3420.6。粗肽用RP-HPLC纯化。第二片段CGERGFFYTPTGKGSSSAAAPQTGIVEQCCTSICSLYQLENYCN按通用方法合成。分子量计算值4686.3,质谱测试分子量4687.5。粗肽用RP-HPLC纯化。第一片段34mg(10μmol)和第二片段47mg(10μmol)溶解于缓冲液(5mL)。缓冲液包含6M胍盐酸盐,200mM磷酸盐,200mM4-羧甲基苯硫酚,20mM三(2-甲酰乙基)膦,pH6.9。分子量计算值7913.9,质谱测试分子量7915.7。将混合物转移到尺寸排阻层析柱,洗脱缓冲液是0.5M胍盐酸盐,20mMTris,pH7.8。收取包含正确多肽分子量的部分,合并后加入8mM半胱氨酸,1mM胱氨酸盐酸盐缓冲液。多肽折叠完毕后,将缓冲液用0.1N盐酸酸化至pH2,然后RP-HPLC纯化。分子量计算值7610.5,质谱测试分子量7611.2。室温下将多肽(78mg)溶于100mMNa2CO3(2mL,pH10)溶液。叔丁基十六烷二酰基-L-Glu(OSu)-OtBu(6.5mg)溶于乙腈(2mL),加入多肽溶液。搅拌30分钟后,用50%醋酸酸化,上RP-HPLCC5柱纯化。缓冲液A:0.1%TFA水溶液,10%乙腈;缓冲液B:0.1%TFA水溶液,80%乙腈。初步纯化冻干后的多肽加入TFA/TIS/H2O(95:2.5:2.5,10mL),30分钟后真空蒸发溶剂,将粗产品溶于缓冲液A并冻干。使用RP-HPLCC5柱纯化得到产物。分子量计算值8008.0,质谱测试分子量8010.1。多肽溶解于70%甲酸(或0.1M盐酸),加入溴化氰(30倍量),在室温下培养。HPLC检测反应完成后,用氮气挥发大部分甲酸和溴化氰后,用10%醋酸稀释,然后RP-HPLC纯化。最终获得Ⅱ-2的分子量计算值7102.1,质谱测试分子量7103.5。少量化合物经DTT还原和胰蛋白酶降解后,用液相色谱-质谱联用观察到FVNQHLCGSHLVEALYLVCGER(计算分子量2487.9,质谱测试分子量2488.1),GFFYTPTGK[Nε-(Nα-(HOOC(CH2)14CO)-γ-Glu)]GSSSAAAPQTGIVEQCCTSICSLYQLENYCN(计算分子量4638.3,质谱测试分子量4639.6)。经分析,合成的物质即是Ⅱ-2。OSu-CO-(CH2CH2O)5-(CH2)2-NH-[Nα-(HOOC(CH2)16CO)-γ-Glu]合成十八烷二酸(2.5g,8.0mmol)悬浮于DCM(60ml),加入三乙胺(1.16ml,8.3mmol)并用冰浴冷却。在氮气环境中滴加氯甲酸苄基酯(1.14ml),再加入DMAP(0.097g,0.8mmol)。搅拌30分钟后,减压蒸发溶剂,将粗品用硅胶柱纯化(乙酸乙酯:庚烷1:7-1:1),蒸发溶剂后得到十八烷二酸一苄酯(1.12g,35%)。1H-NMR(CDCl3)δ:7.35(m,5H),5.11(s,2H),2.35(t,4H),1.63(t,4H),1.30-1.22(m,24)。十八烷二酸一苄酯(0.8g,2mmol)溶于DMF(3ml)和DCM(3ml),用冰浴冷却。加入DCC(0.408g,2mmol)和N-羟基丁二酰亚胺(0.23g,2mmol)。混合物在室温搅拌24小时。过滤混合物,滤液用乙酸乙酯稀释,用0.1NHCl和饱和食盐水洗涤,硫酸镁干燥后,减压蒸发得到琥珀酰亚胺基一苄基十八烷二酸酯。1H-NMR(CDCl3)δ:7.35(m,5H),5.11(s,2H),2.83(s,4H),2.60(t,2H),2.35(t,2H),1.80-1.60(m,4H),1.40-1.20(m,24H)。琥珀酰亚胺基一苄基十八烷二酸酯(95mg,0.19mmol)溶于DMF(1.5ml),加入L-Glu-OBzl(49mg,0.21mmol)和DIEA(52μl,0.3mmol),搅拌16小时。减压蒸发溶剂,加入乙酸乙酯,用0.1NHCl、饱和食盐水洗涤,硫酸镁干燥后减压蒸发溶剂,得到BzlO-十八烷二酰基-L-Glu-OBzl。1H-NMR(CDCl3)δ:7.35(m,5H),6.22(d,2H),5.17(s,2H),5.11(s,2H),4.71(m,1H),2.37(m,4H),2.22(m,3H),1.98(m,1H),1.63(m,4H),1.31-1.20(m,24H)。BzlO-十八烷二酰基-L-Glu-OBzl(110mg,0.18mmol)溶于DMF(1ml)和DCM(1ml),用冰浴冷却。加入DCC(41mg,0.2mmol)和N-羟基丁二酰亚胺(23mg,0.2mmol)。混合物在室温搅拌12小时。过滤混合物,滤液用乙酸乙酯稀释,用0.1NHCl和饱和食盐水洗涤,硫酸镁干燥后,减压蒸发得到BzlO-十八烷二酰基-L-Glu(OSu)-OBzl。1H-NMR(CDCl3)δ:7.36(m,5H),6.40(d,2H),5.19(s,2H),5.11(s,2H),4.75(m,1H),2.82(s,4H),2.68(m,1H),2.59(m,1H),2.35(t,2H),2.19(t,2H),1.62(m,4H),1.32-1.21(m,24H)。BzlO-十八烷二酰基-L-Glu(OSu)-OBzl(72mg,0.1mmol)和H2N-(CH2)2-(OCH2CH2)5COOH(31mg,0.1mmol)溶于DMF/DCM(0.5ml:1.5ml),加入DIEA(26μL,0.15mmol),搅拌16小时。减压蒸发溶剂,加入乙酸乙酯,用0.1NHCl、饱和食盐水洗涤,硫酸镁干燥后减压蒸发溶剂,得到3-[2-[2-[2-[2-[2-[[5-苄氧基-4-[(18-苄氧基-18-氧代-十八烷酰基)氨基]-5-氧代-戊酰基]氨基]乙氧基]乙氧基]乙氧基]乙氧基]乙氧基]丙酸(3-[2-[2-[2-[2-[2-[[5-benzyloxy-4-[(18-benzyloxy-18-oxo-octadecanoyl)amino]-5-oxo-pentanoyl]amino]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]propanoicacid)。计算分子量915.2,测试分子量916.5。3-[2-[2-[2-[2-[2-[[5-苄氧基-4-[(18-苄氧基-18-氧代-十八烷酰基)氨基]-5-氧代-戊酰基]氨基]乙氧基]乙氧基]乙氧基]乙氧基]乙氧基]丙酸(91mg,0.1mmol)溶于DMF(1ml)和DCM(1ml),用冰浴冷却。加入DCC(24.7mg,0.12mmol)和N-羟基丁二酰亚胺(13.8mg,0.12mmol)。混合物在室温搅拌12小时。过滤混合物,滤液用乙酸乙酯稀释,用0.1NHCl和饱和食盐水洗涤,硫酸镁干燥后,减压蒸发得到苯甲基18-[[1-苄氧羰基-4-[2-[2-[2-[2-[2-[3-(2,5-二氧代吡咯烷-1-yl)氧-3-氧代-丙氧基]乙氧基]乙氧基]乙氧基]乙氧基]乙氨基]-4-氧代-丁基]氨基]-18-氧代-硬脂酸盐(benzyl18-[[1-benzyloxycarbonyl-4-[2-[2-[2-[2-[2-[3-(2,5-dioxopyrrolidin-1-yl)oxy-3-oxo-propoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethylamino]-4-oxo-butyl]amino]-18-oxo-octadecanoate)。计算分子量1012.2,测试分子量1013.1。苯甲基18-[[1-苄氧羰基-4-[2-[2-[2-[2-[2-[3-(2,5-二氧代吡咯烷-1-yl)氧-3-氧代-丙氧基]乙氧基]乙氧基]乙氧基]乙氧基]乙氨基]-4-氧代-丁基]氨基]-18-氧代-硬脂酸盐(51mg,0.05mmol)溶于甲醇/丙酮/0.1%TFA,加入Pd/C,在氮气环境下室温搅拌5小时,通过硅藻土过滤,从庚烷中沉淀并蒸发残余溶剂,得到18-[[1-羧基-4-[2-[2-[2-[2-[2-[3-(2,5-二氧代吡咯烷-1-yl)氧-3-氧代-丙氧基]乙氧基]乙氧基]乙氧基]乙氧基]乙氨基]-4-氧代-丁基]氨基]-18-氧代-硬脂酸(18-[[1-carboxy-4-[2-[2-[2-[2-[2-[3-(2,5-dioxopyrrolidin-1-yl)oxy-3-oxo-propoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethylamino]-4-oxo-butyl]amino]-18-oxo-octadecanoicacid)。计算分子量832.0,测试分子量833.4。结构如下所示:II-24合成用上述方法合成FVNQHLCGSHLVEALYLVCGERGFFYTPTGKGSSSAAAPQTGIVEQCCTSICSLYQLENYCN。计算分子量6704.6,质谱测试分子量6706.3。室温下将多肽(67mg,10μmol)溶于100mMNa2CO3(1ml,pH10)溶液。18-[[1-羧基-4-[2-[2-[2-[2-[2-[3-(2,5-二氧代吡咯烷-1-yl)氧-3-氧代-丙氧基]乙氧基]乙氧基]乙氧基]乙氧基]乙氨基]-4-氧代-丁基]氨基]-18-氧代-硬脂酸(9.2mg,11μmol)溶于乙腈(0.5ml),加入多肽溶液。搅拌30分钟后用醋酸酸化,上RP-HPLCC5柱纯化。缓冲液A:0.1%TFA水溶液,10%乙腈;缓冲液B:0.1%TFA水溶液,80%乙腈。分子量计算值7421.5,质谱测试分子量7422.9。经分析,所得化合物即II-24。十八烷二酰基-Glu(Glu(OSu)-OH)-OH的制备Fmoc-Glu-OBzl(4.59g,10mmol)溶解于DCM(30mL),加到3克2-CTC树脂(2-chlorotritylchlorideresin,sub.1mmol/g),继续加入DIPEA(1.29g,10mmol,1.74mL)。混合物在摇动器振动5分钟后,再加入DIPEA(1.93g,15mmol,2.6mL)。混合物剧烈振动1小时。为了封住活性三苯甲游基,树脂中加入HPLC级甲醇(2.4mL),混合15分钟。树脂过滤,用DCM(3X30mL),DMF(2X30mL),DCM(3X30mL),甲醇(3X30mL)清洗后,在真空中干燥。用哌啶脱除Fmoc后,3g树脂(3mmol)与BzlO-十八烷二酰基-L-Glu-OBzl(6.24g,10mmol)加入无水DMF(50mL),逐次加入DIC(1.35g,1.12mL,10.7mmol),HOBT(1.44g,10.7mmol),DIPEA(1.3g,10mmol,1.74mL)。在室温振动过夜后,树脂用DMF(2X30mL)和DCM(2X30mL)清洗。准备AcOH/TFE/DCM(1:1:8)的切割液(20mL/g树脂)。树脂悬浮在一半的切割液,室温下放置30分钟。过滤树脂,用另一半切割液洗涤树脂三次。混合滤液加入15倍体积的正己烷,旋蒸去除多余醋酸。BzlO-十八烷二酰基-Glu(Glu-OBzl)-OBzl溶于DMF(3ml)和DCM(3ml),用冰浴冷却。加入DCC(618mg,3mmol)和N-hydroxysuccinimide(345mg,3mmol)。混合物在室温搅拌12小时。过滤混合物,滤液用乙酸乙酯稀释,用0.1NHCl和饱和食盐水洗涤,硫酸镁干燥后,减压蒸发得到BzlO-十八烷二酰基-Glu(Glu(OSu)-OBzl)-OBzl。BzlO-十八烷二酰基-Glu(Glu(OSu)-OBzl)-OBzl溶于甲醇/丙酮/0.1%TFA,加入Pd/C,在氮气环境下室温搅拌5小时,通过硅藻土过滤,从庚烷中沉淀并蒸发残余溶剂得到十八烷二酰基-Glu(Glu(OSu)-OH)-OH。计算分子量669.8,质谱测试分子量670.3。II-23合成用上述方法合成FVNQHLCGSHLVEALYLVCGERGFFYTPTGKGSSSAAAPQTGIVEQCCTSICSLYQLENYCN。计算分子量6704.6,质谱测试分子量6705.9。室温下将多肽(67mg,10μmol)溶于100mMNa2CO3(1ml,pH10)。十八烷二酰基-Glu(Glu(OSu)-OH)-OH溶于乙腈(0.5ml),加入多肽溶液。搅拌30分钟后用醋酸酸化,上RP-HPLCC5柱纯化。缓冲液A:0.1%TFA水溶液,10%乙腈缓冲液B:0.1%TFA水溶液,80%乙腈。分子量计算值7259.3,质谱测试分子量7260.2。经分析,所得化合物即II-23。聚乙二醇化修饰方法(PEGylation)a)还原烷基化(reductivealkylation)多肽,mPEG20K-CHO,氰基硼氢化钠(NaBH3CN)按1:2:45比例溶于pH4.3醋酸溶液(0.1MNaCl,0.2MCH3COOH,0.1MNa2CO3)。多肽浓度为0.5-1mg/mL。反应用HPLC检测和纯化。产率约55%。还原烷基化反应可以将聚乙二醇选择性地结合在B1位。Ⅱ-18的合成。使用上述自然化学连接方法合成FVNQHLCGSHLVEALYLVCGERGFFGSGSSSAAAPQTGIVEQCCTSICSLYQLENYCN,和mPEG20K-CHO还原烷基化反应得到产物。用质谱检测,该化合物分子量计算值26201.0,质谱测试得到一宽峰,中间分子量26206.3。少量化合物经DTT还原和胰蛋白酶降解后,用液相色谱-质谱联用观察到GFFGSGSSSAAAPQTGIVEQCCTSICSLYQLENYCN质量(计算分子量3737.2,质谱测试分子量3738.5),没有观察到FVNQHLCGSHLVEALYLVCGER质量(计算分子量2487.9),但质谱测试得到一宽峰,中间分子量22495.6,证明PEG结合位点是B1。经分析,合成的物质即是Ⅱ-18。b)NHS酯(N-羟基丁二酰亚胺)酰化多肽和mPEG20K-NHS按摩尔比2:1溶于0.1NN,N-双(2-羟乙基)甘氨酸溶液(pH10),多肽浓度0.5mg/mL。反应在室温进行1小时,用HPLC纯化。产率56%。Ⅱ-17合成:FVNQHLCGSHLVEALYLVCGERGFFYTPTGSGSSKAAAPQTGIVEQCCTSICSLYQLENYCN合成方法参照Ⅰ-2。多肽与mPEG20K-NHS按上述酰化方法反应后得到产物。用质谱检测,分子量计算值26704.6,质谱测试得到一宽峰,中间分子量26710.7。少量化合物经DTT还原和胰蛋白酶降解后,用液相色谱-质谱联用观察到FVNQHLCGSHLVEALYLVCGER(计算分子量2487.9,质谱测试分子量2489.0),GFFYTPTGSGSSK(Nε-PEG20K)AAAPQTGIVEQCCTSICSLYQLENYCN(计算分子量24240.8,质谱测试得到一宽峰,中间分子量24247.6),没有观察到分子量22487.9,证明PEG结合位点是C肽赖氨酸侧链。经分析,合成的物质即是Ⅱ-17。Ⅱ-4合成FVNQHLCGSHLVEALYLVCGERGFFYTPDTGSGSSSAAAPQTGIVEQCCTSICSLYQLENYCN使用以上自然化学连接方法合成。分子量计算值6778.6,质谱测试分子量6779.8。多肽(68mg)溶于DMF(3mL),加入Mal-dPEG12-NHS(8.7mg)(QuantaBiodesign)和三乙胺(30μL)。反应在室温下搅拌2小时。减压挥发溶剂后,粗品溶于H2O/ACN(3:1),用RP-HPLC纯化。马来酰亚胺多肽溶于纯净水,多肽浓度10mM。加入人白蛋白(665mg),在37℃培养30分钟。然后用含有5mM辛酸钠和750mM硫酸铵的20mM磷酸钠溶液稀释到5%人白蛋白。用凝胶过滤层析法除去未反应的试剂,0.05M碳酸氢铵水溶液作为洗脱液。真空冷冻干燥后得到纯品。经分析,分子量计算值74001.7,质谱测试分子量74003.8,所得的化合物即是Ⅱ-4。合成结果:按照上述方法分别合成各基于胰岛素的修饰的化合物,通过质谱检测各化合物的结构,结果如下:Ⅱ-1:分子量计算值6932.0,质谱测试分子量6933.8,经分析,合成的物质即是Ⅱ-1;Ⅱ-3:分子量计算值7102.1,质谱测试分子量7103.4,经分析,合成的物质即是Ⅱ-3;Ⅱ-5:分子量计算值7199.2,质谱测试分子量7200.9,经分析,合成的物质即是Ⅱ-5;Ⅱ-6:分子量计算值7118.1,质谱测试分子量7120.2,经分析,合成的物质即是Ⅱ-6;Ⅱ-7:分子量计算值7274.3,质谱测试分子量7275.5,经分析,合成的物质即是Ⅱ-7;Ⅱ-8:分子量计算值6655.6,质谱测试分子量6656.7,经分析,合成的物质即是Ⅱ-8;Ⅱ-9:分子量计算值6655.6,质谱测试分子量6657.3,经分析,合成的物质即是Ⅱ-9;Ⅱ-10:分子量计算值6639.6,质谱测试分子量6640.4,经分析,合成的物质即是Ⅱ-10;Ⅱ-11:分子量计算值6639.6,质谱测试分子量6741.1,经分析,合成的物质即是Ⅱ-11;Ⅱ-12:分子量计算值6639.6,质谱测试分子量6740.8,经分析,合成的物质即是Ⅱ-12;Ⅱ-13:分子量计算值6674.7,质谱测试分子量6676.0,经分析,合成的物质即是Ⅱ-13;Ⅱ-14:分子量计算值6731.7,质谱测试分子量6732.5,经分析,合成的物质即是Ⅱ-14;Ⅱ-15:分子量计算值6726.7,质谱测试分子量6728.2,经分析,合成的物质即是Ⅱ-15;Ⅱ-16:分子量计算值6598.5,质谱测试分子量6599.6,经分析,合成的物质即是Ⅱ-16;Ⅱ-19:分子量计算值7088.1,质谱测试分子量7089.7,经分析,合成的物质即是Ⅱ-19;Ⅱ-20:分子量计算值6960.0,质谱测试分子量6961.8,经分析,合成的物质即是Ⅱ-20;Ⅱ-21:分子量计算值7086.1,质谱测试分子量7086.9,经分析,合成的物质即是Ⅱ-21;Ⅱ-22:分子量计算值6944.0,质谱测试分子量6945.1,经分析,合成的物质即是Ⅱ-22。受体结合分析1、125I-IGF-1和125I-胰岛素的制备文献方法(Cresto等,“Preparationofbiologicallyactivemono-125I-insulinofhighspecificactivity”,ActaPhysiolLatAm.1981,31(1):13-24)2、化合物的受体结合分析文献方法(E.K.FrandsenandR.A.Bacchus.“New,simpleinsulin-receptorassaywithuniversalapplicationtosolubilizedinsulinreceptorsandreceptorsinbrokenandintactcells.”Diabetes,1987,36,3:335-340)或下述方法之一。如无特别说明,受体制备方法亦如文献方法,使用人胎盘膜。一般情况下,胰岛素受体结合实验使用0.025毫克胎盘膜;IGF-1受体结合实验使用0.2毫克胎盘膜。在胰岛素受体结合分析实验中,胰岛素标准和本发明化合物的起始浓度均为100nM,然后将胰岛素和本发明化合物系列3倍稀释,分别得到7个不同浓度的对照和化合物溶液(100nM、33.33nM、11.11nM、3.70nM、1.23nM、0.41nM、0.13nM、0.04nM)。对于本发明中其胰岛素受体的活性低于人胰岛素标准10%的化合物,化合物起始浓度为500nM。在IGF-1受体结合分析实验中,IGF-1标准的起始浓度为100nM,本发明化合物起始浓度为1000nM,然后将IGF-1与本发明化合物系列3倍稀释,分别得到7个不同浓度的对照和化合物溶液(1000nM、333.33nM、111.11nM、37.04nM、12.35nM、4.12nM、1.37nM、0.46nM)。对于本发明中其IGF-1受体的活性低于IGF-1标准1%的化合物,化合物起始浓度为5000nM。受体结合分析(1)截断的水溶性受体IGF-1或胰岛素受体,125I-IGF-1(3-10pM)或125I-胰岛素(3pM)和系列3倍稀释的多肽加入缓冲液[100mMHepes,pH8.0,100mMNaCl,10mMMgCl2,0.5%(w/v)BSA,0.025%(w/v)TritonX-100],总体积200μL,在4℃培养48小时。受体及与受体结合的多肽和配体用0.2%γ-球蛋白和500μL25%(w/v)PEG8000沉淀,测量沉淀中的放射性。受体的浓度要调节到在未添加多肽的时候有15-20%的受体与配体结合。膜结合受体受体结合分析使用的膜结合受体来自高度表达全长胰岛素或IGF-1受体的BHK细胞。等量的转染BHK细胞(2000-5000)均匀分布在96孔板的每一孔,在包含10%(v/v)胎牛血清的Dulbecco's改良的Eagle's培养基(DMEM)中培养24小时后再进行受体结合分析。细胞先用结合缓冲液(DMEM,含0.50%BSA,20mMHepes,pH7.8)洗一遍,加入400μL125I-IGF-1(6.5pM)或125I-胰岛素(6.5pM)和溶于结合缓冲液的系列3倍稀释的多肽。在16℃培养3小时,未结合的多肽用吸引器吸出,用1.2ml结合缓冲液洗一遍。细胞溶解于500μL1%(w/v)SDS,100mMNaCl,25mMHepes(pH7.8),然后测量。细胞数量要调整到未加多肽时有16-28%的受体与配体结合。受体结合分析(2)IGF-1受体:[Thr59]IGF-1用于酪氨酸碘化反应(iodination)。125I-IGF-1(50-80Ci/g,50fmol),人胎盘膜(0.2mg)和系列3倍稀释的多肽加入0.2毫升0.1MHepes缓冲液,pH8,包含120mM氯化钠、5mM氯化钾、0.12mM硫酸镁以及0.1%牛白蛋白,在20℃培养1小时。样品用WhatmanGF/F过滤器过滤以分离结合与未结合的多肽化合物。过滤器预先用0.1%聚乙烯亚胺处理。培养管和过滤器用2.5毫升不含牛白蛋白的冷缓冲液洗4遍。没有胎盘膜的情况下,少于5%的多肽化合物附着在过滤器上。在没有多肽竞争的条件下,胎盘膜结合大约38%的配体。对胎盘膜非特异结合可以通过添加过量的非碘化[Thr59]IGF-1(0.3μM)到培养混合物来测量。非特异结合通常占配体与胎盘膜结合总量的5%。胰岛素受体:125I-胰岛素(30nCi)、系列3倍稀释的多肽和胎盘膜(0.025mg)在0.05毫升上述缓冲液中,20℃培养1小时。样品用EHWP过滤器过滤,培养管和过滤器用2.5毫升不含牛白蛋白的冷缓冲液洗4遍。没有胎盘膜的情况下,少于5%的多肽化合物附着在过滤器上。对胎盘膜非特异结合可以通过添加过量的非碘化胰岛素(1μM)到培养混合物来测量。非特异结合通常占配体与胎盘膜结合总量的1%以下。特异结合百分比=(结合放射量-非特异结合放射量/全部结合放射量-非特异结合放射量)x100。全部结合放射量是未添加多肽时测得的放射总量。结合放射量是添加多肽后测得的放射量。多肽化合物的IC50使用Origin软件(OriginLab,Northampton,MA)计算。多肽相对于人胰岛素或IGF-1标准的活性=IC50胰岛素或IGF-1标准/IC50多肽。3、动物实验7-9周龄C57BL/6雄性小鼠,平均体重20-25g,6只分为一组,在实验开始前4小时禁食。实验开始前测量血糖,并在以后各个指定时间点取样测量血糖。对照组是生理盐水,多肽溶解在生理盐水中,皮下注射。观察小鼠在实验全过程的反应,记录任何异常行为。实验结果:通过对本发明的基于胰岛素的化合物与胰岛素受体的结合力进行实验来检测这些化合物的生物活性,使用天然胰岛素作为胰岛素受体结合力的基准(100%)和天然IGF-1作为IGF-1受体结合力的基准(100%)。得到的结果分别见表2和表3。以胰岛素A和B链及连接片段组成的基于胰岛素的单链化合物,与胰岛素受体的结合力接近胰岛素的水平,但由于IGF-1C肽是与IGF-1受体结合的关键序列,也导致单链多肽在IGF-1受体上的结合力远高于天然胰岛素。C2Tyr在IGF-1晶体结构中是非常突出的一个氨基酸残基,显示可能是与IGF-1受体结合的关键。酪氨酸被丝氨酸或丙氨酸取代后,胰岛素受体活性基本保留,但大幅度降低了IGF-1受体活性,达到预期的效果。另外,结果显示,C肽的长度不一定需要12个氨基酸残基。原IGF-1C末端的3、4、5、6个氨基酸残基都是可以缺失或被替换的。尤其是IGF-1C末端去除3个氨基酸残基PQT和4个残基APQT不但对胰岛素受体的活性没有负面影响,而且使其IGF-1受体活性降低到胰岛素的水平。进一步的研究发现,在保留C肽的长度是12个氨基酸残基的情况下,胰岛素B链C末端的5个氨基酸残基X111X112X113X114X115可以有1个、2个、3个、4个或全部缺失,而不会降低胰岛素受体结合力。进一步研究表明,IGF-1C肽仅仅是很多种连接片段中的一个选择。这些数据说明,适当的C链长度、灵活的C链空间构象和特定位点的氨基酸取代是提高胰岛素受体活性,降低IGF-1受体结合力的重要因素。表2:未经修饰的基于胰岛素的单链化合物的生物活性结果其中,IR表示胰岛素受体,IGF-1R表示IGF-1受体。聚乙二醇化和脂肪酸酰化是延长多肽体内作用时间的常用方法,但聚乙二醇化和脂肪酸酰化一般大幅度降低生物活性。因此寻找人胰岛素B29之外新的能够引入赖氨酸等具有氨基的酰化位点,而酰化产物具有足够的生物活性对于开发长效多肽具有重要意义。实验证明,B1、单链化合物的连接片段、A22修饰后都保留了相当的胰岛素受体活性。由于在受体结合实验中要使用牛白蛋白以减少蛋白非特异性结合,但酰化多肽上的脂肪酸能够与白蛋白结合(这也是脂肪酸延长作用时间的机理),从而降低了实验中多肽有效浓度,因此酰化多肽的受体结合数据显得较低。过去30年的大量动物实验表明,胰岛素类似物的体外活性与体内活性没有明确的对应关系。体外活性显著低于人胰岛素的类似物在体内与人胰岛素的活性基本相当(参照Volund等“Invitroandinvivopotencyofinsulinanalogsdesignedforclinicaluse”,DiabeticMedicine,1991,8:839-47;Ribel等“Equivalentinvivobiologicalactivityofinsulinanalogsandhumaninsulindespitedifferentinvitropotencies”,Diabetes,39,1033-39,1990)。发明人的动物实验数据也表明聚乙二醇化和脂肪酸酰化多肽的体内实际活性要优于胰岛素对照。表3:修饰的基于胰岛素的单链化合物的生物活性化合物IR(%)化合物IR(%)化合物IR(%)化合物IR(%)胰岛素100.0Ⅱ-716.3Ⅱ-1310.8Ⅱ-196.9Ⅱ-112.4Ⅱ-810.4Ⅱ-149.3Ⅱ-2012.0Ⅱ-210.3Ⅱ-913.9Ⅱ-1526.5Ⅱ-2113.5Ⅱ-313.6Ⅱ-107.5Ⅱ-1630.4Ⅱ-2211.8Ⅱ-45.7Ⅱ-1111.6Ⅱ-1712.3Ⅱ-2310.6Ⅱ-514.2Ⅱ-1212.7Ⅱ-1816.7Ⅱ-248.2Ⅱ-615.8其中,IR是胰岛素受体。实验结果中还给出了本发明的胰岛素类似物的延时效果。以人胰岛素、化合物Ⅱ-2和阴性对照分别做实验,胰岛素和Ⅱ-2的用量分别为70nmol/kg。监控小鼠的血糖浓度,结果见图1。Ⅱ-2在给药后的5-10小时内依然具有明显的抑制血糖效果,但胰岛素在这个时间内已经渐渐失去抑制血糖能力。人胰岛素在实验中表现出典型的V字型降血糖曲线。这种降血糖曲线的缺点在于初期血糖下降过快,容易造成低血糖,而后期又无法控制血糖。Ⅱ-2显示出L型降血糖曲线,血糖控制平稳而且持久,效果显著优于人胰岛素。在另外一个实验中,小鼠皮下注射3种剂量的Ⅱ-17后监控血糖浓度变化,结果见图2。Ⅱ-17剂量低至25nmol/kg就足以平稳控制血糖至少24小时。而当剂量加大到90nmol/kg后,小鼠也没有出现血糖低谷。因此,Ⅱ-17在控制血糖和安全性方面都优于人胰岛素。在另外一个实验中,小鼠皮下注射生理盐水、人胰岛素和Ⅱ-11后检测血糖随时间变化值,结果见图3。与图1类似,人胰岛素表现出典型的V字型降血糖曲线,而Ⅱ-11显示出L型降血糖曲线,平稳控制血糖至少24小时,效果显著优于人胰岛素。以上三个实验证明,以聚乙二醇或脂肪酸修饰本发明中的胰岛素类似物,能够改善胰岛素类似物的治疗效果和药物动力学特征。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1