用于靶向癌症和产生抗体的抗神经节苷脂化合物的制作方法
本申请说明书涉及作为抗肿瘤疫苗的神经节苷脂糖缀合物和其用途。
背景技术:
神经节苷脂是含神经氨酸的鞘糖脂,其在质膜的外部小叶中积聚。神经节苷脂,如GD2和GD3是普遍的肿瘤标记物。它们在成神经细胞瘤、黑素瘤、小细胞肺癌和神经胶质瘤(Hakomori,1996,Cancer Research,56:5309)以及乳腺癌干细胞(Battula et al.,2012,The Journal of clinical investigations,122:2066)中表达,但它们在正常细胞中不存在。因此,GD2和GD3已经被开发为肿瘤靶点,并且它们是有效的临床靶点。局部治疗可通过被动施用纯化的抗GD2(Cheun et al.,1987,J Clin Oncol,5:1430)或者抗GD3单克隆抗体(mAbs)(Houghton et al.,1985,Proc Natl Acad Sci USA,82:1242)来实现。然而,被动免疫具有高的财务成本、显著的副作用、有限的干预频率和低的治疗效果(Navid et al.,2010,Current Cancer Drug Targets,10:200)。
作为替代,许多团体追求主动免疫疗法神经节苷脂(Astronomo and Burton,2010,Nat Rev Drug Discov,9:308)。然而,与神经节苷脂相关的严重困难包括免疫原性差、溶解性差和制剂差、有限使用和制备充分表征和同源的免疫原的困难、和具有结构高度相关的非肿瘤神经节苷脂交叉反应性风险的选择性差的可能性。
例如,化学缀合到钥孔戚血蓝素(KLH)的GD2内酯是免疫原性的,并且可以诱导延迟小鼠肿瘤生长的抗体(Chapman et al.,2000,Clinical Cancer Research,6:4658)。由这种疫苗诱导的抗体通过补体依赖性细胞毒性(CDC)机制起作用(Kim et al.,2011,Cancer Immunology,Immunotherapy,60:621)。然而,KLH-神经节苷脂缀合产生化学异质产品(Danieshefsky and Allen,2000,Angew Chem Int Ed,39:836),这是一个严重的缺点。其它神经节苷脂缀合物已显示免疫原性差,并且通常引起低和短暂的抗神经节苷脂抗体应答(Ragupathi et al.,2000,International Journal of Cancer,85:659)。即使是最具免疫原性的神经节苷脂,GM2-KLH疫苗也没有提供临床益处(Kirkwood et al.,2001,Journal of Clinical Oncology,19:2370),并且被中断。另外的实验方法包括GD2-肽模拟表位(Wondimu et al.,2008,Cancer Immunology,Immunotherapy,57:1079)、GD2-模仿肽(Bolesta et al.,2005,Cancer Research,65:3410)、和GD2模拟表位DNA疫苗(Zeytin et al.,2000,Cancer Gene Therapy,7:1426),其可诱导对GD2的交叉反应性免疫。然而,在肿瘤治疗范例中免疫应答没有很有效地保护宿主(Bleeke et al.,2009,European Journal of Cancer,45:2915)。
因此,仍然需要提供利用神经节苷脂作为靶点的新治疗方法。
技术实现要素:
根据一个方面,提供了下式的神经节苷脂碳水化合物:G-芳基-NH2,其中G是含有一个或多个唾液酸(例如n-乙酰神经氨酸)的寡糖,其中所述G通过C1异头氧原子共价结合到芳基,并且G为免疫原性的,并且芳基是C6至C10芳基,任选地被取代。
本文所提供的神经节苷脂碳水化合物针对肿瘤具有免疫原性。更具体地,它提供了针对肿瘤具有免疫原性的神经节苷脂碳水化合物,用于预防或治疗癌症。
根据本说明书,还提供神经节苷脂碳水化合物多聚体,其包含共价结合到多聚体核心分子的如本文所述的至少一种或至少两种碳水化合物神经节苷脂类似物或神经节苷脂碳水化合物。
提供了特异性结合到如本文所限定的神经节苷脂碳水化合物或神经节苷脂碳水化合物多聚体的抗体。
还提供了包含如本文所限定的神经节苷脂碳水化合物或神经节苷脂碳水化合物多聚体的疫苗。
还提供了如本文所限定的神经节苷脂碳水化合物或神经节苷脂碳水化合物多聚体的用途,用于预防或治疗癌症。
还提供了如本文所限定的神经节苷脂碳水化合物或神经节苷脂碳水化合物多聚体在制备用于预防或治疗癌症的药物中的用途。
还提供了在对其有需要的患者中预防或治疗癌症的方法,其包括对所述患者施用有效量的如本文所限定的神经节苷脂碳水化合物或神经节苷脂碳水化合物多聚体的步骤。
还提供了在对其有需要的患者中引发免疫原性应答的方法,其包括对所述患者施用有效量的如本文所限定的神经节苷脂碳水化合物或神经节苷脂碳水化合物多聚体的步骤。
还提供了包含有效量的如本文所限定的神经节苷脂碳水化合物多聚体和药学上适用的载体或赋形剂的药物组合物。
附图说明
现在将参考附图,其中:
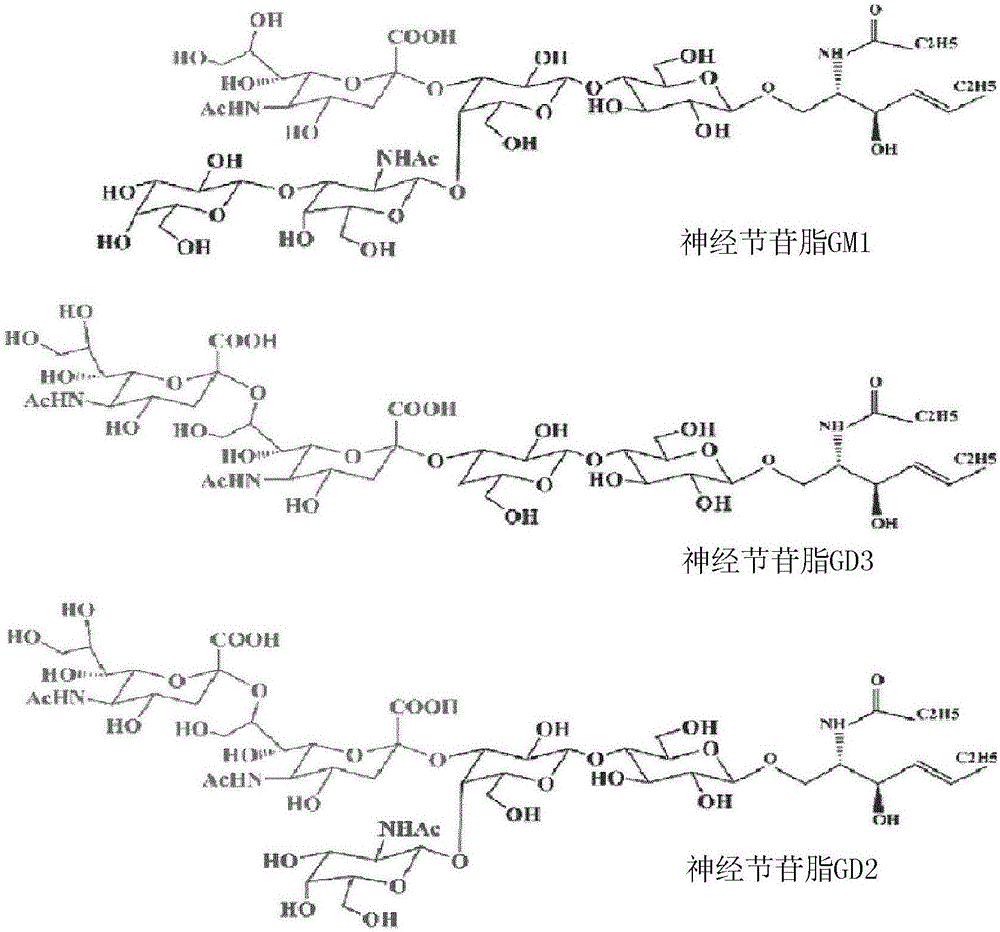
图1A显示神经节苷脂GM1、GD3和GD2的结构;图1B显示如本文所公开的GD2和GD3类似物合成的示意图;图1C显示如本文所公开的抗原合成的示意图;
图2A显示GD2的氨基苯基醚类似物(AP-GD2)的质谱;图2B显示重水中的GD2的氨基苯基醚类似物(AP-GD2)的H-NMR谱;图2C显示重水中的四-GD2树状大分子的H-NMR谱;
图3A显示表明IgG类的抗GD2反应性抗体存在的代表性FACScan数据;图3B显示使用抗-小鼠IgG第二试剂研究的测试或对照血清的连续稀释;图3C显示表明每轮免疫后IgG和IgM同种型增加的血清分型;图3D显示在用指定抗体培养的完全培养基中指数增长的EL4-GD2+细胞和24小时后MTT量化的它们的存活/代谢;
图4A显示由3H-胸苷掺入试验评估的T细胞增殖,其中与从接种的或从初次接受试验的小鼠纯化的T细胞以1:10的比例培养肿瘤细胞;图4B显示用台盼蓝排除(Trypan Blue exclusion)测量的GD2依赖性T细胞增殖;
图5A显示腹腔内接种的小鼠的测量的肿瘤体积;图5B显示针对免疫的与对照的小鼠测量的平均肿瘤体积;图5C显示利用四-GD2在腹腔内接种的小鼠中测量的肿瘤体积;图5D显示免疫的与对照的小鼠平均肿瘤体积;图5E显示过继转移的治疗效果;图5F显示淋巴结转移的定量;
图6显示来自2组初次接受试验的荷瘤小鼠(对照或接种的)的纯化的T细胞,和通过FACScan定量的细胞的CD4/CD8分布图;
图7是显示IgG亚类的抗GD3反应性抗体的血清的代表性ELISA数据;
图8和9表示用四-GD3接种的结果;和
图10显示在使用GD3疫苗接种后转移结节的计数。
具体实施方式
本公开内容涉及由以下组成的神经节苷脂碳水化合物:
本公开内容具体提供由以下组成的神经节苷脂碳水化合物:
如本文所用,G指的是仅包含对应于各自神经节苷脂的寡糖和唾液酸(例如,n-乙酰神经氨酸,NANA)的各自神经节苷脂(如GD2、GD3、GM2和GT1b)的部分。换言之,G指的是相应的神经节苷脂的寡糖和唾液酸,不包括在本文被氨基-芳基残基(如氨基-苯基)取代的神经节苷脂的神经酰胺部分。本文所用的G的实例包括GD3和GD2的残基,诸如
如本文所用的术语“芳基”,被理解为6至10元的芳族基团,例如苯基或萘基,优选苯基。芳族环可在一个或多个环位置处,优选在不存在取代基处,被取代,并且氨基优选相对于糖部分在苯基的对位。优选地,因此“-芳基-NH2”是4-氨基苯基。
关于芳基的术语“任选地取代”指用烷基、芳基、或卤素中的一种或多种在任何可用的位置或多个位置任选地取代。优选地,没有取代基。
本公开内容提供了包含共价结合到多聚体核心分子的至少一种或至少两种碳水化合物神经节苷脂类似物的神经节苷脂碳水化合物多聚体。
在一个实施方式中,碳水化合物神经节苷脂类似物是GD2、GD3、GM2和GT1b中的至少一种的类似物。
在一个实施方式中,碳水化合物神经节苷脂类似物或神经节苷脂碳水化合物多聚体包含至少一种GD2碳水化合物神经节苷脂类似物、或至少一种GD3碳水化合物神经节苷脂类似物。
在一个实施方式中,碳水化合物神经节苷脂类似物或神经节苷脂碳水化合物多聚体是碳水化合物神经节苷脂类似物的四聚体。在一个实施方式中,碳水化合物神经节苷脂类似物或神经节苷脂碳水化合物多聚体可用于预防或治疗癌症。在一个实施方式中,碳水化合物神经节苷脂类似物或神经节苷脂碳水化合物多聚体可用于治疗癌症。在一个实施方式中,癌症是神经节苷脂阳性癌症。在另一个实施方式中,癌症是成神经细胞瘤、黑素瘤、或神经胶质瘤。在一个实施方式中,癌症是乳腺癌或小细胞肺癌。
在一个实施方式中,提供特异性结合如本文限定的碳水化合物神经节苷脂类似物或神经节苷脂碳水化合物多聚体的抗体。在一个实施方式中,抗体是单克隆抗体、多克隆抗体或人源化抗体。在一个实施方式中,抗体用于预防或治疗癌症。在一个实施方式中,癌症是神经节苷脂阳性癌症。在一个实施方式中,癌症是成神经细胞瘤、黑素瘤、或神经胶质瘤。在一个实施方式中,癌症是乳腺癌或小细胞肺癌。在一个实施方式中,癌症是乳腺癌或小细胞肺癌。
在一个实施方式中,提供了包含如本文限定的碳水化合物神经节苷脂类似物或神经节苷脂碳水化合物多聚体和载体的疫苗。在一个实施方式中,疫苗用于预防或治疗癌症。在一个实施方式中,癌症是神经节苷脂阳性癌症。在一个实施方式中,癌症是成神经细胞瘤、黑素瘤、或神经胶质瘤。在一个实施方式中,癌症是乳腺癌或小细胞肺癌。
在一个实施方式中,用于本文限定的方法或用途的碳水化合物神经节苷脂类似物或神经节苷脂碳水化合物多聚体被配制用于注射。在一个实施方式中,疫苗被配制用于经皮给药或肠胃外给药。在一个实施方式中,肠胃外给药是肌肉内给药、皮下给药或静脉内给药。
在一个具体的实施方式中,免疫原性的GD2糖缀合物在此公开,其被用作抗肿瘤疫苗。
本文公开了缀合以形成树状大分子(例如四聚体,以下称为“四-GD2”或“四-GD3”)的GD2和GD3碳水化合物的水溶性类似物的设计和特性。
例如,四聚体神经节苷脂碳水化合物保存天然存在的GD2或GD3的天然结构特征,但具有免疫原性并且引起体内细胞毒性抗神经节苷脂体液和细胞应答。例如,四-GD2在预防和治疗范例中作为GD2癌症疫苗是有效的。提供了有效的抗肿瘤疫苗,靶向细胞表面碳水化合物,其迅速引起在治疗范例中具有保护性的体液和细胞免疫应答。
神经节苷脂积聚在细胞膜的外部小叶,神经酰胺和脂质是嵌入的并且碳水化合物头部是暴露的。这应该能被免疫系统识别,因为复杂的神经节苷脂是新抗原并被限定为肿瘤标记物。此外,甚至抗原神经节苷脂也是差的免疫原。免疫系统可将碳水化合物识别为“自身”而不做出应答或者它可产生交叉反应性的病理反应(例如格-巴二氏综合征是由于抗GM1抗体)。
产生具有免疫原性并且可用于产生针对肿瘤的选择性免疫的GD2和GD3的合成的碳水化合物类似物。
据信,G的类似物(如GD2、GD3、GM2和GT1b中的至少一种的类似物)可以是多聚体、即二聚体、三聚体、四聚体或适于允许适当的空间定位的任何其它形式。
据信,尤其GD2和GD3的类似物可以是多聚体,即二聚体、三聚体、四聚体或适于允许GD2或GD3的适当空间定位的任何其它形式。本文包括如本文所述的碳水化合物神经节苷脂类似物的2、3、4、5、6、7、8、9、10、11、12、13、14、15或16多聚体。
以下示意图1显示处于四聚体形式的GD2和GD3免疫原性的合成碳水化合物类似物。
类似物基本上包括一个中心多聚体(或如上所示的四聚体)核心,其允许共价结合到间隔基(spacer),间隔基反过来也共价结合到所需的GD2或GD3。该间隔基的典型例子是-(C=X)-,其中X是N或X(如-(C=S)-或-(C=O)-)。间隔基可通过使用异氰酸酯或异硫氰酸酯化学作用来引入。图1c显示具体的例子,但是该化学作用将适用于以上公开的GD2/GD3氨基芳基化合物。
优选地,中央核心包括乙二胺残基,通常如示意图2中所述,其上连接许多末端(即,伯)氨基。
该核心的实例可以是PAMAM化合物,其中许多是商业上可获得的(参见www.sigmaaldrich.com上的Aldrich Catalog)。优选地,中央多聚体核心具有许多末端(即,伯)氨基。PAMAM化合物的实例包括0.0代PAMAM。
PAMAM化合物的较高代包括PAMAM,其上的末端-NH2进一步(部分或完全)由残基官能化:
这样的较高代PAMAM的部分表示如下:
其中剩余的“臂”(显示波浪线)也可任选地具有酰氨基胺(amido amine)的残基,以提供多达8个可进一步扩展的多聚体。
当中央核心是以上列出的0.0代时,四聚体中G(如GD2和GD3)的免疫原性的合成的碳水化合物类似物的实例可通过以下说明:
其中G是以上所限定的,或优选地
X是O或S,优选地X是S。
如Gilbert et al.,2002,J Bio Chem,277:327所述,可合成GD2或GD3衍生物,同时改变Tong et al.,2010,Chem Bio,17:183的方法以使用具有可用于将GD2或GD3共价结合到中央多聚体核心的氨基的适当官能化的β-D-乳糖吡喃糖苷。例如,官能化的β-D-乳糖吡喃糖苷可以是C1-β-D-乳糖吡喃糖苷氨基芳基衍生物,或优选氨基苯基-β-D-乳糖吡喃糖苷或更优选p-氨基苯基-β-D-乳糖吡喃糖苷。
官能化的β-D-乳糖吡喃糖苷可进一步衍生,以便中央多聚体(或如上所示的四聚体)核心可共价结合。官能化β-D-乳糖吡喃糖苷可与合适的试剂反应,以提供活化的羰基残基。例如,C1-氨基芳基衍生物、或优选氨基苯基-β-D-乳糖吡喃糖苷或更优选p-氨基苯基-β-D-乳糖吡喃糖苷可以与光气、双光气、三光气、硫光气、羰基二咪唑、二琥珀酰亚胺基碳酸酯、或其它合适的试剂反应以提供相应的异氰酸基、异硫氰酸基、羰基咪唑基或琥珀酰亚胺基羰基衍生物。
中央多聚体核心然后可与具有上述活化的羰基残基的官能化β-D-乳糖吡喃糖苷反应以提供所需的免疫原性分子。
作为替代的合成方法,中央多聚体核心(如PAMAM)可首先与合适的试剂反应,以提供如上所述活化的羰基残基。然后可添加含有氨基的官能化的β-D-乳糖吡喃糖苷,以提供所需的免疫原性分子。
如果进一步的另外的治疗剂是需要的或期望的,那么比率将容易被调节,这对于普通技术人员来说将是清楚的。应当理解的是,本文所述的组合的范围没有被具体地限制,但原则上包括用于预防和治疗癌症的任何治疗剂。
将可以理解的是,用于治疗所需要的本发明的化合物的量将不仅随着所选择的特定化合物变化,而且随着给药途径、需要治疗的状况的性质和患者的年龄和状况变化,并且最终将由主治医生决定。
所需的剂量可以方便地呈现为单一剂量或作为分次剂量以适当的间隔施用,例如每天二、三、四或更多次剂量。
药物组合物包括但不限于那些适合于经皮、或肠胃外(包括肌内、皮下和静脉内)给药的组合物。
用于制备药物组合物的方法可包括将本文所限定的化合物和药学上可接受的赋形剂相结合的步骤。
如本文所限定的化合物和组合也可配制用于肠胃外给药(例如通过注射,例如推注(bolus injection)或连续输注)并且可以安瓿、预填充注射器、小体积输注或具有添加的防腐剂的多剂量容器中的单位剂量形式呈现。组合物可采取如悬浮液、溶液或油性或水性载体中的乳液的形式,并且可含有配制剂如悬浮剂、稳定剂和/或分散剂。可选地,活性成分可以是,通过无菌固体的无菌分离或通过从溶液冻干而获得的粉末形式,以用于在使用前利用合适的载体,例如无菌水或盐水来构成(constitution)。
具体实施方式如下所述,之后描述实施例。
公开了氨基苯基醚-GD2类似物(本文中的AP-GD2),它具有正确的GD2碳水化合物结构,但是氨基苯基取代神经酰胺和脂质(参照图1B)。该类似物是水溶性的。在AP-GD2中,苯基和第一糖之间的键优选处于β构型,β构型是天然神经节苷脂中神经酰胺和第一糖之间的构型。该键对于显示遍及整个碳水化合物的适当和同类的结构是至关重要的。预期质量和构型通过质谱法(图2A)和NMR光谱学(图2B)分别验证。
将AP-GD2转化成其相应的异硫氰酸苯基类似物,并且将该中间体偶联至四价PAMAM G0连接体树状核心的末端游离胺(图1C)。AP-GD2和PAMAM G0连接体之间的硫脲桥的形成通过出现在HMBC(NHC(S)NHPh)谱中在178ppm处的碳化学位移验证。四聚体产物的形成通过1D-1H-NMR验证。1D-1H-NMR谱显示所有糖单元的单一信号模式,并指出酰胺NHs、NHC(S)NHPh、H-邻、H-间、NHAc/CH3/Hax或Heq的40:36:8的比率,表明GD2树状大分子确实是四价的(图2C)。
设计四-GD2抗原以用作肿瘤治疗研究中的免疫原。作为潜在免疫原的四-GD2的设计的基本原理基于以下概念。首先,四-GD2的呈现可能会更接近地模拟膜筏(membrane rafts)中正常聚集的GD2的寡聚展示。其次,糖AP-GD2类似物可容易地在温和条件下在室温下缀合至PAMAM连接体。第三,化学-酶法合成保证糖苷键的合适的构型,从而保持整个碳水化合物的构象。第四,抗原将是同质的并且被充分化学表征。第五,所得到的产物将是水溶性的和稳定的。所有这些特征是疫苗所需的,并且可转变成在此公开的AP-GD3。
利用四-GD2对小鼠进行免疫多达四次。每次免疫四天后收集血清,并针对抗神经节苷脂抗体的存在测试样品。在25只小鼠中的22只(88%)中利用四-GD2进行的免疫产生针对肿瘤标记物GD2和GD3神经节苷脂的高滴度和选择性抗血清。
FACScan测试的数据表明,免疫的小鼠血清具有与肿瘤细胞中细胞表面GD2和GD3选择性反应的抗体(参见图3A和表1)。其血清含有IgG和IgM同种型抗体(基于所使用的同种型特异的第二试剂)。血清结合EL4-GD2+和/或EL4-GD3+细胞。阴性对照正常小鼠血清预免疫(NMS)无反应性。阳性对照mAbs显示EL4-GD2+细胞表达GD2而不是GD3,并且EL4-GD3+细胞表达GD3而不是GD2。在细胞对照中,血清并不结合不表达GD2或GD3但表达许多其它神经节苷脂如GM1的Jurkat细胞。
表1
用GD2四聚体免疫的小鼠血清的抗神经节苷脂反应性
针对与固定化神经节苷脂的直接结合,血清还通过ELISA进行测试。将神经节苷脂GD2、GD3、或对照固定在板上,并且测试试验和对照免疫前血清的指示的稀释液。通过选择性结合GD2的疫苗接种产生抗体(参照图3B)。一次免疫足以引起循环抗GD2IgG的增加,比背景多约2倍,并在增强之后存在高于背景的约3倍的增加(图3C)。抗体也结合GD3,但不结合GM1。检测抗GD2IgG和抗GD2IgM同种型。每次增强后IgG同种型增加,提示B细胞成熟和类型转换(图3C)。这些ELISA数据与通过FACScan获得的结果一致。
利用四-GD2接种的小鼠的抗体杀死培养物中的EL4-GD2+细胞(图3D)。在补体不存在的情况下EL4-GD2+细胞被免疫血清杀死——已经报道的一些抗GD2mAbs的效果(Yoshida et al.,2001,Cancer Research,61:4244)(例如,mAb 3F8杀死细胞,但mAb ME361没有)。此外,EL4-GD2+细胞的杀伤通过对活体染料台盼蓝染色的细胞计数和评估其形态学来证实。
总之,这些数据证实作为免疫原的四-GD2产生细胞毒性体液免疫力并使其成熟。
已经证明,糖肽疫苗可通过结合组织相容性II类(MHC II)激活适应性免疫系统(Avci et al.,2011,Nature Medicine,17:1602)。这提示,T细胞介导的免疫还可被四-GD2激活。因此,对测量3H-胸苷掺入的混合淋巴细胞反应(MLR)中的原代T细胞进行试验。作为T细胞活化的靶细胞刺激物,使用丝裂霉素(mytomicin)处理过的EL4-GD2+,并且Jurkat细胞(GD2-)被用作阴性对照(图4A)。丝裂霉素处理过的EL4-GD2+或Jurkat细胞没有掺入3H胸苷(分别为188±4cpm和107±5cpm),因此它们只充当刺激物。
用四-GD2接种两次的小鼠的T细胞在用EL4-GD2+细胞攻击时强大地增殖,但在用Jurkat细胞攻击时,它们没有增殖。在细胞对照中,来自未接种小鼠的T细胞在用EL4-GD2+或Jurkat细胞攻击时没有增殖。在阳性对照中,ConA处理在类似程度上刺激了对照或接种的小鼠的T细胞的增殖(分别为21,457±504cpm和19,834±309cpm)。类似的数据通过台盼蓝排除法对各组中增殖T细胞的数目进行计数的相关测试获得(图4B)。在这些试验中,四-GD2接种的小鼠的40,000个应答T细胞用作为刺激物的活细胞Jurkat或EL4接种。7天的体外培养之后,所有的EL4靶细胞死亡,而Jurkat细胞存活并繁殖。
总之,这些数据证实作为免疫原的四-GD2产生细胞免疫力。
在肿瘤预防的范例中,免疫活性的C57/BI6小鼠间隔一周腹膜内免疫两次,随后皮下植入同源的EL4-GD2+细胞,其是非常攻击性和高度转移性的。EL4细胞是同源的,并且在这些小鼠中生长和转移非常快速。在测量的所有天(肿瘤移植后11、14、16),免疫的小鼠(5≤n≤9)具有比对照小鼠显著较小尺寸的原发肿瘤(图5A)。肿瘤预防的疫苗实验独立重现三次(总n=22免疫的与n=22对照小鼠)。为了比较所有三个独立的实验,在第16天每个实验的对照小鼠的平均肿瘤体积被标准化为100%。使用此标准,免疫小鼠中的总肿瘤体积降低约57%(图5B)。
在肿瘤治疗的范例中,首先用EL4-GD2+细胞植入小鼠,并且当肿瘤是可见/可触及时,小鼠用四-GD2或对照载体免疫两次。在这个更临床相关的范例中,在测量的所有天,免疫的小鼠(4≤n≤6)与对照小鼠相比已显著延迟原发肿瘤生长(图5C)。18天后,所有的对照小鼠发展了平均约6,000mm3的原发肿瘤,和广泛的淋巴结转移。相比之下,免疫的小鼠具有约2,300mm3的原发肿瘤。
肿瘤治疗的疫苗数据在两个独立的实验(N=13免疫的与n=18对照小鼠)中再现。为了比较所有实验,在第18天每个实验的对照小鼠的平均肿瘤体积被标准化为100%。使用此标准,免疫小鼠中的总肿瘤体积降低约51%(图5D)。
具有皮下肿瘤的小鼠通过腹腔注射接收纯化自四-GD2免疫的供体小鼠的4×106T细胞。在测量的所有天,过继转移的小鼠(n=6)相比对照未处理小鼠(n=6)已显著延迟原发肿瘤生长(图5E)。肿瘤生长14天后,对照组发展了平均约1,200mm3的原发肿瘤。相比之下,过继转移组具有约500mm3的原发肿瘤。
值得注意的是,过继转移组没有转移至淋巴结或胸腺的证据,淋巴结或胸腺是观察EL4肿瘤转移的主要位点的器官。EL4肿瘤转移引起组织扩大,和可量化的重量的相应增加。荷瘤小鼠(n=6)比不带肿瘤的初次接受试验的小鼠具有更大的淋巴结,其尺寸增加约10倍。荷瘤但接受T细胞过继转移的小鼠(n=6)具有较小的淋巴结,其可比得上正常淋巴结(图5F)。
接种后激活的T细胞关于其CD4和CD8表型被进一步表征。T细胞分离自荷瘤接种的小鼠或对照小鼠,并且将细胞在具有固定在塑料上的GD2的平皿中培养。接种小鼠的T细胞在GD2包被的平皿中强大增殖。相比之下,对照小鼠的T细胞没有在GD2包被的平皿上增殖。虽然所有的小鼠都带有肿瘤并且暴露于GD2,但是仅接种小鼠可以对这种抗原作出应答。表征培养物的FACScan试验显示,增殖细胞的表型主要是CD8+。由于CD8亚群的扩增,这些细胞中的CD4/CD8比率改变,然而对照小鼠的T细胞保持正常CD4/CD8比率(图6)。
这些数据表明,接种后激活的T细胞可在缺少抗原呈递细胞的情况下对固定化(多价)抗原进行应答。
肿瘤浸润淋巴细胞的存在通过免疫染色从原发肿瘤制备的冷冻切片来验证。EL4肿瘤是“双阴性”T细胞,并且不与抗CD4或抗CD8抗体染色。相比没有接受过继转移的荷瘤小鼠,在接受免疫小鼠的T细胞的过继转移的小鼠中,原发肿瘤中存在明显较高数量的浸润的CD8+细胞。抗CD4抗体在两个组中检测到浸润CD4+细胞。
总之,该数据显示疫苗接种足以处理真实治疗范例——其中在肿瘤形成后给予疫苗——中的原发肿瘤生长和肿瘤转移。
一种新的四价GD2碳水化合物树状大分子已发展为有效的碳水化合物免疫原和治疗性癌症疫苗。合成免疫原的生物物理表征显示它是同质的四聚体,其维持所需的β-键。寡聚碳水化合物结构对免疫系统的呈现可通过模拟肿瘤膜中的筏式GD2刺激更真正的和细胞毒性抗肿瘤应答。体内和体外生物学研究显示疫苗诱导抗GD2细胞毒性抗体和细胞毒性细胞免疫。由疫苗引起的免疫可延缓已形成的肿瘤生长和转移。本文公开的体内研究证实,神经节苷脂疫苗不仅可以阻止肿瘤的生长,还可抑制已形成的肿瘤生长。
从针对本文所描述的四价GD2碳水化合物树状大分子所生成的数据,靶向碳水化合物的其它癌症疫苗的发展,和适于其它肿瘤相关的神经节苷脂如GD3涵盖在本文。从氨基苯基醚-GD3类似物制备的四聚体GD3碳水化合物在本文公开(参见图1B),与保存天然存在的GD3天然结构特征的AP-GD2类似,其可预测地具有免疫原性并且会引起体内细胞毒性抗神经节苷脂体液和细胞应答。
利用与AP-GD2所述的相同的合成策略,产生GD3树状大分子(四-GD3)类似物并且两轮免疫后,检测到抗GD3抗体的高滴度。从图7可看出,检测到通过接种四-GD3引发的体液免疫。
新的GD3疫苗被评价为体内抗癌剂并且确定在测量的所有天,免疫小鼠具有比对照小鼠明显较小尺寸的原发肿瘤(图8),并且转移实际上不存在于淋巴结(图9)和肺(图10)。GD3疫苗减少黑素瘤肺转移(图10)。因此,新的四价GD3碳水化合物树状大分子已发展为有效的碳水化合物免疫原和治疗性癌症疫苗。
通过参照以下实施例,本公开内容将被更容易地理解,所给出的实施例用于阐述实施方式而不是限制其范围。
实施例I
合成AP-GD2和四-GD2树状大分子
碳水化合物如以下所述(Gilbert et al.,2002,J Biol Chem,277:327)通过改变苯硫基GD2的方法(Tong et al.,2010,Chem Biol,17:183)来合成,其中最初报导的苯硫基类似物由p-氨基苯基-β-D-乳糖吡喃糖苷(AP-Lac)(Toronto Research Chemcals)取代,用于随后缀合树状大分子(见下文)。AP-GD2是水溶性的(>20mg/ml),并通过尺寸排阻(Superdex 30 16mm×85cm柱,GE Health Care)纯化至>99%纯度。AP-GD2的测量分子量为1218g/mol,与预期值对应。结构通过1D和2D NMR光谱学和质谱(EI-MS)验证(参见图2A和B)。AP-GD2的化学酶法合成具有约90%纯材料的最终产率。
将硫光气(2μΙ)加入到80%乙醇(300μΙ)的AP-GD2(2mg)搅拌溶液,并允许将该混合物在室温下静置3小时,那时薄层色谱法(乙酸乙酯-甲醇,4:1)显示所有的起始材料已经反应并且单一产品已经形成。浓缩至几乎干燥得到固体,向其中添加水。过滤并用水洗涤产品,得到异硫氰酸苯基GD2溶液,其被冷冻干燥成白色粉末(1.8mg,90%产率)。将来自PAMAM G0(Dendritech,Inc)的甲醇溶液的挥发物在减压下蒸发,将所得残余物溶解在二甲基甲酰胺(DMF)中。将异硫氰酸苯基GD2(1.8mg)在DMF(110μl)中的溶液逐滴加入到N,N-二异丙基乙胺(0.5μΙ)和PAMAM G0(0.854μg/μl的2μΙ)的搅拌的DMF溶液(100μl)。将反应在室温下搅拌20小时,直到用TLC检测无起始材料。用3ml水稀释该反应混合物,针对水进行透析(截留分子量2kDa,Spectrum Laboratories Inc)。将所得溶液冷冻干燥,得到基于四价PAMAM的GD2,其为80%产率的白色粉末(1.34mg)。基于四价PAMAM的GD2由1D和2D NMR光谱学验证。从ATCC获得小鼠淋巴瘤EL4-GD2+(野生型EL4细胞)和Jurkat白血病细胞。通过使用抗GD2mAbs阴性选择EL4-GD2+,随后通过有限稀释亚克隆来产生EL4-GD3+细胞。EL4-GD3+细胞是稳定的,并具有与EL4-GD2+细胞相同的体外生长特性和动力学。所有细胞在37℃下5%CO2加湿的气氛中在补充有5%胎牛血清、2mM谷氨酰胺、10mM Hepes和青霉素/链霉素的RPMI 1640培养基(Wisent INC)中生长。流式细胞术显示,所有细胞系表达同等水平的细胞表面GM1。流式细胞术和神经节苷脂提取物的薄层色谱证实,EL4-GD2+细胞表达GD2但不表达GD3,EL4-GD3+细胞表达GD3但不表达GD2,并且Jurkat细胞不表达GD2或GD3。
实施例Ⅱ
四-GD2的体内表征
用于血清FACS和ELISA表征的免疫
将PBS中的四-GD2(50μg)腹膜内施用给C57/BI6小鼠。10天后,用PBS中的四-GD2腹膜内(25μg)和皮下(25μg)再免疫小鼠。四天后,收集血液样品用于分析。
FACSan:2×105的EL4-GD2+细胞、EL4-GD3+细胞、和Jurkat细胞用FACS缓冲液(PBS、0.5%BSA、0.05%NaN3)洗涤,并与2μΙ小鼠抗血清(1:50稀释)或阳性对照抗GD2mAb(13nM)或抗GD3mAb(13nM)在冰上温育20分钟。细胞用冰冷的FACS缓冲液洗涤2次,并在冰上与FITC结合的抗小鼠IgG或FITC结合的抗小鼠IgM(Sigma)温育20分钟。细胞用FACS缓冲液洗涤,并在流式细胞仪(Becton-Dickinson)中现研究,并使用CellQuest软件分析数据。小鼠IgG或IgM和正常小鼠血清用作阴性对照抗体。Jurkat细胞用作阴性对照细胞。
直接结合ELISA:神经节苷脂(Advanced Immunochemical Inc)被固定到聚苯乙烯Corning Strip Well 96孔板上(10ng/孔)(Fisher Scientific)。然后用含有0.5%牛血清白蛋白(PBS-0.5%BSA)的磷酸盐缓冲盐水“封锁”孔一小时。将孔与包括测试血清、对照预出血(pre-bleed)小鼠血清、小鼠IgG(Sigma)的初级抗体,或特异性抗神经节苷脂的单克隆抗体温育2小时。将板用PBS-0.5%BSA,之后是对小鼠IgG同种型、或小鼠IgM同种型具有特异性的辣根过氧化物酶(HRP)结合的抗小鼠抗体(Sigma)洗涤三次。用PBS-0.5%BSA洗涤三次并且用PBS洗涤两次后,添加比色底物TMB单溶液(Promega),并将该反应用0.5N H2SO4终止。将板在450nm处读数(Benchmark Plus,Bio-Rad)(31)。
血清分型:每轮免疫后利用毛细管血液收集系统(Microvette,Sardstedt)收集血液并在室温下以10000×g离心5分钟以用于血清分离。然后使用小鼠亚分型试剂盒(Calbiochem,cat#386445)遵循制造商的说明书对存在于血清中的Ig进行分型。实验针对每种血清的三份进行4次。
通过MTT测试评估的细胞毒性
EL4-GD2+细胞(5,000/孔,在96孔板中,Corning)在补充有指示试剂的常规培养基中培养。24小时后细胞的存活/代谢概况用四唑盐试剂(MTT,Sigma)和UV吸收定量。试验一式四份各进行5次。试验试剂包括阳性对照抗GD2mAbs(7nM最终浓度)、阴性对照正常小鼠IgG(7nM最终浓度)。从初次接受试验的小鼠(阴性对照)、或腹膜内接种两次的试验小鼠收集血清。在这些实验中,接种是在第3天和第10天进行,血清在第13天收集。血清采集的时间遵循肿瘤治疗范例的时间线(见下文)。半纯化血清并且施加约50μg/孔的血清抗体。血清抗体的小部分将是抗神经节苷脂抗体,然而mAbs对照含有100%抗神经节苷脂IgG。
由3H-胸苷掺入法评估的混合淋巴细胞反应(MLR)
用25μg/ml丝裂霉素(Sigma)处理EL4-GD2+细胞和对照Jurkat细胞1小时以阻止其增殖。将细胞用培养基洗涤三次以除去丝裂霉素后,将它们以2×105细胞/孔铺板在96孔板中。从两次免疫(如上)和注射载体的对照小鼠获得脾细胞的单细胞悬浮液。按照EASYSEPTM磁体(Stem Cell Tech)的方案分离细胞。从每只小鼠脾脏得到类似量的T细胞(>95%纯度,数据未显示)。将T细胞与丝裂霉素处理过的EL4或Jurkat细胞以10:1的比率铺板。作为对照,使用单独的T细胞(没有刺激肿瘤细胞)或伴刀豆球蛋白A处理过的T细胞的培养物。培养5天后,加入0.1μCi/孔3H-胸苷(Sigma-Aldrich公司)。掺入DNA的3H-胸苷通过液体闪烁计数,并且数据报告为平均值cpm±sd。
实施例Ⅲ
肿瘤预防研究
用于肿瘤预防研究的免疫
给C57BL/6小鼠腹膜内接种四次,每次每隔一周(每次50μg)。对照小鼠仅接受载体注射。第四次接种的一周后,皮下注射5×105EL4-GD2+。肿瘤攻击后十天,在肿瘤植入后的指定时间测量肿瘤。
用于肿瘤治疗研究的免疫
用5×105EL4-GD2+细胞在左侧皮下注射C57BL/6小鼠。三天后,当肿瘤是可见/可触及时,将小鼠随机化并且用载体对照或四-GD2-树状大分子(PBS中50μg)在右侧腹膜内接种两次。在肿瘤植入后的指定时间测量肿瘤。
过继T细胞转移治疗研究
给C57BL/6小鼠用50μg四-GD2腹膜内接种两次(相隔一周)。第二次免疫后七天,使用EasySep阴性选择小鼠T细胞富集试剂盒(Stemcell Tech)从脾和淋巴结分离T细胞。将约4×106T细胞腹膜内注射给C57BL/6小鼠,过继转移之前3天C57BL/6小鼠已被皮下注射2.5×105EL4-GD2+细胞。在指定时间测量肿瘤并在肿瘤植入后14天将小鼠安乐死,以解剖同侧腹股沟和腋窝淋巴结并评估转移。
肿瘤生长的评估
用数字游标卡尺测量原发肿瘤,并通过下面的等式分析数据:V(mm3)=0.5×宽度×(长度)2。安乐死后,将小鼠解剖并且显微镜检查以获得向淋巴结和胸腺(已知EL4细胞回家的器官)转移的证据。
通过双尾学生t检验分析两组的肿瘤生长的差异;统计学意义在P<0.05(*)和P<0.01(**)。在别处,单向ANOVA与Tukey-Kramer多重比较检验比较了五个不同的组。结果之间的差异被认为在P<0.05(*)和P<0.01(**)具有统计学意义。
实施例Ⅳ
四-GD3的体内表征
安全性。接种的小鼠没有显示出可从已知的副作用预测的不利影响的任何迹象。测量的所有端点都是阴性的,包括使用GD2和GD3抗原的形式的临床试验中报告有问题的那些端点(痛觉过敏,行为、活动、和学习/记忆的改变)。过度免疫的小鼠没有生成针对正常神经节苷脂的交叉反应性免疫,并且没有改变血液学分布、肝脏或肾脏酶分布。
利用实施例I中所述的相同的合成策略,产生GD3树状大分子(四-GD3)类似物。两轮免疫后,检测到高滴度的抗GD3抗体而不是抗GM1Abs。安全性评价,如上所述,没有发现问题。
图7显示了用四-GD3接种引起体液免疫。血清的代表性ELISA数据显示IgG亚类的抗GD3-反应性抗体。阴性对照是正常小鼠的接种前血清和小鼠Ig(Sigma)。结合对GD3是选择性的,然而GM1ELISA板是阴性的(未示出)。显示的数据为n=8种个体样品平均值±sem。
新GD3疫苗被评价为体内抗癌剂。使用表达高水平GD3的EL4-GD3+。在预防的范例中,在非常攻击性的同源EL4-GD3+植入前对小鼠进行两次免疫。在临床相关肿瘤治疗模型中,进行从接种的供体小鼠到携带形成的皮下肿瘤的小鼠的T细胞过继转移。在两种范例中,在测量的所有天,免疫过的小鼠具有比对照小鼠明显较小尺寸的原发肿瘤(图8),并且转移实际上不存在于淋巴结(图9)和肺(图10)。
图8显示用四-GD3接种的结果保护不受GD3+肿瘤攻击。在EL4-GD3+细胞皮下肿瘤植入前用四-GD3腹膜内接种小鼠(2x,间隔1周,每次10μg/小鼠,无佐剂)。平均原发肿瘤体积±sd。
图9显示用四-GD3接种的结果保护不受GD3+肿瘤攻击。在EL4-GD3+细胞皮下肿瘤植入前用四-GD3腹膜内接种小鼠(2x,间隔1周,每次10μg/小鼠,无佐剂)。平均淋巴结体积±sd(指示转移,通过检测淋巴结中的EL4细胞而测量),每组n=8。淋巴结显示为实施。
图10显示GD3疫苗降低黑素瘤肺转移的观察。将5×105B16-GD3黑素瘤细胞注射到C57BL/6小鼠的尾静脉中。三天后,将小鼠随机化并且腹膜内接种两次。14天后处死小鼠。对具有转移性结节黑斑的肺进行定量(肿瘤含有黑色素并且可以很容易看到)。
虽然本发明已经结合其具体实施方式进行了描述,但是可以理解,其能够进一步修改,并且本申请意欲涵盖本发明的任何变化、应用、或修改,其属于本发明所属领域内的已知或惯常做法,并且可应用于上文所述的基本特征,并且在以下所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!