竹叶青酒中的生物活性成分和医药用途的制作方法
本发明涉及竹叶青酒中的生物活性成分和保健作用,特别的涉及竹叶青酒中具有免疫调节活性、抗氧化、抗炎、保护肝脏损伤的生物活性成分。
背景技术:
竹叶青酒是我国传统历史名酒,也是中国载誉最高且最多的保健酒。它是以中国清香型名酒——汾酒为基酒,以竹叶、当归、陈皮、栀子、砂仁、檀香、丁香等十余味名贵中药材的浸泡液和冰糖配制而成的一种露酒。该酒具备有养血、和胃、消食、除烦等功效。常年适量饮用,可以调和脏腑、疏气养血、消火消痰、解毒利尿、健脾滋肝。不仅可以保健身体,还可以防治关节炎、高血压、高血脂等疾病。近年来,随着消费者健康保健意识的不断增强,对于保健食品的特殊功效成分及其保健作用,也越来越引起人们的关注。因此,对竹叶青酒中生物活性成分进行系统深入的研究,尝试发掘、探讨其特有的保健功能作用,具有重要的理论意义和实际应用价值。
技术实现要素:
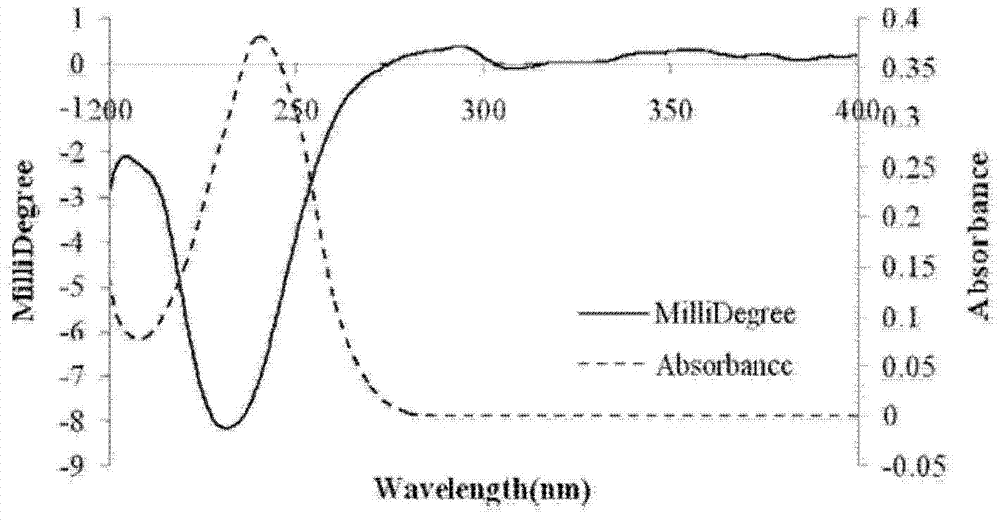
本发明的目的:系统科学的研究竹叶青酒中的化学成分,寻找新的活性单体化合物。发明的实现过程如下:运用各种分离手段包括硅胶柱色谱、大孔吸附树脂、聚酰胺、葡聚糖凝胶LH-20柱色谱和制备型高效液相色谱法等,从竹叶青酒中分离得到96个化合物,其中16个萜类化合物,10个环烯醚萜类化合物,25个黄酮及黄酮苷类化合物,3个色原酮类化合物,15个酚酸及酚苷类化合物,14个芳香类化合物,1个奎尼酸类,2个香豆素类,2个木脂素类,3个甾体类,2个长链脂肪酸类,2个糠醛类,1个呋喃酮类。其中化合物1、2、3、4、5、14、16、53为新的化学成分。这些化合物其化学名称及结构式如下:化合物1:(1R,10S,11R)-10,11-二甲基-4-醛基-2,9-二氧代-二环[5.4.0]十一-4,6-二烯-3-酮,[(1R,10S,11R)-10,11-dimethyl-4-formyl-2,9-dioxa-bicyclo[5.4.0]undeca-4,6-dien-3-one],具有结构式1所示结构。化合物2:6-(6-(3,4-二甲氧基)苯丙烯酰基-β-D-葡萄糖基)-O-β-D-葡萄糖甲苷[methyl-6-(6-(3,4-dimethoxy)-benzalacryloyl-β-D-glucosyl)-O-β-D-glucopyranoside],具有结构式2所示结构。化合物3:(4-羟基-2,6,6-三甲基)-环己烯甲酸-4-羟基-(苯甲酸)酯[Picrocrocinicester],具有结构式3所示结构。化合物4:(7R)-6’-O-(3”-甲氧基-4”-羟基-苯丙烯酰基)-β-D-葡萄糖-1’-O-7-羟甲基-(6-羟甲基-1,1-二甲基环己-4-烯-3-酮)苷[6'-O-(3-methoxyl-4-hydroxyl-coumaroyl)-epijasminosideB],具有结构式4所示结构。化合物5:(4R)-3-羟甲基-4-羟甲基-5,5-二甲基环己-2-烯酮-β-D-葡萄糖苷[epijasminosideB],具有结构式5所示结构。化合物14:(5R)-(2E)-5-羟基-2-甲基-戊-2-烯-1,6-二酮[(5R)-(2E)-5-hydroxy-2-methyl-hepta-2-ene-1,6-dione],具有结构式6所示结构。化合物16:6”-O-反式-对-甲氧基-苯丙烯基京尼平龙胆二糖苷[6”-O-trans-p-methoxyl-coumaroylgenipingentiobioside],具有结构式7所示结构。化合物53:7-甲氧基-异双花母草素[7-methoxyl-isobiflorin],具有结构式8所示结构。本发明的另一个目的在于提供本发明所涉及的竹叶青酒,从竹叶青酒中分离得到的化合物的医药用途。本发明经过研究发现,竹叶青酒,从竹叶青酒中分离得到的化合物具有抗氧化,抗炎,免疫增强,保护肝脏作用。可以用于制备预防和治疗具有上述功效的药物或保健食品。本发明还提供含有竹叶青酒或从竹叶青酒中分离得到的化合物的药物或保健食品组合物,以适合应用。所述的药物组合物其适合的形式包括任何一种适宜服用的制剂形式,如本发明的药物组合物,在使用时可以根据需要制备成药物制剂形式,如口服制剂形式,注射剂形式,外用制剂形式,栓剂形式等。所述保健食品组合物,包括但不限于以下食品形式:饮料、乳制品、面包、糕点、糖果等。优选的,本发明提供上述8种化合物,它们的制备,以及它们在制备药物或保健食品中的应用。本发明经过研究发现,竹叶青酒具有抗氧化,抗炎,免疫增强,保护肝脏作用,其中萜类,环烯醚萜类,黄酮类及酚酸类化合物为其主要有效成分。生物活性研究表明,化合物1-98中任一化合物具有抗氧化、抗炎、清除自由基、抗胆碱酯酶、免疫增强、保护肝脏作用,是竹叶青酒发挥保健功能的物质基础。发明的实现过程如下:建立不同损伤机制的急性肝损伤模型(化学性肝损伤模型、免疫性肝损伤模型、酒精性肝损伤模型、药物性肝损伤模型),对竹叶青酒进行了肝保护作用的研究。建立免疫力低下模型,研究竹叶青酒的免疫调节活性。采用酒精诱导HepaG2细胞损伤,筛选肝细胞保护成分。采用LPS诱导RAW264.7研究竹叶青酒中化合物的抗炎活性。对竹叶青酒中分得化合物进行胆碱酯酶活性的筛选。附图说明图1化合物1的CD和UV图谱图2化合物2的CD和UV图谱图3化合物3的CD和UV图谱图4化合物4的CD和UV图谱图5化合物7的CD和UV图谱图6CCl4所致的小鼠急性肝损伤的肝组织病理变化HE染色(100×).(A)正常组;(B)CCl4模型组;(C)-(F)分别为竹叶青母液A-D剂量组图7TAA所致的小鼠急性肝损伤的肝组织病理变化HE染色(100×).(A)正常组;(B)TAA模型组;(C)-(F)分别为竹叶青母液A-D剂量组;(G)复方益肝灵组(200mg/kg)图8酒精所致的小鼠急性肝损伤的肝组织病理变化HE染色(×100).(A)正常组;(B)酒精模型组;(C)-(F)分别为竹叶青酒母液A-D剂量组;(G)为联苯双酯组(150mg/kg)图9酒精所致的小鼠急性肝损伤肝组织TNF-α表达(×200).(A)正常组;(B)酒精模型组;(C)-(F)分别为竹叶青酒母液A-D剂量组;(G)为联苯双酯组(150mg/kg)图10酒精所致的小鼠急性肝损伤肝组织Fas表达(×200).(A)正常组;(B)酒精模型组;(C)-(F)分别为竹叶青酒母液A-D剂量组;(G)为联苯双酯组(150mg/kg)图11酒精所致的小鼠急性肝损伤肝组织FasL表达(×200).(A)正常组;(B)酒精模型组;(C)-(F)分别为竹叶青酒母液A-D剂量组;(G)为联苯双酯组(150mg/kg)图12酒精所致的小鼠急性肝损伤肝组织Bcl-2表达(×200).(A)正常组;(B)酒精模型组;(C)-(F)分别为竹叶青酒母液A-D剂量组;(G)为联苯双酯组(150mg/kg)图13酒精所致的小鼠急性肝损伤肝组织Bax表达(×200).(A)正常组;(B)酒精模型组;(C)-(F)分别为竹叶青酒母液A-D剂量组;(G)为联苯双酯组(150mg/kg)图14竹叶青酒的提取流程图图15竹叶青酒HPD10060%乙醇洗脱部分分离流程图图16竹叶青酒氯仿和乙酸乙酯萃取部分分离流程图图17化合物1的HMBC相关图图18A化合物1的相对构型图,图18B化合物1的相对构型图图19A化合物2的HMBC图,图19B化合物2的NOEs图图20A化合物3的HMBC相关图,图20B化合物3的HMBC相关图,图20C化合物3的HMBC相关图图21A化合物4的HMBC相关图,图21B化合物4的HMBC相关图图22A化合物5的HMBC相关图,图22B化合物5的HMBC相关图图23化合物14的HMBC相关图图24化合物16的HMBC相关图具体实施方式以下通过实施例进一步说明本发明,但不作为对本发明的限制。实施例1:化合物的分离取竹叶青酒母液,浓缩挥去醇后,依次用石油醚、氯仿、乙酸乙酯萃取,分别萃取5遍,回收各萃取层溶剂,得各萃取层浸膏:石油醚层100g,氯仿层56g,乙酸乙酯层100g。萃取后的水层用HPD100大孔吸附树脂进行处理,依次用水、60%乙醇、95%乙醇进行洗脱,其中水洗部分弃掉,分别回收60%乙醇、95%乙醇洗脱部分得浸膏:60%乙醇洗脱部分200g,95%乙醇洗脱部分20g。提取分离流程见图14。将氯仿层、乙酸乙酯层样品合并,取合并后样品100g,利用反复硅胶柱色谱、聚酰胺、SephadexLH-20、和HPLC等手段分离共得到50个化合物;取HPD100大孔吸附树脂60%EtOH洗脱部分样品100g,利用硅胶柱色谱、开放ODS和HPLC等手段分离得到48个化合物。分离流程见图15,16。其中本发明的8个新化合物,化合物1、2、3、4、5、14、16、53具体的分离方法描述如下:乙酸乙酯萃取部位(100g)以石油醚/丙酮(100:0-0:100)为洗脱溶剂进行硅胶柱层析(350g,200-300目,9×160cm),得洗脱流份A-O。流份I(石油醚/丙酮,100:15,2.3g)及流份M(石油醚/丙酮,100:50,3.0g)合并进行半制备HPLC分离(乙腈/水,15/85)得化合物3(18mg)。60%乙醇洗脱部位(100g)以氯仿/甲醇(100:0-0:100)为洗脱溶剂进行硅胶柱层析(350g,200-300目,9×160cm),得洗脱流份a-m。流份b(氯仿/甲醇,100:0.5,70mg)以石油醚/丙酮进行硅胶柱层析,得流份b1-b3。流份b2进行半制备HPLC分离(甲醇/水,4/96)得化合物6(3.0mg)。流份c(氯仿/甲醇,100:2,2.0g)进行半制备HPLC分离(乙腈/水,6/94)得化合物1(5.1mg)。流份e(氯仿/甲醇,100:3及100:5)以甲醇/水(15:85-40:60,v/v)进行ODS梯度洗脱得五个部分,e1-e5。流份e1(甲醇/水,15:85,38.9mg)进行半制备HPLC分离(乙腈/水,20/80)得化合物2(3.5mg)。流份f(氯仿/甲醇,100:8,3.0g)以甲醇/水(5:95-50:50,v/v)进行ODS梯度洗脱得六个部分f1-f6。流份f2(甲醇/水,10:90,52.6mg)进行半制备HPLC分离(乙腈/水,5/95)得化合物4(4.2mg),化合物5(3.0mg)和化合物8(8.5mg)。流份g(氯仿/甲醇,100:12)以氯仿/甲醇为洗脱溶剂进行硅胶柱层析得三个流份g1-g3。流份g2进行半制备HPLC分离(乙腈/水,21/79)得化合物7(4.5mg)。实施例2:化学结构鉴定利用1维、2维核磁共振谱(1D,2D-NMR)、质谱(MS)、圆二色谱(CD)等光谱手段以及其他物理化学方法确定了分离得到的96个化合物的化学结构。其中包括的8个新化合物的化学结构和鉴定手段如表1:表1竹叶青酒中的96个化合物(其中包括8个新化合物)的结构及其鉴定方法*为新化合物实施例3:化合物1的化学结构鉴定黄色透明固体(甲醇),溶于甲醇。HR-ESI-TOF-MS谱给出高分辨准分子离子峰m/z223.0973[M+H]+(Calcd.223.0970,1.3ppm)。结合其NMR数据,确定其分子式C12H14O4,并计算出该化合物含有6个不饱和度。1HNMR谱(600MHz,CD3OD),低场区给出2个烯氢质子信号δ6.35(1H,d,J=4.2Hz),7.15(1H,d,J=4.2Hz);1个活泼氢质子信号δ9.33(1H,s)。高场区给出2个连氧叔碳质子信号δ5.23(1H,d,J=11.4Hz),4.34(1H,dq,J=3.0,6.0Hz);1个连氧仲碳质子信号δ4.65(2H,s);1叔碳质子信号δ2.65(1H,m),两个甲基质子信号δ1.13(3H,d,J=6.0Hz),1.55(3H,d,J=6.0Hz)。13CNMR谱(150MHz,CD3OD)中给出12个碳信号,低场区给出6个sp2杂化的碳信号,其中δ180.5处给出一醛基碳信号,δ174.6处为一成酯的羰基碳信号。δ111.9,128.3,133.4,146.3处给出两个双键碳信号。高场区δ82.3,63.8处给出两个连氧次甲基碳信号,δ56.8处给出1个连氧亚甲基碳信号,δ45.3处给出1个次甲基碳信号,δ14.7,18.8处给出两个甲基碳信号。在HMBC谱中(图17),由δ1.13(3H,d,J=6.0Hz),1.55(3H,d,J=6.0Hz)分别与δ45.3,63.8,82.3存在相关,δ4.34(1H,dt,J=3.0,6.6Hz)与δ14.7相关,δ2.65(1H,m)与δ14.7,18.8,63.8,82.3相关,说明14.7的甲基连在82.3的连氧叔碳上,18.8的甲基连在45.3的叔碳上。由δ4.65(2H,s)与δ111.9,146.3有远程相关,δ5.23(1H,d,J=11.4Hz)与δ14.7,45.3,133.4,146.3,174.6相关,δ6.35(1H,d,J=4.2Hz)与δ56.8,128.3,133.4,146.3相关,δ7.15(1H,d,J=4.2Hz)与δ111.9,133.4,146.3,180.5相关,可得出该化合物的平面结构如图1。另外,根据H-10/H-11的偶合常数为J=11.4Hz,H10/H-9的偶合常数为J=3.0Hz,并利用计算机模拟结构最小能量(CSChem3DProVersion8.0,MM2minimizeenergycaculate)计算,可得出该化合物的相对构型如图18,命名为10,11-二甲基-4-醛基-2,9-二氧代-二环[5.4.0]十一-4,6-二烯-3-酮。在CD谱(见附图1)中,根据不饱和内酯的螺旋规则,化合物1在306nm处呈现正cotton效应,260nm处呈现负cotton效应,可判断符合P-螺旋,故判断1位为R型,确定化合物1的绝对构型为(1R,10S,11R)。经系统文献检索,为未见文献报道的新化合物,其结构为(1R,10S,11R)-10,11-二甲基-4-醛基-2,9-二氧代-二环[5.4.0]十一-4,6-二烯-3-酮。表2化合物1的1HNMR(600MHzinCD3OD),13CNMR(150MHzinCD3OD)及HMBC数据实施例4:化合物2的化学结构鉴定白色粉末(甲醇),易溶于甲醇,不溶于石油醚,乙酸乙酯,氯仿。HR-ESI-TOF-MS谱给出高分辨准分子离子峰m/z545.1877[M-H]-(Calcd.545.1870,0.5ppm)。结合其NMR数据,确定其分子式为C24H34O14,并计算出该化合物含有8个不饱和度。1HNMR谱(400MHz,CD3OD)中给出1组1”',3”',4”'-三取代苯环质子信号δ6.90(2H,s,H-2”',6”')、δ7.48(1H,s,H-5”'),2个与羧基共轭的反式双键质子信号δ6.38(1H,d,J=16.0Hz,H-α)、δ7.59(1H,d,J=16.0Hz,H-β),3个甲氧基质子信号δ3.71(3H,s),δ3.88(3H,s),δ3.86(3H,s),由β-D-葡萄糖端基质子信号δ4.98(1H,d,J=8.0Hz,glc-1)和酰化的葡萄糖6位质子信号δ4.26(1H,br.d,J=14.4Hz,glc-6),δ4.18(1H,br.d,J=14.4Hz,glc-6)及由另一个β-D-葡萄糖端基质子信号δ4.71(1H,d,J=8.0Hz,glc-1)和向低场位移的葡萄糖6位质子信号δ4.47(1H,dd,J=11.2,6.0Hz,glc-6),δ4.39(1H,dd,J=11.2,2.4Hz,glc-6),推测该葡萄糖6位被葡萄糖基取代,并且形成甲苷。13CNMR谱(100MHz,CD3OD)中给出共有24个碳信号,低场显示9个sp2杂化的碳信号,其中δC168.9为羰基碳信号。结合1HNMR谱推测其中11个碳信号显示为3”',4”'-二甲氧基苯丙烯酰结构骨架,其余13个碳信号显示为两个β-D-葡萄糖上的碳信号和一个甲氧基的碳信号。由HSQC光谱可知δC51.9(C-1),57.0(C-3”'),57.0(C-4”')为三个甲氧基碳信号,δC61.9(C-6”),64.2(C-6')两个仲碳信号分别为两个β-D-葡萄糖上的六位碳信号,δC100.6(C-1'),99.4(C-1”)两个叔碳信号分别为两个β-D-葡萄糖上的端基碳信号,δC145.0(C-β),115.8(C-α)分别为与羧基共轭的反式双键上的碳信号,δC128.5(C-1”'),149.5(C-3”'),149.4(C-4”')为苯环上取代的季碳信号,δC106.9(C-2”',6”'),112.4(C-5”')为3”',4”'-二甲氧基苯丙烯酰结构骨架中的三个未取代碳信号。在HMBC光谱中(图19),甲氧基质子δH3.65与δC100.6(C-1')相关,推断C-1连接在β-D-葡萄糖的端基上,形成甲苷。甲氧基质子δH3.86和3.88分别与δC149.4(C-4”'),149.5(C-3”')存在远程相关,说明这两个甲氧基分别连接在苯环C-4”',C-3”'位上。葡萄糖6位质子信号δH4.39与δC99.4(C-1”)有相关,表明此葡萄糖的6位与另一β-D-葡萄糖的1位相连。另一β-D-葡萄糖的6位质子信号δH4.26与δC168.9(C-9”'),115.8(C-8”')相关,即说明此葡萄糖6位连接在苯丙烯酰基上。另外,苯环质子信号δH6.90与δC128.5(C-1”'),149.5(C-3”'),149.4(C-4”'),145.0(C-7”')存在远程相关。在NOESY光谱中(图19),H-1/H-1'相关,可知β-D-葡萄糖的端基被甲基取代,形成甲苷。H-6'/H-1”相关,说明此β-D-葡萄糖的6位与另一葡萄糖的端基相连。H-6”/H-8”',H-6”/H-2”'相关,显示此葡萄糖6位与苯丙烯酰基相连。另外,H-8”'/H-2”',H-7”'/H-6”'相关,NOESY效应同时可以结合1HNMR的偶合常数判断C-α,C-β双键为反式双键。因此,综上分析,可判定该化合物为6-(6-(3,4-二甲氧基)苯丙烯酰基-β-D-葡萄糖基)-O-β-D-葡萄糖甲苷。表3化合物2的1HNMR(400MHzinCD3OD),13CNMR(100MHzinCD3OD),HMBC,NOESY谱实施例5:化合物3的化学结构鉴定黄色粉末(甲醇),溶于甲醇。HR-ESI-TOF-MS谱给出高分辨准分子离子峰m/z303.1225[M-H]-(Calcd.303.1232,-1.9ppm)。结合其NMR数据,确定其分子式为C17H20O5,并计算出该化合物含有8个不饱和度。1HNMR谱(600MHz,CD3OD)中,低场区给出一组AA'BB'偶合系统的苯环质子信号δ6.84(2H,dd,J=2.4,8.4Hz),6.84(2H,dd,J=2.4,8.4Hz)。高场区给出3个甲基质子信号δ1.09(3H,s),1.21(3H,s),1.72(3H,s)。两个亚甲基质子信号δ1.74(1H,m),1.40(1H,m),1.95(1H,m),2.33(1H,m)。13CNMR谱(150MHz,CD3OD)中给出17个碳信号,低场区给出10个sp2杂化的碳信号,其中δ174.6处为一成酯的羰基碳信号,δ170.3处为一羧基碳信号δ131.8,136.9处为一双键碳信号。δ116.2,116.2,122.9,133.1,133.1,163.5处为一苯环碳信号。高场区δ65.2处给出一连氧的碳信号,δ21.4,29.2,29.9给出三个甲基碳信号。在HMBC谱中(图20),δ1.09(3H,s),1.21(3H,s)与δ29.9,36.6,48.4,136.9存在相关,说明这两个甲基连接在δ36.6的季碳上。δ1.72(3H,s)与δ41.6,131.8,136.9有远程相关,说明此甲基链接在δ131.8的双键碳上。由δ1.95(1H,m)与δ65.2,131.8,136.9相关,δ2.33(1H,m)与δ21.4,48.4,65.2,131.8,136.9相关,δ1.40(1H,m)与δ29.2,36.6,41.6,65.2存在远程相关,δ1.74(1H,m)与δ36.6,65.2存在相关,可得出结构片段A。由δ6.84(2H,dd,J=2.4,8.4Hz)与δ116.2,122.9,133.1存在相关,δ7.90(2H,dd,J=2.4,8.4Hz)与δ116.2,133.1,163.5,170.3存在相关,可得出结构片段B。另外,由向高场位移的羰基碳信号可知,该羰基碳已成酯。故,由A、B片段可得出结构C。综上分析,可判定该化合物结构为(4-羟基-2,6,6-三甲基)-环己烯甲酸-4-羟基-(苯甲酸)酯。在CD谱(见附图2)中,根据不饱和内酯的螺旋规则,化合物2在233nm处呈现负cotton效应,可判断4位为R型,这与化合物picrocrocinicacid的构型一致[1],故确定该化合物为(4-羟基-2,6,6-三甲基)-环己烯甲酸-4-羟基-(苯甲酸)酯。经系统文献检索,为未见文献报道的新化合物。表4化合物3的1H-(600MHzinCD3OD),13C-NMR(150MHzinCD3OD)及HMBC数据实施例6:化合物4的化学结构鉴定白色粉末(甲醇),溶于甲醇,Molisch反应阳性。HR-ESI-TOF-MS谱给出高分辨准分子离子峰m/z521.2018[M-H]-(Calcd.521.2023,-0.9ppm)。结合其NMR数据,确定其分子式为C26H34O11,并计算出该化合物含有10个不饱和度。1HNMR谱(400MHz,CD3OD)中低场区给出1组1,3,4-三取代苯环质子信号δ6.90(1H,br.s,H-2”),6.96(1H,br.d,J=8.0Hz,H-5”),6.43(1H,br.d,J=8.0Hz,H-6”),2个反式双键质子信号δ6.41(1H,d,J=16.0Hz,H-8”)、δ7.63(1H,d,J=16.0Hz,H-7”),1个烯氢质子信号δ6.25(1H,s,H-4)。高场区给出1甲氧基质子信号δ3.87(3H,s),2个甲基质子信号δ1.01(3H,s),1.11(3H,s)。由β-D-葡萄糖端基质子信号δ4.44(1H,d,J=8.0Hz,glc-1)和6位质子信号δ4.32(1H,br.d,J=11.6Hz),4.51(1H,br.d,J=11.6Hz)可知,该分子结构中存在一葡萄糖分子,而且6位被酰化,1位被取代。13CNMR谱(100MHz,CD3OD)中给出26个碳信号,低场区给出12个sp2杂化的碳信号,其中δ202.9处显示为一羰基碳信号。δ104.7处碳信号为葡萄糖端基碳信号。δ57.0处为一甲氧基碳信号,另高场区给出两个甲基碳信号δ27.6,29.5。由HMBC谱可知(图21),δ6.41(1H,d,J=16.0Hz,H-8”)与δ125.7,147.5,169.1存在远程相关,δ7.63(1H,d,J=16.0Hz,H-7”)与δ107.1,125.7,169.1存在远程相关,可得出一苯丙烯酰基结构片段。δ4.32(1H,br.d,J=11.6Hz,glc-6),4.51(1H,br.d,J=11.6Hz,glc-6)与δ169.1存在远程相关,说明该葡糖糖6位被酰化,与苯丙烯酰基相连。由δ4.47,4.53与δ164.1,125.6存在相关,δ3.83与δ36.4,50.7,164.1有远程相关,δ2.01,2.72与δ202.9,36.4,50.7相关,δ1.01,1.11与δ36.4,50.2,50.7相关,可得出结构片段A。δ4.44(1H,d,J=8.0Hz,glc-1)与δ72.2存在远程相关,可推断该葡萄糖1位与上述结构片段中10位羟甲基相连。综上分析,可得出该化合物的相对构型为6'-O-(3”-甲氧基-4”-羟基-苯丙烯酰基)-β-D-葡萄糖-1'-O-7-甲基-(6-羟甲基-1,1-二甲基环己-4-烯-3-酮)苷。由CD谱(附图4)可看出,235nm、224nm和207nm处呈现正的Cotton效应,251nm处呈现负的Cotton效应。可知C-7连氧亚甲基和C-2其中一个亚甲基质子(δ2.72)为β-构型,所以判断该化合物的绝对构型为R构型[3]。综上可断定该化合物为(7R)-6’-O-(3”-甲氧基-4”-羟基-苯丙烯酰基)-β-D-葡萄糖-1’-O-7-羟甲基-(6-羟甲基-1,1-二甲基环己-4-烯-3-酮)苷。表5化合物4的1H-(400MHzinCD3OD),13C-NMR(100MHzinCD3OD)及HMBC数据实施例7:化合物5的化学结构鉴定淡黄色不定型粉末(甲醇),溶于甲醇,Molisch反应阳性。HR-ESI-TOF-MS谱给出高分辨准分子离子峰m/z345.1540[M-H]-(Calcd.345.1549,1.2ppm)。结合其NMR数据,确定其分子式为C16H26O8,并计算出该化合物含有4个不饱和度。1HNMR谱(400MHz,CD3OD)中低场区1个烯氢质子信号δ6.23(1H,br.s,H-4)。高场区给出2个甲基质子信号δ1.01(3H,s),1.11(3H,s)。由β-D-葡萄糖端基质子信号δ4.25(1H,d,J=7.8Hz,glc-1)和6位质子信号δ3.67(1H,dd,J=12.0,5.2Hz),3.86(1H,dd,J=12.0,1.6Hz)可知,该分子结构中存在一葡萄糖分子。13CNMR谱(100MHz,CD3OD)中给出16个碳信号,低场区给出3个sp2杂化的碳信号,其中δ202.9处显示为一羰基碳信号。δ104.6处碳信号为葡萄糖端基碳信号。另高场区给出两个甲基碳信号δ27.6,29.5。由HMBC谱可知(图22),由δ4.43,4.57与δ164.0,125.5存在相关,δ3.83与δ36.5,50.7,164.0有远程相关,δ2.00,2.71与δ202.9,36.5,50.7相关,δ1.01,1.11与δ36.5,50.1,50.7相关,可得出结构片段A。δ4.25(1H,d,J=7.8Hz,glc-1)与δ72.2存在远程相关,可推断该葡萄糖1位与上述结构片段中10位羟甲基相连。综上分析,可得出该化合物的相对构型为3-羟甲基-4-羟甲基-5,5-二甲基环己-2-烯酮-β-D-葡萄糖苷。由CD谱(附图3)可看出,233nm和208nm处呈现正的Cotton效应,329nm处呈现负的Cotton效应。可知C-7连氧亚甲基和C-2其中一个亚甲基质子(δ2.71)为β-构型,所以判断该化合物的绝对构型为R构型。综上可断定该化合物为(4R)-3-羟甲基-4-羟甲基-5,5-二甲基环己-2-烯酮-β-D-葡萄糖苷。以上数据与文献[2]对比,可知该化合物与jasminosideB互为同分异构体。表6化合物5的1H-(400MHzinCD3OD),13C-NMR(100MHzinCD3OD)及HMBC数据实施例8:化合物14的化学结构鉴定淡黄色固体(甲醇),HR-ESI-TOF-MS谱给出高分辨准分子离子峰m/z156.0796[M+H]+(Calcd.156.0786,2.3ppm)。结合其NMR数据,确定其分子式为C8H12O3,并计算出该化合物含有3个不饱和度。1HNMR和13CNMR(600MHz,CD3OD)谱中给出一反式双键信号δH7.29(1H,t,J=1.5Hz,H-3),δC130.8(C-2),151.2(C-3),一醛基信号δH9.75(1H,s,-CHO),δC176.3(C-1),一羰基碳信号δC207(C-6),两个甲基碳信号δH2.18(3H,s,H-7),1.87(3H,s,2-CH3),δC30.3(C-7),10.6(2-CH3),一个亚甲基碳信号δH2.87(2H,m,H-4),δC46.9(C-4)和一个连氧叔碳信号δH5.32(1H,m,H-5),δC78.9(C-5)。HMBC谱(图23)提示,δH1.87(3H,s,2-CH3)和C-1,C-2,C-3相关,H-3与C-1,C-2,C-4相关,H-4和C-3,C-5,C-6相关,H-7与C-4呈W相关,H-7与C-5,C-6相关。可得出该化合物结构为(E)-5-羟基-2-甲基-庚-2-烯-1,6-二酮。表7化合物14的1HNMR(600MHz),13CNMR(150MHz)数据实施例9:化合物16的化学结构鉴定黄色无定型粉末(甲醇),溶于甲醇,Molisch反应阳性。HR-ESI-TOF-MS谱给出准分子离子峰m/z711.2508[M+H]+(Calcd.711.2500,1.8ppm)。并结合其NMR数据,推测其分子式为C33H42O17,并计算出该化合物含有13个不饱和度。1HNMR谱(400MHz,CD3OD)及13CNMR谱(100MHz,CD3OD)中给出四个双键质子信号和六个双键碳信号,其中包含一反式双键信号δH7.63(1H,d,J=16.0Hz,H-7″′),6.44(1H,d,J=16.0Hz,H-8″′),δC147.4(C-7″′),115.7(C-8″′)。δH7.23(2H,dd,J=2.0,8.0Hz,H-2″′,6″′),6.80(2H,dd,J=2.0,8.0Hz,H-3″′,5″′),3.87(3H,s,4″′-OCH3)处质子信号与δC126.6(C-1″′),159.6(C-4″′),126.4(C-2″′,6″′),115.3(C-3″′,5″′),56.9(4″′-OCH3)处碳信号提示结构中含有一个1,4-二取代的苯环。HMBC谱中(图24),H-7″′与C-1″′,C-2″′,6″′,C-9″′相关,4″′-OCH3与C-4″′相关,H-8″′与C-9″′,C-1″′相关,提示存在一反式对-甲氧基苯丙烯酸基团。另外,δH4.40(1H,d,J=8.0Hz,H-1″),4.53(1H,br.d,J=10.8Hz,H-6″),4.22(1H,dd,J=2.0,10.8Hz,H-6″)及δH4.71(1H,d,J=8.0Hz,H-1′),4.09(1H,dd,J=12.0,2.4Hz,H-6′),3.75(1H,dd,J=12.0,2.4Hz,H-6′)提示结构中存在两分子葡萄糖,由端基质子偶合常数(8.0Hz)可知,该葡萄糖为β-构型。H-6′与C-1″及H-1″与C-6′相关,提示两葡萄糖的连接为1→6。其余1H、13CNMR信号与京尼平苷相似[8]。H-1与C-1′及H-1′与C-1相关,说明葡萄糖1位与京尼平1位相连。由H-6″与C-9″′相关,及向低场位移的C-6″信号可知,对-甲氧基苯丙烯酸基连接在另一葡萄糖的6位。1HNMR谱(400MHz,CD3OD)及13CNMR谱数据与6”-O-反式-对-羟基-苯丙烯基-京尼平-龙胆二糖苷对比,基本一致[4],故判断该化合物为6”-O-反式-对-甲氧基-苯丙烯基-京尼平-龙胆二糖苷。表8化合物16的1H-(400MHzinCD3OD)及13C-NMR(100MHzinCD3OD)数据实施例10:化合物53的化学结构鉴定黄色粉末(甲醇),三氯化铁-铁氰化钾反应阳性,表明有酚羟基存在。UV(MeOH)λmax(logε):204(3.82),254(3.79),294(2.93),HR-ESI-TOF-MS谱给出准分子离子峰m/z369.1175[M+H]+(Calcd.369.1186,-2.6ppm),结合13CNMR、1HNMR谱,推测其分子式为C17H20O9。1HNMR谱(400MHz,CD3OD)中低场区给出2个芳香质子信号δ6.09(1H,s,H-3)、δ6.24(1H,s,H-6)。高场区显示1个甲氧基质子信号δ3.97(3H,s,7-OCH3),1个甲基质子信号δ2.40(3H,s,2-CH3),另δ4.39(1H,d,J=7.6Hz,glc-1’)处为葡萄糖端基质子信号。13CNMR谱(100MHz,CD3OD)中给出的17个碳信号,其中低场区给出9个sp2杂化的碳信号,其中δ184.5处为一羰基碳信号。高场区δ56.8处为一甲氧基碳信号,δ20.4处为一甲基碳信号,另δ82.4,80.0,74.9,72.8,71.7,62.9处给出一组向高场位移的葡萄糖碳信号,由此可判定该葡萄糖与母核形成碳苷。综合以上信息将1HNMR,13CNMR数据与文献[5]进行比对,可见δ105.2(C-8)向低场移动,可判断甲氧基连在7位,故可推断该化合物为7-methoxyl-5-hydroxy-2-methylchromone-8-C-β-D-glucopyranoside,即7-甲氧基-异双花母草素。表9化合物53的1H-(400MHzinCD3OD)及13C-NMR(100MHzinCD3OD)数据实施例11:药效学研究竹叶青酒进行不同损伤类型的小鼠急性肝损伤保护作用研究及对正常及免疫力低下小鼠的免疫调节作用研究。其保护肝损伤及免疫增强的数据如下,说明竹叶青酒中发挥保护肝损伤及免疫增强作用的有效成分为现有技术中的有效成分:萜类,环烯醚萜类,黄酮及黄酮苷类,色原酮类化合物,酚酸及酚苷类,芳香类,奎尼酸类,香豆素类,木脂素类,甾体类,生物碱类,呋喃酮类,糠醛类,长链脂肪酸类化合物中的任意一类。四氯化碳致小鼠化学性肝损伤保护作用研究其保护四氯化碳所致肝损伤的数据如下表:1对CCl4致肝损伤小鼠脏器系数的影响与正常组比较,模型组肝损伤小鼠的肝脏系数、脾脏系数及肾脏系数均有升高,但无显著性差异。与模型组相比,竹叶青酒A-D组的肝脏系数、脾脏系数及肾脏系数均有所降低,但无显著性差异。表10竹叶青酒母液对CCl4致肝损伤小鼠肝脏系数、脾脏系数及肾脏系数的影响注:*与模型组对比,P<0.05;#与空白组对比,P<0.052对血清AST、ALT、NO的影响CCl4模型组与正常组相比,血清ALT、AST水平显著升高(P<0.01),血清NO含量显著升高(P<0.01)。表明本试验造模成功;与模型组相比,竹叶青酒母液A-C组表现出较好的活性(P<0.01,P<0.05),尤以B组较佳。D组血清AST、ALT水平与模型组相比有所减低,但无显著性差异。与模型组比较,A-D组血清NO含量显著性降低(P<0.01,P<0.05),F组无显著性差异。以上结果表明竹叶青酒母液对CCl4所导致的小鼠急性肝损伤的保护作用可能是基于降酶,抗炎方面。结果见表11。表11竹叶青酒母液对CCl4致肝损伤小鼠血清ALT、AST、NO的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.013对肝组织中T-AOC、GSH-PX的影响CCl4模型组与正常组比较,肝组织T-AOC、GSH-PX含量显著降低(P<0.01),表明本试验造模成功;与模型组相比,竹叶青酒母液A-D组肝组织GSH-PX含量均显著升高(P<0.01,P<0.05);竹叶青酒母液B组中肝组织T-AOC含量显著升高(P<0.05)。表明竹叶青酒母液可提高CCl4致肝损伤小鼠的抗氧化能力。结果见表12。表12竹叶青酒母液对CCl4致肝损伤小鼠肝组织中T-AOC、GSH-PX的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01,#为与空白组对比,P<0.05.4对肝组织中SOD、MDA的影响CCl4模型组与正常组比较,肝组织SOD活性显著降低(P<0.01),脂质过氧化产物MDA含量显著升高(P<0.05),表明本试验造模成功。与模型组相比,竹叶青酒母液A-D组肝组织SOD活性均显著升高(P<0.01,P<0.05);B、C组脂质过氧化产物MDA含量显著下降(P<0.05)。表明竹叶青酒母液可降低CCl4所致小鼠的脂质过氧化产物,具有一定的保护作用。结果见表13。表2-413竹叶青酒母液对CCl4致肝损伤小鼠肝组织中SOD、MDA的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01,#为与空白组对比,P<0.05.5对肝组织病理变化的影响由组织病理学变化可知,正常对照组肝细胞以中央静脉为中心呈放射状排列,结构正常;而CCl4模型组能观察到严重的病理组织变化,例如:肝中心小叶坏死、巨噬细胞、气球样变形和大量的炎性细胞浸润;复方益肝灵组和竹叶青母液A-D剂量组能显著改善这种肝组织病理变化,结果见图6。硫代乙酰胺致小鼠化学性肝损伤保护作用研究1竹叶青酒母液对硫代乙酰胺致肝损伤小鼠脏器系数的影响与正常组比较,TAA模型组肝损伤小鼠的胸腺系数显著性降低(P<0.01),肝脏系数有所升高,但无显著性差异,脾脏系数、肾脏系数无显著性差异。与模型组相比,竹叶青酒母液A-D各剂量组的胸腺系数及脾脏系数均无显著性差异,竹叶青酒母液C组的肝脏系数显著性降低(P<0.05),各剂量组的肾脏系数无显著性差异。阳性药益肝灵组与模型组比较,胸腺系数、脾脏系数、肝脏系数、肾脏系数均无显著性差异。结果见表14。表14竹叶青酒母液对TAA致肝损伤小鼠胸腺系数、脾脏系数、肝脏系数、肾脏系数的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01.2对血清AST、ALT、TBIL的影响TAA模型组与正常组相比,血清ALT、AST、TBIL水平显著升高(P<0.01)。表明本试验造模成功;与模型组相比,竹叶青酒母液B-D组ALT水平显著性降低(P<0.01,P<0.05)。A-D各剂量组AST、TBIL水平显著性降低(P<0.05,P<0.01)。表明竹叶青酒母液对TAA所导致的小鼠肝损伤具有一定的保护作用。阳性药益肝灵组与模型组比较血清ALT、TBIL水平均显著性降低(P<0.05,P<0.01),结果见表15。表15竹叶青酒母液对TAA致肝损伤小鼠血清ALT、AST、TBIL的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01.3对肝组织中GSH、T-AOC的影响TAA模型组与正常组比较,肝组织GSH、T-AOC含量均显著降低(P<0.01),肝组织SOD活性显著降低(P<0.01),脂质过氧化产物MDA含量显著升高(P<0.01),表明本试验造模成功;与模型组相比,竹叶青酒母液A-D组肝组织GSH含量均显著升高(P<0.01,P<0.05),SOD活性均显著升高(P<0.01,P<0.05);B-D各剂量组脂质过氧化产物MDA含量显著下降(P<0.01,P<0.05),T-AOC含量显著升高(P<0.01,P<0.05)。表明竹叶青酒母液可提高TAA致肝损伤小鼠的抗氧化能力。结果见表16。表16竹叶青酒母液对TAA致肝损伤小鼠肝组织中GSH、T-AOC、SOD、MDA的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01.4病理组织学结果病理组织结果分析,正常对照组:肝细胞以中央静脉为中心呈放射状排列,肝小叶、肝板结构正常,无明显炎细胞浸润,肝细胞无变性、坏死等形态学改变。模型对照组:以中心静脉为中心,周围肝组织出现片灶状坏死,平均每个高倍视野14个,坏死部位有不同程度的炎细胞浸润,大片肝组织肝细胞肿大,胞浆疏松化,部分肝窦扩张,汇管区有少量细胞浸润。竹叶青酒母液A-D组:与模型组相比,肝组织坏死灶仍为片灶状坏死,但面积变小,呈点、小片灶状坏死,坏死部位有不同程度的炎细胞浸润,部分肝组织肝肝细胞肿大,胞浆疏松化,肝窦未见明显扩张,汇管区有少量炎细胞浸润,B、D组改善病变较为明显。复方益肝灵组:部分血管周围肝组织出现点状坏死,平均每个高倍视野3个,坏死灶可见炎细胞浸润,被膜下肝组织肝细胞肿大,胞浆疏松化,肝窦未见明显扩张,汇管区有少量炎细胞浸润,见图7。乙醇致小鼠酒精性肝损伤保护作用研究1动物行为观察所有小鼠在灌胃酒精前,均正常饮食饮水,皮毛光泽柔顺,健康活泼,体重有不同程度增加。模型组和各药物组灌胃酒精后,大都站立不稳,行走歪斜,不久醉卧,几小时后自动醒转,但饮食和饮水量都有所减少,皮毛失去光泽,精神萎靡不振,大便呈黑色,有恶臭,体重下降。药物组的动物状态优于模型组。2对酒精所致急性肝损伤小鼠脏器系数的影响与正常组相比,模型组的肝脏系数明显增大,各药物治疗组都可以显著降低肝脏系数,且呈剂量依赖性,其中竹叶青酒母液C、D两组可显著降低肝脏的肿大(P<0.01,P<0.05),推测药物组可以减轻肝脏的水肿和充血。模型组的脾脏系数相比于正常组,有一定的增加,提示酒精性引起的肝损伤中脾脏也可能出现了水肿和充血,导致质量增加,各药物治疗组和联苯双酯组可以不同程度的降低脾脏系数,但没有显著性差异。具体数据见表17。表17竹叶青酒母液对酒精致肝损伤小鼠胸腺系数、脾脏系数、肝脏系数和肾脏系数的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01.3对血清AST、ALT、TBIL的影响酒精模型组与正常组相比,血清ALT、AST、TBIL水平显著升高(P<0.01)。表明本试验造模成功;与模型组相比,竹叶青酒母液A-D组表现出较好的活性(P<0.01,P<0.05),尤以B组较佳。表明竹叶青酒母液对酒精所导致的小鼠急性肝损伤血清转氨酶的升高具有一定的降低作用。结果见表18。表18竹叶青酒母液对酒精致肝损伤小鼠血清ALT、AST、TBIL的影响注:**与模型组对比,P<0.01;##为与空白组对比,P<0.01.4对肝组织中GSH、T-AOC、SOD、MDA的影响酒精模型组与正常组比较,肝组织T-AOC、SOD、GSH含量显著降低(P<0.01,P<0.05),脂质过氧化产物MDA的含量显著升高(P<0.01),表明本试验造模成功;与模型组相比,竹叶青酒母液B、C组肝组织GSH含量均显著升高(P<0.01,P<0.05);C组肝组织T-AOC含量均显著升高(P<0.05);竹叶青酒母液A-D组中肝组织SOD含量显著升高(P<0.01,P<0.05);A-D组脂质过氧化产物MDA含量显著降低,表明竹叶青酒母液可提高酒精致肝损伤小鼠的抗氧化能力,降低脂质过氧化产物的含量。结果见表19。表19竹叶青酒母液对酒精致肝损伤小鼠肝组织中GSH、T-AOC、SOD、MDA的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01,#为与空白组对比,P<0.05.5对肝组织病理变化的影响从病理组织切片结果来看,正常对照组肝小叶结构正常,无炎细胞浸润,肝细胞以中央静脉为中心呈放射状排列,肝细胞无变性、坏死等形态学改变。模型对照组中心静脉周围肝组织出现片灶状坏死,坏死部位有不同程度的炎细胞浸润,大片肝组织肝细胞肿大,胞浆疏松化,部分肝窦扩张,汇管区有少量细胞浸润。竹叶青酒母液A-D组,与模型组相比,肝组织坏死灶面积缩小,呈点、小片灶状坏死,坏死部位有不同程度的炎细胞浸润,部分肝组织肝肝细胞肿大,胞浆疏松化,肝窦未见明显扩张,汇管区有少量炎细胞浸润,C组改善病变较为明显。联苯双酯阳性对照组,部分血管周围肝组织出现点状坏死,坏死灶可见炎细胞浸润,被膜下肝组织肝细胞肿大,胞浆疏松化,肝窦未见明显扩张,汇管区有少量炎细胞浸润,见图8。6对TNF-α表达的影响实验结果显示,正常对照组肝细胞胞浆中无TNF-α的表达,模型组小鼠肝组织汇管区及肝窦旁肝细胞胞浆中表达显著增强。各剂量竹叶青酒母液组具有明显减少TNF-α在肝组织表达的作用,与模型组比较,C、D组小鼠肝组织TNF-α表达差异均有显著的统计学意义,见图9。7对Fas和FasL表达的影响研究表明,Fas系统介导的细胞凋亡是肝病发生发展的重要机制之一。肝病病毒在肝细胞表面表达可能一方面刺激肝细胞大量表达Fas。另一方面激活肝内细胞毒性T细胞CTL大量表达FasL,两者结合导致细胞凋亡。正常的肝脏一般没有Fas/FasL的表达,或有少量Fas表达。Fas阳性表达主要在胞浆、部分在胞膜表达,阳性肝细胞主要存在于小叶周围碎屑样坏死区,Fas表达与炎症活动度相关联。本研究用免疫组织化学染色发现,正常小鼠肝脏无Fas和FasL的表达;模型组肝组织Fas、FasL表达均明显增高,呈广泛弥漫性表达,在淋巴细胞浸润区周围明显。Fas抗原主要表达于肝细胞浆内,棕黄色颗粒,弥漫而不规则,肝细胞表面及肝窦内皮细胞表面也有表达:FasL表达主要以胞浆为主,少数以胞膜为主,主要集中于中央静脉周围,同时在肝小叶中也有大量分布。经竹叶青酒母液预处理后,小鼠肝组织损伤减轻,Fas及FasL抗原阳性细胞数均减少,其中C组效果最为明显,与模型组比较有极显著的统计学意义(P<0.01),提示竹叶青酒母液可通过抑制Fas/FasL的表达,达到阻断CTL对肝细胞的杀伤,阻断酒精诱导的肝细胞凋亡,见图10,图11。8对Bcl-2/Bax表达的影响Bcl-2与Bax免疫组织化学表达结果显示,Bcl-2在正常组高表达,模型组低表达,Bax与之相反,在正常组低表达,模型组高表达。而竹叶青酒母液及阳性对照组Bcl-2表达较模型组增强,Bax表达较模型组减弱,提示药物可通过上调抗凋亡蛋白Bcl-2及下调促凋亡蛋白Bax的表达来发挥抗凋亡作用的,见图12,图13。醋氨酚致小鼠药物性肝损伤保护作用研究1对醋氨酚致肝损伤小鼠脏器系数的影响与正常组比较,AP模型组肝损伤小鼠的胸腺系数显著性降低(P<0.01),肝损伤小鼠的肝脏系数显著升高(P<0.05),脾脏系数显著性升高(P<0.01),肾脏系数无显著性差异。与模型组相比,竹叶青酒母液A-D各剂量组的胸腺系数有所升高,但无显著差异;竹叶青酒母液B、C组的肝脏系数显著性降低(P<0.05);竹叶青酒母液A-D组的脾脏系数均显著性降低(P<0.01);各剂量组的肾脏系数无显著性差异。阳性药联苯双酯组与模型组比较,胸腺系数有所升高,但无显著性差异,脾脏系数显著性降低(P<0.01)。结果见表20。表20竹叶青酒母液对醋氨酚致肝损伤小鼠胸腺系数、脾脏系数、肝脏系数及肾脏系数的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01.2对血清AST、ALT、TBIL的影响AP模型组与正常组相比,血清ALT、AST、TBIL水平显著升高(P<0.01)。表明本试验造模成功;与模型组相比,竹叶青酒母液B、C剂量组的ALT水平显著降低(P<0.05,P<0.01),竹叶青酒母液A-D各剂量组的AST、TBIL水平均显著降低(P<0.01),表明竹叶青酒母液对AP所导致的小鼠药物性肝损伤具有保护作用。阳性药联苯双酯组与模型组比较,血清AST、TBIL水平显著降低(P<0.01),结果见表21。表21竹叶青酒母液对AP致肝损伤小鼠血清ALT、AST、TBIL的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01.3对肝组织中GSH、T-AOC、SOD、MDA的影响AP模型组与正常组比较,肝组织GSH、T-AOC含量显著降低(P<0.01),肝组织SOD活性显著降低(P<0.01),脂质过氧化产物MDA含量显著升高(P<0.01),表明本试验造模成功。与模型组相比,竹叶青酒母液B-D各剂量组肝组织GSH、T-AOC含量均显著升高(P<0.05、P<0.01),竹叶青酒母液A-D各剂量组肝组织SOD活性均显著升高(P<0.01),脂质过氧化产物MDA含量显著下降(P<0.05、P<0.01),表明竹叶青酒母液可提高AP致肝损伤小鼠的抗氧化能力,清除肝损伤过程中产生的脂质过氧化产物MDA,对药物性肝损伤具有一定的保护作用。阳性药联苯双酯组与模型组比较,肝组织中GSH、T-AOC含量显著升高(P<0.05,P<0.01),SOD活性均显著升高(P<0.01),脂质过氧化产物MDA含量显著下降(P<0.01)。结果见表22。表22竹叶青酒母液对醋氨酚致肝损伤小鼠肝组织中GSH、T-AOC、SOD、MDA的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01.ConA致小鼠免疫性肝损伤保护作用研究1试验动物一般状况用ConA成功诱导ICR小鼠建立急性肝损伤模型。模型组小鼠尾静脉注射ConA(20mg/kg)4h后,自主活动明显减少,无反抗,精神萎靡,蜷缩于笼内,对外界声光刺激不灵敏,觅食较少,尿液黄,个别小鼠毛发直立,但8h内无死亡。2对ConA致肝损伤小鼠脏器系数的影响与正常组比较,ConA模型组肝损伤小鼠的胸腺系数显著性降低(P<0.01),脾脏系数、肝脏系数显著性升高(P<0.01),肾脏系数无显著性差异。与模型组相比,竹叶青酒母液B、C两组的胸腺系数显著性升高(P<0.01),竹叶青酒母液A-D组的脾脏系数均显著性降低(P<0.01);竹叶青酒母液A-D各剂量组的肝脏系数均显著性降低(P<0.01),各剂量组的肾脏系数无显著性差异。阳性药联苯双酯组与模型组比较,胸腺系数有所升高,但无显著性差异,脾脏系数显著性降低(P<0.01)。结果见表23。表23竹叶青酒母液对ConA致肝损伤小鼠胸腺系数、脾脏系数、肝脏系数及肾脏系数的影响注:**与模型组对比,P<0.01;##为与空白组对比,P<0.01.3对血清AST、ALT、TBIL的影响实验结果显示,尾静脉注射ConA8小时后与正常组相比,ConA模型组血清ALT、AST、TBIL水平显著升高(P<0.01),表明本试验造模成功。与模型组相比,竹叶青酒母液B、C两组的ALT水平显著性降低组(P<0.05,P<0.01),A、D两组的ALT水平无显著性差异;竹叶青酒母液A-D组的AST、TBIL水平均显著性降低(P<0.01),试验结果表明竹叶青酒母液对ConA所导致的小鼠肝损伤具有保护作用。与模型组比较,阳性药组血清AST、TBIL水平显著降低(P<0.05,P<0.01),结果见表24。表24竹叶青酒母液对ConA致肝损伤小鼠血清ALT、AST、TBIL的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01.4对肝组织中GSH、T-AOC、SOD、MDA的影响ConA模型组与正常组比较,肝组织GSH、T-AOC含量均显著降低(P<0.01),肝组织SOD活性显著降低(P<0.01),脂质过氧化产物MDA含量显著升高(P<0.01),表明本试验模型成功。与模型组相比,竹叶青酒母液A-D组肝组织GSH、T-AOC含量均显著升高(P<0.05,P<0.01),SOD活性均显著升高(P<0.01);肝组织脂质过氧化产物MDA含量显著下降(P<0.01),表明竹叶青酒母液对ConA所致小鼠免疫性肝损伤具有一定的保护作用。阳性药组与模型组比较,GSH、T-AOC含量显著升高(P<0.01),SOD活性均显著升高(P<0.01);脂质过氧化产物MDA含量显著下降(P<0.01)。结果见表25。表25竹叶青酒母液对ConA致肝损伤小鼠肝组织中GSH、T-AOC、SOD、MDA的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01.免疫增强活性研究1对正常及免疫力低下的小鼠体重、胸腺系数及脾脏系数的影响与正常组相比,模型组小鼠的体重、胸腺系数及脾脏系数均明显降低(P<0.01,P<0.05),尤其胸腺系数降低最为显著(P<0.01),提示环磷酰胺所致免疫力低下模型造模成功。与正常组相比,正常小鼠在给予竹叶青母液后,各组小鼠的体重、胸腺系数及脾脏系数并没有显著性差异。与模型组相比,竹叶青酒A-F组的免疫力低下小鼠的胸腺系数显著升高(P<0.01,P<0.05);A、B两组的脾脏系数显著升高(P<0.05);而免疫力低下小鼠的体重与模型组比较无显著性差异,结果见表26。表26竹叶青酒母液对正常及免疫力低下小鼠体重、胸腺系数及脾脏系数的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01,#为与空白组对比,P<0.05.2对正常及免疫力低下的小鼠肝脏系数及肾脏系数的影响与正常组相比,模型组小鼠肝脏系数升高,但无显著性差异;肾脏系数升高呈现显著性差异(P<0.05)。正常小鼠给予竹叶青酒母液后,其肝脏、肾脏系数与正常组比较无显著性差异。与模型组相比,免疫力低下小鼠的肝脏、肾脏系数均显著降低(P<0.01,P<0.05),结果见表27。表27竹叶青酒母液对正常及免疫力低下小鼠肝脏、肾脏系数的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;#为与空白组对比,P<0.05.3对血清IFN-γ、IL-6及LSZ的影响模型组与正常组比较,血清中IL-6、IFN-γ含量显著下降(P<0.01),说明本试验造模成功。正常小鼠在给予A-F剂量组的竹叶青酒母液后,与正常组比较,除E、F组外,其余各剂量组血清IL-6、IFN-γ含量均有所升高。其中,竹叶青酒母液A、B组的IL-6含量升高较为显著(P<0.01),其余组无显著性差异。此外,环磷酰胺致免疫力低下小鼠在给予A-F剂量组的竹叶青酒母液后,与模型组比较,各剂量组血清IL-6、IFN-γ含量均有所升高。其中,A-D剂量组血清IL-6、IFN-γ含量与模型组比较具有显著性差异(P<0.01)。以上数据说明竹叶青酒母液可增强正常及免疫力低下小鼠的细胞因子IL-6、IFN-γ的分泌,从而增强自身免疫力,结果见表3-3。另外,血清溶菌酶是由巨噬细胞合成并能迅速释放到细胞外的一种重要水解酶,是机体防御的一种重要的非特异性免疫因子。本实验评价了ZYQL对小鼠血清溶菌酶活性的影响,结果见表28,与正常组相比,小鼠单独灌胃竹叶青酒母液200mg/kg和400mg/kg,血清溶菌酶活力有不同程度的提高,具有显著性差异(P<0.05,P<0.01),而单独给予竹叶青酒母液50mg/kg和100mg/kg剂量时,血清溶菌酶活力无显著性差异;腹腔注射Cy后,与正常对照组相比,血清溶菌酶活力显著降低(P<0.01);与Cy组相比,ZYQL+Cy各剂量组血清溶菌酶活力均有不同程度的提升(P<0.05,P<0.01),其中200mg/kg的竹叶青酒母液配合Cy的作用极显著(P<0.01)。表28竹叶青酒母液对正常及免疫力低下小鼠血清中IFN-γ、IL-6及LSZ含量的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.014对脾组织中SOD、GSH-PX、CAT的影响模型组与正常组比较,脾组织中GSH-PX、CAT含量及SOD的活性,均显著降低(P<0.01),说明本试验免疫低下模型造模成功。正常小鼠在灌胃给于不同浓度的竹叶青酒母液(A-F组)后,脾组织中,GSH-PX、CAT含量及SOD的活性显著升高(P<0.01,P<0.05),说明竹叶青酒能提高正常小鼠体内氧化抗氧化酶活性,从而增强小鼠机体免疫力。由表29可知,竹叶青母液B、C组较其他组别效果明显。另外,竹叶青酒母液亦能够提高环磷酰胺所致免疫力低下小鼠体内的GSH-PX、CAT含量及SOD的活性,与模型组相比,具有显著性差异(P<0.01,P<0.05),结果见表29。表29竹叶青酒母液对正常及免疫力低下小鼠脾组织中SOD、GSH-PX、CAT的影响注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;##为与空白组对比,P<0.01,#为与空白组对比,P<0.05.5竹叶青酒母液对小鼠单核吞噬细胞系统吞噬功能的影响(碳粒廓清)注射Cy(100mg/kg)后,Cy组与正常对照组相比,小鼠碳粒廓清指数显著降低。与正常组比较,单独给予400mg/kg的竹叶青酒母液,可使小鼠碳粒廓清指数升高(P<0.05)。与模型组相比,100mg/kg、200mg/kg、400mg/kg的竹叶青酒母液均可对抗Cy造成的免疫抑制,可显著提高碳粒廓清指数(P<0.05,P<0.01),结果见表30。表30竹叶青酒母液对小鼠单核吞噬细胞系统吞噬功能的影响(n=10)注:**与模型组对比,P<0.01,*与模型组对比,P<0.05;#为与空白组对比,P<0.05.实施例12:生物活性研究本发明中有效单体化学成分化合物1-78中任意一种化合物进行抗炎、抗胆碱酯酶、体外肝细胞保护作用研究。研究结果表明,竹叶青酒中发挥抗炎、抗胆碱酯酶、体外肝细胞保护作用的有效成分为本发明中所涉及的化合物1-78中的任意一种。其抗炎、抗胆碱酯酶、体外肝细胞保护作用结果如下表31:表31各单体化合物体外抗炎、抗胆碱酯酶以及体外肝细胞保护活性a各单体化合物浓度为50μΜ.b肝保护活性阳性对照组.c抗炎活性阳性对照组.d抗AChE活性对照组.参考文献[1]Straubinger,M.,Bau,B.,Eckstein,S.,Fink,M.,Winterhalter,P..IdentificationofnovelglycosidicaromaprecursorsinSaffron(CrocussativusL.).JAgricFoodChem.1998,46,3238-3243.[2]QuanChengChen,UiJoungYoun,Byung-SunMin,andKiHwanBae,PyronaneMonoterpenoidsfromtheFruitofGardeniajasminoides,J.Nat.Prod.2008,71,995-999.[3]Kai,N.K..ShinJikkenKagakuKoza13,Yukikozo(Ⅱ),Maruzen,Tokyo,1977,pp.821-830.[4]Yu,Y.,Xie,Z.L.,Gao,H.,Ma,W.W.,Dai,Y.,Wang,Y.,ZhongY.,Yao,X.S.,BioactiveIridoidGlucosidesfromtheFruitofGardeniajasminoides.JournalofNaturalProducts2009,72,1459-1464.[5]Okamurα,N.,Hine,N.,Tateyamα,Y.,Nakazawα,M.,Fujiokα,T.,Mihashi,K.,Yagi,A.,FivechromonesfromAloeVeraleaves,Phytochemistry,1998,49,219-223.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1