一种新的败血症多肽及其在败血症诊断中的应用的制作方法
本发明属于医学诊断治疗
技术领域:
,具体地,本发明涉及来自DcR3的多肽及其衍生物在败血症治疗中的应用及应用这一治疗所需的血中DcR3作为一种新的败血症诊断指标。
背景技术:
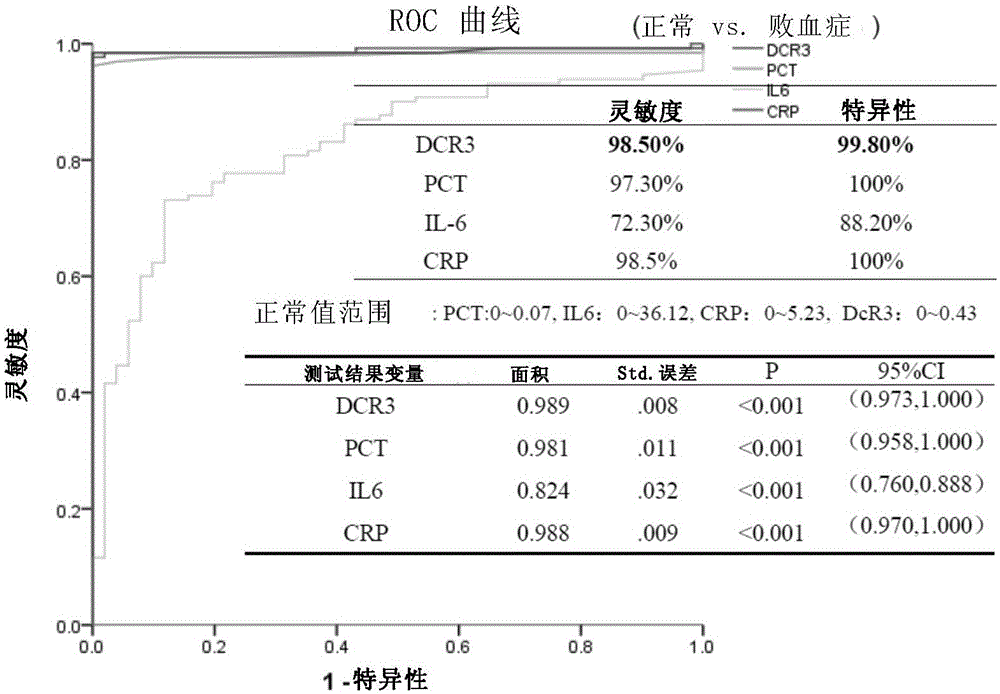
:败血症是致病菌入血的严重感染性疾病。入血的致病菌以每20分钟一代的惊人速度繁殖生长,快速扩散,可在数小时内发展为感染性休克、弥散性血管内凝血(DIC)和多器官衰竭,死亡率达25-46%,故为临床急重症。早期正确诊断及有效治疗是抢救患者的关键。败血症的病理生理机制是致病菌及其毒素入血后激活炎症反应细胞(免疫细胞、血管内皮细胞、血小板等),使其大量释放炎症介质而引起的强烈的全身应激反应。已明确,病原体可激发大量的炎症介质,如IL1-b,IL6(白细胞介素),TNF-a(肿瘤坏死因子-a),FasL,LIGHT和TL1A(TNF-likemolecule1A),IFN-r(干扰素-r),CRP(C反应蛋白),花生四烯酸代谢产物,PAF(血小板活化因子),蛋白酶,凝血恶烷和氧自由基等促炎和促凋亡因子,这些因子直接导致畏冷,发热,心跳加快,呼吸急促,血压降低等临床症状。全身炎症反应综合征(systemicinflammatoryresponsesyndrome,SIRS)是因非感染病因(如烧伤、创伤、手术、胰腺炎以及缺血一再灌注等多种因素)作用于机体而引起的机体失控的自我持续放大和自我破坏的全身无菌性炎症反应。败血症和SIRS临床症状极为相似,都有高热、心跳、呼吸加快、血压下降等,但是在治疗方面有所不同,败血症最重要的是要用抗菌素控制感染及生物制剂控制机体的过度反应,在感染没有控制前不能用激素(以防加重感染),而SIRS则应使用激素,因此二者治疗上的截然不同决定了鉴别诊断非常重要。目前败血症的实验室诊断的金标准是细菌培养,但细菌培养需时间较长,不能满足对急危重败血症诊疗的需要。C反应蛋白(CRP)和IL-6亦用于败血症的辅助诊断,但二者在SIRS时也都明显增高,难以区分感染性和非感 染性的。因此,本领域迫切需要开发高特异性和灵敏度的鉴别感染和非感染性炎症的标志物,并找到更有效的治疗感染性炎症,尤其是败血症的药物。技术实现要素:本发明第一方面,提供了一种分离的多肽或其药学上可接受的盐,所述的多肽具有下式所示的结构:[Xaa0]-[Xaa1]-[Xaa2]-[Xaa3]-[Xaa4]-[Xaa5]-[Xaa6]-[Xaa7]-[Xaa8]-[Xaa9]-[Xaa10]-[Xaa11]-[Xaa12]-[Xaa13]-[Xaa14]-[Xaa15]-[Xaa16]-[Xaa17]-[Xaa18]-[Xaa19]-[Xaa20]-[Xaa21]-[Xaa22]-[Xaa23]-[Xaa24]-[Xaa25]-[Xaa26]-[Xaa27]-[Xaa28]-[Xaa29]-[Xaa30]-[Xaa31]-[Xaa32]-[Xaa33]-[Xaa34]-[Xaa35]-[Xaa36]-[Xaa37]-[Xaa38]-[Xaa39]-[Xaa40]Xaa0是无,或1-3个氨基酸构成肽段;Xaa1是选自下组的氨基酸:Tyr、Trp、Phe、Thr或Ser;Xaa2是选自下组的氨基酸:Leu、Ile、Val、Met、Ala或Phe;Xaa3是选自下组的氨基酸:Glu或Asp;Xaa4是选自下组的氨基酸:Arg、Lys、Gln或Asn;Xaa5是选自下组的氨基酸:Arg或Lys;Xaa6是选自下组的氨基酸:Arg、Lys、Gln或Asn;Xaa7是选自下组的氨基酸:Arg或Lys;Xaa8是选自下组的氨基酸:Cys或Ser;Xaa9是选自下组的氨基酸:Asn、Gln、His、Lys或Arg;Xaa10是选自下组的氨基酸:Val、Ile、Leu、Met、Phe或Ala;Xaa11是选自下组的氨基酸:Leu、Ile、Val、Met、Ala或Phe;Xaa12是选自下组的氨基酸:Cys或Ser;Xaa13是选自下组的氨基酸:Gly、Pro或Ala;Xaa14是选自下组的氨基酸:Gly或Ala;Xaa15是选自下组的氨基酸:Arg、Lys、Gln或Asn;Xaa16是选自下组的氨基酸:Arg或Lys;Xaa17是选自下组的氨基酸:Glu或Asp;Xaa18是选自下组的氨基酸:Glu或Asp;Xaa19是选自下组的氨基酸:Ala、Val、Leu或Ile;Xaa20是选自下组的氨基酸:Arg、Lys、Gln或Asn;Xaa21是选自下组的氨基酸:Arg或Lys;Xaa22是选自下组的氨基酸:Cys或Ser;Xaa23是选自下组的氨基酸:His、Asn、Gln、Lys或Arg;Xaa24是选自下组的氨基酸:Ala、Val、Leu或Ile;Xaa25是选自下组的氨基酸:Thr或Ser;Xaa26是选自下组的氨基酸:His、Asn、Gln、Lys或Arg;Xaa27是选自下组的氨基酸:Asn、Gln、His、Lys或Arg;Xaa28是选自下组的氨基酸:Arg、Lys、Gln或Asn;Xaa29是选自下组的氨基酸:Arg或Lys;Xaa30是选自下组的氨基酸:Cys或Ser;Xaa31是选自下组的氨基酸:Arg、Lys、Gln或Asn;Xaa32是选自下组的氨基酸:Arg或Lys;Xaa33是选自下组的氨基酸:Arg、Lys、Gln或Asn;Xaa34是选自下组的氨基酸:Arg或Lys;Xaa35是选自下组的氨基酸:Gly、Pro或Ala;Xaa36是选自下组的氨基酸:Gly或Ala;Xaa37是选自下组的氨基酸:Phe、Leu、Val、Ile、Ala或Tyr;Xaa38是选自下组的氨基酸:Ala、Val、Leu或Ile;Xaa39是选自下组的氨基酸:His、Asn、Gln、Lys或Arg;Xaa40是无,或1-3个氨基酸构成肽段。在另一优选例中,Xaa40为Cys。在另一优选例中,所述的多肽具有下式所示的结构:[Xaa0]-[Xaa1]-[Xaa2]-[Xaa3]-[Xaa4]-[Xaa5]-[Xaa6]-[Xaa7]-[Xaa8]-[Xaa9]-[Xaa10]-[Xaa11]-[Xaa12]-[Xaa13]-[Xaa14]-[Xaa15]-[Xaa16]-[Xaa17]-[Xaa18]-[Xaa19]-[Xaa20]-[Xaa21]-[Xaa22]-[Xaa23]-[Xaa24]-[Xaa25]-[Xaa26]-[Xaa27]-[Xaa28]-[Xaa29]-[Xaa30]-[Xaa31]-[Xaa32]-[Xaa33]-[Xaa34]-[Xaa35]-[Xaa36]-[Xaa37]-[Xaa38]-[Xaa39]-[Xaa40]Xaa0是无,或1-3个氨基酸构成肽段;Xaa1是选自下组的氨基酸:Tyr或Phe; Xaa2是选自下组的氨基酸:Leu或Ile;Xaa3是选自下组的氨基酸:Glu或Asp;Xaa4是选自下组的氨基酸:Arg或Lys;Xaa5是选自下组的氨基酸:Cys或Ser;Xaa6是选自下组的氨基酸:Arg或Lys;Xaa7是选自下组的氨基酸:Tyr或Phe;Xaa8是选自下组的氨基酸:Cys或Ser;Xaa9是选自下组的氨基酸:Asn或Gln;Xaa10是选自下组的氨基酸:Val或Leu;Xaa11是选自下组的氨基酸:Leu或Ile;Xaa12是选自下组的氨基酸:Cys或Ser;Xaa13是选自下组的氨基酸:Gly或Ala;Xaa14是选自下组的氨基酸:Glu或Asp;Xaa15是选自下组的氨基酸:Arg或Lys;Xaa16是选自下组的氨基酸:Glu或Asp;Xaa17是选自下组的氨基酸:Glu或Asp;Xaa18是选自下组的氨基酸:Glu或Asp;Xaa19是选自下组的氨基酸:Ala或Val;Xaa20是选自下组的氨基酸:Arg或Lys;Xaa21是选自下组的氨基酸:Ala或Val;Xaa22是选自下组的氨基酸:Cys或Ser;Xaa23是选自下组的氨基酸:His或Arg;Xaa24是选自下组的氨基酸:Ala或Val;Xaa25是选自下组的氨基酸:Thr或Ser;Xaa26是选自下组的氨基酸:His或Arg;Xaa27是选自下组的氨基酸:Asn或Gln;Xaa28是选自下组的氨基酸:Arg或Lys;Xaa29是选自下组的氨基酸:Ala或Val;Xaa30是选自下组的氨基酸:Cys或Ser;Xaa31是选自下组的氨基酸:Arg或Lys;Xaa32是选自下组的氨基酸:Cys或Ser;Xaa33是选自下组的氨基酸:Arg或Lys;Xaa34是选自下组的氨基酸:Thr或Ser;Xaa35是选自下组的氨基酸:Gly或Ala;Xaa36是选自下组的氨基酸:Phe或Leu;Xaa37是选自下组的氨基酸:Phe或Leu;Xaa38是选自下组的氨基酸:Ala或Val;Xaa39是选自下组的氨基酸:His或Arg;Xaa40是无,或1-3个氨基酸构成肽段。在另一优选例中,所述的多肽为SEQIDNO.:1所示的多肽。在另一优选例中,所述的多肽为SEQIDNO.:1经过1-8个(较佳地1-5个、更佳地1-3个,最佳地1-2个)氨基酸的取代、缺失或添加形成的,且具有抑制感染性炎症活性衍生多肽。在另一优选例中,所述的多肽为SEQIDNO.:1经过1-3个氨基酸的取代;和/或经过1-2个氨基酸的缺失;和/或所述多肽的两端分别经过1-3个氨基酸的添加形成的,且具有抑制感染性炎症活性的衍生多肽。在另一优选例中,所述的多肽选自下组:(a)具有SEQIDNO.:1所示氨基酸序列的多肽,且所述多肽的长度为32-48个氨基酸;(b)将SEQIDNO.:1所述的氨基酸序列经过1-8个(较佳地1-5个、更佳地1-3个,最佳地1-2个)氨基酸的取代、缺失或添加形成的,具有抑制感染性炎症活性的衍生多肽。在另一优选例中,所述的衍生多肽与SEQIDNO:1的相同性≥80%,较佳地≥90%;更佳地≥95%。在另一优选例中,所述的衍生多肽保留了≥70%的SEQIDNO:1的所示多肽的抑制感染性炎症活性。在另一优选例中,所述的多肽如SEQIDNO.:1(YLERCRYCNVLCGEREEEARACHATHNRACRCRTGFFAH)或2所示(Ac-YLERCRYCNVLCGEREEEARACHATHNRACRCRTGFFAHC-NH2)。在另一优选例中,所述的多肽包括修饰和未修饰的多肽。在另一优选例中,所述多肽为经修饰的多肽。在另一优选例中,所述的修饰包括经酰胺化或乙酰化。在另一优选例中,所述的修饰包括在所述多肽的C端经酰胺化(NH2)修饰;和/或在所述多肽的N端经乙酰化(Ac)修饰。在另一优选例中,本发明还提供了由式I多肽构成的、具有二聚体本发明第二方面,提供了一种分离的多核苷酸,所述的多核苷酸编码本发明第一方面所述的多肽。本发明第三方面,提供了本发明第一方面所述多肽或其衍生多肽的用途,用于制备治疗感染性炎症的药物组合物。在另一优选例中,所述多肽为天然或非天然多肽在另一优选例中,所述的药物组合物含有安全有效量的本发明第一方面所述多肽和药学上可接受的载体。在另一优选例中,所述的药物组合物还可含有抗感染活性成分,如抗生素及炎症抑制因子。在另一优选例中,所述的感染性炎症包括全身感染性炎症、或局部感染性炎症。在另一优选例中,所述全身感染性炎症包括败血症。本发明第四方面,提供了一种药物组合物,所述的药物组合物含有本发明第一方面所述的多肽或其药学上可接受的盐,以及药学上可接受的载体。在另一优选例中,所述的药物组合物还含有抗感染活性成分。在另一优选例中,所述的抗感染活性成分包括抗生素或炎症抑制因子。在另一优选例中,所述的炎症抑制因子包括TNF-α抑制剂。在另一优选例中,所述TNF-α抑制剂包括Pentoxifylline。本发明第五方面,提供了诱捕受体3(DcR3)或其检测试剂的用途,用于制备判断感染性疾病预后的试剂或试剂盒。在另一优选例中,所述感染性疾病包括败血症。在另一优选例中,当样本中测定的DcR3表达量较低,则说明感染性疾病的预后好;当样本中测定的DcR3表达量较高,则说明感染性疾病的预后差。在另一优选例中,所述的样本为血液样本。在另一优选例中,所述的DcR3来源于哺乳动物,较佳地,来源于人类、小鼠或大鼠。本发明第六方面,提供了诱捕受体3(DcR3)以及降钙素原(PCT)或其检测试 剂的用途,用于(I)鉴别诊断SIRS与败血症;和/或(II)诊断败血症的试剂或试剂盒。本发明第七方面,提供了一种败血症检测试剂盒,所述的试剂盒含有:(i)诱捕受体3的检测试剂;(ii)降钙素原的检测试剂;和(iii)使用说明书。在另一优选例中,所述的试剂盒中还可含有内毒素检测试剂。在另一优选例中,所述的检测试剂为定性或定量检测试剂。在另一优选例中,所述的试剂盒中还含有诱捕受体3和/或降钙素原作为阳性对照。在另一优选例中,所述的试剂盒中还可含有白介素-6、急性反应蛋白、细菌、真菌等能够反映病原体入侵血中的检测试剂。在另一优选例中,提供了一种诊断感染性炎症和/或鉴别感染与非感染性炎症的方法,包括步骤:(I)测定样品中的DcR3和PCT含量,并与正常值进行比较;(II)当样品中DcR3和PCT的含量显著高于正常值,则说明提供该样品的对象患有感染性炎症。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1显示血中DcR3在正常人极低,SIRS(全身炎症反应综合征)时轻、中度升高,败血症时高度升高。图2显示血中DcR3对诊断败血症的价值及与PCT、IL-6及CRP的相关与比较。图3显示血中DcR3对败血症与SIRS鉴别诊断的价值及与PCT、IL-6及CRP的相关与比较。图4显示血中DcR3的升高与败血症的严重性(APACHEIIScore)相关性。图5显示尽管血中DcR3在多数情况下,与PCT变化动向是一致的,但在 一些败血症患者,PCT并不升高时血中DcR3已经明显升高,说明二者联合应用可防止漏诊。图6显示血中DcR3在某些病人(约10%)与PCT不一致时,DcR3比PCT更能够反映病情的动态变化,DcR3与临床病情(以体温变化为证)较为一致。图7显示败血症死亡患者血中DcR3的二种动态变化。血中DcR3在死亡患者中的二种变化状况:图7A为不断升高;或图7B为一度极高,而后降低,但仍维持高水平。血中DcR3水平与病情严重程度及转归正相关。图8显示用BiaCore测定DcR3-P1多肽与DcR3配体FasL有亲和力。结果表明,在20ng/ml浓度可见与配体的结合。DcR3与FasL结合的Kd值为271.4+24.4nM28。由此可推测,DcR3-P1有一定的与促凋亡的Fas受体竞争其FasL的生物活性,从而可阻断FasL的诱导凋亡功能。FasL在败血症时大量产生,是败血症病理过程的关键因素,阻断其功能可望减轻败血症症状。图9A显示DcR3-P1多肽能够减轻LPS诱导的败血症症状,并降低败血症死亡率,其中生理盐水对照鼠DIC表现:鼻面部微血管堵塞、淤血、发肿发蓝、萎靡、少动,5只鼠均死于24小时,而实验鼠精神,无DIC表现,仍有2/6存活到>60小时(P=0.024)。图9B显示DcR3-P1多肽能够减轻LPS诱导的败血症DIC(disseminatedintravascularcoagulation,弥散性血管内凝血,尾巴、足部发紫)症状。图10显示DcR3-P1多肽与抗TNF-a的Pentoxifylline联合应用时,败血症的生存率比二者单用的效果更好,呈协同作用。图11显示DcR3-P1多肽通过同时拮抗三个重要凋亡因子(FasL、LIGHT及TL-1A)与它们的凋亡受体结合而诱导细胞死亡,从而产生抗败血症DIC(弥漫性血管内凝血)的生物活性功能。具体实施方式本发明人经过广泛而深入的研究,首次意外地发现,来源于DcR3的多肽作为DcR3的活性部位,能够有效地阻断DcR3与其配体的结合,从而达到有效抗感染性炎症的作用。此外,DcR3还是一个高度特异性、灵敏地指示感染性炎症的标志物。实验发现,当同时采用DcR3和PCT作为标志物时,对感染性炎症的诊断特异性和灵敏度具有协同作用,可强化早期诊断、避免误诊。在此基础上,完成了本发明。诱捕受体3(DcR3)诱捕受体3(DecoyReceptor3,简称DcR3)就是一种体内极为重要应对外来病原菌而激发的抗凋亡因子。DcR3是肿瘤坏死因子受体(TNFR)超家族成员。它有受体的膜外配体结合部位,但缺乏跨膜区,是一种分泌型的蛋白,虽然能结合配体,但不能像其它TNFR膜受体-样转导信号和产生效应(如诱导凋亡),因而称诱捕受体。DcR3的最大特点是它能够在细胞外竞争性地结合至少三种TNF超家族配体:FasL、LIGHT和TL1A,阻止这些因子与它们各自的跨膜受体(Fas,HVEM/LTβR,DR3)结合从而抑制它们诱导细胞凋亡的作用。有文献报道多种生物因子(如TNFa,IL6,EBV病毒等)均可上调DcR3的表达。活性多肽在本发明中,术语“本发明多肽”、“DcR3活性多肽”、“DcR3活性小肽”、“短肽DcR3”或“肽DcR3”可互换使用,都指具有感染性疾病抑制活性的肽DcR3氨基酸序列(YLERCRYCNVLCGEREEEARACHATHNRACRCRTGFFAH,如SEQIDNO:1所示)的蛋白或多肽。此外,所述术语还包括具有抑制感染性疾病功能的、SEQIDNO:1序列的变异形式。这些变异形式包括(但并不限于):1-8个(通常为1-5个,较佳地为1-3个或1-2个,更佳地1个)氨基酸的缺失、插入和/或取代,以及在C末端和/或N末端添加或缺失一个或数个(通常为3个以内,较佳地为2个以内,更佳地为1个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在C末端和/或N末端添加或缺失一个或数个氨基酸通常也不会改变蛋白质的结构和功能,优选地,SEQIDNO.:2所示的多肽即为将SEQIDNO.:1所示的多肽在C末端添加了Cys形成的活性衍生多肽(YLERCRYCNVLCGEREEEARACHATHNRACRCRTGFFAHC)。此外,所述术语还包括单体和多聚体形式本发明多肽。该术语还包括线性以及非线性的多肽(如环肽)。本发明还包括DCR3多肽的活性片段、衍生物和类似物。如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持抑制感染性疾病功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或几个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,或(ii)在一个或 多个氨基酸残基中具有取代基团的多肽,或(iii)DCR3-P1多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(iv)附加的氨基酸序列融合于此多肽序列而形成的多肽(与前导序列、分泌序列或6His等标签序列融合而形成的然后蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。一类优选的活性衍生物指与式I的氨基酸序列相比,有至多3个,较佳地至多2个,更佳地至多1个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表1进行氨基酸替换而产生。表1最初的残基代表性的取代优选的取代Ala(A)Val;Leu;IleValArg(R)Lys;Gln;AsnLysAsn(N)Gln;His;Lys;ArgGlnAsp(D)GluGluCys(C)SerSerGln(Q)AsnAsnGlu(E)AspAspGly(G)Pro;AlaAlaHis(H)Asn;Gln;Lys;ArgArgIle(I)Leu;Val;Met;Ala;PheLeuLeu(L)Ile;Val;Met;Ala;PheIleLys(K)Arg;Gln;AsnArgMet(M)Leu;Phe;IleLeuPhe(F)Leu;Val;Ile;Ala;TyrLeuPro(P)AlaAlaSer(S)ThrThrThr(T)SerSerTrp(W)Tyr;PheTyrTyr(Y)Trp;Phe;Thr;SerPheVal(V)Ile;Leu;Met;Phe;AlaLeu发明还提供DcR3活性多肽的类似物。这些类似物与天然DcR3活性多肽的差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。类似物还包括具有不同于天然L-氨基酸的残基(如D-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的多肽并不限于上述例举的代表性的多肽。修饰(通常不改变一级结构)形式包括:体内或体外的多肽的化学衍生形式 如乙酰化、酰胺化或羧基化。一种更优选的方式是将SEQIDNO.:1所示的多肽,在C端进行酰胺化,和/或在N端进行乙酰化。修饰还包括糖基化,如那些在多肽的合成和加工中或进一步加工步骤中进行糖基化修饰而产生的多肽。这种修饰可以通过将多肽暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的多肽。本发明多肽还可以以由药学上或生理学可接受的酸或碱衍生的盐形式使用。这些盐包括(但不限于)与如下酸形成的盐:氢氯酸、氢溴酸、硫酸、柠檬酸、酒石酸、磷酸、乳酸、丙酮酸、乙酸、琥珀酸、草酸、富马酸、马来酸、草酰乙酸、甲磺酸、乙磺酸、苯磺酸、或羟乙磺酸。其他盐包括:与碱金属或碱土金属(如钠、钾、钙或镁)形成的盐,以及以酯、氨基甲酸酯或其他常规的“前体药物”的形式。编码序列本发明还涉及编码DcR3活性多肽及其衍生多肽(如P1多肽)的多核苷酸。本发明的多核苷酸可以是DNA形式或RNA形式。DNA可以是编码链或非编码链。本发明的DcR3活性多肽核苷酸全长序列或其片段通常可以用PCR扩增法、重组法或人工合成的方法获得。目前,已经可以完全通过化学合成来得到编码本发明多肽(或其片段,或其衍生物)的DNA序列。然后可将该DNA序列引入本领域中已知的各种现有的DNA分子(或如载体)和细胞中。本发明也涉及包含本发明的多核苷酸的载体,以及用本发明的载体或DcR3活性多肽编码序列经基因工程产生的宿主细胞。另一方面,本发明还包括对DcR3活性多肽具有特异性的多克隆抗体和单克隆抗体,尤其是单克隆抗体。制备方法本发明多肽可以是重组多肽或合成多肽。本发明的多肽可以是化学合成的,或重组的。相应地,本发明多肽可用常规方法人工合成,也可用重组方法生产。一种优选的方法是使用液相合成技术或固相合成技术,如Boc固相法、Fmoc 固相法或是两种方法联合使用。固相合成可快速获得样品,可根据目的肽的序列特征选用适当的树脂载体及合成系统。例如,Fmoc系统中优选的固相载体如连接有肽中C端氨基酸的Wang树脂,Wang树脂结构为聚苯乙烯,与氨基酸间的手臂是4-烷氧基苄醇;用25%六氢吡啶/二甲基甲酰胺室温处理20分钟,以除去Fmoc保护基团,并按照给定的氨基酸序列由C端逐个向N端延伸。合成完成后,用含4%对甲基苯酚的三氟乙酸将合成的相关肽从树脂上切割下来并除去保护基,可过滤除树脂后乙醚沉淀分离得到粗肽。将所得产物的溶液冻干后,用凝胶过滤和反相高压液相层析法纯化所需的肽。当使用Boc系统进行固相合成时,优选树脂为连接有肽中C端氨基酸的PAM树脂,PAM树脂结构为聚苯乙烯,与氨基酸间的手臂是4-羟甲基苯乙酰胺;在Boc合成系统中,在去保护、中和、偶联的循环中,用TFA/二氯甲烷(DCM)除去保护基团Boc并用二异丙基乙胺(DIEA/二氯甲烷中和。肽链缩合完成后,用含对甲苯酚(5-10%)的氟化氢(HF),在0℃下处理1小时,将肽链从树脂上切下,同时除去保护基团。以50-80%乙酸(含少量巯基乙醇)抽提肽,溶液冻干后进一步用分子筛SephadexG10或Tsk-40f分离纯化,然后再经高压液相纯化得到所需的肽。可以使用肽化学领域内已知的各种偶联剂和偶联方法偶联各氨基酸残基,例如可使用二环己基碳二亚胺(DCC),羟基苯骈三氮唑(HOBt)或1,1,3,3-四脲六氟磷酸酯(HBTU)进行直接偶联。对于合成得到的短肽,其纯度与结构可用反相高效液相和质谱分析进行确证。在一优选例中,本发明多肽DcR3活性多肽,按其序列,采用固相合成的方法制备,行高效液相色谱纯化,获得高纯度目的肽冻干粉,-20℃贮存。另一种方法是用重组技术产生本发明多肽。通过常规的重组DNA技术,可利用本发明的多核苷酸可用来表达或生产重组的DcR3-P1多肽。一般来说有以下步骤:(1).用本发明的编码DcR3活性多肽的多核苷酸(或变异体),或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;(2).在合适的培养基中培养的宿主细胞;(3).从培养基或细胞中分离、纯化活性多肽。重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的活性多肽。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于: 常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(HPLC)和其它各种液相层析技术及这些方法的结合。由于本发明多肽较短,因此可以考虑将多个多肽串联在一起,重组表达后获得多聚体形式的表达产物。如果需要可通过酶切等方法形成所需的小肽。DcR3活性多肽及其衍生多肽本发明发现,SEQIDNO.:1所示的多肽是DcR3的功能性活性肽区。它能够在细胞外竞争性地结合至少三种TNF超家族配体:FasL、LIGHT和TL1A(TNF-likeligand1A),阻止这些因子与它们各自的促凋亡跨膜受体(Fas,HVEM/LTR,DR3)结合,从而抑制各种细胞(体细胞、淋巴细胞、内皮细胞)的凋亡(图11)。而对SEQIDNO.:1序列进行进一步改进和修饰后的SEQIDNO.:2(DcR3-P1)所示序列,不仅能够起到SEQIDNO.:1所示多肽相似的活性,其纯化更简单,更稳定,活性更强。败血症时,凋亡因子大量表达,与败血症的病理过程及症状发展有密切关系。DcR3活性多肽及其衍生肽通过竞争性结合FasL、LIGHT和TL1A,阻断这些凋亡因子与其各自凋亡受体结合,进而减轻多种细胞凋亡,降低机体对入侵病原体的反应强度,从而减轻临床症状。药物组合物和施用方法另一方面,本发明还提供了一种药物组合物,它含有(a)安全有效量的本发明多肽或其药学上可接受的盐;以及(b)药学上可接受的载体或赋形剂。本发明多肽的数量通常为10微克-100毫克/剂,较佳地为100-1000微克/剂。为了本发明的目的,有效的剂量为给予个体约0.01毫克/千克至50毫克/千克,较佳地0.05毫克/千克至10毫克/千克体重的本发明多肽。此外,本发明的多肽可以单用,也可与其他治疗剂一起使用(如配制在同一药物组合物中)。优选地,所述的治疗剂为抗感染性炎症的活性成分,例如抗生素、TNF-α抑制剂、等。药物组合物还可含有药学上可接受的载体。术语“药学上可接受的载体”指用于治疗剂给药的载体。该术语指这样一些药剂载体:它们本身不诱导产生对接受该组合物的个体有害的抗体,且给药后没有过分的毒性。这些载体是本领域普通技术人员所熟知的。在Remington’sPharmaceuticalSciences(Mack Pub.Co.,N.J.1991)中可找到关于药学上可接受的赋形剂的充分讨论。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、佐剂及其组合。治疗性组合物中药学上可接受的载体可含有液体,如水、盐水、甘油和乙醇。另外,这些载体中还可能存在辅助性的物质,如润湿剂或乳化剂、pH缓冲物质等。通常,可将治疗性组合物制成可注射剂,例如液体溶液或悬液;还可制成在注射前适合配入溶液或悬液中、液体载体的固体形式。一旦配成本发明的组合物,可将其通过常规途径进行给药,其中包括(但并不限于):肌内、静脉内、皮下、皮内或局部给药。待预防或治疗的对象可以是哺乳动物;尤其是人。当本发明的药物组合物被用于实际治疗时,可根据使用情况而采用各种不同剂型的药物组合物。较佳地,可以例举的有静脉注射剂。这些药物组合物可根据常规方法通过混合、稀释或溶解而进行配制,并且偶尔添加合适的药物添加剂,如赋形剂、崩解剂、粘合剂、润滑剂、稀释剂、缓冲剂、等渗剂(isotonicities)、防腐剂、润湿剂、乳化剂、分散剂、稳定剂和助溶剂,而且该配制过程可根据剂型用惯常方式进行。例如,眼药水的配制可这样进行:将短肽DCR3-P1或其药学上可接受的盐与基本物质一起溶解于无菌水(在无菌水中溶解有表面活性剂)中,调节渗透压和酸碱度至生理状态,并可任意地加入合适的药物添加剂如防腐剂、稳定剂、缓冲剂、等渗剂、抗氧化剂和增粘剂,然后使其完全溶解。本发明的药物组合物还可以缓释剂形式给药。例如,短肽DcR3-P1或其盐可被掺入以缓释聚合物为载体的药丸或微囊中,然后将该药丸或微囊通过手术植入待治疗的组织。此外,短肽DcR3-P1或其盐还可通过插入预先涂有药物的眼内透镜而得以应用。作为缓释聚合物的例子,可例举的有乙烯-乙烯基乙酸酯共聚物、聚羟基甲基丙烯酸酯(polyhydrometaacrylate)、聚丙烯酰胺、聚乙烯吡咯烷酮、甲基纤维素、乳酸聚合物、乳酸-乙醇酸共聚物等,较佳地可例举的是可生物降解的聚合物如乳酸聚合物和乳酸-乙醇酸共聚物。当本发明的药物组合物被用于实际治疗时,作为活性成分的短肽DCR3-P1或其药学上可接受的盐的剂量,可根据待治疗的每个病人的体重、年龄、性别、症状程度而合理地加以确定。例如,当皮下、肌肉或静脉注射时,可采用 2-1000mg/kg的剂量,优选为20-500mg/kg,更优选为50-200mg/kg,使用时间为疑似感染性疾病开始时,每天1-2次。当然,具体应用本发明药物组合物的方案也应当由个体病情变化(体温、脉搏、呼吸、血生化指标,DcR3/PCT变化),不断调整治疗方案,以达最佳抗感染疗效。本发明的主要优点如下:(1)本发明提供用抗凋亡的DcR3活性多肽及其衍生多肽治疗败血症的新方法;(2)本发明中所述抗凋亡的DcR3活性多肽及其衍生多肽治疗败血症的新方法可与其它抗败血症的药物(如TNFa拮抗剂,抗菌素、抗炎药物等)协同,提高败血症的抢救效果;(3)本发明提出最佳诊断败血症的方法应为组合监测,如DcR3及PCT、血培养病原体、内毒素等的联合监测,以达到互补效果,提高败血症早期诊断的准确率及临床治疗疗效判断的及时性及正确性。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(NewYork:ColdSpringHarborLaboratoryPress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。实施例1DcR3活性多肽及其P1衍生多肽的合成、分离纯化及鉴定DcR3活性多肽及其P1衍生多肽由商业化多肽合成公司按常规方法合成,用HPLC常规分离纯化,经质谱及HPLC鉴定分子量及纯度。纯度>98%为合格产品,冰冻干燥保存备用。DcR3活性多肽在液体中可由Cys形成二硫键,形成二聚体,经鉴定后纯化二聚体。实施例2DcR3-P1多肽亲和力实验使用BiaCore系统的SPR生物传感技术鉴定所纯化的DcR3活性多肽及DcR3活性多肽二聚体对FasL配体的亲和力。用氨基交联试剂盒将FasL共价交联到CM5 反应片上的金质表面,再让DcR3二聚体以每5ul/分钟速度在10分钟内流过金质表面,洗掉未结合者,通过测定plasmonresonance信号(responseunits,RU)及生物信息分析方法(BIA)评估计算出Kd(解离常数,nM)。结果(图8)表明,在20ng/ml浓度可见与配体的结合。DcR3与FasL结合的Kd值为271.4+24.4nM28。由此可推测,DcR3-P1能够与促凋亡的Fas受体竞争其配体FasL的生物活性,从而可阻断FasL的诱导凋亡功能。FasL在败血症时大量产生,是败血症病理过程的关键因素,阻断其功能可望减轻败血症症状。实施例3DcR3-P1多肽对败血症的抑制作用在细胞水平证实DcR3-P1有一定的抗凋亡功能后,本实验对之进行了小鼠LPS败血症的拮抗的预实验。考虑到吸收及发挥作用时间,DcR3-P10mg/ml(对照组)或10mg/kg/0.2ml盐水(实验组)i.v.注入BALB/c小鼠(6只/组,少量初试),10分钟后,LPS(2mg/kg,E.coli0111:B4,Sigma)腹腔注入各组小鼠,然后观察败血症发展变化。对照组小鼠在数小时内出现全身毛发竖立,萎靡,少动,不食,眼睛无神,微血管堵塞淤血,类似DIC(弥散性血管内凝血)症状明显:鼻面部、耳朵、四肢、尾巴明显青紫,头面部发肿,与实验组鼠的红润、毛发平顺、面尖,眼睛有神相比,明显不同。对照组于6小时开始死亡,14小时剩一半,24小时全死,而实验组在22小时仍有一半存活,有2只能够熬过“cytokninestorm”而不死(P<0.024,图9)。此实验重复2次,结果相似。结论:在用LPS造成的小鼠败血症模型上,DcR3功能性多肽能够增强小鼠对LPS的耐受,减少LPS引起的死亡。与此同时,实验发现DcR3功能性多肽(10mg/kg)与抗TNFa的药物(Pentoxifylline,PTX,50mg/kg)联合使用比DcR3功能性多肽或PTX单独使用有更强的抗LPS诱导对败血症死亡效果(30%or60%vs.100%存活,图10,P<0.05)。这一协同作用的发现为可提高抗败血症疗效,降低LPS引起的死亡提供新途径。DcR3抗败血症的机理与其能够同时拮抗三个重要凋亡因子(FasL、LIGHT及TL-1A)与它们的凋亡受体结合而诱导的细胞死亡,从而产生抗败血症及其DIC(弥漫性血管内凝血)的生物学功能(如图11所示)。实施例4衍生多肽的制备和鉴定根据SEQIDNO.:1的序列,按实施例1中的方法,制备了如下衍生多肽(表2),并经分离纯化并鉴定后获得高纯度的SEQIDNO.:3-12多肽。表2多肽SEQIDNO.:序列DcR3-P23Ac-PIERCRYCNVLCGEREEEARACHATHNRACRCRTGFFAHC-NH2DcR3-P34Ac-YLDKSRYCNVLCGEREEEARACHATHNRACRCRTGFFAHC-NH2DcR3-P45Ac-YLERCRYCNVICGDKEEEARACHATHNRACRSRTGFFAHC-NH2DcR3-P56Ac-YLERCRYCNVLCGEREEEAKVCHATHNRACRCRTGFFAHC-NH2DcR3-P67Ac-YLERCRYCGVLCGEREEEARACHATHGRACRCRTGFFAHC-NH2DcR3-P78Ac-YLERCRYCNVLCGEREEEARACHATHNRACRCRTALLGHC-NH2DcR3-P89Ac-YLERCRYCNVLCGEREEEARACHATHNRACRCRTGFFAHC-NH2DcR3-P910Ac-YLERCRYCNVLCGEREEEARACHATHNRASKSKSGFFAHC-NH2DcR3-P1011Ac-ERCRYCNVLCGEREEDARACHATHNRACRCRTGFFAHC-AcylDcR3-P1112Ac-YLERCRFSNVLCGEREEEARACHATHNRACRCRTGFFAHC-Acyl实施例5衍生多肽对败血症的抑制作用方法同实施例3,结果可见在5-10mg/kg的剂量下,本发明衍生多肽均能够增强小鼠对LPS的耐受,减少LPS引起的死亡。实施例6DcR3与PCT的诊断协同作用采用ELISA法测定DcR3与PCT联用对败血症的诊断作用结果:血中DcR3可在降钙素原(PCT)升高之前升高(表3),可与PCT协同诊断败血症;表3病例检测时间DcR3PCT1血培养日2.0420.072培养后13天1.0010.073血培养日3.470.034血培养日1.2880.075培养前1天7.6430.036培养前1天1.1670.026血培养日2.8280.057血培养日2.3650.027培养后8天8.6210.038血培养日1.2010.029血培养日2.0790.0710血培养日1.7790.0611血培养日1.3410.0512培养后4天2.3290.0712培养后5天0.8780.0413One培养前天1.1670.0314血培养日2.3970.0415培养后9天1.0230.0616培养后2天2.7350.0716培养后4天3.0420.0616培养后6天2.7940.0317培养前2天1.7330.0218培养前1天2.4320.051.血中DcR3的升高可以因内毒素先于病原体入血而检测阳性,有别于正常人及全身炎症反应综合征(SIRS)(图1),与现有败血症的指标如PCT、急性反应蛋白(CRP)、白介素-6(IL-6)有好的相关性(图2,图3),为败血症早期诊断的新指标;2.血中DcR3在无病原体入血前的一般无菌性炎症(如SIRS等)含量较低,一旦病原体入血,则血中DcR3明显升高,可提示SIRS向sepsis(败血症)的转化(图1,图3),对临床从使用激素到使用抗菌素有重要指导意义;3.在约90%的败血症患者,血中DcR3含量的动态变化与PCT有较好一致性(图5)。有约10%的败血症患者,血中DcR3含量的动态变化与PCT不一致,其临床症状变化可与DcR3变化一致。4.动态检测血中DcR3含量,可提示病情的严重性、治疗效果的好坏。血中DcR3降低可提示病情轻、疗效好;反之,病情重、疗效差(图4,表4),对临床及时调整用药有指导意义;病情发展加重时,血中DcR3含量不断升高,为;或血中DcR3含量极度升高但而后又下降。这些变化均可为死亡前奏(表4,图7),提示临床应采取积极的、较强的治疗措施;表4通过建立的DcR3-ELISA检测了134多例细菌培养阳性的败血症血浆标本,结果表明:1)败血症时患者血浆中DcR3明显升高,升高幅度较CRP和IL6明显,与临床上常用的降钙素原(PCT)相关性为0.98;2)DcR3在败血症时升高比非感染性SIRS的增高时更为明显,有可能用于二者的鉴别诊断;3)初步动态观察发现,DcR3的变化能够比PCT更好地反映败血症病情变化,可用于疗效判定及病情跟踪,因而对临床诊断和治疗有重要指导意义。除了有诊断价值之外,还发现根据DcR3晶体衍射结构显示的功能区域设计合成的DcR3功能性多肽能够减轻小鼠LPS引起的败血症的症状,降低死亡率。DcR3小分子多肽(40个氨基酸)使用比DcR3大分子蛋白有其优势:1)结构稳定,不易因加热、反复冻融、酶降解而失去其有效结构及功能;2)容易保存,保存期长;2)生产价格低,容易大量生产,可推广使用。DcR3的多肽衍生物在败血症治疗上有临床实用价值。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1