一种与油菜粒重相关基因ARF18及其应用的制作方法
本发明属于植物基因工程领域。具体地说,本发明涉及一种与油菜粒重相关基因ARF18及其应用。
背景技术:
随着人口的快速增长,全球食物短缺问题变得越来越严重。因此,在作物产量方面急需突破。作为影响作物产量的三因素之一,粒重已经被广泛认为是多基因控制的复杂数量性状。对粒重性状的遗传和分子机制的解析对于提高作物育种效率非常重要。
种子大小受到一系列细胞过程的影响。这种影响来源于双亲效应和母体/合子组织(Fang et al.,2012)。在模式植物拟南芥中,一些突变体如ap2、arf2、da1、eod3、ttg2、klu等主要通过调控种皮的细胞延伸来控制种子大小(Fang et al.,2012;Ohto et al.,2005;Schruff et al.,2006;Garcia et al.,2005;Adamski et al.,2009),而在mini3、iku1、iku2和shb1突变体中,胚乳在种子发育早期过早细胞化或增值影响了种子大小(Garcia et al.,2003;Luo et al.,2005;Wang et al.,2010;Zhou et al.,2009;Kang et al.,2013).met1基因由于CG背景中胞嘧啶残基甲基化的缺失导致对种子大小具有双亲效应(Feng et al.,2010)。在水稻中,已鉴定出47个籽粒长度QTLs和48个籽粒宽度QTLs(Bao,2014),一些调控籽粒大小的基因如GW2、GIF1、qSW5、GS3、GS5、GW8和qGL3被定位(Song et al.,2007;Wang et al.,2008;Shomura et al.,2008;Weng et al.,2008;Mao et al.,2010;Li et al.,2011;Wang et al.,2012;Zhang et al.,2012)。其中,GW2和qSW5通过调节外颖壳细胞数目影响粒重,而其它基因则是直接调节籽粒细胞数目或细胞大小来影响粒重。尽管粒重研究取得不错进展,目前在多倍体油菜中仍没有发现调控粒重的新基因。
多倍体是由单倍体多倍化或者两个或更多多样性基因组的组合,后者是在开花植物包括许多重要农作物中普遍存在的(Masterson,1994)。多倍体基因组由于不同染色体上同源序列的存在和同源基因的互作使得QTL定位更加困难。如甘蓝型油菜(AACC),世界上继大豆之后的第二大油料作物,是由白菜和甘蓝两个祖先种自然杂交而来。白菜为A基因组。A基因组与甘蓝的C基因组相似度非常高(Rana et al.,2004)。最近几年,作为全球重要的农业作物,油菜受到越来越多的关注。目前为止,尽管有80多个粒重相关的QTL被鉴定出来,具体调控基因尚未见报道(Quijada et al.,2006;Udall et al.,2006;Fan et al.,2010;Yang et al.,2012)。
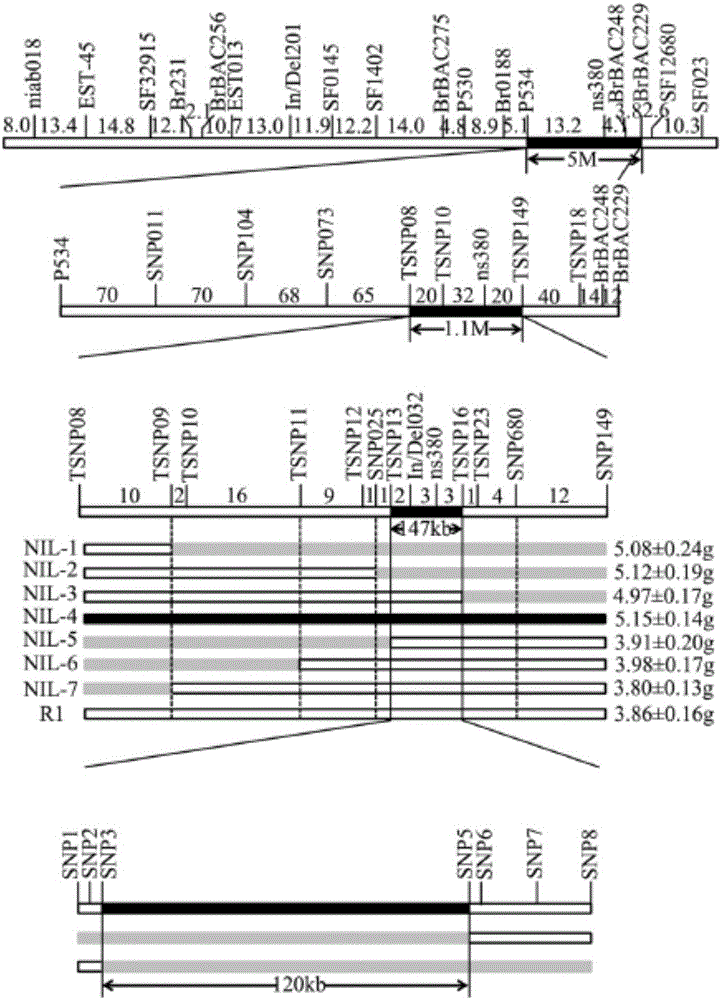
我们前期的研究中,利用zy72360和R1构建的F2分离群体检测到一个位于A9染色体上的粒重主效QTL,其贡献率超过30%。在本发明中,我们通过构建近等基因系和资源群体关联分析图位克隆了A9位点的粒重调控基因。其中,ARF18作为调控粒重的候选基因,利 用模式植物拟南芥和油菜作了进一步的功能分析。
技术实现要素:
本发明的目的是在于提供了一种与油菜粒重相关基因ARF18,其序列为SEQ ID NO:2所示。编码的蛋白质为SEQ ID NO.3所示。
本发明的另一个目的是在于提供了一种与油菜粒重相关基因ARF18在提高植物粒重性状中的应用。
为了实现上述发明目的,本发明采用以下技术措施:
一种与油菜粒重相关基因ARF18,通过以下方式得到:
1.粒重主效QTL位点的近等基因系构建
亲本zy72360和R1在粒重性状方面具有显著差异。通过F2群体对粒重性状QTL进行初定位。利用杂种F1和亲本连续回交4次,期间利用QTL连锁标记结合表型进行遗传前景的选择,同时利用非连锁标记进行遗传背景的评估,从BC4F1群体中获得目标QTL杂合且遗传背景回复率高的QTL-NIL单株;利用BC4F1代杂合目标QTL-NIL单株自交获得BC4F2代QTL-NIL分离群体。
2.粒重主效QTL位点的精细定位
基于该区间新开发的引物,我们利用近等基因系BC4F2群体缩短区间。根据区间内的SNP信息,通过PCR扩增继续缩短区间.为了进一步缩短QTL区间的距离,利用380份资源群体,开发并筛选获得区间内的标记引物进行粒重表型和基因型之间的关联分析。根据连锁分析和关联分析,我们最终将该区间定位至50kb以内并在该区域内发现7个基因。
3.确定突变位点,获得候选基因
根据油菜基因组序列,我们利用zy72360和R1材料克隆了上述7个基因的编码区和上游调控区,序列对比发现其中4个基因存在SNP和In/Del。其中ARF18基因的变异最大,将其列为调控粒重主效QTL位点的候选基因。
4.ARF18基因的功能验证
利用模式植物拟南芥为受体,超量表达ARF18及其等位基因验证其功能。构建超表达载体,采用农杆菌EHA105介导的遗传转化方法,将超表达载体导入拟南芥中,最后每个基因获得超表达的转基因株系约30株。获得转基因材料的纯合株系,考察粒重表型,最终发现ARF18(SEQ ID NO.2所示)的过量表达可以降低种子重量。通过对该基因的拟南芥同源基因突变体表型的调查,发现突变体材料的种子粒重增加。这表明ARF18的表达水平高低可以调控植物种子的重量。
最终获得了一种与油菜粒重相关基因ARF18,其序列为SEQ ID NO.2所示。
一种与油菜粒重相关基因ARF18在提高油菜粒重性状中的应用,包括通过生物技术,将油菜中ARF18基因的表达进行抑制,获得的转基因植物的种子粒重增加。
本发明的保护内容还包括,与SEQ ID NO.3所示蛋白质同源的植物蛋白质在提高植物粒重性状中的应用,即将植物中与SEQ ID NO.3所示蛋白质同源的植物蛋白质的表达进行抑制,获得的转基因植物的种子粒重增加。
本发明中所用的术语“转基因植物”是指含有导入的基因并能够稳定地增强或抑制所导入的基因表达并产生具有特定的生物学性状的植物。本发明中所提到的植物包括水稻、小麦、玉米等粮食作物,也包括油菜、大豆、棉花等经济作物,还包括夏季生长的黄瓜、番茄等蔬菜作物,还包括拟南芥。
与现有技术相比,本发明具有以下优点:
目前油菜中尚未定位到粒重调控相关基因,本发明通过图位克隆的ARF18基因能够控制油菜粒重,这对植物粒重调控的分子机理研究将有极大的推动作用。虽然在拟南芥中ARF18的基因序列已被公开,但并不清楚其具体的生物学功能,本发明克隆的油菜ARF18基因对油菜粒重有显著的调控作用,这对阐明ARF18基因的生物学功能有重要意义。通过基因工程技术提高或减弱ARF18基因的表达量能够调控油菜种子的大小,从而有利于产量三因素的之间的平衡进而达到增产的目的。
附图说明
图1两亲本zy72360和R1的粒重表型分析。
图2近等基因系连锁分析将粒重QTL区间缩短至120kb。
图3资源群体关联分析发现该QTL区间部分标记与粒重性状极显著相关。
图4zy72360和R1材料中ARF18基因的序列差异比较。
图5来自R1材料中的ARF18在拟南芥中的过量表达降低种子重量,而来自zy72360中的基因过量表达没有导致种子发生显著改变。
图6拟南芥ARF18突变体种子重量增加。
图7ARF18RNAi的表达载体转化R1导致转基因株系的种子粒重增加。
具体实施方式
通常按照常规条件如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring Harbor Laboratory Press,1989),或Draper等人(Blackwell科学出版社,1988)所述的条件,或按照所用试剂制造厂商所建议的条件。
实施例1:
粒重主效QTL位点的近等基因系构建
亲本甘蓝型油菜zy72360和R1(Hu Z,Hua W,Huang S,Yang H,Zhan G,Wang X,et al.(2012)Discovery of Pod Shatter-Resistant Associated SNPs by Deep Sequen cing of a Representative Library Followed by Bulk Segregant Analysis in Rapesee d.PLoS ONE 7(4):e34253.)在粒重性状方面具有显著差异(zy72360为5.53±0.43g,R1为3.98±0.51g)(图1)。首先,我们通过F2群体将SW QTL定位到W236和W239之间。利用杂种F1和亲本连续回交4次,期间利用QTL连锁标记结合表型进行遗传前景的选择,同时利用非连锁标记进行遗传背景的评估,从BC4F1群体中获得目标QTL杂合且遗传背景回复率高的QTL-NIL单株;利用BC4F1代杂合目标QTL-NIL单株自交获得BC4F2代QTL-NIL分离群体。田间种植该群体,最终获得3800个单株。
实施例2:粒重主效QTL位点的精细定位
基于该区间新开发的引物,我们利用近等基因系BC4F2群体,将该区间缩短至W024和W004之间的147kb。利用147kb以内的SNP信息,通过PCR扩增将区间继续缩短至120kb(图2).为了进一步缩短QTL区间的距离,利用380份资源群体,开发并筛选获得11个QTL区间内的标记引物进行粒重表型和基因型之间的关联分析。结果显示位于SSR-72and SSR-89之间的标记显示显著的关联性(图3)。根据连锁分析和关联分析,我们最终将该区间定位至50kb以内。
实施例3:
确定突变位点,获得候选基因
根据油菜基因组序列,设计跨基因上游调控区和基因区的两侧引物以及可扩增cDNA文库的基因编码区引物,用于从油菜中扩增候选基因的对应序列。
3.1油菜基因组DNA和总RNA的提取
DNA的提取:
A.70%(体积比)乙醇擦洗叶片,称取大约100mg
B.加入600ul抽提缓冲液(0.2M Tris-Cl,0.25NaCl,25mM EDTA,0.5%SDS,pH 7.5),室温快速研磨。
C.1.5ml Ependorff管中涡旋混匀5-10s。
D.12000rpm,25min,室温。取上清,加等体积异丙醇,-20摄氏度沉淀过夜。
E.12000rpm,15min,室温。加入70%乙醇200ul泡洗DNA沉淀。
F.12000rpm,15min,室温。去乙醇。倒置于纸巾上,待乙醇挥发干净。
G.加无菌水100ul溶解粗提DNA沉淀。用分光光度计测定或电泳估测其浓度。
RNA的提取(TRIZOL TM Kit提取RNA)
液氮研磨100mg材料
A.加1mlTRIZOL,室温(20-25℃,下同)放置5min。
B.加入200ul氯仿,剧烈振荡30s,室温放置2min。
C.12000g,15min,4℃,取上清至新管中,加入500ul异丙醇,混匀后室温放置15min。
D.12000g,15min,4℃,去上清,加入1ml70%(无水酒精与H2O的体积比)乙醇。
E.7500g,7min,4℃,去上清,空气干燥。
F.DEPC-H2O溶解。
3.2基因组序列的扩增
以zy72360和R1的基因组DNA为模板,扩增7个基因的上游启动子调控区和基因组序列。PCR反应时间和温度作如下:94℃3min,94℃45s,59℃45s,72℃2min 30s,30cycles,72℃5min。
3.3基因编码区的扩增
对于编码区的扩增,首先,利用zy72360和R1的总RNA进行反转录。cDNA第一链的反转录采用RevertAid H Minus First Strand cDNA Synthesis Kit(Fermentas),操作参照所用试剂盒说明进行。以cDNA为模板进行PCR扩增,PCR反应时间和温度作如下:94℃3min,94℃45s,59℃45s,72℃2min 30s,30cycles,72℃5min。
3.4上述获得的扩增序列在两亲本间进行比对,发现ARF18的编码区存在较大差异(zy72360中丢失了一个外显子)(图4),因此将其列为候选基因进行转基因功能验证。
实施例4:候选基因的功能验证
4.1表达载体的构建及拟南芥的转化
将ARF18(SEQ ID NO.2所示)及其等位基因(SEQ ID NO.1所示)的编码区序列与TOPO入门载体(invitrogen公司)连接后,转化到感受态细胞DH5α(invitrogen公司)中,壮观酶素筛选,载体引物(T7引物)与基因引物(基因上游引物)扩增鉴定正向插入克隆,质粒经小量制备后与Pearleygate100(invitrogen公司)进行重组,并转化到感受态细胞DH5α中,卡那霉素筛选,其插入片段经载体引物(35S启动字序列引物)与基因引物(基因下游引物)PCR鉴定。
拟南芥的转化过程:
试剂配制
渗透培养基(1L):1/2xMurashige-Skoog;5%(质量比)蔗糖;0.5克MES;用KOH调至pH5.7;再加:10微升1mg/ml的6-BA母液;200微升Silwet L-77
转化步骤
(1)制备好已转化了相应质粒的农杆菌(根癌农杆菌GV3101)菌液10ml,在转化前一天晚上,转入大瓶培养过夜,第二天取出使用时农杆菌液O.D600当在1.2到1.6之间。
(2)室温5000rpm离心15分钟。
(3)弃上清,将农杆菌沉淀悬浮于相应体积的渗透培养基里,使O.D600在0.8左右。
(4)将整个植株直接浸泡至农杆菌悬浮液30s。
(5)避光培养过夜,然后正常培养至结子。
4.2转基因拟南芥的筛选和验证
转化子的筛选
将春化过的拟南芥种子种于浇过饱和PNS营养液的人工土中,并用保鲜膜罩上。两天后人工模拟自然条件光照(光照16小时,暗8小时),三天后揭膜。
人工培养室条件:相对湿度80%,恒温20-240C,光照强度80-200umol/M2/S,光照周期为8h黑暗﹑16h光照培养。一周左右,喷除草剂筛选阳性植株。
PCR鉴定
(1)用于PCR的转化植株总DNA的提取
A.70%(体积比)乙醇擦洗叶片,称取大约100mg
B.加入600ul抽提缓冲液(0.2M Tris-Cl,0.25NaCl,25mM EDTA,0.5%SDS,pH 7.5),室温快速研磨。
C.1.5ml Ependorff管中涡旋混匀5-10s。
D.12000rpm,25min,室温。取上清,加等体积异丙醇,-20摄氏度沉淀过夜。
E.12000rpm,15min,室温。加入70%乙醇200ul泡洗DNA沉淀。
F.12000rpm,15min,室温。去乙醇。倒置于纸巾上,待乙醇挥发干净。
G.加无菌水100ul溶解粗提DNA沉淀。用分光光度计测定或电泳估测其浓度。
H.以总DNA为模板,进行PCR。
(2)PCR程序
PCR反应利用植物表达载体中35S启动子序列和基因下游引物[5’-TCAGCCAGAGATCTGGATAG-3’],反应的时间和温度作如下:
94℃3min
94℃45s,
59℃45s
72℃2min 30s,30cycles
72℃5min
检测结果显示,大多数转化植株均能够扩增出预期大小的电泳条带,而阴性对照则没有,表明转基因拟南芥基因组中已经含有外源基因DNA片段。
4.3转基因株系的表型考察
对转基因材料的纯合株系进行粒重表型的考察,发现过量表达来自R1材料中的ARF18 降低了部分转基因株系的种子重量,降低幅度在10%左右(图5),而过量表达来自zy72360材料中的ARF18则基本与野生型对照一致,种子重量没有明显变化。
通过对该基因的拟南芥同源基因缺失突变株(商业来源:https://www.arabidopsis.org/)表型的调查,发现突变体材料的种子粒重增加(图6)。这表明ARF18的表达水平高低可以调控植物种子的重量。
实施例5:
油菜ARF18抑制表达载体的构建及在油菜中的转化
5.1CaMV启动子驱动ARF18反义RNA表达的载体构建
根据R1材料的ARF18编码区序列,设计引物扩增部分编码区片段(300bp)引物序列为:ARF18RNAiF:5‘-atggcgaatgtagatggagatga-3’,ARF18RNAiR:5‘-tgaagtctacgctcagatcacat/atgtgatctgagcgtagacttca-3’。将其反向连接到topo载体上并重组到pEarleyGate100中。将载体转化到LBA4404中准备转化油菜。
5.2油菜的农杆菌LBA4404转化
A.无菌苗的准备:种子经70%乙醇1min,氯化汞(HgCl2)浸泡13-15min,ddH2O洗5次后,平铺于MS培养基(PH 5.8)中,琼脂浓度0.8%。油菜无菌苗备用。
B.油菜子叶柄转化:接种根癌农杆菌LBA4404于固体培养基LB上,两天后挑取单菌落于50ml YEP液体培养基(胰蛋白胨10g+酵母提取物10g+NaCl5g+MgSO40.5g)中培养。取4-5天无菌苗子叶柄,于菌液中浸泡5-8min,其间轻摇,而后倒去菌液,以无菌滤纸吸去外植体上残留菌液。置于共培养基(MS+0.2mg/L 6-苄基腺嘌呤(6-BA)+1mg/L 2,4-二氯苯氧乙酸(2、4-D)+200um乙酰丁香酮(AS),PH5.8),上培养2-3天。
C.将共培养后的外植体转入只含青霉素(Car)不含Kan的分化培养基中,黑暗条件的温室中进行脱菌与分化培养5-7天。再继代在添加Kan筛选压的选择培养基(MS+3mg/L6-BA+0.1mg/Lα-萘乙酸(NAA)+5mg/L硝酸银(AgNO3)+400mg/L Car+15mg/L Kan;pH5.8)中,进行筛选,待分化出再生绿芽。
D.待再生芽长至1cm时切取小芽移至生根培养基(MS+0.2mg/L NAA+10mg/L Kan+400mg/L Car;pH5.8)上,用加Car与Kan的固体MS培养基筛选。
E.苗生根后,移栽入室外。10天后移栽下土钵。
实施例6:转化植株的鉴定
(1)用于PCR的转化植株总DNA的提取
A.70%乙醇擦洗叶片,称取大约100mg
B.加入600ul抽提缓冲液(0.2M Tris-Cl,0.25NaCl,25mM EDTA,0.5%SDS,pH 7.5),室温快速研磨。
C.1.5ml Ependorff管中涡旋混匀5-10s。
D.12000rpm,25min,室温。取上清,加等体积异丙醇,-20摄氏度沉淀过夜。
E.12000rpm,15min,室温。加入70%乙醇200ul泡洗DNA沉淀。
F.12000rpm,15min,室温。去乙醇。倒置于纸巾上,待乙醇挥发干净。
G.加无菌水100ul溶解粗提DNA沉淀。用分光光度计测定或电泳估测其浓度。
H.以总DNA为模板,进行PCR。
(2)PCR程序
PCR反应体系的总体积为20μl,基因组DNA模板1ul(约50ng)、1×Taq酶反应缓冲液、25mM MgCL2 1.2ul、2mM dNTP 1.5ul、10uM引物各0.2ul、50%甘油2ul、0.3单位rTaq酶(Takara公司),加ddH2O至20μl。依据植物表达载体中目的基因设计并合成跨内含子的PCR引物。(正向引物:[5’-CACGTCTTCAAAGCAAGTGGA-3’]和反向引物[5’-atcagaaatatggtcagtcac-3’],反应的时间和温度作如下:94℃3min,94℃45s,59℃45s,72℃2min 30s,30cycles,72℃5min。
检测结果显示,阳性对照和大多数转化植株均能够扩增出预期大小的电泳条带,而阴性对照则没有,表明转基因油菜基因组中已经含有外源基因DNA片段。
实施例7:对T1代转基因株系进行表型分析
油菜ARF18RNAi转基因株系及对照完全成熟后收获,油菜籽脱粒并充分晒干称取千粒重。最终结果显示,与非转基因株系相比,部分转基因株系种子重量增加,最大的增幅超过15%(图7)。
SEQUENCE LISTING
<110> 中国农业科学院油料作物研究所
<120> 一种与油菜粒重相关基因ARF18及其应用
<130> 一种与油菜粒重相关基因ARF18及其应用
<160> 3
<170> PatentIn version 3.1
<210> 1
<211> 1521
<212> DNA
<213> 人工序列
<400> 1
atggcgaatg tagatggaga tgattccaga agttctttcc caagttgtta tcaggatcag 60
ctgtacacag agctatggaa agcctgtgca ggtccattag tggaggttcc tcttgttgga 120
gagagagttt tctacttccc tcagggtcac atggaacaac ttgtggcctc aactaatcaa 180
ggaattgaat cagagaaaat acctgatttt aaacttcctc ccaagatact ctgtcaagtt 240
cttagtgtga tgctaaaggc agagcatgac acagatgaag tctacgctca gatcacatta 300
aaaccagagg aagatcaaag tgaaccaaca agtcttgatc caccaattgt tgaaccaaca 360
aagcaaatgt tccactcttt tgtaaagatt ctaacagctt cagacacaag cactcatgga 420
gggttctctg ttcttcgtaa acacgccact gaatgcttgc ctgccttgga catgacacaa 480
gctactccta ctcaagaact tgtgactaga gatcttcatg ggtttgagtg gaggtttaag 540
catattttca gaggacaacc taggaggcat ttgcttacta caggctggag tacctttgtt 600
tcctcaaaaa gacttgtagc tggagatgct tttgtgttct tgaggataag ccaattcata 660
gtaggtgtga acaagtatat ggaagctatg aagcatggtt tctctcttgg tacaagattc 720
aggatgaagt ttgaaggaga agagtctcct gagagaatat ttaccggtac tattgtggga 780
attggagatt tatcttcaca atggccagct tctacatgga gatcattgca ggtccaatgg 840
gatgagccaa caacagttca gagaccagac aaagtctcac catgggagat tgagcctttc 900
ttgccatctt ccccagcttc aacaccttct caacaatcac aacccaaaag caaaaggtca 960
aaacctgttg aatcatcaag tttgagtcca ggtcaagcta gtttcttagg cgtccaagct 1020
gagcctcctc ctcctcctcc tcctgcgagt agttgctata ggttgtttgg atttgatctc 1080
acaagcaatc ctccagctcc aatacctcca gacaagcaac cgatggatac ttctgaagct 1140
gccaagtgtc aagaccccat cactccaagc tcagttaatg agccaaagaa gcaacaaaca 1200
tcaaggactc gaaccaaagt gcaaatgcaa gggatagctg ttggtcgtgc ggtagattta 1260
acgctgttga aatcatatga tgaactgatt aaggagcttg aggagatgtt tgagatccaa 1320
ggacagcttc ttccccgaga taaatggatc gttgtcttca ctgatgatga aggtgacatg 1380
atgcttgctg gagatgatcc atggaatgag ttttgtaaga tggcgaagaa gatatttata 1440
tattcaagcg atgaggttaa gaaaatgaca aggagaatga agagttcttc ttcgttagag 1500
aatgaagcaa gcatggatta a 1521
<210> 2
<211> 1680
<212> DNA
<213> 人工序列
<400> 2
atggcgaatg tagatggaga tgattccaga agttctttcc caagttgtta tcaggatcag 60
ctgtacacag agctatggaa agcctgtgca ggtccattag tggaggttcc tcttgttgga 120
gaaagagttt tctacttccc tcagggtcac atggaacaac ttgtggcctc aactaatcaa 180
ggaattgaat cagagaaaat acctgatttt aaacttcctc ccaagatact ctgtcaagtt 240
cttagtgtga tgttaaaggc agagcatgac acagatgaag tctacgctca gatcacatta 300
aaaccagagg aagatcaaag tgaacctaca agtcttgatc caccaattgt tgaaccaaca 360
aagcaaatgt tccactcctt tgtaaagatt ctaaccgctt cagacacaag cactcatggt 420
ggattctctg ttcttcgtaa acacgccact gaatgcttgc ctgccttgga catgacacaa 480
gctattccta ctcaagaact tgtgactaga gatcttcatg ggtttgagtg gaggtttaag 540
catattttca gaggacaacc taggaggcat ttgcttacta caggctggag tacatttgtt 600
tcctcaaaaa gacttgtagc tggagatgct tttgtgttct tgaggggtga gaatggagat 660
ttaagagttg gagtgaggcg tttagctagg catcagaaca ccatgcctgc ttcagttatc 720
tctagtcaga gcatgcattt aggagtcctt gctacagctt ctcatgctgt gaacacccaa 780
actatgtttc ttgtgcttta caagcctagg ataagccaat tcatagtaag tgtgaacaag 840
tatatggaag ctatgaagca tggtttctct cttggtacaa gattcaggat gaggtttgaa 900
ggagaagagt ctcctgagag aatatttacc ggtactattg tgggaattgg agatttatct 960
tcacaatggc cagcttctac atggagatca ttgcaggtcc aatgggatga gccaacaaca 1020
gttcagagac cagacaaagt ctcaccatgg gagattgagc ctttcttgcc atcttcccca 1080
gcttcaacac cttctcaaca atcacaaccc aaaagcaaaa ggtcaaaacc cattgaatca 1140
tcaagtttga gtccaggtca agctagtttc ttaggcgtcc aagctgagcc tcctcctcct 1200
cctgcgagta gttgctatag gttgtttgga tttgatctca caagcaatcc tccagctcca 1260
atacctccag acaagcaacc gatggatact tctgaagctg ccaagtgtca agaccccatc 1320
actccaagct cagttaatga gccaaagaag caacaaacat caaggactcg aaccaaagtg 1380
caaatgcaag ggatagctgt tggtcgtgcg gtagatttaa cgctgttgaa atcatatgat 1440
gaactgatta aggagcttga ggagatgttt gagatccaag gacagcttct tccccgagat 1500
aaatggatcg ttgtcttcac tgatgatgaa ggtgacatga tgcttgctgg agatgatcca 1560
tggaatgagt tttgtaagat ggcgaagaag atatttatat attcaagcga tgaggttaag 1620
aaaatgacaa ggagaatgaa gagttcttct tcgttagaga atgaagcaag catggattaa 1680
<210> 3
<211> 559
<212> PRT
<213> 人工序列
<400> 3
Met Ala Asn Val Asp Gly Asp Asp Ser Arg Ser Ser Phe Pro Ser Cys
1 5 10 15
Tyr Gln Asp Gln Leu Tyr Thr Glu Leu Trp Lys Ala Cys Ala Gly Pro
20 25 30
Leu Val Glu Val Pro Leu Val Gly Glu Arg Val Phe Tyr Phe Pro Gln
35 40 45
Gly His Met Glu Gln Leu Val Ala Ser Thr Asn Gln Gly Ile Glu Ser
50 55 60
Glu Lys Ile Pro Asp Phe Lys Leu Pro Pro Lys Ile Leu Cys Gln Val
65 70 75 80
Leu Ser Val Met Leu Lys Ala Glu His Asp Thr Asp Glu Val Tyr Ala
85 90 95
Gln Ile Thr Leu Lys Pro Glu Glu Asp Gln Ser Glu Pro Thr Ser Leu
100 105 110
Asp Pro Pro Ile Val Glu Pro Thr Lys Gln Met Phe His Ser Phe Val
115 120 125
Lys Ile Leu Thr Ala Ser Asp Thr Ser Thr His Gly Gly Phe Ser Val
130 135 140
Leu Arg Lys His Ala Thr Glu Cys Leu Pro Ala Leu Asp Met Thr Gln
145 150 155 160
Ala Ile Pro Thr Gln Glu Leu Val Thr Arg Asp Leu His Gly Phe Glu
165 170 175
Trp Arg Phe Lys His Ile Phe Arg Gly Gln Pro Arg Arg His Leu Leu
180 185 190
Thr Thr Gly Trp Ser Thr Phe Val Ser Ser Lys Arg Leu Val Ala Gly
195 200 205
Asp Ala Phe Val Phe Leu Arg Gly Glu Asn Gly Asp Leu Arg Val Gly
210 215 220
Val Arg Arg Leu Ala Arg His Gln Asn Thr Met Pro Ala Ser Val Ile
225 230 235 240
Ser Ser Gln Ser Met His Leu Gly Val Leu Ala Thr Ala Ser His Ala
245 250 255
Val Asn Thr Gln Thr Met Phe Leu Val Leu Tyr Lys Pro Arg Ile Ser
260 265 270
Gln Phe Ile Val Ser Val Asn Lys Tyr Met Glu Ala Met Lys His Gly
275 280 285
Phe Ser Leu Gly Thr Arg Phe Arg Met Arg Phe Glu Gly Glu Glu Ser
290 295 300
Pro Glu Arg Ile Phe Thr Gly Thr Ile Val Gly Ile Gly Asp Leu Ser
305 310 315 320
Ser Gln Trp Pro Ala Ser Thr Trp Arg Ser Leu Gln Val Gln Trp Asp
325 330 335
Glu Pro Thr Thr Val Gln Arg Pro Asp Lys Val Ser Pro Trp Glu Ile
340 345 350
Glu Pro Phe Leu Pro Ser Ser Pro Ala Ser Thr Pro Ser Gln Gln Ser
355 360 365
Gln Pro Lys Ser Lys Arg Ser Lys Pro Ile Glu Ser Ser Ser Leu Ser
370 375 380
Pro Gly Gln Ala Ser Phe Leu Gly Val Gln Ala Glu Pro Pro Pro Pro
385 390 395 400
Pro Ala Ser Ser Cys Tyr Arg Leu Phe Gly Phe Asp Leu Thr Ser Asn
405 410 415
Pro Pro Ala Pro Ile Pro Pro Asp Lys Gln Pro Met Asp Thr Ser Glu
420 425 430
Ala Ala Lys Cys Gln Asp Pro Ile Thr Pro Ser Ser Val Asn Glu Pro
435 440 445
Lys Lys Gln Gln Thr Ser Arg Thr Arg Thr Lys Val Gln Met Gln Gly
450 455 460
Ile Ala Val Gly Arg Ala Val Asp Leu Thr Leu Leu Lys Ser Tyr Asp
465 470 475 480
Glu Leu Ile Lys Glu Leu Glu Glu Met Phe Glu Ile Gln Gly Gln Leu
485 490 495
Leu Pro Arg Asp Lys Trp Ile Val Val Phe Thr Asp Asp Glu Gly Asp
500 505 510
Met Met Leu Ala Gly Asp Asp Pro Trp Asn Glu Phe Cys Lys Met Ala
515 520 525
Lys Lys Ile Phe Ile Tyr Ser Ser Asp Glu Val Lys Lys Met Thr Arg
530 535 540
Arg Met Lys Ser Ser Ser Ser Leu Glu Asn Glu Ala Ser Met Asp
545 550 555
- 还没有人留言评论。精彩留言会获得点赞!