抗EpCAM和CD3特异性双靶向抗体及其制备方法和应用、含该双靶向抗体表达盒的微环DNA及应用与流程
本发明涉及生物医药和诊疗领域,具体涉及一种抗EpCAM和CD3特异性双靶向抗体及其制备方法和应用、含该双靶向抗体表达盒的微环DNA及应用。
背景技术:
EpCAM(Epithelial cell adhesion molecule)上皮细胞粘附分子,也称为TACSTD1(tumor-associated calcium signal transducer1),CD326(cluster of differentiation),17-A,ESA,EGP40,EPCAM是一种由GA-733-2基因编码的分子量为40kDa的跨膜糖蛋白,作为嗜同种的钙非依赖性的上皮细胞间粘附分子在上皮癌变过程中发挥着作用。
EpCAM最早作为肿瘤相关抗原被发现,因其在各种类型疾病的肿瘤组织中高水平表达,引起了特别的关注。目前大量的实验证实EpCAM可以作为诊断和治疗肿瘤的标记蛋白,许多从原发性肝肿瘤组织中分离建系的人原发性肝癌细胞系中含有EpCAM的表达,并且这种表达的肿瘤细胞具有肿瘤干细胞的某些典型特性,尤其对肿瘤发生和发展具有决定性的作用。此外,以EpCAM+/CD44+为表型的结直肠癌干细胞被发现以后,它具有干细胞功能的特征已在多个方面得到证实。最近的研究表明,EpCAM蛋白在胚胎干细胞高度表达,在上皮性肿瘤细胞内,其多向分化潜能是通过抑制p53蛋白表达和提高小鼠胚胎成纤维细胞的分化能力实现的,表明EpCAM跨膜信号是通过抑制p53-p21信号途径实现程序重排的。因此EpCAM被认为是肿瘤干细胞的标志物。
Edrecolomab(ED)是一种来源于鼠的抗EpCAM的单克隆IgG2抗体,它能识别人类肿瘤相关抗原17-1A。此单抗已在德国上市,并在乳腺癌和结直肠癌使用,刚开始报道不管是单独使用或者结合其他辅助化疗在无复发及总体生存方面有显著的优势。但在后来的四个大宗的前瞻性随机临床试验中,不管是单独使用还是联合化疗,ED对术后Ⅱ、Ⅲ期结直肠癌都是无效的。
在鼠源性抗体临床试验效果不佳的情况下,人源性抗EpCAM单克隆IgG1抗体Adecatumumab(MT201)的问世给肿瘤临床免疫导向治疗带来了新的希望。在体外实验中有比ED更强烈的抗体依赖细胞毒性反应,目前已在乳腺癌、子宫浆液性乳头状癌、卵巢癌、前列腺癌等治疗中显示出一定的效果,目前在乳腺癌治疗中研究较多。Schmidt等在其Ⅱ期临床研究中发现,接受高剂量和高表达EpCAM的患者肿瘤进展能力明显降低,与治疗相关的不良反应较低或轻微。结果表明,单剂型的MT201治疗进展期乳腺癌,尽管并不能客观的使肿瘤消退,但能减缓肿瘤进展,为下一步对过表达EpCAM和低瘤荷其他肿瘤的MT201治疗提供理论支持。目前其他肿瘤的Ⅱ、Ⅲ期临床研究还在进行中,前景令人瞩目,在胃肠肿瘤方面还未见报道,故其在治疗中的地位需要更深入地研究。
近年来,在肿瘤免疫治疗领域,出现了利用双靶向抗体(Bispecific antibody,BsAb)介导T细胞 杀灭癌细胞的新疗法。人体免疫系统中,细胞毒性T淋巴细胞(Cytotoxic T Lymphocyte,CTL)扮演着重要的角色,具有T细胞受体(T cell receptor,TCR),能特异性识别并结合表达目标抗原的细胞,并分泌穿孔素和颗粒酶杀灭靶细胞。肿瘤细胞由于缺少免疫粘附分子和共刺激分子等原因,使得机体免疫无法有效识别和活化,从而使得CTL无法清除癌细胞。BsAb能够同时与T细胞和肿瘤细胞特异性抗原结合,可在T细胞与肿瘤细胞之间形成免疫突触(immune synapse),发挥T细胞受体(TCR)一样的功能,从而激活T细胞免疫机制,介导T细胞杀死靶细胞。
卡妥索单抗(Catumaxomab)是一种能与EpCAM分子、CD3抗原以及FC受体特异性结合的三功能双特异性抗体,是目前报道的第一个上市的BsAb抗体。于2009年在欧盟获得批准用于治疗EPCAM阳性肿瘤的恶性腹水患者,取得了良好的效果。
Strhlein等研究恶性腹水灌注Catumaxomab的Ⅰ期临床效果,采取剂量递增(10~200μg)腹腔治疗消化道来源的恶性腹水,随访2年后结果发现,Catumaxomab治疗能清除腹腔灌洗样本中肿瘤细胞,延迟疾病进展,延长生存时间。Parsons等研究癌性腹水灌注Catumaxomab的Ⅱ、Ⅲ期临床效果,观察EpCAM阳性的上皮源性恶性腹水258例,最初观察终点是免穿刺生存时间,对照组允许观察终点过后给予腹腔穿刺灌注Catumaxomab治疗。结果显示,免穿刺生存时间差异有统计学意义,两组腹水的症状和体征都有明显的减轻,中位总生存时间延长,生存受益。对照组终点过后的治疗延长了免穿刺时间。总体治疗不良反应通常来说轻微或者少见,可完全逆转。因此,癌性腹水腹腔灌注Catumaxomab能够延长免穿刺生存时间和免穿刺时间,并能够明显地减轻腹水的症状和体征。
然而,卡妥索单抗(Catumaxomab),一种抗CD3和上皮细胞粘附分子(EpCAM)的BsAb,为由大鼠和小鼠抗体序列的杂交获得,并于2009年在欧盟获得批准用于治疗EpCAM阳性肿瘤的恶性腹水患者。另外一个处于临床II期研究的BsAb抗体:Solitomab,一种抗CD3和上皮细胞粘附分子(EpCAM)的小鼠双特异性抗体,目前效果尚在观察。综合来说,这两种BsAb的抗原结合区序列都是来源于鼠单抗,长期应用会产生部分的移植物抗宿主反应(graft versus host reaction,GVHR)。目前还没有抗原结合区序列来自于人源单抗的EpCAM的双靶向抗体的报道。本发明旨在提供一个高效、低成本、来自于人源的抗EpCAM和CD3特异性双靶向抗体及其制备方法和应用。
技术实现要素:
第一方面,本发明提供了一种特异性双靶向抗体,所述特异性双靶向抗体具有特异性与人类CD3结合的第一抗原结合结构域和特异性与EpCAM抗原结合的第二抗原结合结构域。
本发明提供了的特异性双靶向抗体(Bispecific antibody,BsAb),能够同时与CD3和EpCAM抗原结合;特异地识别并结合EpCAM抗原阳性细胞,同时也结合表达CD3的T细胞,可在T细胞与肿瘤细胞之间形成免疫突触(immune synapse),发挥T细胞受体(T cell receptor,TCR)一样的功能,从而激活T细胞免疫机制,介导T细胞发挥杀伤EpCAM阳性肿瘤细胞的作用,从而清除EpCAM阳性肿瘤细胞。
本发明所述的“双靶向”表示“能够同时与CD3和EpCAM抗原结合”。
在本发明一个实施例中,本发明提供了的特异性双靶向抗体,可与CD3和EpCAM结合;该特异性双靶向抗体在文中亦称为“抗-CD3/抗-EpCAM特异性双靶向抗体”。“抗-CD3/抗-EpCAM特异性双靶向抗体” 的抗-EpCAM部分可用于靶向表达EpCAM的细胞,如HepG2肝癌细胞系,而特异性双靶向抗体分子的抗-CD3部分可用于活化T细胞。通过与EpCAM阳性细胞上的cMET和T细胞上的CD3的同时结合,促进活化的T细胞定向杀死(细胞裂解)被靶向的EpCAM阳性细胞。
本发明的抗-CD3/抗-EpCAM特异性双靶向抗体,特别地,用于诊断、治疗EpCAM阳性肿瘤细胞,以及治疗、预防和/或控制与EpCAM的异常表达和/或由EpCAM的异常表达引发的生理紊乱的方法和组合物。这样的紊乱包括但不限于:癌症、非癌过度增生性细胞紊乱。
本发明的示例性特异性双靶向抗体列于文中的表1和表2。本发明提供的特异性双靶向抗体中,第一抗原结合结构域和第二抗原结合结构域均包括的重链可变区(HCVR)和轻链可变区(LCVR))。表1表2列出了本发明提供的特异性双靶向抗体的HCVR、LCVR的氨基酸序列,及其在序列表中的序列号。表2列出了编码本发明所述的HCVR、LCVR氨基酸序列对应的核苷酸序列,及其在序列表中的序列号。
本发明提供的特异性双靶向抗体的氨基酸序列包括:至少一条第一抗原结合结构域的HCVR氨基酸序列、至少一条第一抗原结合结构域的LCVR氨基酸序列、至少一条第二抗原结合结构域的HCVR氨基酸序列、以及至少一条第二抗原结合结构域的LCVR氨基酸序列;具体HCVR和LCVR优选为任一选自表1的氨基酸序列。
编码本发明提供的特异性双靶向抗体的核苷酸序列包括:至少一条第一抗原结合结构域的HCVR核苷酸序列、至少一条第一抗原结合结构域的LCVR核苷酸序列、至少一条第二抗原结合结构域的HCVR核苷酸序列、以及至少一条第二抗原结合结构域的LCVR核苷酸序列;具体HCVR和LCVR优选为任一选自表2的核苷酸序列。
表1 序列表中的氨基酸序列
在本发明一实施例中,3条不同序列的抗-CD3/抗-EpCAM特异性双靶向抗体,在表1中编号分别为 BsAb-1、BsAb-2、BsAb-3,其中BsAb-1是经过筛选出的最佳效果的特异性双靶向抗体。
在本发明一些实施例中,表1各序列具体为:
具体地,在表1各序列中,高变区为如下带下划线序列:
SEQUENCE NO.1中,
CD3.HCVR
DIKLQQSGAELARPGASVKMSCKTSGYTFTRYTMHWVKQRPGQGLEWIGYINPSRGYTNYNQKFKDKATLTTDKSSSTAYMQLSSLTSEDSAVYYCARYYDDHYCLDYWGQGTTLTVSS;
SEQUENCE NO.2中,
CD3.LCVR
DIQLTQSPAIMSASPGEKVTMTCRASSSVSYMNWYQQKSGTSPKRWIYDTSKVASGVPYRFSGSGSGTSYSLTISSMEAEDAATYYCQQWSSNPLTFGAGTKLELK;
SEQUENCE NO.3中,
EPCAM-HCVR
EVQLLEQSGAELVRPGTSVKISCKASGYAFTNYWLGWVKQRPGHGLEWIGDIFPGSGNIHYNEKFKGKATLTADKSSSTAYMQLSSLTFEDSAVYFCARLRNWDEPMDYWGQGTTVTVSS;
SEQUENCE NO.4中,
EPCAM-LCVR
DIELVMTQSPSSLTVTAGEKVTMSCKSSQSLLNSGNQKNYLTWYQQKPGQPPKLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVQAEDLAVYYCQNDYSYPLTFGAGTKLEIK;
SEQUENCE NO.5中,
EPCAM-HCVR
EVQLLEQSGAELVRPGTSVRLSCKASGYAFTNYWLGWVKQRPGHGIEWLGDIFPGSGNIRYNEKFKGKATITADKSSSTAYMQLSSLTFEDSAVYFCARIKNWDEPMDYWGQGTTVTVSS;
SEQUENCE NO.6中,
EPCAM-LCVR
DIELVMTQSPSSLTVTMGERVTMSCKSSQSLLNSGNQKNYITWYQQKPGQPPKLLIYWASTRESGVPDKFTGSSSGTDFTLTISSVQAEDLAVYYCQNDYSQPITFGAGTKLEIK;
SEQUENCE NO.7中,
EPCAM-HCVR
EVQLLEQSGAELVKPGSSVKISCKASGYAFTNYWLGWVKQRPGKGIEWIGDIFPGSGNIHYNEKFKGKATLTADKSGSTAYMGLSSLTFEDSAVYFCARLKNWDEPSDYWGQGTTVTVSS;
SEQUENCE NO.8中,
EPCAM-LCVR
DIELVMTQSPSSLTVTAGERVTMSCKGSQSLLNSGNQKNYLTWYQQKPGQPPKLLIYWASTRESGVPDKFTGSGSGTDFTITISSVQAEDLAVYTCQNDTGYPLTFGAGTKLEIK;
表2 序列表中的核苷酸序列
在本发明一些实施例中,表2各序列具体为:
SEQUENCE NO.9,
CD3.HCVR
GACATCAAACTGCAGCAGTCAGGGGCTGAACTGGCAAGACCTGGGGCCTCAGTGAAGATGTCCTGCAAGACTTCTGGCTACACCTTTACTAGGTACACCATGCACTGGGTCAAACAGAGGCCTGGACAGGGTCTGGAATGGATTGGATACATTAATCCTAGCAGAGGTTATACTAATTACAATCAGAAGTTCAAGGACAAGGCCACATTGACTACAGACAAATCCTCCAGCACAGCCTACATGCAACTGAGCAGCCTGACATCTGAGGACTCTGCAGTCTATTACTGCGCAAGATATTATGATGATCATTACTGCCTTGACTACTGGGGCCAAGGCACCACTCTCACAGTCTCCTCA;
SEQUENCE NO.10,
CD3.LCVR
GACATTCAGCTGACCCAGTCTCCAGCAATCATGTCTGCATCTCCAGGGGAGAAGGTCACCATGACCTGCAGAGCCAGTTCAAGTGTCAGTTACATGAACTGGTACCAGCAGAAGTCAGGCACCTCCCCCAAAAGATGGATTTATGACACATCCAAAGTGGCTTCTGGAGTCCCTTATCGCTTCAGTGGCAGTGGGTCTGGGACCTCATACTCTCTCACAATCAGCAGCATGGAGGCTGAAGATGCTGCCACTTATTACTGCCAACAGTGGAGTAGTAACCCTCTCACGTTCGGTGCTGGGACCAAGCTGGAGCTGAAA;
SEQUENCE NO.11中,
EPCAM-HCVR
GAGGTGCAGCTGCTCGAGCAGTCTGGAGCTGAGCTGGTGAGGCCTGGGACTTCAGTGAAGATCTCCTGCAAGGCTTCTGGATACGCCTTCACTAACTACTGGCTTGGTTGGGTCAAGCAGAGGCCTGGACATGGACTTGAGTGGATTGGAGATATTTTCCCTGGAAGTGGTAATATCCACTACAATGAGAAGTTCAAGGGCAAAGCCACACTGACTGCAGACAAATCTTCCAGCACAGCCTATATGCAGCTCAGTAGCCTGACATTTGAGGACTCTGCTGTCTATTTCTGCGCAAGACTGAGGAACTGGGACGAGCCTATGGACTACTGGGGCCAAGGGACCACAGTCACCGTCTCCTCC;
SEQUENCE NO.12中,
EPCAM-LCVR
GAGCTCGTGATGACACAGTCTCCATCCTCCCTGACTGTGACAGCAGGAGAGAAGGTCACTATGAGCTGCAAGTCCAGTCAGAGTCTGCTTAACAGTGGAAATCAAAAGAACTACTTGACCTGGTACCAGCAGAAACCAGGGCAGCCTCCTAAACTGTTGATCTACTGGGCATCCACTAGGGAATCTGGGGTCCCTGATCGCTTCACAGGCAGTGGATCTGGAACAGATTTCACTCTCACCATCAGCAGTGTGCAGGCTGAAGACCTGGCAGTTTATTACTGCCAGAATGATTATAGTTATCCTCTCACCTTCGGTGCTGGGACCAAACTTGAGATCAAA;
SEQUENCE NO.13中,
GAGGTGCAGCTGCTGGAGCAGAGCGGCGCCGAGCTGGTGCGCCCCGGCACCAGCGTGCGCCTGAGCTGCAAGGCCAGCGGCTACGCCTTCACCAACTACTGGCTGGGCTGGGTGAAGCAGCGCCCCGGCCACGGCATCGAGTGGCTGGGCGACATCTTCCCCGGCAGCGGCAACATCCGCTACAACGAGAAGTTCAAGGGCAAGGCCACCATCACCGCCGACAAGAGCAGCAGCACCGCCTACATGCAGCTGAGCAGCCTGACCTTCGAGGACAGCGCCGTGTACTTCTGCGCCCGCATCAAGAACTGGGACGAGCCCATGGACTACTGGGGCCAGGGCACCACCGTGACCGTGAGCAGC;
SEQUENCE NO.14中,
GACATCGAGCTGGTGATGACCCAGAGCCCCAGCAGCCTGACCGTGACCATGGGCGAGCGCGTGACCATGAGCTGCAAGAGCAGCCAGAGCCTGCTGAACAGCGGCAACCAGAAGAACTACATCACCTGGTACCAGCAGAAGCCCGGCCAGCCCCCCAAGCTGCTGATCTACTGGGCCAGCACCCGCGAGAGCGGCGTGCCCGACAAGTTCACCGGCAGCAGCAGCGGCACCGACTTCACCCTGACCATCAGCAGCGTGCAGGCCGAGGACCTGGCCGTGTACTACTGCCAGAACGACTACAGCCAGCCCATCACCTTCGGCGCCGGCACCAAGCTGGAGATCAAG;
SEQUENCE NO.15中,
GAGGTGCAGCTGCTGGAGCAGAGCGGCGCCGAGCTGGTGAAGCCCGGCAGCAGCGTGAAGATCAGCTGCAAGGCCAGCGGCTACGCCTTCACCAACTACTGGCTGGGCTGGGTGAAGCAGCGCCCCGGCAAGGGCATCGAGTGGATCGGCGACATCTTCCCCGGCAGCGGCAACATCCACTACAACGAGAAGTTCAAGGGCAAGGCCACCCTGACCGCCGACAAGAGCGGCAGCACCGCCTACATGGGCCTGAGCAGCCTGACCTTCGAGGACAGCGCCGTGTACTTCTGCGCCCGCCTGAAGAACTGGGACGAGCCCAGCGACTACTGGGGCCAGGGCACCACCGTGACCGTGAGCAGC;
SEQUENCE NO.16中,
GACATCGAGCTGGTGATGACCCAGAGCCCCAGCAGCCTGACCGTGACCGCCGGCGAGCGCGTGACCATGAGCTGCAAGGGCAGCCAGAGCCTGCTGAACAGCGGCAACCAGAAGAACTACCTGACCTGGTACCAGCAGAAGCCCGGCCAGCCCCCCAAGCTGCTGATCTACTGGGCCAGCACCCGCGAGAGCGGCGTGCCCGACAAGTTCACCGGCAGCGGCAGCGGCACCGACTTCACCATCACCATCAGCAGCGTGCAGGCCGAGGACCTGGCCGTGTACACCTGCCAGAACGACACCGGCTACCCCCTGACCTTCGGCGCCGGCACCAAGCTGGAGATCAAG;
具体地,SEQUENCE NO.9-16分别编码SEQUENCE NO.1-8的氨基酸序列。
鉴于序列同源性,本领域技术人员可以理解的是,如下实施方案应纳入本发明保护范围:
在本发明一些实施例中,所述的第一抗原结合结构域的HCVR为与表1中所示的第一抗原结合结构域中任一HCVR氨基酸序列具有至少90%、至少95%、至少98%或至少99%同源性的氨基酸序列。
在本发明一些实施例中,所述的第一抗原结合结构域的LCVR为与表1中所示的第一抗原结合结构域中任一LCVR氨基酸序列具有至少90%、至少95%、至少98%或至少99%同源性的氨基酸序列。
在本发明一些实施例中,所述的第二抗原结合结构域的HCVR为与表1中所示的第一抗原结合结构域中任一HCVR氨基酸序列具有至少90%、至少95%、至少98%或至少99%同源性的氨基酸序列。
在本发明一些实施例中,所述的第二抗原结合结构域的LCVR为与表1中所示的第一抗原结合结构域中任一LCVR氨基酸序列具有至少90%、至少95%、至少98%或至少99%同源性的氨基酸序列。
在本发明一些实施例中,所述的编码第一抗原结合结构域HCVR的序列为与表2中所示的第一抗原结 合结构域中任一HCVR核苷酸序列具有至少90%、至少95%、至少98%或至少99%同源性的核苷酸序列。
在本发明一些实施例中,所述的编码第一抗原结合结构域LCVR的序列为与表2中所示的第一抗原结合结构域中任一LCVR核苷酸序列具有至少90%、至少95%、至少98%或至少99%同源性的核苷酸序列。
在本发明一些实施例中,所述的编码第二抗原结合结构域HCVR的序列为与表2中所示的第一抗原结合结构域中任一HCVR核苷酸序列具有至少90%、至少95%、至少98%或至少99%同源性的核苷酸序列。
在本发明一些实施例中,所述的编码第二抗原结合结构域LCVR的序列为与表2中所示的第一抗原结合结构域中任一LCVR核苷酸序列具有至少90%、至少95%、至少98%或至少99%同源性的核苷酸序列。
可以理解的,由于“核苷酸序列”具有碱基简并、突变等情况,行业内普通技术人员可调整某些碱基的种类,所述的碱基变化虽然导致了密码子的变化,但不会引起密码子翻译的氨基酸的变化,很常见的,亮氨酸的密码子就具有多种密码子,比如:UUA、UUG、CUU。
此外,本发明所述的EpCAM抗体氨基酸序列来自于人源抗体氨基酸序列,在人体应用中能降低宿主抗移植物反应(host versus graft reaction,HVGR)。核苷酸序列经过密码子优化,利于在哺乳动物细胞内表达。
在本发明一些实施例中,所述特异性双靶向抗体的氨基酸序列为:任选自表1中的序列,按如下连接形式为(a)~(h)中的一种组合所得(“VLCD3”表示特异性双靶向抗体的第一抗原结合结构域的LCVR;“VH CD3”表示特异性双靶向抗体的第一抗原结合结构域的HCVR;“VLEpCAM”表示特异性双靶向抗体的第二抗原结合结构域的LCVR;“VHEpCAM”表示特异性双靶向抗体的第二抗原结合结构域的HCVR):
(a)VLEpCAM-linker1-VHEpCAM-linker2-VLCD3-linker1-VHCD3,
(b)VHEpCAM-linker1-VLEpCAM-linker2-VLCD3-linker1-VHCD3,
(c)VLEpCAM-linker1-VHEpCAM-linker2-VHCD3-linker1-VLCD3,
(d)VHEpCAM-linker1-VLEpCAM-linker2-VHCD3-linker1-VLCD3,
(e)VLCD3-linker1-VHCD3-linker2-VLEpCAM-linker1-VHEpCAM,
(f)VLCD3-linker1-VHCD3-linker2-VHEpCAM-linker1-VLEpCAM,
(g)VHCD3-linker1-VLCD3-linker2-VLEpCAM-linker1-VHEpCAM,
(h)VHCD3-linker1-VLCD3-linker2-VHEpCAM-linker1-VLEpCAM,
其中,横杠“-”代表各氨基酸序列顺序排列。
在本发明一个实施例中,第一抗原结合结构域或第二抗原结合结构域的HCVR(VH)和LCVR(VL)之间的Linker(Linker1)的氨基酸序列为(GGGGS)n(n=1-4)、(GGS)4或(Gly)n(n=6-8),但不限于此。
在本发明一个实施例中,各抗原结合结构域之间的Linker(Linker2)的氨基酸序列为(GGGGS)n(n=1-4),但不限于此。
在本发明一优选实施例中,双特异性单链抗体氨基酸序列为具有与(a)~(h)任一所示序列的同源性 不小于90%、95%、98%或99%的氨基酸序列。
在本发明一些实施例中,各抗原结合结构域的HCVR(VH)和LCVR(VL)之间、各抗原结合结构域之间通过linker相连,Linker为连接肽,该连接肽主要采用了以甘氨酸和丝氨酸为主构成的多肽序列,其中,甘氨酸是分子量最小、侧链最短的氨基酸,可增加侧链的柔韧性;丝氨酸是亲水性最强的氨基酸,可增加肽链的亲水性。
在本发明一些实施例中,所述特异性双靶向抗体的N段具有免疫球蛋白κ链信号肽的氨基酸序列。
本发明提供的所述特异性双靶向抗体的N端加上了免疫球蛋白轻链κ链的分泌信号肽,从而保证抗体的表达并分泌到宿主细胞外。
第二方面,本发明还提供了一种制备如第一方面所述的特异性双靶向抗体的方法,该方法包括:将第一方面所述的特异性双靶向抗体序列用于构建表达所述的特异性双靶向抗体的重组表达载体;导入宿主细胞;在表达条件下,培养宿主细胞,表达,分离纯化,获得所述特异性双靶向抗体。
第三方面,本发明还提供了如第一方面所述的特异性双靶向抗体按下述一种或多种方法进行应用:
(1)将所述特异性双靶向抗体单独进行应用;
(2)将所述特异性双靶向抗体与化疗、放疗、手术、生物治疗、免疫治疗中的一种或几种联合应用;
(3)采用体内投递的方式将所述特异性双靶向抗体直接投递到患者体内进行治疗;
(4)先通过体外转染技术将所述特异性双靶向抗体与免疫效应细胞混合,然后将所述混有特异性双靶向抗体的免疫效应细胞输回患者体内实施治疗。
在本发明一些实施例中,如第三方面所述的应用(3)和(4)中,向患者施用如上所述的抗体,可向患者施用多于一次。
在本发明一些实施例中,如第三方面所述的应用(3)中,所述的投递的方式为靶向投递,包括但不限于采用可靶向投递的liposome脂质体(或其多聚体)等行业常用载体进行投递。
通过向包括人的哺乳动物施用本发明第一方面提供的抗体或第四方面提供的药物组合物,可预防或治疗肝癌或其他EpCAM的相关疾病,比如EpCAM表达异常或紊乱相关的疾病。
第四方面,本发明提供了一种药物组合物,包括至少一种如第一方面所述的特异性双靶向抗体,及可药用的载剂、赋形剂或稀释剂。
本发明提供的药物组合物可根据常规方法制成药物制剂。制剂过程中,优选将抗体与载体混合或用载体稀释,或装入容器形式的载体中。当载体作为稀释剂时,其可以为固体、半固体或液体,用作用于抗体的囊泡、赋形剂或培养基。因此,制剂可以是片剂、丸剂、粉剂、袋装剂、胶囊、酏剂、混悬剂、乳剂、溶液剂、糖浆剂、气溶胶、软和硬明胶胶囊、注射用无菌溶液、无菌粉剂等形式。合适的载体、赋形剂或稀释剂的实例包括乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石粉、硬脂酸镁和矿物油。制剂还可以包括填充剂、抗凝血剂、润滑剂、润湿剂、调味剂、乳化剂、防腐剂等。
在本发明一些实施例中,所述的药物组合物还包括第二治疗剂,第二治疗剂为任何有利地与所述的特异性双靶向抗体组合的活性剂。包括但不限于结合和/或活化CD3讯号传递的其他活性剂(包括其他抗体或其抗原结合片段等),和/或不直接与CD3结合,但却活化或刺激免疫细胞活化的活性剂。
在本发明一些实施例中,所述的第二治疗剂包括与抗体协同作用的干扰剂、抗EpCAM单克隆抗体、抗EpCAM多克隆抗体、核苷类似物、DNA聚合酶抑制剂、siRNA制剂、用作抗病毒剂的治疗用疫苗、细胞因子、毒素、化学治疗剂、放射治疗剂、激素、抗体Fc片段、TLR激动剂、含CpG的分子或免疫共刺激分子。
第五方面,本发明提供了一种诊断试剂,包括至少一种如第一方面所述的特异性双靶向抗体,及诊断剂,所述的诊断剂包括但不限于荧光团、发色团、染料、放射性同位素、化学发光分子、顺磁性离子或自旋捕获试剂。
第六方面,本发明提供了一种抗体药物,为任一如第一方面所述的特异性双靶向抗体,与人类CD3结合并于体外诱导人类T细胞增殖。
第七方面,本发明提供了一种抗体药物,为任一如第一方面所述的特异性双靶向抗体,与人类CD3结合并于体外诱导T细胞介导的对EpCAM阳性细胞进行杀伤。
第八方面,本发明提供了一种核酸分子,编码如第一方面所述的特异性双靶向抗体的氨基酸序列;在某些实施方式中,所述的核酸分子编码的氨基酸序列,为与如第一方面所述特异性双靶向抗体的氨基酸序列具有至少90%、至少95%、至少98%或至少99%同源性的氨基酸序列。
第九方面,本发明提供了一种表达如第一方面所述的特异性双靶向抗体的重组载体;在某些实施方式中,所述的重组载体具有本发明第八方面提供的任一核酸分子序列。
在本发明一些实施例中,所述的载体为微环DNA重组母质粒或微环DNA。
在本发明一些实施例中,所述微环DNA重组母质粒是在微环DNA空质粒的多克隆位点中插入本发明第八方面提供的任一核酸分子序列组合而成。具体插入方法可采用常规的基因克隆,也可采用无缝克隆(Seamless cloning)。
在本发明一些实施例中,所述微环DNA空质粒优选为p2ФC31质粒或pMC.BESPX质粒。具体地,所述空质粒p2ФC31构建方法参照Chen ZY等,Molecular Therapy,8(3),495-500(2003)、Chen ZY等,Human Gene Therapy,16(1),126-131(2005)和美国专利US7897380 B2。具体地,所述空质粒pMC.BESPX构建方法及全基因序列参照Chen ZY等,Nature Biotechnology,28,(12),1289-1291(2010)。
本发明典型实施例中采用的p2ФC31质粒、pMC.BESPX质粒分别获得的p2ФC31重组母质粒、pMC.BESPX重组母质粒,区别在于:p2ФC31载体上具有编码ФC31重组酶和I-Sce1内切酶的核苷酸序列,而pMC.BESPX载体上没有编码ФC31重组酶和I-Sce1内切酶的核苷酸序列,所以采用pMC.BESPX载体制备的微环DNA母质粒更加优质,大大减少了重组酶和内切酶的核苷酸序列的污染;但是pMC.BESPX需配套使用了大肠杆菌E.coli ZYCY10P3S2T工程菌,ZYCY10P3S2T工程菌具有编码ФC31重组酶和I-Sce1内切酶功能,无ФC31重组酶(即phiC31组酶)和I-Sce1内切酶核苷酸编码序列的pMC.BESPX重组母质粒需要配套使用ZYCY10P3S2T工程菌才能产生体内位点特异性重组(而大肠杆菌E.coli TOP 10无此功能)并最终生产出微环DNA;相应的,p2ФC31重组母质粒可配套使用TOP 10即可产生体内位点特异性重组,并最终生产出微环DNA。
在本发明一些实施例中,所述的微环DNA为本发明提供的微环DNA重组母质粒通过特异性重组位点的位点特异性重组产生。本发明提供的微环DNA重组母质粒具有特异性重组位点,所述的“微环DNA重组母 质粒”通过特异性重组位点的位点特异性重组产生微环DNA和骨架DNA序列。p2ФC31重组母质粒生产微环DNA的方法参照Chen ZY等,Molecular Therapy,8(3),495-500(2003)、Chen ZY等,Human Gene Therapy,16(1),126-131(2005)和美国专利US7897380 B2。pMC.BESPX重组母质粒生产微环DNA的方法参照Chen ZY等,Nature Biotechnology,28,(12),1289-1291(2010)。
如本文所用,“骨架DNA序列”具有标准质粒中负责细菌质粒的复制、或筛选含质粒的宿主等功能的DNA序列,比如细菌复制序列、抗性基因、未甲基化的CpG基序等。
在本发明一些实施例中,所述的重组载体还包含表达目的多肽(本发明中为特异性双靶向抗体)所需的所有必要元件的基因表达系统,通常其包括以下元件:启动子、编码多肽的基因序列,终止子;此外还可选择性包括信号肽编码序列等;这些元件是操作性相连的。
如本文所用,所述的“可操作地连接”是指两个或多个核酸区域或核酸序列的功能性的空间排列。例如:启动子区被置于相对于目的基因核酸序列的特定位置,使得核酸序列的转录受到该启动子区域的引导,从而,启动子区域被“可操作地连接”到该核酸序列上。优选地,所述信号肽为免疫球蛋白κ链信号肽。优选地,所述标签为His标签、GST标签、c-myc标签和Flag标签中的至少一种。以上的信号肽和标签种类为本发明人的优选方式,本领域技术人员可以根据具体需要选择合适的信号肽和标签。
第十方面,本发明提供了一种具有如第九方面所述载体的宿主细胞(优选为真核细胞或包括人在内的哺乳动物细胞);还提供了将如第九方面所述载体导入宿主细胞中的方法;还提供了通过在允许产生抗体的条件下培养具有所述载体的宿主细胞,并分离力所产生的抗体的方法。
第十一方面,本发明提供了一种检测试剂盒,包括固体检测支持物,所述的固体检测支持物包含至少一种如第一方面所述的特异性双靶向抗体。在一些实施方式中,所述固体支持物是可连接大分子如抗体、蛋白质、多肽、肽、多核苷酸的固体表面,如磁性珠、胶乳珠、微量滴定板孔、玻璃平板、尼龙、琼脂糖、聚丙烯酰胺、二氧化硅颗粒、硝酸纤维素膜等。
第十二方面,本发明提供了一种在待测样品中检测异常细胞的方法,其包括使所述样品与至少一种如第一方面所述的特异性双靶向抗体相接触。在一些实施方式中,所述的样品来自肝脏或经切除的肿瘤床。
如本发明所述,“异常细胞”是具有对于该细胞类型为非典型特征(包括非典型生长、非典型位置处的典型生长或针对非典型靶标的典型作用)的任何细胞。这样的细胞包括癌细胞、良性增生细胞或发育异常细胞、炎性细胞或自身免疫细胞。
在本发明一些实施例中,采用如第十二方面所述的方法对移植前捐赠的组织或器官进行筛选,以提供基本不含EpCAM的组织或器官。
在本发明一些实施例中,采用如第十二方面所述的方法对血液供给品进行筛选,以提供基本不含EpCAM的血液供给品。
第十三方面,如第一方面所述的特异性双靶向抗体或如第九方面所述的重组载体在制备诊断、预防、治疗EpCAM相关疾病的试剂或药物中的应用。
如本发明所述的,所述的“EpCAM疾病”包括但不限于EpCAM表达异常或紊乱相关疾病,比如,EpCAM抗原阳性的肝癌。
本发明提供的技术方案,通过设计一组特异性双靶向抗体,并将抗体表达框(DNA序列)插入微环DNA载体(优选为Kay MA*,He CY and Chen ZY*(*通讯作者).A Robust system for production of minicircle DNA vecrtors.Nat Biotechnology,28:1287,2010)中。由微环DNA表达的抗体具有以下特性:1)特异性结合EpCAM阳性抗原;2)特异性结合T细胞;3)介导T细胞对EpCAM抗原阳性细胞发挥杀伤作用。此外,在一些实施例中,由于抗体表达框带有分泌信号肽的编码序列,抗体表达后能分泌至胞外、保持生物活性。
附图说明
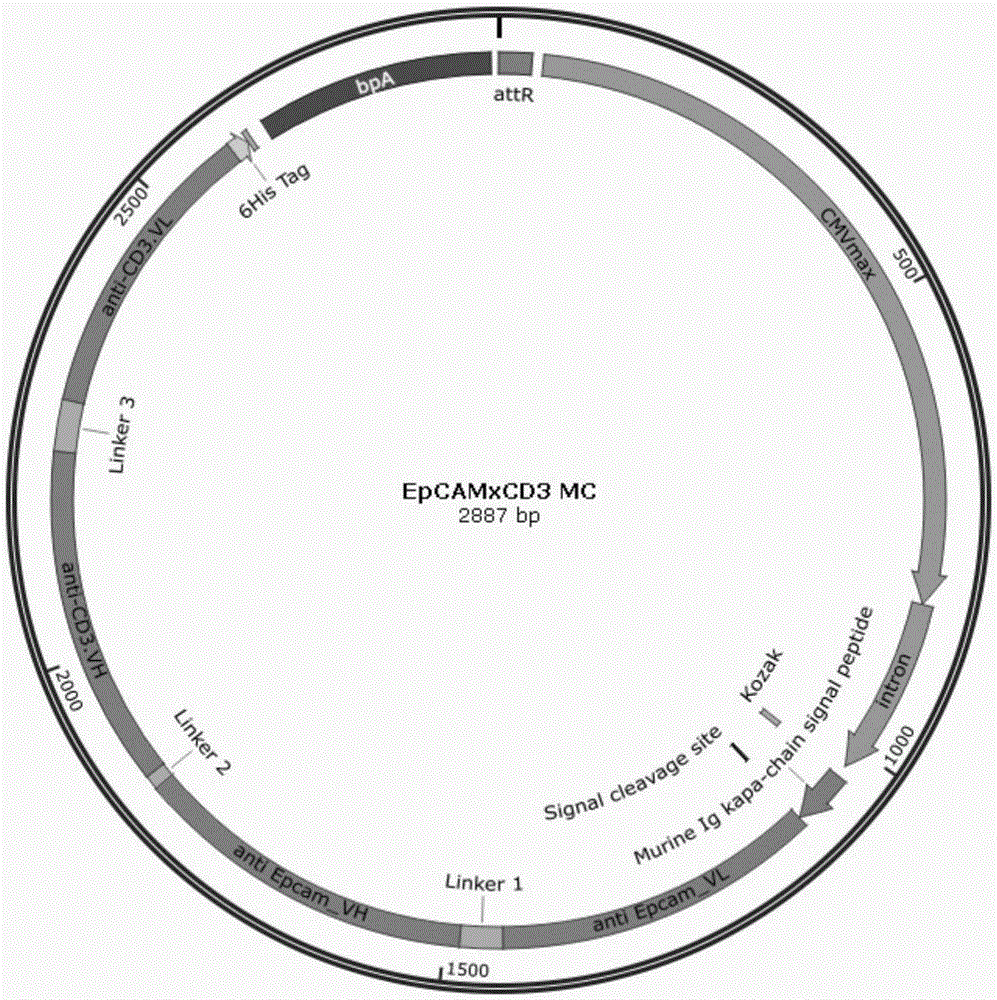
图1为本发明实施例1制备的微环母质粒的质粒图谱;
图2为本发明实施例2制备的微环DNA的质粒图谱;
图3为本发明实施例3提供的Western Blot检测培养基上清中BsAb抗体表达水平的结果;
图4-5为本发明实施例4提供的EpCAM×CD3 BsAb细胞结合实验流式细胞仪检测结果;
图6本发明实施例5提供的EpCAM×CD3 BsAb联合DCIK细胞杀伤实验的结果。
具体实施方式
以下所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也视为本发明的保护范围。
本发明实施例中无特别说明外,所用试剂及耗材均为市售商品。
实施例1
具有编码EpCAM×CD3 BsAb抗体核苷酸序列的微环母质粒的构建,包括如下步骤:
1)设计BsAb抗体基因表达盒
本发明实施例1的BsAb抗体基因表达盒除含有编码BsAb的核苷酸序列之外,还包括启动子、分泌信号肽、蛋白纯化标签、polyA加尾信号的编码序列。
在一具体实施方式中,本发明实施例1的BsAb抗体基因表达盒包括依次连接的:
编码免疫球蛋白κ链信号肽的核苷酸序列(Murine Ig kapa-chain signal peptide,SEQ ID NO:17)-BsAb抗体的基因序列(VLEpCAM-linker1-VHEpCAM-linker2-VHCD3-linker1-VLCD3;具体核苷酸序列对应表2中的EpCAM LCVR-linker1-EpCAM HCVR-linker2-CD3 HCVR-linker3-CD3 LCVR-编码组氨酸6-His标签的核苷酸序列(SEQ ID NO:18)-双重终止密码子(TAGTGA);其中,
编码免疫球蛋白κ链信号肽的核苷酸序列,如SEQ ID NO:17所示。
编码组氨酸6-His标签的核苷酸序列,如SEQ ID NO:18所示。
本发明实施例1的BsAb抗体基因表达盒还包括巨细胞病毒CMV启动子的核苷酸序列,位于Signal peptide分泌信号肽的N段;序列为SEQ ID NO:19。
本发明实施例1的BsAb抗体基因表达盒还包括牛生长激素多聚核苷酸poly A(BGH poly A)的核苷酸序列,位于终止密码子(TGATAG)的C端;序列为SEQ ID NO:20。
为了增强微环DNA载体的表达效率,添加了元件chimeric intron(介于CMV启动子和Signal peptide 分泌信号肽之间;文献报道,在多种细胞上能增强10-20倍),序列为SEQ ID NO:21。
本发明实施例1的BsAb抗体基因表达盒中,linker1为(GGGGS)3,核苷酸序列为SEQUENCE NO.22所示核苷酸序列。
linker2为GGGGS,核苷酸序列为SEQUENCE NO.23所示核苷酸序列。
Linker3为(GGGGS)3,核苷酸序列为SEQUENCE NO.22所示核苷酸序列。
具体地,各序列如下:
SEQUENCE NO.17中,
Murine Ig kapa-chain signal peptide
ATGGAGACAGACACACTCCTGCTATGGGTACTGCTGCTCTGGGTTCCAGGTTCCACTGGT;
SEQUENCE NO.18中,
6-His
CATCATCACCATCATCAT;
SEQUENCE NO.19中,
CMV promoter
GTCAATATTGGCCATTAGCCATATTATTCATTGGTTATATAGCATAAATCAATATTGGCTATTGGCCATTGCATACGTTGTATCTATATCATAATATGTACATTTATATTGGCTCATGTCCAATATGACCGCCATGTTGGCATTGATTATTGACTAGTTATTAATAGTAATCAATTACGGGGTCATTAGTTCATAGCCCATATATGGAGTTCCGCGTTACATAACTTACGGTAAATGGCCCGCCTGGCTGACCGCCCAACGACCCCCGCCCATTGACGTCAATAATGACGTATGTTCCCATAGTAACGCCAATAGGGACTTTCCATTGACGTCAATGGGTGGAGTATTTACGGTAAACTGCCCACTTGGCAGTACATCAAGTGTATCATATGCCAAGTCCGCCCCCTATTGACGTCAATGACGGTAAATGGCCCGCCTGGCATTATGCCCAGTACATGACCTTACGGGACTTTCCTACTTGGCAGTACATCTACGTATTAGTCATCGCTATTACCATGGTGATGCGGTTTTGGCAGTACACCAATGGGCGTGGATAGCGGTTTGACTCACGGGGATTTCCAAGTCTCCACCCCATTGACGTCAATGGGAGTTTGTTTTGGCACCAAAATCAACGGGACTTTCCAAAATGTCGTAATAACCCCGCCCCGTTGACGCAAATGGGCGGTAGGCGTGTACGGTGGGAGGTCTATATAAGCAGAGGTCGTTTAGTGAACCGTCAGATCACTAGTAGCTTTATTGCGGTAGTTTATCACAGTTAAATTGCT;
SEQUENCE NO.20中,
BGH poly A
GGTGATCAGCCTCGACTGTGCCTTCTAGTTGCCAGCCATCTGTTGTTTGCCCCTCCCCCGTGCCTTCCTTGACCCTGGAAGGTGCCACTCCCACTGTCCTTTCCTAATAAAATGAGGAAATTGCATCGCATTGTCTGAGTAGGTGTCATTCTATTCTGGGGGGTGGGGTGGGGCAGGACAGCAAGGGGGAGGATTGGGAAGACAATAGCAGGCATGCTGGGGATGCGGTGGGCTCTATGGAACCAGCTG;
SEQUENCE NO.21中,
chimeric intron
AACGCAGTCAGTGCTCGACTGATCACAGGTAAGTATCAAGGTTACAAGACAGGTTTAAGGAGGCCAATAGAAACTGGGCTTGTCGAGACAGAGAAGATTCTTGCGTTTCTGATAGGCACCTATTGGTCTTACTGACATCCACTTTGCCTTTCTCTCCACAGGGGTACCGAAGCCGCTAGCGCTACCGGTC;
SEQUENCE NO.22中,
Linker1
GGTGGTGGTGGTTCTGGCGGCGGCGGCTCCGGTGGTGGTGGTTCT;
SEQUENCE NO.23中,
Linker2
GGAGGTGGTGGATCC;
2)将所述的BsAb抗体基因表达盒插入p2ФC31空载体或pMC.BESXP空载体的attB和attP位点之间,具体步骤包括A)或B)中的任一一种:
A)
具体步骤参照发明人在2014年递交的PCT申请(申请号:PCT/CN2014/083741)说明书:
实施例1“一种含基因工程抗体基因表达盒的微环DNA重组母质粒p2ФC31.Bab的构建方法”,至获得本发明实施例2的具有编码EpCAM×CD3 BsAb抗体核苷酸序列的p2ФC31微环母质粒;以及
实施例6“一种含基因工程抗体基因表达盒的微环DNA重组母质粒pMC.Bab的构建方法”的步骤;至获得本发明实施例2的具有编码EpCAM×CD3 BsAb抗体核苷酸序列的pMC.BESXP微环母质粒。
本发明步骤1-2)与上述PCT申请不同的地方仅在于,本发明实施例2步骤1-2)将上述PCT申请实施例1或6中的“BiTE的基因序列”替换为本发明实施例2的“EpCAM×CD3 BsAb的基因序列”。
B)
直接采用酶切-连接的方法,在BsAb抗体基因表达盒两端设计SmaI-ApaI两个酶切位点与pMC.BESXP空载体或p2ФC31空载体,将合成的BsAb抗体基因表达盒通过酶切-连接的方式插入p2ФC31空载体或pMC.BESXP空载体的attB和attP位点之间;分别获得本发明实施例1的具有编码EpCAM×CD3 BsAb抗体核苷酸序列的p2ФC31微环母质粒或pMC.BESXP微环母质粒。
本发明实施例1制备的pMC.BESXP微环母质粒的质粒图谱如图1所示(命名为p-EpCAM×CD3)。
实施例2
具有编码EpCAM×CD3 BsAb抗体核苷酸序列的微环DNA的构建
参照发明人在2014年递交的PCT申请(申请号:PCT/CN2014/083741)说明书:
实施例2和实施例7“一种含基因工程抗体基因表达盒的微环DNA的制备方法”,分别至获得本发明实施例2的具有编码EpCAM×CD3 BsAb抗体核苷酸序列的微环DNA。
本发明与上述PCT申请实施例2和实施例7不同的地方仅在于,本发明实施例3将上述PCT申请实施例2或7中的微环母质粒替换为本发明实施例1提供的微环母质粒。
本发明实施例2制备的微环图谱如图2所示。
实施例3
BsAb抗体的表达和纯化,包括如下步骤:
(1)EpCAM×CD3 BsAb抗体在HEK 293T细胞中的表达
采用X-treme GENEHP DNA Transfection Reagent质粒转染试剂盒(Roche公司)将实施例3的微环DNA(图2所示微环母质粒制备的微环DNA)转染HEK 293T细胞,HEK 293T细胞转染EpCAM BsAb微环载体 72小时后,Western Blot检测培养基上清和细胞质中BsAb抗体表达水平,结果如图3所示,BsAb-1、BsAb-2细胞质中均有表达,但只有BsAb-1在培养基上清(分泌表达)。
(2)EpCAM BsAb抗体的纯化
将有分泌表达的抗体BsAb-1中量规模转染HEK 293T细胞,收集培养上清液进行低温超速离心,取上清,再采用His-Tag亲和树脂纯化(Omplete His-Tag Purification Resin,Roche),纯化后的抗体采用ELISA法检测蛋白质浓度;纯化后蛋白浓度达到0.6mg/ml,置于-80℃长期保存,备用于流式细胞术检测。
实施例4
流式细胞术检测EpCAM×CD3 BsAb-1抗体与K562、HepG2、Jurkat细胞的结合活性,包括如下步骤:
a)细胞培养:K562(DMEM medium+10%FBS培养;悬浮生长,无EpCAM表达细胞系;阴性对照),HepG2(DMEM medium+10%FBS培养;EpCAM表达阳性肝癌细胞系),Jurkat细胞(1640medium+10%FBS培养;悬浮生长,CD3表达阳性细胞系);
b)胰酶消化HepG2,加含血清培养基中和后离心弃上清得细胞;Jurkat为悬浮细胞直接离心收集细胞;
c)均用预冷PBS洗涕2次,200g离心5min,收集细胞,分别计数;
d)平均分配每实验组1×105个/组样品,分组如下:
K562,2组:空白组(Blank,pMC.BESXP空载体转染HEK 293T细胞后的上清;预先准备);EpCAM BsAb组(实施例3所得纯化的EpCAM BsAb抗体;预先准备)
HepG2,2组:分组如上,空白组&EpCAM BsAb组(实施例3所得纯化的EpCAM BsAb抗体;预先准备)
Jurkat,2组:分组如上,空白组&EpCAM BsAb组(实施例3所得纯化的EpCAM BsAb抗体;预先准备)
e)加入上述上清100μl/组冰上孵育30min;
f)加入1ml预冷PBS洗涤,200g离心5min,收集细胞,加事先预冷并稀释好的APC-mouse anti-6His抗体的PBS 100μl(1:1000稀释),冰上孵育30min,
g)加入1ml预冷PBS洗涤,200g离心5min,收集细胞,再用200μl PBS重悬。上流式细胞仪(BD C6)进行检测,观察结合情况。
图4为BsAb结合CD3阳性细胞(Jurkat)的流式细胞仪检测结果;图5为BsAb结合EpCAM抗原阳性细胞(HepG2)的流式细胞仪检测结果。图4和图5中,C曲线为空白组;B曲线为BsAb实验组。由图可知,BsAb-1具有结合细胞表面相关抗原的功能。
实施例5
EpCAM×CD3 BsAb-1抗体联合DCIK细胞杀伤HepG2细胞的方法
本例中靶细胞(T)为HepG2细胞;效应细胞(E)为DCIK细胞(树突状细胞调节的细胞因子诱导的 杀伤细胞,dendritic cell activated and cytokine induced killer cell)
步骤:
a)提前1天种靶细胞(HepG2)于96孔板,细胞接种量为2×104/孔;同时设置分组(如下表3;每组3个复孔):
表3 不同分组
b)第二天更换新鲜opti-DMEM培养基,100μL/孔;
c)效应细胞DCIK(E)计数并重悬于opti-DMEM培养基,按照T:E=1:8的比例,根据a)中分组加入相应数量的DCIK(1.6×105/孔,100μL/孔);
d)根据分组,相应孔加入10μl/孔纯化的BsAb抗体(浓度分别为0.02、0.04、0.06μg/μL),混匀;
e)37℃细胞培养箱孵育6小时;
f)加入CCK-8(Dojindo,日本)试剂(20μl/孔),37℃细胞培养箱孵育2小时后,450nm处测定吸光度;
g)根据CCK-8试剂盒(Dojindo,日本)说明书,统计活细胞数目并推算杀伤效率:
杀伤率=[((T+E)-T&E)/T]×100%
其中,T代表活的靶细胞数量;E代表活的效应细胞数量;则T+E等于活的靶细胞和效应细胞的总数;T&E代表靶细胞经效应细胞杀伤后的活细胞数量。
EpCAM×CD3 BsAb联合DCIK细胞杀伤实验的结果如图6所示。
在图6中,纵轴表示靶细胞死亡率的相对值;横坐标表示不同组别。
由图6可知,BsAb 0.02、BsAb 0.04、BsAb 0.06分别对应表3-组4中的BsAb抗体浓度分别为0.02、0.04、0.06μg/μl的设置;DCIK为表3-组3的结果;由此可知,单纯加入效应细胞DCIK,对靶细胞杀伤效果不佳,仅为28%左右;而同时加入DCIK和BsAb的组4,靶细胞杀伤效果分别可达62%、85%和91%,且随BsAb抗体浓度的增加,杀伤效果越好。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺