抗体处理方法与流程
本发明涉及生产适合于治疗应用的高质量抗体的方法。
背景技术:
基于生物制品的新型免疫调节药物对于患有严重的慢性疾病例如各种类型的癌症和炎性疾病的许多患者而言代表了一种革命。
许多生物药物是以抗体为基础的。因而在本领域中需要用于提供极高纯度的高质量治疗性抗体的方法。使用蛋白A亲和色谱法、离子交换色谱法和疏水作用色谱法纯化IgG是已知的(EP 746398)。使用蛋白A色谱法从错误折叠的抗体种类中分离单体IgG也是已知的(US 5429746)。由US 5641870得知,使用具有极低pH(2.5-4.5)的缓冲液通过HIC纯化抗体适合于F(ab′)2抗体的纯化。
关于一些抗体的纯化,可形成诸如抗体二聚体或高阶聚集体的抗体聚集体,并且在一些情况下,它们可能难以使用分析方法来分离。因而在本领域中需要用于去除抗体聚集体的改进方法。特别是,在本领域中需要用于提供来自细胞培养物的高质量(单体)抗体例如重组治疗性抗体的有效方法。
技术实现要素:
本发明提供了优选地在(单体)抗体产率没有显著降低的情况下用于纯化/分离抗体的改进的方法,特别是用于从含有单体抗体的溶液中去除不需要的抗体聚集体和/或抗体二聚体和/或抗体前单体(pre-monomer)的方法。
本发明涉及用于从重组抗体水溶液中去除不需要的抗体聚集体和/或抗体二聚体和/或抗体前单体的方法,其中所述方法包括使用疏水作用 色谱法(HIC)纯化(单体)抗体的步骤。本发明还涉及由这样的方法产生的产物及其用途。
说明
本文所述的方法适合于从(单体)抗体水溶液中去除抗体聚集体和/或抗体二聚体和/或抗体前单体。优选地,本文所述的方法导致具有更高纯度和/或更均一的性质的重组治疗性抗体。特别是,本发明人已惊奇地发现,通过采用疏水作用色谱法纯化步骤可显著降低抗体聚集体和/或抗体二聚体和/或抗体前单体的水平。本文提供的方法对于从细胞培养物中纯化重组抗体的过程尤其有用。
附图说明
图1:显示各种抗IL-21化合物(单体和聚集体)的SEC-HPLC色谱图。
图2:包含两条重链(HC)和三条轻链(LC)的抗体前单体杂质,其中一条轻链是非共价连接的(LC2HC2:LC)。基于LC2HC2:LC的生物物理学、光谱学和功能特征,提出了所示的分子结构,即这样一种抗体,其中额外的轻链占据了在正常情况下被HC占据的位置。该额外的LC仅仅经由非共价相互作用与另一LC结合,该另一LC又与HC共价结合。通过与谷胱甘肽或半胱氨酸形成二硫键,非共价连接的LC中的C末端半胱氨酸被加帽。
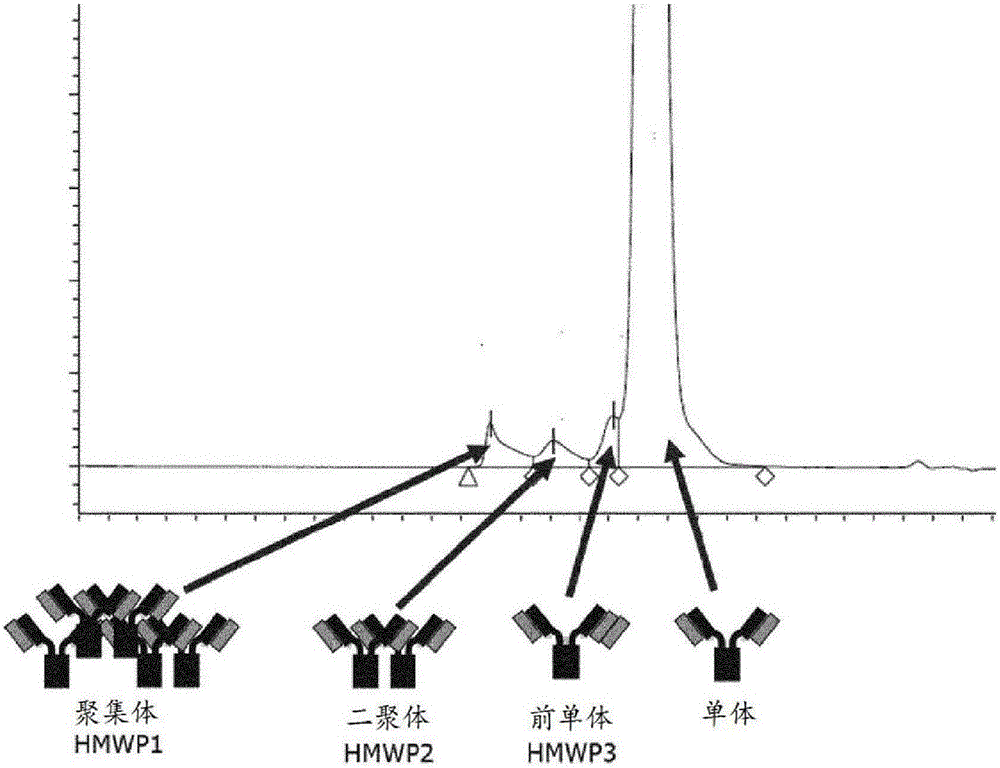
图3:图3A和图3B显示了如实施例3中所述对来自抗体组分的两种HIC分离的洗脱液级分(eluate fraction)的分析。左侧刻度表示抗体含量,而右侧刻度表示抗体聚集体的相对量。首先洗脱出单体,然后是抗体制剂的前单体(hmwp3)和二聚体(hmwp2)组分。最后洗脱出更高阶的聚集体(hmwp1)。
定义和序列信息
“生物制品”:生物药物是在诸如微生物或植物或动物细胞等生命系 统中制备的。大多数生物制品是大的复杂分子或分子的混合物。许多生物制品使用重组DNA技术产生。通过实验室中可用的测试方法表征复杂的生物药物可能是困难的,并且有时是不可能的,并且制成的生物药物的一些元素可能是未知的。抗体是生物药物的实例。
“抗体”:如本文所用的术语“抗体”、“单克隆抗体”、“单体抗体”和“mAb”旨在表示具有与抗原特异性结合的能力的免疫球蛋白分子及其片段。本文使用单体和单体抗体来描述常规形式的抗体,例如由两条轻链和两条重链组成的抗体。本文的抗体优选地是重组抗体。全长抗体包含四条多肽链:通过二硫键互相连接的两条重(H)链和两条轻(L)链。每条重链包含重链可变区(在此缩写为HCVR或VH)和重链恒定区。重链恒定区包含三个结构域:CH1、CH2和CH3。每条轻链包含轻链可变区(在此缩写为LCVR或VL)和轻链恒定区。轻链恒定区包含一个结构域:CL。VH和VL区可进一步细分为高变区,被称为互补决定区(CDR),其中散布着被称为构架区(FR)的更保守的区域。每个VH和VL包含三个CDR和四个FR,从氨基末端至羧基末端以下列顺序排列:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。抗体可以为不同同种型的形式;例如IgG(例如IgG1、IgG2、IgG3、IgG4)、IgGA1、IgA2、IgD和IgE。全长抗体通常是二价的/双价的,即,它具有用两只“臂”结合抗原的能力。相反,单价抗体(例如Fab片段)仅包含一个对抗原具有特异性的结合位点。如本文所用的术语“人抗体”意指具有来源于人种系免疫球蛋白序列的可变区和恒定区的抗体。“人源化抗体”包含移植到人类骨架上的来自非人来源(例如小鼠)的CDR序列。
“抗体聚集体”:聚集体是分子量不同于单体抗体的抗体或抗体部分的复合物。
抗体聚集体的实例包括大聚集体,其包含3个或更多个非共价结合的抗体分子。就图1而言,这样的聚集体被称为HMWP1或更高阶的聚集体。抗体二聚体被称为HMWP2,并且表示两个非共价结合的抗体的复合物。本文所述的非传统聚集体被称为HMWP3或前单体,并且其被表征为抗体单体和非共价结合的轻链的复合物。
“疏水作用色谱法(HIC)”是指依赖于物质对液体移动介质和对它们所通过的固定吸附介质如纸、明胶或氧化镁的差异亲和力来分离复杂混合物的各种技术。以含有附接至骨架的芳香疏水基团的材料为基础的固定柱材料,例如具有共价偶联的苯基基团的交联琼脂糖,是优选的。具有约2-15%、3-12%、4-10%、4-8%、5-7%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%或15%交联的琼脂糖是优选的。特别优选的柱材料是以苯基琼脂糖(Phenyl Sepharose)或具有类似性质的材料为基础的,例如“Phenyl Sepharose 6Fast(low sub和high sub)”和“Phenyl Sepharose High”以及Phenyl Sepharose它们均为GE-HealthCare.Life Science的商标。
“IL-21”是一种I型细胞因子.它对先天性和适应性免疫应答均发挥多效性作用。其主要由活化的CD4+T细胞、滤泡T细胞和自然杀伤细胞产生。此外,最近的证据表明,Th17细胞可以产生大量的IL-21。IL-21增加CD8+T细胞的细胞毒性,并且可以在抗原的存在下促进CD8+细胞的增殖。IL-21由IL-6诱导,IL-6是一种已知促进Th17细胞的发育的细胞因子。IL-21以自分泌方式作用于T辅助细胞,促进其自身的产生并支持T辅助细胞分化为Th17细胞。IL-21还作用于B细胞并增加抗体产量。IL-21增强免疫的能力已引起对IL-21的治疗用途的极大兴趣。动物研究已证明了在IL-21与肿瘤特异性抗体之间的协同作用,这可能提示了未来IL-21作为抗肿瘤抗体的增效剂的治疗用途。而且,IL-21在自身免疫病中发挥复杂的作用。IL-21促进Th17发育的能力使其成为促炎性细胞因子,并且目前正在研究IL-21抑制剂在治疗一系列不同的自身免疫病中的潜在用途。
SEQ ID No1:hIL-21(包括横跨氨基酸1-29的信号肽-mAb 5表位以粗体显示;IL-21Rα结合位点以下划线显示;形成mAb 14表位的氨基酸残基用斜体小写字母表示)
“IL-21抗体”:IL-21特异性单克隆(重组)抗体在本领域中已知,例如由WO2007111714和WO2010055366(Zymo-Genetics,Inc.)可知。具体而言,WO2010055366描述了一种抗IL-21抗体,其由克隆号362.78.1.44命名(“mAb 5”),它具有对其同源抗原的高亲和力和其他所需性质,显示出对人和食蟹猴IL-21的特异性。其中描述的另一种抗体以克隆号366.328.10.63标识(“mAb 14”)。本文优选的IL-21抗体是那些能够竞争/干扰IL-21受体(IL-21R)与IL-21的结合的抗体——这类抗体的实例在WO12098113中公开,包括“mAb 5”。本文其他优选的IL-21抗体是那些能够竞争/干扰普通γ链与IL-21的结合的抗体——这类抗体的实例在WO201216402中公开,包括“mAb 14”。因此,在WO12098113和WO2012164021中公开的具有竞争/干扰受体与IL-21结合的能力的抗体并入本文。
优选地,本文的IL-21抗体与人IL-21的螺旋1和3结合。优选地,该IL-21抗体与IL-21上的不连续表位结合,其中所述表位包含如SEQ ID NO 1所示的氨基酸137至Y52和N92至P108。优选地,该IL-21抗体包含如SEQ ID NO 2所示的三个CDR序列和如SEQ ID NO 3所示的三个CDR序列。优选地,该IL-21抗体与γC(γ链)竞争结合IL-21。优选地,该IL-21抗体与人IL-21的螺旋2和4结合。优选地,该IL-21抗体与包含如SEQ ID NO.1所示的氨基酸Glu 65、Asp 66、Val 67、Glu 68、Thr 69、Asn 70、Glu 72、Trp73、Lys 117、His 118、Arg 119、Leu 143、Lys 146、Met 147、His 149、Gln 150和His 151的表位结合。优选地,该IL-21抗体包含如SEQ ID NO 4所示的三个CDR序列和如SEQ ID NO 5所示的三个CDR序列。
SEQ ID No2:“mAb 5”:轻链(省略信号肽-CDR序列以粗体/下划线表示-恒定区以小写字母表示-可变区以大写字母表示)
SEQ ID No3:“mAb 5”:IgG1同种型的重链(省略信号肽-CDR序列以粗体/下划线表示-恒定区以小写字母表示-可变区以大写字母表示)
SEQ ID No4:“mAb14”轻链(省略信号肽-CDR序列以粗体/下划线表示,恒定区以小写字母表示)
SEQ ID No5:“mAb14”,IgG4同种型的重链(省略信号肽-CDR序列以粗体/下划线表示,恒定区以小写字母表示)
具体实施方式
本发明涉及用于从重组抗体水溶液中去除不需要的抗体聚集体和/或抗体二聚体和/或抗体前单体的方法,其中所述方法包括使用疏水作用色谱法(HIC)纯化单体抗体的步骤。本发明还涉及由这样的方法产生的产物及其用途。应当明白,使用术语“去除”来描述抗体聚集体的量或浓度的减少,因为纯化步骤很少能够去除全部不需要的组分。
根据本发明的抗体产物例如是包含至多1%抗体前单体聚集体的组合物,尤其是包含至多1%抗体前单体聚集体的抗IL-21抗体的组合物。
如本文实施例所述,抗体组合物的制备需要多个步骤,其中大多数是本领域技术人员已知的。本发明描述HIC从可能已在抗体的表达过程或初始纯化过程中形成的抗体聚集体中分离单体抗体分子的特定用途。先前已使用疏水作用色谱法从二聚体和更高阶的聚集体中分离单体抗体。如本文所述,本申请的发明人已鉴定了如上所述已经被命名为前单体的抗体聚集体的另一种类,其包括抗体单体和与之非共价结合的轻链。与单体抗体相比,轻链的附接仅略微改变了分子量,因此在纯化单体抗体以供治疗应用方面代表了更大的挑战。如图1所见,当通过SEC-HPLC分析时,前单体恰好在单体抗体的主峰之前(并且一起)洗脱下来,从而与抗体的二聚体和更高阶的聚集体清晰地区分开来。
抗体制剂是包含感兴趣的单体抗体以及抗体聚集体如前单体(如本文所述)、抗体二聚体和更高阶的抗体聚集体作为该制剂的组分的组合物。
在一个实施方案中,感兴趣的抗体是全长抗体,例如所述制剂应当包含大部分的该特定全长抗体,而所述抗体聚集体被认为是杂质。
所述抗体制剂可以如前所述从重组来源中获得,并通过一种或多种旨在至少部分地纯化感兴趣的抗体的方法处理。这样的方法是本领域已知的,并且包括诸如蛋白A纯化、过滤和其他色谱方法。
根据本发明的方法包括以下步骤;
i)获得包含前单体组分的抗体制剂
ii)将所述抗体制剂加载至疏水作用色谱柱,以使抗体和前单体与柱材料结合
iii)顺序洗脱所述制剂的抗体组分,和
iv)选择不包含大量前单体的洗脱液级分。
上文描述了疏水作用色谱柱的合适类型。HIC柱材料的结合容量优选为例如至少约50g抗体/L或至少60g抗体/L。在优选的实施方案中,柱材料包含4-8%含有共价偶联的苯基基团的交联琼脂糖。在进一步的实施方案中,HIC柱材料包含约15-35、15-30、20-35、20-30、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34或35μmol苯基/ml凝胶,或20/40μmol/ml。据估计,20-25μmol苯基/ml凝胶对应于Sepharose High Performa的估算容量,而40μmol苯基/ml凝胶对应于Sepharose 6的估算容量。
HIC柱的长度可以影响HIC纯化步骤的质量,因此可优选更长的柱,诸如至少5cm的HIC柱,诸如至少8cm,诸如至少12cm。在进一步的实施方案中,HIC柱为5-50cm,诸如8-25cm,诸如10-20cm,诸如8-15cm。
在一个实施方案中,在硫酸铵((NH4)2SO4)的存在下进行加载(步骤b),例如硫酸铵的浓度为约0.8-1.5mol/kg,优选1.2-1.0或1.1-0.9mol/kg。
在这样的实施方案中,可通过降低硫酸铵浓度进行洗脱,例如通过使用直到0mol/kg的线性梯度的硫酸铵。
HIC的使用已证明有分离所述制剂的抗体组分的能力,因为各种组分以顺序方式洗脱下来。虽然洗脱被描述为顺序的,但是当洗脱的级分包含多于一种抗体组分时,可能存在一定的重叠,而大部分单独的组分应当洗脱在不同的级分中。
在一个实施方案中,单体抗体组分作为第一抗体组分洗脱下来。在这样的实例中,通过收集在包含大部分前单体和抗体二聚体的级分之前洗脱的级分,可以获得感兴趣的抗体溶液。
在这样的实施方案中,通过取消选择(deselecting)后续的洗脱液级分,可以从抗体组合物中排除前单体。在一个实施方案中,通过仅选择在大部分前单体之前洗脱的级分,从抗体溶液中去除前单体(和其他 聚集体)。
根据本发明选择不包含大量前单体的洗脱液级分。大量是对于纯化单体抗体的目的而言将被认为是不可接受的量。
在进一步的实施方案中,取消选择包含大量任何聚集体的洗脱液级分。同样地,如果聚集体的总和是大量的,则应当取消选择这样的洗脱液级分。在大多数情况下,如果聚集体占蛋白质含量的5%,则将会存在大量的聚集体(包括前单体)。
如实施例中所述,一种或多种抗体聚集体的阈值含量可以确定哪些洗脱液级分对于获得感兴趣的抗体组合物是有用的。在优选的实施方案中,抗体聚集体的总量为1%或更低。
一种根据本发明的方法,其中所述方法包括以下步骤:
a)在宿主细胞中表达抗体,其中所述宿主细胞包含编码所述抗体的载体(或分别编码重链和轻链的两种载体),
b)收集来自步骤(a)的包含所述抗体的细胞培养基,
c)在蛋白A亲和柱上结合来自在步骤(b)中获得的细胞培养基的抗体,并在约3.5(例如2.5-4.5、3-4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9或4.0)的pH下用约10mmol/kg甲酸(例如5-15、7-13、8-12、5、6、7、8、9、10、11、12、13、14或15mmol甲酸/kg)洗脱所述抗体,
d)任选地将在步骤(c)中获得的洗脱液的pH调节至3.7,以便灭活任何病毒(还可以使用其他方法灭活病毒),
e)按照需要调节pH后,将在步骤(c)或(d)中获得的洗脱液加载在阳离子交换色谱柱(CIEX)上,并任选地使用例如POPOS50HS用盐梯度(例如NaCl梯度)洗脱所述抗体,并且任选地可以使用0.45μm的孔隙大小过滤洗脱液,任选地与pH调节相结合,
f)使用例如20N病毒过滤器,使在步骤(e)中获得的洗脱液经历病毒过滤,
g)泵送在步骤(f)中获得的经过滤的洗脱液穿过流穿膜(flow through membrane)(诸如Q膜),并且任选地在所述流穿膜上过滤之前调节pH和电导率,
h)在浓度为约0.8-1.5mol/kg,优选1.0mol/kg的硫酸铵的存在下,将在步骤(g)中获得的流穿产物加载在疏水作用色谱柱上,
i)用逐渐降低的硫酸铵梯度洗脱所述抗体,
j)通过超滤浓缩在步骤(i)中获得的洗脱液中的所述抗体,
k)然后任选地在蔗糖的存在下渗滤并进一步超滤。
如本文所述,可使用该方法来制备包含至多1%抗体聚集体(总HMWP)的抗体组合物,其中该方法包括通过使用疏水作用色谱法(HIC)从重组抗体水溶液中去除抗体前单体。在进一步的实施方案中,使用疏水作用色谱法(HIC)将前单体和抗体二聚体均与(正确折叠的)单体抗体分离开。如上文所述,该方法可由本文以上描述的单独步骤的说明进一步描述。
本发明的一个方面涉及通过根据本发明的方法获得(或可获得)的药物产品或制剂。在一个实施方案中,本发明涉及一种药物产品,其中抗体聚集体的量为抗体总量的1%或更低。在大多数情况下,抗体聚集体如抗体二聚体和抗体前单体的量可通过SEC-HPLC来测量。检测水平以下的聚集体的残留水平是很难预计的,但当然是有吸引力的实施方案。进一步优选的是,根据本发明的药物产品不包含可检测的病毒。可使用本领域公知的方法测量病毒计数。
所得的抗体组合物可被称为均质抗体组合物,它可以直接用作药物产品或用于制备药物产品。最终的抗体产物可被称为药物制剂。
根据本发明,通过本文所述的方法获得的抗体组合物、抗体产物、药物组合物或药物产品可用于在治疗方法中使用。因此,所述组合物和产物可用于在炎性疾病的治疗方法中使用。
本文公开的抗体组合物和产物用于在炎性疾病和病状的治疗方法中使用,尤其是抗炎性疾病,例如银屑病、I型糖尿病、格雷夫斯病(Grave’s disease)、炎性肠病(IBD)、克罗恩病、溃疡性结肠炎、肠 易激综合征、多发性硬化、类风湿性关节炎(RA)、自身免疫性心肌炎、川崎病(Kawasaki disease)、冠状动脉疾病、慢性阻塞性肺疾病、间质性肺病、自身免疫性甲状腺炎、系统性红斑狼疮(SLE)、硬皮病、系统性硬化病、银屑病关节炎、骨关节炎、特应性皮炎、白癜风、移植物抗宿主病、舍格伦综合征(syndrome)、自身免疫性肾炎、古德帕斯丘综合征(Goodpasture’s syndrome)、慢性炎性脱髓鞘性多神经病、变态反应、哮喘和其他自身免疫病。本文的抗体产物还适合于治疗各种癌症类型,例如癌、肉瘤、淋巴瘤、白血病、生殖细胞肿瘤和胚细胞瘤。
如本文所述的发明在下列实施方案中举例说明,但不受其限制:
实施方案
1.一种用于从重组抗体水溶液中去除抗体二聚体和/或抗体前单体的方法,其中所述方法包括使用疏水作用色谱法(HIC)将二聚体和/或前单体与(正确折叠的)抗体分离的步骤。
2.一种用于从重组抗体水溶液中去除抗体前单体的方法,其中所述方法包括使用疏水作用色谱法(HIC)将前单体与单体(正确折叠的)抗体分离的步骤。
3.根据本发明的方法,其中所述抗体为IL-21抗体。
4.根据本发明的方法,其中所述抗体包含如SEQ ID NO 2所示的三个CDR序列和如SEQ ID NO 3所示的三个CDR序列。或者,所述抗体包含SEQ ID NO 2+3所示的VH/VL序列。
5.根据本发明的方法,其中所述抗体为全长抗体。
6.根据本发明的方法,其中所述HIC柱材料具有50g抗体/L(或更大)的结合容量,优选60g抗体/L(或更大)。
7.根据本发明的方法,其中所述HIC柱材料包含4-8%含有共价偶联的苯基基团的交联琼脂糖,优选6%。
8.根据本发明的方法,其中所述HIC柱材料包含约15-35、15-30、20-35、20-30、15、16、17、18、19、20、21、22、23、24、25、26、 27、28、29、30、31、32、33、34或35μmol苯基/ml凝胶,或20/40μmol/ml(20-25μmol苯基/ml凝胶对应于Sepharose High的估算容量;40μmol苯基/ml凝胶对应于Sepharose 6的估算容量)。
9.根据本发明的方法,其中所述HIC柱的长度为至少5cm,诸如至少8cm,诸如至少12cm。
10.根据本发明的方法,其中所述HIC柱的长度为5-50cm,诸如8-25cm,诸如10-20cm,诸如8-15cm。
11.根据本发明的方法,其中所述方法包括以下步骤:在高浓度(约1mol/kg,或至少约0.8mol/kg,或至少约0.8mol/kg且不大于1.5mol/kg)的硫酸铵的存在下,将所述抗体加载在HIC柱上,随后用逐渐降低的硫酸铵梯度从HIC柱上洗脱所述抗体。
12.根据任一前述权利要求所述的方法,其中在当硫酸铵浓度从约0.8mol/kg降低至0.4mol/kg时所得的洗脱液级分中获得所述单体抗体。
13.根据本发明的方法,其中通过在前单体的累积量达到约1%时取消选择洗脱液级分来去除所述前单体。
14.根据本发明的方法,其中在当OD280在前沿0.2与后沿8.0之间时所得的洗脱液级分中获得所述单体抗体。
15.根据本发明的方法,其中在包含高含量的前单体和抗体二聚体的级分之前洗脱的级分中获得感兴趣的抗体组合物。
16.根据本发明的方法,其中在包含高含量的前单体的级分之前洗脱的级分中获得感兴趣的抗体组合物。
17.根据本发明的方法,其中所述方法导致病毒颗粒的减少。
18.根据本发明的方法,其中进行所述HIC纯化,作为浓缩所述抗体之前,和/或渗滤之前和/或冷冻干燥之前和/或配制所述抗体之前的最后一步。
19.根据本发明的方法,其包括以下步骤;
i)获得包含前单体组分的抗体制剂
ii)将所述抗体制剂加载至疏水作用色谱柱上
iii)使抗体和前单体与柱材料结合
iv)顺序洗脱所述制剂的抗体组分,和
v)选择不包含大量前单体的洗脱液级分。
20.根据本发明的方法,其中所述方法包括以下步骤:
a.在宿主细胞中表达抗体,其中所述宿主细胞包含编码所述抗体的载体(或分别编码重链和轻链的两种载体),
b.收集来自步骤(a)的包含所述抗体的细胞培养基,
c.在蛋白A亲和柱上结合来自在步骤(b)中获得的细胞培养基的抗体,并在约3.5(例如2.5-4.5、3-4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9或4.0)的pH下用约10mmol/kg甲酸(例如5-15、7-13、8-12、5、6、7、8、9、10、11、12、13、14或15mmol甲酸/kg)洗脱所述抗体,
d.任选地将在步骤(c)中获得的洗脱液的pH调节至3.7,以便灭活任何病毒(还可以使用其他方法灭活病毒),
e.将在步骤(c)或(d)中获得的洗脱液加载在阳离子交换色谱柱(CIEX)上,并任选地使用例如POPOS 50HS用盐梯度(例如NaCl梯度)洗脱所述抗体,并且任选地可以使用0.45μm的孔隙大小过滤洗脱液,任选地与pH调节相结合,
f.使用例如20N病毒过滤器,使在步骤(e)中获得的洗脱液经历病毒过滤,
g.泵送在步骤(f)中获得的经过滤的洗脱液穿过流穿膜(例如Q膜),并且任选地在所述流穿膜上过滤之前调节pH和电导率,
h.在浓度为约0.8-1.5mol/kg,优选1.0mol/kg的硫酸铵的存在下,将在步骤(g)中获得的流穿产物加载在疏水作用色谱柱上,
i.用逐渐降低的硫酸铵梯度洗脱所述抗体,
j.通过超滤浓缩在步骤(i)中获得的洗脱液中的所述抗体,
k.然后任选地可能在蔗糖的存在下渗滤并进一步超滤,以及
l.向在步骤(j)中获得的浓缩的洗脱液中或步骤(k)的洗脱液中添加表面活性剂,并任选地过滤所述洗脱液,然后任选地冷冻干燥所述经过滤的洗脱液。
21.一种用于制备包含至多1%抗体聚集体(总HMWP)的抗体组合物的方法,其包括通过使用疏水作用色谱法(HIC)从重组抗体水溶液中去除抗体前单体。
22.根据实施方案21所述的方法,其中使用疏水作用色谱法(HIC)将前单体和抗体二聚体与(正确折叠的)抗体分离开。
23.根据实施方案21或22所述的方法,其包括实施方案3-20的一个或多个特征。
24.通过根据本发明的方法获得(或可获得)的药物产品。
25.根据本发明的药物产品,其中抗体聚集体的量为抗体总量的1%或更低。
26.根据本发明的药物产品,其中不存在可检测的病毒。可使用本领域公知的方法测量病毒计数。
27.一种包含根据本发明的药物产品的药物制剂。
28.根据本发明的药物制剂在治疗炎性疾病中的用途。
29.根据本发明的药物制剂在治疗选自1型糖尿病、炎性肠病、克罗恩病、银屑病、移植物抗宿主病和SLE的炎性疾病中的用途。
30.根据本发明的药物制剂在治疗癌症中的用途。
31.根据本发明的药物产品,其用于在炎性疾病的治疗方法中使用。
32.根据本发明的药物产品,其用于在选自1型糖尿病、炎性肠病、克罗恩病、银屑病、移植物抗宿主病和SLE的炎性疾病的治疗方法中使用。
33.根据本发明的药物产品,其用于在癌症的治疗方法中使用。
实施例
实施例1
纯化过程已经证明对于在工业规模上从细胞培养物中纯化各种重组抗体是有用的。这一过程可以扼要表示如下:
这一相对简单的纯化过程导致极高纯度的高抗体产率,并且因此对于在工业规模上纯化不同的重组治疗性抗体是非常有效的,关于具体实例的进一步的信息也参见WO2009/138484。
然而,关于IL-21抗体-尤其是在WO2010055366中公开的具有克隆362.78.1.44的CDR序列的抗体(mAb 5”)-的纯化,所得到的纯化的IL-21抗体出乎意料地含有约2-3%的量的不需要的高分子量蛋白质(HMWP)。结果还证明HMWP含量随时间累积/增加——尤其是二聚体浓度。在不显著降低抗体产率的情况下,这些聚集体中的一些显然难以分离。在不显著降低抗体产率的情况下,采用了多种纯化方法来试图去除HMWP(包括抗体二聚体和抗体前单体),以达到约为或低于1%的量(各种阳离子交换法,如HS 50,所研究的参数,如流速、载量、梯度长度、切割标准,EMD COO,EMD SO3, CaptoTM Adhere,CaptoTM MMC,和某些HIC树脂,Phenyl-5PW)。这些方法均导致抗体产率的显著(且不可接受的)降低。聚集体的SEC HPLC分析揭示了它们包含抗体二聚体和抗体前单体。
因此希望提供具有改善的纯度的抗IL-21组合物,所述抗体具有含量降低的不需要的聚集体,如二聚体和/或前单体。如本文所述,本发明人发现了这一问题的解决方案。已知HIC在一些情况下对于在抗体纯化过程中减少抗体二聚体和高阶聚集体是有用的。因此,结合在高硫酸铵浓度下的结合以及在到零硫酸铵的梯度中的洗脱,研究了各种树脂。
在例如抗IL-21过程中的一些杂质是被统称为聚集体的HMWP(高分子量蛋白质)。它们包含HMWP1=更高阶的聚集体,HMWP2=抗体二聚体,HMWP3=抗体前单体(图2)。HMWP1在CIEX步骤过程中得以去除,但通常的过程并不会导致前单体和二聚体的充分减少。CIEX(POROS 50HS或Fractogel COO)似乎对前单体(HMWP3)完全没有选择性(也参见实施例4)。
实施例2
根据厂商说明书使用包含Phenyl SepharoseTM FF和/或Phenyl SepharoseTM HP的柱材料进行HIC纯化步骤出乎意料地证明了对前单体和二聚体的所需要的选择性——前单体在单体峰的后部与其他聚集体一起洗脱下来(参见图3和以下描述)。具有逐渐降低的硫酸铵浓度的梯度优选用于HIC洗脱步骤。Phenyl SepharoseTM HP材料具有高结合容量(大于60g mAb/L填充材料)的优势。这种类型的柱材料具有相对较低密度的苯基基团(25μmol/ml),因此令人惊讶的是,与例如苯基密度为40μmol/ml的Phenyl SepharoseTM FF high sub相比,该材料具有与Ab结合容量相关的优越的性能。
HIC步骤优选地在最终UF/DF步骤之前(在配制活性药物成分一在这种情况下为重组治疗性抗体一之前)发生。该HIC步骤优选地作为最终步骤之一在冷冻干燥和/或制备抗体的药物制剂之前发生,以避免在纯化过程中二聚体的累积。可在HIC之后使用缓冲液更换,如渗滤步骤, 以确保抗体在适合于冷冻干燥的溶液中。
IL-21抗体的二聚体形成在生产过程中明显地自发地发生。因此,HIC步骤/HIC纯化过程可用于纯化具有形成聚集体的倾向的抗体。
除了减少与该蛋白质的产生(和纯化)相关的二聚体形成之外,HIC步骤还可能导致病毒清除/减少,从而还可能提高纯化的抗体产物的安全性。
在抗IL-21纯化中的HIC纯化步骤:
溶剂:
方法
柱(直径为1cm,长度为13cm)用10ml Phenyl Sepharose HP填充,用5个柱体积(CV)的S1平衡,流速为15CV/h。
通过将AmSO4添加至从前一阳离子交换步骤中获得的抗体溶液中,制备加载溶液。向110ml的起始抗体制剂(6.6g/L)中添加16.72g AmSO4,得到5.57g/L的抗体浓度。以流速9CV/h加载105ml的加载溶液。所得的载量为58g抗体/L树脂。
加载之后,用5CV的S1(流速为15CV/h)洗柱,并通过100%S1至100%S2的梯度以15CV(流速为15CV/h)、然后用5CV的S2(流速为15CV/h)实现洗脱。根据OD收集级分,从前沿OD 0.2开始至后沿8.0。最后用2CV的S3以流速3CV/h对柱进行清理(sanitise)。使用OD280测量蛋白质含量,OD280被定义为在280nm处在1cm上的UV吸光度。为了最小化前单体(和其他聚集体)的量,使截断值低于1%HMWP,这样可通过收集在前沿0.2的OD280时从柱上洗脱的级分 连同后沿直到8.0的OD280时洗脱的级分来获得感兴趣的抗体产物。
分析了所得洗脱液的单体和聚集体的百分比。分析程序为尺寸排阻色谱法(SE-HPLC)试验,其中使用TSK G3000SWx1柱分析样品,使用磷酸钠/异丙醇缓冲液进行等度洗脱,随后在280nm下进行UV检测。相对于总积分面积计算%HMWP。结果包含在下表中,表明HIC步骤去除了大多数的聚集体,使聚集体的总浓度降低至0.96%。
实施例3
为了进一步分析HIC的效果以及进一步分析收集洗脱液中的哪些级分才能在最大化抗体产率的同时最小化前单体的含量,如上所述使用Phenyl Sepharose HP和46g/L的蛋白质载量进行纯化。
使用36.8ml蛋白A病毒灭活的抗体制剂(浓度为6.6g/L)通过添加5.6g AmSO4制备加载溶液。
向长度为3.4cm且直径为1cm的柱中填充2.7ml Phenyl Sepharose HP,并用5CV的S1b平衡,并加载26.33ml的加载溶液(4.77g抗体/L),其相当于46g抗体(抗IL-21)/L树脂的总载量。
将该柱用5CV的S1b洗涤,并用100%S1b至100%S2的线性梯度以10CV、然后用6CV的S2进行洗脱。在洗脱过程中收集2ml级分。将抗体制剂加载在包含1mol/kg(NH4)2SO4的缓冲液中。通过线性降低(NH4)2SO4浓度以在级分15时达到0mol/kg,在级分3-15中获得蛋白质的洗脱。表2显示了每一级分中的蛋白质浓度以及HMWP1、HMWP2和HMWP3的百分比。图3A中示出了该纯化过程,并且HMWP1和HMWP2显示出与单体抗体很好地分离的清晰的峰,而前单体(HMWP3)在各个级分中洗脱出来。
表2:来自Phenyl Sepharose HP纯化的HIC级分的蛋白质分析
以类似的方式进行并分析使用Phenyl Sepharose 6FF和37g/L的蛋白质载量的纯化。
向长度为11cm且直径为0.5cm的柱中填充2.1ml Phenyl Sepharose6FF,并用5CV的S1b平衡。
通过使14.2ml上述蛋白A纯化且病毒灭活的抗体制剂(6.6g/L)与5.8ml的3M AmSO4(pH 7)混合,由该抗体制剂制备加载溶液。将13.7ml的加载溶液(4.77g/L)加载到柱上,相当于30g抗体/L树脂的载量。
加载之后,将柱用5CV的S1b洗涤,并用100%S1b至100%S2的线性梯度以10CV、然后用10CV的S2进行洗脱。在洗脱过程中,收集2ml级分。在级分2至12之间采用在25mmol/kg Na2HPO4(pH 7)中从1.2mol/kg至0mol/kg(NH4)2SO4的梯度。表3显示了获得的洗脱级分的蛋白质分析。
表3:来自Phenyl Sepharose 6FF纯化的HIC级分的蛋白质分析
为了最小化前单体的量,使截断值低于诸如与约0.4mol/kg的(NH4)2SO4浓度相关联的1%累积的HMWP2和HMWP3。因此,如前所述,可通过获得在前沿0.2的OD280时从柱上洗脱的级分连同在后沿最高8.0的OD280时洗脱的级分来收集感兴趣的产物,从而排出具有高含量的前单体和二聚体的级分。
实施例4
进行了大规模的实验。从在阴离子交换色谱法之后获得的抗体制剂开始。
向在总重量为391kg的组合物中的总计1411g的抗体中添加59.58kg固体(NH4)2SO4,用1.0mol/kg NaOH将pH调节至7.0。
向填充有10.73lPhenyl Sepharose HP(长度为15.6cm,直径为29.6cm)且采用3.8CV的S1以流速80l/h平衡的柱上以流速60l/h加载201.8l的上述加载溶液,相当于62.9g抗IL-21抗体/L树脂。将该柱用5CV的S1以80l/h洗涤,并用100%S1至100%S2的线性梯度以15CV、80L/h、然后用5CV的S2以流速80L/h进行洗脱。将该柱用2CV的S3以流速20l/h进行清理,并最终用2CV的水以流速80l/h冲洗。从前沿0.2至后沿8.0的OD280收集抗体产物。相比于加载溶液的2.9%HMWP的纯度,所得纯度为0.8%HMWP。
基于以上所述,还应当指出,柱的长度以这样一种方式影响所获得的结果,即较长的柱(如本实验中使用的)比实施例3中使用的较短的 柱提供更好的分辨率。
实施例5
最初,进行实验来评估CIEX POROS 50HS对于获得不含前单体的抗体组合物的可用性。
缓冲液A:25mmol/kg乙酸钠,pH 5,缓冲液B:25mmol/kg乙酸钠+300mmol/kg NaCl,pH 5。
用加载有20g aIL21/l树脂的5ml柱(1cmD x20cmL)进行纯化。将该柱用5CV的缓冲液A进行平衡,加载,并用100%缓冲液A至100%缓冲液B的梯度以20CV、然后用5CV的缓冲液B进行洗脱。在级分25与37之间使用50%-72.5%的缓冲液B的梯度获得单体抗体的洗脱。如上分析所述分离,并且从图4中可以看出,前单体(HMWP3)在单体峰的前面洗脱下来,而二聚体在单体峰的尾部洗脱下来。由于HMWP3较早洗脱,因此只可能获得极少的具有低含量聚集体(前单体、二聚体和/或高阶聚集体)的级分,这导致极差的产率。
表4
实施例6
包括HIC步骤的抗体纯化过程的整体描述。
进行蛋白A衍生步骤以浓缩澄清化的培养肉汤,并且该步骤充当mAb的极具特异性的亲和捕获步骤。而且,该步骤包括通过调节pH至3.7进行的病毒灭活(包膜病毒)。
CIEX是采用50HS树脂的阳离子交换步骤。将来自前一蛋白A步骤的病毒灭活的洗脱液调节至pH 5.0,并且可能在加载到柱上之前过滤。在用平衡溶剂洗涤之后,采用盐梯度洗脱产物。减少了HCP、培养基污染物和聚集体。
在Planova 20N病毒过滤器上进行作为死端过滤的病毒过滤,以去除来自其中表达mAb的CHO细胞的潜在病毒。
Q膜步骤是一种流穿步骤,其中在加载过程中使稀释的产物通过,并且主要减少了DNA、内毒素、HCP和其他杂质。
引入HIC步骤以减少二聚体和前单体含量。向来自Q膜步骤的产物中添加硫酸铵,并将该产物加载到HIC柱上。通过从高至低硫酸铵浓度的梯度实现洗脱。
最后的步骤为UF/DF,其中将产物通过TFF进行浓缩,并用包含蔗糖的API制剂缓冲液进行渗滤。添加吐温80并使API产物通过0.22μm过滤器过滤。
总结
以下表5中概括了来自各个实验的结果,其显示在所有试验中,HIC步骤均能够降低抗体聚集体的浓度,从而提供了适合于在药物产品或制剂中进一步使用的抗体组合物。
表5结果的比较
- 还没有人留言评论。精彩留言会获得点赞!