通过与氨甲蝶呤选择偶联的睡美人转座子制备工程化T细胞的制作方法
本申请要求2014年10月2日提交的美国临时专利申请号62/058,973、2014年4月10日提交的美国临时专利申请号61/977,751、2014年4月30日提交的美国临时专利申请号61/986,479、2014年12月9日提交的美国临时专利申请号62/089,730、2014年12月11日提交的美国临时专利申请号62/090845和2014年12月5日提交的美国临时专利申请号62/088,363的优先权的权益。据此上述申请的全部公开内容特别地通过引用全文并入。
序列表、表格或计算机程序列表的引用
本发明连同电子格式的序列表一起提交。序列表提供为2015年3月20日创建的大小为4kb的命名为SCRI.077PR.TXT的文件。信息是电子格式的序列表通过引用全文并入本文。
技术领域
本文描述的本发明的方面包括使用具针对通过病毒或癌症细胞呈现的分子的受体的基因工程化人T细胞,治疗、抑制、改善和/或清除受试者的病毒或癌症细胞的方法。
背景技术:
工程化人T细胞是有前途的针对癌症免疫治疗和病毒治疗的治疗途径。表达与另外的基因组合的嵌合抗原受体以提高T细胞的增殖、存活或肿瘤归巢的T细胞能进一步改善效果但需要多次稳定的基因转移事件。因此,需要提高多重工程化细胞的生产效率的方法。可以使用通过核转染引入的微环中的睡美人转座子系统获得T细胞的有效率、稳定的转导。也可以实现针对表达耐代谢抑制的突变二氢叶酸还原酶(DHFRdm)的细胞,快速选择用氨甲蝶呤(MTX)转导的细胞。
技术实现要素:
本文描述的是表达多个转基因,优选编码对通过病毒或癌细胞呈现的分子特异的受体或嵌合受体的多个转基因的T细胞的优先扩增方法。在一些供选择的方案中,使用增加浓度的MTX将对转化的T细胞的选择压力应用于二级MTX选择中。
在一种供选择的方案中,提供了用于将核酸稳定插入寡核苷酸的基因递送多核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中提供了可选择的基因递送多核苷酸,其中基因递送多核苷酸包括第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列;第四序列,其中第四序列包括编码蛋白质或编码用于mRNA转录的序列的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用于选择用基因递送多核苷酸转导的细胞以提高表达至少一个基因的细胞的比,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列是针对在人体内表达和/或减少第五序列的总GC/AT比而密码子优化的。在优选的供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,T细胞是前体T细胞。在一些供选择的方案中,前体T细胞是造血干细胞。
在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化多重T细胞的方法,其中方法包括提供基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶(Sleeping Beauty transposase)的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,基因递送多核苷酸包括第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列,第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。在一些供选择的方案中,T细胞是前体T细胞。在一些供选择的方案中,前体T细胞是造血干细胞。
在一些供选择的方案中,提供了提高T细胞中蛋白产量的方法,其中方法包括提供多核苷酸;将多核苷酸引入细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的细胞。在一些供选择的方案中,基因递送多核苷酸包括第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列,第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM、150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。在一些供选择的方案中,T细胞是前体T细胞。在一些供选择的方案中,前体T细胞是造血干细胞。
在一些供选择的方案中,提供了通过任意一种方法产生用于过继T细胞免疫治疗的工程化多重T细胞。在一些供选择的方案中,通过以下方法产生用于过继T细胞免疫治疗的工程化多重T细胞,其中所述方法包括提供基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,基因递送多核苷酸包括第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列,第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。在一些供选择的方案中,基因递送多核苷酸包括第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列,第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。在一些供选择的方案中,T细胞是前体T细胞。在一些供选择的方案中,前体T细胞是造血干细胞。
在一些供选择的方案中,提供了治疗、抑制或改善受试者的癌症或疾病的方法,其中方法包括将如上文描述产生的修饰的或工程化的多重T细胞施用于受试者。在一些供选择的方案中,通过以下方法产生用于过继T细胞免疫治疗的工程化多重T细胞,其中所述方法包括:提供基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,基因递送多核苷酸包括第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列,第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,T细胞是前体T细胞。在一些供选择的方案中,前体T细胞是造血干细胞。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。在一些供选择的方案中,受试者是人。
在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化多重T细胞的方法,其中方法包括提供基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,基因递送多核苷酸包括第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列,第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。在一些供选择的方案中,T细胞包括前体T细胞。在一些供选择的方案中,前体T细胞是造血干细胞。
在一些供选择的方案中,产生用于过继T细胞免疫治疗的工程化细胞的方法包括,提供基因递送多核苷酸;将基因递送多核苷酸引入前体T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入前体T细胞;选择包括基因递送多核苷酸的前体T细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的前体T细胞。在一些供选择的方案中,基因递送多核苷酸用于将核酸稳定插入寡核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的,其中基因递送多核苷酸包括:第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列;第四序列,其中第四序列包括至少一个基因,其中至少一个基因编码蛋白质或编码用于mRNA转录的序列,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用于选择用基因递送多核苷酸转导的细胞,以提高表达至少一个基因的细胞的比例,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。在一些供选择的方案中,T细胞前体是造血干细胞。
在一些供选择的方案中,提供了提高前体T细胞中蛋白产量的方法,其中方法包括:提供多核苷酸;将多核苷酸引入细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入前体T细胞;选择包括基因递送多核苷酸的前体T细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的前体T细胞。在一些供选择的方案中,基因递送多核苷酸用于将核酸稳定插入寡核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的,其中基因递送多核苷酸包括:第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列;第四序列,其中第四序列包括至少一个基因,其中至少一个基因编码蛋白质或编码用于mRNA转录的序列,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用于选择用基因递送多核苷酸转导的细胞,以提高表达至少一个基因的细胞的比,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。
在一些供选择的方案中,其中第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第二浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将细胞暴露于选择药剂至少2、3、4、5、6或7天。在一些供选择的方案中,前体T细胞是造血干细胞。
附图说明
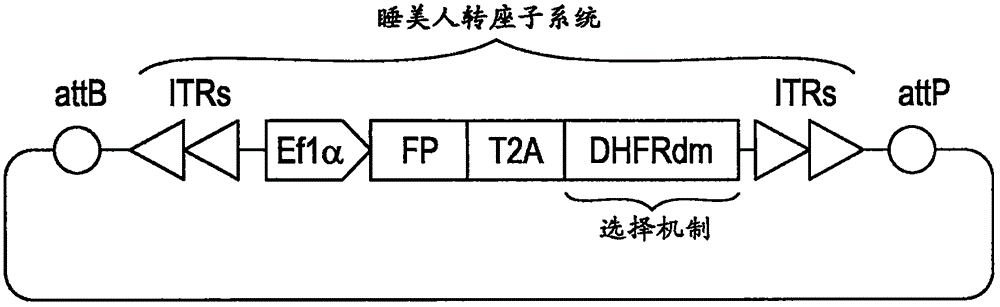
图1显示了基因递送微环的产生质粒MC_T3/FP-DHFRdm的总示意图。具有睡美人转座子T3代的微环包括位于反向末端重复(ITR,箭头)之间的EF1α启动子,荧光蛋白(FP;maxGFP、mCherry或蓝色荧光蛋白(BFP))、明脉扁刺蛾β四体病毒(Thosea asigna virus)2A肽(T2A)和对氨甲蝶呤(MTX)不敏感的二氢叶酸还原酶双突变体(DHFRdm)的融合体。在剩余的细菌骨架被酶促地降解的同时,在attB/attP位点的重组产生微环。
图2显示了一系列柱状图,证明了转座子:转座酶DNA比的最优化。用2μg MC_T3/eGFP-T2A-DHFRdm DNA(转座子)和增加量的MC_SB100X(转座酶)DNA(0.5、1、2、4、8μg)核转染H9细胞。在核转染之后24小时(条纹柱)和7天(黑色柱)进行流式细胞术以评价瞬时转染和稳定转染的效率。柱上方的数字表示被计算为稳定GFP表达占瞬时GFP表达的百分比的整合效率。
图3显示了一系列柱状图,证明了在选择过程期间MTX浓度的作用。进行了对用T3/GFP-T2A-DHFRdm转座子DNA稳定转染的、在增加浓度的MTX(0、50、100和200nM)下,生长3天(白色柱)、5天(水平条纹)、7天(垂直条纹)和10天(黑色柱)的H9细胞群的流式细胞术分析。图3的图片A显示了GFP+/PI-百分比,图3的图片B显示了平均GFP相对荧光单位(RFU)。
图4显示了一系列柱状图,其证明了在MTX移除后转基因的存留。如所示的是用T3/GFP-T2A-DHFRdm转座子稳定转染的、在补充了不同浓度的MTX(50、100和200nM)的培养基中生长2周(黑色柱)的H9细胞群的流式细胞术分析,之后移除MTX选择,并在之后的下列不同时间点收集数据:1周(水平条纹)、2周(垂直条纹)、3周(格纹柱)和4周(白色柱)。图4的图片A显示了GFP+/PI-百分比;图4的图片B显示了平均GFP相对荧光单位(RFU)。
图5A显示了每个人单倍体基因组的转座子拷贝数。在用不同浓度的MTX(50、100和200nM)选择之前和之后,从用T3/GFP-T2A-DHFRdm转座子DNA稳定转染的H9细胞群中分离基因组DNA。通过定量PCR确定平均转座子拷贝数。通过有限稀释方法产生“金标准(Gold standard)”。通过将原始H9群(8%整合的转座子)分选为100%GFP阳性细胞,建立“分选的”群。括起来的柱状图上方的星号(*)表示200nM MTX和分选的群之间的差异,根据学生T检验,所述差异具有显著性(P=0.04)。
图5B显示了转座子整合事件的分布。通过有限稀释方法从H9群分离60个克隆,所述H9群在之前用200nM MTX选择为100%具有整合的T3/GFP-T2A-DHFRdm转座子的细胞。分离基因组DNA并通过相对RT-qPCR确定转座子拷贝数。数字被四舍五入为最接近的整数值(例如0.5-1.5被四舍五入为1)。N=60;平均值±标准偏差=1.78±0.69。通过这些数据计算整合事件的概率和标准误(插表)。
图6显示了一系列饼状图,表示转座子的多重分析。如图片A-C所示的是用携带具有不同荧光蛋白(FP)的转座子的3种微环(MC_T3/GFP-T2A-DHFRdm、MC_T3/BFP-T2A-DHFRdm、MC_T3/mCherry-T2A-DHFRdm),每种2μg,以及6μg MC_SB100X DNA核转染的H9细胞群在如下的不同时间点的流式细胞术分析:(图片A)转染后24小时(瞬时表达)、(图片B)1周(稳定整合),和(图片C)用200nM的MTX选择1周。
图7显示了单个、两个和三个FP的表达分布的选择步骤的柱状图分析。用200nM MTX选择用三个转座子稳定转染的H9细胞群1周,然后暴露于更高的500和1000nM的MTX浓度。
图8显示了MTX选择后对淋巴细胞中具有睡美人的转座子DNA的稳定表达进行流式分析的例子。将新鲜解冻的PBMC细胞用微环GFP(mcGFP)DNA(MC_T3/GFP-T2A-DHFRdm)和睡美人转座酶DNA(MC_SB 100X)电穿孔,然后用通过结合于CD3和CD28选择性激活T细胞的Miltenyi Transact珠刺激。电穿孔后1周,使用25、50和100nM MTX选择PBMC细胞的样品12天(这里显示50nM)。图片A、B和C显示了对淋巴细胞(A)、单个细胞(B)和活细胞(C)的顺序选择。图片D中显示的是在CD8+和CD8-两个群中的高水平的GFP表达。注意对于该供体,刺激后大多数淋巴细胞是CD8+T细胞。
图9显示了淋巴细胞中具有睡美人的转座子DNA的初始表达的直方图。用单独的mcGFP DNA(10μg),mcGFP∶MC_SB100X的比为2∶1的mcGFP(10μg)和MC_SB100X DNA(5μg),mcGFP∶MC_SB100X的比为1∶1的mcGFP(10μg)和MC_SB100X DNA(10μg),pMAXGFP(10μg)对照或无DNA对照转染PBMC。图片A中显示的是作为最初电穿孔效率的实例,没有添加Transact珠的转染后2天的细胞的结果。图片B显示的是在5天后暴露于Transact珠的细胞的结果。虽然到第5天时mcGFP DNA的水平降低至接近对照水平,但用转座酶共转染的细胞中mcGFP的表达保持提高。
图10显示了添加MTX之前的一周中转染的淋巴细胞中GFP转座子DNA的表达和细胞生长的水平。用单独的mcGFP DNA,mcGFP∶MC_SB100X的比为2∶1的mcGFP和MC_SB100X DNA,mcGFP∶MC_SB100X的比为1∶1的mcGFP和MC_SB100X DNA,pMAXGFP对照(10μg)或无DNA对照转染的PBMC。图片A显示了从第2天到第7天GFP的表达水平降低。图片B显示了在第0天用Miltenyi Transact珠处理的转染的细胞样品从第0天到第7天的活细胞水平。图片C显示了在Miltenyi Transact珠不存在下从第0天到第7天的活细胞水平。如所示的,在Miltenyi Transact珠存在下用mcGFP DNA转染的细胞生长缓慢。
图11显示了在MTX选择1周后T细胞中具有睡美人的转座子DNA的稳定表达。所示的是其中研究了用转座子DNA和睡美人转座酶DNA转染后,修饰以表达GFP的T细胞的GFP产生和增殖的流式细胞术散点图。图片A、B、E和F显示了散点谱以鉴别淋巴细胞,而图片C、D、G和H显示了CD8和GFP表达。图片A-D显示了用100nM MTX处理的细胞的流式细胞术分析。图片E-H显示了未用MTX处理的细胞的流式细胞术分析。图片A、C、E和G是用单独的mcGFP转染的样品。图片B、D、F和H显示了用2∶1的mcGFP和MC_SB100X(睡美人转座酶)转染的细胞的流式细胞术结果。如图片D所证明,在用mcGFP和SB100X共转染以使GFP基因稳定插入细胞基因组的T细胞(CD8+和CD8-)中,在100nM MTX存在下约95%的细胞稳定表达GFP,而在MTX不存下仅约23%的细胞表达GFP。
图12显示了在MTX选择14天后转座子转染的淋巴细胞中的增殖的GFP/CD8的表达。用无DNA(对照),单独的mcGFP,mcGFP∶MC_SB100X的比为2∶1的mcGFP和MC_SB100X DNA,或mcGFP∶MC_SB100X的比为1∶1的mcGFP和MC_SB100X DNA转染细胞样品。1周后,使用0nM MTX(对照)、25nM MTX、50nM MTX或100nM MTX选择细胞。在第一栏、第三栏、第五栏和第七栏中显示的淋巴细胞窗证明了在更高浓度的MTX存在下,仅稳定转染的细胞存活。在第二栏、第四栏、第六栏和第八栏中针对GFP和CD8检测为活的单个淋巴细胞设门。对于用单独的mcGFP转染的细胞样品,GFP表达随时间而丧失(第二栏)。然而,用mcGFP和MC_SB100X两者转染的细胞稳定表达GFP,两者均采用MTX选择(>90%)和无MTX选择(约20%)(第四栏和第六栏)。如用mcGFP和MC_SB100X DNA转染的样品中所示,在50和100nM MTX的浓度下,MTX对选择是有效的,并且2∶1或1∶1的比之间未观察到显著差异。注意大多数淋巴细胞是CD8+T细胞。
图13显示了在MTX选择19天后转座子转染的细胞中的淋巴细胞窗和GFP/CD8表达两者。用无DNA(对照),单独的mcGFP、mcGFP∶MC_SB100X的比为2∶1的mcGFP和MC_SB100X DNA,或mcGFP∶MC_SB100X的比为1∶1的mcGFP和MC_SB100X DNA转染细胞样品。使用0nM MTX(对照)、25nM MTX、50nM MTX或100nM MTX选择细胞。在第一栏、第三栏、第五栏和第七栏显示了淋巴细胞窗,显示在MTX存在下仅稳定转染的细胞的存活。在第二栏、第四栏、第六栏和第八栏中针对GFP和CD8检测为活的单个细胞设门。对于用单独的mcGFP转染的细胞样品,GFP表达随时间而丧失(第二栏)。然而,用mcGFP和MC_SB100X两者转染的细胞稳定表达GFP,两者均用MTX选择(>90%)和无MTX选择(约20%)(第四栏和第六栏)。如用mcGFP和MC_SB100X DNA转染的样品中所示,在50和100nM MTX的浓度下,MTX对选择是有效的,对于25nM MTX的浓度,效率稍微较低。mcGFP∶SB比为2∶1或1∶1相似地有效。
图14显示了稳定表达转座子DNA和经历MTX选择的细胞的活细胞计数。在转染后第7、14和19天进行台盼蓝细胞计数。用无DNA(对照),单独的mcGFP,mcGFP∶MC_SB100X的比为2∶1的mcGFP和MC_SB100X DNA,或mcGFP∶MC_SB100X的比为1∶1的mcGFP和MC_SB100X DNA转染PBMC样品。在第7天使用0nM MTX(对照)、25nM MTX、50nM MTX或100nM MTX选择细胞。图片A显示了MTX不存在下活细胞的水平。图片B显示了暴露于100nM MTX后活细胞的水平。图片C显示了暴露于50nM MTX后活细胞的水平。图片D显示了暴露于25nM MTX后活细胞的水平。由于MTX通过抑制叶酸的代谢使细胞的生长减慢,因此只有用共表达MTX抗性基因(DHFRdm)的mcGFP转座子和编码睡美人转座酶的MC_SB100X质粒两者转染的细胞能够在高MTX存在的情况下增殖,这是由于整合的转座子DNA的稳定表达。
图15显示了在MTX选择下由稳定表达GFP转座子DNA的、具有睡美人转座酶的淋巴细胞分析GFP表达。用单独的mcGFP,mcGFP∶MC_SB100X的比为2∶1的mcGFP和MC_SB100X,mcGFP∶MC_SB100X的比为1∶1的mcGFP和MC_SB100X,pMAXGFP(10μg)和无DNA(对照)转染PBMC。在转染后第7天将细胞暴露于MTX,并测量活的单个淋巴细胞的GFP表达。图片A显示了在不存在MTX下在第2、5、7、14和19天的GFP表达水平。图片B显示了在MTX浓度为0nM、25nM、50nM和100nM的MTX选择下,用单独的mcGFP转染的淋巴细胞在第7、14和19天的GFP表达水平。图片C显示了在0nM、25nM、50nM和100nM的MTX选择下,用mcGFP∶MC_SB100X的比为2∶1的mcGFP和MC_SB100X转染的T细胞的GFP表达。图片D显示了在0nM、25nM、50nM和100nM的MTX选择浓度的控制下,用mcGFP∶MC_SB100X的比为1∶1的mcGFP和MC_SB100X转染的T细胞的GFP表达。如所示的,来自用具有2∶1和1∶1的比的mcGFP和MC_SB100X转染的结果是相似的,1周的MTX后,在25nM下具有约75%的GFP表达,在50和100nM下具有约90%的GFP表达。另外,用50和100nM MTX进行的处理之间,GFP表达具有最小的差异。
图16:睡美人转座子:微环构建体。如图所示的是为本文描述的数个供选择的方案设计的数个睡美人构建体的示意图。
图17:如所示的是用携带表达GFP的基因的睡美人转座子转染的细胞的数个散点图。如所示的是转染后14天的细胞。用SB100X或携带GFP的基因的转座子使细胞电穿孔。
图18.睡美人转座子和MTX:GFP转座子。如所示的,用不同比例的mcGFP质粒和携带表达GFP的基因的睡美人转座子(McGFP∶SB为1∶1和2∶1)转染细胞。如所示的,不添加MTX则18天后GFP表达是低的。具有睡美人转座子,则显示在MTX存在下,存在GFP表达的增加。
图19.睡美人转座子:微环构建体。如图所示的是为本文描述的数个供选择的方案设计的数个睡美人构建体的示意图。
图20.睡美人转座子和MTX:GFP转座子-SB100X DNA和RNA。用SB100X(DNA或RNA)或携带GFP、CAR或GFP/mCherry/BFP的基因的转座子将细胞电穿孔。
图21.睡美人转座子和MTX:GFP转座子-SB100X DNA和RNA。如图所示是用携带转座子的GFP基因转染的细胞的数个散点图。用包括用于GFP表达的基因的DNA(2.5μg和5μg)、仅mcGFP和RNA(1μg和3μg)转染细胞的数个样品。在不同浓度0μM、50μM和100μM的MTX的影响下使样品分离并生长。
图22.睡美人转座子和MTX:GFP转座子-SB100X DNA和RNA。在如上部左侧图片所见的不同浓度下用携带用于GFP表达的基因的睡美人转座子转染细胞。然后,在转染后第7天添加MTX。如所示的,在第7天至第14天后用50μg至100μg转染的细胞可表达GFP。
图23.在MTX存在下表达GFP的DNA和RNA。如所示的,用mcGFP、GFP:SB和GFP:SB RNA转染的细胞生长并在转染后7天暴露于MTX。作为对照,没有暴露于MTX的细胞生长至14天(上部左侧图片)。
图24.用GFP:SB转染的细胞中GFP的表达。如左侧图片显示的,用不同浓度的GFP:SB(2.5μg,5μg)转染细胞,并将细胞暴露于不同浓度的MTX(50μM和100μM)。如显示的,当用5μgGFP:SB转染时,在MTX,最佳为50μM MTX的存在下,细胞能够表达GFP。使用RNA也进行了该实验,然而,DNA对于引起蛋白的表达具有更高的效率。
图25.睡美人转座子:微环构建体。如图所示的是为本文描述的数个供选择的方案设计的数个睡美人构建体的示意图。
图26.CD19CAR的表达。构建了携带用于CD19CAR的基因的睡美人构建体(SB:CD19CAR)。用DNA(2.5μg或5μg)或RNA(1μg或3μg)转染细胞。如所示的,用两种浓度的DNA或RNA转染的细胞能够在50μM MTX存在下表达CD19CAR。对于在100uM MTX存在下用1μg的RNA转染的细胞也显示该结果。
图27.CD19CAR的表达。构建了携带用于CD19CAR的基因的睡美人构建体(SB:CD19CAR)。用DNA(2.5μg或5μg)或RNA(1μg或3μg)转染细胞。使细胞生长并在转染后第7天,暴露于MTX。CD19CAR还包括EGFRt标签。如显示的,标签的检测与CD19CAR的表达关联。在暴露于MTX之后,在用携带睡美人构建体的DNA转染的细胞中,以及用携带睡美人构建体的RNA转染的细胞中可进行标签的检测,所述睡美人构建体携带用于CAR19的基因。
图28.睡美人转座子和MTX:CD19 CAR:CD8+细胞的生长。CD19CAR的表达。构建了携带用于CD19CAR的基因的睡美人构建体(SB:CD19CAR)。用DNA(2.5μg或5μg)或RNA(1μg或3μg)转染细胞。使细胞生长并在转染后第7天暴露于MTX。如显示的,当转染更低浓度的DNA时,CD8+细胞能够生长。然而,采用RNA,发现更高浓度导致更好的表达,但更低的浓度导致更好的细胞的最初生长。
图29.睡美人转座子:微环构建体。如图所示的是为本文描述的数个供选择的方案设计的数个睡美人构建体的示意图。
图30.睡美人转座子和MTX:多重3FP’s。用DNA或mcFP使细胞电穿孔并在MTX存在下生长。然后,如散点图所表明的,分析细胞的mCherry、BFP和/或GFP的表达。
图31.睡美人转座子和MTX:多重3FP’s。
图32.睡美人转座子:微环构建体。如图所示的是为本文描述的数个供选择的方案设计的数个睡美人构建体的示意图。
图33.如所示的,使用包括睡美人转座子的DNA电穿孔的细胞在第二轮选择时经历不同浓度的MTX。
图34.在不同浓度的MTX(2、100nM、250nM和500nM)存在下,用包括睡美人转座子的DNA电穿孔的细胞中标记蛋白的表达。
图35.睡美人转座子:微环构建体。如图所示的是为本文描述的数个供选择的方案设计的数个睡美人构建体的示意图。
具体实施方式
提供了以下的定义以促进对本发明的实施方案和供选择的方案的理解。
如本文所使用的,“一个/一种(a)”或“一个/一种(an)”可表示一个/一种或多于一个/一种。
如本文所使用的,术语“大约”表明值包括用于确定值的方法的误差的固有变化或在实验中存在的变化。
如本文使用的,“核酸”或“核酸分子”是指多核苷酸如脱氧核糖核酸(DNA)或核糖核酸(RNA),寡核苷酸,通过聚合酶链式反应(PCR)产生的片段和通过任意的连接、断裂、核酸内切酶作用和核酸外切酶作用产生的片段。核酸分子可由天然存在的核苷酸(如DNA和RNA)的单体组成,或由天然存在的核苷酸的类似物(如对映异构体形式的天然存在的核苷酸)的单体组成,或两者的组合组成。修饰的核苷酸可具有在糖部分和/或在嘧啶或嘌呤碱基部分的改变。糖修饰包括,例如用卤素、烷基、胺和叠氮基取代一个或多个羟基,或糖可以被官能化为醚类或酯类。此外,可以用空间或电子相似结构,如氮杂糖和碳环糖类似物取代全部糖部分。在碱基部分修饰的例子包括烷基化的嘌呤和嘧啶、酰基化的嘌呤或嘧啶或其他熟知的杂环取代。核酸单体可以通过磷酸二酯键或这样的连键的类似物连接。磷酸二酯键的类似物包括硫代磷酸酯、二硫代磷酸酯、硒代磷酸酯、二硒代磷酸酯、苯胺硫代磷酸酯(phosphoroanilothioate)、苯胺磷酸酯(phosphoranilidate)、氨基磷酸酯等。术语“核酸分子”也包括所谓的“肽核酸”,其包括结合于聚酰胺骨架的天然存在或修饰的核酸碱基。核酸可以是单链的或双链的。在本文描述的一些供选择的方案中,提供了用于将核酸稳定插入基因的基因递送多核苷酸。“寡核苷酸”可以与核酸互换地使用,并可以指双链或单链片段的DNA或RNA,或DNA或RNA。
“基因”是活有机体的遗传分子单位,描述了编码在有机体内具有一定功能的多肽或RNA链并可定位于有机体的基因组内的区域的脱氧核糖核酸(DNA)和核糖核酸(RNA)的某些伸长。在本文描述的一些供选择的方案中,提供了用于将核酸稳定插入基因的基因递送多核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的。
“染色体”是包装且有组织的染色质,是在细胞中发现的大分子复合体,由DNA、蛋白质和RNA组成。在一些供选择的方案中,提供了用于将核酸稳定插入基因的基因递送多核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的。在一些供选择的方案中,核酸被插入于染色体的基因。
“启动子”是指导结构基因的转录的核苷酸序列。在一些供选择的方案中,启动子位于基因的5’非编码区,接近于结构基因的转录起始位点。具有起始转录的功能的启动子内的序列元件通常表征为共有核苷酸序列。这些启动子元件包括RNA聚合酶结合位点、TATA序列、CAAT序列、分化特异性元件(DSE;McGehee等人,Mol.Endocrinol.7:551(1993);通过引用全文并入)、环状AMP应答元件(CRE)、血清应答元件(SRE;Treisman,Seminars in Cancer Biol.1:47(1990);通过引用全文并入)、糖皮质激素应答元件(GREs)和其他转录因子结合位点,如CRE/ATF(O′Reilly等人,J.Biol.Chem.267:19938(1992);通过引用全文并入)、AP2(Ye等人,J.Biol.Chem.269:25728(1994);通过引用全文并入)、SP1、cAMP应答元件结合蛋白(CREB;Loeken,Gene Expr.3:253(1993);通过引用全文并入)和八聚物因子(通常见Watson等人编,基因分子生物学(Molecular Biology ofthe Gene),第四版.(The Benjamin/Cummings Publishing Company,Inc.1987;通过引用全文并入))以及Lemaigre和Rousseau,Biochem.J.303:1(1994);通过引用全文并入)。如本文所使用的,启动子可以是组成型活性的、抑制型的或诱导型的。如果启动子是诱导型启动子,那么转录速率应答于诱导剂而增长。相反地,如果启动子是组成型启动子,那么转录速率不受诱导剂调控。抑制型启动子也是已知的。在一些供选择的方案中,提供了基因递送多核苷酸。在一些供选择的方案中,基因递送多核苷酸包括启动子序列。
“选择标记盒”是引入载体或细胞的、提供用于人工选择的特性的基因。选择标记盒可以是用于允许研究者区别想要的和不想要的细胞,或富集特别的细胞类型的筛选标记。在一些供选择的方案中,提供了基因递送多核苷酸。在一些供选择的方案中,基因递送多核苷酸包括选择标记盒。
如本文描述的“二氢叶酸还原酶”或DHFR,是使用NADPH作为电子供体将二氢叶酸还原为四氢叶酸的酶,所述四氢叶酸可以转化为用于1-碳转移化学的各种四氢叶酸辅因子。在本文描述的一些供选择的方案中,提供了基因递送多核苷酸。在一些供选择的方案中,基因递送多核苷酸包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒。
如本文描述的“氨甲蝶呤”(MTX),是抗代谢物和抗叶酸药物。它通过抑制叶酸的代谢起作用。在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化多重T细胞的方法。最广义地,该方法可包括:提供本文描述的任意供选择的方案的基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的相同的选择试剂,其中第二浓度范围大于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在该选择压力下分离表达表型的T细胞。在本文描述的一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,选择试剂是MTX。
“反向重复”或IR是跟随其反向互补物下游的核苷酸序列。反向重复序列可具有许多重要的生物学功能。它们可以限定转座子中的界限,并指示能够自我互补碱基配对的区域(可以相互碱基配对的单个序列内的区域)。这些特性在基因组不稳定性中发挥重要作用,并有助于细胞进化、遗传多样性,也有助于突变和疾病。在一些供选择的方案中,提供了基因递送多核苷酸。在一些供选择的方案中,基因递送多核苷酸包括第一反向末端重复基因序列和第二反向末端重复基因序列。在一些供选择的方案中,基因递送多核苷酸包括位于两个反向重复序列之间的睡美人转座子。
睡美人转座酶结合位于睡美人转座子的IR的特异性结合位点。IR(反向重复)的序列如下:cagttgaagtcggaagtttacatacacttaagttggagtcattaaaactcgtttttcaactacTccacaaatttcttgttaacaaacaatagttttggcaagtcagttaggacatctactttgtgcatgacacaagtcatttttccaacaattgtttacagacagattatttcacttataattcactgtatcacaattccagtgggtcagaagtttacatacactaagttgactgtgcctttaaacagcttggaaaattccagaaaatgatgtcatggctttagaagcttctgatagactaattgacatcatttgagtcaattggaggtgtacctgtggatgtatttcaagg(SEQ ID NO:1)。
“多肽”是天然或合成产生的通过肽键连接的氨基酸残基的聚合物。少于约10个氨基酸残基的多肽通常被称作“肽”。
“蛋白质”是包括一个或多个多肽链的大分子。蛋白质也可以包括非肽组件,如碳水化合物基团。碳水化合物和其他非肽取代基可以通过产生蛋白质的细胞被添加到蛋白质中,并且会随细胞的类型变化。本文根据氨基酸骨架结构定义蛋白质;取代基如碳水化合物基团通常未指定,但尽管如此是存在的。在一些供选择的方案中,提供了用于将核酸稳定插入基因的基因递送多核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的。在一些供选择的方案中,基因递送多核苷酸进一步包括用于至少一种蛋白质的序列。
如本文描述的“抗体”是指由被免疫系统使用的浆细胞产生的用于鉴别和中和外来物如细菌和病毒的大的Y型蛋白。抗体蛋白可包括四条多肽链;由二硫键连接的两条相同的重链和两条相同的轻链。每条链由称作免疫球蛋白域的结构域组成。这些域含有70-110个氨基酸并根据它们的大小和功能分为不同的类别。在一些供选择的方案中,提供了用于将核酸稳定插入基因的基因递送多核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的。在一些供选择的方案中,基因递送多核苷酸进一步包括用于至少一种蛋白质的序列。在一些供选择的方案中,基因递送多核苷酸可包括可以被人源化的抗体或其部分的序列。
“嵌合抗原受体”(CAR),也称为嵌合T细胞受体,指的是人工T细胞受体,其是将任意特异性移植于免疫效应细胞的工程化受体。例如这些受体可用于将单克隆抗体的特异性移植于T细胞;伴随通过反转录病毒载体促进的其编码序列的转移。CAR的结构可以包括源自单克隆抗体的、融合于CD3-ζ跨膜域和内在域的单链可变区片段(scFv)。这样的分子导致ζ信号响应于由其靶标的scFv识别的传递。某些供选择的方案使用用于将核酸稳定插入基因的基因递送多核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的。在一些供选择的方案中,基因递送多核苷酸进一步包括用于至少一种蛋白质的序列。在一些供选择的方案中,蛋白质是嵌合抗原受体。嵌合受体也可以指人工T细胞受体、嵌合T细胞受体、嵌合免疫受体和嵌合抗原受体(CAR)。这些CAR是工程化的受体,该工程化的受体可以将任意的特异性移植于免疫受体细胞上。一些研究者认为在某些情况下嵌合抗原受体或“CAR”包括抗体或抗原片段、间隔区、信号传导域和跨膜区。然而,因为修饰CAR的不同组件或域如表位结合区(例如,抗体片段,scFv或其部分)、间隔区、跨膜域和/或信号传导域的惊人作用,在某些情况下,本文描述包括这些特征的CAR的组件作为独立元件。CAR的不同元件的变异可以,例如导致更强的对特异性表位的结合亲和性。
人工T细胞受体,或CAR可用作使用称为过继细胞转移的技术对癌症或病毒感染的治疗。将T细胞从患者移除并修饰,使得所述T细胞表达对癌细胞或病毒,或病毒感染的细胞上显示的分子特异性的受体。将基因工程化T细胞重新引入患者,然后所述基因工程化T细胞可以识别和杀伤癌细胞或病毒感染的细胞或促进病毒的清除。在一些供选择的方案中,基因递送多核苷酸可包括针对嵌合抗原受体的序列。在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化多重T细胞的方法。最广义地,方法可包括提供任意一个本文描述的供选择的方案的基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,选择试剂是MTX。
T细胞共刺激对有效的免疫应答的发展是希望的,并且该事件在淋巴细激活期间发生。共刺激信号是抗原非特异性的并且由承载抗原的细胞和T细胞的膜上表达的共刺激分子之间的相互作用提供。共刺激分子可包括但不限于CD28、CD80和CD86。在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化的多重T细胞的方法。在一些供选择的方案中,T细胞是承载嵌合抗原受体的T细胞。在一些供选择的方案中,承载嵌合抗原受体的T细胞被工程化以表达共刺激配体。在一些供选择的方案中,提供了用于治疗、抑制或改善受试者的癌症或病毒感染的方法。最广义地,方法可包括将任意的本文描述的供选择的方案中的T细胞施用于受试者。优选地,基因工程化T细胞用于治疗、抑制或改善癌症或病毒疾病,其中基因工程化T细胞通过T细胞的优先扩增获得,所述T细胞被转化以表达编码对病毒或癌细胞呈现的分子特异性的受体或嵌合受体的多个转基因,并且使用增加浓度的MTX将对转化的T细胞上的选择压力应用于二级MTX选择中。在某些这些供选择的方案中,受试者是动物,如家畜或伴侣动物,以及在其他供选择的方案中,受试者是人。在这些供选择的方案中的一些中,承载嵌合抗原的T细胞被工程化以表达共刺激分子。在一些供选择的方案中,基因递送多核苷酸包括针对至少一个共刺激分子的序列。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至6kB。在一些供选择的方案中,基因递送多核苷酸是微环。
如本文描述的“T细胞前体”是指可以迁移至胸腺并成为不表达T细胞受体的T细胞前体的淋巴样前体细胞。所有T细胞均来源于骨髓中的造血干细胞。来自造血干细胞的造血祖细胞(淋巴样祖细胞)居住于胸腺并通过细胞分裂扩增以产生一大群不成熟的胸腺细胞。最早的胸腺细胞既不表达CD4也不表达CD8,并且因此被分类为双阴性(CD4-CD8-)细胞。随着它们通过发育而发展,它们成为双阳性胸腺细胞(CD4+CD8+),并且最终成熟为单阳性(CD4+CD8-或CD4-CD8+)胸腺细胞,然后从胸腺释放至外周组织。
大约98%的胸腺细胞在胸腺中的发育过程中通过阳性选择或阴性选择失败而死亡,而其他2%胸腺细胞存活并离开胸腺成为成熟的免疫活性T细胞。
前体T细胞的双阴性(DN)阶段集中于产生功能性β-链,而双阳性(DP)阶段集中于产生功能性α-链,最终产生功能性αβT细胞受体。随着发育中的胸腺细胞发展经过4个DN阶段(DN1、DN2、DN3和DN4),T细胞表达不变的α-链但是重排β-链基因座。如果重排的β-链成功地与不变的α-链配对,产生停止β-链的重排(并沉默交互等位基因),并且导致细胞增殖的信号。虽然这些信号需要在细胞表面处的这种前-TCR,但是他们依赖于结合于前-TCR的配体。这些胸腺细胞然后会表达CD4和CD8两者并发展至发生α-链选择的双阳性(DP)阶段。如果重排的β-链没有导致任意信号传导(例如由于不能与不变的α-链配对),细胞可能由于被忽略而死亡(缺少信号传导)。
如本文描述的“造血干细胞”或“HSC”,是可以引起骨髓系细胞的前体细胞,所述骨髓系细胞例如巨噬细胞、单核细胞、巨噬细胞、嗜中性粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、红细胞、巨核细胞/血小板、树突状细胞和淋巴系(例如T细胞、B细胞、NK细胞)。HSC具有异源群体,其中存在三类干细胞,通过他们在血液中淋巴系与骨髓系后代的比例(L/M)区分他们。
在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化多重T细胞的方法,其中方法包括提供基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,基因递送多核苷酸包括第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列,第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。在一些供选择的方案中,T细胞包括前体T细胞。在一些供选择的方案中,前体T细胞是造血干细胞。
在一些供选择的方案中,产生用于过继T细胞免疫治疗的工程化细胞的方法包括,提供基因递送多核苷酸;将基因递送多核苷酸引入前体T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入前体T细胞;选择包括基因递送多核苷酸的前体T细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的前体T细胞。在一些供选择的方案中,基因递送多核苷酸用于将核酸稳定插入寡核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的,其中基因递送多核苷酸包括:第一序列,其中第一序列包括第一反向末端重复基因序列:第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列:第四序列,其中第四序列包括至少一个基因,其中至少一个基因编码蛋白质或编码用于mRNA转录的序列,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用于选择用基因递送多核苷酸转导的细胞,以提高表达至少一个基因的细胞的比例,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。在一些供选择的方案中,T细胞前体是造血干细胞。
在一些供选择的方案中,提供了提高前体T细胞中蛋白产量的方法,其中方法包括提供多核苷酸;将多核苷酸引入细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入前体T细胞;选择包括基因递送多核苷酸的前体T细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的前体T细胞。在一些供选择的方案中,基因递送多核苷酸用于将核酸稳定插入寡核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的,其中基因递送多核苷酸包括:第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列;第四序列,其中第四序列包括至少一个基因,其中至少一个基因编码蛋白质或编码用于mRNA转录的序列,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用于选择用基因递送多核苷酸转导的细胞,以提高表达至少一个基因的细胞的比例,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。
在一些供选择的方案中,其中第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第二浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将细胞暴露于选择药剂至少2、3、4、5、6或7天。在一些供选择的方案中,前体T细胞是造血干细胞。
非宿主DNA分子编码的肽或多肽是“异源的”肽或多肽。
“整合的遗传元件”是在通过人为操作将该元件引入细胞后已并入宿主细胞的染色体的DNA片段。在本供选择的方案中,整合的遗传元件可源自被通过电穿孔或其他技术引入细胞的微环。整合的遗传元件通过原始宿主细胞传递给其子代。在一些供选择的方案中,整合的遗传元件通过环状的基因递送多核苷酸并入宿主细胞的染色体。在一些供选择的方案中,基因递送多核苷酸是至少1kB至6kB。在一些供选择的方案中,基因递送多核苷酸是微环。
“克隆载体”或载体是具有在宿主细胞中自主复制能力的核酸分子,如微环、质粒、粘粒、原质体系或噬菌体。克隆载体典型地含有一个或少数限制性内切酶识别位点以及编码适用于鉴别和选择克隆载体转导的细胞的标记基因的核苷酸序列,所述限制性内切酶识别位点允许核酸分子以可确定的方式插入而不损失载体的基本生物学功能。标记基因典型地包括提供四环素抗性或氨苄青霉素抗性的基因,但在一些供选择的方案中可包括氨甲蝶呤抗性基因。
“表达载体”是编码在宿主细胞中表达的基因的核酸分子。典型地,表达载体包括转录启动子、基因和转录终止子。基因表达通常位于启动子的控制下,并且这样的基因被认为是“可操作地连接于”启动子。相似地,如果调控元件调节核心启动子的活性,则调控元件调节和核心启动子是可操作地连接的。在一些供选择的方案中,提供了表达载体。在一些供选择的方案中,表达载体编码转座酶。在一些供选择的方案中,转座酶是睡美人转座酶。在一些供选择的方案中,表达载体是环状的。在一些供选择的方案中,表达载体是至少1kB至6kB。在一些供选择的方案中,表达载体是微环。
如本文描述的“微环”,是独立于所有原核载体部分的小环状质粒衍生物。微环可用作表达载体,它们被用作针对哺乳动物细胞的基因修饰的转基因载体,其具有以下优点:因为它们含有非细菌DNA序列,所有它们不太可能被认为是外来的而被破坏。如此,典型的转基因递送方法涉及含有外来DNA的质粒。更小尺寸的微环也扩展了它们的克隆能力并促进其递送入细胞。不作为限制,微环的制备可遵循两步方法,其可涉及大肠杆菌(E.coli)中亲代质粒(具有真核插入物的细菌质粒)的产生和该过程结束时位点特异性重组酶的诱导,但仍是在细菌中。这些步骤之后可接着通过在插入物的两个末端的两个重组酶靶序列切除原核载体部分,以及通过毛细管凝胶电泳(CGE)回收所产生的微环(用于高效修饰受体细胞的载体)和极微质粒。
可以通过转染、通过电穿孔或通过本领域技术人员已知的其他方法将纯化的微环转移至受体细胞。常见的微环可以缺少复制起点,因此它们不能在靶细胞内复制,并且由于细胞分裂编码的基因会消失(根据应用需要持续表达或瞬时表达,这可以是优点或缺点)。一些供选择的方案使用用于将核酸稳定插入基因的基因递送多核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的。在一些供选择的方案中,基因递送多核苷酸是微环。
如本文所使用的,“核转染”指的是将外源核酸转染至宿主细胞的方法,并通过电穿孔进行。在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化多重T细胞。最广义地,方法可包括:提供任意的本文描述的供选择的方案的基因递送多核苷酸;将基因递送多核苷酸引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,选择试剂是MTX。在一些供选择的方案中,将基因递送多核苷酸引入T细胞可通过电穿孔进行。
如本文描述的“宿主细胞”,是含有由本发明供选择的方案涵盖的一种或多种核酸酶,例如内切酶,端部处理酶(end-processing enzymes)和/或内切酶/端部处理酶融合蛋白;或编码支持一种或多种核酸酶的复制和/或转录或转录和翻译(表达)的所述一种或多种核酸酶的载体的细胞,所述一种或多种核酸酶例如内切酶、端部处理酶和/或内切酶/端部处理酶融合蛋白。在一些供选择的方案中,用于本发明供选择的方案的宿主细胞可以是真核细胞。免疫系统的宿主细胞可包括T细胞。在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化多重T细胞的方法。在一些供选择的方案中,方法可包括:提供任意一个本文描述的供选择的方案中的基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,选择试剂是MTX。
如本文描述的“转座元件”(TE)、转座子或反转录转座子可以指可以改变其在基因组内的位置,有时产生或回复突变并改变细胞基因组大小的DNA序列。转座经常导致TE复制。TE可构成真核细胞的C值的大部分。如本文描述的“C值”指的是真核生物的二倍体体细胞中一半量的单倍体核中含有的DNA的量(以皮克计)。在某些情况下,术语C值和基因组大小是可交换地使用的,然而在多倍体中C值可以代表相同核内含有的两个或更多个基因组。在具有独特的遗传系统的尖毛虫(Oxytricha)中,转座子在发育中起关键性作用。转座子对于研究者作为改变活有机体内的DNA的工具是非常有用的。在一些供选择的方案中,提供了用于将核酸稳定插入基因的基因递送多核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的。在一些供选择的方案中,基因递送多核苷酸包括转座子。
如本文描述的“睡美人转座子系统”由睡美人(Sleeping Beauty,SB)转座酶和转座子构成,所述转座子于1997年设计为用于将特异性DNA序列插入脊椎动物的基因组。DNA转座子可以以简单、剪切-粘贴的方式从一个DNA位点移位至另一个DNA位点。移位是将定义的DNA片段从一个DNA分子切下并移动至相同或不同DNA分子或基因组的另一个位点的精确过程。
SB转座酶可将转座子插入受体DNA序列中的TA二核苷酸碱基对。插入位点可以在相同DNA分子的其他地方,或在另一个DNA分子(或染色体)中。在哺乳动物(包括人)基因组中,具有大约2亿个TA位点。TA插入位点在转座子整合的过程中复制。该TA序列的复制是转座的特点并用于探明某些实验的机制。在转座子中可以编码转座酶,或可以通过另一来源提供转座酶,在这种情况下,转座子成为非自主的元件。
在一些供选择的方案中,提供了用于将核酸稳定插入基因的基因递送多核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的。在一些供选择的方案中,基因递送多核苷酸包括转座子。在一些供选择的方案中,转座子是睡美人转座子。在一些供选择的方案中,要插入的核酸是侧翼为反向末端重复基因序列的睡美人转座子。
在一些供选择的方案中,用于核酸的稳定插入的基因递送多核苷酸是微环。在一些供选择的方案中,用于核酸的稳定插入的基因递送多核苷酸包括睡美人转座子。在一些供选择的方案中,提供了产生工程化多重T细胞的方法。在一些供选择的方案中,方法包括递送睡美人转座酶至细胞。在一些供选择的方案中,提供了在T细胞中增加蛋白产量的方法。在一些供选择的方案中,方法包括提供编码睡美人转座酶的载体。在一些供选择的方案中,方法包括递送编码睡美人转座酶的载体至细胞。
如本文描述的“密码子优化”指的是改变密码子为已知在希望的细胞中提高最大蛋白表达效率的密码子的设计方法。在一些供选择的方案中,描述了密码子优化,其中可以通过使用本领域技术人员已知的算法进行密码子优化以产生针对高蛋白产量优化的合成基因转录物。含有用于密码子优化的算法的程序对本领域技术人员是已知的。程序可以包括,例如OptimumGeneTM、算法等。此外,可以商购获得合成的密码子优化序列,例如从Integrated DNA Technologies和其他商业可用的DNA序列服务商商购获得。在一些供选择的方案中,提供了用于将核酸稳定插入基因的基因递送多核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的。在一些供选择的方案中,描述了基因递送多核苷酸,其中用于完成基因转录的基因针对在人体内表达被密码子优化。在一些供选择的方案中,优化基因以具有特别用于在人体细胞中最大蛋白表达的选择的密码子,这可以提高T细胞的蛋白或CAR的浓度。
也可以进行密码子优化以减少多核苷酸中二级结构的发生。在一些供选择的方案中,也可以进行密码子优化以减少总GC/AT比。严格的密码子优化也可以导致不想要的二级结构或不希望的导致二级结构的GC含量。因此二级结构影响转录效率。在密码子使用优化后,如GeneOptimizer的程序可以用于避免二级结构和优化GC含量。这些另外的程序可以用于在初始密码子优化后进一步优化和检查问题以限制第一轮优化后可能发生的二级结构。供选择的用于优化的程序对本领域技术人员是已知的。在一些供选择的方案中,提供了用于将核酸稳定插入基因的基因递送多核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的。在一些供选择的方案中,基因递送多核苷酸包括密码子优化以在人体内表达和/或移除二级结构和/或降低总GC/AT比的序列。在一些供选择的方案中,优化序列以避免二级结构。在一些供选择的方案中,优化序列以降低总GC/AT比。
在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化多重T细胞的方法。最广义地,方法可包括:提供任意一个本文描述的供选择的方案中的基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,选择试剂是MTX。
用于癌症或病毒疾病的过继免疫治疗
用于癌症的过继免疫治疗的前提是将患者自身的肿瘤特异性T细胞转移至患者以促进恶性T细胞的破坏。T细胞可以被基因工程化以识别肿瘤特异性抗原,并发挥对抗癌细胞的细胞毒性活性。用于癌症的过继免疫治疗的方法是分离患者的T细胞并通过表达嵌合抗原受体(CAR)、膜蛋白引入肿瘤识别能力,所述膜蛋白含有通过跨膜片段连接于胞内信号传导域的胞外肿瘤结合域。“过继免疫治疗”或“T细胞过继转移”指的是基于T细胞的细胞毒性应答攻击癌细胞或特异性细胞靶标的用途。具有对患者的癌症的天然或基因工程反应性的T细胞可以在体外产生,然后转移回至有需求的受试者。不作为限制,过继转移的例子可通过从具有癌症或病毒疾病的受试者中移除T细胞来实现,并且这些T细胞可以被基因工程化以表达对癌细胞或病毒上发现的生物标记特异性的受体,使得一旦将基因工程化的T细胞转移回至受试者,基因工程化的T细胞就攻击癌细胞或病毒或病毒感染的细胞。在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化多重T细胞的方法。在一些供选择的方案中,提供了靶向于恶性细胞以破坏的方法。在一些供选择的方案中,提供了治疗、抑制或改善受试者的癌症或病毒疾病的方法。在一些供选择的方案中,治疗、抑制或改善受试者的癌症或病毒疾病的方法包括将用于过继T细胞免疫治疗的工程化多重T细胞施用于受试者。在一些供选择的方案中,受试者是人。
另外的基因的共整合可进一步提高表达CAR的T细胞的抗肿瘤或抗病毒活性。全面的T细胞激活除了需要初始肿瘤或病毒识别和由CAR起始信号以外还需要共刺激受体和细胞因子受体的衔接,其可以在肿瘤或病毒感染的受试者的免疫抑制环境中不存在。为了处理肿瘤的这种免疫抑制环境,例如,由于自身共刺激,与肿瘤细胞上共刺激配体的表达相比,共刺激配体如CD80和4-1BBL在工程化的表达CAR的T细胞中的表达可导致更多的T细胞扩增。T细胞免疫治疗中的另一挑战是输注到患者体内之后的细胞存活。已经显示抗细胞凋亡蛋白的诱导表达改善T细胞的体内存活。通过在工程化T细胞中引入趋化因子受体可以提高肿瘤归巢和浸润,该方法可以特别地用于表达不能被T细胞正常识别的趋化因子的肿瘤。最后,可以工程化T细胞以通过例如诱导的细胞因子表达更好地抵抗免疫抑制性肿瘤微环境或免疫功能低下的病毒感染的受试者。因此,用于快速产生表达多个转基因的工程化T细胞的方法对T细胞免疫治疗的临床转化是重要的并且是有利的。在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化多重T细胞的方法。在一些供选择的方案中,T细胞表达嵌合抗原受体。在一些供选择的方案中,表达嵌合抗原受体的T细胞被工程化以表达共刺激配体。在一些供选择的方案中,表达嵌合抗原受体的T细胞表达共刺激配体。在一些供选择的方案中,共刺激配体是CD80。在一些供选择的方案中,共刺激配体是4-1BBL。
过继细胞转移可以指细胞,免疫来源细胞转移回相同患者或转移至不同的受体宿主。对于分离用于过继转移的免疫细胞,可以抽取血液至含有抗凝剂的管中,将PBM(血沉棕黄层)细胞典型地通过密度屏障离心(density barrier centrifugation)分离。在基于T细胞的治疗中,可使用严重依赖于白介素-2的免疫调节作用的细胞培养方法在体外扩增细胞,并且使细胞以激活的状态通过静脉大量返回患者。抗CD3抗体可用于促进T细胞在培养物中的增殖。对白介素-21的研究表明白介素-21在提高体外制备的基于T细胞的治疗效果中也起重要作用。在过继细胞转移中使用的细胞可以用于递送使用重组DNA技术以达到任意数目的目标的基因修饰的淋巴细胞。在本文描述的供选择的方案中,过继细胞转移被用于将细胞转移至受试者,其中细胞是表达CAR的淋巴细胞。在一些供选择的方案中,表达CAR的淋巴细胞在产生用于过继T细胞免疫治疗的工程化多重T细胞的方法中是宿主细胞。在一些供选择的方案中,方法包括:提供本文描述的供选择的方案的基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,基因递送多核苷酸包括共刺激配体的序列。在一些供选择的方案中,基因递送多核苷酸包括嵌合抗原受体的序列。在一些供选择的方案中,T细胞表达CAR。在本文描述的供选择的方案中,表达CAR的淋巴细胞通过微环进行基因修饰,其中微环包括睡美人转座子。在一些供选择的方案中,选择试剂是MTX。
通过举例的方式而非限制,可通过用含有T细胞受体(TCR)基因的拷贝的转移病毒(transferring virus)感染患者的细胞产生基因工程化T细胞,所述T细胞受体基因是专用于识别例如肿瘤或病毒抗原的。重要的是虽然转移病毒不能在细胞内复制,但是应整合到人基因组。这是有利的,因为新TCR基因保持在T细胞中稳定。将患者自己的T细胞暴露于这些转移病毒,然后非特异地扩增或使用基因工程化TCR刺激。然后将细胞转移回患者并准备增加抗肿瘤、病毒或病毒感染的细胞的免疫应答。使用基因工程化T细胞的过继细胞转移的使用是用于治疗各种癌症或病毒感染的有前途的新方法。在一些供选择的方案中,提供了用于癌症的过继免疫治疗方法。在一些供选择的方案中,提供了用于病毒感染的过继免疫治疗方法。
通过用病毒载体制备基因工程化T细胞的方法可具有数个缺点。T细胞的基因修饰典型地是使用γ-反转录病毒载体或慢病毒载体完成的。虽然有效,但是缺点包括生产的成本、有限的基因包装容量和潜在的安全性问题。含有转座子系统如睡美人(SB)或piggyBac的质粒提供用于将基因稳定引入T细胞的非病毒方法。最近,piggyBac系统被用于通过多个转座子的递送产生稳定转染的表达感兴趣的多个转基因的哺乳动物细胞。首先由Ivics和同事的用于哺乳动物细胞使用再激活的SB系统被用作T细胞免疫治疗的临床试验中的基因递送形式。通过SB的基因整合具有与γ-反转录病毒载体和慢病毒载体相比更差的对转录单位和其调控序列的偏好,并且因此被认为是更安全的。在本文描述的一些供选择的方案中,预期了通过包括睡美人系统的微环的基因修饰。在本文描述的一些供选择的方案中,预期了通过包括piggyBac系统的微环的基因修饰。在本文描述的一些供选择的方案中,预期了通过包括睡美人系统的微环的基因修饰。
微环作为转染平台由于三个原因是尤其吸引人的。第一,微环通过电穿孔的转染效率优于其质粒类似物的转染效率。第二,转座效率在微环中更高,因为两个转座子末端之间距离的更短,所述距离显示影响转座酶的效率。最后,由于核转染后细胞生活里随构建体大小的增加而减少,考虑到微环与其类似的质粒相比微环的更小的尺寸,微环是更有利的。为进一步改善转座效率,由Izsvak等人开发的优化的SB100X极活跃转座酶(Nature Genet.2009,41,753-761;通过引用全文并入)可与先前Yant等人的SB T3代(Mol.Cell.Biol.2004,24,9239-9247;通过引用全文并入)组合使用。在数个本文描述的供选择的方案中,预期了用于制备用于过继细胞转移的基因修饰的T细胞。在一些供选择的方案中,方法包括将微环引入T细胞。在一些供选择的方案中,引入包括电穿孔递送。
细胞免疫治疗中的另一挑战是输注入患者后的细胞存活。已经显示抗细胞凋亡蛋白的诱导表达改善T细胞的体内存活。通过在工程化T细胞中引入趋化因子受体可以提高肿瘤归巢和浸润;该方法可以特别地用于表达不能被T细胞正常识别的趋化因子的肿瘤。最后,可以工程化T细胞以通过例如诱导的细胞因子表达更好地抵抗免疫抑制性肿瘤微环境。因此,用于快速产生表达多个转基因的工程化T细胞的方法对T细胞免疫治疗的临床转化是重要和有利的。在本文描述的一些供选择的方案中,预期了引入另外基因的共整合用于共整合以进一步提高表达CAR的T细胞的抗肿瘤活性的方法。在一些供选择的方案中,另外的基因编码共刺激配体。在一些供选择的方案中,共刺激配体是CD80。在一些供选择的方案中,共刺激配体是4-1BBL。在一些供选择的方案中,另外的基因编码抗细胞凋亡蛋白。在一些供选择的方案中,另外的基因编码趋化因子受体。
在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化多重T细胞的方法。最广义地,方法可包括:提供本文描述的任意的供选择的方案中的基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,T细胞是表达嵌合抗原受体(CAR)的T细胞。在一些供选择的方案中,选择试剂是MTX。
在一些供选择的方案中,提供了增加T细胞中蛋白产量的方法。最广义地,方法可包括:提供本文描述的任意的供选择的方案中的基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,选择试剂是MTX。在一些供选择的方案中,T细胞是表达嵌合抗原受体(CAR)的T细胞。
如本文描述的,系统的供选择的方案包括工程化的非病毒基因递送系统,该系统包括三个关键特征:(1)用于稳定基因表达的睡美人转座子系统,(2)用于增强转染的微环,以及(3)人二氢叶酸还原酶双突变体(DHFRdm)作为选择机制(图1)。
微环作为转染平台由于三个原因是尤其吸引人的。第一,微环通过电穿孔的转染效率优于其质粒类似物的转染效率。第二,转座效率在微环中更高,因为两个转座子末端之间距离的更短,所述距离显示影响转座酶的效率。最后,由于核转染后细胞生活里随构建体尺寸的增加而减少,考虑到微环与其类似的质粒相比更小的尺寸,微环是更希望的。为进一步改善转座效率,由Izsvak等人开发的优化的SB100X极活跃转座酶(Nature Genet.2009,41,753-761;通过引用全文并入)与先前的Yant等人的SB转座子T3代(Mol.Cell.Biol.2004,24,9239-9247;通过引用全文并入)组合使用。在本文描述的一些供选择的方案中,使用微环进行T细胞的基因修饰。在一些供选择的方案中,微环包括转座子。在一些供选择的方案中,转座子包括睡美人转座子。在一些供选择的方案中,优化的SB100X极活跃转座酶与SB转座子的T3代组合使用。
还采用了用于快速选择工程化T细胞的选择机制。人二氢叶酸还原酶双突变体(DHFRdm,具有氨基酸突变L22F和F31S)展示了对DHFR的有效抑制剂氨甲蝶呤的亲和性降低至1/15,000,导致对胸苷酸和嘌呤合成的阻碍。DHFRdm在T细胞中的表达提供了MTX抗性而不损害增殖能力、T细胞标记的表达或细胞裂解能力。该选择系统的另外优势包括临床级MTX的可用性、非遗传毒性药物的使用,和小的基因大小的DHFRdm(561bp)。因此,MTX可以用作选择机制以选择性扩增SB-转导的细胞。在一些供选择的方案中,微环包括编码人二氢叶酸还原酶双突变体的基因序列。在一些供选择的方案中,提供了用于快速选择工程化T细胞的选择方法。在一些供选择的方案中,选择方法包括使工程化T细胞与临床级氨甲蝶呤接触。在一些供选择的方案中,T细胞包括微环,其中微环包括用于人二氢叶酸还原酶双突变体的序列。在一些供选择的方案中,人二氢叶酸还原酶双突变体展示对氨甲蝶呤的特异性降低至1/15,000或约1/15,000。在一些供选择的方案中,氨甲蝶呤可用于接触T细胞以选择性扩增用微环转导的细胞,其中微环包括用于人二氢叶酸还原酶双突变体的序列。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGS S VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。
可以使用含有SB转座子的微环的多重递送将高达三个转基因稳定转移至H9T细胞系,随后进行氨甲蝶呤(MTX)选择。通过用MTX增加选择压力可以优先获得具有更多数目的基因整合的细胞。使用通过两个连续的MTX选择轮的二步选择方法,可获得50%的表达三种转基因产物的细胞。在一些供选择的方案中,提供了将转基因稳定转移至细胞系的方法。在一些供选择的方案中,提供了将微环引入细胞系的方法。在一些供选择的方案中,微环包括睡美人转座子。在一些供选择的方案中,方法进一步包括用氨甲蝶呤增加选择压力,其中增加选择压力包括使细胞系与增加浓度的氨甲蝶呤接触。在一些供选择的方案中,进行两轮氨甲蝶呤选择。
另外的供选择的方案
在一些供选择的方案中,提供了用于将核酸稳定插入基因的基因递送多核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的。最广义地,基因递送多核苷酸包括:第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列,第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至6kB。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,第五序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,蛋白质包括抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,微环包括用于二氢叶酸还原酶双突变体的序列,该序列包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。
在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化多重T细胞的方法。最广义地,方法可包括:提供本文描述的任意的供选择的方案的基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6或7天。
在一些供选择的方案中,提供了提高细胞中蛋白质产量的方法。最广义地,方法可包括:提供任意一个本文描述的供选择的方案的基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,通过由选择标记盒增加选择压力来进行选择。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,低浓度范围或第一浓度范围是至少50nM至100nM,高浓度范围或第二浓度范围是至少75至150nM。在一些供选择的方案中,低浓度范围或第一浓度范围是至少75nM至150nM,高浓度范围或第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,低浓度范围或第一浓度范围是至少300nM至675nM,高浓度范围或第二浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6或7天。
在一些供选择的方案中,提供了通过任意一种方法产生的用于过继T细胞免疫治疗的工程化多重T细胞。在一些供选择的方案中,通过一下方法产生用于过继T细胞免疫治疗的工程化多重T细胞,其中所述方法包括:提供基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,基因递送多核苷酸包括:第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列;第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。在一些供选择的方案中,基因递送多核苷酸包括:第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列:第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被入源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。
在一些供选择的方案中,提供了治疗、抑制或改善受试者的癌症或疾病的方法,其中方法包括将如上描述的修饰的或工程化的多重T细胞施用于受试者。在一些供选择的方案中,通过以下方法产生用于过继T细胞免疫治疗的工程化多重T细胞,其中所述方法包括:提供基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,基因递送多核苷酸包括第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列:第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列被密码子优化以在人体内表达;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列被密码子优化以在人体内表达;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。在一些供选择的方案中,受试者是人。
下文更详细地描述了几种物质和方法。
质粒
使用pMC_T3/eGFP_IRES_FGFR(核酸研究(Nucleic Acids Research),2012,1-10doi:10.1093/nar/gks21,全文并入)作为骨架,执行之前描述的克隆策略(Cold Spring Harbor Protoc;2012;doi:10.1101/pdb.ip067876)以创建GFP-T2A-DHFRdm盒,构建了携带T3SB转座子盒的pMC_T3/GFP-T2A-DHFRdm微环(MC)质粒,所述T3SB转座子盒含有EF1a启动子、maxGFP基因、明脉扁刺蛾β四体病毒(Thoseaasigna)2A肽(T2A)和对氨甲蝶呤(MTX)不敏感的二氢叶酸还原酶双突变体(DHFRdm)。将MaxGFP(Lonza)和pEGFRt-T2A-IMPDHdm-T2A-DHFRdm(由Michael Jensen馈赠)质粒用作PCR的模板。引入BmtI和BamHI位点以交换荧光蛋白基因。之前描述了质粒MC_SB100X(核酸研究(Nucleic Acids Research),2012,1-10doi:10.1093/nar/gks213,全文并入本文中)。根据微环DNA载体技术的系统生物科学用户手册产生和纯化微环。使用Endofree Plasmid Kit(Qiagen)在无内毒素条件下扩增所有质粒。
H9培养和转染
在具有10%FBS的DMEM中培养H9细胞。随后是H9细胞(Lonza)的优化的核转染方案(程序X-001,Nucleofector Kit V)。每次核转染,使用1×106个细胞及不同量的MC DNA。核转染后使细胞生长一周以达到稳定转染。对MTX选择,在具有10%FBS,补充了不同浓度MTX的DMEM中培养细胞。
流式细胞术分析
基于碘化丙啶排除通过在流式细胞术缓冲液中添加碘化丙啶至2μg/ml选择活细胞。在MACSQuant分析仪(Miltenyi Biotec)和LSRII(BD Biosciences)上进行流式细胞术分析。用FlowJo软件分析收集的数据。合适的阴性对照(用碘化丙啶染色和未用碘化丙啶染色的未转染的H9细胞,以及用GFP、BFP和mCherry的单个基因转染的细胞)用于补偿和设门(gating)。Becton Dickinson FACSAria II用于细胞分选。在UW免疫学流式细胞设备(UW Immunology Flow Cytometry Facility)进行流式细胞术工作的部分。
转座子拷贝数的确定
使用Puregene Kit A根据制造商说明书(Qiagen)提取基因组DNA,使用Universal SYBR Green Supermix(BioRad)使用7300实时PCR系统(Applied Biosystems)进行qPCR。使用Primer3软件设计用于qPCR的引物:maxGFP正向引物:5’-ACAAGATCATCCGCAGCAAC-3’(SEQ ID NO:4);反向引物:5’-TTGAAGTGCATGTGGCTGTC-3’(SEQ ID NO:5);GAPDH正向引物:5’-ACAACTTTGGTATCGTGGAAGG-3’(SEQ ID NO:6);GAPDH反向引物:5’-GCCATCACGCCACAGTTTC-3’(SEQ ID NO:7)。MaxGFP引物是对转座子中的maxGFP基因特异性的。使用通过有限稀释方法获得的具有转座子的单插入物的H9克隆基因组DNA(“金标准”)产生标准曲线。使用ΔΔCT方法(Schmittgen,T.D.和Livak,K.J.(2008),全文并入本文中)计算拷贝数。
SBTS整合分布的表征
将用200nM MTX选择的T3/GFP-T2A-DHFRdm转染的H9细胞群以在DMEM 10%FBS中0.5个细胞/孔的浓度,连同辐射的(5000R)H9饲养细胞以5,000个细胞/孔一起,于96孔板上铺板。将板温育2-3周,然后将克隆种群移至更大的板上并扩增。通过流式细胞术确认GFP的表达。使用60个单个克隆的DNA进行相对RT-qPCR分析以确定转座子拷贝数。
稳定基因转移至H9细胞的优化
被移除细菌质粒序列的微环构建体用于所有基因转移研究。如Kay等人和同事(Chen,Z.Y.;He,C.Y.;Ehrhardt,A.;Kay,M.A.Molecular Therapy 2003,8,495-500和Kay,M.A.;He,C.Y.;Chen,Z.Y. Nat.Biotechnol.2010,28,1287-U96;通过引用全文并入本文)之前的描述可以产生微环。构建了在EF1α启动子下的含有表达转座子的不同荧光蛋白(maxGFP、mCherry或BFP)的三个报告微环。选择基因,提供对MTX的代谢抗性的二氢叶酸还原酶双突变体(DHFRdm)被克隆在T2A序列后的框内。还在单独的微环构建体中制备了SB100X转座酶基因,用于与转座子微环共递送。
在转座子中存在四个转座酶结合位点(每个反向末端重复中有两个)。计划使结合的转座酶彼此相互作用以促进两个转座子末端的毗邻(juxtaposition)。因为游离转座酶与结合的转座酶的相互作用,假设了转座酶的过表达会导致移位的抑制,因此防止了毗邻步骤。因此,需要最优的转座子/转座酶的比以确定这些基因是否以单独的构建体递送。抑制现象的报告是不同的。
在使用表达maxGFP的报告微环以不同的转座子/转座酶的比核转染后24小时时和稳定转座(核转染后7天)时,通过流式细胞术评价瞬时转染的效率。参见图2,其显示了转座子∶转座酶比的最优化。将H9T细胞系用作转染测试台。初始转染效率为47.5%±2.2%至66.9%±4.5%,随转座酶微环的量的增加而增加。在转座酶不存在下,在核转染后7天检测到最小稳定转染(<1%)。GFP+细胞的百分比随转座子/转座酶比而增加,在比为1∶4时达到39.2%±3.0%,其反映了初始瞬时整合群的58.6%的整合效率。由于细胞生活里的降低,没有测试更高的比。在转座子/转座酶比的该测试范围内没有观察到过表达抑制作用。因此,从结果,使用该优化的1∶4的转座子/转座酶比进行转导实验。
用氨甲蝶呤选择工程化细胞
由于对DHFRdm表达增加的选择压力,假设可以使用高MTX浓度选择多重整合事件的细胞。用T3/maxGFP-T2A-DHRFdm转座子稳定转染的细胞因此在增加的MTX浓度(范围从50至200nM)存在下生长,并且通过流式细胞术评价GFP表达超过10天。参见图3,其显示了选择期间氨甲蝶呤(MTX)浓度的作用。在MTX选择的3天评价的初始选择效果随MTX浓度的增加而降低(图3,图片A)。然而,在所有条件下到选择后的7天,获得具有>94%GFP+细胞的群。GFP+细胞中的平均GFP荧光随选择压力增长(图3,图片B);用200nM MTX选择的细胞中的平均荧光是未选择的细胞的6.4倍,并且是用50nM MTX选择的细胞的3.3倍。如所示的,GFP+细胞中的平均GFP表达和MTX浓度之间的正相关说明增加的MTX浓度选择了具有增加的DHFRdm表达的细胞,因此是多重整合事件。
用两周的MTX处理选择的扩增的细胞群保持大多数的转基因表达,甚至当移除MTX高达4周时。参见图4,其显示了移除氨甲蝶呤(MTX)后转基因的存留。虽然用200nM MTX选择的细胞具有最高的GFP+群,移除MTX后4周,在所有群中GFP+群保持>90%(图4,图A),很可能是由于选择了具有多重整合事件的细胞。MTX撤回后4周时,对200nM、100nM和50nM MTX选择,在所有群中的平均GFP表达分别降低了21%、27%和28%(图4,图B)。如此,平均GFP表达的降低可能是由于在选择压力不存在下启动子沉默或具有低GFP表达的细胞的优先扩增。
整合分布的分析
为了测试增加的MTX选择压力会选择具有多重整合事件的细胞的假设,使用以GFP引物的RT-qPCR确定MTX选择的细胞群中转座子拷贝数的平均数。首先,通过有限稀释放方法产生具有单拷贝的整合转座子的“金标准”克隆。通过细胞分选获得的GFP+细胞的RT-qPCR分析确定在MTX选择之前的原始稳定转导群中整合的平均数。观察到伴随选择压力增加,平均转座子拷贝数增加的趋势。参见图5A,其显示了每个人单倍体基因组中的转座子拷贝数。与MTX选择之前GFP+细胞中的整合事件平均为1.1±0.02相比,用200nM MTX选择的细胞中平均整合事件为2.1±0.45。一式三份地进行RT-qPCR,并且数据代表用于分选的群的单个生物副本和用于MTX选择的3个生物副本。通过学生t检验评价统计学差异。
然后分析了用200nM MTX选择的细胞中整合事件的分布。通过有限稀释方法产生了60个克隆,通过流式细胞术确认了GFP表达,分离基因组DNA,通过RT-PCR分析了每个单倍体基因组中GFP基因的数目。整合事件的分布如图5B所示。多数克隆(约65%)含有GFP的多个拷贝。整合事件的平均数为1.8,这与用200nM MTX选择的细胞群中的平均转座子拷贝数良好地相关(图5A)。
多重基因整合的证明
因为之前证明了在200nM MTX选择压力下扩增的大多数转导的细胞群含有多个转座子拷贝,因此在这些条件下评价多重基因整合。用在转座子盒中含有三个不同报告基因(maxGFP、mCherry和BFP)的三个微环和SB100X转座酶微环核转染H9细胞。然后以200nM选择稳定转导的细胞7天,并通过流式细胞术分析评价细胞群。参见图6,其显示了用携带具有不同荧光蛋白的转座子的3个微环(MC_T3/GFP-T2A-DHFRdm、MC_T3/BFP-T2A-DHFRdm、MC_T3/mCherry-T2A-DHFRdm),每个2μg,以及6μg MC_SB100X DNA核转染的H9细胞群在转染后的不同时间点的流式细胞术分析。评价的核转染后24小时的初始转染效率为68%(图6,图片A)。稳定转染的群为37±1.4%,反映了54%的整合效率。该群中的19±0.6%表达了两种或三种不同的荧光蛋白。然后分析了在200nM MTX的存在下生长1周的稳定转导的细胞;该选择的群的23±1.0%表达所有三种报告蛋白(图6,图片A)。为了进一步增加表达三个转基因的细胞群,通过200nM MTX选择的细胞经历具有提高的MTX浓度的第二选择步骤。参见图7,其显示的柱状图证明了用以200nM MTX选择1周的三个转座子稳定转染,然后暴露于500和1000nM的更高的MTX浓度中的H9细胞群。如显示的,在500或1000nM MTX中培养另外一周的细胞导致了表达三个转基因的细胞群增加(分别为38.5±1.0%和53.1±0.3%)。在第二轮选择期间,由于进一步对DHFRdm基因的过表达的选择,细胞活性回升至约70%。
氨甲蝶呤选择的T细胞中具有睡美人的转座子DNA的稳定表达
使用AmaxaTM NucleofectorTM技术将新鲜解冻的外周血单核细胞(PBMC)电穿孔。用10μg微环GFP(MC_T3/GFP-T2A-DHFRdm)和不同量的SB100X极活跃转座酶(0、5或10μg)转染细胞。用非微环pMAXGFP载体(10μg)或无DNA pMAXGFP载体(10μg)转染对照细胞。然后,在IL-2和IL-15的存在下在转染后4至6个小时用Miltenyi Transact珠刺激细胞。然后将细胞等分以使96孔U型底板的每孔中存在400,000个细胞。在转染后第7天用0、25、50或100nM的氨甲蝶呤处理细胞。在第2、5、7、14和19天时,通过台盼蓝计数,染色并分析细胞。
参见图8,其显示了在微环转染后表达GFP的淋巴细胞的流式分析的例子。用Invitrogen死细胞/活细胞(LIVE/DEAD)红染色(图片C)分析来自淋巴细胞窗(图片A)的单个细胞(图片B)的生活力。然后分析活淋巴细胞的CD8和GFP表达(图片D)。如图8的图片D所示,用50nM氨甲蝶呤选择后,大多数淋巴细胞是CD8+淋巴细胞并表达GFP。
一周后T细胞中具有睡美人的转座子DNA的稳定表达
为了在评价MTX选择之前的一周中微环DNA的表达,进行流式分析,然后比较了用pMAXGFP,比为1∶1的GFP转座子∶SB100X,比为1∶2的GFP转座子∶SB100X,单独的mcGFP或无DNA对照转染的细胞。参见图9,其显示了电穿孔后2天(不存在Transact珠下)和5天(在Transact珠存在下)对细胞进行的FACS测定的结果。如所示的,没有MTX时GFP的表达随时间而丧失。然而,只要存在与SB100X转座酶共转染,在用GFP转座子DNA转染的细胞中GFP表达就会持续。
参见图10,其显示了GFP表达的水平和细胞从第2天到第7天的生长的图。如图10的图片A所示,GFP表达的百分比量随时间降低(pMAXGFP(10μg),mcGFP∶MC_SB100X 1∶1和mcGFP∶MC_SB100X 2∶1)。在Transact存在下,活细胞缓慢增加,但是在没有珠的情况下则不会增加(图片C),表明珠对细胞生长的重要性。
用MTX选择细胞7天和12天
在1周后,将转染的细胞的样品暴露于不同水平的MTX(25、50或100nM)以富集表达微环转座子的细胞。稳定表达DHFRdm MTX耐性基因以及由于转座酶整合而表达GFP的细胞应在更高MTX浓度下存活。参见图11,其显示了用100nM氨甲蝶呤处理7后的转染的细胞的FACS测定结果。在用100nM MTX处理的细胞中,仅用转座子和转座酶DNA两者转染的细胞表达GFP。如所示的,在用MTX选择细胞7天后,在mcGFP与SB的两个比为2∶1mcGFP∶MC_SB100X和1∶1mcGFP∶MC_SB100X时,100nM MTX选择对GFP的表达是有效的。
参见图12和图13,其分别显示了用氨甲蝶呤处理7和12天后,转染的细胞的FACS测定的结果。显示了每种条件下的散点图和活淋巴细胞的CD8+/GFP表达。在图12的框中给出了淋巴细胞中GFP表达的百分比。
如图12所示,在7天,用0或25nM MTX处理的细胞分别显示约25%或75%表达GFP的细胞。相比之下,在50和100nM MTX处理时,至少90%的细胞表达GFP。如所示的,在50nM和100nM下,和在mcGFP与SB的两个比为2∶1mcGFP∶MC_SB100X和1∶1mcGFP∶MC_SB100X时,MTX选择对GFP表达的富集是同等有效的。如预期的,在不存在SB转座酶的情况下和在不存在DNA的对照中,没有可预期的GFP表达。注意GFP的表达在CD8+和CD8-淋巴细胞中是相似的。
用氨甲蝶呤选择的T细胞中具有睡美人的转座子DNA的稳定表达-细胞计数
随后评价了在MTX选择下稳定表达转座子DNA的PBMC的细胞生长。注意由于用Transact珠刺激和在IL2和IL-15存在下生长,到1周时大多数存活细胞是T细胞。如图14所示,在第7、14和19天(MTX处理的第0、7和12天)使用台盼蓝细胞计数确定在0nM、25nM、50nM和100nM氨甲蝶呤下用MTX处理之后的活细胞的量。在对照(0nM MTX)中,对于所有的DNA条件,活细胞的数量随时间增加。然而,在MTX存在下,仅用SB转座酶和共表达GFP和DHFRdm抗性基因的微环转座子二者转染的细胞能够分裂,表明对于转座子的稳定表达,SB是需要的。
用氨甲蝶呤选择的T细胞中具有睡美人的转座子DNA的稳定表达-GFP表达
通过确定19天中转染的细胞的GFP表达评价MTX选择期间T细胞中具有睡美人的转座子DNA的稳定表达。参见图14,其显示了在从第7天开始在氨甲蝶呤选择(0、25、50和100nM)之后的T细胞中,在用转座子DNA和睡美人转染的细胞中GFP表达随时间而增加。如在第2、5、7、14和19天在无氨甲蝶呤选择的对照中所示的,用mcGFP和SB转染的细胞中GFP的表达保持在约20%,而单独的mcGFP和pMAXGFP对照中表达稳定下降。在MTX选择存在下,GFP表达随时间增加,在50和100nM MTX可见最高水平。如所示的,mcGFP∶MC_SB100X的比在比为1∶1和2∶1之间没有区别。另外,在暴露于50nM或100nM MTX的细胞中平均荧光强度具有最小的区别。在MTX存在下,单独的mcGFP的低水平GFP表达很可能是由于转座子非依赖性的稳定整合,并且在这些条件下细胞的绝对数量非常低,如图14所示。
在一种供选择的方案中,提供了用于将核酸稳定插入基因的基因递送多核苷酸,其中用于插入的核酸在基因递送多核苷酸中的侧翼是反向末端重复基因序列,并且其中基因递送多核苷酸是可选择的,其中基因递送多核苷酸包括:第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列:第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。
在一些供选择的方案中,提供了产生用于过继T细胞免疫治疗的工程化多重T细胞的方法,其中方法包括:提供如本文描述的基因递送多核苷酸;将基因递送多核苷酸引入T细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的T细胞。在一些供选择的方案中,基因递送多核苷酸包括:第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列;第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,蛋白质是用于治疗的蛋白质。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。
在一些供选择的方案中,提供了提高T细胞中T细胞中蛋白产量的方法,其中方法包括:提供本文描述的多核苷酸;将多核苷酸引入细胞;提供编码睡美人转座酶的载体;将编码睡美人转座酶的载体引入T细胞;选择包括基因递送多核苷酸的细胞,其中选择包括第一轮选择和第二轮选择,其中第一轮选择包括添加第一浓度范围的选择试剂,以及第二轮选择包括添加第二浓度范围的选择试剂,其中第二浓度范围高于第一浓度范围,并且其中第二浓度范围是第一浓度范围的至少1.5倍;以及在选择压力下分离表达表型的细胞。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。
在一些供选择的方案中,基因递送多核苷酸包括:第一序列,其中第一序列包括第一反向末端重复基因序列;第二序列,其中第二序列包括第二反向末端重复基因序列;第三序列,其中第三序列包括启动子区序列;第四序列,其中第四序列包括编码蛋白质的至少一个基因,并且其中第四序列是优化的;第五序列,其中第五序列包括编码二氢叶酸还原酶双突变体的至少一个选择标记盒,其中二氢叶酸还原酶双突变体对氨甲蝶呤的亲和性降低至1/15,000或约1/15,000,其中氨甲蝶呤可用作选择机制以选择性扩增用基因递送多核苷酸转导的细胞,并且其中第五序列是优化的;第六序列,其中第六序列包括第一附着位点(attP);以及第七序列,其中第七序列包括第二附着位点(attB);其中第一序列、第二序列、第三序列、第四序列、第五序列、第六序列和第七序列中的每一个均有5’端和3’端,并且其中包括第一反向末端重复基因序列的第一序列的3’端邻接于第三序列的5’端,第三序列的3’端邻接于第四序列的5’端,第四序列的3’端邻接于第五序列的5’端,以及第五序列的3’端邻接于包括第二反向末端重复的第二序列的5’端。在一些供选择的方案中,编码人二氢叶酸还原酶双突变体的基因包括DNA序列:ATGGTTGGTTCGCTAAACTGCATCGTCGCTGTGTCCCAGAACATGGGCATCGGCAAGAACGGGGACTTCCCCTGGCCACCGCTCAGGAATGAATCCAGATATTTCCAGAGAATGACCACAACCTCTTCAGTAGAAGGTAAACAGAATCTGGTGATTATGGGTAAGAAGACCTGGTTCTCCATTCCTGAGAAGAATCGACCTTTAAAGGGTAGAATTAATTTAGTTCTCAGCAGAGAACTCAAGGAACCTCCACAAGGAGCTCATTTTCTTTCCAGAAGTCTAGATGATGCCTTAAAACTTACTGAACAACCAGAATTAGCAAATAAAGTAGACATGGTCTGGATAGTTGGTGGCAGTTCTGTTTATAAGGAAGCCATGAATCACCCAGGCCATCTTAAACTATTTGTGACAAGGATCATGCAAGACTTTGAAAGTGACACGTTTTTTCCAGAAATTGATTTGGAGAAATATAAACTTCTGCCAGAATACCCAGGTGTTCTCTCTGATGTCCAGGAGGAGAAAGGCATTAAGTACAAATTTGAAGTATATGAGAAGAATGATTAA(SEQ ID NO:2)。在一些供选择的方案中,人二氢叶酸还原酶双突变体包括蛋白质序列:MVGSLNCIVA VSQNMGIGKN GDFPWPPLRN ESRYFQRMTT TSSVEGKQNL VIMGKKTWFS IPEKNRPLKG RINLVLSREL KEPPQGAHFL SRSLDDALKL TEQPELANKV DMVWIVGGSS VYKEAMNHPG HLKLFVTRIM QDFESDTFFP EIDLEKYKLL PEYPGVLSDV QEEKGIKYKF EVYEKND(SEQ ID NO:3)。在一些供选择的方案中,基因递送多核苷酸是环状的。在一些供选择的方案中,基因递送多核苷酸是至少1kB至5kB。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,基因递送多核苷酸是微环。在一些供选择的方案中,启动子区包括EF1启动子序列。在一些供选择的方案中,第四序列包括1个、2个、3个、4个或5个编码蛋白的基因。在一些供选择的方案中,第四序列被密码子优化以降低第四序列的总GC/AT比。在一些供选择的方案中,第四序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列。在一些供选择的方案中,第四序列是由编码多种相关蛋白的多种核酸产生的共有序列,所述多种相关蛋白为例如对相同表位特异性的多个抗体结合域。在一些供选择的方案中,多种相关蛋白包括多个抗体结合域,其中多个抗体结合域对相同表位是特异性的。在一些供选择的方案中,第五序列被密码子优化以降低第五序列的总GC/AT比。在一些供选择的方案中,第五序列是通过针对人体内表达的密码子优化被优化的。在一些供选择的方案中,密码子优化和/或共有序列通过比较序列和/或多个相关序列中使用的核酸碱基的变异性产生。在一些供选择的方案中,蛋白质包括可以被人源化的抗体或其部分。在一些供选择的方案中,二氢叶酸还原酶双突变体包括L22F和F31S的氨基酸突变。在一些供选择的方案中,引入通过电穿孔进行。在一些供选择的方案中,选择通过由选择标记盒增加选择压力来进行。在一些供选择的方案中,选择试剂包括用于选择的药剂。在一些供选择的方案中,用于选择的药剂是氨甲蝶呤。在一些供选择的方案中,第一浓度范围是至少50nM至100nM,以及第二浓度范围是至少75至150nM。在一些供选择的方案中,第一浓度是50nM、60nM、70nM、80nM、90nM或100nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是75nM、80nM、90nM、100nM、110nM、120nM、130nM、140nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少75nM至150nM,以及第二浓度范围是至少112.5nM至225nM。在一些供选择的方案中,第一浓度是75nM、85nM、95nM、105nM、115nM、125nM、135nM、145nM或150nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是112nM、122nM、132nM、142nM、152nM、162nM、172nM、182nM、192nM、202nM、212nM或225nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一浓度范围是至少300nM至675nM,以及第一浓度范围是至少450nM至1012nM。在一些供选择的方案中,第一浓度是300nM、350nM、400nM、450nM、500nM、550nM、600nM、650nM或675nM或由任意两个前述浓度限定的浓度范围之间的任意浓度,以及第二浓度范围是450nM、500nM、550nM、600nM、650nM、700nM、750nM、800nM、850nM、900nM、1000nM或1012nM或由任意两个前述浓度限定的浓度范围之间的任意浓度。在一些供选择的方案中,第一轮选择包括在第二轮选择之前将T细胞暴露于选择药剂2、3、4、5、6或7天。在一些供选择的方案中,第二轮选择包括在分离之前将T细胞暴露于选择药剂至少2、3、4、5、6、7、8、9、10、11、12、13或14天或通过任意两个前述时间点限定的时间范围之间的任意时间。
在一些供选择的方案中,治疗、抑制或改善受试者的癌症或疾病的方法,方法包括将如本文描述的修饰的T细胞施用受试者。在一些供选择的方案中,受试者是人。
关于本文任何实质上复数和/或单数术语的使用,在适合于上下文和/或本申请时,本领域技术人员可从复数翻译为单数和/或从单数翻译为复数。为了清晰,本文中不同的单数/复数交换可被特别地提出。
本领域技术人员将会理解,通常本文使用的术语,尤其在所附的权利要求中(例如所附权利要求的主体)的术语通常意指“开放性”术语(例如术语“包括(including)”应该被解释为“包括但不限于”,术语“具有”应该被解释为“至少具有”,术语“包括(includes)”应该被解释为“包括但不限于”等)。本领域技术人员将进一步理解如果意引入的权利要求记载的具体数字,这样的意图将明确记载在权利要求中,并且如不存在这样的记载,则不存在这样的意图。例如,为了帮助理解,下面所附的权利要求可以包含介绍性短语“至少一个”和“一个或多个”的使用以介绍权利要求记载。然而,这样的短语的使用不应被解释为暗示通过不定冠词“一个/一种(a)”或“一个/一种(an)”介绍权利要求记载限制任何包含这样的介绍的权利要求记载的特定权利要求至仅含有一个这样的记载的实施方式,即使当相同权利要求包括介绍性短语“一个或多个”或“至少一个”以及不定冠词如“一个/一种(a)”或“一个/一种(an)”(例如“一个/一种(a)”和/或“一个/一种(an)”应该被解释为“至少一个”或“一个或多个”);同样适于用于介绍权利要求记载的定冠词的使用。另外,即使明确记载介绍的权利要求记载的具体数字,本领域技术人员会认识到这样的记载应该被解释为意思至少是引用的数字(例如“两个记载”的直接记载,没有其他修饰,意思是至少两个记载,或两个或多个记载)。此外,在使用类似于“A、B和C中的至少一个等”惯例的那些情况下,通常这样的结构意指就本领域技术人员将理解惯例(例如“具有A、B和C中的至少一个的系统”这个意义而言,将包括但不限于具有单独A、单独B、单独C、A和B一起、A和C一起、B和C一起和/或A、B和C一起等)。在类似于“A、B或C中的至少一个等”惯例的那些情况下,通常这样的结构意指就本领域技术人员会理解惯例(例如“具有A、B或C中的至少一个的系统”这个意义而言,将包括但不限于具有单独A、单独B、单独C、A和B一起、A和C一起、B和C一起和/或A、B和C一起等的系统)。本领域技术人员会进一步理解事实上呈现两个或更多个可供选择的术语的任何转折性词语和/或转折性短语,不论在说明书、权利要求书或附图中,应该被理解为预期包括术语中的一个、术语中的任一个或两个术语的可能性,例如短语“A或B”会被理解为包括“A”或“B”或“A和B”的可能性。
另外,在依据Markush组描述本公开的特征或方面时,本领域技术人员会认识到,进而也依据Markush群组的任意单个成员或成员子组来描述本公开。
- 还没有人留言评论。精彩留言会获得点赞!