新型氟喹诺酮和其用于治疗细菌感染的用途的制作方法
本发明涉及氟喹诺酮类的化合物,所述化合物具有被长烷基链取代的哌嗪部分,包括它们的药学上可接受的盐、溶剂化物或前药。本发明的化合物可用于治疗由细菌所引起的感染。
背景技术:
细菌感染会导致诸如泌尿道感染、皮肤和软组织感染、性传播感染、破伤风、伤寒、结核病、霍乱、梅毒、肺炎或沙门氏菌属(salmonella)的疾病或综合征。尽管存在大量和多种多样的抗细菌剂,但是细菌感染仍是全世界,特别是发展中国家的主要死亡原因。此外,在发达国家和发展中国家中,药物抗性细菌的不断出现是令人担忧的。
抗生素的过度处方似乎是出现抗性的主要原因之一。然而,其它因素,如畜牧业中抗生素的使用以及清洁产品中抗细菌剂的数量增加也导致抗性的出现。此外,即使没有暴露于抗生素,DNA突变和额外染色体DNA的获得也会在细菌中自然发生,从而潜在地导致抗性。
根据它们的抗性程度,药物抗性细菌被分成三组:多药抗性(MDR)、广泛药物抗性(XDR)以及泛药物抗性(PDR)(Magiorakos,A.-P.等,Clinical Microbiology and Infection,2012,第268-281页)。因此需要开发对野生型细菌,而且还对不同类别的药物抗性细菌具有活性的抗生素。此外,在暴露于抗生素时保持存活的任何细菌将复制并且产生抗性后代并且抗生素因此必须具有最大的细菌根除能力。
喹诺酮形成了在60年代开发的具有对抗广泛范围的细菌的活性的一大类抗生素。在芳环上添加氟原子使得在70年代发现氟喹诺酮。这些分子与喹诺酮相比具有改进的药物代谢动力学特性,如良好的口服吸收、良好的组织穿透性以及相对长的活性持续时间。氟喹诺酮,如环丙沙星(ciprofloxacin)(US 4,670,444、EP0049355)、恩氟沙星(enrofloxacin)(US 4,670,444、EP0049355)、加替沙星(gatifloxacin)(US 4,980,470)以及莫西沙星(moxifloxacin)(US 5,607,942)目前被用于治疗各种类型的细菌感染,它是作为初步治疗或二线治疗。
氟喹诺酮在细菌中的作用机制在于抑制为DNA复制所必需的细菌酶DNA旋转酶并且对氟喹诺酮的抗性主要来自DNA旋转酶上的突变。
因此,即使氟喹诺酮允许治疗大范围的细菌感染并且具有良好的药物代谢动力学特性,这些分子也遭受高抗性的出现。
因此需要开发对野生型细菌,而且还对MDR、XDR或PDR药物抗性细菌具有活性的新化合物。这样的化合物必须能够克服由细菌所产生的对抗目前所使用的抗生素的抗性机制并且必须具有最大的细菌根除能力,同时表现出低毒性。
本发明涉及氟喹诺酮类的化合物,所述化合物具有被长烷基链取代的哌嗪部分。本发明的化合物与目前使用的氟喹诺酮相比对野生型细菌,而且还对药物抗性细菌具有改进的杀细菌活性。
技术实现要素:
根据一个实施方案,本发明的化合物具有通式I:
以及其药学上可接受的盐、溶剂化物以及前药,其中:
‐R1表示包含4个至20个碳原子,优选地5个至16个,更优选地5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个或16个碳的饱和或不饱和、取代或未取代、支链或无支链的烷基,当所述烷基被取代时,取代基选自包括以下各项的组:卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基;
‐R2表示选自包括以下各项的组的取代基:氢、烷基、烯烃、炔烃、环烷基、芳基、卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基,优选地R2表示选自包括以下各项的组的取代基:氢、甲基、甲氧基、乙氧基、氯代、氟代,更优选地R2是氢或甲氧基,甚至更优选地R2是甲氧基;
‐R3、R4、R5以及R6可以相同或不同并且各自表示选自以下各项的取代基:氢、烷基、烯烃、炔烃、环烷基、芳基、卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基,优选地R3、R4、R5以及R6相同并且各自表示氢;
‐R7表示选自以下各项的取代基:氢、烷基、烯烃、炔烃、环烷基、芳基、卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基,优选地R7表示氢、-NH2或氟代;
条件是式I的化合物不是:
‐7-(4-丁基哌嗪-1-基)-1-环丙基-6-氟-4-氧代-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-6-氟-7-(4-庚基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;
‐7-(4-丁基-3-甲基哌嗪-1-基)-1-环丙基-6-氟-4-氧代-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-6-氟-7-(4-己基-3-甲基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-6-氟-7-(4-(4-羟基丁基)哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;
条件是当R2是氢并且R7是氟时,R3、R4、R5以及R6不是甲基。
根据另一个实施方案,本发明的化合物具有通式II,所述通式II对应于其中R7是氟的通式I:
以及其药学上可接受的盐、溶剂化物以及前药。
根据另一个实施方案,本发明的化合物具有通式III,所述通式III对应于其中R3、R4、R5以及R6相同并且表示氢原子的通式II化合物:
以及其药学上可接受的盐、溶剂化物以及前药。
在一个优选的实施方案中,本发明的化合物选自包括以下各项的组:1-环丙基-6-氟-4-氧代-7-(4-戊基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-7-(4-己基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-7-(4-辛基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-7-(4-壬基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;1-环丙基-7-(4-癸基哌嗪-1-基)-6-氟-4-氧代-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-4-氧代-7-(4-十一烷基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸;1-环丙基-7-(4-十二烷基哌嗪-1-基)-6-氟-4-氧代-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-4-氧代-7-(4-十三烷基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-4-氧代-7-(4-十四烷基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-4-氧代-7-(4-十五烷基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-7-(4-十六烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-8-甲氧基-4-氧代-7-(4-戊基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-7-(4-己基哌嗪-1-基)-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-7-(4-庚基哌嗪-1-基)-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-8-甲氧基-7-(4-辛基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-8-甲氧基-7-(4-壬基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;1-环丙基-7-(4-癸基哌嗪-1-基)-6-氟-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-8-甲氧基-4-氧代-7-(4-十一烷基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸;1-环丙基-7-(4-十二烷基哌嗪-1-基)-6-氟-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-8-甲氧基-4-氧代-7-(4-十三烷基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-8-甲氧基-4-氧代-7-(4-十四烷基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-8-甲氧基-4-氧代-7-(4-十五烷基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸;1-环丙基-6-氟-7-(4-十六烷基哌嗪-1-基)-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸;以及其药学上可接受的盐、溶剂化物以及前药。
根据另一个实施方案,本发明涉及一种药物组合物,所述药物组合物包含至少一种本发明的化合物、或其药学上可接受的盐、溶剂化物或前药、以及至少一种药学上可接受的载体、稀释剂、赋形剂和/或佐剂。
根据一个实施方案,本发明还涉及一种药物,所述药物包含至少一种本发明的化合物、或其药学上可接受的溶剂化物。
根据一个实施方案,所述药学上可接受的载体、稀释剂、赋形剂和/或佐剂选自乙醇5%、甘油15%、聚乙二醇300 50%、聚乙二醇400 9%、聚山梨醇酯80 0.4%、丙二醇68%、2-羟基丙基-环糊精20%、甲基纤维素0.5%以及玉米油。在一个实施方案中,所述药学上可接受的载体、稀释剂、赋形剂和/或佐剂选自聚山梨醇酯80 0.4%或玉米油。
根据另一个实施方案,本发明的药物组合物或药物进一步包含治疗剂和/或活性成分。
根据一个实施方案,本发明的化合物、药物组合物或药物可用于治疗细菌感染。
根据另一个实施方案,本发明的化合物、药物组合物或药物可用于治疗细菌感染,其中所述细菌感染是由选自包括以下各项的组的属的细菌所引起:分枝杆菌属(Mycobacterium),如结核分枝杆菌(tuberculosis)或麻风分枝杆菌(leprae);革兰氏阳性细菌,如链球菌属(Streptococcus)、葡萄球菌属(Staphylococcus)或芽孢杆菌属(Bacillus);肠杆菌科(enterobacteriaceae),如埃希氏菌属(Escherichia)、克雷伯氏杆菌属(Klebsiella)、肠杆菌属(Enterobacter)、变形杆菌属(Proteus)、沙雷氏菌属(Serratia)、志贺氏菌属(Shigella)、柠檬酸杆菌属(Citrobacter)、沙门氏菌属(Salmonella)或耶尔森氏菌属(Yersinia);非发酵革兰氏阴性杆菌,如假单胞菌属(Pseudomonas)、产碱杆菌属(Alcaligenes)、或不动杆菌属(Acitenobacter);厌氧菌,如拟杆菌属(Bacteroides)、梭杆菌属(Fusobacterium)、真杆菌属(Eubacterium)、丙酸杆菌属(Propionibacterium)、消化球菌属(Peptococcus)、梭菌属(Clostridium)、消化链球菌属(Peptostreptococcus)、或韦荣氏球菌属(Veillonella);幽门螺杆菌(Helicobacter pylori)以及参与性传播感染的病原体,如奈瑟氏球菌属(Neisseria)、嗜血杆菌属(Haemophilus)、衣原体属(Chlamydia)、或支原体属(Mycoplasma)。
定义
在本发明中,以下术语具有以下含义:
‐“芳基”指的是多不饱和芳族烃基,所述基团具有单个环(即苯基)或稠合在一起(例如萘基)或共价连接的多个芳环,通常含有5个至12个原子,优选地6个至10个原子,其中至少一个环是芳族的。
‐“脂族基团”适用于任何含碳的、无环或环状的、饱和或不饱和的、支链或无支链的基团,所述基团任选地被取代,不包括芳族化合物在内。根据本发明,脂族基团优选地包含4个至20个碳原子,优选地5个至16个碳原子,更优选地5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个或16个碳。根据本发明的一个优选的实施方案,支链或无支链脂族基团选自烷基、烯基、炔基。
‐“烷基”适用于任何饱和的直链或支链烃链,所述烃链任选地被取代,包含4个至20个碳原子,并且优选地5个至16个碳原子;更优选地丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基、十六烷基。
‐“环烷基”适用于环状或多环、任选地支链、取代或未取代的烷基,优选地环丙基、环戊基或环己基。
‐“羧基”指的是-COOH基团。
‐“烯基”适用于带有至少一个双键的任何直链或支链、任选取代的烃链。
‐“炔基”适用于带有至少一个三键的任何直链或支链、任选取代的烃链。
‐“烷氧基”适用于O-烷基。对于本发明来说一个优选的烷氧基是甲氧基。
‐“芳族基团”适用于具有6个至12个碳原子的单环系或多环系,它具有一个或几个芳环(当存在两个环时,所用的术语是联芳基),当中包括苯基、联苯基、1-萘基、2-萘基、蒽基、芘基、四氢萘基、茚满基以及联萘基。术语芳族基团还适用于包含选自氧、氮或硫原子的至少一个杂原子的任何芳环,当中包括喹啉、三联吡啶、联吡啶、鸟嘌呤、菲咯啉、羟基喹啉。芳族基团可以被彼此独立地选自包括以下各项的组的1个至3个取代基取代:羟基、包含1个、2个、3个、4个、5个或6个碳原子的直链或支链烷基,特别是甲基、乙基、丙基、丁基;烷氧基或卤素原子,特别是溴、氯以及碘。当芳族基团被取代时,它可以被间位和/或对位和/或邻位取代。
‐“卤代”指的是氟代、氯代、溴代、或碘代。对于本发明来说一个优选的卤代基团是氟代基团。
‐“羟基”指的是-OH。
‐“氧代”指的是-C=O官能团。
‐“硝基”指的是-NO2。
‐“氰基”指的是-CN。
‐“氨基”指的是-NH2基团或通过一个或几个氢原子被脂族或芳族、取代或未取代的有机基团取代而衍生自-NH2的任何基团,其中当所述脂族或芳族基团被取代时,它是被一个或几个取代基取代,所述一个或几个取代基选自包括卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、卤代烷氧基、卤代烷基的组。-NH2衍生基团优选地是烷氨基,换句话说包括单烷基氨基和二烷基氨基的N-烷基。
‐“酰胺基”指的是-NR-CO-官能团,其中R是H或烷基。
‐“药物抗性”指的是对至少一种药物具有抗性的细菌菌株,所述细菌具有多药抗性、广泛药物抗性或泛药物抗性。
‐“多药抗性”指的是对超过一种抗微生物剂具有抗性,优选地对三种或更多种抗微生物类别中的至少一种药剂具有抗性。
‐“广泛药物抗性”等同于极端药物抗性并且指的是对除了两种或更少种抗微生物类别以外的所有类别中的至少一种药剂具有抗性的细菌菌株。
‐“泛药物抗性”指的是对所有抗微生物类别中的所有药剂均具有抗性的细菌菌株。
‐“前药”指的是式I、II或III的化合物的药理学上可接受的衍生物,例如像酰胺或酯,所述衍生物的体内生物转化产物产生生物活性药物。前药的特征一般在于生物利用度提高并且在体内容易被代谢成生物活性化合物。
‐“溶剂化物”指的是本发明的化合物,所述化合物含有化学计量或亚化学计量的一种或多种药学上可接受的溶剂分子,如乙醇或水。
‐如本发明中所用的“治疗(treat)”和“治疗(treatment)”意指包括缓解、减轻或消除病况或疾病和/或它伴有的症状。“治疗(treat)”和“治疗(treatment)”优选地意指根除细菌感染。
‐“药学上可接受”指的是药物组合物的成分彼此相容并且对患者无害。
‐“药物载体”指的是用作其中药物活性剂被配制和/或施用的溶剂或稀释剂的媒介物或惰性介质。药物载体的非限制性实例包括膏、凝胶、洗液、溶液、脂质体。
具体实施方式
本发明涉及通式I的化合物:
以及其药学上可接受的盐、溶剂化物以及前药,其中:
‐R1表示包含4个至20个碳原子,优选地5个至16个,更优选地5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个或16个碳的饱和或不饱和、取代或未取代、支链或无支链的烷基,当所述烷基被取代时,取代基选自包括以下各项的组:卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基;
‐R2表示选自包括以下各项的组的取代基:氢、烷基、烯烃、炔烃、环烷基、芳基、卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基,优选地R2表示选自包括以下各项的组的取代基:氢、甲基、甲氧基、乙氧基、氯代、氟代,更优选地R2是氢原子或甲氧基,甚至更优选地R2是甲氧基;
‐R3、R4、R5以及R6可以相同或不同并且各自表示选自以下各项的取代基:氢、烷基、烯烃、炔烃、环烷基、芳基、卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基,优选地R3、R4、R5以及R6相同并且各自表示氢原子;
‐R7表示选自以下各项的取代基:氢、烷基、烯烃、炔烃、环烷基、芳基、卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基,优选地R7表示氢、-NH2或氟代;
条件是式I的化合物不是:
‐7-(4-丁基哌嗪-1-基)-1-环丙基-6-氟-4-氧代-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-6-氟-7-(4-庚基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;
‐7-(4-丁基-3-甲基哌嗪-1-基)-1-环丙基-6-氟-4-氧代-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-6-氟-7-(4-己基-3-甲基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-6-氟-7-(4-(4-羟基丁基)哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;
条件是当R2是氢并且R7是氟时,R3、R4、R5以及R6不是甲基。
根据一个实施方案,本发明涉及通式I的化合物,其中当R2、R3、R4、R5以及R6是氢并且R7是氟时,R1不是C1-C7烷基或R1不是被氧代基取代的烷基。在一个实施方案中,本发明涉及通式I的化合物,其中当R2、R3、R4、R5以及R6是氢并且R7是氟时,R1不是戊基或己基或R1不是被氧代基取代的烷基。
根据一个实施方案,当R2、R3、R4、R5以及R6是氢并且R7是氟时,R1不是戊基或己基。在一个实施方案中,优选的通式I的化合物不包括1-环丙基-6-氟-4-氧代-7-(4-戊基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸。在一个实施方案中,优选的通式I的化合物不包括1-环丙基-6-氟-7-(4-己基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸。
根据一个实施方案,通式I的化合物不包括其中R1是被至少一个氧代官能团取代的烷基的化合物。在一个实施方案中,通式I的化合物不包括其中R1是仅被一个氧代官能团取代的烷基的化合物。
根据一个实施方案,当R2、R3、R4、R5以及R6是氢并且R7是氟时,R1不是被氧代官能团取代的烷基。在一个实施方案中,通式I的化合物不包括以下化合物:
‐7-(4-丁酰基哌嗪-1-基)-1-环丙基-6-氟-4-氧代-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-6-氟-4-氧代-7-(4-戊酰基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-6-氟-7-(4-己酰基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-6-氟-7-(4-庚酰基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-6-氟-7-(4-壬酰基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-7-(4-癸酰基哌嗪-1-基)-6-氟-4-氧代-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-7-(4-十二烷酰基哌嗪-1-基)-6-氟-4-氧代-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-6-氟-4-氧代-7-(4-十四烷酰基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-6-氟-4-氧代-7-(4-棕榈酰基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸;
‐1-环丙基-6-氟-4-氧代-7-(4-(3-氧代丁基)哌嗪-1-基)-1,4-二氢喹啉-3-甲酸。
根据一个实施方案,R1不是被选自包括以下各项的组的多于一个取代基取代的烷基:卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基。在一个实施方案中,R1不是被选自包括以下各项的组的多于一个取代基取代的烷基:卤代、羟基、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基。在一个实施方案中,R1不是被羧基和氧代基这两者取代的烷基。在一个实施方案中,R1不是被氧代和氨基这两者取代的烷基。
根据一个实施方案,优选的通式I的化合物是那些化合物,其中:
‐R1表示包含4个至20个碳原子,优选地5个至16个,更优选地5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个或16个碳的饱和或不饱和、取代或未取代、支链或无支链的烷基,当所述烷基被取代时,取代基选自包括以下各项的组:卤代、羟基、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基,并且
‐R2、R3、R4、R5、R6以及R7如上文所定义。
根据一个实施方案,优选的通式I的化合物是那些化合物,其中:
‐R1表示包含8个至12个碳原子,优选地8个、9个、10个、11个、12个碳,更优选地包含8个、9个或10个碳原子的饱和或不饱和、取代或未取代、支链或无支链的烷基,当所述烷基被取代时,取代基选自包括以下各项的组:卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基,并且
‐R2、R3、R4、R5、R6以及R7如上文所定义。
在一个实施方案中,优选的通式I的化合物是那些化合物,其中R1是辛基、壬基、癸基、十一烷基或十二烷基;优选地R1是辛基、壬基或癸基。
根据一个实施方案,优选的通式I的化合物是那些化合物,其中:
‐R1表示包含7个至12个碳原子,优选地7个、8个、9个、10个、11个、12个碳,更优选地包含7个、8个、9个或10个碳原子的饱和或不饱和、取代或未取代、支链或无支链的烷基,当所述烷基被取代时,取代基选自包括以下各项的组:卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基,并且
‐R2、R3、R4、R5、R6以及R7如上文所定义。
在一个实施方案中,优选的通式I的化合物是那些化合物,其中R1是庚基、辛基、壬基、癸基、十一烷基或十二烷基;优选地R1是庚基、辛基、壬基或癸基。
根据一个实施方案,本发明涉及通式II的化合物:
以及其药学上可接受的盐、溶剂化物或前药,所述化合物对应于其中R7是氟原子的式I的化合物。
根据另一个实施方案,本发明涉及通式III的化合物:
以及其药学上可接受的盐、溶剂化物或前药,所述化合物对应于其中R3、R4、R5、R6相同并且表示氢原子的通式II的化合物。
在一个优选的实施方案中,本发明涉及通式III的化合物:
以及其药学上可接受的盐、溶剂化物或前药,其中R2是氢原子或甲氧基,甚至更优选地R2是甲氧基并且R1如上文所定义。
根据一个实施方案,优选的通式III的化合物是那些化合物,其中:
-R2是甲氧基,并且
-R1表示包含8个至12个碳原子,优选地8个、9个、10个、11个、12个碳,更优选地包含8个、9个或10个碳原子的饱和或不饱和、取代或未取代、支链或无支链的烷基,当所述烷基被取代时,取代基选自包括以下各项的组:卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基。
在一个优选的实施方案中,优选的通式III的化合物是那些化合物,其中R2是甲氧基并且R1是辛基、壬基、癸基、十一烷基或十二烷基;优选地R2是甲氧基并且R1是辛基、壬基、或癸基。
根据一个实施方案,优选的通式III的化合物是那些化合物,其中:
-R2是甲氧基,并且
-R1表示包含7个至12个碳原子,优选地7个、8个、9个、10个、11个、12个碳,更优选地包含7个、8个、9个或10个碳原子的饱和或不饱和、取代或未取代、支链或无支链的烷基,当所述烷基被取代时,取代基选自包括以下各项的组:卤代、羟基、氧代、硝基、酰胺基、羧基、氨基、氰基、烷氧基、卤代烷氧基、或卤代烷基。
在一个优选的实施方案中,优选的通式III的化合物是那些化合物,其中R2是甲氧基并且R1是庚基、辛基、壬基、癸基、十一烷基或十二烷基;优选地R2是甲氧基并且R1是庚基、辛基、壬基或癸基。
在一个优选的实施方案中,本发明的化合物是表1中所列的那些:
表1
根据一个更优选的实施方案,本发明的化合物选自包括以下各项的组:1-环丙基-6-氟-8-甲氧基-4-氧代-7-(4-戊基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(Quin 17);1-环丙基-6-氟-8-甲氧基-7-(4-辛基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(Quin 18);1-环丙基-7-(4-癸基哌嗪-1-基)-6-氟-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸(Quin 19);以及1-环丙基-6-氟-7-(4-十六烷基哌嗪-1-基)-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸(Quin 20)。
在另一个实施方案中,本发明涉及一种药物组合物,所述药物组合物包含至少一种本发明的化合物或其药学上可接受的盐、溶剂化物或前药、以及至少一种药学上可接受的载体、稀释剂、赋形剂和/或佐剂。本发明还涵盖一种药物组合物,除了作为活性成分的至少一种本发明的化合物或其药学上可接受的盐、溶剂化物或前药之外,所述药物组合物还含有另外的治疗剂和/或活性成分。
根据另一个实施方案,本发明涉及一种药物,所述药物包含至少一种本发明的化合物或其药学上可接受的盐、溶剂化物或前药。
在另一个实施方案中,除了作为活性成分的至少一种本发明的化合物或其药学上可接受的盐、溶剂化物或前药之外,本发明的药物还包含另外的治疗剂和/或活性成分。
另外的治疗剂和/或活性成分的实例包括但不限于氟喹诺酮,如环丙沙星、恩氟沙星、加替沙星、莫西沙星、氧氟沙星(ofloxacin)、左氧氟沙星(levofloxacin)以及司帕沙星(sparfloxacin)。
根据一个实施方案,具有通式III的化合物是根据方案1中所述的途径,从作为前体的氟喹诺酮开始,通过用哌嗪取代位置7处的氟原子来合成的。在哌嗪基团的位置4处添加长烷基链提供了最终的通式III的化合物:
方案1:通式III的化合物的合成
根据本发明的一个实施方案,化合物具有通式III,其中R2是氢原子,并且是根据以下途径,从2,4,5-三氟苯甲酸开始制备的:
方案2:其中R2=H的通式III化合物的合成
根据另一个实施方案,所述化合物具有通式III,其中R2是甲氧基,并且是根据以下途径,从2,4,5-三氟-3-甲氧基-苯甲酸开始制备的:
方案3:其中R2=OMe的通式III化合物的合成
根据一个实施方案,本发明的化合物不具有手性中心。因此,它们的生产成本应当低于已知的喹诺酮,如DC-159a、左氧氟沙星、或莫西沙星。此外,所述合成是趋同的和通用的并且允许制备各种化合物。
本发明还涉及细菌感染的治疗。喹诺酮类和氟喹诺酮类的分子对广泛范围的细菌具有活性。喹诺酮和氟喹诺酮根除细菌的机制是通过抑制II型拓扑异构酶,即DNA旋转酶(作为GyrA和GyrB的复合物具有活性)和DNA拓扑异构酶IV。II型拓扑异构酶上的突变因此是细菌对喹诺酮和氟喹诺酮产生抗性的主要途径。在结核分枝杆菌(Mycobacterium tuberculosis)的特定情况下,DNA旋转酶是唯一的II型拓扑异构酶并且因此是喹诺酮和氟喹诺酮的唯一靶标。对喹诺酮和氟喹诺酮具有抗性的结核分枝杆菌的菌株因此主要在DNA旋转酶的GyrA亚基和/或GyrB亚基中具有至少一个突变。有趣的是并且无任何有关理论,,本发明的化合物抑制细菌的生长,而在低浓度下,它们仅微弱地抑制DNA旋转酶。
不希望被套至任何理论,本发明的化合物可通过不涉及DNA旋转酶的原始机制或涉及DNA旋转酶和另一个途径或细胞靶标的机制抑制细菌的生长。
根据一个实施方案,本发明的化合物、药物组合物以及药物可用于治疗细菌感染。
在另一个实施方案中,本发明的化合物可用于治疗由作为革兰氏阴性细菌或革兰氏阳性细菌的至少一种细菌所引起的感染。
某些细菌,如沙门氏菌属、军团菌属(Legionella)以及分枝杆菌属,特别是结核分枝杆菌具有在巨噬细胞中保持存活的能力。在一个实施方案中,本发明的化合物能够穿透到巨噬细胞中并且在那里具有杀细菌活性。
根据一个实施方案,本发明的化合物可用于治疗由选自以下组的属的至少一种细菌所引起的细菌感染,所述组包括但不限于:分枝杆菌属,如结核分枝杆菌或麻风分枝杆菌;革兰氏阳性细菌,如链球菌属、葡萄球菌属或芽孢杆菌属;肠杆菌科,如埃希氏菌属、克雷伯氏杆菌属、肠杆菌属、变形杆菌属、沙雷氏菌属、志贺氏菌属、柠檬酸杆菌属、沙门氏菌属或耶尔森氏菌属;非发酵革兰氏阴性杆菌,如假单胞菌属、产碱杆菌属、或不动杆菌属;厌氧菌,如拟杆菌属、梭杆菌属、真杆菌属、丙酸杆菌属、消化球菌属、梭菌属、消化链球菌属、或韦荣氏球菌属;幽门螺杆菌以及参与性传播感染的病原体,如奈瑟氏球菌属、嗜血杆菌属、衣原体属、或支原体属。
根据一个实施方案,本发明的化合物可用于治疗由选自以下组的至少一种细菌所引起的细菌感染,所述组包括但不限于:麻风分枝杆菌、结核分枝杆菌复合群,如结核分枝杆菌和非结核分枝杆菌,如龟分枝杆菌(Mycobacterium chelonae)、鸟分枝杆菌(Mycobacterium avium)、脓肿分枝杆菌(Mycobacterium abscessus)、偶发分枝杆菌(Mycobacterium fortuitum)、玛尔摩分枝杆菌(Mycobacterium malmoense)、戈登分枝杆菌(Mycobacterium gordonae)、土分枝杆菌(Mycobacterium terrae)、不产色分枝杆菌(Mycobacterium nonchromogenicium)、猿分枝杆菌(Mycobacterium simiae)、瘰疬分枝杆菌(Mycobacterium scrofulaceum)、草分枝杆菌(Mycobacterium phlei)、蟾蜍分枝杆菌(Mycobacterium xenopi)、海洋分枝杆菌(Mycobacterium marinum)、或溃疡分枝杆菌(Mycobacterium ulcerans);革兰氏阳性细菌,如金黄色葡萄球菌(Staphylococcus aureus)、肺炎链球菌(Streptococcus pneumoniae)、粪肠球菌(Enterococcus faecalis)、炭疽芽孢杆菌(Bacillus anthracis)、表皮葡萄球菌(Staphylococcus epidermidis)、或化脓性链球菌(Streptococcus pyogenes);肠杆菌科,如大肠杆菌(Escherichia coli)、肺炎克雷伯氏杆菌(Klebsiella pneumonia)、产气肠杆菌(Enterobacter aerogenes)、阴沟肠杆菌(Enterobacter cloacae)、普通变形杆菌(Proteus vulgaris)、福氏志贺氏菌(Shigella flexneri)、粘质沙雷氏菌(Serratia marcescens)、弗氏柠檬酸杆菌(Citrobacter freundii)、小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)、或肠炎沙门氏菌(Salmonella enteritidis);非发酵革兰氏阴性杆菌,如铜绿假单胞菌(Pseudomonas aeruginosa)、鲍氏不动杆菌(Acitenobacter baumannii)、洋葱伯克霍尔德菌(Burkholderia cepacia)、或嗜麦芽寡养单胞菌(Stenotrophomonas maltophilia);厌氧菌,如脆弱拟杆菌(Bacteroides fragilis)、狄氏拟杆菌(Bacteroides distasonis)、多形拟杆菌(Bacteroides thetaiotaomicron)、普通拟杆菌(Bacteroide vulgatus)、奇妙丝杆菌(Fusobacterium mortiferum)、坏死梭杆菌(Fusobacterium necrophorum)、可变梭杆菌(Fusobacterium varium)、迟钝真杆菌(Eubacterium lentum)、痤疮丙酸杆菌(Propionibacterium acens)、艰难梭菌(Clostridium difficile)、产气荚膜梭菌(Clostridium perfringens)、多枝梭菌(Clostridium ramosum)、厌氧消化链球菌(Peptostreptococcus anaerobius)、微小消化链球菌(Peptostreptococcus micros)、或小韦荣氏球菌(Veillonella parvula);幽门螺杆菌以及参与性传播感染的病原体,如淋病奈瑟氏球菌(Neisseria gonorrhaeae)、杜氏嗜血杆菌(Haemophulis ducreyi)、沙眼衣原体(Chlamydia trachomatis)、或生殖器支原体(Mycoplasma genitallium)。
根据一个实施方案,本发明的化合物可用于治疗由选自以下组的至少一种细菌所引起的细菌感染,所述组包括但不限于:麻风分枝杆菌、结核分枝杆菌复合群,如结核分枝杆菌和非结核分枝杆菌,如龟分枝杆菌、鸟分枝杆菌和鸟分枝杆菌复合群、脓肿分枝杆菌、偶发分枝杆菌、玛尔摩分枝杆菌、戈登分枝杆菌、土分枝杆菌、不产色分枝杆菌、猿分枝杆菌、瘰疬分枝杆菌、草分枝杆菌、堪萨斯分枝杆菌(Mycobacterium kansasii)、蟾蜍分枝杆菌、海洋分枝杆菌、或溃疡分枝杆菌;革兰氏阳性细菌,如金黄色葡萄球菌、肺炎链球菌、粪肠球菌、炭疽芽孢杆菌、表皮葡萄球菌、或化脓性链球菌;肠杆菌科,如大肠杆菌、肺炎克雷伯氏杆菌、产气肠杆菌、阴沟肠杆菌、普通变形杆菌、福氏志贺氏菌、粘质沙雷氏菌、弗氏柠檬酸杆菌、小肠结肠炎耶尔森氏菌、或肠炎沙门氏菌;非发酵革兰氏阴性杆菌,如铜绿假单胞菌、鲍氏不动杆菌、洋葱伯克霍尔德菌、或嗜麦芽寡养单胞菌;厌氧菌,如脆弱拟杆菌、狄氏拟杆菌、多形拟杆菌、普通拟杆菌、奇妙丝杆菌、坏死梭杆菌、可变梭杆菌、迟钝真杆菌、痤疮丙酸杆菌、艰难梭菌、产气荚膜梭菌、多枝梭菌、厌氧消化链球菌、微小消化链球菌、或小韦荣氏球菌;幽门螺杆菌以及参与性传播感染的病原体,如淋病奈瑟氏球菌、杜氏嗜血杆菌、沙眼衣原体、或生殖器支原体。
在一个优选的实施方案中,本发明的化合物可用于治疗由结核分枝杆菌野生型菌株、以及MDR菌株、XDR菌株、和PDR菌株所引起的细菌感染。
根据一个实施方案,本发明的化合物可用于治疗由选自以下组的细菌的至少一种多药抗性菌株、广泛药物抗性菌株或泛药物抗性菌株所引起的感染,所述组包括但不限于:麻风分枝杆菌、结核分枝杆菌复合群,如结核分枝杆菌和非结核分枝杆菌,如龟分枝杆菌、鸟分枝杆菌、脓肿分枝杆菌、偶发分枝杆菌、玛尔摩分枝杆菌、戈登分枝杆菌、土分枝杆菌、不产色分枝杆菌、猿分枝杆菌、瘰疬分枝杆菌、草分枝杆菌、蟾蜍分枝杆菌、海洋分枝杆菌、或溃疡分枝杆菌;革兰氏阳性细菌,如金黄色葡萄球菌、肺炎链球菌、粪肠球菌、炭疽芽孢杆菌、表皮葡萄球菌、或化脓性链球菌;肠杆菌科,如大肠杆菌、肺炎克雷伯氏杆菌、产气肠杆菌、阴沟肠杆菌、普通变形杆菌、福氏志贺氏菌、粘质沙雷氏菌、弗氏柠檬酸杆菌、小肠结肠炎耶尔森氏菌、或肠炎沙门氏菌;非发酵革兰氏阴性杆菌,如铜绿假单胞菌、鲍氏不动杆菌、洋葱伯克霍尔德菌、或嗜麦芽寡养单胞菌;厌氧菌,如脆弱拟杆菌、狄氏拟杆菌、多形拟杆菌、普通拟杆菌、奇妙丝杆菌、坏死梭杆菌、可变梭杆菌、迟钝真杆菌、痤疮丙酸杆菌、艰难梭菌、产气荚膜梭菌、多枝梭菌、厌氧消化链球菌、微小消化链球菌、或小韦荣氏球菌;幽门螺杆菌以及参与性传播感染的病原体,如淋病奈瑟氏球菌、杜氏嗜血杆菌、沙眼衣原体、或生殖器支原体。
根据一个实施方案,本发明的化合物可用于治疗由选自以下组的细菌的至少一种多药抗性菌株、广泛药物抗性菌株或泛药物抗性菌株所引起的感染,所述组包括但不限于:麻风分枝杆菌、结核分枝杆菌复合群,如结核分枝杆菌和非结核分枝杆菌,如龟分枝杆菌、鸟分枝杆菌和鸟分枝杆菌复合群、脓肿分枝杆菌、偶发分枝杆菌、玛尔摩分枝杆菌、戈登分枝杆菌、土分枝杆菌、不产色分枝杆菌、猿分枝杆菌、瘰疬分枝杆菌、草分枝杆菌、堪萨斯分枝杆菌、蟾蜍分枝杆菌、海洋分枝杆菌、或溃疡分枝杆菌;革兰氏阳性细菌,如金黄色葡萄球菌、肺炎链球菌、粪肠球菌、炭疽芽孢杆菌、表皮葡萄球菌、或化脓性链球菌;肠杆菌科,如大肠杆菌、肺炎克雷伯氏杆菌、产气肠杆菌、阴沟肠杆菌、普通变形杆菌、福氏志贺氏菌、粘质沙雷氏菌、弗氏柠檬酸杆菌、小肠结肠炎耶尔森氏菌、或肠炎沙门氏菌;非发酵革兰氏阴性杆菌,如铜绿假单胞菌、鲍氏不动杆菌、洋葱伯克霍尔德菌、或嗜麦芽寡养单胞菌;厌氧菌,如脆弱拟杆菌、狄氏拟杆菌、多形拟杆菌、普通拟杆菌、奇妙丝杆菌、坏死梭杆菌、可变梭杆菌、迟钝真杆菌、痤疮丙酸杆菌、艰难梭菌、产气荚膜梭菌、多枝梭菌、厌氧消化链球菌、微小消化链球菌、或小韦荣氏球菌;幽门螺杆菌以及参与性传播感染的病原体,如淋病奈瑟氏球菌、杜氏嗜血杆菌、沙眼衣原体、或生殖器支原体。
根据一个实施方案,本发明的化合物可用于治疗由细菌的至少一种多药抗性菌株、广泛药物抗性菌株或泛药物抗性菌株所引起的感染,所述细菌优选地是结核分枝杆菌。
根据本发明的另一个实施方案,所述细菌菌株具有氟喹诺酮抗性,这主要是因为DNA旋转酶的GyrA亚基中的一个或多个突变、因为DNA旋转酶的GyrB亚基中的一个或多个突变、或因为DNA旋转酶的GyrA亚基和GyrB亚基中的多个突变。
根据一个实施方案,结核分枝杆菌具有氟喹诺酮抗性,这是因为DNA旋转酶的GyrA亚基中的一个突变,所述突变选自包括但不限于以下各项的组:D89N、D94A、D94N、D94G、D94H、D94F、D94Y、D94V、A74S、A90V、T80A、G88A、G88C、S91A、以及S91P(Maruri等,J.Antimicrob.Chemother.,2012,第1-13页)。
根据一个实施方案,结核分枝杆菌具有氟喹诺酮抗性,这是因为DNA旋转酶的GyrB亚基中的一个突变,所述突变选自包括但不限于以下各项的组:N538D、N538T、D500A、D500N、D500H、T539P、E540D、以及E540V(Maruri等,J.Antimicrob.Chemother.,2012,第1-13页)。
根据另一个实施方案,结核分枝杆菌具有氟喹诺酮抗性,这是因为DNA旋转酶的GyrA亚基中的多个突变,所述多个突变选自包括但不限于以下各项的组:A74S+D94G、T80A+A90E、T80A+A90G+D94G、G88A+A90V、G88A+D94T、A90V+G94A、A90V+P102H、A90V+S91P、A90V+D94N、A90V+D94G、S91P+D94G、S91P+D94G+G94A、D94A+D94Y、D94N+D94G、D94N+D94G+D94Y、以及D94G+D94A(Maruri等,J.Antimicrob.Chemother.,2012,第1-13页)。
根据另一个实施方案,结核分枝杆菌具有氟喹诺酮抗性,这是因为DNA旋转酶的GyrA亚基和GyrB亚基中的多个突变,所述多个突变选自包括但不限于以下各项的组:A90V+T500P、D94A+D461N、D94G+N499K、D94G+N499T、以及D94N+A504V(Maruri等,J.Antimicrob.Chemother.,2012,第1-13页)。
根据一个实施方案,本发明的化合物可用作初步治疗。根据另一个实施方案,本发明的化合物可用作二线治疗。
本发明还涉及一种用于治疗有需要的受试者的细菌感染的方法,所述方法包括向所述受试者施用治疗有效量的至少一种如上所述的本发明的化合物或组合物。
优选地,所述受试者是温血动物,更优选地是人类。
根据一个实施方案,本发明的化合物可以作为联合治疗的一部分被施用。因此,包括在本发明的范围内的是包括与另外的治疗剂和/或活性成分的共同施用的实施方案,以及除了作为活性成分的本发明的化合物、其药学上可接受的溶剂化物之外,还含有另外的治疗剂和/或活性成分的组合物和药物。
在上述本发明实施方案组合中,本发明的化合物、其药学上可接受的溶剂化物和其它治疗活性剂可以根据剂型彼此分开施用或联合施用,以及根据它们的施用时间,依次施用或同时施用。因此,一种组分药剂的施用可以在施用一种或多种其它组分药剂之前、同时或之后。
一般来说,对于药物用途来说,本发明的化合物可以被配制成药物制剂,所述药物制剂包含至少一种本发明的化合物和至少一种药学上可接受的载体、稀释剂、赋形剂和/或佐剂以及任选的一种或多种另外的药物活性化合物。
借助于非限制性实例,这样的配方可以呈适用于口服施用、适用于肠胃外施用(如通过静脉内、肌内或皮下注射或静脉内输注)、适用于局部施用(包括眼部)、适用于通过吸入、通过皮肤贴剂、通过植入、通过栓剂等施用的形式。根据施用方式可以是固体、半固体或液体的这样的合适的施用形式以及用于制备其的方法和载体、稀释剂以及赋形剂对于本领域技术人员来说将是清楚的;参考Remington's Pharmaceutical Sciences(《雷明顿药物科学》)的最新版。
根据一个实施方案,本发明的化合物是经口(口服施用)或通过静脉内途径施用的。
这样的制剂的一些优选的而非限制性的实例包括片剂、丸剂、粉剂、锭剂、小药囊、扁囊剂、酏剂、悬浮液、乳液、溶液、糖浆、气溶胶、软膏剂、霜剂、洗剂、软明胶胶囊和硬明胶胶囊、栓剂、滴剂、用于以推注和/或连续施用的形式施用的无菌注射溶液和无菌包装粉剂(通常在使用之前复原),它们可以与本身适用于这些制剂的载体、赋形剂以及稀释剂一起来配制,如乳糖、右旋糖、蔗糖、山梨糖醇、甘露醇、淀粉、阿拉伯树胶、磷酸钙、藻酸盐、黄蓍胶、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、聚乙二醇、纤维素、(无菌)水、甲基纤维素、羟基苯甲酸甲酯和羟基苯甲酸丙酯、滑石粉、硬脂酸镁、食用油、植物油和矿物油或其合适的混合物。所述配方可以任选地含有通常用于药物配方中的其它物质,如润滑剂、润湿剂、乳化和助悬剂、分散剂、崩解剂、增量剂、填充剂、防腐剂、甜味剂、调味剂、流动调节剂、隔离剂等。所述组合物还可以被配制成提供其中所含的一种或多种活性化合物的快速释放、持续释放或延迟释放。
本发明的药物制剂优选地呈单位剂型的形式,并且可以被适当地包装在例如盒、泡罩、小瓶、瓶子、小药囊、安瓿或任何其它合适的单剂量或多剂量支持物或容器(它可以被适当地贴上标签)中;任选地具有含有产品信息和/或使用说明的一个或多个活页。
通常,根据待预防或治疗的病况和施用途径,本发明的活性化合物通常将以每天患者的每公斤体重0.001mg至200mg,优选地每公斤体重1mg至160mg,例如每公斤体重约25mg、50mg、100mg、150mg来施用,它可以作为单次日剂量施用、分为一次或多次日剂量施用、或例如使用滴注而基本上连续施用。
根据一个实施方案,本发明的化合物是以0mg/ml至40mg/ml范围的浓度,优选地以10mg/ml或20mg/ml的浓度施用的。
根据一个实施方案,本发明的化合物是以大于0ml/kg至100ml/kg范围的体积施用的;优选地,施用体积是10ml/kg。
附图说明
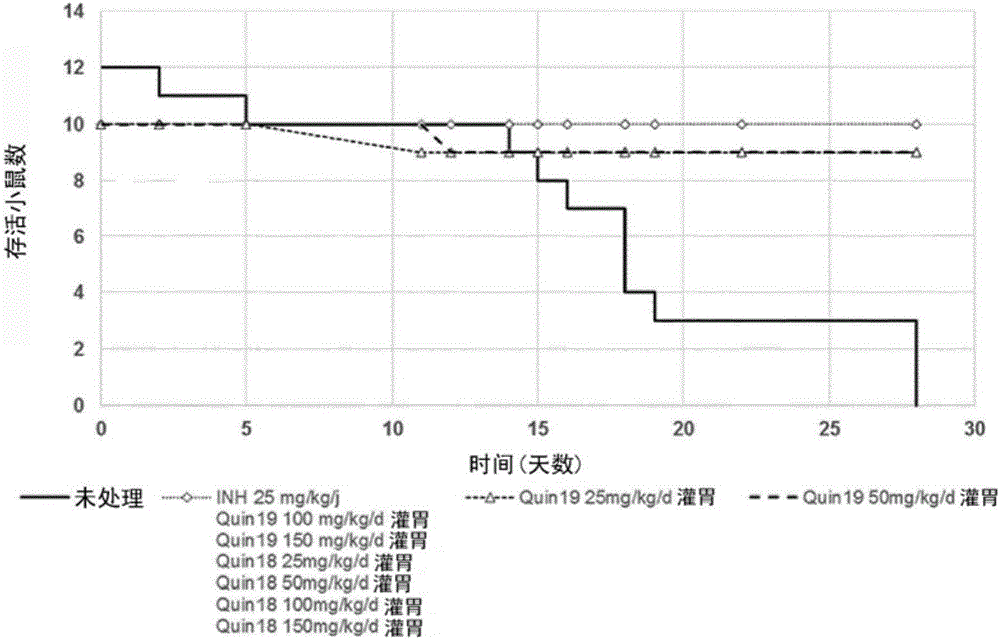
图1是示出了感染了野生型结核分枝杆菌菌株H37rv并且接受Quin18和Quin19灌胃处理的存活小鼠的演变的图。
图2是示出了感染了野生型结核分枝杆菌菌株H37rv并且接受Quin18静脉内处理的存活小鼠的演变的图。
图3是示出了从D0到D14接受不同剂量的Quin 18或Quin 19处理的小鼠的体重的图。
实施例
通过以下实施例来进一步说明本发明。
1.本发明的化合物的合成
材料和方法
所有材料均是从商业供应商获得的并且不经进一步纯化而被使用。在来自默克公司(Merck)的硅胶60F254的TLC塑料片(层厚度0.2mm)上进行薄层色谱。在硅胶60(70目-230目ASTM,默克公司)上进行柱色谱纯化。熔点是在数字熔点装置(Electrothermal IA 8103)上测定的并且未校正或者是在Kofler台式WME(瓦格纳-芒兹公司(Wagner&Munz))上测定的。IR、1H、19F以及13C NMR谱确认了所有化合物的结构。在Perkin Elmer Spectrum 100FT-IR光谱仪上记录IR谱并且在BRUKER AC 300或400光谱仪上,以针对1H的300或400MHz、针对13C的75或100MHz以及针对19F的282或377MHz,使用CDCl3、CD3CN、D2O或DMSO-d6作为溶剂来记录NMR谱。化学位移(δ)是以间接相对于(i)CHCl3(δ7.27)(对于1H)和(ii)CDCl3(δ77.2)(对于13C)的信号以及直接相对于(iii)CFCl3(内标)(δ0)(对于19F)的信号的百万分率表示的。化学位移是以ppm给出的并且峰多重性指定如下:s,单峰;br s,宽单峰;d,双峰;dd,双二重峰;t,三重峰;q,四重峰;quint,五重峰;m,多重峰。高分辨率质谱(HRMS)是从“索莱泽分析服务中心(Service Central d'analyse de Solaize)”(国家科学研究中心(Centre Nationale de la Recherche Scientifique))获得的,并且在Waters光谱仪上使用电喷雾电离-TOF(ESI-TOF)记录。
结果
实施例1:用于制备其中R2是氢原子的通式III化合物的前体的合成
α(Z)-[(二乙氨基)亚甲基]-2,4,5-三氟-β-氧代-苯丙酸乙酯
将2,4,5-三氟苯甲酸(3.49g,19.81mmol)、草酰氯(2.18mL,25.75mmol)以及五滴DMF的无水CH2Cl2溶液(50mL)在室温搅拌24小时。然后将反应混合物在减压下进行浓缩蒸发,溶解在甲苯(30mL)中并且逐滴添加到三乙胺(8.26mL,59.43mmol)和3-(二乙氨基)-2E-丙烯酸乙酯(4.40g,25.75mmol)的甲苯溶液(20mL)中。在90℃搅拌18小时之后,用水洗涤冷却的反应混合物。将有机层经过Na2SO4干燥,过滤并且蒸发。将粗残余物通过硅胶快速色谱(95:5到60:40的己烷/AcOEt)纯化,得到呈无色油状的α(Z)-[(二乙氨基)亚甲基]-2,4,5-三氟-β-氧代-苯丙酸乙酯(4.180g,12.7mmol,64%(两个步骤))。
1H NMR(400MHz,CDCl3,δ):0.97(t,3H,OCH2CH3,3JH-H=7.1Hz),1.03(br s,3H,NCH2CH3),1.33(br s,3H,NCH2CH3),3.45(br s,4H,NCH2CH3),3.98(q,2H,OCH2CH3,3J=7.1Hz),6.87(Td,1H,H5,3JH-F=9.7Hz,4JH-F=6.3Hz),7.45(m,1H,H8),7.75(s,1H);19F NMR(376MHz,CDCl3,δ):-115.6(dd,F2,5JF-F=15.5Hz,4JF-F=5.3Hz),-130.2(br s,F4);-142.8(dd,F5,3JF-F=21.5Hz,5JF-F=15.5Hz)。
1-环丙基-6,7-二氟-4-氧代-1,4-二氢喹啉-3-甲酸乙酯的制备
将于1:2EtOH/Et2O(50mL)中的α(Z)-[(二乙氨基)亚甲基]-2,4,5-三氟-β-氧代-苯丙酸乙酯(1.977g,6.10mmol)添加到环丙胺(0.98mL,10.40mmol)中。在室温搅拌3小时之后,将反应混合物在减压下蒸发。将油状残余物溶解在DMF(40mL)中,然后添加K2CO3(3.386g,24.4mmol)。在100℃搅拌16小时之后,添加冷水(20mL)。将黄色沉淀物过滤并且干燥,得到1-环丙基-6,7-二氟-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(1.336g,4.56mmol,76%)。
1H NMR(400MHz,CD3CN,δ):1.07[m,2H,CH2(cPr)],1.26-1.30[m,2H,CH2(cPr)],1.32[t,3H,OCH2CH3,3JH-H=7.1Hz],3.50(tt,1H,CH(cPr),3JH-H=6.9Hz,3JH-H=3.8Hz),4.26(q,2H,OCH2CH3,3JH-H=7.1Hz),7.95(dd,1H,H5,3JH-F=12.1Hz,4JH-F=6.6Hz),7.95(dd,1H,H8,3JH-F=10.8Hz,4JH-F=8.8Hz),8.53(s,1H,H2)。19F NMR(376MHz,CD3CN,δ):-131.1和-142.4(2d,2F,F6和F7,3JF-F=21.7Hz);MP=181℃-182℃。
1-环丙基-6-氟-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸乙酯的制备
将哌嗪(387mg,4.50mmol)和1-环丙基-6,7-二氟-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(600mg,2.05mmol)于无水CH3CN(10mL)中的溶液回流一周。在减压下蒸发之后,将粗残余物在1:1的CHCl3/H2O中分配。将有机层用水洗涤,经过Na2SO4干燥,过滤并且蒸发,得到呈黄色粉末状的1-环丙基-6-氟-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸乙酯(657mg,1.83mmol,89%)。
1H NMR(400MHz,CD3CN,δ):1.04-1.08(m,2H,CH2(cPr)),1.26-1.29(m,2H,CH2(cPr)),1.32(t,3H,CH3,3JH-H=7.1Hz),2.96(dd,4H,H1',H4',3JH-H=3.9Hz,5.9Hz),3.19(dd,4H,H2',H3',3JH-H=3.9Hz,5.9Hz),3.50(tt,1H,CH(cPr),3JH-H=3.7Hz,7.0Hz),4.25(q,2H,CH2,3JH-H=7.1Hz),7.42(d,1H,H8,4JH-F=7.4Hz),7.83(d,1H,H5,3JH-F=13.7Hz),8.47(s,1H,H2)。19F NMR(376MHz,CD3CN,δ):,-125.9(s,1F,F6)。
实施例2:用于制备其中R2是甲氧基的通式III化合物的前体的合成
α(Z)-[(二乙氨基)亚甲基]-2,4,5-三氟-3-甲氧基-β-氧代-苯丙酸乙酯的制备
将2,4,5-三氟-3-甲氧基-苯甲酸(1.36g,6.60mmol)、草酰氯(0.80mL,9.17mmol)以及五滴DMF的无水CH2Cl2溶液(30mL)在室温搅拌24小时。然后将反应混合物在减压下进行浓缩蒸发,溶解在甲苯(15mL)中并且逐滴添加到三乙胺(3mL,16.5mmol)和3-(二乙氨基)-2E-丙烯酸乙酯(1.29g,7.54mmol)的甲苯溶液(15mL)中。在90℃搅拌5小时之后,用水洗涤冷却的反应混合物。将有机层经过Na2SO4干燥,过滤并且蒸发。将粗残余物通过硅胶快速色谱(95:5到60:40己烷/AcOEt)纯化,得到呈无色油状的α(Z)-[(二乙氨基)亚甲基]-2,4,5-三氟-3-甲氧基-β-氧代-苯丙酸乙酯(1.88g,5.22mmol,79%(两个步骤))。
1H NMR(400MHz,CDCl3,δ):0.77(t,3H,OCH2CH3,3J=7.1Hz),0.84(br s,3H,NCH2CH3),1.08(br s,3H,NCH2CH3),3.25(br s,4H,NCH2CH3),3.76(q,2H,OCH2CH3,3J=7.1Hz),3.78(s,3H,OCH3),6.87(ddd,1H,HAr,3JH-F=10.1Hz,4JH-F=8.5Hz,4JH-F=6.0Hz),7.53(s,1H);19F NMR(376MHz,CDCl3,δ):-135.1(dd,F2,5JF-F=13.8Hz,4JF-F=7.6Hz),-141.5(dd,F5,3JF-F=20.6Hz,5JF-F=13.7Hz),-149.2(br d,F4,3JF-F=6.5Hz);13C NMR(100MHz,CDCl3,δ):10.8,14.2,13.4,45.0,53.8,59.4,61.5,101.6,109.5,126.2,137.1,145.1,146.6,149.1,154.4,167.3,184.5。
1-环丙基-6,7-二氟-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸乙酯的制备
将于1:2的EtOH/Et2O(20mL)中的α(Z)-[(二乙氨基)亚甲基]-2,4,5-三氟-3-甲氧基-β-氧代-苯丙酸酯(850mg,2.37mmol)添加到环丙胺(0.38mL,5.48mmol)中。在室温搅拌3小时之后,将反应混合物在减压下蒸发。将油状残余物溶解在DMF(10mL)中,然后添加K2CO3(1.32g,9.57mmol)。在100℃搅拌5小时之后,添加冷水(5mL)。将黄色沉淀物过滤并且干燥,得到1-环丙基-6,7-二氟-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(627mg,1.94mmol,82%)。
1H NMR(400MHz,CDCl3,δ):1.04和1.19[2m,4H,CH2(cPr)],1.37(t,3H,OCH2CH3,3JH-H=7.1Hz),3.97(tt,1H,CH(cPr),3JH-H=7.5Hz,3JH-H=3.7Hz),4.07(d,3H,OCH3,5JH-H=1.9Hz),4.35(q,2H,OCH2CH3,3JH-H=7.1Hz),7.97(dd,1H,H5,3JH-F=10.0Hz,4JH-F=8.8Hz),8.56(s,1H,H2)。19F NMR(376MHz,CDCl3,δ):-136.9和-145.1(2d,2F,F6和F7,3JF-F=21.3Hz);13C NMR(100MHz,CDCl3,δ):9.2[CH2(cPr)],14.5(OCH2CH3),39.8[CH(cPr)],61.1(OCH2CH3),62.9(d,OCH3,4JC-F=7.7Hz),108.7(dd,C5,2JC-F=18.7Hz,3JC-F=1.1Hz),110.1(C3),126.1(dd,C10,3JC-F=5.9Hz,4JC-F=1.8Hz),131.6(dd,C9,3JC-F=3.7Hz,4JC-F=2.2Hz),140.4(d,C8,2JC-F=12.1Hz),148.2(dd,C7,1JC-F=253.7Hz,2JC-F=15.6Hz),149.2(dd,C6,JC-F=251.4Hz,2JC-F=12.4Hz),150.7(C2),165.2[C(O)O],172.3(C4)。MP=183℃-184℃。
1-环丙基-6,7-二氟-1,4-二氢-8-甲氧基-4-氧代-3-喹啉-甲酸根合-O3,O4)二氟-硼的制备
向1-环丙基-6,7-二氟-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(621mg,1.92mmol)和K2CO3(305mg,2.21mmol)于无水THF(20mL)中的溶液中经过五分钟逐滴添加BF3·Et2O(0.4mL,3.18mmol)。在回流96小时之后,将澄清的反应混合物用Et2O(40mL)稀释,将所得混合物滤出并且用Et2O洗涤。将所获得的粗制白色固体溶解在CH3CN中,并且过滤。将粗制固体再次溶解在CH3CN中并且过滤。将滤液合并并且蒸发,得到呈白色固体状的1-环丙基-6,7-二氟-1,4-二氢-8-甲氧基-4-氧代-3-喹啉-甲酸根合-O3,O4)二氟-硼(514mg,1.50mmol,78%)。
1H NMR(400MHz,CD3CN,δ):1.25-1.37[m,4H,2CH2(cPr)],4.19(d,3H,OCH3,5JH-F=2.4Hz),4.48(tt,1H,CH(cPr),3JH-H=7.3Hz,3JH-H=3.8Hz),8.17(dd,1H,H5,3JH-F=9.8Hz,4JH-F=8.1Hz),9.17(s,1H,H2);19F NMR(376MHz,CD3CN,δ):-131.7和-139.0(2d,2F,F6和F7,3JF-F=19.9Hz),-144.0(s,0.5F,10BF2),-144.1(s,2.4F,11BF2);MS(+ESI)m/z:C14H10BF4NO4的[M+Na]+计算值:343.06;实测值:344.2;Mp=221℃-223℃。
1-环丙基-6-氟-8-甲氧基-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸的制备
将哌嗪(450mg,5.2mmol)和1-环丙基-6,7-二氟-1,4-二氢-8-甲氧基-4-氧代-3-喹啉-甲酸根合-O3,O4)二氟-硼(650mg,1.89mmol)于无水CH3CN(25mL)中的溶液回流96小时。用CH3CN和Et2O洗涤固体,得到呈米色固体状的1-环丙基-6-氟-8-甲氧基-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(550mg,1.44mmol,76%)。
1H NMR(400MHz,D2O/CD3CN:4/1,δ):0.89(m,2H,CH2(cPr)),1.08(m,2H,CH2(cPr)),3.30(m,4H,H1',H4'),3.52(m,4H,H2',H3'),3.74(s,3H,OCH3),4.03(m,1H,CH(cPr)),7.68(d,1H,H5,3JH-F=12.1Hz),8.59(s,1H,H2)。19F NMR(376MHz,CD3CN,δ):-121.6(bs,1F,F-),-122.2(s,1F,F6)。MP=191℃-193℃。
实施例3:其中R2=H的通式III化合物的制备
1-环丙基-6-氟-4-氧代-7-(4-戊基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(Quin 15)的制备
向1-环丙基-6-氟-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸乙酯(63mg,0.18mmol)于无水DMF(18mL)中的溶液中添加1-碘戊烷(760mg,3.8mmol)和NaHCO3(150mg,1.8mmol)。将反应混合物在室温搅拌20小时并且在减压下浓缩。将所获得的油状残余物溶解到DCM(40mL)中。将有机层用水(20mL)洗涤,经过无水MgSO4干燥并且在真空中浓缩,得到呈浅黄色粉末状的1-环丙基-6-氟-4-氧代-7-(4-戊基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸乙酯(65mg,86%)。这一产物对于进一步反应是足够纯的。
将1-环丙基-6-氟-4-氧代-7-(4-戊基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸乙酯(65mg,0.15mmol)溶解在EtOH/H2O(5/2)混合物(21mL)中,然后添加LiOH(30mg,1.25mmol)。将反应混合物在室温搅拌20小时,然后用HCl水溶液(3N)酸化直到pH 1为止。在减压下去除EtOH并且用DCM(40mL)萃取水层。将有机层用饱和NaHCO3水溶液(20mL)洗涤,经过无水MgSO4干燥,然后在真空中浓缩,得到呈白色粉末状的1-环丙基-6-氟-4-氧代-7-(4-戊基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(48mg,80%)。
1H NMR(400MHz,CDCl3,δ):14.78(宽单峰,1H,CO2H),8.73(s,1H,H2),7.90(d,3JH-F=12.6Hz,1H,H5),7.41(d,4JH-F=7.0Hz,1H,H8),3.79(宽单峰,4H,H2'和H3'),3.55(m,1H,CH(cPr)),3.54(宽单峰,4H,H1'和H4'),3.02(m,2H,NCH2CH2CH2),1.94(宽单峰,2H,NCH2CH2CH2),1.47-1.37(m,6H,CH2(cPr),NCH2CH2CH2CH2),1.28-1.19(m,2H,CH2(cPr)),0.94(t,3JH-H=6.7Hz,3H,CH3)。19F NMR(376MHz,CDCl3,δ):-121.9(s,F6)。13C NMR(100MHz,CDCl3,δ):177.1(d,J=2.6Hz,C4),166.7(s,CO2H),153.5(d,J=250.6Hz,C6),147.9(s,C2),144.3(d,J=10.4Hz,C7),139.0(s,C9),121.0(d,J=8.0Hz,C10),112.6(d,J=23.1Hz,C5),108.4(s,C3),106.1(d,J=2.3Hz,C8),58.0(s,NCH2CH2CH2),51.9(s,C1'和C4'),46.9(s,C2'和C3'),35.6(s,CH(cPr)),29.0(s,CH2),23.6(s,CH2),22.3(s,CH2),13.9(s,CH3),8.5(s,2CH2(cPr))。IR(净):ν=3433,2956,2933,2872,1729,1630,1505,1471,1390,1337,1302,1266,1099,979,944,892,831,805,733cm-1;HRMS(+ESI)m/z:C22H29FN3O3的[M+Na]+计算值:402.2194,实测值:402.2192。
使用相应的起始材料,以与参考Quin 15化合物相同的方式制备参考Quin 16、Quin 9、以及Quin 10化合物。
1-环丙基-6-氟-7-(4-辛基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(Quin 16)的制备
根据参考Quin 15,从于无水DMF(15mL)中的1-环丙基-6-氟-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸乙酯(63mg,0.18mmol)、1-碘辛烷(133mg,0.55mmol)以及NaHCO3(80mg,0.95mmol)开始合成1-环丙基-6-氟-7-(4-辛基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(70mg,87%,浅黄色粉末)。这一产物对于进一步反应是足够纯的。
根据Quin 15,从于EtOH/H2O(5/2)混合物(21mL)中的1-环丙基-6-氟-7-(4-辛基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(70mg,0.15mmol)和LiOH(40mg,1.67mmol)开始获得1-环丙基-6-氟-7-(4-辛基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(45mg,68%,白色粉末)。
1H NMR(400MHz,CDCl3,δ):15.02(宽单峰,1H,CO2H),8.71(s,1H,H2),7.94(d,3JH-F=13.1Hz,1H,H5),7.34(d,4JH-F=7.1Hz,1H,H8),3.55(宽单峰,1H,CH(cPr)),3.36(宽单峰,4H,H2'和H3'),2.67(宽单峰,4H,H1'和H4'),2.42(m,2H,NCH2CH2CH2),1.58-1.48(m,2H,NCH2CH2CH2),1.42-1.21(m,12H,CH2(cPr),5CH2),1.15-1.21(m,2H,CH2(cPr)),0.87(t,3JH-H=6.8Hz,3H,CH3)。19F NMR(376MHz,CDCl3,δ):-120.7(s,F6)。13C NMR(100MHz,CDCl3,δ):177.2(d,J=2.5Hz,C4),167.1(s,CO2H),153.8(d,J=251.6Hz,C6),147.4(s,C2),146.1(d,J=10.3Hz,C7),139.2(s,C9),119.8(d,J=7.9Hz,C10),112.4(d,J=23.5Hz,C5),108.2(s,C3),104.9(d,J=3.3Hz,C8),58.8(s,NCH2CH2CH2),53.0(s,C1'和C4'),50.0(s,C2'和C3'),35.4(s,CH(cPr)),31.9(s,CH2),29.6(s,CH2),29.4(s,CH2),27.6(s,CH2),26.9(s,CH2),22.8(s,CH2),14.2(s,CH3),8.3(s,2CH2(cPr))。IR(净):ν=2926,2854,2816,2778,1725,1626,1611,1544,1494,1464,1452,1378,1344,1299,1254,1223,1185,1143,1128,1109,1094,1043,1027,1009,991,945,890,859,833,805,778,747,706cm-1;HRMS(+ESI)m/z:C25H34FN3O3的[M+H]+计算值:444.2663,实测值:444.2668。
1-环丙基-7-(4-癸基哌嗪-1-基)-6-氟-4-氧代-1,4-二氢喹啉-3-甲酸(Quin 9)的制备
根据参考Quin 15,从1-环丙基-6-氟-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸乙酯(117mg,0.33mmol)、1-碘癸烷(0.10mL,0.49mmol)以及NaHCO3(82mg,0.98mmol)开始合成1-环丙基-7-(4-癸基哌嗪-1-基)-6-氟-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(117mg,72%,米色粉末)。这一产物对于进一步反应是足够纯的。
根据Quin 15,从于39ml的4:1MeOH/H2O中的1-环丙基-6-氟-7-(4-癸基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(60mg,0.12mmol)和LiOH·H2O(55mg,1.32mmol)开始获得1-环丙基-7-(4-癸基哌嗪-1-基)-6-氟-4-氧代-1,4-二氢喹啉-3-甲酸(52mg,92%,白色粉末)。
1H NMR(400MHz,CDCl3,δ):15.03(宽单峰,1H,CO2H),8.78(s,1H,H2),8.03(d,3JH-F=13.0Hz,1H,H5),7.36(d,4JH-F=7.1Hz,1H,H8),3.53(宽单峰,1H,CH(cPr)),3.38(宽单峰,4H,H2'和H3'),2.71(宽单峰,4H,H1'和H4'),2.45(m,2H,NCH2CH2CH2),1.60-1.49(m,2H,NCH2CH2CH2),1.42-1.16(m,18H,2CH2(cPr),7CH2),0.88(t,3JH-H=6.9Hz,3H,CH3)。19F NMR(376MHz,CDCl3,δ):s,1F,F6)。HRMS(+ESI)m/z:C27H39FN3O3的计算值:472.2975;实测值:472.2965[M+H]+。IR(净):2928(酸),2853(烷基),1625(酮),1488(C=C),1413(C=C),1306(C-N,C-C,C-O),1254(C-N,C-C,C-O)。MP=209℃。
1-环丙基-6-氟-7-(4-十六烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(Quin 10)的制备
根据参考Quin 15,从1-环丙基-6-氟-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸乙酯(100mg,0.28mmol)、1-碘十六烷(147mg,0.42mmol)以及NaHCO3(70mg,0.84mmol)开始合成1-环丙基-6-氟-7-(4-十六烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(146mg,90%,白色固体)。这一产物对于进一步反应是足够纯的。
于34ml的4:1MeOH/H2O中的1-环丙基-6-氟-7-(4-十六烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸乙酯(60mg,0.1mmol)和LiOH·H2O(47mg,1.10mmol)。将混合物在室温搅拌24小时并且在回流下再持续搅拌22小时。在用冰AcOH酸化到pH 5-6之后,将溶剂蒸发到干燥,并且添加少量水。将悬浮液过滤,并且将固体在真空中干燥,得到呈黄色粉末状的所期望的化合物(35mg,0.06mmol,61%)。
1H NMR(400MHz,CDCl3,δ):15.03(宽单峰,1H,CO2H),8.78(s,1H,H2),8.03(d,3JH-F=13.0Hz,1H,H5),7.36(d,4JH-F=6.2Hz,1H,H8),3.54(宽单峰,1H,CH(cPr)),3.36(宽单峰,4H,H2'和H3'),2.67(宽单峰,4H,H1'和H4'),2.42(dd,3JH-H=7.8,7.3Hz,2H,NCH2CH2CH2),1.60-1.49(m,2H,NCH2CH2CH2),1.42-1.15(m,30H,2CH2(cPr),13CH2),0.88(t,3JH-H=6.5Hz,3H,CH3)。19F NMR(376MHz,CDCl3,δ):δ-120.7(s,1F,F6)。13C NMR(100MHz,CDCl3,δ):δ8.3(s,CH2(cPr)),14.2(s,CH3),22.8(s,CH2),26.9(s,NCH2CH2),27.7,29.5,29.6,29.7,29.8,32.0(s,CH2),49.9(d,C2'和C3',4JC-F=4.4Hz),50.9(s,CH(cPr)),52.9(s,C1'和C4'),58.7(s,NCH2CH2),104.8(d,C8,3JC-F=2.9Hz),108.2(s,C3),112.4(d,C5,2JC-F=23.3Hz),119.8(d,C10,3JC-F=6.3Hz),139.2(s,C9),146.1(d,C7,2JC-F=11.2Hz),147.5(s,C2),153.3(d,C6,1JC-F=249.7Hz),167.2(s,C5'),177.2(s,C4)。HRMS(+ESI)m/z:C33H51FN3O3的计算值:556.3914;实测值:556.3891[M+H]+。IR(净):2916(酸),2850(烷基),1742(酸),1626(酮),1501(C=C),1464(C=C),1335(C-N,C-C,C-O),1254(C-N,C-C,C-O),1131(C-N,C-C,C-O),1029(C-F)。MP=150℃。
实施例4:其中R2=OMe的通式III化合物的制备
1-环丙基-6-氟-8-甲氧基-4-氧代-7-(4-戊基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(Quin 17)的制备
向1-环丙基-6-氟-8-甲氧基-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(65mg,0.17mmol)于无水DMF(18mL)中的悬浮液中添加1-碘戊烷(152mg,0.77mmol)和NaHCO3(200mg,2.4mmol)。将反应混合物在40℃搅拌40小时,然后在减压下浓缩。将残余物溶解在DCM(40mL)中并且将有机层用水(30mL)洗涤并且经过无水MgSO4干燥,得到1-环丙基-6-氟-8-甲氧基-4-氧代-7-(4-戊基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸和1-环丙基-6-氟-8-甲氧基-4-氧代-7-(4-戊基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸戊酯的混合物(150mg)。
将后者混合物溶解在EtOH/H2O(5/2)混合物(21mL)中,然后添加LiOH(40mg,1.67mmol)。将反应混合物在室温搅拌过夜,然后用HCl水溶液(1N)酸化直到pH 3为止。在减压下去除乙醇并且用DCM(40mL)萃取水层。将有机层用饱和NaHCO3水溶液(20mL)洗涤,经过无水MgSO4干燥并且在真空中浓缩。将所获得的粗制固体用Et2O(3×5mL)洗涤,得到呈黄色粉末状的1-环丙基-6-氟-8-甲氧基-4-氧代-7-(4-戊基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(25mg,34%(经过2个步骤))。
1H NMR(400MHz,CD2Cl2,δ):14.83(宽单峰,1H,CO2H),8.78(s,1H,H2),7.82(d,3JH-F=12.4Hz,1H,H5),4.04(m,1H,CH(cPr)),3.76(s,3H,OCH3),3.43(宽单峰,4H,H2'和H3'),2.58(宽单峰,4H,H1'和H4'),2.39(m,2H,NCH2CH2CH2),1.52(m,2H,NCH2CH2CH2),1.42-1.24(m,4H,NCH2CH2CH2CH2),1.20(q,J=6.8Hz,2H,CH2(cPr)),1.01-0.95(m,2H,CH2(cPr)),0.92(t,3JH-H=6.9Hz,3H,CH3)。19F NMR(376MHz,CD2Cl2,δ):-120.1(s,F6)。13C NMR(75MHz,CD2Cl2,δ):177.5(d,J=2.9Hz,C4),166.9(s,CO2H),156.7(d,J=250.9Hz,C6),150.3(s,C2),145.9(d,J=5.8Hz,C8),140.1(d,J=11.6Hz,C7),134.6(s,C9),121.9(d,J=9.3Hz,C10),108.0(s,C3),107.9(d,J=23.3Hz,C5),62.8(s,OCH3),59.2(s,NCH2CH2CH2),54.3(s,C1'和C4'),51.2(d,J=4.6Hz,C2'和C3'),41.0(s,CH(cPr)),30.1(s,CH2),26.9(s,NCH2CH2CH2),23.1(s,CH2),14.3(s,CH3),9.8(s,2CH2(cPr))。IR(净):ν=3081,2954,2931,2857,2810,2771,1729,1665,1616,1580,1534,1506,1440,1372,1314,1277,1238,1206,1187,1148,1128,1114,1089,1057,1039,1001,958,936,888,851,821,807,776,732,709cm-1;HRMS(+ESI)m/z:C23H30FN3O4的[M+H]+计算值:432.2299,实测值:432.2311。
使用相应的起始材料,以与参考Quin 17化合物相同的方式制备参考Quin 18、Quin 19、和Quin 20化合物以及化合物15、17、19、20和22。
1-环丙基-6-氟-8-甲氧基-7-(4-庚基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(化合物15)的制备
根据参考Quin 17,从于无水DMF(450mL)中的1-环丙基-6-氟-8-甲氧基-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(2.370g,6.21mmol)、1-碘庚烷(4.75g,21.2mmol)以及NaHCO3(3.69g,43.9mmol)开始获得1-环丙基-6-氟-8-甲氧基-7-(4-庚基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸和1-环丙基-6-氟-8-甲氧基-7-(4-庚基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸庚酯的混合物。这一产物对于进一步反应是足够纯的。
根据参考Quin 17,从于EtOH/H2O(5/2)混合物(400mL)中的后者混合物和LiOH(580mg,24.2mmol)开始获得1-环丙基-6-氟-8-甲氧基-7-(4-庚基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(1.03g,2.17mmol,35%(经过两个步骤),黄色粉末)。
1H NMR(400MHz,CD2Cl2,δ):14.77(宽单峰,1H,CO2H),8.77(s,1H,H2),7.80(d,3JH-F=12.4Hz,1H,H5),4.04(m,1H,CH(cPr)),3.77(s,3H,OCH3),3.43(宽单峰,4H,H2'和H3'),2.58(宽单峰,4H,H1'和H4'),2.39(m,2H,NCH2CH2CH2),1.50(m,2H,NCH2CH2CH2),1.42-1.24(m,8H,CH2),1.20(q,J=6.9Hz,2H,CH2(cPr)),1.02-0.95(m,2H,CH2(cPr)),0.89(t,3JH-H=6.8Hz,3H,CH3)。13C NMR(100MHz,CD2Cl2,δ):177.1(d,J=3.1Hz,C4),166.9(s,CO2H),157.8(d,J=250.8Hz,C6),154.5(s,C2),145.4(d,J=5.8Hz,C8),139.5(d,J=11.7Hz,C7),134.1(s,C9),121.9(d,J=9.2Hz,C10),108.4(s,C3),107.9(d,J=23.3Hz,C5),62.7(s,OCH3),59.1(s,NCH2CH2CH2),53.9(s,C1'和C4'),50.5(d,J=4.6Hz,C2'和C3'),40.6(s,CH(cPr)),31.9(s,CH2),29.3(s,CH2),29.0(s,CH2),27.6(s,CH2),27.2(s,CH2),26.7(s,CH2),22.7(s,CH2),14.2(s,CH3),9.7(s,2CH2(cPr))。MP=157.2℃。元素分析:C=64.62%,H=7.52%,N=8.83%,计算值:C=65.14%,H=7.47%,N=9.12%。
1-环丙基-6-氟-8-甲氧基-7-(4-辛基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(Quin 18)的制备
根据参考Quin 17,从于无水DMF(18mL)中的1-环丙基-6-氟-8-甲氧基-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(75mg,0.20mmol)、1-碘辛烷(133mg,0.55mmol)以及NaHCO3(100mg,1.20mmol)开始获得1-环丙基-6-氟-8-甲氧基-7-(4-辛基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸和1-环丙基-6-氟-8-甲氧基-7-(4-辛基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸辛酯的混合物(80mg)。这一产物对于进一步反应是足够纯的。
根据参考Quin 17,从于EtOH/H2O(5/2)混合物(21mL)中的后者混合物(80mg)和LiOH(40mg,1.67mmol)开始获得1-环丙基-6-氟-8-甲氧基-7-(4-辛基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(30mg,32%(经过两个步骤),黄色粉末)。
1H NMR(400MHz,CD2Cl2,δ):14.77(宽单峰,1H,CO2H),8.77(s,1H,H2),7.80(d,3JH-F=12.4Hz,1H,H5),4.04(m,1H,CH(cPr)),3.77(s,3H,OCH3),3.43(宽单峰,4H,H2'和H3'),2.58(宽单峰,4H,H1'和H4'),2.39(m,2H,NCH2CH2CH2),1.50(m,2H,NCH2CH2CH2),1.42-1.24(m,10H,CH2),1.20(q,J=6.9Hz,2H,CH2(cPr)),1.02-0.95(m,2H,CH2(cPr)),0.89(t,3JH-H=6.8Hz,3H,CH3)。19F NMR(376MHz,CD2Cl2,δ):-120.1(s,F6)。13C NMR(100MHz,CD2Cl2,δ):177.5(d,J=3.1Hz,C4),166.8(s,CO2H),156.7(d,J=250.8Hz,C6),150.3(s,C2),145.9(d,J=5.8Hz,C8),140.1(d,J=11.7Hz,C7),134.6(s,C9),121.9(d,J=9.2Hz,C10),108.0(s,C3),107.9(d,J=23.3Hz,C5),62.8(s,OCH3),59.3(s,NCH2CH2CH2),54.3(s,C1'和C4'),51.2(d,J=4.6Hz,C2'和C3'),41.0(s,CH(cPr)),32.3(s,CH2),30.0(s,CH2),29.7(s,CH2),27.9(s,CH2),27.2(s,CH2),23.1(s,CH2),14.3(s,CH3),9.8(s,2CH2(cPr))。IR(净):ν=3084,2926,2853,2809,2770,1728,1617,1601,1554,1539,1505,1436,1383,1376,1312,1280,1238,1204,1187,1144,1128,1115,1091,1055,1040,1008,993,957,934,887,831,821,805,730,710cm-1;HRMS(+ESI)m/z:C26H36FN3O4的[M+H]+计算值:474.2769,实测值:474.2765。元素分析:C=66.11%,H=7.78%,N=8.82%,计算值:C=65.94%,H=7.66%,N=8.87%。
1-环丙基-6-氟-8-甲氧基-7-(4-壬基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(化合物17)的制备
根据参考Quin 17,从于无水DMF(450mL)中的1-环丙基-6-氟-8-甲氧基-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(2.04g,5.35mmol)、1-碘壬烷(4.45g,17.5mmol)以及NaHCO3(3.04g,36.2mmol)开始获得1-环丙基-6-氟-8-甲氧基-7-(4-壬基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸和1-环丙基-6-氟-8-甲氧基-7-(4-壬基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸壬酯的混合物。这一产物对于进一步反应是足够纯的。
根据参考Quin 17,从于EtOH/H2O(5/2)混合物(400mL)中的后者混合物和LiOH(580mg,24.2mmol)开始获得1-环丙基-6-氟-8-甲氧基-7-(4-壬基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(1.02g,2.03mmol,38%(经过两个步骤),黄色粉末)。
1H NMR(400MHz,CD2Cl2,δ):14.77(宽单峰,1H,CO2H),8.77(s,1H,H2),7.80(d,3JH-F=12.4Hz,1H,H5),4.04(m,1H,CH(cPr)),3.77(s,3H,OCH3),3.43(宽单峰,4H,H2'和H3'),2.58(宽单峰,4H,H1'和H4'),2.39(m,2H,NCH2CH2CH2),1.50(m,2H,NCH2CH2CH2),1.42-1.24(m,12H,CH2),1.20(q,J=6.9Hz,2H,CH2(cPr)),1.02-0.95(m,2H,CH2(cPr)),0.89(t,3JH-H=6.8Hz,3H,CH3)。13C NMR(100MHz,CD2Cl2,δ):177.1(d,J=3.1Hz,C4),166.9(s,CO2H),157.9(d,J=250.8Hz,C6),154.5(s,C2),145.3(d,J=5.8Hz,C8),139.7(d,J=11.7Hz,C7),134.0(s,C9),121.6(d,J=9.2Hz,C10),108.2(s,C3),107.9(d,J=23.3Hz,C5),62.6(s,OCH3),59.1(s,NCH2CH2CH2),54.0(s,C1'和C4'),50.8(d,J=4.6Hz,C2'和C3'),40.6(s,CH(cPr)),32.0(s,CH2),29.7(s,CH2),29.6(s,CH2),29.4(s,CH2),27.7(s,CH2),26.9(s,CH2),25.5(s,CH2),22.8(s,CH2),14.2(s,CH3),9.7(s,2CH2(cPr))。MP=144.4℃。元素分析:C=66.36%,H=7.86%,N=8.50%,计算值:C=66.51%,H=7.85%,N=8.62%。
1-环丙基-7-(4-癸基哌嗪-1-基)-6-氟-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸(Quin 19)的制备
根据参考Quin 17,从于无水DMF(20mL)中的1-环丙基-6-氟-8-甲氧基-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(80mg,0.21mmol)、1-碘癸烷(163mg,0.61mmol)以及NaHCO3(120mg,1.40mmol)开始获得1-环丙基-7-(4-癸基哌嗪-1-基)-6-氟-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸和1-环丙基-6-氟-8-甲氧基-4-氧代-7-(4-癸基哌嗪-1-基)-1,4-二氢喹啉-3-甲酸癸酯的混合物(90mg)。这一产物对于进一步反应是足够纯的。
根据参考Quin 17,从于EtOH/H2O(5/2)混合物(21mL)中的后者混合物(90mg)和LiOH(40mg,1.67mmol)开始获得1-环丙基-7-(4-癸基哌嗪-1-基)-6-氟-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸(30mg,29%(经过两个步骤),白色固体)。
1H NMR(400MHz,CD2Cl2,δ):14.78(宽单峰,1H,CO2H),8.78(s,1H,H2),7.82(d,3JH-F=12.4Hz,1H,H5),4.04(m,1H,CH(cPr)),3.76(s,3H,OCH3),3.43(宽单峰,4H,H2'和H3'),2.57(宽单峰,4H,H1'和H4'),2.39(m,2H,NCH2CH2CH2),1.51(m,2H,NCH2CH2CH2),1.37-1.24(m,14H,CH2),1.20(m,2H,CH2(cPr)),1.02-0.95(m,2H,CH2(cPr)),0.89(t,3JH-H=6.7Hz,3H,CH3)。19F NMR(376MHz,CD2Cl2,δ):-120.1(s,F6)。13C NMR(100MHz,CD2Cl2,δ):177.5(d,J=3.1Hz,C4),166.9(s,CO2H),156.7(d,J=250.9Hz,C6),150.3(s,C2),145.9(d,J=5.8Hz,C8),140.1(d,J=11.8Hz,C7),134.6(s,C9),121.9(d,J=9.1Hz,C10),108.0(s,C3),107.9(d,J=23.2Hz,C5),62.8(s,OCH3),59.3(s,NCH2CH2CH2),54.3(s,C1'和C4'),51.2(d,J=4.7Hz,C2'和C3'),41.0(s,CH(cPr)),32.3(s,CH2),30.1(s,CH2),30.0(s,2CH2),29.8(s,CH2),27.9(s,CH2),27.3(s,CH2),23.1(s,CH2),14.3(s,CH3),9.8(s,2CH2(cPr))。IR(净):ν=3071;2924,2852,2770,1729,1618,1601,1536,1506,1441,1394,1384,1313,1281,1239,1206,1188,1148,1129,1116,1091,1055,1042,1003,959,937,888,879,831,821,805,730,710cm-1;HRMS(+ESI)m/z:C28H40FN3O4的[M+H]+计算值:502.3082,实测值:502.3077。元素分析:C=67.28%,H=8.21%,N=8.31%,计算值:C=67.04%,H=8.04%,N=8.38%。
1-环丙基-6-氟-8-甲氧基-7-(4-十一烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(化合物19)的制备
根据参考Quin 17,从于无水DMF(450mL)中的1-环丙基-6-氟-8-甲氧基-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(2.13g,5.60mmol)、1-碘十一烷(4.94g,17.5mmol)以及NaHCO3(3.04g,36.2mmol)开始获得1-环丙基-6-氟-8-甲氧基-7-(4-十一烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸和1-环丙基-6-氟-8-甲氧基-7-(4-十一烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸十一烷酯的混合物。这一产物对于进一步反应是足够纯的。
根据参考Quin 17,从于EtOH/H2O(5/2)混合物(400mL)中的后者混合物和LiOH(580mg,24.2mmol)开始获得1-环丙基-6-氟-8-甲氧基-7-(4-十一烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(1.01g,1.96mmol,35%(经过两个步骤),黄色粉末)。
1H NMR(400MHz,CD2Cl2,δ):14.77(宽单峰,1H,CO2H),8.77(s,1H,H2),7.80(d,3JH-F=12.4Hz,1H,H5),4.04(m,1H,CH(cPr)),3.77(s,3H,OCH3),3.43(宽单峰,4H,H2'和H3'),2.58(宽单峰,4H,H1'和H4'),2.39(m,2H,NCH2CH2CH2),1.50(m,2H,NCH2CH2CH2),1.40-1.16(m,18H,CH2,CH2(cPr)),1.02-0.95(m,2H,CH2(cPr)),0.89(t,3JH-H=6.8Hz,3H,CH3)。13C NMR(100MHz,CD2Cl2,δ):177.2(d,J=3.1Hz,C4),166.9(s,CO2H),157.9(d,J=250.8Hz,C6),154.6(s,C2),145.3(d,J=5.8Hz,C8),139.6(d,J=11.7Hz,C7),134.1(s,C9),121.8(d,J=9.2Hz,C10),108.2(s,C3),107.9(d,J=23.3Hz,C5),62.6(s,OCH3),59.1(s,NCH2CH2CH2),54.0(s,C1'和C4'),50.8(d,J=4.6Hz,C2'和C3'),40.7(s,CH(cPr)),32.1(s,CH2),29.8(s,CH2),29.7(s,CH2),29.5(s,CH2),27.7(s,CH2),26.9(s,CH2),25.5(s,CH2),22.8(s,CH2),14.3(s,CH3),9.7(s,2CH2(cPr))。MP=136.3℃。元素分析:C=67.27%,H=8.14%,N=8.02%,计算值:C=67.55%,H=8.21%,N=8.15%。
1-环丙基-6-氟-8-甲氧基-7-(4-十二烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(化合物20)的制备
根据参考Quin 17,从于无水DMF(450mL)中的1-环丙基-6-氟-8-甲氧基-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(2.32g,6.08mmol)、1-碘十二烷(4.94g,17.5mmol)以及NaHCO3(3.04g,36.2mmol)开始获得1-环丙基-6-氟-8-甲氧基-7-(4-十二烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸和1-环丙基-6-氟-8-甲氧基-7-(4-十二烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸十二烷酯的混合物。这一产物对于进一步反应是足够纯的。
根据参考Quin 17,从于EtOH/H2O(5/2)混合物(400mL)中的后者混合物和LiOH(580mg,24.2mmol)开始获得1-环丙基-6-氟-8-甲氧基-7-(4-十二烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(1.03g,1.94mmol,32%(经过两个步骤),黄色粉末)。
1H NMR(400MHz,CD2Cl2,δ):14.77(宽单峰,1H,CO2H),8.77(s,1H,H2),7.80(d,3JH-F=12.4Hz,1H,H5),4.04(m,1H,CH(cPr)),3.77(s,3H,OCH3),3.43(宽单峰,4H,H2'和H3'),2.58(宽单峰,4H,H1'和H4'),2.39(m,2H,NCH2CH2CH2),1.50(m,2H,NCH2CH2CH2),1.40-1.16(m,20H,CH2,CH2(cPr)),1.02-0.95(m,2H,CH2(cPr)),0.89(t,3JH-H=6.8Hz,3H,CH3)。13C NMR(100MHz,CD2Cl2,δ):177.1(d,J=3.1Hz,C4),166.9(s,CO2H),157.8(d,J=250.8Hz,C6),154.5(s,C2),145.4(d,J=5.8Hz,C8),139.7(d,J=11.7Hz,C7),134.0(s,C9),121.6(d,J=9.2Hz,C10),108.2(s,C3),107.8(d,J=23.3Hz,C5),62.6(s,OCH3),59.1(s,NCH2CH2CH2),53.9(s,C1'和C4'),50.7(d,J=4.6Hz,C2'和C3'),40.6(s,CH(cPr)),32.0(s,CH2),29.7(s,CH2),29.6(s,CH2),29.4(s,CH2),27.7(s,CH2),26.8(s,CH2),22.8(s,CH2),14.2(s,CH3),9.6(s,2CH2(cPr))。MP=134.6℃。元素分析:C=67.89%,H=8.49%,N=7.82%,计算值:C=68.03%,H=8.37%,N=7.93%。
1-环丙基-6-氟-8-甲氧基-7-(4-十四烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(化合物22)的制备
根据参考Quin 17,从于无水DMF(450mL)中的1-环丙基-6-氟-8-甲氧基-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(2.18g,5.71mmol)、1-溴十四烷(4.714g,17.0mmol)以及NaHCO3(2.94g,35.0mmol)开始获得1-环丙基-6-氟-8-甲氧基-7-(4-十四烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸和1-环丙基-6-氟-8-甲氧基-7-(4-十四烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸十四烷酯的混合物。这一产物对于进一步反应是足够纯的。
根据参考Quin 17,从于EtOH/H2O(5/2)混合物(400mL)中的后者混合物和LiOH(580mg,24.2mmol)开始获得1-环丙基-6-氟-8-甲氧基-7-(4-十四烷基哌嗪-1-基)-4-氧代-1,4-二氢喹啉-3-甲酸(1.02g,1.83mmol,32%(经过两个步骤),黄色粉末)。
1H NMR(400MHz,CD2Cl2,δ):14.77(宽单峰,1H,CO2H),8.77(s,1H,H2),7.80(d,3JH-F=12.4Hz,1H,H5),4.04(m,1H,CH(cPr)),3.77(s,3H,OCH3),3.43(宽单峰,4H,H2'和H3'),2.58(宽单峰,4H,H1'和H4'),2.39(m,2H,NCH2CH2CH2),1.50(m,2H,NCH2CH2CH2),1.40-1.16(m,24H,CH2,CH2(cPr)),1.02-0.95(m,2H,CH2(cPr)),0.89(t,3JH-H=6.8Hz,3H,CH3)。13C NMR(100MHz,CD2Cl2,δ):177.1(d,J=3.1Hz,C4),166.8(s,CO2H),157.8(d,J=250.8Hz,C6),154.5(s,C2),145.5(d,J=5.8Hz,C8),139.7(d,J=11.7Hz,C7),134.0(s,C9),121.7(d,J=9.2Hz,C10),107.9(s,C3),107.8(d,J=23.3Hz,C5),62.5(s,OCH3),59.1(s,NCH2CH2CH2),54.0(s,C1'和C4'),50.7(d,J=4.6Hz,C2'和C3'),40.6(s,CH(cPr)),32.0(s,CH2),29.7(s,CH2),29.6(s,CH2),29.4(s,CH2),27.7(s,CH2),26.6(s,CH2),22.8(s,CH2),14.2(s,CH3),9.6(s,2CH2(cPr))。MP=131.1℃。元素分析:C=69.10%,H=8.85%,N=7.44%,计算值:C=68.91%,H=8.67%,N=7.53%。
1-环丙基-6-氟-7-(4-十六烷基哌嗪-1-基)-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸(Quin 20)的制备
根据参考Quin 17,从于无水DMF(18mL)中的1-环丙基-6-氟-8-甲氧基-4-氧代-7-(哌嗪-1-基)-1,4-二氢喹啉-3-甲酸(70mg,0.18mmol)、1-碘十六烷(230mg,0.65mmol)以及NaHCO3(200mg,2.40mmol)开始获得1-环丙基-6-氟-7-(4-十六烷基哌嗪-1-基)-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸十六烷酯(100mg,68%)。这一产物对于进一步反应是足够纯的。
根据参考Quin 17,从于EtOH/H2O(5/2)混合物(21mL)中的相应酯(100mg,0.123mmol)和LiOH(40mg,1.67mmol)开始获得1-环丙基-6-氟-7-(4-十六烷基哌嗪-1-基)-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸(50mg,47%(经过两个步骤),白色固体)。
1H NMR(400MHz,CD2Cl2,δ):14.79(宽单峰,1H,CO2H),8.78(s,1H,H2),7.82(d,3JH-F=12.4Hz,1H,H5),4.04(m,1H,CH(cPr)),3.76(s,3H,OCH3),3.43(宽单峰,4H,H2'和H3'),2.58(宽单峰,4H,H1'和H4'),2.39(m,2H,NCH2CH2CH2),1.50(m,2H,NCH2CH2CH2),1.40-1.16(m,28H,CH2,CH2(cPr)),1.01-0.95(m,2H,CH2(cPr)),0.88(t,3JH-H=6.8Hz,3H,CH3)。19F NMR(376MHz,CD2Cl2,δ):-120.1(s,F6)。13C NMR(100MHz,CD2Cl2,δ):177.5(d,J=3.0Hz,C4),166.9(s,CO2H),156.7(d,J=250.8Hz,C6),150.3(s,C2),145.9(d,J=5.8Hz,C8),140.1(d,J=11.7Hz,C7),134.6(s,C9),121.9(d,J=9.2Hz,C10),108.1(s,C3),108.0(d,J=23.3Hz,C5),62.8(s,OCH3),59.3(s,NCH2CH2CH2),54.3(s,C1'和C4'),51.2(d,J=4.6Hz,C2'和C3'),41.0(s,CH(cPr)),32.4(s,CH2),30.11(s,5CH2),30.07(s,3CH2),30.03(s,CH2),29.8(s,CH2),27.9(s,CH2),27.3(s,CH2),23.1(s,CH2),14.3(s,CH3),9.8(s,2CH2(cPr))。IR(净):ν=3078,3004,2917,2850,2770,1733,1620,1601,1511,1443,1393,1384,1370,1328,1312,1281,1239,1208,1187,1149,1130,1115,1090,1053,993,959,937,889,878,831,822,805,730,719cm-1;HRMS(-ESI)m/z:C34H52FN3O4的[M-H]-计算值:584.3863,实测值:584.3843。
1-环丙基-6-氟-7-(4-(2-乙基己基)哌嗪-1-基)-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸(化合物25)的制备
向于二氯甲烷中的化合物2(1当量)中添加2-乙基己醛(1.2当量)和乙酸(6当量)。分批添加NaBH(OAc)3(1.3当量)并且将混合物在室温搅拌过夜。添加水(450ml)并且将混合物在硅藻土上过滤。用二氯甲烷洗涤滤饼并且分离各相。将有机相用水洗涤,经过硫酸镁干燥,过滤并且浓缩到干燥。在硅胶上纯化(DCM/甲醇90/10,0.5%AcOH),得到呈白色固体状的1-环丙基-6-氟-7-(4-(2-乙基己基)哌嗪-1-基)-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸(35%)。
1H NMR(400MHz,CD2Cl2,δ):8.85(s,1H,H2),7.90(d,3JH-F=12.4Hz,1H,H5),4.06(m,1H,CH(cPr)),3.89(s,3H,OCH3),3.56(宽单峰,4H,H2'和H3'),2.59(宽单峰,4H,H1'和H4'),2.28(bs,2H,NCH2CH),1.49-1.21(m,11H,CH2,CH,CH2(cPr)),1.06-1.00(m,2H,CH2(cPr)),0.89(m,6H,2CH3)。13C NMR(100MHz,CD2Cl2,δ):177.4(d,J=3.1Hz,C4),167.3(s,CO2H),156.5(d,J=250.8Hz,C6),150.2(s,C2),145.6(d,J=5.8Hz,C8),140.1(d,J=11.7Hz,C7),134.4(s,C9),121.8(d,J=9.2Hz,C10),117.2(s,C3),108.4(d,J=23.3Hz,C5),63.6(s,OCH3),62.7(s,NCH2CH),54.7(s,C1'和C4'),51.2(d,J=4.6Hz,C2'和C3'),41.0(s,CH(cPr)),36.5(s,CH),31.9(s,CH2),29.4(s,CH2),25.0(s,CH2),23.6(s,CH2),14.6和11.2(s,CH3),9.8(s,2CH2(cPr))。元素分析:C=65.66%,H=7.49%,N=8.57%,计算值:C=65.94%,H=7.66%,N=8.87%。
1-环丙基-6-氟-7-(4-辛酰基哌嗪-1-基)-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸(化合物26)的制备
将1-环丙基-6-氟-7-哌嗪-1-基-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸(1当量)溶解在二氯甲烷中。在0℃,添加三乙胺(1.3当量)和酰氯(1.5当量)并且将混合物在室温搅拌1小时。添加环己烷并且过滤混合物。蒸发滤液并且将所得固体通过柱色谱(硅胶,梯度DCM/甲醇95/15)纯化,得到呈白色固体状的1-环丙基-6-氟-7-(4-辛酰基哌嗪-1-基)-8-甲氧基-4-氧代-1,4-二氢喹啉-3-甲酸(40%)。
1H NMR(400MHz,CD2Cl2,δ):8.87(s,1H,H2),7.95(d,3JH-F=12.4Hz,1H,H5),4.06(m,1H,CH(cPr)),3.77(s,3H,OCH3),3.71(宽单峰,4H,H1'和H4'),3.44(宽单峰,4H,H2'和H3'),2.42(m,2H,NCH2CH2CH2),1.68(m,2H,NCH2CH2CH2),1.42-1.23(m,12H,CH2),1.02-0.95(m,2H,CH2(cPr)),0.94(t,3JH-H=6.8Hz,3H,CH3)。13C NMR(100MHz,CD2Cl2,δ):177.4(d,J=3.1Hz,C4),172.5(s,CO),167.0(s,CO2H),156.4(d,J=250.8Hz,C6),150.5(d,J=5.8Hz,C8),146.0(d,J=11.7Hz,C7),139.4(s,C9),134.3(s,C3),122.9(d,J=9.2Hz,C10),108.7(d,J=23.3Hz,C5),63.0(s,OCH3),51.3(bs,C1',C4',C2'和C3'),40.9(s,CH(cPr)),33.9(s,CH2),32.1(s,CH2),29.9(s,CH2),29.5(s,CH2),25.8(s,CH2),23.0(s,CH2),14.5(s,CH3),10.0(s,2CH2(cPr))。元素分析:C=63.31%,H=7.10%,N=8.08%,计算值:C=64.05%,H=7.03%,N=8.62%。
2.生物学数据
2.1.对结核分枝杆菌H37Rv生长和DNA旋转酶的DNA超螺旋的体外抗微生物活性
A)关于化合物Quin 9到Quin 20
材料和方法
试剂
以下三种喹诺酮是由它们相应的制造商提供的:加替沙星(法国勒瓦卢瓦-佩雷的格兰泰公司(Grünenthal,Levallois-Perret,France));环丙沙星和莫西沙星(法国皮托的拜耳制药公司(Bayer Pharma,Puteaux,France))。
体外抗微生物活性
将结核分枝杆菌H37Rv和在DNA旋转酶中带有在对喹诺酮具有抗性的临床菌株中通常所观测到的突变(GyrA A90V和GyrA D94G)的突变菌株培养在勒-詹二氏培养基(medium)上。通过如先前所述的比例法测定MIC(Guillemin,I.;Jarlier V.;Cambau E.Antimicrob.Agents Chemother.1998,42,2084)。简单地说,将103CFU和105CFU涂铺到补充有10%油酸-白蛋白-右旋糖-过氧化氢酶并且含有系列两倍稀释化合物的7H11琼脂上。在37℃孵育21天至30天之后对菌落进行计数。MIC被定义为细菌生长被减少到无药物对照培养物的细菌生长的1%或更少时的药物浓度(Inderlied,C.B.;Nash K.A.Antibiotics in laboratory medicine(《实验室医学中的抗生素》),第4版;M.D.V.Lorian编著;马里兰州巴尔的摩的威廉姆斯&威尔金斯公司(The Williams&Wilkins Co.;Baltimore,Md.),1996;第127-175页)。
对结核分枝杆菌在巨噬细胞内的复制的干扰是通过基于表型细胞的测定来测量的,所述测定使用自动化的共聚焦荧光显微术来进行化学品的高通量筛选(Christophe T.等,High Content Screening Identifies Decaprenyl-Phosphoribose 29Epimerase as a Target for Intracellular Antimycobacterial Inhibitors(高内涵筛选将十异戊二烯基-磷酸核糖29差向异构酶鉴定为细胞内抗分枝杆菌抑制剂的靶标),PloS pahogens,2009年10月;5(10):e1000645)。
DNA超螺旋测定
如先前所述将结核分枝杆菌DNA旋转酶纯化(Aubry,A.;Pan,X.-S.;Fisher,L.M.;Jarlier,V.;Cambau,E.Antimicrob.Agents Chemother.2004,48,1281)。反应混合物(总体积30μl)含有DNA旋转酶测定缓冲液(40mM Tris-HCl[pH 7.5]、25mM KCl、6mM乙酸镁、2mM亚精胺、4mM二硫苏糖醇、牛血清白蛋白[0.36μg/mL]、10mM谷氨酸钾、1mM ATP[pH 8.0])和作为底物的松弛pBR322DNA(0.4μg)。对于结核分枝杆菌,在37℃在递增浓度的喹诺酮存在下混合旋转酶蛋白质(300ng的GyrA和250ng的GyrB),持续1小时。通过添加含有0.25%溴酚蓝的50%甘油终止反应,并且在0.5×TBE(Tris-硼酸盐-EDTA,pH 8.3)缓冲液中在1%琼脂糖凝胶中对总反应混合物进行电泳。以50V电泳5.5小时之后,用溴化乙锭(0.7μg/mL)对凝胶进行染色。通过确定将酶的超螺旋活性抑制50%所需的药物的浓度(IC50)来评估喹诺酮对DNA旋转酶的抑制作用。通过用Molecular Analyst软件(伯乐公司(Bio-Rad))跟踪对应于超螺旋的pBR322DNA的条带的亮度来评估超螺旋活性。
结果
表2:抑制结核分枝杆菌H37Rv生长(MIC)和DNA旋转酶的DNA超螺旋(IC50)的八种化合物的活性(μM)
nd=未测定
巨噬细胞内=巨噬细胞内的活性
MIC=最大抑制浓度
aclogP是使用ChemdrawUltra 12.0软件计算的
b莫西沙星呈现了R7中的不同取代以及在末端氮原子上没有烷基链
c在此所示的加替沙星和莫西沙星的生物活性是先前公开的那些(Poissy等,Antimicrob.Agents Chemother.,2010,第4765-71页)。
d在此所示的环丙沙星的生物活性是上述出版物中未公开的针对相同的菌株完成的数据(Poissy,Antimicrob.Agents Chemother.,2010,第4765-71页)。
所合成的所有氟喹诺酮均对野生型结核分枝杆菌菌株表现出抗细菌活性,特别是Quin 9、Quin 16、Quin 18、Quin 19以及Quin 20(MIC<1μM)。惊人的是,它们中没有一种抑制(或在非常高的浓度下)野生型结核分枝杆菌DNA旋转酶。此外,这些新喹诺酮中的两种(Quin 18和Quin 19)受到特别的关注。它们对野生型(H37Rv菌株)以及对喹诺酮抗性结核分枝杆菌菌株(D94V菌株和A90V菌株)表现出高抗细菌活性。
总而言之,这些结果表明了(i)与喹诺酮所表现出的作用方式不同的(或另外的)作用方式以及(ii)对包括XDR-TB菌株(即对喹诺酮具有抗性的菌株)在内的结核分枝杆菌菌株的抗细菌活性。
B)关于化合物15至20、Quin 18以及Quin 19
材料和方法
试剂
用作阳性对照的莫西沙星(MOX)是由它的相应制造商(法国皮托的拜耳制药公司)提供的。
体外抗微生物活性
将结核分枝杆菌H37Rv野生型菌株和在DNA旋转酶中带有在对喹诺酮具有抗性的临床菌株中通常所观测到的突变(GyrA A90V、GyrA D94G以及GyrB D500N)的突变菌株、以及多药抗性结核分枝杆菌临床菌株(MDR;被定义为对关键的抗结核药物异烟肼(isoniazid)和利福平(rifampin)具有抗性;这3种菌株中的2种还对氨基糖苷具有抗性并且因此被分类为前XDR菌株(极端药物抗性);GV1503014223、KC1503006247、XCC1503082245)培养在勒-詹二氏培养基上。通过如先前所述的比例法测定MIC(Guillemin,I.;Jarlier V.;Cambau E.Antimicrob.Agents Chemother.1998,42,2084)。简单地说,将103CFU和105CFU涂铺到补充有10%油酸-白蛋白-右旋糖-过氧化氢酶并且含有系列两倍稀释化合物的7H11琼脂上。在37℃孵育3天至30天之后(取决于分枝杆菌菌种)对菌落进行计数。MIC被定义为细菌生长被减少到无药物对照培养物的细菌生长的1%或更少时的药物浓度(Inderlied,C.B.;Nash K.A.Antibiotics in laboratory medicine(《实验室医学中的抗生素》),第4版;M.D.V.Lorian编著;马里兰州巴尔的摩的威廉姆斯&威尔金斯公司,1996;第127-175页)。
结果
结果呈现于表3中。
表3
MIC=最大抑制浓度
所合成的所有新化合物均对野生型结核分枝杆菌菌株显示出抗细菌活性。特别是Quin18、Quin19、化合物17、19以及20具有低于莫西沙星MIC(1.2μM)的MIC。有趣的是,它们还对喹诺酮抗性结核分枝杆菌菌株(GyrB D500N菌株、GyrA D94G菌株以及GyrA A90V菌株)表现出高抗细菌活性。应当注意到的是,对于Quin18、Quin19、化合物17、19以及20,在FQ抗性菌株中MIC是相似的或增加,这取决于突变,但是Quin18、Quin19、化合物17以及化合物20的MIC仍≤2μM,即类似于莫西沙星对抗野生型菌株的MIC。非常有趣的是,在MDR菌株与野生型结核分枝杆菌H37Rv菌株之间,最强效的化合物的MIC是相似的。
2.2.在鼠类TB模型中确定Quin18和Quin19的最低有效剂量(MED)
材料和方法
用106CFU的结核分枝杆菌H37Rv菌株静脉内感染四周大的Balb/C/J雌性小鼠。在感染后的那天(D1),将10只小鼠处死以确定脾脏重量和肺中CFU计数的确切基线值。将其余小鼠分配到以下处理组中:用于存活率监测的未处理阴性对照组、用异烟肼(INH)25mg/kg/d处理1个月的阳性对照组,用通过经口灌胃给予的递增剂量(25mg/kg/d;50mg/kg/d;100mg/kg/d;150mg/kg/d)的Quin18和Quin19处理的十个测试组,并且用Quin18(25mg/kg/d和100mg/kg/d)静脉内处理的两个另外的测试组。所有组均含有10只小鼠并且从D1到D28、每周5天来处理。用于评估感染的严重程度和处理的有效性的参数是存活率、脾脏重量、肉眼肺病变以及肺中的CFU计数。
最低有效剂量被定义为能够预防小鼠死亡、脾脏肿大以及肉眼肺病变发生的最低剂量。CFU计数被认为是确定Quin18和Quin19的剂量范围功效的更精确的方法。
将组之间的存活率绘制在卡普兰-迈耶曲线(Kaplan-Meier curve)上,并且使用对数秩检验进行比较。
结果
结果呈现于表4、图1以及图2中。
无论剂量(25mg/kg/d、50mg/kg/d、100mg/kg/d以及150mg/kg/d)和施用途径(通过灌胃(图1)或对于Quin18通过静脉内(图2))如何,感染了野生型结核分枝杆菌菌株H37Rv并且接受Quin18和Quin19任一者处理的小鼠中的存活率在统计学上优于未处理组并且类似于通过参考药物,即异烟肼25mg/kg/d处理的组(曲线可以叠加)。
未处理组中的小鼠体重低于测试组中的小鼠体重,其中小鼠体重在通过新化合物处理的组或通过异烟肼处理的组之间是相似的。脾脏重量是感染的一个间接信号,未处理组中的脾脏重量高于由通过灌胃给予的两种化合物处理的组和通过异烟肼处理的组中的脾脏重量,而通过Quin18静脉内处理的组具有与未处理组相似的脾脏重量。
按剂量随时间推移的存活率示于图1和图2中。存活率在测试组之间没有差异,其中存活率显著不同于未处理组的存活率并且与通过异烟肼处理的阳性对照组的存活率相当,甚至是在相同的剂量,即25mg/kg/j。
被认为是确定Quin18和Quin19的剂量范围功效的更精确的方法的CFU计数正在待定。
结论
这些结果证实经口给予的Quin18和Quin19在小鼠结核病模型中具有显著的功效。用于结核病,特别是MDR TB和XDR TB的口服药物是一个公认的临床需求并且Quin18和Quin19在这方面具有巨大的前景。
2.3.在单次处理后在健康雌性CD-1小鼠中Quin 18和Quin 19的急性毒性的评价
这个研究的目的在于评价在D0单次口服处理之后在健康雌性CD-1中两种新化合物(Quin 18和Quin 19)的急性毒性。
在用于向小鼠经口注射的适当的媒介物中对Quin 18和Quin 19这两者进行溶解度测定以获得每一种化合物的最大浓度(MC)的细悬浮液。通过观测潜在的沉淀物来评价每一种化合物在每一种媒介物中的溶解度。在这一研究期间测定了九种常见的赋形剂(乙醇5%、甘油15%、聚乙二醇300 50%、聚乙二醇400 9%、聚山梨醇酯80 0.4%、丙二醇68%、2-羟基丙基-环糊精20%、甲基纤维素0.5%以及玉米油)。
以下结果针对聚山梨醇酯80 0.4%和玉米油,这些赋形剂分别允许Quin 18和Quin 19的最佳溶解。
第一剂量(MC)是获得测试物质在用于动物的适合溶剂中的细悬浮液的最大浓度。根据用最高剂量的每一种分子获得的结果,可以降低或增加每一种化合物的浓度。
通过监测动物(药理作用和毒性作用的一般体征、发病率、死亡率和明显的毒性体征,以及每周两次监测临床体征和体重)直到实验结束(D14)为止来评价处理的毒性。在实验结束时,将动物处死并且进行宏观尸检。
材料和方法
测试物质
将两种测试物质Quin 18(MW:472.13.6克/摩尔,纯度>99%)和Quin19(MW:501.70克/摩尔,纯度>99%)提供给C.RIS Pharma公司并且储存在室温下。
动物购买和笼养
三十六(36)只7周大的雌性CD-1小鼠(RjOrl:SWISS)是从让维耶公司(Janvier)(法国的勒热内斯圣伊斯尔(Le Genest-Saint-Isle,France))获得的。在开始研究之前将动物在我们的常规动物监护仓中维持至少5天,所述动物监护仓是由法国农业和研究部(French Ministries of Agriculture and Research)授权的(协议号B 35 288-1)。将根据动物实验的伦理准则进行动物实验。
环境
将动物在温度(22℃±3℃)、湿度(50%±20%)、光周期(12小时亮/12小时暗)以及空气交换的受控条件下维持在室内。空气处理系统被编程为每小时14次空气更换而没有再循环。新鲜的外部空气通过过滤器,然后均匀地扩散到每一个室内。根据标准操作程序号GEN-006,在常规条件下工作的所有人员在他们进入动物管理区域时遵循关于卫生和着装的具体准则。
动物管理和笼养
将动物饲养在经过装备以提供食物和水的模克隆笼(makrolon cage)(参考号:03120133,法国的Genestil公司)中。所用的标准尺寸笼是820cm2,根据标准操作程序号TEC-106,每笼最多有10只小鼠。动物的垫料是刨花(参考号:Toplit select fine,法国奥吉的SAFE公司(SAFE,Augy,France)),每周更换一次。
为了增加动物福利,将生活环境的一些富集材料包括在笼中:杨树木条(参考号:TOP WOODWOOL,法国的Safe公司)。
饮食
动物饲料购自法国SAFE公司。受控颗粒的类型是A04。食物是不限量提供的,被放置在笼顶部上的金属盖中。水也是由装备有橡胶塞和吸管的水瓶不限量提供的。水瓶每周被清洁和更换一次。
动物和笼标识
根据标准操作程序号TEC-167,将小鼠用一个ISO应答器8mm(法国的Genestil公司)标识。通过GES阅读器2S(西班牙的Rumitag公司)检测应答器。在应答器在任何时间失灵的情况下,将新的应答器注射到小鼠体内。将每一个笼用对应于研究编号和组编号的特定代码标记。
小鼠的随机化
在适应期之后,根据标准操作程序号TEC-086,将小鼠称重并且根据体重标准随机化到12个组(3只小鼠/组)中。各组的平均体重将没有统计学差异。
测试物质和媒介物的制备
媒介物A(VA)是聚山梨醇酯80 0.4%溶液。它是通过称取聚山梨醇酯80并且在NaCl 0.9%中稀释来制备的。
媒介物B(VB)是即用型玉米油。
通过在使用或不使用超声处理的情况下将适当含量的Quin18溶解在聚山梨醇酯80 0.4%中来制备10mg/ml或20mg/ml浓度的Quin 18。使用纯的Quin 18或在聚山梨醇酯80 0.4%中稀释以获得工作浓度。Quin 18在处理时间期间保持在室温,并且在室温注射。
通过在使用或不使用超声处理的情况下将适当含量的Quin 19溶解在玉米油中来制备10mg/ml或20mg/ml浓度的Quin 19。使用纯的Quin 19或在玉米油中稀释以获得工作浓度。Quin 19在处理时间期间保持在室温,并且在室温注射。
处理和实验设计
根据标准操作程序号TEC-078,通过以10ml/kg经口(PO)注射来对每一组的小鼠进行施用。向小鼠经口(PO)施用的推荐体积是10ml/kg。
实验组如下文所述并且如表5中所限定:
测试物质(Quin18):
根据处理方案Q1D×1,用聚山梨醇酯800.4%(媒介物A)以10ml/kg处理组VA1。
根据处理方案Q1D×1用10mg/ml的Quin18(使用超声处理)以100mg/kg处理组A1。
根据处理方案Q1D×1,用20mg/ml的Quin18(使用超声处理)以200mg/kg处理组A2。
根据处理方案Q1D×1,用10mg/ml的Quin18(不使用超声处理)以100mg/kg处理组A3。
根据处理方案2Q1D×1(在2次注射之间相隔2小时),用聚山梨醇酯800.4%(媒介物A)以10ml/kg处理组VA4。
根据处理方案2Q1D×1(在2次注射之间相隔2小时),用10mg/ml的Quin18(不使用超声处理)以200mg/kg处理组A4。
测试物质(Quin19):
根据处理方案Q1D×1,用玉米油(媒介物B)以10ml/kg处理组VB1。
根据处理方案Q1D×1,用10mg/ml的测试物质(使用超声处理)以100mg/kg处理组B1。
根据处理方案Q1D×1,用20mg/ml的测试物质(使用超声处理)以200mg/kg处理组B2。
根据处理方案Q1D×1,用20mg/ml的测试物质(不使用超声处理)以200mg/kg处理组B3。
根据处理方案2Q1D×1(在2次注射之间相隔2小时),用玉米油(媒介物B)以10ml/kg处理组VB4。
根据处理方案2Q1D×1(在2次注射之间相隔2小时),用20mg/ml的测试物质(不使用超声处理)以400mg/kg处理组B4。
在D0,通过经口(PO)施用来处理小鼠。
监测小鼠
从D0开始每天考虑小鼠的发病率、死亡率以及明显毒性体征直到实验结束(D14或D15)为止。
根据标准操作程序号TEC-192,从D0开始每周两次对小鼠进行监测以进行详细的行为和临床观测直到实验结束(D14或D15)为止。
根据标准操作程序号TEC-108,在D1、D2,然后每周两次监测小鼠的体重直到实验结束(D14或D15)为止。相对于每一只小鼠在D0时的初始体重评估体重减轻。
在实验的过程中,如果以下中的任一种发生的话,那么将动物处死:
·痛苦的体征(恶病质、虚弱、难以移动或进食),
·化合物毒性(拱背、抽搐),
·在任何一天体重减轻25%。
动物的处死
在D14或D15,通过吸入CO2将动物处死并且进行宏观尸检。
结果
体重的研究
平均体重(MBW)曲线的结果呈现于图3中。
接受媒介物A,即聚山梨醇酯80 0.4%(10ml/kg,PO,Q1D×1)处理的组VA1的小鼠没有表现出任何体重减轻。从D0到D14的MBW分别是31.6g±1.23g和32.13g±1.79g。测试物质媒介物A,即聚山梨醇酯80 0.4%(10ml/kg,PO,Q1D×1)被良好耐受。
接受Quin 18/聚山梨醇酯80 0.4%(10mg/ml,使用超声处理,10ml/kg,100mg/kg,PO,Q1D×1)处理的组A1的小鼠没有表现出任何体重减轻。从D0到D14的MBW分别是31.5g±1.48g和31.77g±0.76g。测试物质Quin 18/聚山梨醇酯80 0.4%(10mg/ml,使用超声处理,10ml/kg,100mg/kg,PO,Q1D×1)被良好耐受。
接受Quin 18/聚山梨醇酯80 0.4%(20mg/ml,使用超声处理,10ml/kg,200mg/kg,PO,Q1D×1)处理的组A2的小鼠没有表现出任何体重减轻。从D0到D14的MBW分别是30.2g±1.15g和32.6g±1.35g。测试物质Quin 18/聚山梨醇酯80 0.4%(20mg/ml,使用超声处理,10ml/kg,200mg/kg,PO,Q1D×1)被良好耐受。
接受Quin 18/聚山梨醇酯80 0.4%(10mg/ml,使用超声处理,10ml/kg,100mg/kg,PO,Q1D×1)处理的组A3的小鼠没有表现出任何体重减轻。从D0到D15的MBW分别是29.9g±1.25g和32.17g±1.94g。测试物质Quin 18/聚山梨醇酯80 0.4%(10mg/ml,使用超声处理,10ml/kg,100mg/kg,PO,Q1D×1)被良好耐受。
接受媒介物A,即聚山梨醇酯80 0.4%(10ml/kg,PO,2Q1D×1,在2次注射之间相隔2小时)处理的组VA4的小鼠没有表现出任何体重减轻。从D0到D14的MBW分别是29.83g±1.56g和32.17g±2.91g。测试物质媒介物A,即聚山梨醇酯80 0.4%(10ml/kg,PO,2Q1D×1,在2次注射之间相隔2小时)被良好耐受。
接受Quin 18/聚山梨醇酯80 0.4%(20mg/ml,使用超声处理,10ml/kg,200mg/kg,PO,Q1D×1)处理的组A4的小鼠没有表现出任何体重减轻。从D0到D14的MBW分别是29.5g±0.89g和31.33g±1.63g。测试物质Quin 18/聚山梨醇酯80 0.4%(20mg/ml,使用超声处理,10ml/kg,200mg/kg,PO,Q1D×1)被良好耐受。
接受媒介物B,即玉米油(10ml/kg,PO,Q1D×1)处理的组VB1的小鼠没有表现出任何体重减轻。从D0到D14的MBW分别是30.57g±1.32g和31.5g±1.64g。测试物质媒介物B,即玉米油(10ml/kg,PO,Q1D×1)被良好耐受。
接受Quin 19/玉米油(10mg/ml,使用超声处理,10ml/kg,100mg/kg,PO,Q1D×1)处理的组B1的小鼠没有表现出任何体重减轻。从D0到D14的MBW分别是31.67g±2.25g和31.4g±0.44g。测试物质Quin 19/玉米油(10mg/ml,使用超声处理,10ml/kg,100mg/kg,PO,Q1D×1)被良好耐受。
接受Quin 19/玉米油(20mg/ml,使用超声处理,10ml/kg,200mg/kg,PO,Q1D×1)处理的组B2的小鼠没有表现出任何体重减轻。从D0到D14的MBW分别是30.67g±0.21g和31.9g±1.15g。测试物质Quin 190/玉米油(20mg/ml,使用超声处理,10ml/kg,200mg/kg,PO,Q1D×1)被良好耐受。
接受Quin 19/玉米油(20mg/ml,不使用超声处理,10ml/kg,200mg/kg,PO,Q1D×1)处理的组B3的小鼠没有表现出任何体重减轻。从D0到D15的MBW分别是33.6g±2.11g和35.43g±1.99g。测试物质Quin19/玉米油(20mg/ml,不使用超声处理,10ml/kg,200mg/kg,PO,Q1D×1)被良好耐受。
接受媒介物B,即玉米油(10ml/kg,PO,2Q1D×1,在2次注射之间相隔2小时)处理的组VB4的小鼠没有表现出任何体重减轻。从D0到D14的MBW分别是31.23g±1.23g和32g±0.7g。测试物质媒介物B,即玉米油(10ml/kg,PO,2Q1D×1,在2次注射之间相隔2小时)被良好耐受。
接受Quin 19/玉米油(20mg/ml,不使用超声处理,10ml/kg,PO,2Q1D×1,在2次注射之间相隔2小时,400mg/kg)处理的组B4的小鼠没有表现出任何体重减轻。从D0到D14的MBW分别是31.03g±1.86g和32.53g±1g。测试物质Quin 19/玉米油(20mg/ml,不使用超声处理,10ml/kg,PO,2Q1D×1,在2次注射之间相隔2小时,400mg/kg)被良好耐受。
监测小鼠
每周两次对小鼠进行监测(观测活动性、死亡率以及明显毒性体征)并且汇总于表6中。没有观测到特定体征。
尸检
表7汇总了每一只小鼠的死亡原因和宏观观测。在接受Quin 18或Quin 19和/或媒介物处理的小鼠中没有观测到特定体征。
表7
*对于组VA4,2只小鼠在结肠中有空气泡,对于组VB1和B1,每一组
中的一只小鼠在盲肠中有空气泡。
结论
测试物质Quin18/聚山梨醇酯80 0.4%被良好耐受最高达200mg/kg(最大溶解度;在雌性小鼠中没有发现关于体重临床体征和宏观分析的观测结果)。
测试物质Quin19/玉米油被良好耐受最高达400mg/kg(最大溶解度;在雌性小鼠中没有发现关于体重临床体征和宏观分析的观测结果)。
因此,这些结果表明Quin18和Quin19在小鼠中被极好耐受,而在所测试的剂量水平没有毒性体征。
- 还没有人留言评论。精彩留言会获得点赞!