制备小脑祖先组织的方法与流程
[技术领域]
本发明涉及用于在体外诱导人多能干细胞分化成小脑祖先组织的技术。
[
背景技术:
]
小脑是运动系统的主要组成部分,是高度有序的脑结构,具有一些已确定的细胞类型。在包括人的羊膜动物中,小脑的早期发育是保守的。小脑发育的初始阶段是形成峡部形成体(isthmicorganizer),其位于中脑-后脑边界(midbrain-hindbrainboundary,mhb)。在其诱导影响下,在菱脑原节1(r1)的背侧区(翼板)中形成小脑原基(cerebellaranlage)(非专利文件1-3)。小脑细胞在r1中的两个不同的胚区(germinalzone)生成。一个是小脑板的脑室区(ventricularzone,vz),其表达碱性螺旋-环-螺旋(bhlh)转录因子ptf1a。ptf1a+祖先细胞产生小脑皮质(浦肯野细胞(purkinjecell)和中间神经元)和深部小脑核(dcn)的γ-氨基丁酸能神经元(gabaergicneuron)。另一个区是菱唇(rhombiclip,rl),其表达另一种bhlh因子,即atoh1(也称为math1)。atoh1+祖先细胞产生小脑谷氨酸能神经元,包括颗粒细胞(gc)、单极刷细胞(unipolarbrushcell)和大dcn投射神经元(非专利文件4-9)。在这十年来在对小脑细胞分化的控制的理解方面已经取得了很多进展。这些知识已经促进了在体外由多能干细胞产生小脑神经元组成部分的技术进展(非专利文件10-13)。然而,所产生的细胞成分怎样组装形成错综复杂的小脑构造在很大程度上仍然保持是难以理解的。
本发明人之前报道通过重建三维(3d)培养过程中的自诱导信号传导微环境可以从小鼠胚胎干细胞(mesc)有效地生成小脑神经元(非专利文件11)。mesc具有响应fgf2和胰岛素在聚集体内形成一些峡部形成体组织的潜力。在那些条件下,当用抑制剂抑制内源性shh信号传导时,mesc-衍生的神经祖先细胞分化成表达浦肯野细胞祖先细胞标记kirrel2(也称为neph3)的小脑板ne。另一方面,向培养物中加入bmp信号促进向atoh1+gc和tbr1+dcn神经元的分化,而其抑制浦肯野细胞在mesc聚集体中的产生。尽管在mesc中能够成功地诱导小脑神经元分化,但是目前尚未再现小脑原基的3d形成。
已经报道,fgf19,即小鼠fgf15(在mhb中表达)的人直向同源物,参与后脑背侧祖先细胞的发育(非专利文件14和15)。
sdf1(也称为cxcl12),即分泌的针对趋化因子受体4(cxcr4)的配体,在脑膜细胞中表达并在表达cxcr4的外部颗粒(egl)细胞的迁移中起关键作用(非专利文件16-19)。sdf1-或cxcr4-缺陷型小鼠异常发育,具有不规则的外部颗粒层(egl)和异位存在的浦肯野细胞。
本发明人已经发现rho相关卷曲螺旋激酶(rho-associatedcoiled-coilkinase,rock)的抑制剂阻抑通过分散诱导的多能干细胞(特别是,人多能干细胞)的细胞死亡(专利文件1和2)。
[文件列表]
[专利文件]
专利文件1:jp-a-2008-99662
专利文件2:wo2008/035110
[非专利文件]
非专利文件1:wingate,r.j.t,和hatten,m.e.(1999).theroleoftherhombiclipinaviancerebellumdevelopment(菱唇在鸟类小脑发育中的作用).development126,4395-4404.
非专利文件2:joyner,a.l.,liu,a.,和millet,s.(2000).otx2,gbx2andfgf8interacttopositionandmaintainamid-hindbrainorganizer(otx2,gbx2和fgf8相互作用以安置并保持中-后脑组织体).curr.opin.cellbiolo.12,736-741.
非专利文件3:zervas,m.,milet,s.,ahn,s.,和joyner,a.l.(2004).cellbehaviorandgeneticlineageofthemesencephalonandrhombomere1(中脑和菱脑原节1的细胞行为和遗传谱系).neuron43,345-357.
非专利文件4:ben-arie,n.,bellen,h.j.,armstrong,d.l.mccall,a.e.,gordadze,p.r.,guo,q.,matzuk,m.m.,和zoghbi,h.(1997).math1isessentialforgenesisofcerebellargranuleneurons(math1是小脑颗粒神经元发生所必需的).nature390,169-172.
非专利文件5:hoshino,m.,nakamura,s.,mori,k.,kawauchi,t.,terao,m.,nishimura,y.v.,fukuda,a.,fuse,t.,matsuo,n.,sone,m.,watanabe,m.,bito,h.,terashima,t.,wright,c.v.e.,kawaguchi,y.,nakano,k.,和nabeshima,y.(2005).ptf1a,abhlhtranscriptionalgene,definesgabaergicneuronalfatesincerebellum(ptf1a,即一种bhlh转录基因,限定小脑中的γ-氨基丁酸能(gabaergic)神经元命运).neuron47,201-213.
非专利文件6:machold,r.,和fishell,g.(2005).math1isexpressedintemporallydiscretepoolsofcerebellarrhombic-lipneuralprogenitors(math1在小脑-菱唇神经祖先的临时离散性集合中表达).neuron48,17-24.
非专利文件7:wang,v.y.,rose,m.f.,和zoghbi,h.y.(2005).math1expressionredefinestherhombiclipderivativesandrevealsnovellineageswithinthebrainstemandcerebellum(math1表达重新限定菱唇衍生物并且揭示脑干和小脑内的新谱系).neuron48,31-43.
非专利文件8:fink,a.j.,englund,c.,daza,r.a.m.,pham,d.,lau,c.,nivison,m.,kowalczyk,t.,和hevner,r.f.(2006).developmentofthedeepcerebellarnuclei:transcriptionfactorsandcellmigrationfromtherhombiclip(深部小脑核的发育:来自菱唇的转录因子和细胞迁移).j.neurosci.26,3066-3076.
非专利文件9:carletti,b.,和rossi,f.(2008).neurogenesisinthecerebellum(小脑中的神经发生).neuroscientist14,91-100.
非专利文件10:su,h.-l.,muguruma,k.,matsuo-takasaki,m.,kengaku,m.,watanabe,k.,和sasai,y.(2006).generationofcerebellarneuronprecursorsfromembryonicstemcells(从胚胎干细胞产生小脑神经元前体).dev.biol.290,287-296.
非专利文件11:muguruma,k.,nishiyama,a.,ono,y.,miyawaki,h.,mizuhara,e.,hori,s.,kakizuka,a.,obata,k.,yanagawa,y.,hirano,t.,和sasai,y.(2010).ontogeny-recapitulatinggenerationandtissueintegrationofescell-derivedpurkinjecells(es细胞-衍生的浦肯野细胞的个体发育-重现性产生和组织整合).natureneurosci.13,1171-1180.
非专利文件12:tao,o.,shimazaki,t.,okada,y.,naka,h.,kohda,k.,yuzaki,m.,mizusawa,h.,和okano,h.(2010).efficientgenerationofmaturecerebellarpurkinjecellsfrommouseembryonicstemcells(从小鼠胚胎干细胞有效产生成熟的小脑浦肯野细胞).j.neurosci.res.88,234-247.
非专利文件13:erceg,s.,ronaghi,m.,zipancic,i.,lainez,s.,rosello,m.g.,xiong,c.,moreno-manzano,v.,rodriguez-jimenez,f.j.,planells,r.,alvarez-dolado,m.,bhattacharya,s.s.,和stojkovic,m.(2010).efficientdifferentiationofhumanembryonicstemcellsintofunctionalcerebellar-likecells(人胚胎干细胞向功能性小脑样细胞的有效分化).stemcellsdev.,19,1745-1756.
非专利文件14:gimeno,l.,和martinez,s.(2007)expressionofchickfgf19andmousefgf15orthologsisregulatedinthedevelopingbrainbyfgf8andshh(在发育的脑中,fgf8和shh调节鸡fgf19和小鼠fgf15直向同源物的表达).dev.dyn.236,2285-2297.
非专利文件15:fischer,t.,faus-kessler,t.,welzl,g.,simeone,a.,wurst,w.,和prakash,n.(2011)fgf15-mediatedcontrolofneurogenicandproneuralgeneexpressionregulatesdorsalmidbrainneurogenesis(fgf15-介导的神经发生和颈板基因表达的控制调节背侧中脑神经发生).dev.biol.350,496-510.
非专利文件16:ma,q.,jones,d.,borghesani,p.r.,segal,r.a.,nagasawa,t.,kishimoto,t.,bronson,r.t.,和springer,t.a.(1998).impairedb-lymphopoiesis,myelopoiesis,andderailedcerebellarneuronmigrationincxcr4-andsdf-1-deficientmice(在cxcr4-和sdf-1-缺陷型小鼠中损害的b-淋巴细胞生成、髓细胞生成和偏离正常进程的(derailed)小脑神经元迁移).proc.natl.acad.sci.usa95,9448-9453.
非专利文件17:reiss,k.,mentlein,r.,sievers,j.,和hartmann,d.(2002).stromalcell-derivedfactor1issecretedbymeningealcellsandactaschemotacticfactoronneuronalstemcellsofthecerebellarexternalgranularlayer(基质细胞-衍生的因子1由脑膜细胞分泌,并且以趋化性因子作用在小脑外部颗粒层的神经元干细胞上).neurosci.115,295-305.
非专利文件18:zou,y.-r.,kottmann,a.h.kuroda,m.,taniuchi,i.,和littman,d.r.(1998).functionofthechemokinereceptorcxcr4inhaematopoiesisandincerebellardevelopment(趋化因子受体cxcr4在血细胞生成和在小脑发育中的功能).nature393,595-599.
非专利文件19:zhu,y.,yu,t.,zhang,x.-c.,nagasawa,t.,wu,j.y.,和rao,y.(2002).roleofthechemokinesdf-1asthemeningealattractantforembryoniccerebellarneurons(趋化因子sdf-1作为胚胎小脑神经元的脑膜引诱剂的作用).natureneurosci.5,719-720.
[发明概述]
[发明解决的问题]
如上文提及的,已经报道小鼠多能干细胞在含有fgf2和胰岛素的培养基中进行聚集体悬浮培养时能够分化成小脑祖先细胞(非专利文件11)。然而,发现当将用于小鼠多能干细胞的培养条件直接应用于人多能干细胞时,不支持人多能干细胞的小脑分化,没有观察到小脑分化,并且由于聚集体的瓦解和其他原因,神经培养本身不能继续。另外,极大地促进小鼠多能干细胞向小脑祖先组织的分化诱导的hedgehog抑制剂(环杷明(cyclopamine))没有显著地促进由人多能干细胞形成小脑板。这提示由人多能干细胞的小脑祖先组织的分化条件极大地不同于小鼠的那些,原因在于,例如,向人多能干细胞培养系统中添加sonichedgehog相反地促进极化的小脑板的形成。
因此,本发明目的在于提供用于在体外由人多能干细胞诱导小脑组织或其祖先组织的技术。
[解决问题的方式]
本发明人对人esc培养应用自形成原则,以在体外产生人小脑组织。使用改良的培养条件,包括添加rock抑制剂(y-27632)或tgf-β抑制剂(sb431542)并且不添加hedgehog抑制剂等,在体外它们能够首次从人多能干细胞分化为小脑祖先组织。并且,在优化3d培养条件的过程中,本发明人鉴定了两种因子,即fgf19和sdf1,它们以不同的方式促进有序的小脑板样组织的自形成。在聚集体培养中加入fgf19促进由人多能干细胞的小脑板形成并且增强在所述聚集体中的中脑-后脑边界神经组织中的背腹(dv)极性。在用于小脑组织的自形成的hesc培养中额外的sdf1处理诱导产生如在早期小脑板中观察到的分层的连续的小脑板ne。此外,神经外胚层(ne)边缘形成由atoh1+/barh1+细胞组成的独特的rl-样胚区。另外,在小脑祖先组织(小脑板组织)的自组织过程中加入gdf7促进在小脑板组织中的菱唇形成。
基于上文提及的发现,本发明人已经进行了进一步的研究并且完成了本发明。
因此,本发明如下所述:
[1]用于制备包含小脑祖先组织的人细胞聚集体的方法,其包括使人多能干细胞聚集体在包含胰岛素的无血清培养基中进行悬浮培养,并且在所述悬浮培养中,用rock抑制剂、tgfβ信号抑制剂和第一成纤维细胞生长因子处理所述人多能干细胞聚集体或源自其的人细胞聚集体。
[2][1]的制备方法,其中所述小脑祖先组织是中脑-后脑边界神经祖先组织。
[3][1]或[2]的制备方法,其中在所述悬浮培养中,不用bmp4处理所述人多能干细胞聚集体或源自其的人细胞聚集体。
[4][1]-[3]中任一项的制备方法,其中在所述悬浮培养中,不用sonichedgehog抑制剂处理所述人多能干细胞聚集体或源自其的人细胞聚集体。
[5][1]-[4]中任一项的制备方法,其中所述第一成纤维细胞生长因子是fgf2或fgf8。
[6][1]的制备方法,其包括:
(i)将人多能干细胞聚集体在包含胰岛素的无血清培养基中进行悬浮培养,并且,在所述悬浮培养中,用rock抑制剂、tgfβ信号抑制剂和第一成纤维细胞生长因子处理所述人多能干细胞聚集体或源自其的人细胞聚集体,从而得到包含中脑-后脑边界神经祖先组织的人细胞聚集体,并且
(ii)将得到的包含中脑-后脑边界神经祖先组织的人细胞聚集体在无血清培养基中进行进一步的悬浮培养,从而诱导所述神经祖先组织中的神经祖先细胞形成神经上皮结构,由此得到包含小脑板组织的人细胞聚集体。
[7][6]的制备方法,其包括在步骤(i)的悬浮培养中,用第二成纤维细胞生长因子进一步处理所述人多能干细胞聚集体或源自其的人细胞聚集体。
[8][7]的制备方法,其中所述第二成纤维细胞生长因子是fgf19、fgf17或fgf8。
[9][6]-[8]中任一项的制备方法,其包括在步骤(ii)的悬浮培养中,用sdf1处理所述包含中脑-后脑边界神经祖先细胞的人细胞聚集体或源自其的人细胞聚集体。
[10][6]的制备方法,其包括在步骤(ii)的悬浮培养中,用gdf7处理所述包含中脑-后脑边界神经祖先细胞的人细胞聚集体或源自其的人细胞聚集体。
[11][7]或[8]的制备方法,其中所述小脑板组织是包含γ-氨基丁酸能神经祖先细胞和小脑颗粒细胞祖先细胞的神经上皮结构。
[12][11]的制备方法,其中所述神经上皮结构具有背-腹极性。
[13][9]的制备方法,其中所述小脑板组织包含在所述细胞聚集体表层区域上的连续的小脑神经上皮结构和菱唇样组织。
[14][13]的制备方法,其中所述小脑板组织具有三层结构,所述三层结构包括自顶端面按顺序成层的脑室区、浦肯野细胞区和源自菱唇的细胞区。
[15]通过[1]-[14]中任一项的制备方法得到的人细胞聚集体。
[16]用于制备人浦肯野细胞、人高尔基细胞或人中间神经元的方法,其包括:
(i)通过[6]-[14]中任一项的制备方法由人多能干细胞得到包含小脑板组织的人细胞聚集体,
(ii)由所得到的人细胞聚集体得到γ-氨基丁酸能神经祖先细胞,并且
(iii)将所述γ-氨基丁酸能神经祖先细胞与哺乳动物小脑颗粒细胞祖先细胞共同培养,从而诱导所述γ-氨基丁酸能神经祖先细胞向浦肯野细胞、高尔基细胞或中间神经元的分化。
[17]用于制备人小脑颗粒细胞的方法,其包括:
(i)通过[6]-[14]中任一项的制备方法由人多能干细胞得到包含小脑板组织的人细胞聚集体,
(ii)由所得到的人细胞聚集体得到小脑颗粒细胞祖先细胞,并且
(iii)将所述小脑颗粒细胞祖先细胞与哺乳动物小脑细胞共同培养,从而诱导向小脑颗粒细胞的分化。
[发明效果]
按照本发明,在体外可以由人多能干细胞有效地诱导小脑祖先组织。这是首次在体外能够由人多能干细胞形成中脑-后脑边界祖先组织。在该中脑-后脑边界祖先组织中可以重现在体内观察到的背-腹极性。按照本发明,可以在人多能干细胞-衍生的细胞的聚集体中自组织具有连续的表皮结构的小脑祖先组织(小脑板组织)。在该人小脑板组织中,可以邻近地自形成小脑神经上皮(小脑浦肯野细胞和中间神经元的祖先组织)和菱唇(小脑颗粒细胞和小脑核神经细胞的祖先组织),它们是在体内观察到两个主要的区域。另外,可以进一步诱导体外诱导的人小脑板组织向浦肯野细胞、小脑中间神经元、小脑颗粒细胞、小脑核等的分化。
[附图简述]
图1显示使用针对gbx2(绿色)、otx2(红色)和n-钙黏着蛋白(蓝色)的抗体对细胞聚集体的荧光免疫组织化学染色图像。
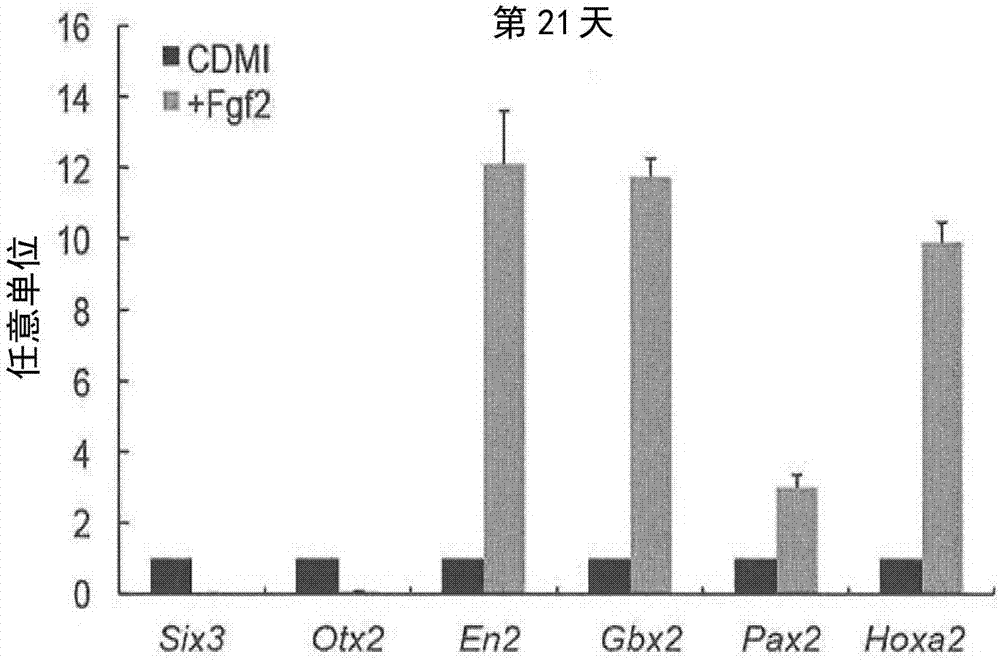
图2显示通过定量pcr法对区域特异性基因表达的分析。six3和otx2(前脑);en2(中脑);gbx2(吻侧后脑);pax2和hoxa2(尾侧后脑)。分别地,左侧柱(cdmi)显示不添加fgf2的条件,右侧柱(+fgf2)显示添加fgf2的条件。
图3显示在分化诱导培养第35天的细胞聚集体的荧光免疫组织化学染色图像。a:n-钙黏着蛋白(绿色),kirrel2(红色)。b:kirrel2(绿色)。c:kirrel2(绿色),ptf1a(红色)。在所有的图像中,细胞核用dapi(蓝色)复染。
图4显示通过抗-kirrel2抗体的facs分析。左:对照组,右:添加fgf2的组。
图5显示通过共同培养分选的kirrel2细胞与小鼠上菱唇-衍生的细胞得到的浦肯野细胞(a-e)或高尔基细胞(f)的荧光抗体染色图像。a:l7(绿色),钙结合蛋白(红色)。b:l7(绿色)。c:l7(绿色),glurdelta2(红色)。d:l7(绿色),glurdelta2(红色)。e:钙结合蛋白(绿色),glurdelta2(白色),cbln1(红色)。f:神经颗粒蛋白(红色)。
图6显示在分化诱导培养第35天细胞聚集体的荧光免疫组织化学染色图像。a:kirrel2(绿色),atoh1(红色)。b:sox2(绿色),atoh1(红色)。c:barhl1(绿色),atoh1(红色)。d:zic1(绿色),atoh1(红色)。
图7显示在分化诱导第35天(a和b)和第53天(c)细胞聚集体的荧光免疫组织化学染色图像。a:barhl1(绿色),atoh1(红色),dapi(蓝色)。b:barhl1(绿色),atoh1(红色),lhx2(绿色)。c:tbr1(绿色),smi32(红色)。
图8显示在再聚集培养后第5天(上图)和第8天(下图)的荧光免疫组织化学染色图像。a:gfp(绿色),barhl1(白色),map2(红色)。b:gfp(绿色),barhl1(白色),map2(红色)。c:gfp(绿色),pax6(白色),map2(红色)。d:gfp(绿色)。e:pax6(白色),map2(红色)。f:gfp(绿色)。
图9显示由fgf2诱导的两个结构不同的kirrel2+/n-钙黏着蛋白+神经上皮(ne)的免疫组织化学分析。a:小玫瑰花结样ne。n-钙黏着蛋白(绿色),kirrel2(红色)。b:扁平-卵形连续的ne。n-钙黏着蛋白(绿色),kirrel2(红色)。c:显示添加fgf19时具有小玫瑰花结ne的细胞聚集体和具有扁平-卵形连续的ne的细胞聚集体的比例的图表。
图10显示在分化诱导培养第35天细胞聚集体的荧光抗体染色图像。a:kirrel2(绿色),ptf1a(红色)。b:kirrel2(绿色),skor2(白色),dapi(蓝色)。c:kirrel2(红色),nkx6.1(白色),dapi(蓝色)。d:kirrel2(绿色),nestin(白色),nkx6.1(红色)。e:kirrel2(绿色),foxa2(白色),nkx6.1(红色),dapi(蓝色)。
图11是显示人es细胞衍生的神经上皮和胚胎小鼠菱脑原节1的背腹轴的示意图。
图12显示在培养第35天(左侧和中间)细胞聚集体的荧光免疫组织化学染色图像和通过定量pcr法进行的atoh1基因表达分析(右侧)。atoh1(红色),dapi(蓝色)。
图13显示在人es细胞聚集体中神经上皮结构的自形成。pkcζ(绿色),n-钙黏着蛋白(红色)。
图14显示在关于通过sdf1处理形成小脑组织的检测中在培养第35天细胞聚集体的荧光抗体染色。a:kirrel2(绿色)。b:pkc(绿色),sox2(红色)。c:kirrel2(绿色),skor2(红色)。d:sox2(红色),ph3(白色)。e:kirrel2(绿色),atoh1(红色)。f:barhl1(绿色),atoh1(红色)。g:kirrel2(绿色),ptf1a(红色)。h:sox2(绿色),oligo2(红色),lhx5(白色)。i:oligo2(红色),sox2(白色)。j:barhl1(绿色),sox2(白色)。k:kirrel2(绿色),atoh1(红色)。l:kirrel2(绿色),atoh1(红色),barhl1(白色)。
图15是分别显示在两份报道中具有通过fgf19和另外的sdf1诱导的rl-样结构的极化的小脑ne和连续的ne的自组织的示意图。svz:脑室下区,vz:脑室区。
图16显示浦肯野细胞的电生理特性特征,所述特征在由人多能干细胞聚集体诱导的浦肯野细胞中观察到。
[实施方案描述]
(1)多能干细胞
“多能干细胞”是指具有分化成组成身体的所有细胞的潜能(多能性)和经由细胞分裂产生具有相同的分化能力的子细胞的潜能(自我复制能力)的细胞。
多能性可以通过将评价靶标的细胞移植到裸鼠中并且检测是否存在包含三个胚层(外胚层、中胚层、内胚层)的每种细胞的畸胎瘤的形成来评价。
多能干细胞的实例包括胚胎干细胞(es细胞)、胚胎生殖细胞(eg细胞)、诱导的多能干细胞(ips细胞)等,并且多能干细胞没有限制,只要其具有多能性和自我复制能力二者即可。在本发明中,优选使用胚胎干细胞或诱导的多能干细胞。
例如,胚胎干细胞(es细胞)可以通过培养预植入的早期胚胎、构成早期胚胎的内细胞团、单个卵裂球等而建立(manipulatingthemouseembryoalaboratorymanual(操作小鼠胚胎实验室手册),第二版,coldspringharborlaboratorypress(1994);thomson,j.a.等人,science,282,1145-1147(1998))。作为早期胚胎,可以使用通过对体细胞的细胞核进行核移植制备的早期胚胎(wilmut等人(nature,385,810(1997)),cibelli等人(science,280,1256(1998)),akirairitani等人(tanpakushitsukakusankoso,44,892(1999)),baguisi等人(naturebiotechnology,17,456(1999)),wakayama等人(nature,394,369(1998);naturegenetics,22,127(1999);proc.natl.acad.sci.usa,96,14984(1999)),rideoutiii等人(naturegenetics,24,109(2000),tachibana等人(humanembryonicstemcellsderivedbysomaticcellnucleartransfer(通过体细胞核转移获得的人胚胎干细胞),cell(2013),出版中))。作为早期胚胎,还可以使用单性生殖胚(kim等人(science,315,482-486(2007)),nakajima等人(stemcells,25,983-985(2007)),kim等人(cellstemcell,1,346-352(2007)),revazova等人(cloningstemcells,9,432-449(2007)),revazova等人(cloningstemcells,10,11-24(2008))。
用于本发明方法的胚胎干细胞中还包括通过将es细胞与体细胞进行细胞融合获得的融合es细胞。
胚胎干细胞可从适当的机构获得,并且可以购买商业产品。例如,人胚胎干细胞khes-1、khes-2和khes-3可从京都大学(kyotouniversity)的前沿医学科学研究所(instituteforfrontiermedicalsciences)获得。
胚胎生殖细胞(eg细胞)可以通过在lif、bfgf和scf存在下培养原生殖细胞而建立(matsui等人,cell,70,841-847(1992),shamblott等人,proc.natl.acad.sci.usa,95(23),13726-13731(1998),turnpenny等人,stemcells,21(5),598-609,(2003))。
诱导的多能干细胞(ips细胞)是指通过使体细胞(例如,成纤维细胞、皮肤细胞、淋巴细胞等)与核重编程因子(nuclearreprogrammingfactor)接触而人工获得多能性和自我复制能力的细胞。通过包括向体细胞(例如,成纤维细胞、皮肤细胞等)中引入由oct3/4、sox2、klf4和c-myc构成的核重编程因子的方法首次发现ips细胞(cell,126:第663-676页,2006)。此后,多名研究者已经在重编程因子的组合和所述因子的引入方法方面进行了多种改进,并且已经报道了多种诱导的多能干细胞的制备方法。
所述核重编程因子可以用任意物质配置,诸如蛋白质因子或编码其的核酸(包括结合在载体中的形式)或低分子化合物,只要其是能够由诸如成纤维细胞的体细胞诱导具有多能性和自我复制能力的细胞的物质即可。当所述核重编程因子是蛋白质因子或编码其的核酸时,优选的核重编程因子由以下组合示例(以下,仅显示蛋白质因子的名称):
(1)oct3/4,klf4,sox2,c-myc(其中sox2可被sox1、sox3、sox15、sox17或sox18替换。klf4可被klf1、klf2或klf5替换。此外,c-myc可被t58a(活性形式突变体)、n-myc或l-myc替换。)
(2)oct3/4,klf4,sox2
(3)oct3/4,klf4,c-myc
(4)oct3/4,sox2,nanog,lin28
(5)oct3/4,klf4,c-myc,sox2,nanog,lin28
(6)oct3/4,klf4,sox2,bfgf
(7)oct3/4,klf4,sox2,scf
(8)oct3/4,klf4,c-myc,sox2,bfgf
(9)oct3/4,klf4,c-myc,sox2,scf
在这些组合中,当考虑将获得的ips细胞用于治疗应用时,优选的是oct3/4、sox2和klf4三种因子的组合。另一方面,当不考虑将ips细胞用于治疗应用时(例如,用作药物发现筛选等的研究工具),优选的是由oct3/4、klf4、sox2和c-myc组成的四种因子,或向其加入lin28或nanog的5种因子。
ips细胞优选地用于自体移植。
通过由已知的遗传工程方法修饰染色体中的基因而获得的多能干细胞也可以用于本发明。所述多能干细胞可以是这样的细胞,其中已经通过已知方法以符合读码框的(in-frame)方式在编码分化标记物的基因中敲入标记基因(例如,荧光蛋白,如gfp等),所述细胞可以通过使用所述标记基因的表达作为指标而被鉴定为已经达到相应的分化阶段。
可以使用温血动物多能干细胞,优选哺乳动物多能干细胞作为多能干细胞。例如,哺乳动物包括实验室动物,包括啮齿动物,如小鼠、大鼠、仓鼠和豚鼠,和兔;家畜动物,如猪、牛、山羊、马和绵羊;陪伴动物,如狗和猫;灵长类动物,如人、猴、猩猩和黑猩猩。多能干细胞优选是啮齿动物(小鼠、大鼠等)或灵长类动物(人等)的多能干细胞,并且最优选是人多能干细胞。
多能干细胞可以通过本身已知的方法培养来维持。例如,从临床应用方面来看,优选地通过使用血清替代品(如knockouttm血清替代物(knockouttmserumreplacement,ksr))的无血清培养或不含饲养细胞的培养维持多能干细胞。
用于本发明的多能干细胞优选是分离的。“分离的”意指已经进行去除靶细胞或成分之外的因子的操作,并且所述细胞或成分不再以天然状态存在。“分离的人多能干细胞”的纯度(人多能干细胞的数目占总细胞数目的百分比)通常不小于70%,优选地不小于80%,更优选地不小于90%,进一步优选地不小于99%,最优选100%。
(2)多能干细胞聚集体的形成
可以通过在不粘附于培养容器的条件下培养(即,悬浮培养)分散的多能干细胞并且组装多个多能干细胞以允许聚集体形成,而获得多能干细胞聚集体。
用于聚集体形成的培养容器没有特别限制,并且其实例包括烧瓶、组织培养瓶、平皿、培养皿、组织培养皿、多重平皿(multi-dishes)、微量板、微孔板、微孔、多重板(multi-plates)、多孔板(384孔,192孔,96孔,48孔,24孔等)、室载玻片(chamberslide)、碗(schale)、管、托盘、培养袋和旋转瓶。为了允许在非贴壁条件下的培养,培养容器优选是非细胞粘附的。可用的非细胞粘附培养容器包括其表面被人工处理成非细胞粘附的培养容器、其表面没有进行用于改善细胞粘附性的人工处理(例如,利用胞外基质的包被处理等)的培养容器。
多孔板、微孔、室载玻片、管等的底部形状优选是u型底或v型底,更优选是v型底,从而促使分散的多能干细胞沉淀在一个点上。v型底容器是指具有带斜面的底表面的容器,其中所述斜面在整个底表面上形成均匀的倾斜角(例如,从水平面起30-60°)。
用于聚集体形成的培养基可以使用用于培养哺乳动物细胞的培养基作为基础培养基来制备。所述基础培养基没有特别限制,只要其可以用于培养哺乳动物细胞即可,并且可以是bme培养基,bgjb培养基,cmrl1066培养基,glasgowmem培养基,改良的mem锌选择培养基(improvedmemzincoptionmedium),imdm培养基,medium199培养基,eaglemem培养基,αmem培养基,dmem培养基,ham培养基,ham’sf-12培养基,rpmi1640培养基,fischer’s培养基,neurobasal培养基,其混合培养基等。在一个实施方案中,使用imdm培养基与ham’sf-12培养基的混合培养基。例如,混合比例为imdm:ham’sf-12=0.8-1.2:1.2-0.8(体积比)。
用于培养的培养基可以是含有血清的培养基或无血清培养基。所述无血清培养基意指不含未调节的或未纯化的血清的培养基。含有纯化的来源于血液的成分和来源于动物组织的成分(例如,生长因子)的培养基对应于无血清培养基。为了避免化学上未确定的成分的污染,在本发明中优选使用无血清培养基。
用于聚集体形成的培养基可以包含血清替代品。例如,所述血清替代品可以是适当地包含清蛋白、运铁蛋白、脂肪酸、胶原蛋白前体、痕量元素、2-巯基乙醇或3’-硫代甘油或其等价物等的替代品。例如,这样的血清替代品可以通过wo98/30679中所述的方法制备。为了促使本发明的方法更容易实施,可以使用商购的血清替代品。所述商购血清替代品的实例包括敲除血清替代物(knockoutserumreplacement,ksr,由lifetechnologies制备)、化学成分确定的浓缩脂质(chemically-definedlipidconcentrated,由lifetechnologies制备)。
用于聚集体形成的培养基可以包含其他添加剂,只要对多能干细胞向小脑或其祖先组织的分化诱导没有不利影响即可。添加剂的实例包括,但不限于,胰岛素、铁源(例如,运铁蛋白等)、矿物质(例如,硒酸钠等)、糖(例如,葡萄糖等)、脂质(例如,胆固醇等)、有机酸(例如,丙酮酸、乳酸等)、血清蛋白(例如,清蛋白等)、氨基酸(例如,l-谷氨酰胺等)、还原剂(例如,2-巯基乙醇、单硫代甘油等)、维生素(例如,抗坏血酸、d-生物素等)、抗生素(例如,链霉素、青霉素、庆大霉素等)、缓冲剂(例如,hepes等)等。
用于聚集体形成的培养基可以优选地是用于下文提到的步骤(i)的培养基。
为了形成多能干细胞聚集体,自传代培养物收集多能干细胞,并且分散成单个细胞状态或接近单个细胞状态。将多能干细胞用适当的细胞离散溶液分散。所述细胞离散溶液的实例包括edta;蛋白酶,如胰蛋白酶、胶原酶iv和金属蛋白酶等,它们单独使用或者以适当的组合使用。这些中,优选的是显示低细胞毒性的那种,并且此种细胞离散溶液的实例包括商购的产品,如dispase(eidia),tryple(lifetechnologies),和accutase(millipore)。分散的多能干细胞被悬浮在上述培养基中。
为了抑制由分散引起的多能干细胞(特别是人多能干细胞)的细胞死亡,优选的是自培育开始起就加入rho相关卷曲螺旋激酶(rock)的抑制剂(jp-a-2008-99662)。尽管添加rock抑制剂的期间没有特别限制,只要可以抑制多能干细胞的细胞死亡即可,例如,其在自培育开始起的15天的期间内加入。rock抑制剂的实例包括y-27632((+)-(r)-反式-4-(1-氨基乙基)-n-(4-吡啶基)环己烷甲酰胺二盐酸盐)等。用于悬浮培养的rock抑制剂的浓度是能够抑制由分散引起的多能干细胞的细胞死亡的浓度。例如,对于y-27632,该浓度通常为约0.1-200μm,优选地约2-50μm。rock抑制剂的浓度在其添加期间可以变化,例如,在后半阶段浓度可以减半。
为了抑制由分散引起的多能干细胞(特别是人多能干细胞)的细胞死亡,可以将rock抑制剂添加到前述细胞解离溶液中,并且可以在存在rock抑制剂的条件下分散多能干细胞。
将分散的多能干细胞的悬浮液接种到上述培养容器中,并且将分散的多能干细胞在不粘附细胞培养容器的条件下培养,由此多个多能干细胞组装形成聚集体。在该情形中,分散的多能干细胞可以被接种到比较大的培养容器(如10-cm平皿)中,以在一个培养隔室中同时形成多个多能干细胞聚集体。然而,聚集体的尺寸,以及所述聚集体中包含的多能干细胞的数量可以宽泛地变化,并且所述变化可能引起聚集体之间多能干细胞向小脑或其祖先组织的分化水平的差异,这又可能降低分化诱导的效率。因此,优选的是快速地使分散的多能干细胞团聚以在一个培养隔室中形成一个聚集体。用于快速地使分散的多能干细胞团聚的方法的实例包括下述方法:
(1)包括将分散的多能干细胞装入具有比较小的体积(例如,不大于1ml,不大于500μl,不大于200μl,不大于100μl)的培养隔室中以在所述隔室中形成一个聚集体的方法。优选地,在装入所述分散的多能干细胞后,将所述培养隔室静置。所述培养隔室的实例包括,但不限于,多孔板(384-孔,192-孔,96-孔,48-孔,24-孔等)中的孔,微孔,室载玻片等;管;悬滴法中的培养基的液滴。由于重力,装在所述隔室中的分散的多能干细胞沉淀于一点上,或者细胞彼此粘附从而在一个培养隔室中形成一个聚集体。多壁板、微孔、室载玻片、管等的底部的形状优选是u型底或v型底,最优选是v型底,以促使分散的多能干细胞沉淀于一点。
(2)包括将分散的多能干细胞放置在离心管中,将其离心以允许多能干细胞沉淀于一点上,由此在管中形成一个聚集体的方法。
要接种在一个培养隔室中的多能干细胞的数量没有特别的限制,只要每个培养隔室形成一个聚集体,并且可以通过本发明的方法在所述聚集体中诱导多能干细胞向小脑或其祖先组织的分化。通常,在一个培养隔室中接种约1×103-约5×104个,优选约1×103-约2×104个,更优选约2×103-约1.2×104个,进一步优选地约5×103-约7×103个(例如,6000个)多能干细胞。然后,通过快速地使多能干细胞团聚,每个培养隔室形成通常由约1×103-约5×104个、优选约1×103-约2×104个、更优选约2×103-约1.2×104个,进一步优选地约5×103-约7×103个(例如,6000个)多能干细胞构成的一个细胞聚集体。
可以适当地确定至聚集体形成的时间,只要每个隔室形成一个聚集体,并且可以通过本发明的方法在所述聚集体中诱导多能干细胞向小脑或其祖先组织的分化。通过缩短所述时间,预期向目标小脑或其祖先组织的分化的有效诱导,并且,因此,所述时间优选更短。优选地,在24小时内形成多能干细胞聚集体,更优选地,在12小时内形成,更优选地在6小时内形成,最优选地在2–3小时内形成。可以通过由本领域技术人员选择用于细胞聚集的工具、离心条件等来适当地调节至聚集体形成的时间。
可以适当地设定其他培养条件,如聚集体形成时的培养温度和co2浓度。培养温度没有特别限制,并且,例如,是约30-40℃,优选地约37℃。例如,co2浓度是约1-10%,优选约5%。
此外,准备多个在相同培养条件下的培养隔室,并且在每个培养隔室中形成一个多能干细胞聚集体,由此可以获得多能干细胞聚集体的质量均一的群体。多能干细胞聚集体是否是质量均一的可以基于下述进行评价:聚集体团块的尺寸和其中的细胞数量,通过组织染色分析的其宏观形态学、微观形态学和同质性,分化和不分化标记物的表达及其同质性,分化标记物表达的调节及其同步性,聚集体间分化效率的重现性等。在一个实施方案中,用于本发明方法的多能干细胞聚集体的群体在所述聚集体中包含均一数量的多能干细胞。特定参数“均一”的多能干细胞聚集体的群体意指在其群体中的总聚集体的不低于90%落在所述聚集体群体中该参数的平均数±10%、优选±5%的范围内。
(3)诱导小脑祖先组织
本发明提供用于制备包含小脑祖先组织的人细胞聚集体的方法,所述方法包括将多能干细胞聚集体在包含胰岛素的无血清培养基中进行悬浮培养,并且,在所述悬浮培养中,用rock抑制剂、tgfβ信号抑制剂和第一成纤维细胞生长因子处理所述人多能干细胞聚集体或源自其的人细胞聚集体。
小脑祖先组织的实例包括,但不限于,中脑-后脑边界神经祖先组织;小脑板组织;其部分组织(例如,脑室区,菱唇)等。所述中脑-后脑边界是在胚胎发生过程中控制中脑和后脑前部发育的形成体。中脑-后脑边界可以通过中脑-后脑边界标记的表达来鉴定。关于中脑-后脑边界标记,可以提及en2(中脑标记)、gbx2(吻侧后脑标记)等。中脑-后脑边界包含选自由下述组成的组的至少一种:en2阳性神经祖先细胞和gbx2阳性神经祖先细胞,优选两种细胞。所述神经祖先细胞可以鉴定为n-钙黏着蛋白阳性细胞。在一个实施方案中,中脑-后脑边界是en2阳性和/或gbx2阳性神经祖先组织。小脑板组织的定义在下文中提及。
在本发明中,组织是指具有这样的结构的细胞群体的结构:其中具有不同形式和特性的多种细胞以特定的样式立体排列。
本发明的制备方法特别包括将多能干细胞聚集体在包含胰岛素的无血清培养基中进行悬浮培养,并且,在所述悬浮培养中,用rock抑制剂、tgfβ信号抑制剂和第一成纤维细胞生长因子处理所述人多能干细胞聚集体或源自其的人细胞聚集体,从而得到包含中脑-后脑边界神经祖先组织的细胞聚集体(步骤(i))。当需要进一步的小脑分化进程时,将在步骤(i)中得到的包含中脑-后脑边界神经祖先组织的细胞聚集体进一步在无血清培养基中进行悬浮培养,以诱导所述神经祖先组织中的神经祖先细胞形成神经上皮结构,由此得到包含小脑板组织的人细胞聚集体(步骤(ii))。在步骤(i)中,诱导多能干细胞向中脑-后脑边界神经祖先组织分化,并且在步骤(ii)中,诱导中脑-后脑边界神经祖先组织向小脑板组织的进一步分化。
由于在本发明的方法中在细胞聚集体中诱导小脑祖先组织的自组织,包含在所述细胞聚集体中的小脑祖先组织的分化阶段随着时间进展继续进行。因此,培养期间和培养条件优选地按照目的小脑祖先组织的分化阶段适当地进行调节。
(3.1)步骤(i)
在步骤(i)中,将多能干细胞聚集体在包含胰岛素的无血清培养基中进行悬浮培养,并且在悬浮培养中,用rock抑制剂、tgfβ信号抑制剂和第一成纤维细胞生长因子处理所述多能干细胞聚集体或源自其的人细胞聚集体。
多能干细胞聚集体的“悬浮培养”是指在不粘附于培养容器的条件下在培养基中培养多能干细胞聚集体。
用于悬浮培养的培养基包含胰岛素。培养基中胰岛素的浓度可以在能够在所述细胞聚集体中诱导多能干细胞向中脑-后脑边界神经祖先组织分化的范围内适当地确定。其浓度通常不小于0.1μg/ml,优选不小于1μg/ml。尽管上限没有特别设定,只要对向中脑-后脑边界神经祖先组织的分化没有不利影响即可,但是,从培养成本方面来看,其通常不超过100μg/ml,优选不超过20μg/ml。在一个实施方案中,培养基中胰岛素的浓度通常为0.1-100μg/ml,优选1-20μg/ml(例如,7μg/ml)。由于胰岛素特别有助于促进多能干细胞或源自其的细胞的分化,其以能够实现这一效果的浓度包含在培养基中。
用于悬浮培养的培养基可以使用用于培养哺乳动物细胞的培养基作为基础培养基来制备。所述基础培养基没有特别限制,只要其可以用于培养哺乳动物细胞即可,并且可以是bme培养基,bgjb培养基,cmrl1066培养基,glasgowmem培养基,改良的mem锌选择培养基,imdm培养基,medium199培养基,eaglemem培养基,αmem培养基,dmem培养基,ham培养基,ham’sf-12培养基,rpmi1640培养基,fischer’s培养基,neurobasal培养基,其混合培养基等。在一个实施方案中,使用imdm培养基与ham’sf-12培养基的混合培养基。例如,混合比例为imdm:ham’sf-12=0.8-1.2:1.2-0.8(体积比)。
为了避免化学上未确定的成分的污染,优选使用无血清培养基进行悬浮培养。
用于细胞聚集体悬浮培养的培养基可以包含血清替代品。例如,所述血清替代品可以是适当地包含清蛋白、运铁蛋白、脂肪酸、痕量元素、2-巯基乙醇或3’-硫代甘油或其等价物等的替代品。例如,这样的血清替代品可以通过wo98/30679中所述的方法制备。为了促使本发明的方法更容易实施,可以使用商购的血清替代品。所述商购血清替代品的实例包括化学成分确定的浓缩脂质(由lifetechnologies制备)。优选包含化学确定的成分的血清替代品。另外,优选不包含由不同于要培养的细胞的动物物种的动物分离的成分(异种动物来源的成分)(例如,当培养人细胞时,从非人动物分离的成分)的血清替代品。由于化学成分不确定的血清替代品和包含异种动物来源的成分的血清替代品(例如,ksr(敲除血清替代物))可能抑制多能干细胞向中脑-后脑边界神经祖先组织的分化诱导,不优选它们的使用。
用于细胞聚集体悬浮培养的培养基可以包含其他添加剂,只要对多能干细胞向中脑-后脑边界神经祖先组织的分化诱导没有不利影响即可。添加剂的实例包括,但不限于,铁源(例如,运铁蛋白等)、矿物质(例如,硒酸钠等)、糖(例如,葡萄糖等)、脂质(例如,胆固醇等)、有机酸(例如,丙酮酸、乳酸等)、血清蛋白(例如,清蛋白等)、氨基酸(例如,l-谷氨酰胺等)、还原剂(例如,2-巯基乙醇、单硫代甘油等)、维生素(例如,抗坏血酸、d-生物素等)、抗生素(例如,链霉素、青霉素、庆大霉素等)、缓冲剂(例如,hepes等)等。
在一个实施方案中,为了避免对向中脑-后脑边界神经祖先组织分化诱导的不利影响,用于细胞聚集体悬浮培养的培养基需要除了本说明书中特别描述包含在培养基中的那些之外不含生长因子。此处,“生长因子”包括模式形成因子(patternformationfactor),如fgf;bmp;wnt,nodal,notch和shh;富脂质清蛋白;细胞外基质。不含生长因子的培养基的实例包括wataya等人,procnatlacadsciusa,105(33):11796-11801,2008中公开的gfcdm。
为了避免化学成分未确定的成分的污染,用于悬浮培养的培养基优选是成分化学确定的培养基。
优选地,用于悬浮培养的培养基不包含异种动物来源的成分。
用于细胞聚集体悬浮培养的其他培养条件下,诸如培养温度、co2浓度和o2浓度,可以适当设定。例如,培养温度是约30-40℃,优选约37℃。co2浓度例如是约1-10%,优选约5%。o2浓度例如是约20%。
在步骤(i)的悬浮培养中,细胞聚集体的悬浮培养可以在存在或不存在饲养细胞的条件下进行,只要可以通过本发明的方法诱导多能干细胞向小脑祖先组织的分化即可。为了避免未确定因子的污染,细胞聚集体的悬浮培养优选地在不存在饲养细胞的条件下进行。
作为可以用于悬浮培养细胞聚集体的容器,可以提及上文(2)中作为可以用于形成多能干细胞聚集体的容器引用的那些。为了使细胞聚集体稳定地位于一个位置并且避免聚集体的瓦解,容器的底部优选是u型底或v型底,更优选是v型底。
在优选的实施方案中,将多能干细胞聚集体的质量均一的群体在包含胰岛素的无血清培养基中悬浮培养。使用多能干细胞聚集体的质量均一的群体,可以将聚集体之间向中脑-后脑边界神经祖先组织的分化水平的差异抑制至最小程度,并且可以提高目标分化诱导的效率。多能干细胞聚集体的质量均一的群体的悬浮培养包括以下实施方案:
(1)准备多个培养隔室,并且接种多能干细胞聚集体的质量均一的群体,以使在一个培养隔室中包含一个多能干细胞聚集体(例如,在96孔板的每个孔中放置一个多能干细胞聚集体)。在每个培养隔室中,将一个多能干细胞聚集体在包含胰岛素的培养基中悬浮培养。
(2)接种多能干细胞聚集体的质量均一的群体,以使在一个培养隔室中包含多个多能干细胞聚集体(例如,在10cm的平皿中放置多个多能干细胞聚集体)。在所述培养隔室中,将多个多能干细胞聚集体在包含胰岛素的培养基中悬浮培养。
可以将实施方案(1)和(2)中任一个用于本发明的方法,并且在培养过程中可以改变实施方案(从实施方案(1)到实施方案(2),或从实施方案(2)到实施方案(1))。在一个实施方案中,在步骤(i)中用实施方案(1),并且在步骤(ii)中用实施方案(2)。
在步骤(i)中,在上文提及的悬浮培养中,用rock抑制剂、tgfβ信号抑制剂和第一成纤维细胞生长因子处理多能干细胞聚集体或源自其的人细胞聚集体。用这些因子处理所述细胞聚集体可以通过向悬浮培养中添加rock抑制剂、tgfβ信号抑制剂和第一成纤维细胞生长因子并且使所述多能干细胞聚集体或源自其的细胞聚集体与培养基中的所述rock抑制剂、tgfβ信号抑制剂和第一成纤维细胞生长因子接触而实现。
rho相关卷曲螺旋激酶(rock)抑制剂具有抑制由分散诱发的多能干细胞(特别是人多能干细胞)的细胞死亡和支持生长的作用。关于rock抑制剂,一些化合物是已知的(例如,ishizaki等人,mol.pharmacol.57,976-983(2000)和narumiya等人,methodsenzymol.325,273-284(2000))。具体地,关于rock抑制剂,可以提及y-27632((+)-(r)-反式-4-(1-氨基乙基)-n-(4-吡啶基)环己烷甲酰胺)(优选地,二盐酸盐);法舒地尔(fasudil)(5-(1-高哌嗪基)磺酰基异喹啉)(优选地,盐酸盐);h-1152((s)-(+)-2-甲基-1-[(4-甲基-5-异喹啉基)磺酰基]-六氢-1h-1,4-二氮杂
用rock抑制剂处理细胞聚集体的时机和持续时间没有特别限制,只要能够抑制由分散诱发的多能干细胞的细胞死亡并且多能干细胞向中脑-后脑边界神经祖先组织的分化是可能的即可。为了有效地抑制由分散诱发的多能干细胞的细胞死亡,优选在自多能干细胞聚集体的悬浮培养开始起的2小时内,更优选在自悬浮培养开始起的0.5小时内,进一步优选自悬浮培养开始起,将rock抑制剂添加到培养基中,从而用所述rock抑制剂处理所述细胞聚集体。使用rock抑制剂的处理时期通常不小于12小时,优选不小于2、4或7天。使用rock抑制剂处理时期的上限没有特别设定,只要多能干细胞向中脑-后脑边界神经祖先组织的分化是可能的即可。为了避免对分化的不可预料的不利影响,其通常在21天内,优选在14天内。在使用rock抑制剂的处理时期过去后,从培养基中去除所述rock抑制剂。在使用rock抑制剂处理期间rock抑制剂在培养基中的浓度是能够抑制由分散诱发的多能干细胞的细胞死亡的浓度。例如,对于y-27632,该浓度通常为约0.1至200μm,优选约2至50μm。在处理期间内,rock抑制剂的浓度可以变化。例如,在后半阶段浓度可以减半。
tgfβ信号抑制剂具有抑制多能干细胞向中胚层分化并且促进向神经外胚层分化的作用。tgfβ信号抑制剂没有特别限制,只要其能够抑制由tgfβ介导的信号转导即可。tgfβ信号抑制剂的实例包括,但不限于,sb431542(4-(5-苯并[1,3]二氧代-5-基-4-吡啶-2-基-1h-咪唑-2-基)-苯甲酰胺),ly-364947,sb-505,a-83-01等。特别地,优选是sb431542。
用tgfβ信号抑制剂处理所述细胞聚集体的时机和持续时间没有特别限制,只要能够抑制多能干细胞向中胚层的分化并且能够促进向神经外胚层的分化即可。为了有效地抑制中胚层分化和有效地促进向神经外胚层的分化,优选地在自多能干细胞聚集体的悬浮培养开始起的2小时内,更优选在自悬浮培养开始起的0.5小时内,进一步优选自悬浮培养开始起,将tgfβ信号抑制剂添加到培养基中,从而用所述tgfβ信号抑制剂处理所述细胞聚集体。使用tgfβ信号抑制剂的处理时期通常不小于2天,优选不小于7天。使用tgfβ信号抑制剂处理时期的上限没有特别设定,只要多能干细胞向中脑-后脑边界神经祖先组织的分化是可能的即可。为了避免对分化的不可预料的不利影响,其通常在21天内,优选在14天内。在使用tgfβ信号抑制剂的处理时期过去后,从培养基中去除所述tgfβ信号抑制剂。在使用tgfβ信号抑制剂处理期间tgfβ信号抑制剂在培养基中的浓度是能够抑制多能干细胞向中胚层分化并且能够促进向神经外胚层分化的浓度。例如,对于sb431542,该浓度通常为约0.1至200μm,优选约2至50μm,更优选约10-30μm。在处理期间内,tgfβ信号抑制剂的浓度可以变化。例如,在后半阶段浓度可以减半。
第一成纤维细胞生长因子是具有促进多能干细胞向中脑-后脑边界分化并且抑制向前脑分化的作用的fgf。成纤维细胞生长因子没有特别限制,只要其促进向中脑-后脑边界的分化即可。关于成纤维细胞生长因子(fgf),已经在人和小鼠中鉴定了fgf1-fgf23。由于人fgf19是小鼠fgf15的直向同源物,人和小鼠的fgf家族由22个成员组成。在本说明书中,fgf的名称按照人fgf的命名法。所述第一成纤维细胞生长因子优选是fgf2或fgf8,更优选是fgf2。fgf2是一种已知的细胞因子,其还称为碱性成纤维细胞生长因子(bfgf),并且其氨基酸序列也是已知的。用于本发明的fgf2通常是哺乳动物fgf2。哺乳动物的实例包括上文提及的那些。由于fgf2在多种哺乳动物物种之间具有交叉反应性,也可以使用任意哺乳动物的fgf2,只要能够实现本发明的目的即可。优选地,使用与培养的细胞相同物种的哺乳动物fgf2。例如,使用啮齿动物(小鼠、大鼠等)或灵长动物(人等)的fgf2。此处,小鼠fgf2意指fgf2具有在小鼠体内天然表达的fgf2的氨基酸序列。在本说明书中,相似的解释也应用其他蛋白等。代表性的小鼠fgf2的氨基酸序列的实例包括ncbi登记号np_032032.1(2014年2月18日更新),即通过从所述氨基酸序列去除n-端信号序列(1-9)得到的氨基酸序列(成熟的小鼠fgf2氨基酸序列)等。代表性的人fgf2的氨基酸序列的实例包括ncbi登记号np_001997.5(2014年2月18日更新)等。
用第一成纤维细胞生长因子处理细胞聚集体的时机和持续时间没有特别限制,只要能够促进多能干细胞向中脑-后脑边界的分化即可。当将多能干细胞聚集体悬浮培养开始时视为第0天(d0)时,优选在d2-d4、更优选在d2的任意时间点向培养基中添加第一成纤维细胞生长因子,从而开始用所述第一成纤维细胞生长因子处理所述细胞聚集体。用第一成纤维细胞生长因子的处理期间通常不小于2天,优选不小于5天。用第一成纤维细胞生长因子的处理期间的上限没有特别设定,只要多能干细胞向中脑-后脑边界神经祖先组织的分化是可能的即可。为了避免对分化的不可预料的不利影响,其通常在19天内,优选在12天内。在使用第一成纤维细胞生长因子的处理时期过去后,从培养基中去除所述第一成纤维细胞生长因子。在使用第一成纤维细胞生长因子处理期间第一成纤维细胞生长因子在培养基中的浓度是能够促进多能干细胞向中脑-后脑边界分化的浓度。尽管第一成纤维细胞生长因子还用于多能干细胞的维持培养,但是用于促进向中脑-后脑边界分化的浓度通常高于用于维持培养的浓度。当使用fgf2作为第一成纤维细胞生长因子时,其在培养基中的浓度优选不小于20ng/ml,更优选不小于40ng/ml,进一步优选不小于50ng/ml。尽管fgf2浓度的上限没有特别设定,只要没有发现对向中脑-后脑边界分化的不利影响即可,但是,从培养成本方面来看,其优选不超过1000ng/ml,更优选不超过300ng/ml,进一步优选不超过100ng/ml。在一个实施方案中,培养基中fgf2的浓度优选为20-1000ng/ml,优选为40-300ng/ml,进一步优选为50-100ng/ml。第一成纤维细胞生长因子的浓度在处理期间内可以变化。例如,在后半阶段浓度可以减半。
在优选的实施方案中,从悬浮培养开始起直到开始用第一成纤维细胞生长因子处理时,不用第一成纤维细胞生长因子刺激细胞聚集体。即,从悬浮培养开始起直到开始用第一成纤维细胞生长因子处理时,用于悬浮培养的培养基优选地基本上不含第一成纤维细胞生长因子。“基本上不含第一成纤维细胞生长因子”意指培养基中第一成纤维细胞生长因子的浓度低于用于促进向中脑-后脑边界分化的浓度。在一个实施方案中,在自悬浮培养开始起到开始用第一成纤维细胞生长因子处理的期间过程中,培养基中第一成纤维细胞生长因子的浓度通常小于1ng/ml,优选地小于0.1ng/ml,更优选地小于0.01ng/ml。
在一个实施方案中,步骤(i)包括在悬浮培养中进一步用第二成纤维细胞生长因子处理人多能干细胞聚集体或源自其的人细胞聚集体。
所述第二成纤维细胞生长因子是具有对步骤(ii)中形成的神经上皮结构赋予沿着神经管的背腹轴的极性的作用的fgf,所述步骤(ii)是使用步骤(i)得到的细胞聚集体进行的。关于所述成纤维细胞生长因子(fgf),已经在人和小鼠中鉴定了fgf1-fgf23。第二成纤维细胞生长因子优选是fgf19、fgf17或fgf8,更优选是fgf19。fgf19是已知的细胞因子,并且其氨基酸序列也是已知的。用于本发明的fgf19通常是哺乳动物fgf19。哺乳动物的实例包括上文提及的那些。也可以使用任意哺乳动物的fgf19,只要能够实现本发明的目的即可。优选地,使用与培养的细胞相同物种的哺乳动物fgf19。例如,使用啮齿动物(小鼠、大鼠等)或灵长动物(人等)的fgf19。代表性的人fgf19的氨基酸序列的实例包括ncbi登记号np_0015108.1(2014年4月27日更新),即通过从所述氨基酸序列去除n-端信号序列(1-22)得到的氨基酸序列(成熟的人fgf19)等。
用第二成纤维细胞生长因子处理细胞聚集体的时机和持续时间没有特别限制,只要对神经上皮结构赋予沿着神经管背腹轴的极性即可。当将多能干细胞聚集体悬浮培养开始时视为第0天(d0)时,优选在d10-d14、更优选在d14的任意时间点向培养基中添加第二成纤维细胞生长因子,从而开始用所述第二成纤维细胞生长因子处理所述细胞聚集体。用第二成纤维细胞生长因子的处理期间通常不小于2天,优选不小于4天。用第二成纤维细胞生长因子的处理期间的上限没有特别设定,只要对神经上皮结构赋予沿着神经管背腹轴的极性即可。为了抑制向除中脑-后脑边界之外的结构部分分化的可能性,其通常在14天内,优选在11天内,更优选在7天内。在用第二成纤维细胞生长因子处理期间后,从培养基中取出所述第二成纤维细胞生长因子。在第二成纤维细胞生长因子处理期间内培养基中第二成纤维细胞生长因子的浓度是对神经上皮结构赋予沿着神经管背腹轴的极性的浓度。当使用fgf19作为第二成纤维细胞生长因子时,其在培养基中的浓度优选不小于30ng/ml,更优选不小于40ng/ml,进一步优选不小于50ng/ml。尽管fgf19浓度的上限没有特别设定,只要没有发现对向中脑-后脑边界的分化的不利作用即可,但是其优选不超过1000ng/ml,更优选不超过500ng/ml,更优选不超过300ng/ml。在一个实施方案中,培养基中fgf2的浓度优选为30-1000ng/ml,优选为40-500ng/ml,更优选为50-300ng/ml。第二成纤维细胞生长因子的浓度在处理期间可以变化。例如,在后半阶段浓度可以减半。
在优选的实施方案中,从悬浮培养开始起直到开始用第二成纤维细胞生长因子处理时,不用第二成纤维细胞生长因子刺激细胞聚集体。即,从悬浮培养开始起直到开始用第二成纤维细胞生长因子处理时,用于悬浮培养的培养基优选地基本上不含第二成纤维细胞生长因子。“基本上不含第二成纤维细胞生长因子”意指培养基中第二成纤维细胞生长因子的浓度低于用于对神经上皮结构赋予沿着神经管背腹轴的极性的浓度。在一个实施方案中,在自悬浮培养开始起到开始用第二成纤维细胞生长因子处理的期间过程中,培养基中第二成纤维细胞生长因子的浓度通常小于1ng/ml,优选地小于0.1ng/ml,更优选地小于0.01ng/ml,最优选为0ng/ml。
用于本发明的胰岛素、第一成纤维细胞生长因子和第二成纤维细胞生长因子优选是分离的。“分离的”意指已经进行去除目的成分或细胞之外的因子的操作,并且所述成分或细胞不再以天然状态存在。因此,“分离的蛋白x”不包括由培养的细胞或组织产生的内源性蛋白x。“分离的蛋白x”的纯度(蛋白x的重量占总蛋白重量的百分比)通常不小于70%,优选地不小于80%,更优选地不小于90%,进一步优选地不小于99%,最优选为100%。包含在用于悬浮培养的培养基中的分离的胰岛素、第一成纤维细胞生长因子和第二成纤维细胞生长因子是外源添加到培养基中的。因此,在一个实施方案中,本发明包括提供分离的胰岛素/分离的第一成纤维细胞生长因子/分离的第二成纤维细胞生长因子中的每一种的步骤。在一个实施方案中,包括向步骤(i)中用于悬浮培养的培养基中外源添加分离的胰岛素/分离的第一成纤维细胞生长因子/分离的第二成纤维细胞生长因子中的每一种的步骤。
rock抑制剂、tgfβ信号抑制剂和第一成纤维细胞生长因子的优选组合是y27632、sb431542和fgf2。
rock抑制剂、tgfβ信号抑制剂、第一成纤维细胞生长因子和第二成纤维细胞生长因子的优选组合是y27632、sb431542、fgf2和fgf19。
在一个实施方案中,在步骤(i)的悬浮培养中,多能干细胞聚集体或源自其的人细胞聚集体自悬浮培养开始起用rock抑制剂处理,自悬浮培养开始起用tgfβ信号抑制剂处理,并且自悬浮培养开始后第2-4天用第一成纤维细胞生长因子处理。用rock抑制剂的处理期间是足以抑制由分散诱发的多能干细胞的细胞死亡的期间(例如,持续12小时(2天,4天,或7天)–21天(或14天))。用tgfβ信号抑制剂的处理期间是足以抑制中胚层分化并且促进向神经外胚层分化的期间(例如,持续2天(或7天)–21天(或14天))。用第一成纤维细胞生长因子处理的处理期间是足以促进多能干细胞向中脑-后脑边界神经祖先组织分化的期间(例如,持续2天(或5天)–19天(或12天))。
在一个实施方案中,在步骤(i)的悬浮培养中,多能干细胞聚集体或源自其的人细胞聚集体自悬浮培养开始起用rock抑制剂处理,自悬浮培养开始起用tgfβ信号抑制剂处理,自悬浮培养开始后第2-4天用第一成纤维细胞生长因子处理,并且在悬浮培养开始后第10-14天用第二成纤维细胞生长因子处理。用rock抑制剂的处理期间是足以抑制由分散诱发的多能干细胞的细胞死亡的期间(例如,持续12小时(2天,4天,或7天)–21天(或14天))。用tgfβ信号抑制剂的处理期间是足以抑制中胚层分化并且促进向神经外胚层分化的期间(例如,持续2天(或7天)–21天(或14天))。用第一成纤维细胞生长因子处理的处理期间是足以促进多能干细胞向中脑-后脑边界神经祖先组织分化的期间(例如,持续2天(或5天)–19天(或12天))。用第二成纤维细胞生长因子处理的处理期间是足以对神经上皮结构赋予沿着神经管背腹轴的极性的期间(例如,持续2天(或4天)–14天(或11天或7天))。
在优选的实施方案中,为了在上述(2)中形成多能干细胞聚集体,步骤(i)中所用的培养基用来形成多能干细胞的聚集体,并且在步骤(i)中继续进行所述聚集体的悬浮培养。即,将分散的多能干细胞悬浮在要用于步骤(i)的培养基(包含胰岛素的无血清培养基)中,在上文提及的培养容器中接种所述分散的多能干细胞的混悬液,并且在不粘附所述细胞培养容器的条件下培养所述分散的多能干细胞,由此组装多个多能干细胞形成聚集体,并且所形成的多能干细胞聚集体在该培养基中继续悬浮培养。由于当开始悬浮培养时分散的多能干细胞在短时间内形成聚集体,在该实施方案中,开始培养所述分散的多能干细胞可以视为步骤(i)中悬浮培养的起始。
在一个实施方案中,分散在包含胰岛素、rock抑制剂和tgfβ信号抑制剂的无血清培养基中的多能干细胞在培养容器中进行悬浮培养,从而形成多能干细胞聚集体,并且将所得到的多能干细胞聚集体继续在相同的无血清培养基中悬浮培养。在所述悬浮培养中,将所述多能干细胞聚集体或源自其的人细胞聚集体进一步用第一成纤维细胞生长因子(以及任选地用第二成纤维细胞生长因子)处理。
在一个实施方案中,分散在包含胰岛素、rock抑制剂和tgfβ信号抑制剂的无血清培养基中的多能干细胞进行悬浮培养,从而形成多能干细胞聚集体,并且将所得到的多能干细胞聚集体继续在相同的无血清培养基中悬浮培养。在该悬浮培养中,自悬浮培养开始后第2-4天,将所述多能干细胞聚集体或源自其的细胞聚集体进一步用第一成纤维细胞生长因子处理。用rock抑制剂的处理期间是足以抑制由分散诱发的多能干细胞的细胞死亡的期间(例如,持续12小时(2天,4天,或7天)–21天(或14天))。用tgfβ信号抑制剂的处理期间是足以抑制中胚层分化并且促进向神经外胚层分化的期间(例如,持续2天(或7天)–21天(或14天))。用第一成纤维细胞生长因子处理的处理期间是足以促进多能干细胞向中脑-后脑边界神经祖先组织分化的期间(例如,持续2天(或5天)–19天(或12天))。
在一个实施方案中,分散在包含胰岛素、rock抑制剂和tgfβ信号抑制剂的无血清培养基中的多能干细胞进行悬浮培养,从而形成多能干细胞聚集体,并且将所得到的多能干细胞聚集体继续在相同的无血清培养基中悬浮培养。在该悬浮培养中,自悬浮培养开始后第2-4天,将所述多能干细胞聚集体或源自其的细胞聚集体进一步用第一成纤维细胞生长因子处理,并且自悬浮培养开始后第10-14天,用第二成纤维细胞生长因子处理。用rock抑制剂的处理期间是足以抑制由分散诱发的多能干细胞的细胞死亡的期间(例如,持续12小时(2天,4天,或7天)–21天(或14天))。用tgfβ信号抑制剂的处理期间是足以抑制中胚层分化并且促进向神经外胚层分化的期间(例如,持续2天(或7天)–21天(或14天))。用第一成纤维细胞生长因子的处理期间是足以促进多能干细胞向中脑-后脑边界神经祖先组织分化的期间(例如,持续2天(或5天)–19天(或12天))。用第二成纤维细胞生长因子的处理期间是足以对神经上皮结构赋予沿着神经管背腹轴的极性的期间(例如,持续2天(或4天)-14天(或11天或7天))。
步骤(i)的悬浮培养进行足以诱导多能干细胞向中脑-后脑边界神经祖先组织分化的期间。结果,得到包含所述中脑-后脑边界神经祖先组织的细胞聚集体。向中脑-后脑边界神经祖先组织的分化可以通过,例如,使用中脑-后脑边界标记特异性的探针的rt-pcr,和使用中脑-后脑边界标记特异性的抗体和神经祖先组织特异性的抗体的免疫组织化学进行检测。例如,进行步骤(i)的悬浮培养直到不少于20%、优选不少于50%、更优选不少于70%的包含在所述细胞聚集体中的细胞变成中脑-后脑边界神经祖先细胞。由于培养期间可能取决于多能干细胞的动物物种而变化;以及rock抑制剂、tgfβ信号抑制剂和第一成纤维细胞生长因子的种类和浓度而变化,其通常不能指定。然而,当使用人多能干细胞时,例如,第一培养步骤通常是14–30天(例如,21天)。
关于中脑-后脑边界标记,可以提及en2(中脑标记)、gbx2(吻侧后脑标记)等。关于神经祖先细胞标记,可以提及n-钙黏着蛋白。因此,在一个实施方案中,所述中脑-后脑边界神经祖先细胞可以鉴定为en2-或gbx2-阳性、且n-钙黏着蛋白-阳性的细胞。
步骤(i)可以包括证实在细胞聚集体中向中脑-后脑边界神经祖先组织的分化诱导的步骤。该证实步骤可以通过分离一部分细胞聚集体并且对其进行使用中脑-后脑边界标记特异性的探针的rt-pcr或使用中脑-后脑边界标记特异性的抗体和神经祖先组织特异性的抗体的免疫组织化学分析而进行。
在一个实施方案中,在步骤(i)的悬浮培养中不添加sonichedgehog抑制剂,并且步骤(i)的悬浮培养在其整个期间内不包含sonichedgehog抑制剂。即,所述多能干细胞聚集体或源自其的聚集体不用sonichedgehog抑制剂处理。在muguruma,k.等人,natureneurosci.13,1171-1180,2010的方法中,由小鼠es细胞的小脑分化需要sonichedgehog抑制剂,而通过本发明的方法,不添加sonichedgehog抑制剂,多能干细胞(特别是人多能干细胞)向中脑-后脑边界神经祖先组织的有效分化是可能的。相反,添加sonichedgehog抑制剂抑制向中脑-后脑边界神经祖先组织的分化。sonichedgehog抑制剂的实例包括,但不限于,低分子量化合物,如环杷明,介藜芦胺(jervine),gant61,sant-2,番茄碱(tomatidine),花姜酮(zerumbone),gdc-0449,xl139,ipi926,ipi609,lde225,曲帕拉醇(triparanol),ay9944等。
在一个实施方案中,在步骤(i)的悬浮培养中不添加bmp4,并且步骤(i)的悬浮培养在其整个期间内基本上不含bmp4。即,所述多能干细胞聚集体或源自其的聚集体不用bmp4处理。在muguruma,k.等人,natureneurosci.13,1171-1180,2010的方法中,由小鼠es细胞的小脑分化需要bmp4,而通过本发明的方法,不添加bmp4,多能干细胞(特别是人多能干细胞)向中脑-后脑边界神经祖先组织的分化是可能的。“基本上不含bmp4”意指培养基中bmp4的浓度低于生理活性表达的水平。具体地,培养基中bmp4的浓度通常小于0.1ng/ml,优选小于0.01ng/ml,更优选小于0.001ng/ml,最优选为0ng/ml。
在优选的实施方案中,由于在步骤(i)的悬浮培养中不添加sonichedgehog抑制剂和bmp4,并且步骤(i)的悬浮培养在其整个期间内不含sonichedgehog抑制剂且基本上不含bmp4。即,所述多能干细胞聚集体或源自其的聚集体不用sonichedgehog抑制剂和bmp4处理。
(3.2)步骤(ii)
在步骤(ii)中,将在步骤(i)中得到的包含中脑-后脑边界神经祖先组织的人细胞聚集体进一步在无血清培养基中进行悬浮培养,以诱导神经祖先组织中的神经祖先细胞形成神经上皮结构,由此得到包含小脑板组织的人细胞聚集体。
以与步骤(i)中相同的方式,通过使用用于培养哺乳动物细胞的培养基作为基础培养基,可以制备用于步骤(ii)的培养基。关于所述基础培养基,可以提及与步骤(i)相关联描述的基础培养基。在优选的实施方案中,用于步骤(ii)的培养基由用于培养人神经元的培养基作为基础培养基制备。关于所述基础培养基,可以提及neurobasal培养基。
用于步骤(ii)的培养基优选是无血清培养基,以避免化学成分不确定的成分的污染。
用于步骤(ii)的培养基可以包含血清替代品。例如,所述血清替代品可以是适当地包含清蛋白、运铁蛋白、脂肪酸、胶原蛋白前体、痕量元素、2-巯基乙醇或3’-硫代甘油或其等价物等的替代品。关于所述血清替代品,可以提及n2、b27、ksr等。n2是已知的包含胰岛素、运铁蛋白、孕酮、腐胺和亚硒酸钠的血清替代组合物。b27的组分记述在j.neurosci.res.,vol.35,第567-576页,1993,brainres.,vol.494,第65-74页,1989等中。n2,b27可以从lifetechnologies等购买。添加到培养基中的血清替代品的量没有特别限制,只要其能够实现向小脑板组织的分化诱导即可。例如,当其是由lifetechnologies生产的n2补充剂时,相对于培养基总体积,添加1/500-1/10体积。在优选的实施方案中,用于步骤(ii)的培养基包含n2。优选包含化学成分确定的成分的血清替代品。另外,优选不包含由不同于要培养的细胞的动物物种的动物分离的成分(异种动物来源的成分)(例如,当培养人细胞时,从非人动物分离的成分)的血清替代品。不优选化学成分不确定的血清替代品和包含异种动物来源的成分的血清替代品(例如,ksr(敲除血清替代物))的使用。
用于步骤(ii)的培养基可以包含其他添加剂,只要对向小脑板组织的分化诱导没有实施不利影响即可。添加剂的实例包括,但不限于,胰岛素、铁源(例如,运铁蛋白等)、矿物质(例如,硒酸钠等)、糖(例如,葡萄糖等)、有机酸(例如,丙酮酸、乳酸等)、血清蛋白(例如,清蛋白等)、氨基酸(例如,l-谷氨酰胺等)、还原剂(例如,2-巯基乙醇等)、维生素(例如,抗坏血酸、d-生物素等)、抗生素(例如,链霉素、青霉素、庆大霉素等)、缓冲剂(例如,hepes等)等。由于在包含l-谷氨酰胺的培养基中长期培养可能引起氨毒性,也可以使用l-丙氨酰-l-谷氨酰胺二肽替代l-谷氨酰胺。在优选的实施方案中,用于步骤(ii)的培养基包含l-丙氨酰-l-谷氨酰胺二肽。例如,l-丙氨酰-l-谷氨酰胺二肽是市售的,例如作为glutamax(由lifetechnologies制备)等。
为了避免化学成分不确定的成分的污染,用于步骤(ii)的培养基优选是其成分化学确定的培养基。
优选地,用于步骤(ii)的培养基不包含异种动物来源的成分。
步骤(ii)中的其他培养条件,诸如培养温度和co2浓度,可以适当地设定。例如,培养温度是约30-40℃,优选约37℃。例如,co2浓度是约1-10%,优选约5%。
在步骤(ii)的悬浮培养中,细胞聚集体的悬浮培养可以在存在或不存在饲养细胞的条件下进行,只要通过本发明的方法使中脑-后脑边界神经祖先组织向小脑板组织的分化诱导是可能的即可。为了避免不确定因素的污染,细胞聚集体的悬浮培养优选在不存在饲养细胞的条件下进行。
关于可以用于悬浮培养细胞聚集体的容器,可以提及在上述(2)中作为可以用于形成多能干细胞聚集体的容器的那些。在一个实施方案中,使用具有平底的容器,如培养皿。
步骤(ii)中的悬浮培养进行足以诱导中脑-后脑边界神经祖先细胞形成神经上皮结构的期间。通过进行步骤(ii),可以在细胞聚集体中形成包含γ-氨基丁酸能神经祖先细胞和小脑颗粒细胞祖先细胞的神经上皮结构,即,小脑板组织。所述神经上皮结构可以是上皮管状组织。包含γ-氨基丁酸能神经祖先细胞和小脑颗粒细胞祖先细胞的神经上皮结构的形成可以通过检测包含γ-氨基丁酸能神经祖先细胞标记阳性的细胞和小脑颗粒细胞祖先细胞标记阳性的细胞的神经上皮结构(即,γ-氨基丁酸能神经祖先细胞标记阳性且小脑颗粒细胞祖先细胞标记阳性的神经上皮结构)的形成而证实,例如,通过使用对γ-氨基丁酸能神经祖先细胞标记(例如,kirrel2,ptf1a,sox2)特异性的抗体和对小脑颗粒细胞祖先细胞标记(例如,atoh1,barhl1)特异性的抗体的免疫组织化学进行检测。例如,进行步骤(ii)中的悬浮培养,直至不少于30%、优选不少于50%、更优选不少于70%的包含在培养物中的细胞聚集体中的神经上皮结构(例如,n-钙黏着蛋白阳性的神经上皮结构)变成γ-氨基丁酸能神经祖先细胞标记阳性的且小脑颗粒细胞祖先细胞标记阳性的。由于培养期间可能取决于多能干细胞的动物物种而变化;以及培养条件如培养基组成而变化,其通常不能指定。然而,当使用人多能干细胞时,由于在步骤(ii)中自悬浮培养起始起约3天内开始形成神经上皮结构,因此,悬浮培养的培养期间不少于3天。步骤(ii)的培养期间没有上限,只要维持包含γ-氨基丁酸能神经祖先细胞和小脑颗粒细胞祖先细胞的神经上皮结构即可。当培养期间过长时,细胞聚集体的脆弱性增加,并且所述细胞聚集体可能会瓦解。因此,培养期间通常在40天内,优选在32天内。
在一个实施方案中,神经上皮结构具有顶端-基底极性。所述顶端-基底极性可以通过使用顶端标记(例如,pkcζ)和针对基底标记的抗体的免疫组织化学分析来鉴定。当所述神经上皮接哦故是上皮管状组织时,顶端侧面向管腔(顶端侧向内)。
此处,当上文提及的步骤(i)包括用第二成纤维细胞生长因子进一步处理所述人多能干细胞聚集体或源自其的人细胞聚集体时,要在步骤(ii)中得到的细胞聚集体中的小脑板组织(神经上皮结构)获得背-腹极性。更具体地,在每个神经上皮结构中,对小脑神经祖先细胞标记(例如,kirrel2,ptf1a,atoh1,skor2)(在胚胎发育中,它们表达在神经管的背侧)阳性的细胞位于所述细胞聚集体的外侧,并且对腹侧标记(例如,nkx6.1,foxa2)阳性的细胞位于所述神经上皮结构内腔对侧的相对区域上。即,可以在体外在所述细胞聚集体中重现胚胎发育中的具有沿着神经管背腹轴的极性的结构。
当在步骤(i)中不进行使用第二成纤维细胞生长因子的处理时,大部分的细胞聚集体具有小玫瑰花结神经上皮结构。当进行使用第二成纤维细胞生长因子的处理时,促进神经上皮结构的形成,并且大部分(例如,不少于70%)的细胞聚集体包含较大的扁平-卵形的神经上皮结构。
在一个实施方案中,步骤(ii)包括在悬浮培养中用gdf7处理包含中脑-后脑边界神经祖先组织的人细胞聚集体或源自其的人细胞聚集体。用gdf7处理促进向小脑颗粒细胞祖先细胞(例如,atoh阳性的细胞)的分化,和菱唇的形成。
gdf7是一种已知的细胞因子,并且其氨基酸序列也是已知的。要用于本发明的gdf7通常是哺乳动物gdf7。关于哺乳动物,可以提到上文提及的那些。尽管可以使用任意哺乳动物的gdf7,只要能够实现本发明的目的即可,但是优选使用与要培养的细胞相同物种的哺乳动物的gdf7。例如,使用啮齿动物(小鼠、大鼠等)或灵长动物(人等)的gdf7。代表性的人gdf7的氨基酸序列的实例包括ncbi登记号np_878248.2(2014年1月26日更新),即所述氨基酸的第322个到第450个氨基酸的部分序列(成熟的人gdf7)等。
用gdf7处理细胞聚集体的时机和持续时间没有特别限制,只要促进向小脑颗粒细胞祖先细胞的分化即可。为了有效地促进向小脑颗粒细胞祖先细胞的分化,优选在自细胞聚集体的悬浮培养起始起的2天内,更优选自悬浮培养起始起的1天内,进一步优选自悬浮培养起始时,向步骤(ii)的培养基中添加gdf7,从而用gdf7处理所述细胞聚集体。使用gdf7的处理期间通常不小于2天,优选不小于7天。使用gdf7的处理期间的上限没有特别限制,只要在所述细胞聚集体内向小脑板组织的分化是可能的即可。为了避免对分化的不可预料的不利影响,其通常在21天内,优选在14天内。在使用gdf7的处理时期过去后,从培养基中去除gdf7。在使用gdf7处理期间gdf7在培养基中的浓度是能够促进向小脑颗粒细胞祖先细胞分化的浓度。例如,该浓度通常不小于10ng/ml,优选不小于50ng/ml,更优选不小于100ng/ml。gdf7浓度的上限没有特别限制,只要没有不利地影响向小脑颗粒细胞祖先细胞的分化即可。从培养成本的方面看来,其通常不超过1000ng/ml,优选不超过500ng/ml,更优选不超过300ng/ml。gdf7浓度在处理期间内可以变化。例如,在后半阶段浓度可以减半。
在一个实施方案中,步骤(ii)包括在悬浮培养中用sdf1处理包含中脑-后脑边界神经祖先组织的人细胞聚集体或源自其的人细胞聚集体。使用sdf1的处理促进在小脑板组织中形成神经上皮结构。特别地,对于形成连续的小脑板神经上皮是有效的。另外,可以形成与神经上皮结构连续的菱唇。
sdf1是一种已知的趋化因子,还称为cxcl12,并且其氨基酸序列也是已知的。用于本发明的sdf1通常是哺乳动物sdf1。哺乳动物的实例包括上文提及的那些。可以使用任意哺乳动物的sdf1,只要能够实现本发明的目的即可。优选地,使用与培养的细胞相同物种的哺乳动物的sdf1。例如,使用啮齿动物(小鼠、大鼠等)或灵长动物(人等)的sdf1。代表性的人sdf1的氨基酸序列的实例包括ncbi登记号np_001171605.1(2014年5月25日更新),即通过从所述氨基酸序列去除n端信号序列(1-22)得到的氨基酸序列(成熟的人sdf1)等。
用sdf1处理所述细胞聚集体的时机和持续时间没有特别限制,只要促进小脑板组织中神经上皮结构的形成即可。由于sdf1是参与大脑内细胞的定位的因子,因此,优选地在所述细胞聚集体中以某种程度形成包含γ-氨基丁酸能神经祖先细胞和小脑颗粒细胞祖先细胞的神经上皮结构(小脑板组织)的阶段用sdf1处理所述细胞聚集体。从这些方面看来,优选地在自步骤(ii)中细胞聚集体悬浮培养起始起第4天-第10天的任意时间点,更优选地在第6天-第8天的任意时间点,将sdf1添加到培养基中,从而用sdf1处理所述细胞聚集体。使用sdf1的处理期间通常不小于2天,优选不小于7天。使用sdf1的处理期间的上限没有特别限制,只要在所述细胞聚集体中向小脑板组织的分化是可能的即可。为了避免对分化的不可预料的不利影响,其通常在21天内,优选在14天内。在使用sdf1的处理时期过去后,从培养基中去除sdf1。在使用sdf1处理期间sdf1在培养基中的浓度是能够促进神经上皮结构形成的浓度。例如,该浓度通常不小于约50ng/ml,优选不小于100ng/ml。sdf1浓度的上限没有特别限制,只要促进神经上皮结构的形成即可。从培养成本方面看来,其通常不超过1000ng/ml,优选不超过500ng/ml。sdf1浓度在处理期间内可以变化。例如,在后半阶段浓度可以减半。
在优选的实施方案中,从步骤(ii)中悬浮培养开始起直到开始用sdf1处理,不用sdf1刺激细胞聚集体。即,从步骤(ii)中悬浮培养开始起直到开始用sdf1处理,用于悬浮培养的培养基优选基本上不含sdf1。“基本上不含sdf1”意指培养基中sdf1的浓度低于用于促进神经上皮结构形成的浓度。在一个实施方案中,从步骤(ii)中悬浮培养开始起到开始用sdf1处理的期间内,sdf1在培养基中的浓度通常小于1ng/ml,优选小于0.1ng/ml,更优选小于0.01ng/ml。
在一个实施方案中,在步骤(i)的悬浮培养中,将多能干细胞聚集体或源自其的细胞聚集体用第二成纤维细胞生长因子(例如,fgf19)处理,并且,进一步地,在在步骤(ii)的悬浮培养中,将包含中脑-后脑边界神经祖先组织的细胞聚集体或源自其的细胞聚集体用sdf1处理。如上文所提及的,通过在步骤(i)中用第二成纤维细胞生长因子(例如,fgf19)处理,在步骤(ii)中得到的细胞聚集体中的小脑板组织(神经上皮结构)获得背-腹极性。具体而言,在每个神经上皮结构中,小脑神经祖先细胞标记-阳性的细胞位于所述细胞聚集体的外侧,并且腹侧标记-阳性的细胞位于所述神经上皮结构内腔对侧的相对区域上。通过用sdf1进一步处理包含具有背-腹极性的小脑板组织(神经上皮结构)的所述细胞聚集体,促进连续的小脑板神经上皮形成,并且在所述细胞聚集体的表面区可以形成连续的小脑神经上皮结构(例如,kirrel2阳性的神经上皮结构)。所述神经上皮结构具有这样的极性:顶端侧(例如,sox2+vz细胞,pkcζ阳性细胞)位于表面侧(细胞聚集体的表面),并且基底侧(例如,skor2+浦肯野祖先细胞)位于深部的部分。sdf1处理促进小脑神经上皮结构沿着顶端-基底轴层叠成三层,如在胚胎的早期小脑发育中观察到的,并且,从顶端到基底方向,产生脑室区(例如,apkc+,sox2+,ptf1a+,kirrel2+)、浦肯野细胞前体区(例如,skor2+,olig2+,gad+,lhx5+)和菱唇-来源的神经细胞区(例如,atoh1+,barhl1+)的三层结构。此外,其在连续的小脑神经上皮结构的边缘引起菱唇样组织的形成。所述菱唇样组织表现出卷曲的结构并且包含atoh1+细胞和barhl1+细胞。如上文所示,通过联合在步骤(i)中用第二成纤维细胞生长因子(例如,fgf19)处理和在步骤(ii)中用sdf1处理,可以形成具有更高级结构的小脑祖先组织。
在一个实施方案中,在步骤(i)的悬浮培养中,将多能干细胞聚集体或源自其的人细胞聚集体自悬浮培养起始起用rock抑制剂处理,自悬浮培养起始起用tgfβ信号抑制剂处理,自悬浮培养起始起第2-4天用第一成纤维细胞生长因子处理,并且自悬浮培养起始起第10-14天用第二成纤维细胞生长因子处理,并且进一步地,在步骤(ii)的悬浮培养中,将包含中脑-后脑边界神经祖先细胞的人细胞聚集体或源自其的人细胞聚集体自悬浮培养起始起第4-10天用sdf1处理。用rock抑制剂的处理期间是足以抑制由分散诱发的多能干细胞的细胞死亡的期间(例如,持续12小时(2天,4天,或7天)–21天(或14天))。用tgfβ信号抑制剂的处理期间是足以抑制中胚层分化并且促进向神经外胚层分化的期间(例如,持续2天(或7天)–21天(或14天))。用第一成纤维细胞生长因子处理的处理期间是足以促进多能干细胞向中脑-后脑边界神经祖先组织分化的期间(例如,持续2天(或5天)–19天(或12天))。用第二成纤维细胞生长因子处理的处理期间是足以对神经上皮结构赋予沿着神经管背腹轴的极性的期间(例如,持续2天(或4天)–14天(或11天或7天))。使用sdf1的处理期间是足以促进小脑板组织中形成神经上皮结构的期间(例如,持续2(或7天)–21天(或14天))。
用于本发明的gdf7和sdf1优选是分离的。包含在用于悬浮培养的培养基中的分离的gdf7和sdf1是外源添加到所述培养基中的。因此,在一个实施方案中,本发明包括提供分离的gdf7/分离的sdf1中的每一种的步骤。在一个实施方案中,本发明包括向步骤(ii)中用于悬浮培养的培养基中外源添加分离的gdf7/分离的sdf1中的每一种的步骤。
(4)诱导浦肯野细胞、高尔基细胞或中间神经元
由于通过上文提及的本发明的制备方法得到的包含小脑板组织的细胞聚集体包含γ-氨基丁酸能神经祖先细胞,因此,可以通过在分化条件下进一步培养所述细胞聚集体而产生浦肯野细胞、高尔基细胞或中间神经元。具体而言,从通过上文所述的本发明的制备方法得到的包含小脑板组织的细胞聚集体得到γ-氨基丁酸能神经祖先细胞,并将所述γ-氨基丁酸能神经祖先细胞与哺乳动物小脑颗粒细胞祖先细胞共同培养,并且,所述γ-氨基丁酸能神经祖先细胞被诱导,由所述γ-氨基丁酸能神经祖先细胞向浦肯野细胞、高尔基细胞或中间神经元分化。
γ-氨基丁酸能神经祖先细胞可以提供为多能干细胞衍生的包含γ-氨基丁酸能神经祖先细胞的细胞群体,优选地,作为分离的γ-氨基丁酸能神经祖先细胞。γ-氨基丁酸能神经祖先细胞的分离可以使用针对γ-氨基丁酸能神经祖先细胞特有的标记的抗体通过facs进行。作为γ-氨基丁酸能神经祖先细胞特有的标记,可以提及kirrel2等。
由于菱唇中大量包含小脑颗粒细胞祖先细胞,因此,通过分离非人哺乳动物(例如,小鼠)胚胎的菱唇并且将其分散在适当的细胞分散溶液(例如,胰蛋白酶-edta,tryple等)中而得到的菱唇来源的细胞可以用作小脑颗粒细胞祖先细胞。
γ-氨基丁酸能神经祖先细胞和小脑颗粒细胞祖先细胞的共同培养可以通过以适当的比例(例如,γ-氨基丁酸能神经祖先细胞:小脑颗粒细胞祖先细胞=1:5-1:20)混合γ-氨基丁酸能神经祖先细胞和小脑颗粒细胞祖先细胞并将该混合物在用细胞外基质(如层粘连蛋白)包被的培养容器上培养而进行。关于用于所述培养的培养基,可以使用多种用于培养小脑神经细胞的培养基。优选地向所述培养基中添加n2和三-碘甲腺原氨酸。另外,可以向培养基中加入胞嘧啶β-d-阿拉伯呋喃糖苷(ara-c)(tabata,t.等人,j.neurosci.method.104,45-53)。例如,可以使用补充有n2和三-碘甲腺原氨酸的dmem/hamf-12等。
尽管培养期没有特别限制,只要其是足以使γ-氨基丁酸能神经祖先细胞向浦肯野细胞、高尔基细胞或中间神经元分化的充分期间即可,但是其通常不小于15天。
向浦肯野细胞或中间神经元的分化可以通过评价浦肯野细胞、高尔基细胞或中间神经元特有的标记的表达、细胞形、电生理特性等而确认。本发明的方法可以包括所述确认步骤。关于浦肯野细胞特异性标记,可以提及l7/pcp2、钙结合蛋白等。关于高尔基细胞的标记,可以提及神经颗粒蛋白(neurogranin)等。关于中间神经元的标记,可以提及小清蛋白(parvalbumin)等。
在向浦肯野细胞的分化过程中,首先产生具有轴突和树突的浦肯野特异性的标记(l7/pcp2,钙结合蛋白)-阳性的细胞。通过进一步培养所述细胞,成熟继续,形成树突棘,表达glurdeta2,并且由此产生成熟的浦肯野细胞。成熟的浦肯野细胞表现出特征性电生理特性,包括:(1)自发性动作电位的反复触发,(2)超极化-激活的阳离子通道电流(ih电流),和(3)nmda受体-不依赖性的ampa受体依赖性的谷氨酸接收。
可以通过从共同培养物中分离浦肯野细胞、高尔基细胞或中间神经元而得到浦肯野细胞或中间神经元。所述分离可以通过施用针对每种细胞特有的标记的抗体经由facs、淘选(panning)等进行。
关于γ-氨基丁酸能神经祖先细胞和小脑颗粒细胞祖先细胞的共同培养,可以参考muguruma,k.等人,natureneurosci.13,1171-1180,2010。
(5)诱导小脑颗粒细胞
由于通过上文提及的本发明的制备方法得到的包含小脑板组织的细胞聚集体包含小脑颗粒细胞祖先细胞,因此,可以通过将所述祖先细胞在分化条件下进一步培养而产生小脑颗粒细胞。具体而言,从通过上文提及的本发明的制备方法得到的包含小脑板组织的细胞聚集体得到小脑颗粒细胞祖先细胞,将所述小脑颗粒细胞祖先细胞与哺乳动物小脑细胞共同培养,从而诱导小脑颗粒细胞祖先细胞向小脑颗粒细胞分化。
小脑颗粒细胞祖先细胞可以提供为多能干细胞衍生的包含小脑颗粒细胞祖先细胞的细胞群体,或作为分离的小脑颗粒细胞祖先细胞。小脑颗粒细胞祖先细胞的分离可以使用针对小脑颗粒细胞祖先细胞特有的标记的抗体通过facs、淘选、磁珠等进行。关于小脑颗粒细胞祖先细胞特异性的标记,可以提及atoh1、barhl1、pax6等。
小脑细胞可以通过分离非人哺乳动物(例如,小鼠)小脑并且将其用适当的细胞分散溶液(例如,胰蛋白酶-edta,tryple等)分散而得到。优选地,使用新生的(例如,在出生后2天内)非人哺乳动物小脑。
小脑颗粒细胞祖先细胞与小脑细胞的共同培养可以通过以适当的比例(例如,小脑颗粒细胞祖先细胞:小脑细胞=1:5-1:40)混合小脑颗粒细胞祖先细胞与小脑细胞并将该混合物在用细胞外基质(如层粘连蛋白)包被的培养容器上培养而进行。关于用于所述培养的培养基,可以使用多种用于培养小脑神经细胞的培养基。优选地向所述培养基中添加n2。例如,可以使用补充有n2和血清等的dmem/hamf-12。
尽管培养期没有特别限制,只要其是足以使小脑颗粒细胞祖先细胞向小脑颗粒细胞分化的充分期间即可,但是,其通常为约3-10天(优选地,5-8天)。
向小脑颗粒细胞的分化可以通过评价小脑颗粒细胞特有的标记的表达、细胞形等而确认。本发明的方法可以包括所述确认步骤。关于小脑颗粒细胞-特异性的标记,可以提及barhl1、pax6、map2等。
由于分化的小脑颗粒细胞表现出这样的特征性移动模式:其中细胞沿着神经突移动,然后细胞的移动方向变为与该点的切线垂直的方向,因而,可以将具有此类移动模式的轴突的细胞鉴定为小脑颗粒细胞。
小脑颗粒细胞可以通过从共同培养物中分离小脑颗粒细胞而得到。分离可以通过使用针对小脑颗粒细胞特有的标记的抗体经由facs、淘选等进行。
(6)细胞聚集体、分离的小脑祖先组织、组成小脑祖先组织的细胞、组成小脑的细胞以及它们的应用
在另一方面,可以从通过上文提及的本发明的制备方法得到的细胞聚集体分离小脑祖先组织(小脑板组织等)。另外,可以通过用适当的细胞分散溶液分散小脑祖先组织而分离组成小脑祖先组织的多种细胞。本发明提供通过上文提及的本发明的制备方法得到的细胞聚集体、小脑祖先组织和组成小脑祖先组织的细胞。此外,本发明还提供通过上述(4)和(5)所述的方法得到的组成小脑的细胞(浦肯野细胞、高尔基细胞、中间神经元、颗粒细胞、深部小脑核)。
通过本发明得到的细胞聚集体、小脑祖先组织、组成小脑祖先组织的细胞和组成小脑的细胞可以用于移植疗法。例如,通过本发明的方法得到的细胞聚集体、小脑祖先组织、组成小脑祖先组织的细胞或组成小脑的细胞可以用作治疗药物用于由小脑紊乱导致的疾病,或用于补充小脑损伤病症中相应的被损伤的部分。通过对具有由小脑紊乱导致的疾病的患者或具有小脑损伤病症的患者移植通过本发明得到的细胞聚集体、小脑祖先组织、组成小脑祖先组织的细胞或组成小脑的细胞,可以治疗所述由小脑紊乱导致的疾病或小脑的损伤病症。由小脑紊乱导致的疾病的实例包括症状性小脑皮层生活力缺损(symptomaticcerebellarcorticalabiotrophy),橄榄体脑桥小脑萎缩(olivopontocerebellaratrophy),夏伊-德雷格综合征(shy-dragersyndrome),脊髓小脑性共济失调(spinocerebellarataxia,sca)(例如,遗传性脊髓小脑性共济失调(hereditaryspinocerebellarataxia),偶发性脊髓小脑性共济失调(sporadicspinocerebellarataxia)(例如,多系统萎缩(multiplesystematrophy,msa)),皮质小脑萎缩(corticalcerebellaratrophy,cca))),丹迪-沃克综合征(dandy-walkersyndrome)等。经常在儿童中观察到的髓母细胞瘤(medulloblastoma)常常在小脑蚓中发展,并且小脑中的此类髓母细胞瘤也包括在由小脑紊乱导致的疾病中。此外,这些小脑损伤病症的实例包括小脑切除的患者,在对小脑中的肿瘤辐照后的患者、外伤。
在移植疗法中,由于组织相容性抗原的差异导致的移植物排斥(graftrejection)通常构成问题,然而,该问题可以通过使用由移植接受体的体细胞建立的多能干细胞(例如,诱导的多能干细胞)而得到解决。即,在优选的实施方案中,使用由接受体的体细胞建立的多能干细胞(例如,诱导的多能干细胞)作为本发明的方法中的多能干细胞,并且产生对于所述接受体来说是免疫学自身的细胞聚集体、小脑祖先组织、组成小脑祖先组织的细胞或组成小脑的细胞并将植入到所述接受体中。
此外,通过本发明的方法得到的细胞聚集体、小脑祖先组织、组成小脑祖先组织的细胞或组成小脑的细胞可以用于筛选和评价用于治疗由小脑紊乱导致的疾病或用于小脑损伤病症的药物。具体地,由于通过本发明获得的小脑祖先组织具有与活体内的小脑祖先组织的结构极相似的高等结构,其可以用于筛选用于由小脑紊乱导致的疾病、小脑损伤病症的治疗药,检测药物产品的副作用和毒性,并且开发用于小脑疾病的新治疗方法等。例如,从具有前述由小脑紊乱导致的疾病、特别是由小脑紊乱导致的遗传病的人患者制备ips细胞,并且使用该ips细胞,通过本发明的方法制备包含小脑祖先组织的细胞聚集体。包含在所得到的细胞聚集体中的小脑祖先组织可以在体外重现引起患者疾病的小脑紊乱。在存在或不存在(阴性对照)测试物质的条件下,培育包含紊乱的小脑祖先组织的细胞聚集体或由所述细胞聚集体分离的紊乱的小脑祖先组织。然后,将用所述测试物质处理的所述细胞聚集体或小脑祖先组织的紊乱程度与阴性对照进行比较。结果,可以选择降低紊乱水平的测试物质作为用于由所述紊乱导致的疾病的治疗药的候选物质。另外,通过向作为用于筛选的所述细胞聚集体或小脑祖先组织的来源的患者施用治疗有效量的所选择的物质,可以治疗该患者中由小脑紊乱导致的疾病,此时具有证实的作为药物的安全性的物质用作测试物质。此外,使用包含紊乱的小脑祖先组织的细胞聚集体或由所述细胞聚集体分离的紊乱的小脑祖先组织,可以进行药物产品的毒性测试和开发用于由所述紊乱导致的疾病的新治疗方法。
通过参考下述实施例更详细地解释本发明,所述实施例仅是示例,并不限制本发明的范围。
[实施例]
[实施例1]由人多能干细胞立体形成中脑-后脑边界神经祖先组织
(方法)
使用通过常规方法在mef上进行维持培养的人es细胞(khes-1)。为了通过用快速重聚无血清漂浮培养胚状体样聚集体(sfebq法)分化人es细胞,按照nakano等人(cellstemcell,10(6),771-785,2012)的方法,将人es细胞酶解分散成单个细胞,并且使用低细胞粘附性v-底96孔平板(sumitomobakelite)重聚。每孔接种6,000个细胞,并且在37℃在5%co2下在作为分化培养基的cdm培养基[不含生长因子的化学合成培养基(无生长因子的化学成分确定的培养基(growth-factor-freechemicallydefinedmedium);gfcdm;wataya等人,proc.natl.acad.sci.usa,105,11796-11801,2008),所述培养基补充有胰岛素(7μg/ml)和脱铁运铁蛋白(15μg/ml)]中培养。
将接种日视为分化培养的第0天。从第0天到第7天,添加10μmy-27632(rock抑制剂;在分散过程中的细胞死亡的抑制剂:watanabe等人,natureneuroscience,8,288-296,2007)和10μmsb431542(tgf-β抑制剂)。从培养的第2天至第7天,向培养基中添加fgf2至50ng/ml的终浓度。在第7天,将1/3的培养基更换为不含y-27632、sb431542和fgf2的分化培养基。在培养的第14天,将培养基完全替换为不含y-27632、sb431542和fgf2的分化培养基。将细胞聚集体固定并切片,并且通过免疫荧光法和定量pcr法分析组织分化。
(结果)
到自分化培养起始起的第14天,细胞聚集体不少于90%的细胞分化成n-钙黏着蛋白阳性的神经祖先细胞。在第14天观察到吻侧后脑区标记gbx2的表达,并且,在第21天,不少于80%的n-钙黏着蛋白阳性细胞是gbx2阳性的。在这时,几乎没有观察到作为中脑吻侧区标记的otx2的表达(图1)。另外,在沿着神经管首尾轴的区域特有的基因中,通过添加fgf2,中脑-后脑边界标记en2、gbx2的表达显著增加(图2)。在自培养起始起的第14天和第21天,还发现en2和gbx2的表达由于fgf2增加。尽管fgf2抑制前脑标记six3和otx2的表达(图2),但是其增加fgf8和wnt1的表达,fgf8和wnt1被认为参与在胚胎中脑-后脑边界形成的峡部形成体的功能(第10和14天)。这些结果表明,以这种方法,fgf2促进中脑-后脑边界中神经祖先细胞的自组织。
在上文提及的方法中,由于不添加y-27632时,人es细胞不形成聚集体,表明rock抑制剂提供抑制由于分散引起的细胞死亡以及支持细胞聚集体形成和多能干细胞的生长的作用。
sb431542在10-30μm范围内的浓度诱导向中脑-后脑边界中神经祖先细胞的分化。也在3μm的浓度观察到向神经祖先细胞的分化诱导。
fgf2甚至在20ng/ml和100ng/ml的浓度也促进向中脑-后脑边界中神经祖先细胞的分化。处于用于es细胞维持培养的浓度(5-10ng/ml)的fgf2没有表现出促进向中脑-后脑边界中神经祖先细胞的分化。甚至当自第0天或第1天向培养基中添加fgf2时,没有观察到促进向中脑-后脑边界中神经祖先细胞的分化。第2-14天、第3-7天、第4-7天的fgf2的添加各自也表现出对向中脑-后脑边界中神经祖先细胞的分化的促进作用,并且第2-7天的fgf2的添加表现出最高的作用。当使用fgf8b替代fgf2时,促进向中脑-后脑边界中神经祖先细胞的分化;然而,该作用弱于fgf2。
当在第7天不进行培养基更换时,细胞聚集体培养物可以维持至第14天,并且向中脑-后脑边界中的神经祖先细胞的分化是可能的;然而,细胞聚集体的脆弱性增加并且细胞聚集体变得脆弱。
[实施例2]具有来自人多能干细胞的连续的上皮结构的小脑板组织的自组织
(方法)
按照实施例1的方法培养人多能干细胞聚集体,在第21天及之后,将这些聚集体转移到低细胞粘附性的10cm平皿中,并且在神经培养基(neurobasal/glutamaxi/n2,均来自lifetechnologies)中培养。在培养的第28天,将总量的培养基更换为相同的神经培养基,并且在培养的第35天通过免疫荧光法分析组织的分化。
(结果)
在一个聚集体中形成多个n-钙黏着蛋白阳性的神经上皮结构,并且不少于70%的神经上皮细胞是小脑γ-氨基丁酸能神经祖先细胞-特异性kirrel2阳性的(图3左图,中图)。不少于80%的表达kirrel2的神经上皮结构也表达γ-氨基丁酸能神经祖先细胞-特异性的ptf1a(图3,右图)。该kirrel2阳性的神经上皮结构也是en2阳性的。这些结果清楚地表明,通过实施例1的方法诱导分化的中脑-后脑边界区祖先细胞被促进自组织成小脑神经板以及形成神经上皮结构。
甚至当将用神经培养基更换的时机设定为第14天、第18天和第28天时,形成与当在第21天更换时得到的相似的n-钙黏着蛋白阳性的神经上皮结构。当在第21天更换时,形成最有组织性的神经上皮结构。
当在第7-14天、第14-21天或第21-35天添加hedgehog抑制剂环杷明(1μm)时,向kirrel2阳性细胞的分化没有进一步提高。
[实施例3]通过分散培养人多能干细胞衍生的小脑板组织进行的浦肯野细胞和小脑中间神经元的分化
(方法)
按照实施例1和2的方法培养人多能干细胞聚集体,并且,在培养的第35天,使用针对小脑γ-氨基丁酸能神经祖先细胞标记kirrel2的抗体经由facs分离kirrel2阳性细胞。将分离的kirrel2阳性细胞和由第14天胚胎小鼠的上菱唇制备的小脑颗粒细胞祖先细胞通过细胞分散酶(tryple,lifetechnologies)分散成单个细胞,并且在用聚d-赖氨酸/层粘连蛋白包被的盖玻片上在dmem/f12/10%fbs培养基中(5%co2,37℃)培养。在共同培养中,相对于小鼠来源的小脑颗粒细胞祖先细胞(10体积),混合人多能干细胞衍生的kirrel阳性细胞(1体积)。在6–12小时后,添加dmem/f12/n2/bsa/三-碘甲腺原氨酸(t3),以将fbs浓度减少为约0.8%。然后,以每周一次的频率,将一半培养基更换为dmem/f12/n2/bsa/三-碘甲腺原氨酸(t3)/胞嘧啶β-d-阿拉伯呋喃糖苷(ara-c),以维持培养(muguruma等人,natureneurosci.,13,1171-1180,2010)。在自共同培养起始起的第15-115天,通过免疫荧光法分析细胞成熟。
(结果)
按照实施例1和2的方法培养人多能干细胞聚集体,并且在第35天,使用抗-kirrel2抗体通过facs分离细胞。观察到几乎30%的暴露于fgf2的细胞是kirrel2阳性的(图4,右图)。
将分离的细胞与小鼠上菱唇衍生的细胞共同培养。在第15天(在分化诱导后,总天数50),观察到浦肯野细胞特异性标记l7/pcp2和钙结合蛋白的表达,并且在这些标记阳性细胞中观察到轴突延伸和不成熟的树突的形成(图5a)。在共同培养的第58天(总天数93),观察到l7阳性细胞的树突分支和延伸(图5b)。不仅在人es细胞的情形中,也在类似培养的人ips细胞(4个细胞系)的情形中发现此类l7阳性细胞的出现。此外,在共同培养的第110天(总天数145),可能观察到浦肯野细胞树突棘特异性glurdelta2的表达和树突棘的形态学清楚的形成(图5c,d)。也可能证实在树突棘中表达的glurdelta2与其配体cbln1结合(图5e)。在该共同培养系统中,分离的kirrel2阳性细胞主要分化成浦肯野细胞,但是它们中的一些在长期的共同培养后(58–113天)分化成类似的kirrel2阳性的γ-氨基丁酸能中间神经元高尔基细胞(图5f,神经颗粒蛋白阳性的细胞)、小清蛋白阳性的中间神经元。
[实施例4]在人多能干细胞衍生的小脑板组织中形成神经上皮和菱唇组织
(方法)
按照实施例1和2的方法培养人多能干细胞聚集体,并且,在培养的第35天,通过免疫荧光法分析组织分化。
(结果)
在培养的第35天,在kirrel2阳性的神经上皮组织中观察到小脑颗粒细胞祖先细胞特异性的atoh1阳性细胞(图6a,c)。atoh1阳性细胞还表达其他小脑颗粒细胞标记,如barhl1,sox2和zic1(图6b,d,e)。小脑神经细胞从kirrel2阳性的脑室区和atoh1阳性的菱唇产生。结果表明,按照实施例1和2的方法,诱导了人多能干细胞向kirrel2阳性的脑室区和atoh1阳性的菱唇的分化,并且形成了小脑板组织。
尽管从fgf2-处理的小鼠es细胞-衍生的神经上皮结构诱导atoh1阳性的细胞需要添加bmp4(muguruma等人,natureneurosci.,13,1171-1180,2010),但是从人多能干细胞诱导atoh1阳性的细胞无需添加bmp4。
[实施例5]从衍生自人多能干细胞的小脑板组织分化小脑颗粒细胞和小脑核细胞
(方法)
按照实施例1和2的方法培养人多能干细胞聚集体,并且在第21天及以后在神经培养基(neurobasal/glutamaxi/n2)中培养。在培养的第28天及以后,通过每周一次更换全部量的培养基来连续培养所述聚集体,并且在培养的第35天和第53天通过免疫荧光法分析。
另外,通过重聚培养系统分析人多能干细胞衍生的atoh1阳性细胞向小脑颗粒细胞的分化。即,按照上文提及的方法培养人多能干细胞,并且在第42–49天,使用细胞分散剂(tryple,lifetechnologies)分散成单个细胞。将pcag-gfp电穿孔到细胞中,从而标记所述细胞。另一方面,将从2日龄icr系统小鼠分离的小脑分散成单个细胞,并取其20个体积与1体积的用gfp标记的人多能干细胞衍生的神经祖先细胞混合。将细胞混合物离心形成细胞聚集体,将所述细胞聚集体在用聚d-赖氨酸/层粘连蛋白包被的盖玻片上在dmem/f12/n2/10%fbs(5%co2,37℃)中培养(muguruma等人,natureneurosci.,13,1171-1180,2010)。在重聚培养后,在第5天和第8天,通过免疫荧光法分析所述细胞。
(结果)
在培养的第35天,barhl1单个细胞位于神经上皮组织中共表达barhl1和atoh1的细胞的外侧,并且lhx2阳性的细胞进一步位于其最外侧(图7a,b)。这表示atoh1阳性的菱唇衍生的小脑神经祖先细胞在人多能干细胞衍生的小脑板组织中移动,并且向颗粒细胞祖先细胞(barhl1)和小脑核祖先细胞(lhx2)的分化持续进行。此外,在培养的第53天,共表达菱唇衍生的小脑核细胞祖先细胞标记tbr1和smi32的大细胞位于所述聚集体中(图7c)。
在重聚培养的第5天,gfp-标记的人多能干细胞衍生的细胞延伸长的神经突伸出所述细胞聚集体外(图8a)。gfp阳性细胞是神经细胞特异性标记map2阳性的,并且发现其细胞体(cellsoma)表达小脑颗粒细胞祖先细胞特异性的标记barhl1、pax6,并且沿着神经突移动(图8b,c)。在第8天,细胞体的移动方向从切线方向变为垂直方向(图8d)。证实所述改变移动方向的细胞也表达map2和pax6。这些结果表明,由于在重聚培养系统中它们重现来自菱唇的小脑颗粒细胞在小脑板表面层上以切线方向的移动,以及按照发育移动方向由所述切线方向变为指向小脑板更深部分的垂直方向的变化,因而可以诱导人多能干细胞向小脑颗粒细胞的分化。
[实施例6]通过添加fgf19促进具有背腹轴模式的小脑板组织和其周围组织的形成
(方法)
按照实施例1和2的方法培养人多能干细胞聚集体。在培养的第14天,以100ng/ml的终浓度添加fgf19。在第21天及以后,将细胞在神经培养基(neurobasal/glutamaxi/n2)中培养。在第28天,将全部量的培养基更换为相同的培养基,并且在第35天,通过免疫荧光法分析组织分化。
(结果)
当不添加fgf19时,在第35天在细胞聚集体中观察到两种不同类型的kirrel2阳性神经上皮结构。大部分细胞聚集体具有小玫瑰花结样神经上皮结构(图9a)。其余的细胞聚集体(-30%)包含少量更大的扁平-卵形神经上皮结构(图9b)。后一种类型的神经上皮是连续的并且更厚。有趣的是,关于每个细胞聚集体,作为小脑板神经上皮标记的kirrel2表达在扁平-卵形神经上皮结构的最外侧(图9b)。相反,细胞聚集体中的小玫瑰花结没有表现出具有明确的极性的kirrel2的定位(图9a)。
添加fgf19促进细胞聚集体中连续的扁平-卵形神经上皮结构的形成(图9c)。添加fgf19导致在人多能干细胞衍生的神经上皮结构中形成具有沿着神经管背腹轴的极性的结构。即,作为小脑神经祖先细胞标记并且表达在神经管背侧的kirrel2-、ptf1a-、skor2-阳性的细胞位于细胞聚集体的最外侧,并且占据每个神经上皮结构的1/3-1/2的区域。atoh1也在最外侧表达。相反,腹侧标记nkx6.1、foxa2在相对的区域(细胞聚集体的内侧)上表达(图10)。这些结果表明,在人多能干细胞的第三阶段培养中,fgf19促进具有背侧表面明确的背-腹极性的吻侧后脑神经管样结构的自形成(图11)。
尽管fgf19甚至在50ng/ml的浓度促进神经上皮结构中具有沿着神经管背腹轴的极性的结构的形成,但是,其效果(频率)约为在100ng/ml时的1/3。300ng/mlfgf19类似地促进背腹轴模式的形成。其效果(频率)是与在100ng/ml时相同的水平。甚至当在培养的第10天添加fgf19时,促进背腹轴模式的形成,但是效率低。当使用fgf8或fgf17替代fgf19时,如fgf19一样,促进背腹轴模式形成,但是效果弱于fgf19。
[实施例7]通过添加gdf7促进小脑板组织中菱唇的形成
(方法)
按照实施例6的方法培养人多能干细胞聚集体。在第21天,以100ng/ml的终浓度添加gdf7。将细胞在神经培养基(neurobasal/glutamaxi/n2)中连续培养。在第28天,将全部量的培养基更换为不含gdf7的相同的培养基,并且在第35天,通过免疫荧光法和定量pcr法分析所述细胞。
(结果)
添加gdf7促进人多能干细胞衍生的神经祖先组织中atoh1阳性细胞的表达(图12左图,中间图)。在基因水平上,其增加至添加fgf2的约220-倍,并且增加至添加fgf2的1.5-倍(图12,右图)。这些结果表明在培养的第21天添加gdf7促进菱唇的形成。
甚至在自培养的第14天添加gdf7时,诱导atoh1阳性的细胞;然而,细胞聚集体的生长被抑制,细胞聚集体的尺寸变小,并且神经上皮结构趋向瓦解。在第28天及以后,甚至在没有从培养基中去除gdf7的条件下,没有发现对菱唇形成的不利影响。
在小鼠中,已知bmp4促进菱唇的形成。然而,在上文提及的检测系统中,使用bmp4替代gdf7不能诱导从人多能干细胞形成菱唇。这表明,在小鼠与人之间,在体外从多能干细胞诱导菱唇所需要的因子是不同的,并且gdf7对于在人中形成菱唇是重要的,并且gdf7不能用bmp4替代。
[实施例8]通过添加sdf1促进小脑板组织中菱唇的形成和小脑板3层结构的形成
(方法)
按照实施例6的方法培养人多能干细胞聚集体。在第21天及以后,将细胞在神经培养基(neurobasal/glutamaxi/n2)中培养。在第28天,将全部量的培养基更换为相同的培养基,并且以300ng/ml的终浓度添加sdf1。在第35天,通过免疫荧光法分析组织分化。
(结果)
在不添加sdf1的条件下,检查在大的扁平-卵形神经上皮的自形成中的时程变化(时间方面)。在第21天,在细胞聚集体中形成的神经组织几乎不表现出上皮形成或顶端-基底极性(图13a)。直到第24-28天,形成具有顶端-基底极性的神经上皮结构;然而,大部分是小玫瑰花结(图13b,c)。到第35天,神经上皮玫瑰花结转变为大的扁平-卵形结构,其顶端侧位于内侧(顶端朝内)(图13d)。
添加sdf1促进连续的kirrel2阳性神经上皮结构的形成(图14a-c)。与不用sdf1处理的神经上皮不同,sdf1处理的小脑神经上皮(kirrel2+)在细胞聚集体的表面区域上连续形成,顶端侧位于最外侧(顶端朝外)(图14a和b;与该观点一致,sox2+脑室区细胞位于神经上皮的表面侧,并且shor2+浦肯野祖先细胞位于更深的部分;图14c)。在kirrel2阳性神经上皮的边缘,形成包含sox2阳性神经祖先细胞的卷曲的组织,并且atoh1、barhl1阳性细胞位于此(图14d-f)。这些结果表明,添加sdf1促进由人多能干细胞形成kirrel2阳性的神经上皮结构,并且能够允许菱唇的连续构造。其进一步阐明,在连续的神经上皮中,从顶端表面连续自形成包括脑室区(kirrel2,sox2,ptf1a阳性的)、浦肯野细胞层(lhx5,oligo2阳性的)、和衍生自神经细胞层的菱唇(atoh1,barh1阳性的)的3层结构(图14g-l)。
sdf1在浓度为100ng/ml和500ng/ml时也促进小脑板组织中菱唇的形成和3层小脑板结构的形成。甚至在自第21天添加sdf1时,观察到与在自第28天添加的效果相似的效果。基质胶(matrigel)或层粘连蛋白不能替代sdf1。
从上述表明用fgf2和fgf19处理的人多能干细胞衍生的聚集体能够自形成具有背-腹极性的连续的神经上皮,并且另外的sdf1处理促进atoh+/barhl1+菱唇-样结构和层状小脑神经上皮结构(如在早期小脑发育中观察到的那些)的自发形成(图15)。
[实施例9]由人多能干细胞诱导的浦肯野细胞的功能分析
(方法)
按照实施例3的方法,由人多能干细胞聚集体分化成熟的浦肯野细胞。使用膜片钳技术,分析其电生理反应。
(结果)
可以观察浦肯野细胞特有的四个电生理反应(图16)。第一个是自发动作电位的反复触发。第二个是超极化-激活的阳离子通道电流(ih电流)。第三个是通过ampa受体抑制剂(nbqx)抑制微小的兴奋性突触后电流。第四个是微小的兴奋性突触后电流不受nmda受体抑制剂抑制。这些特征表明“谷氨酸接收不受nmda受体调控但是依赖于ampa受体”,这是浦肯野细胞的特征。
[工业适用性]
按照本发明,可以在体外从人多能干细胞有效地诱导小脑祖先组织。本发明可用于筛选用于由小脑紊乱导致的疾病的治疗药,检测副作用和毒性,并且开发用于所述疾病的新治疗方法等。
尽管已经着重于优选的实施方案描述了本发明,但是所述优选的实施方案可以进行改进,这对本领域技术人员是显而易见的。本发明旨在本发明可以通过除了本说明书中详细描述的那些之外的方法实施。因此,本发明包括附上的“权利要求书”的精神和范围所涵盖的所有改进。
在本文引用的任何公布(包括专利、专利申请和科技文献)中公开的内容通过引用完全结合在本文中,结合的程度如同它们在此公开一样。
本申请是基于在日本提交的专利申请号2014-182758(申请日:2014年9月8日),其内容完整地结合于此。
- 还没有人留言评论。精彩留言会获得点赞!