一种用超临界流体色谱制备烟草中具有抗菌活性的苯并异呋喃类化合物方法和应用与流程
本发明属于烟草化学技术领域,具体涉及一种从烟草中首次提取得到的苯并异呋喃类化合物。同时,本发明还涉及该化合物的制备方法和在抗菌接装纸中的应用。
背景技术:
烟草是世界上化学成分最为复杂的植物,次生代谢产物非常丰富,据1982年Dube和Green等报道,烟草中已鉴定出的化学成分就超过2549种,到2008年,Rodgman和perfetti的报道称,烟草、烟草代用品以及卷烟烟气中发现的化合物总数大约为8700种。目前,人们从烟草中鉴定出来的单体化学物质就超过3000多种,而且还有许多成分尚未鉴定出来。烟草除主要用于卷烟抽吸用途外,还可从中提取多种有利用价值的化学成分,从中发现有开发利用价值的先导性化合物。
呋喃类化合物在很多天然植物中存在,并且具有多种生物活性。据文献报道,该类化合物具有抗肿瘤,抗氧化,钙内流阻滞,血管紧张素II受体拮抗,腺苷Al受体拮抗,抗真菌、抗细菌活性和血小板聚集拮抗等药理作用。由于苯呋喃类化合物具有如此广谱的药理活性,国内外研究者对该类化合物进行了深入的研究,除从天然产物中寻找该类化合物外,还经过结构修饰而得到具有更优药理活性的化合物。为了研究这类化合物的构效关系,可进一步研究和开发更多的呋喃类化合物,从中寻找有效的先导化合物和活性基团。本发明从云南烤烟烟叶中分离得到了一种新的苯并异呋喃类化合物,该化合物至今尚未见到相关报道,值得一提的是该化合物具有显著的抗菌活性。
技术实现要素:
本发明的第一方面在于提供一种新的苯并异呋喃类化合物。该化合物从烤烟烟叶中分离得到,其分子式为C13H14O3,经过分析化学鉴定,其具有下述结构:
该化合物为浅黄色胶状物,本发明人将其中文名命名为2-羟基-1-异戊烯基-异苯并呋喃-5(3H)-酮,英文名为2-hydroxy-1-prenyl-isobenzofuran-5(3H)-one。
本发明第二方面提供了上述第一方面所述的苯并异呋喃类化合物的制备方法,该方法包括如下步骤:
(1)浸膏提取:以烟草叶片为原料,将其粉碎或切成小段,用第一溶剂浸泡并提取所述烟草3~5次,每次24h~72h,将提取液合并、过滤并浓缩后得到所述烟草提取物浸膏;其中所述第一溶剂是选自重量百分浓度80%~100%的甲醇或乙醇,或重量百分浓度60%~90%的丙酮,且第一溶剂:烟叶=2~4:1,重量比;
(2)硅胶柱层析:将上述烟草提取物浸膏用选自纯甲醇、纯乙醇或纯丙酮的第二溶剂溶解后与为烟草提取物浸膏的0.8~1.2重量倍的80~100目硅胶拌样,将拌样后的混合物再与为烟草提取物浸膏的2~4重量倍的160~300目硅胶混合后干法装柱,然后用体积比依次为1:0、20:1、9:1、8:2、7:3、6:4、1:1和1:2的一系列氯仿-丙酮溶液进行梯度洗脱,收集其中用体积比为7:3的氯仿-丙酮溶液洗脱时得到的洗脱液,称为第一洗脱液;
(3)超临界流体色谱分离纯化:将上述第一洗脱液通入超临界流体色谱进行分离纯化,该超临界流体色谱采用10mm×150mm,5μm的Silica 2-EP色谱柱,流动相二氧化碳/乙醇(85/15,质量比),流动相流速为20mL/min,紫外检测器检测波长为305nm,第一洗脱液液每次进样200~500μL,收集每次进样后色谱峰保留时间为11.5min时所对应的洗脱液,称为第二洗脱液,将该第二洗脱液脱除溶剂后即得所述苯并异呋喃类化合物。
在优选的实施方案中,本发明还包括以下进一步提纯的步骤:将在所述超临界流体色谱分离之后得到的所述苯并异呋喃类化合物再次溶于甲醇溶液,并以甲醇溶液为流动相,通过凝胶柱进行层析分离,以进一步分离纯化。
本发明的第三方面提供了所述苯并异呋喃化合物在抗菌接装纸中的应用。
附图说明
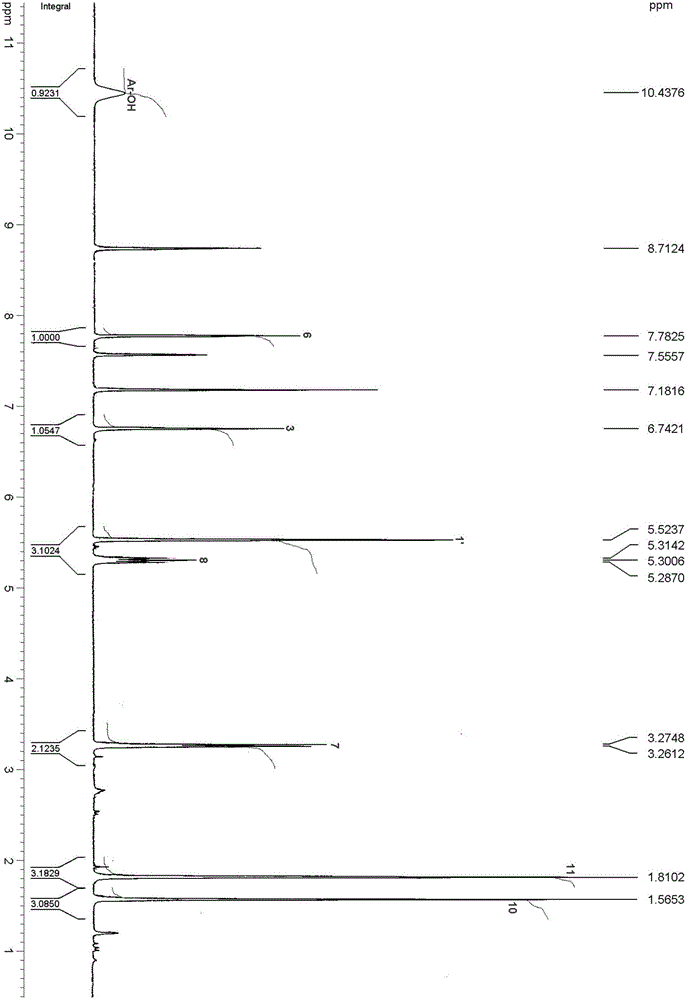
图1为本发明苯并异呋喃类化合物的核磁共振碳谱;
图2为本发明苯并异呋喃类化合物的核磁共振氢谱;
图3为本发明苯并异呋喃类化合物的主要HMBC相关。
具体实施方式
本发明制备得到的苯并异呋喃类化合物的结构通过以下方法进行测定。为浅黄色胶状物;HR-ESI-MS显示其准分子离子峰为241.0832[M+Na]+,结合1H-和13C-NMR谱确定分子式为C13H14O3,不饱和度为7。其红外光谱显示化合物中有羟基(3389cm-1)、羰基(1715和1650cm-1),和芳环(1610、1566和1467cm-1)信号,紫外光谱在305、272和210nm有最大吸收也证实化合物中存在芳环结构。从1H和13CNMR谱(数据归属见表-1)信号可以看出化合物中有一个1,2,4,5-四取代的苯环(δC 126.0s、159.2s、111.2d、144.7s、116.4s和130.2d;δH6.74s和7.78s)、一个异戊烯基(δC 27.2t、124.2d、133.3s、17.6q和25.8q;δH 3.27(d)6.8、5.30(t)6.8、1.57s和1.81s)、一个氧化亚甲基(δC 68.9t和δH 5.52s)、一个酯羰基(δC168.6s)、1个酚羟基(δH 10.44s)。根据H2-1′(δH 5.52)和C-2′(δC 168.6)、C-3(δC 111.2)、C-4(δC 144.7)、C-5(δC 116.4),H-3(δH 6.74)和C-1(δC 111.2),以及H-6(δH 7.78)和C-2′(δC 168.6)的HMBC相关可证实化合物为异苯并呋喃内脂类化合物[6],C-1'和C-2'通过氧原子连接形成了五元内酯环。化合物的母体骨架得到确认后,其他取代基团的位置也可通过HMBC相关确认;根据H-8(δH 5.30)和C-1(δC 126.0),H-7(δH 3.27)和C-1(δC 126.0)、C-2(δC 159.2)、C-6(δC 130.2),以及H-6(δH 7.78)和C-7(δC 27.2)的HMBC相关可证实异戊烯基连接在苯环的-1位,根据酚羟基氢(δH 10.44)和C-1(δC 126.0)、C-2(δC 159.2)和C-3(δC111.2)的HMBC相关可证实酚羟基取代在C-2位。至此化合物的(1)结构得以确定,该化合物命名为2-羟基-1-异戊烯基-异苯并呋喃-5(3H)-酮。
化合物的红外、紫外和质谱数据::为浅黄色胶状物;UV(MeOH),λmax(logε)305(2.60)、272(3.43)、210(3.86)nm;IR(KBr)λmax 3389、3086、2953、1715、1650、1610、1566、1467、1352、1278、1156、1055、920和775cm-1;ESIMS(正离子模式)m/z 241[M+Na]+;HRESIMS(正离子模式)m/z 241.0832[M+Na]+(计算值241.0841,C13H14NaO3)。
表-1化合物(1)的核磁共振数据(溶剂为C5D5N)
本发明化合物是首次被分离出来的,通过上述核磁共振和质谱测定方法确定了为苯并异呋喃类化合物,并表征了其具体结构。对该化合物进行了抗菌活性筛选,其对金黄色葡萄球菌、大肠杆菌、埃希菌、枯草杆菌、变形杆菌等具有显著的活性。
该化合物应用到卷烟接装纸中,和对照相比较,添加过本化合物的接装纸检测细菌总数、大肠菌群、金黄色葡萄球菌、绿脓杆菌、溶血性链球菌、真菌总数显著减少;对大肠杆菌(ATCC25922)、金黄色葡萄球菌(ATCC6538)的抑菌率全部达到92.2%以上,能够降低或消除卷烟接装纸及在贮存过程中细菌滋生和繁殖的可能性,另外,在卷烟吸食、传递过程中,该抗菌作用也能够对卷烟烟支上的接装纸被污染的微生物起到抑制作用。
与现有技术相比,本发明具有以下突出优点:(1)本发明的化合物原料易得,提取方法简单,容易分离得到;分子结构也简单,容易实现人工合成。(2)采用了常规柱层析和高效液相色谱结合的制备方法,化合物制备操作流程简单,所获得的本发明化合物纯度高,后续的工业化生产容易实现。(3)本发明化合物对动物无毒,使用安全,展现出良好的抗菌活性,对大肠杆菌、金黄色葡萄球菌等的抑菌率全部达到92.2%以上;应用于卷烟接装纸,能够对卷烟接装纸被污染的微生物起到抑制作用。卷烟接装纸直接和口腔接触,该化合物在卷烟接装纸中的使用可避免在卷烟在吸食、传递过程中被微生物污染,有效提高了卷烟的卫生和安全性。
本发明所用烟叶原料不受地区和品种限制,均可以实现本发明,下面以来源于云南中烟工业有限责任公司不同产地的烟叶原料,对本发明做进一步说明。除非另有说明,本发明中所采用的百分数均为质量百分数。
实施例1
制备苯并异呋喃类化合物C13H14O3,包括浸膏提取、硅胶柱层析、超临界流体色谱分离,具体采用以下步骤:
(1)浸膏提取:以烟草叶片为原料,将其粉碎或切成小段,用第一溶剂浸泡并提取所述烟草3~5次,每次24h~72h,将提取液合并、过滤并浓缩后得到所述烟草提取物浸膏;其中所述第一溶剂是选自重量百分浓度80%~100%的甲醇或乙醇,或重量百分浓度60%~90%的丙酮,且第一溶剂:烟叶=2~4:1,重量比;
(2)硅胶柱层析:将上述烟草提取物浸膏用选自纯甲醇、纯乙醇或纯丙酮的第二溶剂溶解后与为烟草提取物浸膏的0.8~1.2重量倍的80~100目硅胶拌样,将拌样后的混合物再与为烟草提取物浸膏的2~4重量倍的160~300目硅胶混合后干法装柱,然后用体积比依次为1:0、20:1、9:1、8:2、7:3、6:4、1:1和1:2的一系列氯仿-丙酮溶液进行梯度洗脱,收集其中用体积比为7:3的氯仿-丙酮溶液洗脱时得到的洗脱液,称为第一洗脱液;
(3)超临界流体色谱分离纯化:将上述第一洗脱液通入超临界流体色谱进行分离纯化,该超临界流体色谱采用10mm×150mm,5μm的Silica 2-EP色谱柱,流动相二氧化碳/乙醇(85/15,质量比),流动相流速为20mL/min,紫外检测器检测波长为305nm,第一洗脱液液每次进样200~500μL,收集每次进样后色谱峰保留时间为11.5min时所对应的洗脱液,称为第二洗脱液,将该第二洗脱液脱除溶剂后即得所述苯并异呋喃类化合物。
在优选的实施方案中,本发明还包括以下进一步提纯的步骤:将在所述超临界流体色谱分离之后得到的所述苯并异呋喃类化合物再次溶于甲醇溶液,并以甲醇溶液为流动相,通过凝胶柱进行层析分离,以进一步分离纯化。
实施例2
烟草样品来源于云南玉溪,品种为玉溪K326。将烟草取样2.0kg粉碎以95%的甲醇提取5次,每次提取24h,提取液合并,过滤,减压浓缩成浸膏,得浸膏105g。浸膏用重量比2.0倍量的纯甲醇溶解后用120g的100目粗硅胶拌样,0.6kg的160目硅胶装柱进行硅胶柱层析,用体积配比为1:0、20:1、9:1、8:2、7:3、6:4、1:1、1:2的氯仿-丙酮梯度洗脱,TLC监测合并相同的部分,得到8个部分,其中体积配比为7:3的氯仿-丙酮洗脱部分用超临界流体色谱进行分离纯化,该超临界流体色谱采用10mm×150mm,5μm的Silica 2-EP色谱柱,流动相二氧化碳/乙醇(85/15,质量比),流动相流速为20mL/min,紫外检测器检测波长为305nm,每次进样200μL,收集每次进样后色谱峰保留时间为11.5min时所对应的洗脱液,将洗脱液脱除溶剂后即得所述苯并异呋喃类化合物。所得产物再次用纯甲醇溶解,再以纯甲醇为流动相,用Sephadex LH-20凝胶柱层析分离,即得该新化合物。
实施例3
烟草样品来源于云南大理,品种为云烟200,将烟草取样3.5kg切碎,以95%的乙醇提取4次,每次提取48h,提取液合并,过滤,减压浓缩成浸膏,得浸膏250g。浸膏用重量比2.0倍量的纯甲醇溶解后用250g的80目粗硅胶拌样,1.2kg的200目硅胶装柱进行硅胶柱层析,用体积配比为1:0、20:1、9:1、8:2、7:3、6:4、1:1、1:2的氯仿-丙酮梯度洗脱,TLC监测合并相同的部分,得到8个部分,其中体积配比为7:3的氯仿-丙酮洗脱部分用超临界流体色谱进行分离纯化,该超临界流体色谱采用10mm×150mm,5μm的Silica 2-EP色谱柱,流动相二氧化碳/乙醇(85/15,质量比),流动相流速为20mL/min,紫外检测器检测波长为305nm,每次进样200μL,收集每次进样后色谱峰保留时间为11.5min时所对应的洗脱液,将洗脱液脱除溶剂后即得所述苯并异呋喃类化合物。所得产物再次用纯甲醇溶解,再以纯甲醇为流动相,用Sephadex LH-20凝胶柱层析分离,即得该新化合物。
实施例4
烟草样品来源于云南昆明,品种为红花大金元,将烟草取样5kg粉碎,以75%的丙酮用超声提取3次,每次提取72h,提取液合并,过滤,减压浓缩成浸膏,得浸膏380g。浸膏用重量比1.6倍量的纯甲醇溶解后用400g的90目粗硅胶拌样,2.4kg的180目硅胶装柱进行硅胶柱层析,用体积配比为1:0、20:1、9:1、8:2、7:3、6:4、1:1、1:2的氯仿-丙酮梯度洗脱,TLC监测合并相同的部分,得到8个部分,其中体积配比为7:3的氯仿-丙酮洗脱部分用超临界流体色谱进行分离纯化,该超临界流体色谱采用10mm×150mm,5μm的Silica 2-EP色谱柱,流动相二氧化碳/乙醇(85/15,质量比),流动相流速为20mL/min,紫外检测器检测波长为305nm,每次进样200μL,收集每次进样后色谱峰保留时间为11.5min时所对应的洗脱液,将洗脱液脱除溶剂后即得所述苯并异呋喃类化合物。所得产物再次用纯甲醇溶解,再以纯甲醇为流动相,用Sephadex LH-20凝胶柱层析分离,即得该新化合物。
实施例5
------化合物结构的鉴定
取实施例1-4制备的化合物,以上述方法制备得到的苯并异呋喃类化合物的结构通过以下方法进行测定。化合物为浅黄色胶状物;HR-ESI-MS显示其准分子离子峰为241.0832[M+Na]+,结合1H-和13C-NMR谱确定分子式为C13H14O3,不饱和度为7。其红外光谱显示化合物中有羟基(3389cm-1)、羰基(1715和1650cm-1),和芳环(1610、1566和1467cm-1)信号,紫外光谱在305、272和210nm有最大吸收也证实化合物中存在芳环结构。从1H和13CNMR谱(数据归属见表-1)信号可以看出化合物中有一个1,2,4,5-四取代的苯环(δC 126.0s、159.2s、111.2d、144.7s、116.4s和130.2d;δH 6.74s和7.78s)、一个异戊烯基(δC 27.2t、124.2d、133.3s、17.6q和25.8q;δH 3.27(d)6.8、5.30(t)6.8、1.57s和1.81s)、一个氧化亚甲基(δC 68.9t和δH 5.52s)、一个酯羰基(δC 168.6s)、1个酚羟基(δH 10.44s)。根据H2-1′(δH 5.52)和C-2′(δC168.6)、C-3(δC 111.2)、C-4(δC 144.7)、C-5(δC 116.4),H-3(δH 6.74)和C-1(δC 111.2),以及H-6(δH 7.78)和C-2′(δC 168.6)的HMBC相关可证实化合物为异苯并呋喃内脂类化合物[6],C-1'和C-2'通过氧原子连接形成了五元内酯环。化合物的母体骨架得到确认后,其他取代基团的位置也可通过HMBC相关确认;根据H-8(δH 5.30)和C-1(δC126.0),H-7(δH 3.27)和C-1(δC126.0)、C-2(δC 159.2)、C-6(δC 130.2),以及H-6(δH 7.78)和C-7(δC 27.2)的HMBC相关可证实异戊烯基连接在苯环的-1位,根据酚羟基氢(δH 10.44)和C-1(δC 126.0)、C-2(δC 159.2)和C-3(δC 111.2)的HMBC相关可证实酚羟基取代在C-2位。至此化合物的(1)结构得以确定,该化合物命名为2-羟基-1-异戊烯基-异苯并呋喃-5(3H)-酮。
实施例6
取实施例3制备的化合物,为黄色胶状物。测定方法与实施例5相同,确认实施例3制备的化合物为所述的苯并异呋喃类化合物——2-羟基-1-异戊烯基-异苯并呋喃-5(3H)-酮。
实施例7
取实施例4制备的化合物,为黄色胶状物。测定方法与实施例5相同,确认实施例4制备的化合物为所述的2-羟基-1-异戊烯基-异苯并呋喃-5(3H)-酮。
实施例8
取实施例1-4制备的任苯并异呋喃类化合物进行抗菌活性试验,试验情况如下:
体外抗菌实验用琼脂扩散法进行,首先将受试菌均匀地涂在普通琼脂培养基(牛肉膏、蛋白胨、氯化钠、血清、琼脂)的平板上,再将待测化合物(苯并呋喃丙素化合物用10mL DMSO溶解,加水稀释成50μg/mL的溶液)浸泡好的药片(直径5mm)放在带菌的培养基上,放入恒温箱内,于25℃孵育24-72h后观察抑菌圈大小。结果表明:本发明化合物对金黄色葡萄球菌、大肠杆菌、埃希菌、枯草杆菌、变形杆菌等具有很强的活性;抑制率超过92.2%。
实施例9
对本发明化合物进行了安全性评价,通过小鼠骨髓微核实验、Ames实验和TK基因突变实验,证明本发明化合物对动物无毒,使用安全。本化合物以50μg/mL的浓度加到卷烟接装纸上;按中华人民共和国《一次性使用卫生用品卫生标准》GB15979-2002的检测方法,取加过本发明化合物的卷烟用接装纸,2.0×3.0mm大小,检测细菌总数、大肠菌群、金黄色葡萄球菌、绿脓杆菌、溶血性链球菌、真菌总数。结果表明,添加过本发明化合物的接装纸菌落总数明显减少,本化合物对几种测试的细菌都有明显抑制作用,对大肠杆菌、金黄色葡萄球菌等的抑菌率全部达到92.2%以上。
- 还没有人留言评论。精彩留言会获得点赞!