提升活性的纤维素酶的制作方法
本发明关于一种纤维素酶,尤指一种提升活性的纤维素酶。
背景技术:
纤维素是植物细胞壁的主要组成之一,也是地球上主要生物质能(biomass)的来源,因此,现今许多能够有效分解纤维素的酶蛋白在不同工业上的应用也十分广泛。纤维素是由葡萄糖为单位,以β-1,4-糖苷键(β-1,4-glycosidicbond)所键结而成的长链多糖,这些多糖体共同组织排列成紧密的结晶型纤维素,进而抵抗外界的分解作用。然而,生物界中许多草食动物以及微生物等需要藉由将植物细胞壁中的多糖纤维素分解成可以被体内吸收的葡萄单糖,以作为生存能量来源。纤维素酶的催化机制主要是藉由酸碱反应,将连接两个单糖的β-1,4-糖苷键进行水解作用,进而分解多糖纤维素。而纤维素酶基本上可分成三类,分别为内切葡聚糖酶(endo-glucanase)、外切葡聚糖酶(cellobiohydrolase)以及葡萄糖苷酶(β-glucosidase)。内切葡聚糖酶能够随机地将长链纤维素切成许多小片段的寡糖;而外切葡聚糖酶则可从长链纤维素的还原端或非还原端进行分解,其主要产物为纤维二糖;至于葡萄糖苷酶则可把纤维二糖分解为单糖的葡萄糖。
纤维素酶在工业上的应用十分广泛,不论是在食品、饲料或纺织业,甚至可运用到现在最受关注的生质能源。针对不同工业的应用,纤维素酶也需有符合其不同的适用条件与范围。举例而言:饲料工业上适合偏酸性以及耐温的酶蛋白,然而纺织工业上则是偏好偏碱性的纤维素酶。因此,找出更加符合不同工业上所需的酶蛋白是学术或产业界努力的目标。目前在许多相关的研究中,为了得到更佳的酶,除了在自然界中筛选出来之外,就是将现有的酶蛋白加以改造。现今主要有两大改造策略,其一是随机突变或是将酶基因随机排列,再于特定的作用条件之下,筛选出更符合其作用条件的酶蛋白。此策略的好处是无须深入研究酶的结构或作用机制,而是直接在特定的条件下随机去找出更好的酶蛋白;然而,其缺点即是需要大量的人力以及时间去 进行大量筛选或是要有很好的大量筛选方法来配合。另一种改造策略则是藉由研究酶结构与作用机制以找出对于酶活性或特性具有关键性的氨基酸,并针对这些特定氨基酸进行突变并测试,进而得到功能性更强的改造酶蛋白。此优点是不需花费时间与人力在大量突变与筛选的步骤,但需要先了解此酶的蛋白结构以及其作用机制,才能找出具改造潜力的特定氨基酸。
因此,本发明欲藉由研究酶结构以找出对于酶活性具有关键性的氨基酸并进行基因改造,以有效提升纤维素酶的活性,进而增加纤维素酶的工业应用价值。
技术实现要素:
本发明的目的在于改造现有纤维素酶,利用结构分析及定点突变技术,以有效提升纤维素酶的活性,进而增加纤维素酶的工业应用价值。
为达上述目的,本发明的一较广义实施方式为提供一种纤维素酶,其氨基酸序列为将序列编号2第161位置的酪氨酸改以组氨酸取代修饰的序列。
在一实施例中,编码该序列编号2的基因为从草菇(volvariellavolvacea)所分离出来并经优化的eg1t基因。
在一实施例中,该纤维素酶为一内切葡聚糖酶。
在一实施例中,该纤维素酶的氨基酸序列如序列编号6所示。
本发明的另一较广义实施方式为提供一种编码前述纤维素酶的核酸分子。
本发明的又一较广义实施方式为提供一种重组质体,其包含前述的核酸分子。
附图说明
图1显示原始纤维素酶eg1t的核苷酸序列以及氨基酸序列。
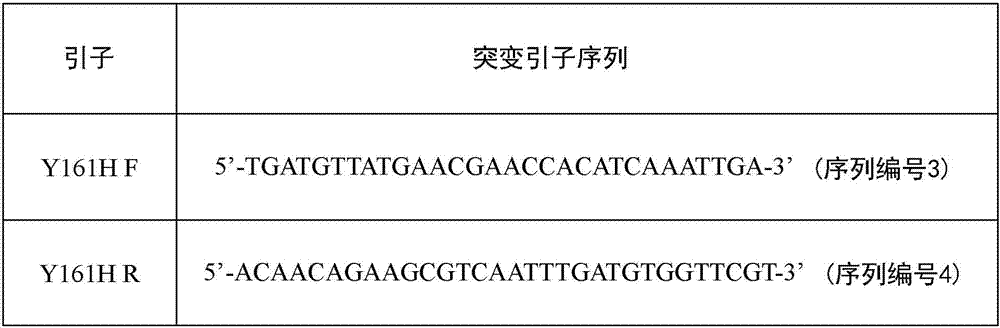
图2显示点突变技术所采用的引子序列。
图3显示突变改造后的纤维素酶y161h的核苷酸序列以及氨基酸序列。
图4显示原始蛋白eg1t及突变蛋白y161h在bmmy的摇瓶活性。
图5显示相同蛋白量的原始蛋白eg1t及突变蛋白y161h的活性比较。
图6显示原始蛋白eg1t的最适作用ph。
图7显示突变蛋白y161h的最适作用ph。
具体实施方式
体现本发明特征与优点的一些典型实施例将在后段的说明中详细叙述。应理解的是本发明能够在不同的态样上具有各种的变化,其皆不脱离本发明的范围,且其中的说明及附图在本质上当作说明之用,而非用以限制本发明。
里氏木霉(trichodermareesei)的内切葡聚糖酶基因cel5a是具有高活性的纤维素酶,故为常被研究并改造应用在纺织工业的纤维素酶之一。本发明将草菇(volvariellavolvacea)的内切葡聚糖酶基因eg1t进行蛋白结构仿真(modeling),取得酶蛋白仿真结构之后,再将里氏木霉的cel5a结构与草菇的eg1t仿真结构进行比对,找出相似序列(consensusresidue),并在活性区域附近挑选出可能对活性有影响的氨基酸进行改造。
以下将详述本发明改造纤维素酶的方法及其所得到的改良纤维素酶。
首先,将草菇(volvariellavolvacea)的内切葡聚糖酶eg1t氨基酸序列以swiss-model软件进行结构仿真,取得蛋白质仿真结构后,再运用pymol软件与里氏木霉(trichodermareesei)的内切葡聚糖酶cel5a(pdbid:3qr3)进行结构比对(alignment),在里氏木霉cel5a的酶蛋白结构里,活性区域附近第150位置上的组氨酸(histidine,h)与第185位置上的色氨酸(tryptophan,w)有结构堆栈(stacking),可能对于活性有影响,而在草菇eg1t酶蛋白结构上,相对应的结构为第161个位置的酪氨酸(tyrosine,y)与第252个位置的色氨酸(tryptophan,w),因此将草菇eg1t第161个位置上的酪氨酸(tyrosine,y)突变为组氨酸(histidine,h),并将突变蛋白(y161h)进行表达及活性测试。
本发明运用点突变技术进行突变改造。首先优化并合成一段内切葡聚糖酶eg1t基因,其中如图1所示,eg1t基因包含1002个碱基(核苷酸序列以序列编号1标示)以及333个氨基酸(氨基酸序列以序列编号2标示),此段基因两端并以ecori与noti限制酶位置衔接在ppicza载体上。图2为点突变技术所采用的引子序列,以将eg1t基因第161位置的酪氨酸(tyrosine,y)突变为组氨酸(histidine,h),其中f为顺向引子,r为逆向引子,且引子序列分别以序列编号3及4标示。经突变改造后的纤维素酶y161h的核苷酸序列及氨基酸序列如图3所示,其中,纤维素酶y161h基因同样包含1002个碱基(核苷酸序列以序列编号5标示)以及333个氨基酸(氨基酸序列以序列编号6标示),且第161个氨基酸由酪氨酸(tyrosine,y)突变为组氨酸(histidine,h)。
将突变改造的dna质体使用pmei限制酶进行线性化之后,以电转(electroporation)方式送入酵母pichiapastorisx33,然后将转型后的菌液涂到含有100μg/mlzeocin抗生素的ypd平板上,放置于30℃的培养箱进行两天的培养。之后挑选单一菌落至5mlypd于30℃培养,再接种到50mlbmgy中30℃培养一天。接下来将菌体换至20ml的bmmy进行四天的诱导蛋白表达,每24小时取样并加0.5%甲醇,菌液以3500rpm离心并收取上清液,进行蛋白量测量及纤维素酶活性测定。
纤维素酶的活性测试方式是取1%羧甲基纤维素(carboxymethylcellulose,cmc,ph6.0,0.05m磷酸钾缓冲液)0.2ml与适当浓度的纤维素酶蛋白液(稀释缓冲液为0.05m磷酸钾缓冲液,ph6.0)0.2ml,混合均匀后在50℃下作用15分钟,接着加入1.2ml的1%dns并于100℃沸水中煮沸5分钟以停止反应且呈色,然后在冷水中降温10分钟,在od540波长测定吸光值,再换算成酶活性单位(unit)。其中,酶活性的标准曲线是由葡萄糖标准溶液0-0.35(μg/m)之间制定,而1unit的定义为每分钟释放1μmole产物所需的酶蛋白量。
图4显示原始蛋白eg1t及突变蛋白y161h在bmmy的摇瓶活性,其中两株表达酵母菌株y161h-7及y161h-20的酶蛋白上清液被挑选来进行活性测试,结果发现在四天的甲醇诱导之下,突变蛋白y161h-7及y161h-20的纤维素酶活性高于原始蛋白eg1t。
进一步调整突变蛋白y161h-7及y161h-20与原始蛋白eg1t的酶液浓度一致之后,在0.05m磷酸钾缓冲液、ph6.0及50℃下进行活性检测,并比较其相对活性数值。图5即显示相同蛋白量的原始蛋白eg1t及突变蛋白y161h的活性比较,由图示结果可知,在相同的酶蛋白量之下测定酶活性,突变蛋白y161h-7及y161h-20的纤维素酶活性皆明显高于原始蛋白eg1t。
另外,本发明亦进一步测定突变蛋白及原始蛋白的最适作用ph值,其测试方法为将适当的酶蛋白液以不同缓冲液,包含ph3.5~ph6.0的0.05m柠檬酸缓冲液(citratebuffer)、ph5.8~ph8.0的0.05m磷酸钾缓冲液(potassiumphosphatebuffer,kpbuffer)、ph8.0~ph9.0的0.05m四硼酸钠/盐酸缓冲液(na-tetraborate/hclbuffer)、及ph9.0~ph10的0.05m碳酸钠缓冲液(na-carbonatebuffer)稀释后,在50℃下反应15分钟,取出后放置在4℃降温10分钟再放置室温回温10分钟,之后再进行50℃的酶活性检测,以最高酶活性 作为100%对照,分别计算不同ph值相对活性百分比。图6显示原始蛋白eg1t的最适作用ph,图7显示突变蛋白y161h的最适作用ph,由图示结果可知,突变蛋白y161h与原始蛋白eg1t最适作用ph范围不变,皆在中性ph5.5~ph5.8范围。
综上所述,为了增加纤维素酶的工业应用价值,本发明比对草菇eg1t及里氏木霉cel5a的蛋白结构,筛选出活性区域附近的突变点,将草菇eg1t蛋白第161个位置上的酪氨酸(tyrosine,y)突变为组氨酸(histidine,h),经进一步表达及活性测试发现,突变蛋白y161h的纤维素酶活性明显高于原始蛋白eg1t,且最适作用ph范围不变。因此,本发明提供的纤维素酶突变蛋白y161h可有效提升纤维素酶的活性,故可进一步降低生产成本,并增加其工业应用价值。
纵使本发明已由上述实施例详细叙述而可由本领域普通技术人员任施匠思而为诸般修饰,然皆不脱如附权利要求书所欲保护者。
- 还没有人留言评论。精彩留言会获得点赞!