一种PEDV和TGEV双重RT‑PCR检测方法及其探针引物组合与试剂盒与流程
本发明涉及一种PEDV和TGEV双重RT-PCR检测方法及其探针引物组合与试剂盒,属于病毒核酸检测技术领域。
背景技术:
猪流行性腹泻(Porcine Epidemic Diarrhea,PED)和猪传染性胃肠炎(Transmissible Gastroenteritis,TGE)二者均为高度接触性肠道疾病,主要发生在冬季和春季等寒冷季节,感染后,主要引起猪的呕吐、腹泻、食欲下降和脱水,各年龄段的猪均易感染。分别由两种RNA病毒:猪流行性腹泻病毒(Porcine Epidemic Diarrhea virus,PEDV)和传染性胃肠炎病毒(Transmissible Gastroenteritis virus,TGEV)引起。该两种病毒均可以破坏小肠上皮细胞而引起肠绒毛萎缩,对哺乳仔猪的致死率分别为30%-80%、80%-100%。由于二者引起的临床症状、病理变化和流行病学极为相似,且往往混合感染,单凭临床症状和组织病理学难以鉴别诊断。近几年二者已成为当前猪场常见的病毒性腹泻,给养猪业造成了严重的经济损失。
目前常规的病毒诊断方法有病毒分离、荧光抗体检测、血清学诊断方法和免疫组织化学以及PCR方法等,病毒分离困难,PCR方法因其具有快速、特异、准确等优点,现己经广泛应用于畜禽传染病的快速诊断。以上这些诊断方法在特异性上尚存在一定的缺陷,在敏感性方面对早期感染往往不能做出准确的判定;并且单一的RT-PCR方法用于多种病毒感染的临床鉴别诊断,不能一次达到目的,且因为需要对不同检测病毒分别进行扩增,不仅样品需求量较大,且耗时较长。此外疾病的严重程度与病毒的含量相关,传统的检测方法很难准确测定样品中的病毒含量,这使得实时荧光定量RT-PCR方法不仅在定量研究中具有重要意义,而且在检测病毒存在及其在疾病发展过程中病毒对机体持续性作用方面也起重要作用。因此,开发出一种同时特异检测两种猪病毒感染的双重实时荧光定量RT-PCR检测试剂盒,有助于提升病毒检测水平,在疾病诊断和防治及食品安全等方面具有重要的应用前景。
技术实现要素:
为了克服现有技术的不足,本发明的目的在于提供一种PEDV和TGEV双重RT-PCR探针引物组合,包括以下引物对和探针:
PEDV上游引物:CGTGGAATTTCATTAGGTTTGCTTA
PEDV下游引物:CAAGTGCTGTGCTGTCCTCTAGT
PEDV探针:CAAGTGCTGTGCTGTCCTCTAGT
TGEV上游引物:GCAGGTAAAGGTGATGTGACAAGAT
TGEV下游引物:ACATTCAGCCAGTTGTGGGTAAT
TGEV探针:CTTGGCACTGCTCCCATTGGCAAC。
作为优选,所述PEDV探针和TGEV探针序列的3’端结合相同的荧光淬灭基团;所述PEDV探针和TGEV探针序列的5’端结合不同的荧光报告基团。
作为优选,所述荧光淬灭基团为BHQ1;所述PEDV探针的荧光报告基团为HEX;所述TGEV探针的荧光报告基团为FAM。
本发明的另一目的在于提供一种PEDV和TGEV双重RT-PCR检测方法,包括以下步骤:
1)病毒总RNA提取;
2)反转录合成cDNA;
3)RT-PCR扩增:利用上述探针引物组合,以cDNA为模板进行RT-PCR扩增,收集荧光信号;
4)结果判定:若扩增产物产生的Ct值≤38,则为阳性。
作为优选,步骤3)中,RT-PCR扩增的反应体系如下:2μL 10×PCR buffer、2μL 2.5mΜdNTP、1U Ace Taq DNA聚合酶、0.3μM PEDV上游引物、0.3μM PEDV下游引物、0.2μM PEDV探针、0.3μM TGEV上游引物、0.3μM TGEV下游引物和0.25μM TGEV探针、补足至20μL的ddH2O。
作为优选,步骤3)中,RT-PCR扩增的反应程序如下:95℃1min;95℃10s,60℃30s,40个循环,从60℃开始收集荧光信号。
本发明的目的之三在于提供一种PEDV和TGEV双重RT-PCR检测试剂盒,包括上述的探针引物组合。
作为优选,上述试剂盒还包括RT-PCR缓冲液、DNA聚合酶、酶混合物、阳性对照品、阴性对照品;所述阴性对照为灭菌后焦碳酸二乙酯处理水。
作为优选,所述RT-PCR缓冲液为氯化镁和三磷酸脱氧核糖核苷酸的混合物;所述酶混合物包括RNA酶抑制剂,M-MLV逆转录酶和Ace Taq DNA聚合酶。
相比现有技术,本发明的有益效果在于:
本发明运用实时荧光定量RT-PCR技术,采用PEDV和TGEV两种病毒的特异性引物和探针,提供了一种PEDV和TGEV双重TaqMan实时荧光定量RT-PCR检测试剂盒。该发明是通过一个RT-PCR反应可以从样本中同时检测出PEDV和TGEV的存在,比传统的普通PCR和单重荧光定量PCR方法更简便、省时和快捷,并且能够对待检测的病毒进行实时准确定量。本发明提供的试剂盒可判定在疾病爆发时哪种病毒在起主要作用,从而为实现临床早期诊断和及时制定治疗方案、减少死亡率及后遗症成为可能。
附图说明
图1为实施例2步骤1)的标准曲线图,其中,曲线A为PEDV病毒,曲线B为TGEV病毒;
图2为实施例2步骤2)的特异性试验结果图;
图3为实施例2步骤3)的敏感性试验结果图;
图4为实施例2步骤3)的普通RT-PCR敏感性试验结果图。
具体实施方式
下面,结合附图以及具体实施方式,对本发明做进一步描述:
以下具体实施方式中,如未特殊说明,所采用的试剂或仪器均可通过市售的途径获得。采用的DNA聚合酶为DNA聚合酶为Vazyme公司生产的Ace Taq DNA Polymerase(Code NO P401-d2)。
本发明提供一种PEDV和TGEV双重RT-PCR探针引物组合,包括以下引物对和探针:
PEDV上游引物SEQ ID No.1:CGTGGAATTTCATTAGGTTTGCTTA
PEDV下游引物SEQ ID No:2:CAAGTGCTGTGCTGTCCTCTAGT
PEDV探针SEQ ID No.3:CAAGTGCTGTGCTGTCCTCTAGT
TGEV上游引物SEQ ID No.4:GCAGGTAAAGGTGATGTGACAAGAT
TGEV下游引物SEQ ID No.5:ACATTCAGCCAGTTGTGGGTAAT
TGEV探针SEQ ID No.6:CTTGGCACTGCTCCCATTGGCAAC。
以下具体实施方式中,PEDV和TGEV的上下游引物和探针委托上海Invitrogen公司合成。以下具体实施例中,使用的PEDV探针为HEX-CAAGTGCTGTGCTGTCCTCTAGT-BHQ1,使用的TGEV探针为FAM-CTTGGCACTGCTCCCATTGGCAAC-BHQ1。
本发明同时提供了一种PEDV和TGEV双重RT-PCR检测方法,包括以下步骤:
1)病毒总RNA提取;
2)反转录合成cDNA;
3)RT-PCR扩增:利用上述的探针引物组合,以cDNA为模板进行RT-PCR扩增,收集荧光信号;
4)结果判定:若扩增产物产生的Ct值≤38,则为阳性。
本发明提供的PEDV和TGEV双重RT-PCR检测试剂盒,包括上述的探针引物组合。
本发明中,PEDV上游引物和PEDV下游引物的Tm值范围为59.2-61.3℃;PEDV探针的Tm值为71℃;TGEV上游引物和TGEV下游引物为58-62.1℃、TGEV探针的Tm值为70.6℃。
实施例1:制备质粒标准品
1)病毒总RNA提取
将含有PEDV和TGEV病毒的组织样品各100mg置于1.5mL离心管中,用病毒RNA/DNA抽提试剂盒Axyprep Body Fluid Vial DNA/RNA Miniprep Kit(AXYGEN)提取,得到病毒总RNA;
2)反转录合成cDNA
在无RNase的0.2mL PCR管中依次加入步骤1)制备的病毒总RNA 10μL,OligodT-Adaptor primer(10pmol/L)2μL,5×Buffer 4μL,dNTP Mixture(10mM)2μL,RNase Inhibitor(40U/μL)0.5μL,M-MLV(200U/μL)1μL,不含RNase的ddH2O补足至20μL。37℃60min,72℃10min。待反转录反应结束后,所得反应液即为cDNA模板;
3)qPCR扩增
qPCR反应体系(总反应体积20μL):取2μL步骤2)获得的cDNA为模板进行TaqMan实时荧光定量PCR反应,其中10×PCR buffer2μL,2.5mΜdNTP 2μL,Ace Taq DNA聚合酶1.5U,0.3μM PEDV上游引物、0.3μM PEDV下游引物、0.2μM PEDV探针、0.3μM TGEV上游引物、0.3μM TGEV下游引物和0.25μM TGEV探针、补足至20μL的ddH2O;反应参数为:95℃1min;95℃10s,60℃30s,40个循环,从60℃开始收集荧光信号。
4)获得质粒标准品
将步骤3)获得的扩增产物进行琼脂糖凝胶电泳,按照DNA Gel Extraction Kit操作方法回收目的片段,将回收产物连接到PMD18-T载体上,通过大肠杆菌DH-5α感受态转化,挑取其中白色单菌落进行鉴定,重组质粒序列委托上海Invitrogen公司进行序列测定。利用Plasmid Miniprep Kit提取测序正确的重组质粒DNA,PEDV阳性质粒标准品的序列如SEQ ID No.7所示;TGEV阳性质粒标准品序列如SEQ ID No.8所示,利用核酸蛋白检测仪(thermo)定量重组质粒PEDV为1.8×1011Copies/μL,TGEV为8.1×1011Copies/μL。
实施例2:检测方法的建立及验证
1)制作标准曲线
取实施例1获得的PEDV和TGEV阳性质粒标准品,以无菌去离子水将质粒按照1.0×101Copies/μL-1.0×106Copies/μL 10倍梯度稀释制备质粒标准溶液,进行实时荧光定量PCR反应,反应体系:2μL标准溶液作为模板,10×buffer 2μL,2.5mΜdNTP 2μL,Ex Taq DNA聚合酶1U,0.3μM PEDV上游引物、0.3μM PEDV下游引物、0.2μM PEDV探针、0.3μM TGEV上游引物、0.3μM TGEV下游引物和0.25μM TGEV探针、补足至20μL的ddH2O。反应参数为:95℃1min;95℃10s,60℃30s,40个循环,从60℃开始收集荧光信号。扩增完成后,以Ct值为纵坐标,log10X(X为标准品系列浓度)为横坐标,Ct值与log10X呈线性关系,制作标准曲线,结果如图1所示,呈良好的线性关系。
2)特异性试验
配制12份相同的实时荧光定量PCR反应体系反应液,分别单独加入2μL提取的PCV2、PRV核酸DNA或已反转录的PRRSV、CSFV、PEDV以及TGEV的cDNA为模板,即,反应体系为10×PCR buffer2μL,2.5mΜdNTP 2μL,Ace Taq DNA聚合酶1.5U,0.3μM PEDV上游引物、0.3μM PEDV下游引物、0.2μM PEDV探针、0.3μM TGEV上游引物、0.3μM TGEV下游引物和0.25μM TGEV探针、补足至20μL的ddH2O。反应参数为:95℃1min;95℃10s,60℃30s,40个循环,从60℃开始收集荧光信号。
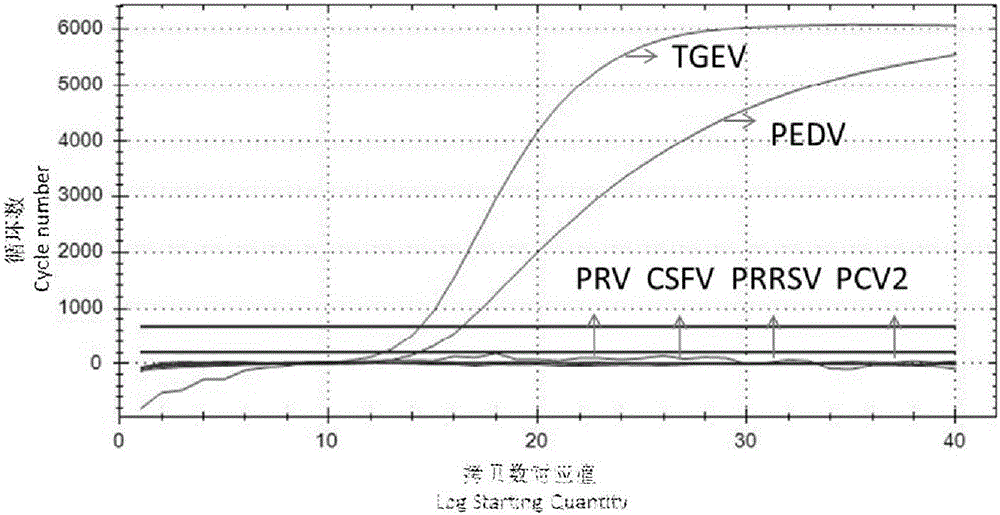
结果如图2所示,图2中,上曲线从左到右依次为TGEV、PEDV,下曲线为PRV、CSFV、PRRSV、PCV2及阴性对照。该方法能很好地同时通过双重TaqMan实时荧光定量RT-PCR扩增出对应两种病毒扩增产物,并通过扩增曲线及荧光集团的不同,将两种产物明显区分开来。
由此,我们可得以下结论:PEDV和TGEV两种病毒可同时通过一次双重实时荧光定量RT-PCR反应,扩增出相应目的产物,并能在扩增曲线上,通过Ct和所标记荧光基团的不同,将两种病毒有效区分开来,可以很直观通过扩增曲线来判定试验结果,证明所检测两种病毒正是PEDV和TGEV。
3)敏感性试验
以本实施例步骤1)的10倍系列稀释的PEDV和TGEV阳性质粒标准品(1.0×101~1.0×106Copies/μL)作为模板,每个稀释度设立3个重复,分别进行实时荧光定量PCR、普通RT-PCR检测敏感度,比较敏感性。
敏感性实验结果显示,本发明可检测出10Copies/μL的病毒量见图3,曲线a至f分别对应PEDV的1×106,1×105,1×104,1×103,1×102和1×101各自的拷贝;曲线1至6分别对应TGEV的1×106,1×105,1×104,1×103,1×102和1×101各自的拷贝;由此可见本发明检测病毒的敏感性高于常规PCR约100倍。
普通RT-PCR只能检测到1000Copies/μL的病毒量见图4,泳道1至7分别对应PEDV的1×106,1×105,1×104,1×103,1×102和1×101;泳道8至14分别对应TGEV的1×106,1×105,1×104,1×103,1×102和1×101各自的拷贝;普通RT-PCR检测只能检测到1×103Copies/μL的病毒量。
4)稳定性试验
取本实施例步骤1)的10倍系列稀释的PEDV和TGEV质粒标准品溶液,取DEPC-H2O作为阴性对照品,分别进行批内、批间重复试验。批内重复试验是将3份样品在同一次实时荧光定量试验中重复3次;批间重复试验是在3次不同时间的试验中(间隔1月)进行实时荧光定量PCR试验。稳定性结果如下表所示显示,本发明2种病毒批内的变异系数分别为0.05%、0.58%、0.16%、0.09%、0.41%、0.32%;批间的变异系数分别为1.8%、2.7%、3.3%、2.4%、3.2%、3.7%,由此可见本发明检测过程中具有良好的稳定性。
表1稳定性试验结果
实施例3:试样检测
一种PEDV和TGEV双重RT-PCR检测方法,包括以下步骤:
1)病毒总RNA提取:将含有PEDV、TGEV病毒的细胞上清各200μL置于1.5mL离心管中,用病毒RNA/DNA抽提试剂盒Axyprep Body Fluid Vial DNA/RNA Miniprep Kit(AXYGEN)从细胞株提取病毒总RNA;
2)反转录合成cDNA:
在无RNase的0.2mL PCR管中依次加入步骤1)制备的病毒总RNA 10μL,OligodT-Adaptor primer(10pmol/L)2μL,5×Buffer 4μL,dNTP Mixture(10mM)2μL,RNase Inhibitor(40U/μL)0.5μL,M-MLV(200U/μL)1μL,不含RNase的ddH2O补足至20μL。37℃60min,72℃10min。待反转录反应结束后,所得反应液即为cDNA模板;
3)PEDV和TGEV两种病毒双重TaqMan实时荧光定量RT-PCR扩增:
qPCR反应体系(总反应体积20μL):取2μL步骤2)得到的cDNA为模板进行TaqMan实时荧光定量PCR反应,其中10×PCR buffer2μL,2.5mΜdNTP 2μL,Ace Taq DNA聚合酶1.5U,0.3μM PEDV上游引物、0.3μM PEDV下游引物、0.2μM PEDV探针、0.3μM TGEV上游引物、0.3μM TGEV下游引物和0.25μM TGEV探针、补足至20μL的ddH2O;反应参数为:95℃1min;95℃10s,60℃30s,40个循环,从60℃开始收集荧光信号。
4)结果判定:若扩增产物产生的Ct值≤38,则为阳性。
实施例4:临床检验
1)样本采集
样本共计52份,其中在广东地区采集血清22份,感染不同代次的细胞19份,组织病料11份。
2)总RNA小量抽提
用病毒RNA/DNA抽提试剂盒Axyprep Body Fluid Vial DNA/RNA Miniprep Kit(AXYGEN)从细胞株提取病毒总RNA;
3)反转录合成cDNA:
同实施例3步骤2);
4)RT-PCR检测和双重TaqMan实时荧光定量RT-PCR
qPCR反应体系(总反应体积20μL):取2μL已反转录的cDNA为模板进行TaqMan实时荧光定量PCR反应,其中10×PCR buffer 2μL,2.5mΜdNTP 2μL,Ace Taq DNA聚合酶1.5U,0.3μM PEDV上游引物、0.3μM PEDV下游引物、0.2μM PEDV探针、0.3μM TGEV上游引物、0.3μM TGEV下游引物和0.25μM TGEV探针、补足至20μL的ddH2O;反应参数为:95℃1min;95℃10s,60℃30s,40个循环,从60℃开始收集荧光信号,记载Ct值。
5)定量分析
根据实施例2步骤1)的标准曲线及待测样品Ct值,计算待测标本病毒Copies/μL。通过结果分析得出所采集样本中PEDV和TGRV两种病毒的总cDNA大都在101~109Copies/μL之间(超过以及等于106拷贝/μL的样品,均稀释100后再次检测),而在普通PCR检测呈阴性通过本发明检测结果为阳性的样本,其对应拷贝数值在103Copies/μL左右。
对比例:普通RT-PCR检测
对比例中,样本采集、总RNA小量抽提以及反转录合成cDNA步骤均于实施例4相同,后采用普通RT-PCR进行检测,其中RT-PCR反应体系(总反应体积25μL):10×PCR buffer 2.5μL,25mM MgCl22μL,2.5mM dNTP 2.5μL,Ace Taq DNA聚合酶2U,以cDNA2μL为模板,0.3μM PEDV上游引物、0.3μM PEDV下游引物、0.3μM TGEV上游引物、0.3μM TGEV下游引物,加ddH2O至反应体系总体积为25μL,分别进行普通RT-PCR扩增。反应在Bio-Rad S1000PCR扩增仪进行反应参数为:95℃5min;94℃30s,60℃30s,72℃30s,35个循环,72℃10min。
5)结果检测:通过琼脂糖凝胶电泳进行检测。
实施例4与对比例相比,对于同一批待测样品,实施例4检测出21份PEDV阳性,9份TGEV阳性,其中PEDV和TGEV混合感染3份;对比例检测出19份PEDV阳性,8份TGEV阳性,其中PEDV和TGEV混合感染3份。
由上述结果可知,采用本发明提供的PEDV和TGEV双重RT-PCR检测方法的实施例4,其检测效果明显好于采用普通RT-PCR方法的对比例,可以减少假阴性的发生,同时一次可以检测出混合感染,减少二次RT-PCR验证及不需要RT-PCR扩增后续处理,大大节约时间,提高工作效率。
本发明的提供的PEDV和TGEV双重RT-PCR检测试剂盒,包括a)荧光定量RT-PCR反应液、b)阳性对照品、c)阴性对照品和d)定量RT-PCR标准品;
其中,所述a)荧光定量RT-PCR反应液包含RT-PCR缓冲液、DNA聚合酶、PEDV上游引物SEQ ID No.1、PEDV下游引物SEQ ID No:2、PEDV探针SEQ ID No.3、TGEV上游引物SEQ ID No.4、TGEV下游引物SEQ ID No.5、TGEV探针SEQ ID No.6;
所述RT-PCR缓冲液为氯化镁和三磷酸脱氧核糖核苷酸混合物;
所述b)阳性对照品为含有PEDV和TGEV两种病毒的阳性质粒混合物;
所述c)阴性对照品为灭菌后焦碳酸二乙酯处理水;
所述d)定量RT-PCR标准品为PEDV阳性质粒标准品和TGEV阳性质粒标准品。
所述PEDV阳性质粒标准品序列为SEQ ID No.7:GTGGAATTTCATTAGGTTTGCTTAAGTAGCCATCGCAAGTGCTGTGCTGTCCTCTAGTTCCTGGTTGGCGTTCCGTCGCCTTCTACATACTAGACAAACAGCCTTCCTCCG;
所述TGEV阳性质粒标准品序列为SEQ ID No.8:GCAGGTAAAGGTGATGTGACAAGATTTTATGGAGCTAGAAGCAGTTCAGCCAATTTTGGTGACACTGACCTCGTTGCCAATGGGAGCAGTGCCAAGCATTACCCACAACTGGCTGAATGT。
上述试剂盒应避光保存于-20℃,尽量减少反复冻融。
对于本领域的技术人员来说,可根据以上描述的技术方案以及构思,做出其它各种相应的改变以及变形,而所有的这些改变以及变形都应该属于本发明权利要求的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!