一种新型火鸡疱疹病毒的细菌人工染色体、构建方法与应用与流程
本发明涉及动物医学领域,具体涉及一种新型火鸡疱疹病毒的细菌人工染色体、构建方法及应用。
背景技术:
火鸡疱疹病毒(Herpesvirus of turkey,HVT)是属于鸡马立克氏病病毒血清III型的一种α疱疹病毒。早期研究发现,在遗传学和血清学上,HVT与马立克氏病病毒(Marek’s disease virus,MDV)具有相关性,且HVT对鸡没有致病性,因此,HVT FC-126株被广泛用于预防鸡的马立克氏病(Marek’s disease,MD)。
HVT对鸡极为安全,不产生任何副反应;它可以进行胚内接种或1日龄早期接种免疫,不但能避免母源抗体的干扰而且启动免疫快;免疫期长,病毒可以持续长达72周的病毒血症。HVT病毒颗粒大小约为160nm,二十面体的核衣壳内包含了大小约为158kbp的双链DNA基因组(GenBank:AF291866)。HVT基因组大、非致病性和终身感染的特性早就引起了人们对其作为病毒活载体用途的兴趣。目前,国外已成功应用HVT表达多种异源抗原,例如鸡新城疫病毒(Newcastle disease,NDV)的F抗原(-ND-SB(MSD Animal Health)和HVT-NDV(Ceva))和鸡传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)的VP2抗原(HVT+IBD(Merial)和HVT-IBD(Ceva))等,展现了HVT作为活疫苗载体的良好应用前景。
构建疱疹病毒重组载体活疫苗的常用方法有同源重组或黏粒再生,筛选方法通常是通过Lac-z或GFP标记等。然而,在应用病毒DNA进行重组的过程中,病毒培养繁琐,且不同代次的病毒基因组常常会发生变异,导致抗原性不稳定。
疱疹病毒的细菌人工染色体(Bacterial Artificial Chromosome,BAC)是近年来发展起来的一项新技术,能大大提高构建重组疱疹病毒的效率。已报道的HVT BAC的构建是将mini-F序列插入HVT基因组的US2区,虽然获得了具有感染性的克隆,但是mini-F重组病毒很不稳定,有些重组毒在传代后即失去增殖能力,而且从感染性克隆拯救获得的病毒的生长特性也不一致,有些病毒的增殖能力大大减弱,这些结果表明将mini-F插入US2位点可能对HVT的正常复制有干扰作用。
技术实现要素:
本发明提供一种火鸡疱疹病毒的细菌人工染色体,该细菌人工染色体具有较高的稳定性,可以应用于重组载体活疫苗的构建。
本发明的另一目的是提供火鸡疱疹病毒的细菌人工染色体,该构建方法简单、高效。
本发明的再一目的是提供所述细菌人工染色体在构建火鸡疱疹病毒载体活疫苗株中的应用。
本发明的目的采用如下技术方案实现。
一种新型火鸡疱疹病毒的细菌人工染色体,是将HVT基因组中的gC基因敲除,并替换为mini-F质粒序列。
本发明还提供构建所述细菌人工染色体的方法,包括如下步骤:
(1)分别扩增HVT基因组中gC基因上、下游同源臂,将上、下游同源臂插入pUC19载体内获得重组载体A;
(2)将mini-F质粒经Pac I酶切后获得的片段插入重组载体A内,得到重组转移载体B;
(3)将重组转移载体B与HVT的DNA共转染CEF,进行同源重组,挑取发出绿色荧光的细胞病变蚀斑,再经压力培养基筛选,得到mini-F重组HVT;提取mini-F重组HVT的DNA转化DH10B细胞,采用氯霉素筛选,获得阳性重组菌,培养后,挑取质粒DNA,得到所述细菌人工染色体。
在本发明中,所述压力培养基是在DMEM中添加终浓度为10%的血清、100U/mL的青霉素、100μg/mL的链霉素、350μg/mL的霉酚酸、80μg/mL的黄嘌呤和100μg/mL的次黄嘌呤后获得的。
在本发明中,以HVT基因组为模板,以SEQ ID NO:1和SEQ ID NO:2为引物扩增gC基因上游同源臂;以SEQ ID NO:3和SEQ ID NO:4为引物扩增gC基因下游同源臂。
在本发明中,所述上游同源臂的序列为如SEQ ID NO:5所示,下游同源臂的序列如SEQ ID NO:6所示。
本发明还提供所述细菌人工染色体在构建火鸡疱疹病毒载体活疫苗株中的应用。
在本发明中,采用所述细菌人工染色体构建火鸡疱疹病毒载体活疫苗株的方法如下:
(1)通过PCR方法或人工合成的方法获得外源基因的序列,然后在其上游连接上启动子,在下游连接上终止序列,构建成外源基因表达盒;
(2)将权利要求1所述细菌人工染色体转入工程菌GS1783,然后将所述外源基因表达盒插入所述细菌人工染色体中,构建成重组HVT BAC;
(3)将(2)所构建的重组HVT BAC转染鸡胚成纤维细胞进行病毒拯救,同时将gC基因恢复,通过挑斑纯化获得重组火鸡疱疹病毒载体活疫苗株。
优选的技术方案中,所述外源基因表达盒插入所述细菌人工染色体的非编码区或非必需基因位点。
本发明火鸡疱疹病毒的细菌人工染色体具有较高的稳定性,其恢复毒与亲本毒株具有一致的生长特性和免疫原性,因此,可以应用于重组载体活疫苗的构建。本发明构建火鸡疱疹病毒细菌人工染色体的方法简单、高效。本发明火鸡疱疹病毒的细菌人工染色体是将HVT基因组中的gC基因敲除,并替换为mini-F质粒序列,为HVT活载体疫苗的构建和改进提供可靠的技术平台。该HVT活载体疫苗DIVA疫苗,能够区别感染动物与免疫动物的疫苗,由于一些畜禽传染病的防控难度大,因此进行净化是最有效的措施,例如禽流感等,有许多发达国家已经完成净化,不再进行免疫接种,在我国,随着畜牧业和兽医卫生事业的发展,许多动物疫病的防控必然从免疫预防逐步过度到净化为主,在这个转变过程中对可以区别免疫动物与感染动物的DIVA疫苗的需求十分迫切。通过应用本发明的火鸡疱疹病毒的细菌人工染色体BAC-HVT(C1)株可以高效地构建火鸡疱疹病毒载体活疫苗。
附图说明
图1转移载体pUC19(HVT)-H1-H2-mini-F的结构示意图。
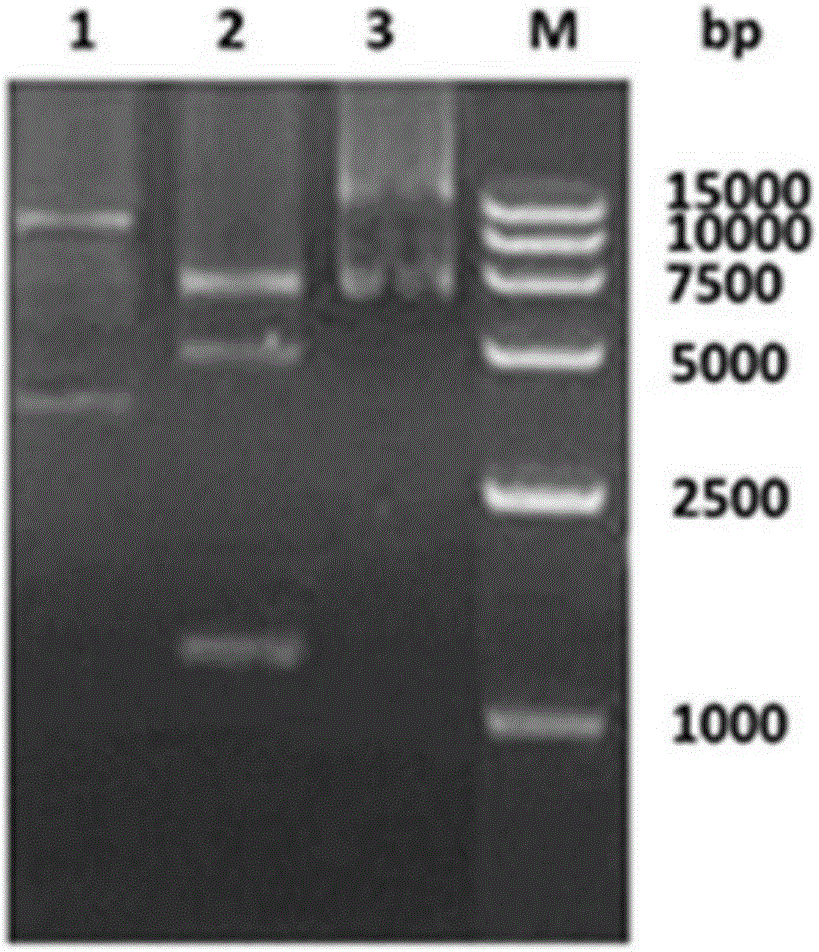
图2转移载体pUC19(HVT)-H1-H2-mini-F的酶切验证图谱。其中脉道1为限制性内切酶Sca I酶切结果,条带大小分别为10165、3775bp;脉道2为限制性内切酶EcoR I酶切结果,条带大小分别为7507、5095、1338bp;脉道3为未酶切的pUC19(HVT)-H1-H2-miniF质粒DNA对照;M.15000bp DNA Marker。
图3 Mini-F重组HVT病毒蚀斑。A.波长为488nm紫外光下观察到的发出绿色荧光的病毒蚀斑;B.在白光下观察到的蚀斑。
图4 BAC-HVT(C1)质粒DNA的RFLP图谱。泳道M是DNA Marker,其他泳道是质粒DNA酶切产物。
图5:HVTBAC-gC-R(C1)的gC基因鉴别电泳图,其中M是DNA Marke,其他泳道分别为各毒株PCR产物。
图6:HVT BAC恢复毒及gC缺失株与亲本株在CEF上的生长动力学曲线。A.三株恢复毒与HVT Fc-126和经胰酶消化成单个细胞的病毒滴度;B.三株恢复毒与HVTFc-126和经裂解的细胞结合性病毒的滴度;C.恢复毒HVTBAC-gC-R(C1)的F1代、F10代和F20代经裂解的细胞结合性病毒的滴度。
具体实施方式
以下通过实施例来进一步说明本发明,但本发明的范围和精神并不限于所列实施例。
实施例1转移载体pUC19(HVT)-H1-H2-miniF的构建与鉴定
1、实验材料
SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。HVT FC-126病毒株购
自中监所(CVCC AV19)。pUC19质粒购自Takara公司。mini-F质粒由柏林自由大学病毒研究所Nikolaus Osterriender教授惠赠(公开于:Tischer B,Smith G,Osterrieder N.En passant mutagenesis:a two step markerless red recombination system.Methods Mol Biol.2010;634:421-430.)。酶EcoR I、Hind III、Sma I、Sca I、BamH I和Pac I及Ex Taq DNA聚合酶,以及连接酶和PCR试剂购均购自Takara公司;DMEM培养基、胰酶及新生牛血清购自Sigma公司;其它试剂均购自南京生工生物有限公司。质粒提取试剂:溶液I:25mmol/L Tris-HCl(pH8.0)中添加有50mmol/L葡萄糖、10mmol/L EDTA和2毫克/毫升的溶菌酶。溶液II:200mmol/L的NaOH水溶液中含有1%的SDS。溶液III:3mol/L NaAc(pH4.8)溶液。TE缓冲液:10mmol/L Tris-HCl(pH 7.5)中添加有1mmol/L的EDTA。
2、实验方法及结果
2.1PCR引物的设计与PCR反应
根据已发表的HVT FC-126株全长基因组序列(GenBank:AF291866),应用Vector NTI软件设计gC基因上、下游同源臂扩增的PCR引物(表1)。在两对引物的两端分别加上EcoR I,Pac I,Sma I,BamH Ⅰ,Pac I和Hind III位点和保护碱基,具体序列见表1。
表1 PCR引物
PCR反应的体系为HVT Fc-126株的DNA模板1uL,Taq聚合酶0.5uL,上游引物2uL(10PM),下游引物2uL(10PM),dNTP mixture 4uL,10倍稀释液5uL,25mM Mg2+4uL,加水补至50uL。
PCR反应程序为:94℃预变性3min;94℃变性30sec,51℃退火40sec,72℃反应1min20sec,10个循环;94℃变性30sec,60℃退火40sec,72℃反应1min20sec,27个循环;72℃延伸10分钟。
2.2鸡胚成纤维细胞的制备
选择9-10日龄发育良好的SPF鸡胚,无菌取出鸡胚,去头、四肢和内脏,用汉克氏液洗涤胚体,剪成米粒大小的组织块,再洗涤2-3次,然后用0.25%胰酶溶液消化20-30分钟,吸出胰酶,用汉克氏液洗2-3次,再加入适量的含血清和抗生素的汉克氏液吹打,经4-6层纱布过滤,制成每1mL含活细胞100-150万的细胞悬液,每个6孔板的孔中加入1mL,置CO2培养箱中37℃培养24小时长成单层备用。
2.3病毒DNA的提取
HVT Fc-126株按0.01的感染复数感染鸡胚成纤维细胞,当细胞病变(CPE)达60%-70%时,将上清与细胞一起反复冻融3次,8000rpm离心15min,取上清作为组织提取物备用。同时设未感染火鸡疱疹病毒的鸡胚成纤维细胞为对照,按感染病毒的细胞相同的方法处理。
病毒DNA的提取:①取组织提取物445μL,加入10%的SDS溶液50μL,20mg/mL蛋白酶K溶液2.5μL,混匀;置56℃水浴1h,99℃水浴10min,冷却至室温;②加入Tris饱和酚200μL,混匀,4℃、12000rpm条件下离心5min,取上清。重复步骤①②2次;③加入Tris饱和酚100μL和氯仿100μL,混匀,4℃、12000rpm条件下离心5min,取上清;④加入1/10体积的3mol/L的醋酸钠溶液,和1-2倍体积无水乙醇,上下颠倒混匀,置-20℃条件下40min至数天;⑤4℃、12000rpm条件下离心20min,弃上清,沉淀用70%乙醇溶液洗涤,4℃、12000rpm条件下离心1min,弃上清,沉淀洗涤2次;⑥置超净台中风干,加入20-100μL无菌纯水溶解,作为HVT Fc-126株病毒DNA备用。
2.4pUC19(HVT)-H1的构建
以HVT Fc-126株的DNA为模板,以HVT-B H1 F和HVT-B H1 R为引物,扩增gC基因的上游同源臂UL44 H1(SEQ ID NO:5),进行胶回收纯化,标定浓度后应用EcoR I和Sma I进行双酶切,回收产物与经过同样双酶切处理的pUC19质粒DNA应用连接酶连接,转化DH5α感受态细胞,对获得的克隆提取DNA进行序列测定,得到重组质粒pUC19(HVT)-H1。
2.5p UC19(HVT)-H1-H2的构建
以HVT Fc-126株的DNA为模板,以HVT-B H2 F和HVT-B H2 R为引物,扩增gC基因的下游同源臂UL44 H2(SEQ ID NO:6),进行胶回收纯化,标定浓度后应用BamH I和Hind III进行双酶切,回收产物与经过同样双酶切处理的pUC19(HVT)-H1质粒DNA应用连接酶连接,转化DH5α感受态细胞,对获得的克隆提取DNA进行序列测定鉴定,得到重组质粒pUC19(HVT)-H1-H2。
2.6pUC19(HVT)-H1-H2-mini-F的构建与鉴定
将pUC19(HVT)-H1-H2质粒DNA应用Pac I进行酶切,回收产物与经过同样酶切处理的mini-F质粒DNA应用连接酶连接,将mini-F质粒酶切后的片段插入UL44 H1和UL44 H2之间,得到转移载体pUC19(HVT)-H1-H2-mini-F(结构如图1),转化DH5α感受态细胞。将转移载体pUC19(HVT)-H1-H2-mini-F分别应用EcoR I和Sca I酶切,应用Vector NTI软件预测酶切后的片段应分别为7507bp、5095bp与1338bp的3条和10165bp与3775bp大小的2条条带。酶切结果可见,EcoR I和Sca I酶切验证符合理论预测结果(图2)。
实施例2HVT Fc-126株的细菌人工染色体的构建
1、实验材料
SPF鸡胚来自购自北京梅里亚维通实验动物技术有限公司。HVT Fc-126病毒株
来自中监所(CVCC AV19)。Plasmid Mini Kit和Midi Kit购自QIAGEN公司。DMEM培养基、胰酶及新生牛血清购自Sigma公司;其它试剂均购自南京生工生物有限公司。DH10B感受态细胞购自Invitrogen公司。
2、构建HVT Fc-126株的细菌人工染色体的方法及鉴定
2.1Mini-F重组HVT的获得
取HVT FC-126株的DNA 10~20uL(约1~3ug)和转移载体pUC19(HVT)-H1-H2-mini-F的3~5uL(约3~5ug)混合,采用磷酸钙沉淀法共转染原代鸡胚成纤维细胞(Chicken embryofibroblast,CEF)。转染细胞传代培养,在波长为488nm紫外光下观察,挑取发出绿色荧光的细胞病变蚀斑传到新鲜制备的单层CEF上培养,然后连续多次挑取绿斑(图3),接种于6孔板CEF内纯化和扩繁后,收集6孔板内的细胞毒采取超声波裂解进行细胞破碎,破碎细胞病毒液10倍倍比稀释接种96孔新鲜制备的CEF平板上,筛选单孔出现单个绿斑的重组毒,经再次接入CEF进行扩繁,同时进行加压培养,即接入前1h将CEF的细胞培养液换成压力培养基,每24h换一次压力培养基,最终获得5株mini-F重组HVT。压力培养基是在DMEM培养基中添加终浓度为10%(质量百分浓度)的血清、100U/mL的青霉素、100μg/mL的链霉素、350μg/mL的霉酚酸、80μg/mL的黄嘌呤和100μg/mL的次黄嘌呤后获得的。
2.2火鸡疱疹病毒的细菌人工染色体的获得
取3株mini-F重组HVT,提取其DNA,分别电转化到E.coli DH10B感受态细胞中,分别取5~10个克隆,具体方法如下:取mini-F重组HVT的DNA约5μg加到50μL电转化感受态细胞E.coli DH10B中。轻轻混匀,冰浴5min左右,吸入到规格为0.1cm经预冷的电转化杯中,应用美国哈佛仪器公司ECM630电转仪,电转化条件为1500V、200Ω、25μF,电击完成后,加入到32℃预热的SOC培养基中,32℃、220r/min振荡活化1h,500g离心5min,取细菌沉淀用150μL LB培养基重悬后均匀涂布于含30μg/ml氯霉素的LB琼脂平板上,32℃培养48h以上,挑取若干阳性BAC克隆单菌落。各株mini-F重组HVT转化E.coli DH10B后,分别取一个克隆,命名为BAC-HVT(C1)、BAC-HVT(C2)和BAC-HVT(C3)。将BAC-HVT(C1)、BAC-HVT(C2)和BAC-HVT(C3)分别接种于含有30μg/ml氯霉素的LB培养液中,32℃振荡培养过夜,用碱裂解法提取质粒DNA,即得到了各火鸡疱疹病毒的细菌人工染色体。
2.3火鸡疱疹病毒的细菌人工染色体的鉴定
取BAC-HVT(C1)、BAC-HVT(C2)和BAC-HVT(C3)的质粒DNA,分别采用EcoR I和BamH I进行RFLP鉴定,将酶切图谱与应用Invitrogen软件预测的HVT FC-126株的图谱进行对比分析,对获得的细菌人工染色体克隆进行初步鉴定。其中,BAC-HVT(C1)质粒DNA的RFLP鉴定结果如图4,可以看到起酶切图谱是典型的BAC谱型,条带分布与软件分析结果吻合。对BAC-HVT(C2)和BAC-HVT(C3)的鉴定结果与BAC-HVT(C1)一致。
实施例3病毒拯救
1、材料
HVT FC-126株来自中监所(CVCC AV19),制备鸡胚成纤维细胞的SPF鸡胚
购自北京梅里亚维通实验动物技术有限公司。携带火鸡疱疹病毒的细菌人工染色体的重组菌BAC-HVT(C1)、BAC-HVT(C2)和BAC-HVT(C3)为实施例2中制备。Plasmid Mini Kit和Midi Kit购自QIAGEN公司。DMEM培养基、胰酶及新生牛血清购自Sigma公司。其它试剂均购自南京生工生物有限公司。
2、实验方法及结果
采用Qiagen plasmid Midi kit按照说明书提取BAC-HVT(C1)的质粒DNA,取约500ng DNA采用磷酸钙沉淀法转染新鲜制备的单层CEF。次日将培养液换成含10%胎牛血清的细胞培养液,培养48~72h后用胰酶将细胞消化成单个细胞,传代到新鲜制备的CEF细胞平板上,继续培养48~72h后,挑取在波长为488nm紫外光激发下发出绿色荧光的病毒蚀斑,得到
gC恢复病毒的获得:应用HVT-B H1 F和HVT-B H2 R为引物,以HVT Fc-126株的DNA为模板,PCR扩增由上游同源臂、gC基因和下游同源臂组成的同源重组片段。取同源重组片段2~3μg分别与BAC-HVT(C1)、BAC-HVT(C2)和BAC-HVT(C3)的质粒DNA约500ng共转染CEF,转染后96h取感染细胞接种到新鲜制备的单层CEF上培养,24~48h后,用甲基纤维素培养基覆盖,观察在紫外光激发下不发出绿色荧光的病变蚀斑(白斑),挑取白斑接种到新的CEF,如此重复多个循环直至纯化成功。BAC-HVT(C1)、BAC-HVT(C2)和BAC-HVT(C3)所携带细菌人工染色体的恢复毒分别得到一株,分别命名为HVTBAC-gC-R(C1)、HVTBAC-gC-R(C2)和HVTBAC-gC-R(C3)。以HVTBAC-gC-R(C1)、HVTBAC-gC-R(C2)和HVTBAC-gC-R(C3)的DNA为模板,用一对引物HVT-gC F(5’-TCGCCATGTGCGCCACTAGCAT-3’)和HVT-gC R(5’-AACACACACAAGACGCGAGGGCTC-3’)进行PCR扩增,并对扩增片段进行序列测定,验证gC基因是否恢复成功。其中HVTBAC-gC-R(C1)和HVT FC-126株均扩增出约1600~1700bp大小的片段,经序列测定证明两者序列完全一致,表明gC基因成功恢复,而未扩增出条带(如图5)。应用相同方法对HVTBAC-gC-R(C2)和HVTBAC-gC-R(C3)进行鉴定,结果与HVTBAC-gC-R(C1)一致。
实施例4恢复毒与亲本毒生长特性的比较
1、试验材料
、HVTBAC-gC-R(C1)、HVTBAC-gC-R(C2)和HVTBAC-gC-R(C3)株病毒为实施例3制备。将HVTBAC-gC-R(C1)在CEF上进行传代,第1代为HVTBAC-gC-R(C1)F1,第10代为HVTBAC-gC-R(C1)F10,第20代为HVTBAC-gC-R(C1)F20,分别保存毒种备用。HVT Fc-126株病毒来自中监所(CVCCAV19),制备鸡胚成纤维细胞的SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。DMEM培养基、胰酶及新生牛血清购自Sigma公司。其它试剂均购自南京生工生物有限公司。
2、实验方法
将HVT Fc-126、、HVTBAC-gC-R(C1)、HVTBAC-gC-R(C2)、HVTBAC-gC-R(C3)、HVTBAC-gC-R(C1)F1、HVTBAC-gC-R(C1)F10和HVTBAC-gC-R(C1)F20分别按0.01感染复数(Multiplicity of infection,MOI)接种到生长24h的单层原代CEF上培养。首先测定接种前和接种后6h、12h、24h、36h、48h和72h感染细胞经胰酶消化成单个细胞的病毒滴度。收集病毒时,首先去除细胞上清液,细胞经PBS洗涤3次,用0.1%胰酶消化后再用2mLDMEM重悬细胞。对单个细胞的病毒滴度,取100μL细胞悬液10倍倍比系列稀释至稀释度为10-7,接种到新鲜制备的单层CEF上,培养72h后计数蚀斑形成单位(Plaque forming unit,PFU)。另外,测定经裂解的细胞结合性病毒的滴度,收毒时间同上,方法为将重悬细胞离心后,倾去上清,将沉淀用SPGA保护液(中国兽药典:鸡马立克氏病火鸡疱疹病毒活疫苗制造及检验规程)再次重悬后,经50赫兹5min超声裂解后接种CEF测定滴度,试验共重复3次,根据PFU计数结果绘制病毒生长曲线。
3、结果
测定和比较了HVT Fc-126、、HVTBAC-gC-R(C1)、HVTBAC-gC-R(C2)和HVTBAC-gC-R(C3)株以及HVTBAC-gC-R(C1)F1,HVTBAC-gC-R(C1)F10和HVTBAC-gC-R(C1)F20感染CEF的多步生长动力学,结果显示HVT Fc-126和各株细菌人工染色体恢复毒接种CEF后,无论是经胰酶消化成单个细胞的病毒滴度(图6A),还是经裂解的细胞结合性病毒的滴度(图6B)都无显著差异。而gC缺失株病毒滴度明显下降,其经胰酶消化成单个细胞的病毒滴度下降了约3倍,而经裂解的细胞结合性病毒的滴度则下降了约100倍。表明HVT的gC基因虽然不是一个必需基因,但对HVT的增殖有重要作用。HVTBAC-gC-R(C1)传一代的HVTBAC-gC-R(C1)F1、传10代的HVTBAC-gC-R(C1)F10和传20代的HVTBAC-gC-R(C1)F20感染CEF后经裂解的细胞结合性病毒的滴度均无显著差异(图6C),表明细菌人工染色体恢复毒的稳定性好。
实施例5恢复毒与亲本毒对马立克氏病保护效力的比较
1、试验材料
、HVTBAC-gC-R(C2)和HVTBAC-gC-R(C3)株病毒为实施例3制备,HVTBAC-gC-R(C1)F1、HVTBAC-gC-R(C1)F10和HVTBAC-gC-R(C1)F20为实施例4制备。HVT FC-126株病毒来自中监所(CVCC AV19),马立克氏病病毒京-1株强毒株来自中监所(CVCC AV86),制备鸡胚成纤维细胞和孵化雏鸡的SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。DMEM培养基、胰酶及新生牛血清购自Sigma公司。其它试剂均购自南京生工生物有限公司。
2、实验方法
将、HVTBAC-gC-R(C2)、HVTBAC-gC-R(C3)、HVTBAC-gC-R(C1)F1、HVTBAC-gC-R(C1)F10和HVTBAC-gC-R(C1)F20分别以4000PFU接种1日龄SPF雏鸡20只,于接种后21天,与攻毒对照鸡20只(不免疫),腹腔注射马立克氏病病毒京-1株强毒株(CVCC AV86)0.2mL,空白对照组鸡不免疫不攻毒,观察2个月,对病死鸡和存活鸡只剖检观察病变,出现坐骨神经、臂神经丛等肿大,肝脏、肾脏、心脏、性腺、肺脏等脏器出现淋巴瘤的病理变化则判为马立克氏病阳性,统计马立克氏病发病比例,比较6种病毒对MD的免疫保护效力。
3、实验结果
将6种病毒分别以4000PFU接种1日龄雏鸡,未出现任何不良反应,于21日龄应用马立克氏病病毒京-1株强毒株攻毒,攻毒后观察至82日龄,对病死鸡和存活鸡只剖检观察马立克氏病的典型病变。其中空白对照组鸡只均健康,无马立克氏病病变。攻毒对照组85%(17/20)MD阳性,HVT Fc-126和HVTBAC-gC-R(C1)F1、HVTBAC-gC-R(C2)、HVTBAC-gC-R(C3)和HVTBAC-gC-R(C1)F20免疫组的MD阳性率分别为20%(4/20)、15%(3/20)、20%(4/20)10%(2/20)和15%(3/20),MD的阳性率分别减少了65%、70%、65%、75%和70%,达到了免疫保护合格的标准,表明本发明BAC-HVT(C1)所携带的细菌人工染色体是HVT全基因组克隆,可以应用于重组载体活疫苗的构建(表2)。
表2 MDV强毒攻击保护率
从实施例4中恢复毒的生长特性及本实施例中恢复毒对马立克氏病的保护效力,可以看出将HVT的gC基因敲除,并替换成mini-F序列的细菌人工染色体非常稳定,因此采用本发明构建的细菌人工染色体能构建出稳定性非常好的重组载体活疫苗。
实施例6采用本发明细菌人工染色体构建重组载体活疫苗
1抗原基因(HA)表达盒的构建
1.1抗原基因的获得
火鸡疱疹病毒(HVT)既可以用作鸡传染病的活载体,也可以用作鸭的传染病的活载体,鸡的传染病包括传染性法氏囊病,鸡新城疫,H5型禽流感,H9型禽流感,传染性喉气管炎和禽脑脊髓炎等,鸭的传染病包括H5型禽流感,H9型禽流感,鸭病毒性肝炎和鸭坦布苏病毒病等。可以通过PCR方法或人工合成的方法获得这些传染病病原的保护性抗原的基因,例如传染性法氏囊病病毒的VP2基因,禽流感的血凝素(HA)基因等。
1.2抗原基因表达盒的构建
为增强火鸡疱疹病毒活载体对外源基因的表达水平,在插入的外源基因的上游加上能增强转录的强启动子,如SV40启动子或MCMV的超早期启动子等,还在外源基因的起始密码子前端加上Kozak序列,使外源基因能正确翻译表达。并在外源基因的下游加上终止信号,例如SV40 PolyA序列等,使转录正确地终止。
2火鸡疱疹病毒载体活疫苗的构建,该疫苗是一种DIVA疫苗。
2.1重组HVT BAC的获得与鉴定
首先从BAC-HVT(C1)、BAC-HVT(C2)或BAC-HVT(C3)中提取质粒DNA,转入GS1783工程菌,然后参照文献方法(Tischer B,Smith G,OsterriederN.En passant mutagenesis:a two step markerless red recombination system.Methods Mol Biol.2010;634:421-430.或Wang J,Osterrieder N.Generation of an infectious clone of duck enteritis virus and generation of a vectored DEV expressing hemagglutinin of H5N1 avian influenza virus.Virus Res.2011;159(1):23-31.),应用En Passant方法将抗原基因表达盒插入到细菌人工染色体中HVT基因组的非编码区或非必需基因位点,构建含有抗原基因表达盒的重组HVT BAC,通过RFLP和PCR以及基因测序方法进行鉴定。
2.2火鸡疱疹病毒载体活疫苗重组毒的筛选与鉴定
按照实施例3应用midi-prep(QIAGEN)试剂盒,按说明书所述方法提取含有抗原基因表达盒的重组HVT BAC。按照实施例2方法,取含有抗原基因表达盒的重组HVT BAC 10~20uL(约1~3ug),按照实施例3方法转染鸡胚成纤维细胞拯救重组病毒的同时恢复gC基因,挑取在紫外光激发下不发出绿色荧光的重组病毒。提取重组病毒的DNA,通过PCR和基因测序鉴定外源基因表达盒是否正确插入,同时鉴定gC基因是否正确恢复。通过将重组病毒连续传代25代以上,检测传代后外源基因是否发生丢失和变异,验证重组病毒的稳定性。
2.3火鸡疱疹病毒载体活疫苗的研制
经验证合格的重组病毒按照国家兽用生物制品规程的相关要求,可用于研制火鸡疱疹病毒载体活疫苗,该疫苗既能对马立克氏病提供保护,也能对所载外源基因的病原所引起的疫病提供保护。
2.4区别免疫动物与自然感染动物
应用本发明研制的火鸡疱疹病毒载体活疫苗免疫动物后只表达病原的一个保护性抗原,免疫后对所载外源基因的病原仅产生此抗原的抗体,而在动物感染病原时,则不仅产生针对此保护性抗原的抗体,也产生针对其他抗原的抗体,所以应用本载体活疫苗免疫动物可以通过ELISA等方法检测动物的血清抗体区别免疫动物与自然感染动物,这对于疫病净化是关键的技术,意义重大。
SEQUENCE LISTING
<110> 江苏省农业科学院
<120> 一种新型火鸡疱疹病毒的细菌人工染色体、构建方法与应用
<130> 20160826
<160> 6
<170> PatentIn version 3.3
<210> 1
<211> 29
<212> DNA
<213> artificial
<220>
<223> HVT-B H1 F
<400> 1
gtagaattcc agtgtatgtt ccttagtgt 29
<210> 2
<211> 38
<212> DNA
<213> artificial
<220>
<223> HVT-B H1 R
<400> 2
atcccgggct ttaattaagt ttcgatagat gcgtaata 38
<210> 3
<211> 36
<212> DNA
<213> artificial
<220>
<223> HVT-B H2 F
<400> 3
cgggatccag ttaattaaat cagcaccatc gcattg 36
<210> 4
<211> 32
<212> DNA
<213> artificial
<220>
<223> HVT-B H2 R
<400> 4
gacaagcttg aaatgtctat ggtgtgattg ga 32
<210> 5
<211> 1297
<212> DNA
<213> HVT FC-126
<400> 5
gtgtatgttc cttagtgtgc atcgctgcac atttagctgt taccgtgtcg ggagtggcat 60
taattccgct tatcgatcaa aacagagctt acggaaactg tacggtatgt gtaattgccg 120
gattcatcgc tacgtttgct gcacgactta cgataagact ttcggaaacg cttatgctag 180
tgggcaagcc ggcgcagttt atatttgcta taatcgcttc cgttgcggaa acactgatca 240
ataacgaggc gcttgccatc agtaatacta cttacaaaac tgcattgcga ataatcgaag 300
taacatcttt ggcgtgtttt gttatgctcg gggcaataat tacatcccac aactatgtct 360
gcatttcaac ggcaggggac ttgacttgga aggcgggatt tttcatgctt accaccggaa 420
cattactcgg tataacaata ccaaacatac acccaatccc tctcgcgggg tttcttgcag 480
tctatacaat attggctata aatatcgcta gagatgcaag cgctacatta ttatccactt 540
gctattatcg caattgccgc gagaggacta tacttcgccc ttctcgtctc ggacatggtt 600
acacaatccc ttctcccggt gccgatatgc tttatgaaga agacgtatat agttttgacg 660
cagctaaagg ccattattcg tcaatatttc tatgttatgc catggggctt acaacaccgc 720
tgattattgc gctccataaa tatatggcgg gcattaaaaa ttcgtcagat tggactgcta 780
cattacaagg catgtacggg cttgtcttgg gatcgctatc gtcactatgt attccatcca 840
gcaacaacga tgccctaatt cgtcccattc aaattttgat attgataatc ggtgcactgg 900
ccattgcatt ggctggatgt ggtcaaatta tagggcctac attatttgcc gcgagttcgg 960
ctgcgatgtc atgttttaca tgtatcaata ttcgcgctac taataagggt gtcaacaaat 1020
tggcagcagc cagtgtcgtg aaatctgtac tgggcttcat tatttccggg atgcttactt 1080
gcgtgctatt accactatcg tgatagatcg tcggtctgcg catcgcccat gctggcggaa 1140
cgctctttcg aaccgtgaat aaaactttgt atctactaaa caataacttt gtgttttatt 1200
gagcggtcga aaacaatgag gagctgcaat ttaaagctaa ccgcatacgc cgggcgggta 1260
aagaccattt tataccatat tacgcatcta tcgaaac 1297
<210> 6
<211> 1043
<212> DNA
<213> HVT FC-126
<400> 6
atcagcacca tcgcattgtt tcgtagatga ctcatgttca gtccgcgtga tgtcaaaaat 60
acgtattttt ggtatcacgc agcggccaaa atgcccatta tgttattttt actccaaacg 120
cggtatttaa aacatcggga cgtacatcat gtggcgcacg ttaatcgtat acggtgccgc 180
tacattaaaa atcgcaagtc tccgaatatc aagctcacgg ccaaaacgtc ggtaataatc 240
ttacgcatcg aatgtgatac ggataccgta caatcgctga gtagatttcc tatatagtta 300
ctcagtagtg atacacaatc acaaaatcgc tggggtatat catataagaa tgatgtcgcc 360
cacccctgaa gatgatcgcg atctcgttgt ggttcgtgga cgtctccgaa tgatggatag 420
cggcacggaa acagatagag agcaacgaca tccacgtacg acttggcgat cgatctgttg 480
tgggtgtacg ataggaatgg tatttaccat attcgttctc gtagcggcag tattgttggg 540
atcactattc actgtttcat acatggccat ggaatcggga acatgtcccg atgaatggat 600
tggtttgggt tatagttgca tgcgcgtggc cgggaaaaat gcaactgatc ttgaggcgtt 660
ggatacatgt gctcggcata acagcaaact tattgacttc gcaaacgcca aagttctggt 720
tgaagctatc gccccattcg gtgtgccaaa tgcagcatat ggggaagtct tccggttaag 780
ggacagcaaa accacgtgta tacgacctac catgggagga cccgtgtcgg cagactgtcc 840
tgtaacatgt accgttatat gtcagcgacc caggcctcta agtaccatgt cttccatcat 900
tagagatgcc cgcgtgtatc ttcatttaga acgacgcgat tattatgaag tctacgcctc 960
tgtcctctct aatgcgatga gtaaataaaa acgcacctct aacggttact gtgttttatt 1020
tatccaatca caccatagac att 1043
- 还没有人留言评论。精彩留言会获得点赞!