重组单纯疱疹病毒HSV‑hTERTp_ICP4_Hep‑GFP及其对应的诊断试剂盒的制作方法
本发明涉及重组单纯疱疹病毒,具体地指一种重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep-GFP及其对应的诊断试剂盒。
背景技术:
端粒是真核生物染色体末端的一种特殊结构,其作用是维护染色体结构稳定,包括防止染色体末端融合,保护染色体结构基因和避免遗传信息在复制中丢失。端粒酶是由小分子RNA和蛋白质组成的逆转录酶,能利用自身RNA为模板合成端粒DNA,弥补随细胞有丝分裂逐渐缩短的端粒。其有三个主要组成部分:人端粒酶RNA(human telomerase RNA,hTR)、端粒酶相关蛋白(telomerase-associated protein,TP1/TLP1)、人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)。端粒酶RNA在大多数细胞中都表达,而人端粒酶逆转录酶是端粒酶的限速成分,仅在端粒酶阳性的细胞中表达,与端粒酶活性相关。尽管一些肿瘤细胞在重组时通过替代性端粒延长(alternative lengthening of telomeres,ALT)机制来维持端粒长度,但仍有90%以上的肿瘤细胞通过上调hTERT来活化端粒酶,而且hTERT仅在极少数正常体细胞中表达。现已知端粒酶启动子(hTERTp)仅在端粒酶活性高的细胞中启动转录过程,这就为肿瘤靶向治疗提供了一个很好的契机。
单纯疱疹病毒(herpes simplex virus,HSV)表达的感染细胞蛋白(infected cell proteins,ICPs)分为三个等级:初始(immediate early,IE)、早期(early)和晚期(late)。其中IE蛋白是影响病毒复制的关键蛋白,包括:ICP0、ICP4、ICP22、ICP27和ICP47,而其中ICP4是最关键的复制相关蛋白。如果将ICP4基因的固有启动子置换成hTERTp,就有可能使HSV选择性地在肿瘤细胞内繁殖。
人工合成人端粒酶逆转录酶启动子(hTERTp)以替换实验室现有I型溶瘤单纯疱疹病毒(17+毒株)基因组中ICP4原启动子,构建出一种新型病毒HSV-hTERTp_ICP4。该重组病毒能选择性地在人肿瘤细胞内生长繁殖,而不在人的正常细胞中繁殖。
构建含hTERTp_ICP4表达盒的质粒是构建的HSV-hTERTp_ICP4病毒的基础,用含hTERTp_ICP4表达盒的质粒,我们构建了原始的HSV-hTERTp_ICP4,该重组病毒虽然可以选择性地在肿瘤细胞内繁殖,但繁殖滴度较低(104/ml)。
为了解决繁殖滴度较低的缺陷,迫切需要构建一种繁殖滴度较高的病毒。
技术实现要素:
本发明所要解决现有病毒繁殖滴度较低的缺陷,提供了一种重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep-GFP,该病毒具有选择性地高滴度繁殖力,病毒在肝癌细胞繁殖滴度稳定在106以上。
本发明还提供了一种由重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep-GFP制备得到的诊断试剂盒。
为实现上述目的,本发明提供的一种重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep-GFP,所述病毒的基因组上的端粒酶逆转录酶启动子和ICP4基因之间插入长度为25bp的DNA片段,且ICP34.5位点插入了GFP表达盒,其中,DNA片段序列为TTGCCCCAAGCGGCATTTGGGTTCA。
一种重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep-GFP的制备方法,包括以下步骤:
1)用人端粒酶逆转录酶启动子hTERTp取代含有ICP4基因的单纯疱疹病毒中的ICP4基因启动子,构建该重组单纯疱疹病毒HSV-hTERTp_ICP4:
(1)构建穿梭质粒pICP4del-hTERTp_ICP4和pICP4del-eGFP
a.用BHK细胞培养含有ICP4基因的单纯疱疹病毒,并纯化其基因组DNA;
b.扩增ICP4基因上游侧翼序列:以步骤a)中所得病毒基因组DNA为模板,用以下ICP4USf正向引物和ICP4USr反向引物:
ICP4USf正向引物:ccctccagacgcaccggagtcggggg,
ICP4USr反向引物:aagtcgactctagaggatcgatctctgacctgagattggcggcactgaggta
扩增出ICP4基因上游侧翼序列;
c.扩增ICP4基因下游侧翼序列:以步骤a中所得病毒基因组DNA为模板,用以下ICP4DSf正向引物和ICP4USr反向引物:
ICP4DSf正向引物:aaaagtcgacctgcaggcatgctaacgaggaacgggcagggggc
ICP4DSr反向引物:aaaaaagcttgcatgcccacgtgcgcggggccagacgggct
扩增出ICP4基因下游侧翼序列;
将上下游侧翼序列克隆到pSP73质粒上,构建pICP4del及pICP4del-eGFP质粒:将SalI酶切的前述扩增出的ICP4基因的上游侧翼序列及SalI/HindIII双酶切的前述扩增出的ICP4基因的下游侧翼序列混合并连接到pSP73的EcoRV/HindIII位点,得到pICP4del;用EcoRI/XhoI从pcDNA3.1-eGFP切下CMV启动子控制的eGFP表达盒,经T4DNA聚合酶补平末端后插入到pICP4del的EcoRV位点,得到pICP4del-eGFP;
d.分三次PCR扩增出ICP4基因中三段序列:
首先,使用以下引物:
ICP4-1st正向引物:ttttttgaattcatggcgtcggagaacaagcagcgcc
ICP4-1st反向引物:tggagccaccccatggcctccgcgt
ICP4-2nd正向引物:cgacgccgcgcagcagtacgccctg
ICP4-2nd反向引物:cggcgggggcgggcccggcgcaccg
ICP4-3rd正向引物:cctcatgtttgacccgcgggccctg
ICP4-3rd反向引物:ttttttctcgagttacagcaccccgtccccctcgaac
以步骤a)中所得病毒基因组DNA为模板,分别扩增出三段基因片段ICP4-1st、ICP4-2nd和ICP4-3rd,而后分别将该三段基因片段插入pSP73质粒的EcoRV位点构建出以下三种质粒:pSP73-ICP4-1st、pSP73-ICP4-2nd、pSP73-ICP4-3rd,从该三种质粒中用EcoRI和BsrGI剪切出ICP4-1st、用BsrGI和PvuI剪切出ICP4-2nd及用PvuI和XhoI剪切出ICP-3rd待用;
e.从含人端粒酶逆转录酶启动子hTERTp的质粒中用NruI和HindIII切下hTERTp片段,取代从pcDNA3-NHN上用NruI和HindIII切除的CMV启动子,得到质粒pcDNA3-NHN-hTERTp,其中,pcDNA3-NHN是在pcDNA3的NheI位点插入NheI-HapI-NheI酶切位点序列所得;
f.将步骤c)中得到的ICP4-1st、ICP4-2nd和ICP4-3rd混合并连接到步骤d)得到的pcDNA3-NHN-hTERTp的EcoRI及XhoI位点,得到质粒pcDNA3-NHN-hTERTp_ICP4;
g.用SalI酶切步骤b)得到的含ICP4基因上下游侧翼序列的质粒pICP4del,并补平末端待用,用PmeI和HpaI从步骤e)得到的质粒pcDNA3-NHN-hTERTp_ICP4剪切出hTERTp_ICP4表达盒片段,并将其与该酶切后待用的pICP4del质粒连接,构建出质粒pICP4del-hTERTp_ICP4;
h.构建BHK-ICP4辅助细胞:用EcoRI和XhoI从步骤e)质粒pcDNA3-NHN-hTERTp_ICP4中酶切出ICP4基因,并克隆到pcDNA3中CMV启动子的下游EcoRI和XhoI位点,得到pcDNA3-CMV-ICP4质粒;将该pcDNA3-CMV-ICP4质粒转染BHK细胞,该pcDNA3-CMV-ICP4质粒DNA可重组到BHK细胞基因组中,使有些BHK重组细胞获得对新霉素的抗性和表达ICP4,用抗菌素G418杀死未重组的BHK细胞,经过几轮的亚克隆筛选,用RT-PCR方法筛选出表达ICP4的BHK-ICP4辅助细胞;
(2)剔除基因组中ICP4基因启动子并插入端粒酶逆转录酶启动子hTERTp启动子:
a.用BHK细胞培养该含有ICP4基因的单纯疱疹病毒,并提取病毒基因组DNA;
b.将步骤A中该病毒基因组DNA与步骤1)的b)小步骤得到的质粒pICP4del-eGFP共转入步骤1)的g)小步骤得到的BHK-ICP4辅助细胞内,经同源重组,该质粒pICP4del-eGFP中绿色荧光蛋白GFP表达盒置换了该含有ICP4基因的单纯疱疹病毒HSV的ICP4基因,使得重组病毒的毒斑发绿色荧光,经过几轮的噬斑纯化,挑选绿色荧光毒斑,纯化出重组病毒HSV-d4GFP;
c.培养HSV-d4GFP病毒,并提取基因组DNA;
d.将重组病毒HSV-d4GFP的基因组DNA和步骤1)中f小步骤得到质粒pICP4del-hTERTp_ICP4的DNA共转入BHK-ICP4辅助细胞中,经同源重组,hTERTp_ICP4表达盒置换了该重组病毒HSV-d4GFP的绿色荧光蛋白GFP表达盒,使新重组病毒的毒斑不发绿色荧光,经过几轮的噬斑纯化,挑选无荧光毒斑,纯化出该重组单纯疱疹病毒HSV-hTERTp_ICP4;
2)构建重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep
(1)按以下序列合成互补的、长度为145个碱基的DNA片段,分别为hp-ICP4正和hp-ICP4负。其中N序列(25个碱基)为随机碱基,两侧翼已知序列一侧与HSV-hTERTp_ICP4上端粒酶逆转录酶启动子的3’端序列同源,另一侧与ICP4基因5’端序列同源;
hp-ICP4正:
CCGCGAAGCTTGGTACCGAGCTCGGATCCACTAGTAACGGCCGCCAGTGTGCTGGAATTCNNNNNNNNNNNNNNNNNNNNNNNNNGAATTCATGGCGTCGGAGAACAAGCAGCGCCCCGGCTCCCCGGGCCCCACCGACGGGCCG
hp-ICP4负:
CGGCCCGTCGGTGGGGCCCGGGGAGCCGGGGCGCTGCTTGTTCTCCGACGCCATGAATTCNNNNNNNNNNNNNNNNNNNNNNNNNGAATTCCAGCACACTGGCGGCCGTTACTAGTGGATCCGAGCTCGGTACCAAGCTTCGCGG
(2)构建重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep:
提取HSV-hTERTp_ICP4病毒基因组DNA与上述合成的DNA片段hp-ICP4正和hp-ICP4负同源重组,用肝癌细胞HepG-2筛选,得到针对肝癌细胞高滴度的HSV-hTERTp_ICP4_Hep(简称HSV_Hep);
(3)培养纯化HSV_Hep重组病毒并提取病毒基因组DNA,对端粒酶逆转录酶启动子与ICP4基因结合部测序,确定25个碱基的序列为TTGCCCCAAGCGGCATTTGGGTTCA;
3)构建重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep-GFP
(1)构建穿梭质粒pdICP34.5-eGFP
a.用BHK-ICP4细胞培养HSV-hTERTp_ICP4,并纯化其基因组DNA;
b.扩增ICP34.5基因上游侧翼序列:以步骤a中所得病毒基因组DNA为模板,用以下ICP34.5USf正向引物和ICP34.5USr反向引物:
ICP34.5USf:CTCTGACCTGAGATTGGCGGCACTG
ICP34.5USr:
GCGGCCGCAGCGCTGCGGCCGCCGCGGGCGCGCTCCTGACCGCGGG
扩增出ICP34.5基因上游侧翼序列;
c.扩增ICP34.5基因下游侧翼序列:以步骤a)中所得病毒基因组DNA为模板,用以下ICP34.5DSf正向引物和ICP34.5DSr反向引物:
ICP34.5DSf:
GCGGCCGCAGCGCTGCGGCCGCCAGCGCGGCGGGGCCCGGCCAACCA
ICP34.5DSr:TTCTTCCCTCTTCTCCCGCCCTCCA
扩增出ICP34.5基因下游侧翼序列;
d.连接ICP34.5基因上下游侧翼序列:以步骤b)和c)得到的ICP34.5上下游侧翼序列为模版,用ICP34.5USf和ICP34.5DSr扩增连接ICP34.5基因上下游侧翼序列;
e.将上下游侧翼序列克隆到pSP72质粒上,构建pdICP34.5;
f.从pcDNA3.1-eGFP获得eGFP表达序列并插入到pdICP34.5的AfeI位点,得到pdICP34.5-eGFP;
(2)构建HSV-hTERTp_ICP4_Hep-GFP
a.用HEPG-2细胞培养HSV-hTERTp_ICP4_Hep(简称HSV_Hep),并纯化其基因组DNA;
b.将步骤A中该病毒基因组DNA与步骤(1)f中该质粒pdICP34.5-eGFP共转入肝癌Hep-2细胞内,经同源重组,该质粒pdICP34.5-eGFP中绿色荧光蛋白GFP表达盒置换了含有ICP34.5基因的单纯疱疹病毒HSV_Hep的ICP34.5基因,使得重组病毒的毒斑发绿色荧光,经过几轮的噬斑纯化,挑选绿色荧光毒斑,纯化出重组病毒HSV-hTERTp_ICP4_Hep-GFP(简称HSV_Hep-GFP)。
本发明还提供了一种重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep-GFP在制备肿瘤的诊断试剂盒中的应用。
所述诊断试剂盒由重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep-GFP、APC标记的人CD45抗体和红细胞裂解液组成。
进一步地,所述单纯疱疹病毒HSV-hTERTp_ICP4_Hep-GFP含量为5E6-5E7CCID50/ml,所述PEcy5标记的人CD45抗体的含量为0.1~0.5mg/ml。
再进一步地,所述红细胞裂解液中含有含有氯化铵、乙二胺四乙酸二钠、碳酸氢钾和超纯水,其中,所述红细胞裂解液中,氯化铵的含量为0.10~0.20M、乙二胺四乙酸二钠的含量为0.5~2mM、碳酸氢钾的含量为5~15mM。优选地,氯化铵的含量为0.15M、乙二胺四乙酸二钠的含量为1mM、碳酸氢钾的含量为10mM。
本发明的理论基础
启动子和其调控基因之间的碱基序列组成可能会影响基因的表达量,而病毒早期蛋白ICP4表达量的高低又可影响病毒在细胞中的繁殖能力及滴度。在HSV-hTERTp_ICP4基础上,我们用同源重组方法在病毒基因组的hTERTp与ICP4之间定点插入合成的随机核苷酸短序列(25nt),并用不同种类的肿瘤细胞筛选繁殖滴度较高的重组病毒。我们意外地发现启动子(hTERTp)和基因(ICP4)之间序列的变化导致了不同的重组病毒在不同类型肿瘤细胞中的繁殖滴度出现了较大的差异。
本发明的有益效果
本发明用合成的随机核苷酸短序列与HSV1-hTERTp_ICP4病毒基因组进行定点重组(在hTERTp与ICP4之间)。短序列的改变不但可以增加病毒的繁殖滴度,还可以使不同病毒针对不同类型肿瘤细胞产生选择性地高滴度繁殖。如有的病毒在肝癌细胞繁殖较好,有的病毒则在肝癌细胞产生更高的滴度等等。
附图说明
图1为病毒感染细胞对比图;
图中,图1A为病毒感染HepG-2细胞对比图;
图1B为病毒感染HuH7细胞对比图;
图1C为病毒感染7721细胞对比图;
图2为肝癌的CTC检测图。
具体实施方式
为了更好地解释本发明,以下结合具体实施例进一步阐明本发明的主要内容,但本发明的内容不仅仅局限于以下实施例。
实施例1
一种重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep-GFP的制备方法,包括以下步骤:
1)用人端粒酶逆转录酶启动子hTERTp取代含有ICP4基因的单纯疱疹病毒中的ICP4基因启动子,构建该重组单纯疱疹病毒HSV-hTERTp_ICP4:
(1)构建穿梭质粒pICP4del-hTERTp_ICP4和pICP4del-eGFP
a.用BHK细胞培养含有ICP4基因的单纯疱疹病毒,并纯化其基因组DNA;
b.扩增ICP4基因上游侧翼序列:以步骤a)中所得病毒基因组DNA为模板,用以下ICP4USf正向引物和ICP4USr反向引物:
ICP4USf正向引物:ccctccagacgcaccggagtcggggg,
ICP4USr反向引物:aagtcgactctagaggatcgatctctgacctgagattggcggcactgaggta
扩增出ICP4基因上游侧翼序列;
c.扩增ICP4基因下游侧翼序列:以步骤a中所得病毒基因组DNA为模板,用以下ICP4DSf正向引物和ICP4USr反向引物:
ICP4DSf正向引物:aaaagtcgacctgcaggcatgctaacgaggaacgggcagggggc
ICP4DSr反向引物:aaaaaagcttgcatgcccacgtgcgcggggccagacgggct
扩增出ICP4基因下游侧翼序列;
将上下游侧翼序列克隆到pSP73质粒上,构建pICP4del及pICP4del-eGFP质粒:将SalI酶切的前述扩增出的ICP4基因的上游侧翼序列及SalI/HindIII双酶切的前述扩增出的ICP4基因的下游侧翼序列混合并连接到pSP73的EcoRV/HindIII位点,得到pICP4del;用EcoRI/XhoI从pcDNA3.1-eGFP切下CMV启动子控制的eGFP表达盒,经T4DNA聚合酶补平末端后插入到pICP4del的EcoRV位点,得到pICP4del-eGFP;
d.分三次PCR扩增出ICP4基因中三段序列:
首先,使用以下引物:
ICP4-1st正向引物:ttttttgaattcatggcgtcggagaacaagcagcgcc
ICP4-1st反向引物:tggagccaccccatggcctccgcgt
ICP4-2nd正向引物:cgacgccgcgcagcagtacgccctg
ICP4-2nd反向引物:cggcgggggcgggcccggcgcaccg
ICP4-3rd正向引物:cctcatgtttgacccgcgggccctg
ICP4-3rd反向引物:ttttttctcgagttacagcaccccgtccccctcgaac
以步骤a)中所得病毒基因组DNA为模板,分别扩增出三段基因片段ICP4-1st、ICP4-2nd和ICP4-3rd,而后分别将该三段基因片段插入pSP73质粒的EcoRV位点构建出以下三种质粒:pSP73-ICP4-1st、pSP73-ICP4-2nd、pSP73-ICP4-3rd,从该三种质粒中用EcoRI和BsrGI剪切出ICP4-1st、用BsrGI和PvuI剪切出ICP4-2nd及用PvuI和XhoI剪切出ICP-3rd待用;
e.从含人端粒酶逆转录酶启动子hTERTp的质粒中用NruI和HindIII切下hTERTp片段,取代从pcDNA3-NHN上用NruI和HindIII切除的CMV启动子,得到质粒pcDNA3-NHN-hTERTp,其中,pcDNA3-NHN是在pcDNA3的NheI位点插入NheI-HapI-NheI酶切位点序列所得;
f.将步骤c)中得到的ICP4-1st、ICP4-2nd和ICP4-3rd混合并连接到步骤d)得到的pcDNA3-NHN-hTERTp的EcoRI及XhoI位点,得到质粒pcDNA3-NHN-hTERTp_ICP4;
g.用SalI酶切步骤b)得到的含ICP4基因上下游侧翼序列的质粒pICP4del,并补平末端待用,用PmeI和HpaI从步骤e)得到的质粒pcDNA3-NHN-hTERTp_ICP4剪切出hTERTp_ICP4表达盒片段,并将其与该酶切后待用的pICP4del质粒连接,构建出质粒pICP4del-hTERTp_ICP4;
h.构建BHK-ICP4辅助细胞:用EcoRI和XhoI从步骤e)质粒pcDNA3-NHN-hTERTp_ICP4中酶切出ICP4基因,并克隆到pcDNA3中CMV启动子的下游EcoRI和XhoI位点,得到pcDNA3-CMV-ICP4质粒;将该pcDNA3-CMV-ICP4质粒转染BHK细胞,该pcDNA3-CMV-ICP4质粒DNA可重组到BHK细胞基因组中,使有些BHK重组细胞获得对新霉素的抗性和表达ICP4,用抗菌素G418杀死未重组的BHK细胞,经过几轮的亚克隆筛选,用RT-PCR方法筛选出表达ICP4的BHK-ICP4辅助细胞;
(2)剔除基因组中ICP4基因启动子并插入端粒酶逆转录酶启动子hTERTp启动子:
a.用BHK细胞培养该含有ICP4基因的单纯疱疹病毒,并提取病毒基因组DNA;
b.将步骤A中该病毒基因组DNA与步骤1)的b)小步骤得到的质粒pICP4del-eGFP共转入步骤1)的g)小步骤得到的BHK-ICP4辅助细胞内,经同源重组,该质粒pICP4del-eGFP中绿色荧光蛋白GFP表达盒置换了该含有ICP4基因的单纯疱疹病毒HSV的ICP4基因,使得重组病毒的毒斑发绿色荧光,经过几轮的噬斑纯化,挑选绿色荧光毒斑,纯化出重组病毒HSV-d4GFP;
c.培养HSV-d4GFP病毒,并提取基因组DNA;
d.将重组病毒HSV-d4GFP的基因组DNA和步骤1)中f小步骤得到质粒pICP4del-hTERTp_ICP4的DNA共转入BHK-ICP4辅助细胞中,经同源重组,hTERTp_ICP4表达盒置换了该重组病毒HSV-d4GFP的绿色荧光蛋白GFP表达盒,使新重组病毒的毒斑不发绿色荧光,经过几轮的噬斑纯化,挑选无荧光毒斑,纯化出该重组单纯疱疹病毒HSV-hTERTp_ICP4;
2)构建重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep
(1)按以下序列合成互补的、长度为145个碱基的DNA片段,分别为hp-ICP4正和hp-ICP4负。其中N序列(25个碱基)为随机碱基,两侧翼已知序列一侧与HSV-hTERTp_ICP4上端粒酶逆转录酶启动子的3’端序列同源,另一侧与ICP4基因5’端序列同源;
hp-ICP4正:
CCGCGAAGCTTGGTACCGAGCTCGGATCCACTAGTAACGGCCGCCAGTGTGCTGGAATTCNNNNNNNNNNNNNNNNNNNNNNNNNGAATTCATGGCGTCGGAGAACAAGCAGCGCCCCGGCTCCCCGGGCCCCACCGACGGGCCG
hp-ICP4负:
CGGCCCGTCGGTGGGGCCCGGGGAGCCGGGGCGCTGCTTGTTCTCCGACGCCATGAATTCNNNNNNNNNNNNNNNNNNNNNNNNNGAATTCCAGCACACTGGCGGCCGTTACTAGTGGATCCGAGCTCGGTACCAAGCTTCGCGG
(2)构建重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep:
提取HSV-hTERTp_ICP4病毒基因组DNA与上述合成的DNA片段hp-ICP4正和hp-ICP4负同源重组,用肝癌细胞HepG-2筛选,得到针对肝癌细胞高滴度的HSV-hTERTp_ICP4_Hep(简称HSV_Hep);
(3)培养纯化HSV_Hep重组病毒并提取病毒基因组DNA,对端粒酶逆转录酶启动子与ICP4基因结合部测序,确定25个碱基的序列为TTGCCCCAAGCGGCATTTGGGTTCA;
3)构建重组单纯疱疹病毒HSV-hTERTp_ICP4_Hep-GFP
(1)构建穿梭质粒pdICP34.5-eGFP
a.用BHK-ICP4细胞培养HSV-hTERTp_ICP4,并纯化其基因组DNA;
b.扩增ICP34.5基因上游侧翼序列:以步骤a中所得病毒基因组DNA为模板,用以下ICP34.5USf正向引物和ICP34.5USr反向引物:
ICP34.5USf:CTCTGACCTGAGATTGGCGGCACTG
ICP34.5USr:
GCGGCCGCAGCGCTGCGGCCGCCGCGGGCGCGCTCCTGACCGCGGG
扩增出ICP34.5基因上游侧翼序列;
c.扩增ICP34.5基因下游侧翼序列:以步骤a)中所得病毒基因组DNA为模板,用以下ICP34.5DSf正向引物和ICP34.5DSr反向引物:
ICP34.5DSf:
GCGGCCGCAGCGCTGCGGCCGCCAGCGCGGCGGGGCCCGGCCAACCA
ICP34.5DSr:TTCTTCCCTCTTCTCCCGCCCTCCA
扩增出ICP34.5基因下游侧翼序列;
d.连接ICP34.5基因上下游侧翼序列:以步骤b)和c)得到的ICP34.5上下游侧翼序列为模版,用ICP34.5USf和ICP34.5DSr扩增连接ICP34.5基因上下游侧翼序列;
e.将上下游侧翼序列克隆到pSP72质粒上,构建pdICP34.5;
f.从pcDNA3.1-eGFP获得eGFP表达序列并插入到pdICP34.5的AfeI位点,得到pdICP34.5-eGFP;
(2)构建HSV-hTERTp_ICP4_Hep-GFP
A.用HEPG-2细胞培养HSV-hTERTp_ICP4_Hep(简称HSV_Hep),并纯化其基因组DNA;
B.将步骤A中该病毒基因组DNA与步骤(1)f中该质粒pdICP34.5-eGFP共转入肝癌HepG-2细胞内,经同源重组,该质粒pdICP34.5-eGFP中绿色荧光蛋白GFP表达盒置换了含有ICP34.5基因的单纯疱疹病毒HSV_Hep的ICP34.5基因,使得重组病毒的毒斑发绿色荧光,经过几轮的噬斑纯化,挑选绿色荧光毒斑,纯化出重组病毒HSV-hTERTp_ICP4_Hep-GFP(简称HSV_Hep-GFP)。
实施例2HSV_Hep-GFP选择性地在肝癌细胞中繁殖并产生高滴度病毒:
将HSV_HEP-GFP以MOI=0.01分别感染肝癌细胞(HuH7、HepG-2、7721)、肺癌细胞(A549、PG)、胃癌细胞BGC823、结肠癌细胞HT-29、人红白血病细胞TF-1、淋巴瘤细胞U937、乳腺癌细胞MD-MB-231、咽部鳞癌细胞Fadu、黑色素瘤细胞A375,于6、12、24、48、72小时检测病毒滴度。结果见表1。实验数据显示HSV_HEP-GFP感染肝癌细胞效果最好,24小时或之后病毒繁殖滴度明显高于(2个对数以上)其它癌种细胞繁殖病毒能达到的滴度。
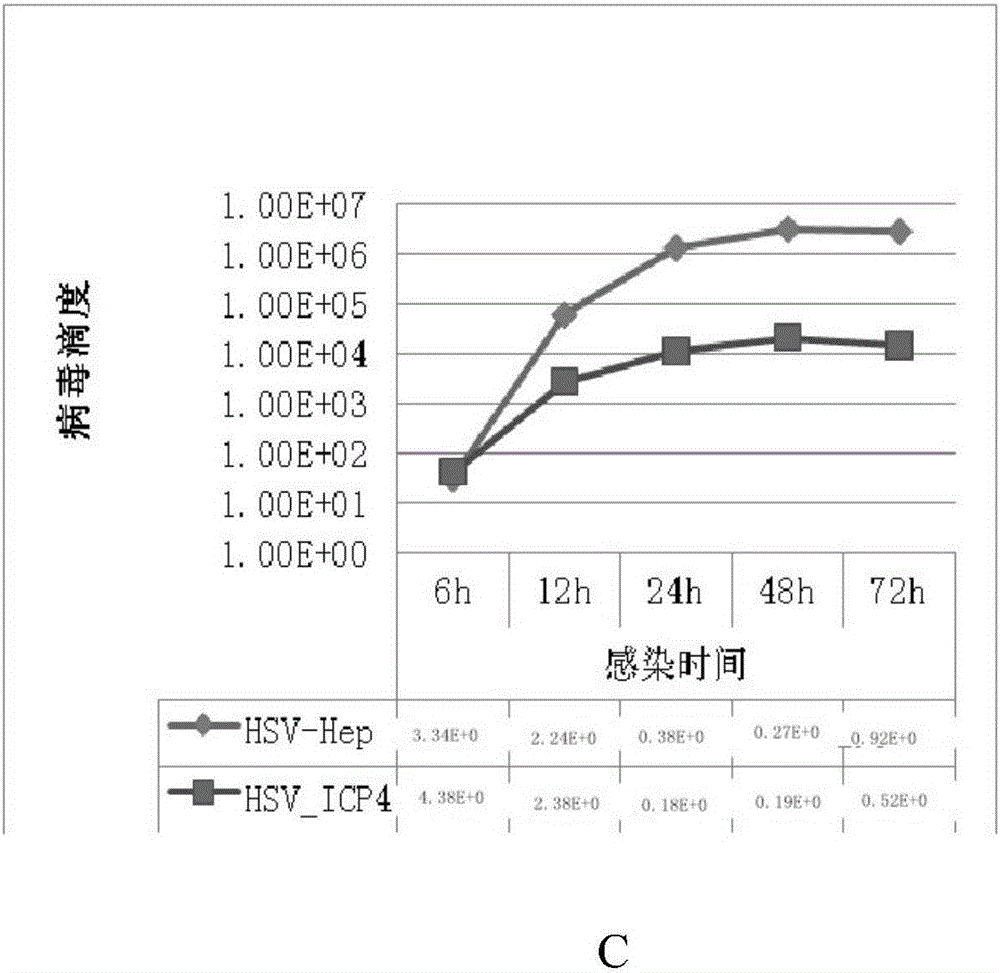
实施例3HSV_Hep-GFP较HSV_ICP4在肝癌细胞中产生更高滴度的病毒
将HSV_HEP及HSV_ICP4以MOI=0.01分别感染肝癌细胞HuH7、HepG-2、7721,于6、12、24、48、72小时检测病毒滴度。结果见图1-3。实验数据显示HSV_HEP感染3种肝癌细胞,24小时或之后病毒繁殖滴度均达到106以上,而HSV_ICP4虽然能在3种肝癌细胞中繁殖,但病毒滴度较低,峰值仅达104。两种病毒感染肝癌细胞,其繁殖滴度相差2个对数。
实施例4、肿瘤检测试剂盒检测肝癌病人血中循环肿瘤细胞(CTC)
实验分两组,肝癌病人50例、正常志愿者50例。每例受试人员均按以下步骤检测:
1)采外周静脉血4ml,1800r/min(根据不同型号离心机调整期转速,以500g为准)离心5min;
2)去上层血浆(切忌破坏白细胞层,可适当保留部分血浆),将收集的细胞转入50ml离心管中;
3)加24ml红细胞裂解液,轻轻混匀,室温静置5~10min,直至溶液变透亮,1800r/min离心5min;
4)去上清,加入5ml PBS,用移液枪轻轻吹打混匀,1800r/min离心5min;
5)去上清,加入2ml DMEM培养基重悬细胞,混匀,每孔1ml分铺至细胞培养板的2个孔;
6)每孔加入100μl HSV_Hep-GFP,然后轻轻晃动细胞培养板,使所有试剂充分混匀,置37℃,5%CO2孵育1h;
7)孵育完成后,向每个样本孔加入1ml DMEM完全培养基(DMEM完全培养基配置:将FBS与DMEM培养基按1:9进行混合),然后轻轻晃动细胞培养板,继续37℃,5%CO2孵育20~24h;
8)将同一样本2个样本孔的培养样本转移到1只孵育管中,1800r/min离心5min;
9)去上清,加入4ml PBS,用移液枪轻轻吹打混匀,1800r/min离心5min;
10)去上清,加入800μl PBS重悬细胞,混匀,然后在避光条件下加入200μl APC标记的人CD45抗体,混匀,室温避光孵育30min(APC荧光信号在见光条件下,容易淬灭,因此务必要保证避光保存和反应);
11)孵育完成后,加入3ml PBS,混匀,1500r/min离心5min。去上清,加入150μlPBS重悬,混匀,吸出后用流式细胞仪检查计数APC阴性且发绿色荧光的细胞。本法阳性结果判断标准为≥4个绿色荧光细胞/4ml血。
如图2所示:肝癌病人4ml血中检出CTC(绿色荧光细胞)均大于6(中位值为30);健康志愿者对照组的4ml血中绝大多数检测不到CTC细胞,少数几位健康志愿者血中检测的细胞数也不超过阈值。
其它未详细说明的部分均为现有技术。尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
- 还没有人留言评论。精彩留言会获得点赞!